食品在热加工过程中往往伴随着原有风味和营养物质的流失,因此,现代食品工业对非热加工技术的创新与应用提出了迫切的需求。常见的非热加工技术有高压CO2、脉冲强光、脉冲电肠及光动力等,然而,脉冲强光、 脉冲电场等技术需要昂贵的设备购置费用,制约了该技术在传统食品加工企业的普及。此外,光动力技术虽然具有良好的靶向性和广谱灭菌的特点,以及操作简便和设备价格低廉的优势,在果蔬食品保鲜[1-3]及食源性致病菌[4-5] 灭活等领域得到成功应用,但较差的穿透性将光动力技术局限于食品表面杀菌,限制了在不同形态和形状食品中的技术推广。因此,在光动力技术的基础上,引入低频超声波,协同光源共同激发光敏剂,构建具有良好穿透性、广谱灭菌性和靶向性的新型非热杀菌技术,即声光动力非热杀菌技术[6-7]。该技术是指声光敏剂在超声波、光源和氧气的共同作用下,生成一系列活性氧物质,从而造成微生物细胞损伤的一种新型杀菌方法。目前已有研究表明,声光动力非热杀菌技术存在协同作用,其对微生物的损伤效果优于声动力或光动力单独作用[8-9]。此外,研究人员成功地将该技术应用于果汁、肉糜等食品的贮藏保鲜,使得该技术在食源性微生物控制和食品品质保持领域表现出了巨大的潜力。
1 声光动力非热杀菌技术的作用机制
1.1 声光动力非热杀菌技术的基本原理
声光动力非热杀菌技术的作用机制如图1所示。声光敏剂与微生物细胞共同避光孵育过程中,前者以聚集、沉淀或分散的方式附着在微生物细胞壁表面,在超声波和LED光源的作用下生成活性氧,进而引起微生物细胞的类程序凋亡[10]、细胞膜损伤、蛋白质降解、核酸降解和细胞内容物的泄漏等。
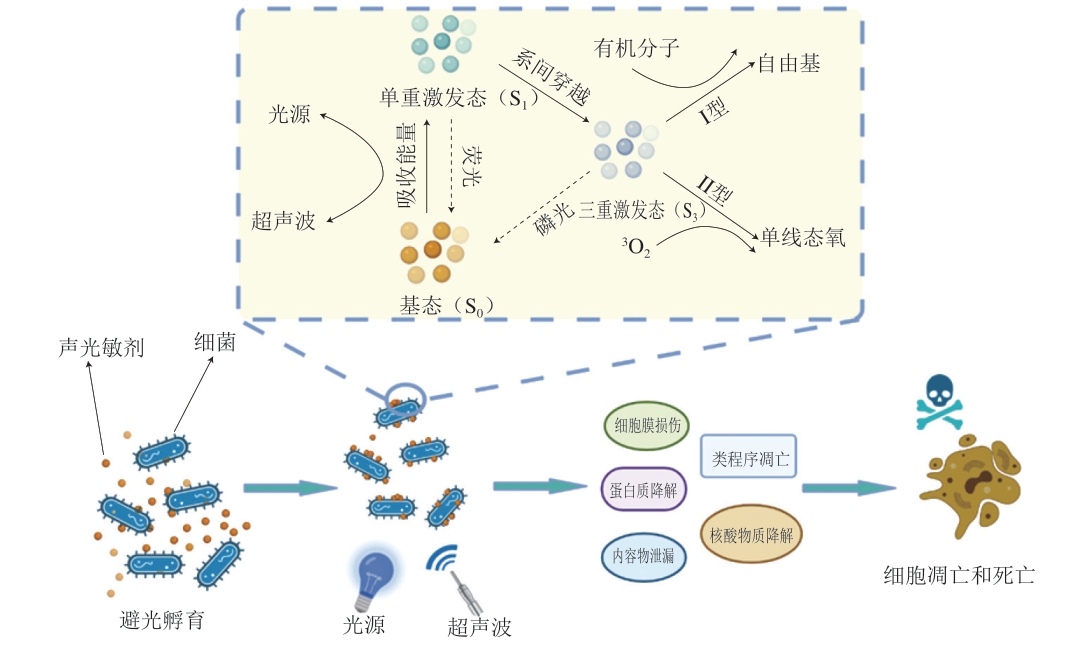
图 1 声光动力非热杀菌技术的灭菌机制
Fig. 1 Sterilization mechanism of sono/photodynamaic non-thermal sterilization technology
活性氧的产生依赖于机械能、热能和光能转化为化学能的反应过程,即能量的吸收与释放的电子跃迁过程。机械能和热能主要来源于超声波在液体传播过程中的声空化效应和热效应。光能主要来源于LED灯光源的照射。声空化效应过程中,微米级气泡会在塌陷破裂的瞬间完成极小区域内的能量释放[11],与空化作用相伴随的内摩擦可以形成电荷,并在气泡内因放电而产生发光现象,即声致发光。有研究表明,在超声波作用下,声空化温度可以达到5 000 K左右,并产生约250 MPa 的压力[12]。
声光敏剂在特定波长的光源照射下,可以吸收光子能量,从而完成电子跃迁过程。声光敏剂在吸收能量后,由基态(S0)转变为单重激发态(S1),单重激发态(S1)由于强烈的不稳定性,会并进一步完成系间穿越,转变为三重激发态(S3),或以产生荧光的方式释放能量,返回至基态(S0)。三重激发态(S3)具有较长的寿命,可以通过产生磷光的方式释放额外能量,或转移至合适的受体分子。受体分子接收能量后主要通过Type Ⅰ和Type Ⅱ 2 个途径发生化学反应,其反应式分别为3PS*+3O2→1PS+1O2*和3PS*+R→PS-+R+(PS表示光敏剂,*表示激发态)。TypeⅠ途径:当受体为有机分子时,处于三重激发态的光敏剂将与之反应,生成亚稳态的物质,再与氧发生反应,生成过氧化物或超氧化物等氧化性物质,用于破坏生物膜结构完整性,使生物膜的离子通透性增强,从而达到杀菌目的;TypeⅡ途径:三重激发态分子的能量与氧转换,形成具有细胞毒性的单线态氧(1O2)[13]。单线态氧具有较强的亲电子性,可以氧化细胞膜及胞内膜结构上的不饱和脂肪酸等,抑制蛋白质合成,造成DNA损伤,从而高效灭活细胞和微生物[13]。一般来说,Type Ⅱ途径化学反应产生活性氧物质的过程比TypeⅠ途径产生的活性氧物质简单得多,因此,单线态氧被认为是大多数声光敏剂的声光光动力活性的关键[14]。
此外,超声波的空化效应还具有机械损伤作用,可以改变细胞膜的通透性,促进声光敏剂渗透到细胞内部,甚至直接作用于细胞结构,引起细胞死亡。
1.2 声光动力非热杀菌技术的作用靶点
微生物细胞结构和组成成分的差异是影响声光动力非热杀菌效果的限制性因素。研究发现,革兰氏阳性菌较革兰氏阴性菌更容易受到声光动力非热杀菌技术的影响[15],一般来说,革兰氏阳性菌的细胞壁中含有肽聚糖和磷壁酸,但不含脂多糖,细胞壁较厚,为20~80 nm,肽聚糖彼此交联,使得细胞壁具有一定的孔隙度,从而为声光敏剂在细胞壁上的附着创造了条件。革兰氏阴性菌的细胞壁含有脂多糖及极少肽聚糖,其厚度较薄,约为10 nm,但结构却很复杂,包括外壁层和内壁层,复杂的细胞壁结构不利于光敏剂的渗透。目前,相关研究者提出了3 个作用靶点的假设,即细胞膜磷脂、膜蛋白和核酸,其中,膜蛋白被认为是声光动力作用的首选靶点,这不仅是因为膜蛋白的重要生理功能,还因为细菌细胞壁表面分布着很多膜蛋白,并且与光敏剂结合后能够快速发生氧化损伤[16]。声光动力的作用靶点多是细菌的外部结构,具有非侵入性的优势,因此可以避免细菌通过阻断吸收和增加代谢解毒等途径产生抗药性的可能[17]。
声光动力通过破坏上述靶点,诱导细菌细胞发生形态和功能上的变化。声光动力处理后,细菌细胞壁的完整性受到损伤,内容物泄漏,膜转运体系失效。功能上的变化则是由膜电位紊乱、蛋白质和酶的失活以及正常代谢受到抑制引起的[18]。在姜黄素和多黏菌素B介导的光动力对铜绿假单胞菌(Pseudomonas aeruginosa)的研究中发现,光动力处理会使铜绿假单胞菌的细胞膜受到致命损伤,电导率显著增加,蛋白质和DNA被严重降解,出现凋亡信号[10]。
2 声光动力的影响因素
2.1 声光敏剂
声光敏剂是指选择性作用于目标细胞的一类化学物质,在一定的超声波和光源作用下可以产生活性氧作用于细胞靶点。声光敏剂既是声敏剂,又是光敏剂。声光敏剂的理化特性和结构特性是决定声光动力作用效果的核心要素。理想的声光敏剂应该具备以下优点:1)安全、无毒,对非靶标细胞不会产生声光毒力作用;2)声光作用高效,能够产生大量活性氧;3)具有稳定的化学结构,仅在暴露于超声波和光源时才具有理化活性[19]。
声光敏剂发展至今,主要包括血卟啉及其衍生物[20]、 稠环醌类化合物、酞菁类化合物等。然而,上述传统的声光敏剂存在水溶性低、靶向性差、稳定性差、利用率低等问题[21],现在的研究热点多集中于声光敏剂的改造,这些改造方法有纳米化、脂质体和多聚体等,姜黄素作为食品级的声光敏剂受到了广泛关注。Li Tianmi等[22] 研究姜黄素-壳聚糖介导的光动力对金黄色葡萄球菌及其在不锈钢表面的生物膜的灭活作用,结果发现,姜黄素-壳聚糖的浓度与灭活效果具有显著相关性,25 μmol/L 姜黄素-壳聚糖对金黄色葡萄球菌的灭活率达99.9%以上,在涂有金黄色葡萄球菌生物膜的不锈钢表面,喷洒姜黄素-壳聚糖和光照10 min处理后,活菌数减少 5.0(lg(CFU/cm2))(初始值为5.6(lg(CFU/cm2)))。 Yao Tiantian等[23]基于传统光敏剂亚甲基蓝与β-环糊精之间的主客体相互作用,研制了一种光动力抗菌涂层,该涂层的研制有效解决了光敏剂在涂层上聚集分布的问题,提高了单重态氧的产量,进一步研究表明,尽管亚甲基蓝的密度很低,但仍然具有良好的光动力抗菌能力,(0.53±0.06)μg/cm2的亚甲基蓝密度便能够抑制金黄色葡萄球菌的生长。近年来,纳米技术的革命性发展对光动力领域产生了重大影响,与常规光敏剂相比较,纳米光敏剂颗粒小、比表面积大、表面反应活性高、活性中心多、催化效率高、吸附能力强,如金纳米离子、介孔二氧化硅纳米颗粒等。此外,碳纳米管、石墨烯、富勒烯及二氧化钛等已经被应用于声光动力领域[24]。 Pourhaji bagher等[2 5]制备了姜黄素纳米颗粒 (NM@CUR),并将其与姜黄素介导的声动力进行比较,结果发现,姜黄素介导的声动力可以将变形链球菌的数量显著减少90.8%(P<0.05),而NM@CUR处理后,变形链球菌数量显著减少99.9%(P<0.05),同时发现,细胞内的活性氧水平较对照组分别增加7.3、10.8 倍。
2.2 超声波
超声波是一种频率大于20 kHz的声波,是一种具有良好穿透性、方向性和反射性的振动能量形式。在食品工业中,超声波通常由频率为20 kHz~10 MHz的超声波换能器产生,具有环保、高效、无毒、低成本的 优势[26]。前文关于声动力的灭菌机理已经提及,超声波的频率和强度是声动力灭菌的限制性因素。一般来讲,超声波的频率越高,强度越大,产生的能量越多,其声动力灭菌作用效果也就越明显,但在超声波频率增大的同时也会伴随着超声传播的衰减[27],故在进行声动力灭菌的同时要注意选择合适的超声强度和频率,以提高灭菌效率与质量,节约灭菌成本[12]。
2.3 光源
目前有研究表明,光源是光动力的3 个重要条件之一,光动力的抗菌效果取决于所使用的波长[28]。光源的选择需要考虑如下因素:1)与光敏剂的吸收光谱相适应;2)有适当的输出功率;3)具有一定的穿透性,光照区域边界灵敏;4)光谱范围界定明显;5)工作性能稳定。
必须强调的是,光的频率与其波长成反比,与光子能量直接相关。短波长的光携带更高的光子能量,从而具有更大的生物效应。de Carvalho等[29]研究发现,蓝光照射和红光照射均对生物膜具有明显的抑制作用,且单种微生物的菌落总数明显下降,此外,蓝光照射对伴生放线菌、牙龈假单胞菌、口腔沙门氏菌的活性降低作用更为明显,红光对核假单胞菌的杀菌效果更好,蓝光可将三氯乙烷光敏剂从基态激发到更高能级,从而产生更多单重态氧物质。Shakhova等[30]研究指出,蓝光对三氯乙烷有更高的表面冲击力和更紧密的匹配,该结论进一步解释了de Carvalho等[29]的研究结果。
3 声光动力非热杀菌技术的应用
3.1 食品级声光敏剂
目前已经有诸多食品级声光敏剂的研究报道,包括姜黄素、叶黄素、核黄素、金丝桃素和叶绿素等,然而研究发现,姜黄素相比其他食品级声光敏剂能够取得更好的灭菌效果。
姜黄素是从多年生草本植物姜黄根茎中提取的一种天然多酚类化合物,因其独特的口感亦被广泛用作天然食品调味剂[31]。姜黄素在我国已有1 000多年的使用历史[32], 同时在GB 2760—2014《食品安全国家标准 食品添加剂使用标准》[33]中被列为允许添加在食品中的9 种天然色素之一。姜黄素具有多种药理作用,如抗癌、抗菌、抗炎、抗氧化、止痛和预防帕金森等,其优异的生物化学特性取决于姜黄素分子结构中存在的3 个反应官能团[34],其结构式如图2所示。
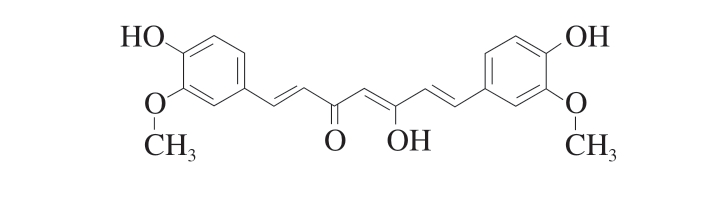
图 2 姜黄素结构式
Fig. 2 Structural formula of curcumin
目前,基于姜黄素的光动力和声动力技术已经被广泛报道。姜黄素和乳酸链球菌素制备的纳米复合物介导的声光动力技术可以有效抑制鲍曼不动杆菌的生物膜形成,并应用到伤口感染的治疗领域[35]。基于姜黄素纳米胶束介导的声光动力非热杀菌技术可以抑制鲍曼不动杆菌致病能力相关基因的表达[36]。Pourhajibagher等[37]制备了姜黄素纳米颗粒(Cur-NPhs),并将其介导的声光动力应用到放线菌的抑制中,结果发现,放线菌毒力因子的表达受到显著抑制。Liu Hanpeng等[38]研究发现, Cur/Cus复合物在光照和超声波的作用下可以产生大量活性氧物质,对金黄色葡萄球菌和大肠杆菌的杀灭率分别为99.56%和99.48%。
3.2 声光动力非热杀菌技术在食品工业中的应用
声光动力非热杀菌技术对微生物表现出的协同杀菌效果使其在食品工业领域的应用表现出巨大潜力,然而,声光动力非热杀菌技术在食品领域中的研究却鲜有报道。Bhavya等[8]将姜黄素介导的声光动力非热杀菌技术应用到橙汁的冷杀菌中,结果发现,在最佳条件下,声光联合处理可使金黄色葡萄球菌数量减少(2.35±0.16)(lg(CFU/mL)),使大肠杆菌数量减少(4.26±0.32)(lg(CFU/mL)),处理后橙汁中的总酚含量、总黄酮含量和橙皮苷含量均无显著变化,然而,橙汁抗坏血酸含量减少,抗氧化活性降低,对橙汁品质产生了负面影响。此外,Wang Dehua等[39]报道了声光动力非热杀菌技术在生浆鱼糜肉类制品中的应用,以姜黄素为声光敏剂,有效延缓了虾滑制品的品质劣变,并改变了虾滑冷藏期间的微生物群落结构。
4 结 语
目前,声光动力非热杀菌技术在食品加工领域表现出巨大应用潜力,然而针对其在食品工业中的推广应用仍需解决几点问题:1)声光动力对食品品质的影响 规律尚待进一步明确。声光动力非热杀菌技术体系复杂,影响因素较多,包括超声波频率、超声波功率、介质类型、介质温度波动、光照强度、食品的种类、体积及厚度等。因此,声光动力技术的发展亟需建立简化、完善、成熟的应用设备,统计不同食品类型的工艺处理条件及品质变化规律,建立声光动力处理工艺的数据库。2)声光动力对微生物的灭活机制仍需进一步阐述。声光动力技术不是简单的光动力技术和声动力技术作用机制的复合,在超声波和光源的共同作用下,声/光敏剂获取激发能量的途径变得多样化,包括声的空化效应、声化学效应、光的照射,甚至在某些条件下还包括声的热效应。此外,超声波存在声穿孔效应,可能会促进声/光敏剂进入微生物细胞内部,从而增强灭菌效果,该观点有助于完善声光动力对微生物细胞膜损伤的研究内容。
[1]LIN Yu, HU Jiamiao, LIN Shaoling, et al. Curcumin-based photodynamic sterilization for preservation of fresh-cut hami melon[J]. Molecules, 2019, 24(13): 2374. DOI:10.3390/molecules24132374.
[2]TAO Ran, ZHANG Fang, TANG Qingjuan, et al. Effects of curcuminbased photodynamic treatment on the storage quality of freshcut apples[J]. Food Chemistry, 2019, 274: 415-421. DOI:10.1016/j.foodchem.2018.08.042.
[3]ZOU Ying, YU Yuanshan, CHENG Lina, et al. Effects of curcuminbased photodynamic treatment on quality attributes of fresh-cut pineapple[J]. LWT-Food Science and Technology, 2021, 141: 110902. DOI:10.1016/j.foodchem.2018.08.042.
[4]GARCEZ A S, KAPLAN M, JENSEN G J, et al. Effects of antimicrobial photodynamic therapy on antibiotic-resistant Escherichia coli[J]. Photodiagnosis and Photodynamic Therapy, 2020, 32: 102029. DOI:10.1016/j.pdpdt.2020.102029.
[5]HUANG Jiaming, CHEN Bowen, LI Huihui, et al. Enhanced antibacterial and antibiofilm functions of the curcumin-mediated photodynamic inactivation against Listeria monocytogenes[J]. Food Control, 2020, 108: 106886. DOI:10.1016/j.foodcont.2019.106886.
[6]PANG Xin, LI Dengfeng, ZHU Jing, et al. Beyond antibiotics: photo/sonodynamic approaches for bacterial theranostics[J]. Nano-Micro Letters, 2020, 12(1): 144. DOI:10.1007/s40820-020-00485-3.
[7]邱建清, 李世洋, 叶倩文, 等. 声动力技术在食品杀菌领域的研究进展[J]. 食品科学, 2020, 41(19): 245-252. DOI:10.7506/spkx1002-6630-20191008-018.
[8]BHAVYA M L, HEBBAR H U. Sono-photodynamic inactivation of Escherichia coli and Staphylococcus aureus in orange juice[J]. Ultrasonics Sonochemistry, 2019, 57: 108-115. DOI:10.1016/j.ultsonch.2019.05.002.
[9]DRANTANTIYAS N, ASTUTI S, NASUTION A. Comparison microbial killing efficacy between sonodynamic therapy and photodynamic therapy[C]//Second International Seminar on Photonics, Optics, and Its Applications (ISPhOA 2016). Bali, Indonesia, 2016. DOI:10.1117/12.2248503.
[10]ZHOU Feng, LIN Shaoling, ZHANG Jinagling, et al. Enhancement of photodynamic bactericidal activity of curcumin against Pseudomonas Aeruginosa using polymyxin B[J]. Photodiagnosis and Photodynamic Therapy, 2022, 37: 102677. DOI:10.1016/j.pdpdt.2021.102677.
[11]SAALBACH K A, TWIEFEL J, WALLASCHEK J. Self-sensing cavitation detection in ultrasound-induced acoustic cavitation[J]. Ultrasonics, 2019, 94: 401-410. DOI:10.1016/j.ultras.2018.06.016.
[12]MEROUANI S, HAMDAOUI O, REZGUI Y, et al. Theoretical estimation of the temperature and pressure within collapsing acoustical bubbles[J]. Ultrasonics Sonochemistry, 2014, 21(1): 53-59. DOI:10.1016/j.ultsonch.2013.05.008.
[13]BAPTISTA M S, CADET J, DI MASCIO P, et al. Type I and type II photosensitized oxidation reactions: guidelines and mechanistic pathways[J]. Photochemistry and Photobiology, 2017, 93(4): 912-919. DOI:10.1111/php.12716.
[14]DEROSA M C, CRUTCHLEY R J. Photosensitized singlet oxygen and its applications[J]. Coordination Chemistry Reviews, 2002, 233: 351-371. DOI:10.1016/S0010-8545(02)00034-6.
[15]CANTELLI A, PIRO F, PECCHINI P, et al. Concanavalin A-Rose Bengal bioconjugate for targeted Gram-negative antimicrobial photodynamic therapy[J]. Journal of Photochemistry and Photobiology B: Biology, 2020, 206: 111852. DOI:10.1016/j.jphotobiol.2020.111852.
[16]SILHAVY T J, KAHNE D, WALKER S. The bacterial cell envelope[J]. Cold Spring Harbor Perspectives in Biology, 2010, 2(5): a000414. DOI:10.1101/cshperspect.a000414.
[17]ALVES E, COSTA L, CUNHA Â, et al. Bioluminescence and its application in the monitoring of antimicrobial photodynamic therapy[J]. Applied Microbiology and Biotechnology, 2011, 92(6): 1115-1128. DOI:10.1007/s00253-011.
[18]JORI G, FABRIS C, SONCIN M, et al. Photodynamic therapy in the treatment of microbial infections: basic principles and perspective applications[J]. Lasers in Surgery and Medicine, 2006, 38(5): 468-481. DOI:10.1002/lsm.20361.
[19]郑宝东, 林少玲, 曾绍校, 等. 光动力技术研究进展及其在食品工业中的应用前景[J]. 食品与生物技术学报, 2020, 39(5): 6-15. DOI:10.3969/j.issn.1673-1689.2020.05.002.
[20]SONG L M W K, WANG K K, ZINSMEISTER A R. Mono-Laspartyl chlorin e6 (NPe6) and hematoporphyrin derivative (HpD) in photodynamic therapy administered to a human cholangiocarcinoma model[J]. Cancer, 1998, 82(2): 421-427. DOI:10.1002/1097-0142(19980115).
[21]WAINWRIGHT M. Photodynamic therapy: the development of new photosensitisers[J]. Anti-Cancer Agents in Medicinal Chemistry, 2008, 8(3): 280-291. DOI:10.2174/187152008783961888.
[22]LI Tianmi, ZHAO Yuling, MATTHEWS K, et al. Antibacterial activity against Staphylococcus aureus of curcumin-loaded chitosan spray coupled with photodynamic treatment[J]. LWT-Food Science and Technology, 2020, 134: 110073. DOI:10.1016/j.lwt.2020.110073.
[23]YAO Tiantian, WANG Jing, XUE Yunfan, et al. Spraying photodynamic antibacterial coating based on the host-guest immobilization of photosensitizer[J]. Journal of Materials Chemistry B, 2019, 7(23): 5089-5095. DOI:10.1039/C9TB01069F.
[24]NIE Xiaolin, JIANG Chenyu, WU Shuanglin, et al. Carbon quantum dots: a bright future as photosensitizers for in vitro antibacterial photodynamic inactivation[J]. Journal of Photochemistry and Photobiology B: Biology, 2020, 206: 111864. DOI:10.1016/j.jphotobiol.2020.111864.
[25]POURHAJIBAGHER M, RAHIMI ESBOEI B, HODJAT M, et al. Sonodynamic excitation of nanomicelle curcumin for eradication of Streptococcus mutans under sonodynamic antimicrobial chemotherapy: enhanced anti-caries activity of nanomicelle curcumin[J]. Photodiagnosis and Photodynamic Therapy, 2020, 30: 101780. DOI:10.1016/j.pdpdt.2020.101780.
[26]ZHANG Lifen, WANG Pei, SUN Xiaoyang, et al. Calcium permeation property and firmness change of cherry tomatoes under ultrasound combined with calcium lactate treatment[J]. Ultrasonics Sonochemistry, 2020, 60: 104784. DOI:10.1016/j.ultsonch.2019.104784.
[27]刘丽艳, 张喜梅, 李琳, 等. 超声波杀菌技术在食品中的应用[J]. 品科学, 2006, 27(12): 778-780.
[28]THORNFELDT C. Photodynamic therapy (PDT) utilizing multiple light sources significantly improves clinical efficacy and subject satisfaction with a review of pdt mechanisms of action[J]. American Journal of Cosmetic Surgery, 2013, 30: 72-79. DOI:10.5992/AJCS-D-12-00054.1.
[29]DE CARVALHO G G, SANCHEZ-PUETATE J C, DONATONI M C, et al. Photodynamic inactivation using a chlorin-based photosensitizer with blue or red-light irradiation against single-species biofilms related to periodontitis[J]. Photodiagnosis and Photodynamic Therapy, 2020, 31: 101916. DOI:10.1016/j.pdpdt.2020.101916.
[30]SHAKHOVA M, LOGINOVA D, MELLER A, et al. Photodynamic therapy with chlorin-based photosensitizer at 405 nm: numerical, morphological, and clinical study[J]. Journal of Biomedical Optics, 2018, 23(9): 1-9. DOI:10.1117/1.JBO.23.9.091412.
[31]ZHENG Dantong, HUANG Chongxing, HUANG Haohe, et al. Antibacterial mechanism of curcumin: a review[J]. Chemistry and Biodiversity, 2020, 17(8): e2000171. DOI:10.1002/cbdv.202000171.
[32]BENZIE I F, WACHTEL-GALOR S. Herbal medicine: biomolecular and clinical aspects[M]. Boca Raton: CRC Press, 2011.
[33]中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品添加剂使用标准: GB 2760—2014[S]. 北京: 中国标准出版社, 2014.
[34]DIAS L D, BLANCO K C, MFOUO-TYNGA I S, et al. Curcumin as a photosensitizer: from molecular structure to recent advances in antimicrobial photodynamic therapy[J]. Journal of Photochemistry and Photobiology C: Photochemistry Reviews, 2020, 45: 100384. DOI:10.1016/j.jphotochemrev.2020.100384.
[35]POURHAJIBAGHER M, POURAKBARI B, BAHADOR A. Contribution of antimicrobial photo-sonodynamic therapy in wound healing: an in vivo effect of curcumin-nisin-based poly (L-lactic acid) nanoparticle on Acinetobacter baumannii biofilms[J]. BMC Microbiology, 2022, 22(1): 28. DOI:10.1186/s12866-022-02438-9.
[36]POURHAJIBAGHER M, TALAEI N, BAHADOR A. Evaluation of antimicrobial effects of photo-sonodynamic antimicrobial chemotherapy based on nano-micelle curcumin on virulence gene expression patterns in Acinetobacter baumannii[J]. Infectious Disorders Drug Targets, 2022, 22(3): 44-51. DOI:10.2174/1871526522 666211220121725.
[37]POURHAJIBAGHER M, BAHADOR A. Attenuation of Aggregatibacter actinomycetemcomitans virulence using curcumindecorated nanophytosomes-mediated photo-sonoantimicrobial chemotherapy[J]. Scientific Reports, 2021, 11(1): 6012. DOI:10.1038/s41598-021-85437-6.
[38]LIU Hanpeng, LI Jianfang, LIU Xiangmei, et al. Photo-sono interfacial engineering exciting the intrinsic property of herbal nanomedicine for rapid broad-spectrum bacteria killing[J]. ACS Nano, 2021, 15(11): 18505-18519. DOI:10.1021/acsnano.1c08409.
[39]WANG Dehua, ZHOU Feng, LAI Danning, et al. Curcumin-mediated sono/photodynamic treatment preserved the quality of shrimp surimi and influenced its microbial community changes during refrigerated storage[J]. Ultrasonics Sonochemistry, 2021, 78: 105715. DOI:10.1016/j.ultsonch.2021.105715.