我国鱼油资源丰富,近几年年产量维持在大约3 万t。 鱼油是从鱼类或其加工副产物中提取的脂质成分,富含ω-3多不饱和脂肪酸[1],主要包含二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)[2]。其中DHA主要存在于视网膜和大脑皮层中[3],具有促进婴幼儿大脑发育、保护视力、预防心脑血管疾病、抗炎症等功能[4-7],已引起食品、保健品等领域研究人员的广泛关注。但由于DHA含有6 个双键,导致其易受到如光、热、氧等外环境的影响,且其气味、水溶性和流动性较差,极大限制了其应用[8]。
脂质体是由磷脂双分子层组成的具有类生物膜结构的囊泡,可包裹水溶性和脂溶性的芯材,以达到对包埋营养物的缓控释、靶向等作用[9-12],在农业、食品工业及医药等领域显示出广阔的应用前景[13]。针对脂溶性鱼油DHA的生理功能及脂质体的特性,采用运载包埋技术将鱼油DHA制备成脂质体,可有利于快速发挥它的功能作用。
常用的制备脂质体的方法有薄膜法[14]、逆向蒸发法[15]、乙醇注入法[16]及高压乳匀法[17]等。薄膜法适用于脂溶性物质的包覆,但一般粒径较大[18]。动态高压微射流(dynamic high pressure microfluidization,DHPM)技术是一种连续化处理手段,由于其强剪切、高速撞击、气蚀、振荡和膨化等作用,在运载体系的均质、细化和乳化等过程中有重要应用[19]。因此,本研究以脂溶性鱼油DHA为原料,分别采用薄膜分散法及薄膜分散法联合DHPM技术制备包载鱼油DHA的粗脂质体(crude liposomes-DHA,CLs-DHA)和纳米脂质体(nanoliposomes-DHA,NLs-DHA),以平均粒径、多分散指数(polydispersity index,PDI)、Zeta电位等为评价指标,考察不同方法制备的鱼油DHA脂质体的pH值和贮藏稳定性;并通过差示扫描量热(differential scanning calorimetry,DSC)法分析不同方法制备的鱼油DHA脂质体的热稳定性差异。旨在开发一种低粒径、稳定性好的脂质体运载体系,以方便在实际生产中使用,扩大DHA鱼油的应用范围。
1 材料与方法
1.1 材料与试剂
10/70 EE-DHA鱼油(DHA含量70%,2021年10月18日 制备,食品级),来源于鳀鱼废弃物提取,舟山新诺佳生物工程有限责任公司提供。
无水乙醇(分析纯) 国药集团化学试剂有限 公司;大豆卵磷脂(纯度>92%) 北京美亚斯磷脂技术有限公司;胆固醇(分析纯) 北京奥博星生物技术责任有限公司;吐温-80(分析纯) 上海申宇医药化工有限公司。
1.2 仪器与设备
RE-5205旋转蒸发器、SHZ-Ⅲ循环水真空泵 上海亚荣生化仪器厂;Nicomp 380 ZLS超细微粒粒度分析仪 美国Santa Barbara公司;T6紫外-可见分光光度计 北京普析通用仪器有限责任公司;Microfluidizer Processor M-700微射流仪 美国Microfluidics公司;DSC 7000X DSC仪 日本日立公司。
1.3 方法
1.3.1 鱼油DHA脂质体的制备
采用薄膜分散法制备CLs-DHA[20],将大豆卵磷脂、胆固醇、吐温-80和10/70 EE-DHA鱼油按质量比15∶3.75∶5∶5混合,在40 ℃水浴中溶于一定量的无水乙醇中,然后旋转蒸发除去乙醇,形成脂质薄膜,加入磷酸盐缓冲液(pH 7.4,0.05 mol/L),在减压条件下充分旋转洗膜,获得CLs-DHA悬液。将CLs-DHA悬液加入DHPM均质机中,在120 MPa下处理2 次,得到均匀的NLs-DHA。NLs-DHA外观透亮、均匀、无沉淀,而 CLs-DHA呈现出乳白色的外观。
1.3.2 平均粒径、PDI、Zeta电位测定
将待测脂质体悬液稀释至一定浓度,采用激光纳米粒度仪在25 ℃下测定平均粒径、PDI和Zeta电位,每个样品平行测定3 次[21]。
1.3.3 DHA脂质体的稳定性测定
1.3.3.1 pH值稳定性
参考付咪等[22]的方法并做适当修改,将CLs-DHA和NLs-DHA分别调节pH值至1.5、4.0、5.5及7.4,并于4 ℃冷藏放置7 d,考察CLs-DHA和NLs-DHA平均粒径、PDI和Zeta电位的变化。
1.3.3.2 贮藏稳定性
将CLs-DHA和NLs-DHA置于4 ℃冷藏放置95 d,间隔取样测定CLs-DHA和NLs-DHA平均粒径、PDI和Zeta电位的变化[23]。
1.3.4 DHA脂质体的DSC分析
用DSC仪对CLs-DHA和NLs-DHA的相变温度进行测定。取8.0 mg CLs-DHA和NLs-DHA冻干样品放入密闭铝坩埚底部,在加热温度20~200 ℃条件下扫描样品,设定升温速率为10 ℃/min,以空白坩埚作为对照[24]。
1.4 数据处理
采用Microsoft Office Excel 2010软件进行数据处理,本研究所列数据为3 个试样的平均值,以平均值±标准差表示。
2 结果与分析
2.1 鱼油DHA脂质体的pH值稳定性
PDI是反映胶体体系中粒径分布的指标,PDI<0.4表明体系粒径分布均匀,PDI越小说明粒径分布的范围越小,体系中颗粒的规整度越好,分散度越均匀[25-26]。Zeta电位是表征脂质体稳定性的一个重要物理特性。Zeta电位绝对值越高,脂质体相互凝聚而沉降的阻力越大, 越稳定[27]。环境pH值会影响磷脂的水解,改变脂膜的通透性,同时会对粒子表面电荷产生影响,引起聚集,影响脂质体的稳定性[28]。
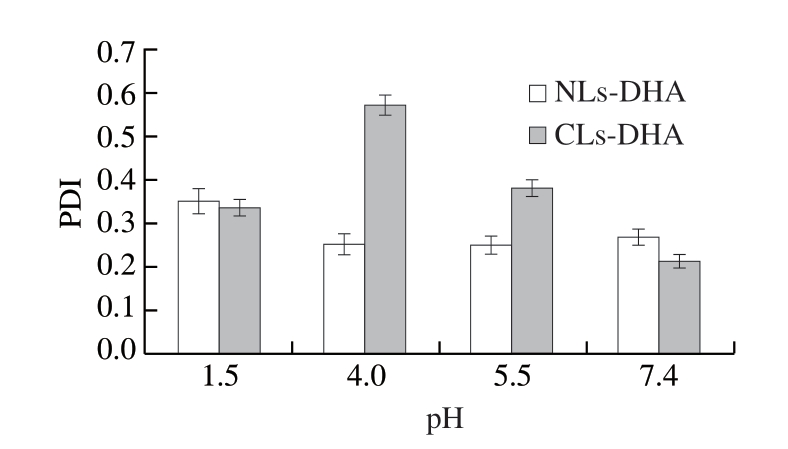
图2 pH值对CLs-DHA和NLs-DHA PDI的影响
Fig. 2 Effect of pH value on PDI of CLs-DHA and NLs-DHA
由图1~2可知,随着pH值逐渐增大,NLs-DHA的平均粒径和PDI均呈下降趋势,平均粒径从172.4 nm降至124 nm左右,PDI从0.349降至0.269,粒径分布比较均一,体系相对稳定,尤其在pH 7.4时NLs-DHA有较好的稳定性。随pH值升高,CLs-DHA的平均粒径和PDI均呈先上升后下降的趋势,不同pH值处理组之间的平均粒径差异也较明显。pH值对脂质体稳定性影响较大,pH值越低,H+浓度增加,H+会穿透双分子层膜,造成双分子层膜被破坏,脂质体越不稳定,越容易发生絮凝和沉淀[29]。
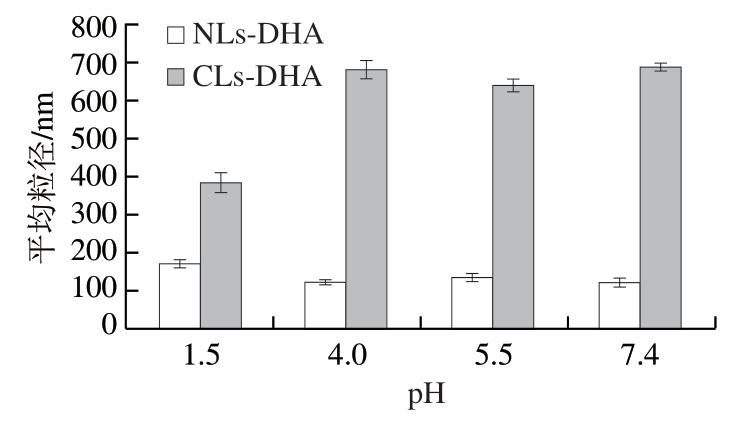
图1 pH值对CLs-DHA和NLs-DHA平均粒径的影响
Fig. 1 Effect of pH value on average particle size of CLs-DHA and NLs-DHA
由图3可知,随着pH值逐渐增大,CLs-DHA和NLs-DHA的Zeta电位绝对值均逐渐升高,在接近中性pH值(7.4)条件下Zeta电位绝对值最大,脂质体贮藏稳定性较好,而当脂质体处于强酸(pH 1.5)环境下,其Zeta电位绝对值大幅下降,接近于0 mV,变得很不稳定;总体来说,CLs-DHA的Zeta电位绝对值略低于NLs-DHA,NLs-DHA表现出更好的稳定性。江连洲等[30]制备的大豆蛋白-磷脂酰胆碱鱼油纳米乳液在酸性条件下不稳定,碱性条件下稳定,不同鱼油运载体系的稳定性受乳化剂种类和浓度的影响,pH值会影响大豆蛋白的电离程度和乳化性,从而影响体系的稳定性,而pH值对吐温稳定的鱼油运载体系的平均粒径影响不大。
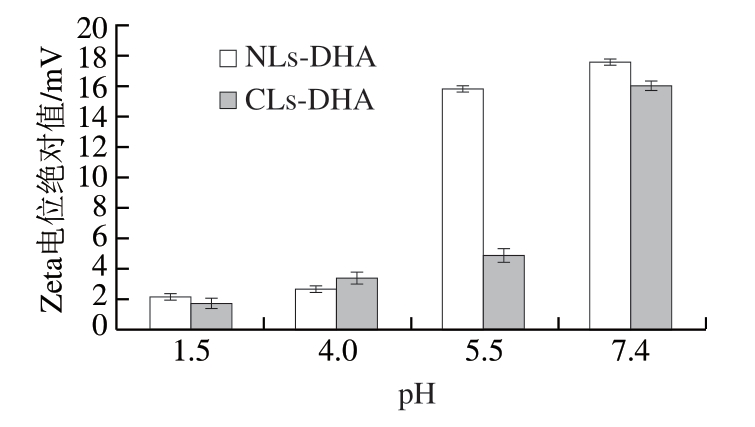
图3 pH值对CLs-DHA和NLs-DHA Zeta电位绝对值的影响
Fig. 3 Effect of pH value on absolute value of zeta potential of CLs-DHA and NLs-DHA
2.2 鱼油DHA脂质体的贮藏稳定性
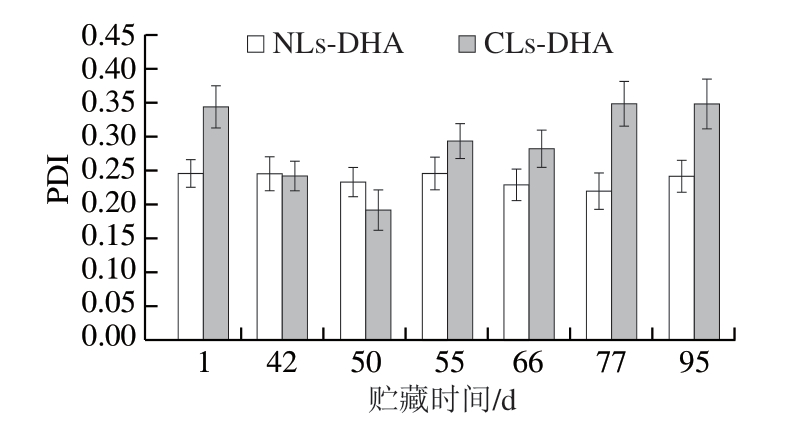
图5 贮藏时间对CLs-DHA和NLs-DHA PDI的影响
Fig. 5 Effect of storage time on PDI of CLs-DHA and NLs-DHA
由图4~5可知,在贮藏95 d过程中,CLs-DHA粒径变化幅度相对较大,平均粒径大致呈先下降后升高的趋势,贮藏66 d之后平均粒径明显上升,从(368.4±4.4) nm增加至(394.0±3.7) nm。这可能是因为在前期制备的脂质体发生了重组,粒径变小,随着贮藏时间的延长,脂质体出现颗粒聚集、破裂等物理不稳定现象,引起粒径和粒径分布范围增大[31];NLs-DHA的平均粒径和PDI变化幅度相对较小,平均粒径为88 nm左右,PDI波动也较小(0.220~0.246),粒径分布较均匀,分散体系较为稳定。
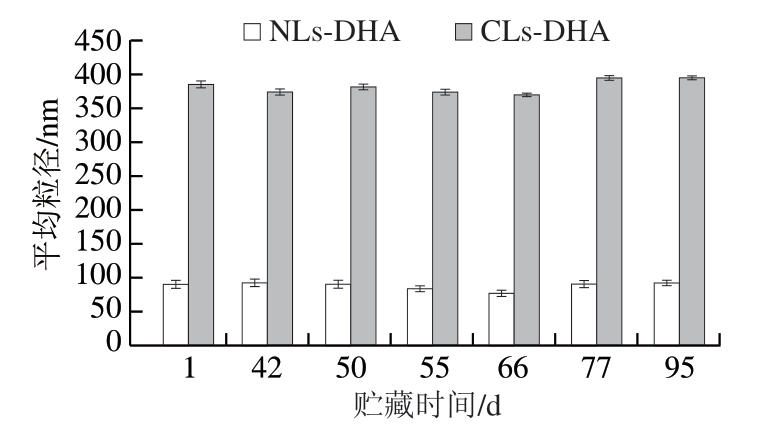
图4 贮藏时间对CLs-DHA和NLs-DHA平均粒径的影响
Fig. 4 Effect of storage time on average particle size of CLs-DHA and NLs-DHA
由图6可知,2 组样品Zeta电位绝对值均呈降低趋势,NLs-DHA的Zeta电位变化小于CLs-DHA,也表明NLs-DHA的长期稳定性优于CLs-DHA,适度的DHPM技术处理可增强脂质体的稳定性[32]。邰克东等[33]采用传统薄膜水化法辅助高压均质制备脂质体,也发现均质压力和均质次数的增加可明显降低脂质体囊泡的粒径并提高其离心物理稳定性。
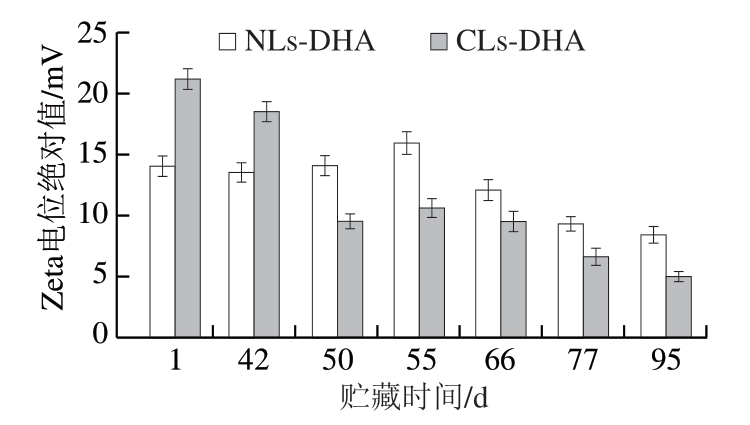
图6 贮藏时间对CLs-DHA和NLs-DHA Zeta电位绝对值的影响
Fig. 6 Effect of storage time on absolute value of zeta potential of CLs-DHA and NLs-DHA
2.3 鱼油DHA脂质体的DSC分析
脂质体双层膜的性质与介质温度密切相关。当介质温度升高时,脂质双分子层中酰基侧链从有序排列变成无序排列,引起脂膜的物理性质产生一系列变化,可由“胶晶态”变成“液晶态”,膜的横切面增加,厚度减小,流动性增加,发生这种转变时的温度称为相变温度(Tm)[34]。Tm可用来评估脂质体的热稳定性,脂质体膜的刚性或流动性密切影响脂质体的稳定性,从而影响脂质体的载体性质。一般来说,Tm越大,焓值越小,物质状态会越好,完整度加大,产品的热稳定性越好[35]。
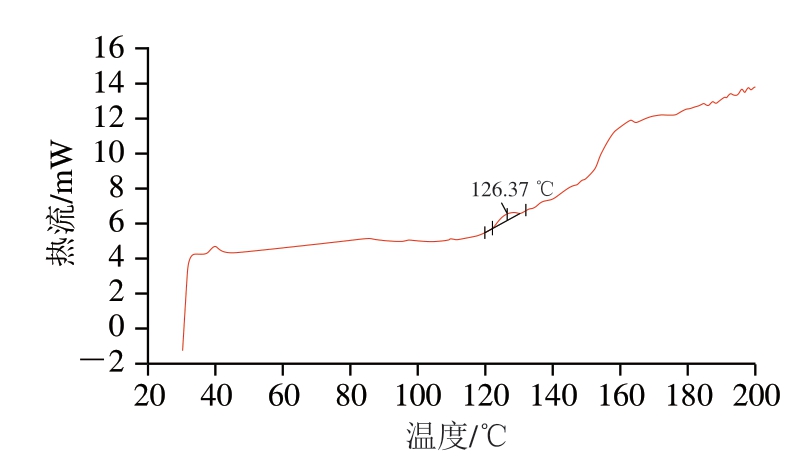
图8 CLs-DHA的DSC曲线
Fig. 8 DSC profile of CLs-DHA
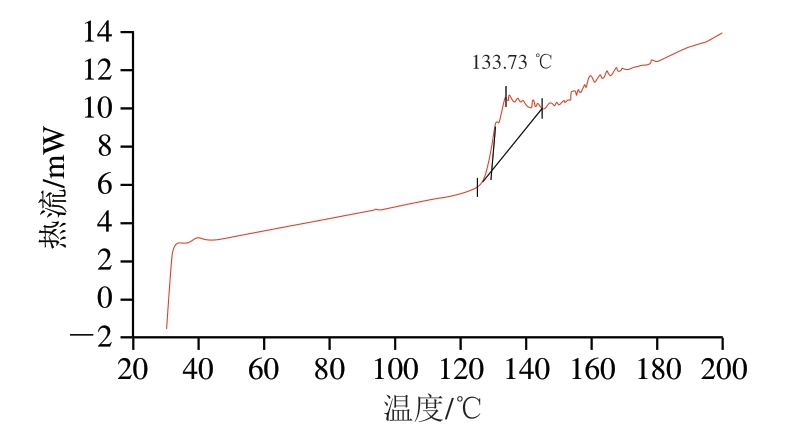
图9 NLs-DHA的DSC曲线
Fig. 9 DSC profile of NLs-DHA
由图7~9可知,CLs-DHA的Tm为126.37 ℃,NLs-DHA的Tm为133.73 ℃,均比大豆卵磷脂的Tm(125.19 ℃)高。其中CLs-DHA的Tm接近于磷脂。将大豆卵磷脂制备成鱼油DHA脂质体后,Tm有所升高,原因可能是胆固醇增加了磷脂双分子层膜的刚性,降低了膜流动性,从而使Tm上升,稳定性增加[36]。NLs-DHA的Tm较CLs-DHA上升较大,膜的稳定性更大,可能是因为DHPM技术处理的高速撞击、高速剪切、瞬时压降、高频振荡和气穴作用有效提高了脂质体的Tm,对脂质体膜的流动性产生一定的影响,增强脂质体的稳定性[33],与前面pH值和贮藏稳定性的结果一致。Wang Qianqian等[24]通过DSC分析仪测得制备的鱼油粗脂质体Tm为56.17 ℃,低于本研究中制备的DHA鱼油脂质体的Tm。不同脂质体制备相关研究中Tm的差异可能是由于制备时使用的磷脂等不同导致的[37]。
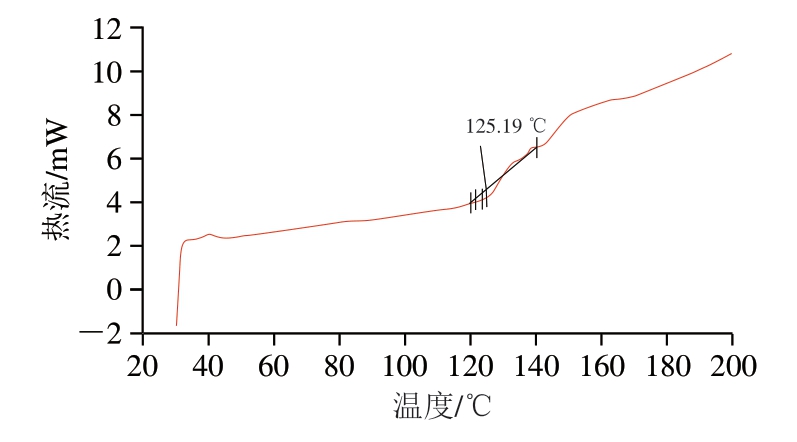
图7 大豆卵磷脂DSC曲线
Fig. 7 DSC profile of soybean lecithin
3 结 论
本研究分别采用薄膜分散法及薄膜分散法联合DHPM技术制备包载鱼油DHA的CLs-DHA和NLs-DHA,以平均粒径、PDI、Zeta电位为主要评价指标,考察 CLs-DHA和NLs-DHA的pH值稳定性和贮藏稳定性,并通过DSC仪分析其热稳定性。结果表明:NLs-DHA表现出更好的pH值和贮藏稳定性;通过DSC分析表明,与未经DHPM均质处理的脂质体CLs-DHA相比,NLs-DHA 具有较高的Tm,也表明适度的DHPM技术处理可增强鱼油DHA脂质体的稳定性。本研究结果表明,相比于 CLs-DHA,NLs-DHA具有更优良的稳定性。
[1] 代志凯, 李祥清, 陈子杰, 等. 国产与进口鱼油品质分析比较[J]. 中国油脂, 2018, 43(6): 51-55. DOI:10.3969/j.issn.1003-7969.2018.06.012.
[2] 张渊超, 孙钦秀, 刘书成, 等. 超高压结合酶解法提取鱼油工艺的优化[J]. 广东海洋大学学报, 2020, 40(2): 1-7. DOI:10.3969/j.issn.1673-9159.2020.02.010.
[3] 叶丽姿, 李佳, 潘英杰, 等. 鱿鱼加工副产物中油脂的综合利用研究进展[J]. 食品与机械, 2021, 37(10): 215-221. DOI:10.13652/j.issn.1003-5788.2021.10.038.
[4] 杨敏, 魏冰, 孟橘, 等. ω-3多不饱和脂肪酸的来源及生理功能研究进展[J]. 中国油脂, 2019, 44(10): 110-115. DOI:10.3969/j.issn.1003-7969.2019.10.023.
[5] WATANABE Y, TATSUNO I. Omega-3 polyunsaturated fatty acids for cardiovascular diseases: present, past and future[J]. Expert Review of Clinical Pharmacology, 2017, 10(8): 865-873. DOI:10.1080/175124 33.2017.1333902.
[6] CALDER P C. Omega-3 fatty acids and inflammatory processes: from molecules to man[J]. Biochemical Society Transactions, 2017, 45(5): 1105-1115. DOI:10.1042/BST20160474.
[7] ABDULRAZAQ M, INNES J K, CALDER P C. Effect of ω-3 polyunsaturated fatty acids on arthritic pain: a systematic review[J]. Nutrition, 2017, 39/40: 57-66. DOI:10.1016/j.nut.2016.12.003.
[8] 刘佳炜, 王旭, 曹雁平, 等. DHA稳态化技术研究进展[J].食品工业科技, 2 0 1 9, 4 0(7): 2 7 3-2 7 7. D O I:1 0.1 3 3 8 6/j.issn1002-0306.2019.07.047.
[9] DING Lijun, YANG Jie, YIN Kangrui, et al. The spatial arrangement of astaxanthin in bilayers greatly influenced the structural stability of DPPC liposomes[J]. Colloids and Surfaces B: Biointerfaces, 2022, 212: 112383. DOI:10.1016/j.colsurfb.2022.112383.
[10] ZHOU Wei, CHENG Ce, MA Li, et al. The formation of chitosancoated rhamnolipid liposomes containing curcumin: stability and in vitro digestion[J]. Molecules, 2021, 26(3): 560. DOI:10.3390/molecules26030560.
[11] SHAH S, DHAWAN V, HOLM R, et al. Liposomes: advancements and innovation in the manufacturing process[J]. Advanced Drug Delivery Reviews, 2020, 154: 102-122. DOI:10.1016/j.addr.2020.07.002.
[12] OZKAN G, KOSTKA T, ESATBEYOGLU T, et al. Effects of lipidbased encapsulation on the bioaccessibility and bioavailability of phenolic compounds[J]. Molecules, 2020, 25(23): 5545. DOI:10.3390/molecules25235545.
[13] 宋恭帅, 刘家源, 袁雅雯, 等. 栀子黄脂质体的制备、表面修饰及体外消化稳定性研究[J]. 核农学报, 2021, 35(12): 2799-2809. DOI:10.11869/j.issn.100-8551.2021.12.2799.
[14] JOSE J, KANNIYAPPAN H, MUTHUVIJAYAN V. A novel, rapid and cost-effective method for separating drug-loaded liposomes prepared from egg yolk phospholipids[J]. Process Biochemistry, 2022, 115: 80-91. DOI:10.1016/j.procbio.2022.02.010.
[15] 陈晶晶, 潘显虎, 吴淑恒, 等. 米糠多糖铁脂质体包合物的制备[J].食品研究与开发, 2 0 1 8, 3 9(1 6): 6 4-6 8. D O I:1 0.3 9 6 9/j.issn.1005-6521.2018.16.013.
[16] SEBAALY C, HAYDAR S, GREIGE-GERGES H. Eugenol encapsulation into conventional liposomes and chitosan-coated liposomes: a comparative study[J]. Journal of Drug Delivery Science and Technology, 2021, 67: 102942. DOI:10.1016/j.jddst.2021.102942.
[17] AMNUAIKIT T. Formulation development and preparation of fish oil liposome by using high pressure homogenizer for food supplement product[J]. Asian Journal of Pharmaceutical Sciences, 2016, 11(1): 126-127. DOI:10.1016/j.ajps.2015.11.094.
[18] 王倩, 丁保淼. 纳米脂质体制备方法及在食品工业中应用研究进展[J]. 食品与机械, 2020, 36(11): 206-210. DOI:10.13652/j.issn.1003-5788.2020.11.039.
[19] 陈兴, 邹立强, 刘伟, 等. 动态高压微射流技术制备脂质体的研究进展[J]. 中国农业科技导报, 2015, 17(5): 75-80. DOI:10.13304/j.nykjdb.2015.480.
[20] 刘玮琳, 李羚, 魏富强, 等. 壳聚糖修饰脂质体的环境压力和体外消化稳定性[J]. 食品科学, 2016, 37(1): 6-11. DOI:10.7506/spkx1002-6630-201601002.
[21] ZHENG Huijuan, LIU Weilin, YANG Shuibing. Carboxymethyl chitosan coated medium-chain fatty acid nanoliposome: its structural and compositional characterizations, stability and in vitro release investigation[J]. Food and Function, 2021, 12: 9947-9954. DOI:10.1039/D1FO01985F.
[22] 付咪, 俞佳丽, 郭亮, 等. 乳酸链球菌素脂质体在不同pH值条件下的稳定性及其抑菌效果[J]. 食品科学, 2019, 40(21): 7-13. DOI:10.7506/spkx1002-6630-20180923-243.
[23] PENG Shengfeng, ZOU Liqiang, LIU Wei, et al. Fabrication and characterization of curcumin-loaded liposomes formed from sunflower lecithin: impact of composition and environmental stress[J]. Journal of Agricultural and Food Chemistry, 2018, 66(46): 12421-12430. DOI:10.1021/acs.jafc.8b04136.
[24] WANG Qianqian, LÜ Shun, LU Jianfeng, et al. Characterization, stability, and in vitro release evaluation of carboxymethyl chitosan coated liposomes containing fish oil[J]. Journal of Food Science, 2015, 80(7): C1460-C1467. DOI:10.1111/1750-3841.12929.
[25] HU Yaqin, WU Tiantian, WU Chunhua, et al. Formation and optimization of chitosan-nisin microcapsules and its characterization for antibacterial activity[J]. Food Control, 2017, 72(Part A): 43-52. DOI:10.1016/ j.foodcont.2016.06.013.
[26] AHMAD M, MUDGIL P, GANI A, et al. Nano-encapsulation of catechin in starch nanoparticles: characterization, release behavior and bioactivity retention during simulated in vitro digestion[J]. Food Chemistry, 2019, 270: 95-104. DOI:10.1016/j.foodchem.2018.07.024.
[27] KRIVOROTOVA T, CIRKOVAS A, MACIULYTE S, et al. Nisin-loaded pectin nanoparticles for food preservation[J]. Food Hydrocolloids, 2016, 54: 49-56. DOI:10.1016/j.foodhyd.2015.09.015.
[28] 夏诗琪, 王培玲, 陈尚钘, 等. 柠檬醛缓释制剂的稳定性及其对黄曲霉菌的抑制作用[J]. 食品工业科技, 2022, 43(8): 85-92. DOI:10.13386/j.issn1002-0306.2021070371.
[29] 丁保淼. 影响补铁剂脂质体芯材泄漏的因素探讨[J]. 中国食品添加剂, 2014(2): 120-123. DOI:10.3969/j.issn.1006-2513.2014.02.015.
[30] 江连洲, 綦玉曼, 马春芳, 等. 鱼油纳米乳液运载体系构建与稳定性研究[J]. 农业机械学报, 2018, 49(10): 387-395. DOI:10.6041/j.issn.1000-1298.2018.10.045.
[31] 张献领, 鲍士宝, 刘春, 等. 茶多酚前体脂质体的制备及稳定性研究[J]. 贵州师范大学学报(自然科学版), 2014, 32(6): 71-75. DOI:10.16614/j.cnki.issn1004-5570.2014.06.016.
[32] 陈蓓, 高惠静, 陈春燕, 等. 采用高压均质法制备阿苯达唑纳米脂质体的工艺优化[J]. 中国医药工业杂志, 2017, 48(8): 1156-1163. DOI:10.16522/j.cnki.cjph.2017.08.011.
[33] 邰克东, 赵苏茂, 杨紫恒, 等. 高压均质对脂质体囊泡特性和稳定性的影响[J]. 食品科学, 2019, 40(17): 169-177. DOI:10.7506/spkx1002-6630-20180916-158.
[34] 万蒙, 陈懿琳, 钱宇豪, 等. 阳离子脂质体包埋角鲨烯佐剂的制备及理化性质研究[J]. 中国畜牧兽医, 2021, 48(4): 1431-1439. DOI:10.16431/j.cnki.1671-7236.2021.04.031.
[35] 宋菲, 雷茜茜, 陈卫军, 等. 角鲨烯脂质体的制备及其性质研究[J]. 食品科技, 2014, 39(3): 41-44. DOI:10.13684/j.cnki.spkj.2014.03.009.
[36] 陈李霞, 丁越, 沈征武, 等. 胆固醇在脂质体中作用及甾醇、皂苷对其替换的研究进展[J]. 中草药, 2020, 51(24): 6396-6404. DOI:10.7501/j.issn.0253-2670.2020.24.031.
[37] 宋范范, 章绍兵, 田少君. 磷脂对脂质体性能的影响评析[J]. 中国油脂, 2020, 45(5): 32-35. DOI:10.12166/j.zgyz.1003-7969/2020.05.007.