扇贝是扇贝属双壳类软体动物的代称,其肉质鲜美、营养丰富,被列入八珍之一。扇贝种类丰富,适合大规模养殖,是我国重要的海洋经济产品之一[1]。2021年我国扇贝产量高达17.4 万t[2],其中扇贝加工废弃物(包括内脏)约占整个扇贝的30%[3],扇贝含有丰富的氨基酸、不饱和脂肪酸、微量元素等营养成分[4]。虾夷扇贝属软体动物门,属大型冷水性双壳贝类,是扇贝中个体最大的,为市面上较为常见的扇贝品种之一[5]。我国的扇贝加工业发展迅速,产品种类不断增加,但主要集中在贝柱为主的产品形式上,裙边等副产物的综合利用方面存在不足[6]。目前,扇贝的加工利用由起初的扇贝柱、冻藏扇贝、扇贝罐头逐渐转移至扇贝副产物加工利用,如利用扇贝内脏团提取多糖、利用扇贝贝壳制备扇贝贝壳粉、利用扇贝裙边提取多肽等精深加工范畴[7]。近年来,虾夷扇贝内脏多糖[8]、硫酸酯多糖[9]等被证实与多种生物功能都有密切关系。
但目前扇贝裙边大多仍作为下脚料丢弃,造成了严重的资源浪费和环境污染[10]。裙边是扇贝的外套膜,近年来的研究表明,扇贝裙边富含活性多肽、氨基多糖、不饱和脂肪酸等多种生物活性物质[11]。多肽一般是指少于100 个氨基酸、通过肽键连接而成的化合物,其相对分子质量低于10 000[12]。多肽在自然界中广泛存在,生物活性多肽具有免疫调节、激素调节、抗病毒、抗氧化、降血压和降血脂等功能。
目前研究报道,使用脂氧合酶催化的亚油酸[13]、磷酸盐-大豆分离蛋白[14]、茶多酚[15]等会对肌原纤维蛋白(myofibrillar protein,MP)的结构和功能产生一定影响。除此之外,陈旭等[16]的研究发现,多肽对MP有良好的冷冻保护作用,尤其是多肽可以作为低温保护剂的替代品,对鱼糜的冷冻贮藏有良好的保护效果[17]。一些植物蛋白饮料中也同样添加多肽来维持其稳定性[18]。目前,虾夷扇贝裙边被大量废弃,少量虾夷扇贝裙边被水解成蛋白,进行生物活性研究[19]。除此之外,还有少量虾夷扇贝裙边被用于糖胺聚糖[20]、多糖[21]的提取,并进行生物活性研究。
关于扇贝裙边多肽对于MP结构影响的研究鲜有报道。本研究以虾夷扇贝裙边多肽(Patinopecten yessoensis mantle polypeptide,PMP)为研究对象,通过考察质量浓度0、2、4 g/100 mL的PMP对鲢鱼MP二、三级结构变化的影响,为虾夷扇贝裙边的高值化利用提供新的思路和理论依据。
1 材料与方法
1.1 材料与试剂
PMP 实验室制得;新鲜鲢鱼 大连熟食品交易中心。
溴化钾(光谱纯) 天津市大茂化学试剂厂;氯化钠、乙酸乙酯 天津市富宇精细化工有限公司;β-巯基乙醇 天津市福晨化学试剂厂;尿素、三(羟甲基)氨基甲烷 国药基团化学试剂有限公司;盐酸胍、三氯乙酸、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithio bis-(2-nitrobenzoic acid),DTNB)、2,4-二硝基苯肼 上海麦克林生化科技有限公司;除溴化钾外所有试剂均为国产分析纯。
1.2 仪器与设备
D S-1高速组织捣碎机 上海标本模型厂; HR/T20MM立式高速冷冻离心机 湖南赫西仪器装备有限公司;NEXUS670红外光谱仪 美国PerkinElmer公司;Epoch2酶标仪 美国伯腾仪器有限公司;F-2700荧光分光光度计 日本Hitachi公司;UV-9000双光束紫外-可见分光光度计 上海元析仪器有限公司;BL-310电子天平 北京赛多利斯仪器系统有限公司;PHS1J-4F精密数显pH计 山东晨拓科学仪器有限公司;SL-III数控层析冷柜、Scientz-30D真空冷冻干燥机 宁波新芝科技股份有限公司;HH-6数显恒温水浴锅 国华电器有限公司。
1.3 方法
1.3.1 MP的提取
根据仪淑敏等[22]的提取方法,略作修改。将冷冻鲢鱼糜于4 ℃层析柜中解冻过夜,取上述鱼糜5 g,加入25 mL 10 mol/L Tris-HCl缓冲液(pH 7.2),4 000 r/min均质2 min后,于4 ℃、5 000 r/min离心15 min,取沉淀加入100 mL 10 mol/L Tris-HCl缓冲液(含0.6 mol/L NaCl,pH 7.2),于4 000 r/min均质30 s,4 ℃、4 500 r/min离心20 min后取上清,即为MP。用双缩脲试剂测定蛋白质量浓度。用10 mol/L Tris-HCl缓冲液(含0.6 mol/L NaCl,pH 7.2)将MP配制成1.0 mg/mL溶液。
1.3.2 PMP的制备
根据刘聪等[23]的方法,将冷冻虾夷扇贝裙边经解冻后清洗,进行脱盐处理后将扇贝裙边组织捣碎,经酶解后进行超滤、灭酶后干燥。
1.3.3 PMP粒径测定
将1.3.2节制备的PMP用pH 6.0、10 mmol/L磷酸盐缓冲液(含0.6 mol/L NaCl)稀释到5 mg/mL,用激光粒度仪对MP粒径进行测定。测定参数:物质折射率1.520,介质为水,介质折射率1.333。
1.3.4 PMP-MP复合物制备
将质量浓度0、2、4 g/100 mL的PMP添加到MP溶液中,放入层析柜中静置过夜。
1.3.5 PMP-MP复合物巯基含量测定
1.3.5.1 总巯基含量测定
根据朱东宏等[24]的方法测定总巯基含量,略作修改。取不同质量浓度PMP-MP复合物溶液0.5 mL,加入4.5 mL Tris-HCl缓冲液(含0.2 mol/L Tris、8 mol/L尿素、2 g/100 mL十二烷基硫酸钠、10 mmol/L EDTA,pH 6.8),空白组加入等量去离子水。混合均匀后取混合液4 mL,加入0.5 mL 10 mol/L DTNB溶液,置于40 ℃水浴锅中加热25 min。于412 nm波长处测定吸光度。总巯基含量按式(1)计算。
式中:A为样品吸光度;A0为空白组吸光度;n为稀释倍数;ρ为蛋白质量浓度/(mg/mL)。
1.3.5.2 活性巯基含量测定
根据Yildiz等[25]的方法测定,略作修改。取不同质量浓度PMP-MP复合物溶液0.5 mL,加入4.5 mL活性巯基缓冲液(含0.2 mol/L Tris-HCl、10 mmol/L EDTA,pH 6.8),空白组加入等量去离子水。混合均匀后加入0.5 mL 10 mol/L DTNB溶液,置于4 ℃冰箱中反应1 h后,于412 nm波长处测定吸光度。活性巯基含量按式(1)计算。
1.3.6 PMP-MP复合物羰基含量测定
根据Sawayama等[26]的方法测定,略作修改。取0.25 mL不同质量浓度PMP-MP复合物溶液于离心管中,加入0.5 mmol/L DNPH(溶于2 mol/L HCl)室温避光反应10 min,每10 min涡旋1 次,加入等体积的20%三氯乙酸,5 000 r/min、4 ℃离心10 min,沉淀加入1 mL乙醇-乙酸乙酯(1∶1,V/V)洗至无色,加入4 mL盐酸胍 (6 mol/L,溶于20 mmol/L磷酸盐缓冲液,pH 6.5),37 ℃沉淀20 min,10 000 r/min离心5 min,于370 nm波长处测定吸光度。羰基含量按式(2)计算。
式中:A为样品吸光度;n为稀释倍数;ε为摩尔吸光系数/(L/(mol·cm));ρ为蛋白质量浓度/(mg/mL)。
1.3.7 PMP-MP复合物傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)测定
根据Xu Yujuan等[27]的方法,略作修改。取复合物溶液,冷冻10 h后,进行冷冻干燥。取冻干后样品2 mg,加入干燥的无水溴化钾100 mg,充分混合后在约18 N压力下加压2 min,形成溴化钾压片。用红外光谱仪进行测定和分析,分辨率为4 cm-1,光谱观察范围为400~4 000 cm-1。
PeakFit软件用于酰胺Ⅰ谱带的原始光谱曲线拟合。1600~1639cm-1被认为是β-折叠波段,1640~1650cm-1被认为是无规卷曲波段,1651~1600cm-1被认为是α-螺旋波段,1 661~1 700 cm-1被认为是β-转角波段。蛋白质二级结构的相对含量根据积分面积计算。
1.3.8 PMP-MP复合物紫外吸收光谱测定
取复合物溶液,以10 mol/L Tris-HCl缓冲液(含0.6 mol/L NaCl,pH 7.2)作为对照。将溶液置于1 cm石英比色皿中,使用紫外-可见分光光度计在230~350 nm获得紫外吸收光谱,使用OriginPro 2017软件从紫外吸收光谱获得二阶导数光谱。
1.3.9 PMP-MP复合物内源荧光光谱测定
取适量各组复合物溶液,加入光路长度为1 cm的荧光比色皿中,采用荧光分光光度计在室温(25 ℃)下进行荧光光谱扫描,设置激发波长为280 nm,扫描范围300~450 nm,测定最大发射波长下的荧光强度[28]。
1.4 数据处理
采用SPSS软件对实验中所得的数据进行显著性分析(P<0.05),使用Excel和OriginPro 2017软件制表绘图。
2 结果与分析
2.1 PMP粒径分布
粒径是衡量脂质体体系稳定性、均匀性[29]和生物利用度[30]的重要物理参数。由图1可知,在本研究工艺条件下制备的PMP粒径分布范围较宽,PMP粒径呈现出先增大后减小的趋势,其中90%以上的PMP粒径均小于200 μm。PMP粒径大小是其能否被吸收的关键[31]。PMP粒径峰值处(70.03~77.83 μm),较小粒径便于携带活性成分[32]。
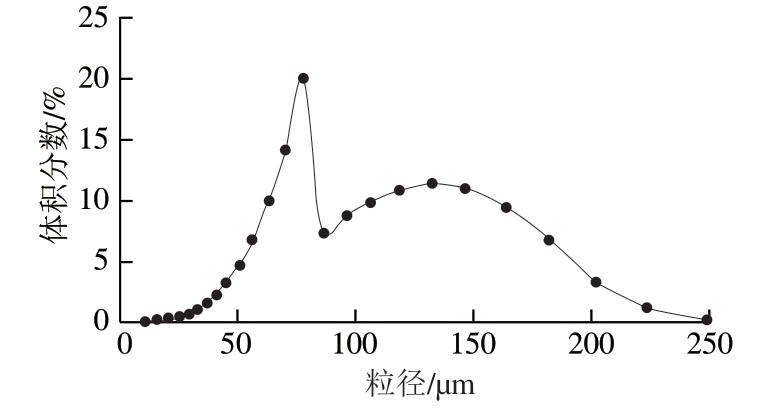
图1 PMP粒径分布
Fig. 1 Particle size distribution of PMP
2.2 PMP对MP巯基的影响
在蛋白质各类基团中反应活性最强的是巯基基团,巯基含量可间接反映MP的氧化程度[33]。蛋白质侧链上的巯基极易被氧化成二硫键,有时还会生成非二硫键的含硫化合物,引起蛋白质间无序的交联聚集,并导致总巯基含量降低[34]。研究表明,茶多酚会对草鱼MP结构产生影响,低浓度的茶多酚抑制巯基含量的降低,高浓度茶多酚导致巯基含量的减少[35]。由图2可知,通过添加不同量PMP,会对MP巯基含量产生不同影响。当PMP添加量2%时,与空白组相比,总巯基和活性巯基含量显著升高(P<0.05),当PMP添加量4%时,与添加量2%相比总巯基与活性巯基含量降低,这与王鹏等[36]的研究结果类似。当PMP添加量2%时,可能使MP结构部分展开,从而使蛋白结构中的二硫键变化形成巯基,使总巯基含量升高。而蛋白溶解度提高会使包埋于分子内部的巯基暴露出来,进而使得活性巯基含量逐渐增加[37]。当PMP添加量4%时巯基含量降低,可能是由于PMP的加入促进了混合体系中MP分子二硫键的形成,导致巯基含量降低[38]。
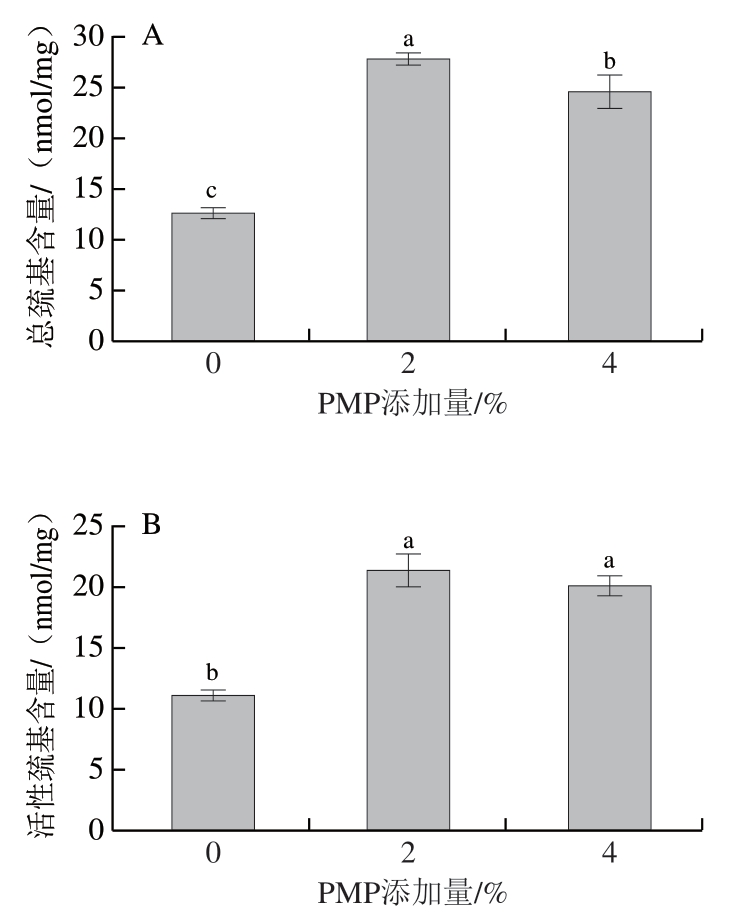
图2 不同添加量PMP对MP总巯基(A)和活性巯基含量(B)的影响
Fig. 2 Effects of different concentrations of PMP on total sulfhydryl (A) and active sulfhydryl contents (B) of MP
小写字母不同,表示差异显著(P<0.05)。图3~4同。
2.3 PMP对MP羰基的影响
蛋白质发生羰基化可作为蛋白质氧化的一个重要指标,羰基主要由活性氧所致肽链的断裂及活性氧攻击氨基酸分子的氨基或亚氨基产生[39],羰基含量越高,蛋白质氧化损伤程度越高[40],因此通过测定羰基含量来评估PMP对MP的抗氧化作用。由图3可知,随着PMP添加量的增加,羰基含量逐渐降低,当添加量4%时,羰基含量显著降低(P<0.05),这与Nikoo[41]、贾娜[42]等的研究结果一致,说明PMP的存在显著抑制蛋白质氧化引起的羰基形成。通常当氨基酸侧链含有—NH—或—NH2时更易被氧化成羰基[43],可能是由于多肽中存在的—NH—或—NH2较少。随着PMP添加量升高,羰基含量降低,MP氧化稳定性增加,反映了多肽的抗氧化性。
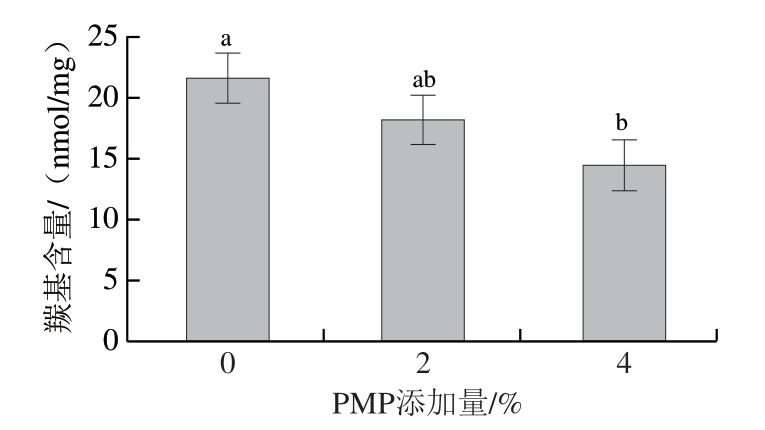
图3 不同添加量PMP对MP羰基含量的影响
Fig. 3 Effect of different concentrations of PMP on the carbonyl content of MP
2.4 PMP对MP二级结构的影响
FTIR因其操作简单、扫描快速、波长精确、灵敏度高等优点,多被用来分析蛋白质的二级结构[44]。蛋白质二级结构变化与C—H、N—H和C—O等的振动方式有关,这些振动方式使红外光谱在多个波段均有吸收[45]。其中,酰胺Ⅰ带(1 700~1 600 cm-1)是肌原纤维中最主要的谱带,常被用来分析肌原纤维二级结构的变化[46]。 图4A显示了PMP修饰后的MP在4 000~500 cm-1范围内的FTIR谱图。由图4A可知,PMP修饰MP后吸收峰会发生变化,可以有效区分MP及修饰后的MP间的光谱差异。3 300 cm-1附近的宽峰属于酰胺A带,是由N—H的伸缩振动导致的特征峰[47]。酰胺Ⅰ带(1 656 cm-1)主要是由 C=O伸缩振动引起的,N—H弯曲振动和C—N伸缩振动引起酰胺带。对比MP及PMP-MP复合物,1 404 cm-1处的吸收峰出现差异,可能是因为氨基酸残基侧链基团对抗氧化性有影响。PMP修饰后改变了MP的结构,反映了多肽的抗氧化性。由此可见,PMP的添加会对MP的FTIR产生一定影响。
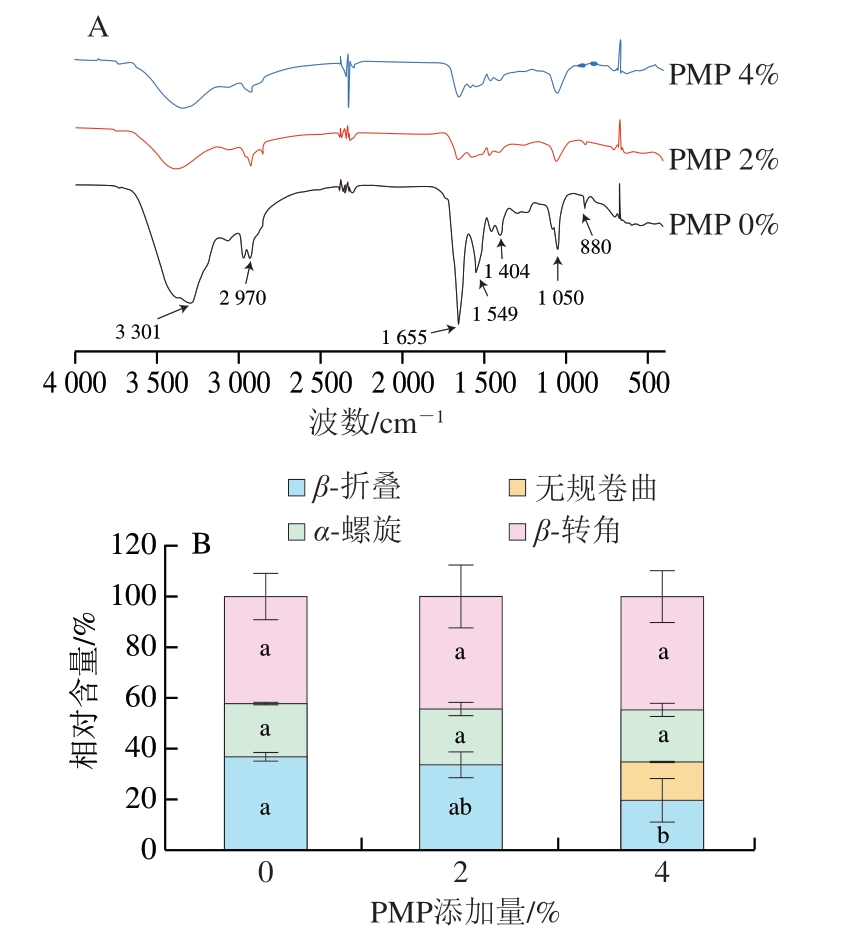
图4 不同添加量PMP对MP FTIR谱图(A)及二级结构(B)的影响
Fig. 4 Effect of different concentrations of PMP on FTIR spectrum (A) and secondary structure (B) of MP
由图4B可知,随着PMP添加量增加,MP的α-螺旋相对含量无显著差异,但β-折叠相对含量随添加量增加而显著降低(P<0.05),β-转角相对含量无显著差异。近年来,亚麻籽胶[48]、小麦麸膳食纤维[49]都被证实可以对MP性质产生一定的影响。α-螺旋为位于多肽链内部的紧密、不含空腔的稳定结构。β-折叠和无规卷曲结构的紧密程度和构象稳定性弱于α-螺旋[50]。氧化后MP的α-螺旋相对含量下降,而无规卷曲相对含量提高。这表明氧化促进了MP α-螺旋结构的去折叠,增加了β-折叠、β-转角和无规卷曲的相对含量。添加PMP后,α-螺旋相对含量先上升后下降,β-折叠相对含量下降,β-转角、无规卷曲相对含量逐渐上升,α-螺旋构象稳定主要是通过碳基氧(C=O)和氨基氢(NH)之间形成的分子间氢键 实现[13],PMP的存在可能会干扰这些氢键,从而影响蛋白质的α-螺旋并降低α-螺旋的比例。
2.5 PMP对MP紫外吸收光谱的影响
紫外吸收光谱的产生是由于蛋白质分子中含有能够吸收紫外区某一波长光的基团,是一种用于检测和研究溶液中MP分子的一种光谱学方法。蛋白质的紫外吸收光谱可以直接反映MP内生色基团(色氨酸残基、酪氨酸残基、苯丙氨酸残基)的含量,被广泛应用于评价蛋白结构变化,进而可以检测出溶液中蛋白质分子的有序结构是否被破坏[51]。
由图5A可知,在约285 nm处观察到紫外光谱中的清晰吸收峰,代表芳香族氨基酸残基,包括色氨酸、酪氨酸和苯丙氨酸。经PMP修饰的MP紫外吸收强度先升高后降低,这与Liu Pingping等[52]的研究结果一致,经PMP修饰的MP紫外吸收强度相对于空白组均有所升高,这可能是由于添加PMP使掩藏在溶剂中的生色基团暴露,即这些基团由原来的非极性环境转变到极性环境,从而使整体的紫外吸收强度升高。
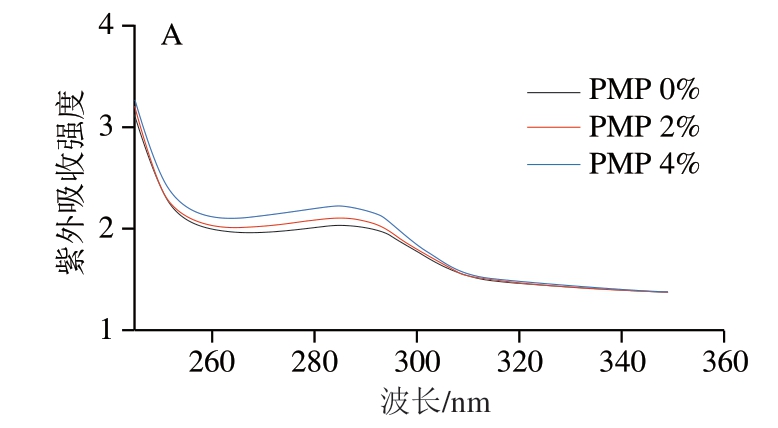
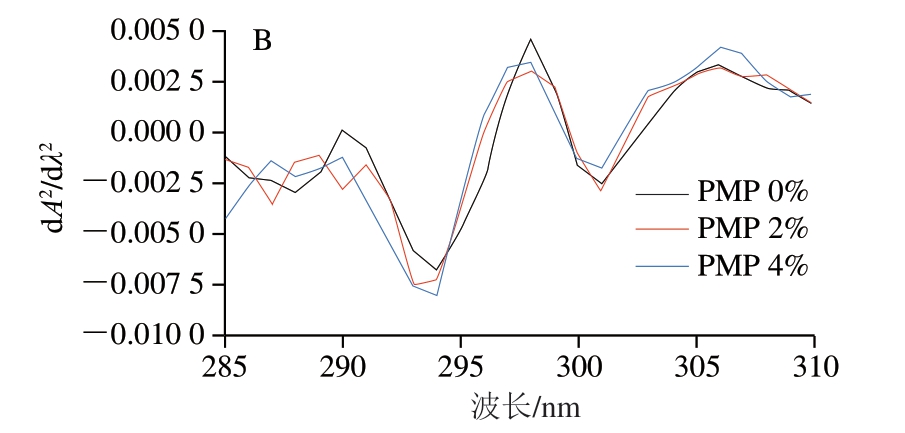
图5 不同添加量PMP对MP紫外吸收光谱(A)及紫外二阶导数 光谱(B)的影响
Fig. 5 Effect of different concentrations of PMP on the ultraviolet absorption spectrum (A) and the second-derivative UV absorption spectrum (B) of MP
二阶导数紫外光谱法已被证明是分析蛋白质结构变化的有效方法,主要是因为它能很好地区分每个芳香族氨基酸的光谱带。可以通过紫外二阶导数光谱生成r值(r=a/b,a、b分别为第1、2次正吸收峰与负吸收峰的差值)来计算酪氨酸残留物周围的极性微环境。由图5B可知,有2 个正吸收峰和2 个负吸收峰。
r首先从初始值1.938 2降低到1.725 3,PMP添加量增加后再上升至1.913 3。结果表明,当PMP添加量较低时,可能是由于PMP三级结构并未展开,导致MP紫外二阶导数降低。但随着PMP添加量的增加,PMP三级结构展开,这导致酪氨酸残基向更强极性的区域移动。在氧化过程中,随着更多疏水性氨基酸残基的暴露,疏水相互作用增强,导致分子之间的聚集,然后在更疏水的环境中重新掩埋非极性芳香族氨基酸残基[52]。
2.6 PMP对MP内源荧光光谱的影响
蛋白质内源性色氨酸荧光对于其周边微环境的极性非常敏感,因此常用于监测蛋白质三级结构的 变化[53]。研究表明,槲皮素和芦丁[54]、白藜芦醇[55]等的添加都会使MP的荧光强度降低。由图6可知,未添加PMP的MP显示出较强的荧光强度,添加PMP诱导蛋白质结构展开,使色氨酸暴露在极性环境中,导致MP荧光强度降低。可能是由于PMP和色氨酸残基之间可能存在相互作用,导致荧光强度的降低[56]。这与Huang Xiang[57]、Zhong Yuanyuan[58]等的研究结果一致。另一方面,随着PMP添加量的增加,MP内源色氨酸最大荧光强度逐渐减弱。这说明PMP对MP的作用增强了MP的去折叠,暴露更多色氨酸残基,使荧光强度降低。
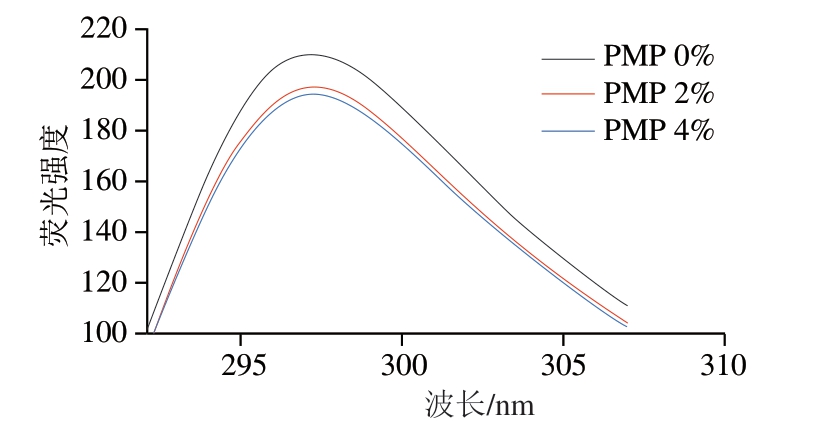
图6 不同添加量PMP对MP内源荧光光谱的影响
Fig. 6 Effect of different concentrations of PMP on the intrinsic fluorescence spectrum of MP
3 结 论
PMP的修饰对鲢鱼MP的结构有一定的影响。巯基、羰基测定结果表明,PMP存在一定的抗氧化性,PMP的修饰对鲢鱼MP的结构有一定影响。内源荧光光谱和紫外吸收光谱结果表明,PMP修饰后改变了MP的二级结构和三级结构,反映了PMP的抗氧化性。总体结果表明,PMP的修饰有利于维持MP结构稳定性。
本研究讨论了PMP对于MP结构的影响。但PMP与MP之间的修饰作用仍需要进一步研究,尤其是MP功能特性改善方面。本研究可为虾夷扇贝加工副产物的高值化利用提供依据,为多肽修饰蛋白质结构、改善其功能特性的相关研究提供参考,同时,可以考虑开发PMP作为淡水鱼糜的天然抗氧化剂、低温保护剂和凝胶质构增强剂。
[1] 谢宗墉. 海洋水产品营养与保健[M]. 青岛: 青岛海洋大学出版社, 1991.
[2] 王丹, 吴反修. 2021中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2021: 17-20.
[3] 郑丽, 汪秋宽. 扇贝加工废弃物海鲜调味料的加工利用[J]. 水产科学, 2005(1): 34-37. DOI:10.3969/j.issn.1003-1111.2005.01.012.
[4] 苏秀榕, 李太武, 丁明进. 扇贝营养成分的研究[J]. 海洋科学, 1997(2): 10-11.
[5] 王璐. 论扇贝的营养价值、生物活性及养殖[J]. 牡丹江大学学报, 2007(3): 92-94.
[6] NIKOO M, BENJAKUL S. Potential application of seafood derived peptides as bifunctional ingredients, antioxidant cryoprotectant: a review[J]. Journal of Functional Foods, 2015, 19: 753-764. DOI:10.1016/j.jff.2015.10.014.
[7] 马丽艳, 汪一红, 刘志东, 等. 扇贝加工副产物资源利用进展[J].渔业信息与战略, 2017, 32(3): 204-210. DOI:10.13233/j.cnki.fishis.2017.03.008.
[8] 殷红玲, 马媛, 王璐, 等. 虾夷扇贝内脏多糖的提取及清除羟基自由基作用的研究[J]. 水产科学, 2007(5): 255-258. DOI:10.16378/j.cnki.1003-1111.2007.05.002.
[9] 于运海, 周大勇, 孙黎明, 等. 虾夷扇贝脏器硫酸酯多糖的制备及性质研究[J]. 食品科学, 2009, 30(6): 68-71. DOI:10.3321/j.issn:1002-6630.2009.06.011.
[10] 冯丁丁, 李楠, 高雨, 等. 虾夷扇贝裙边多糖提取物细胞抗氧化活性的研究[J]. 食品科技, 2017, 42(4): 188-193. DOI:10.13684/j.cnki.spkj.2017.04.038.
[11] 刘雨博, 栾君笑, 佟长青, 等. 虾夷扇贝裙边糖胺聚糖的提取及其体外抗氧化活性研究[J]. 农产品加工, 2017(21): 10-14. DOI:10.16693/j.cnki.1671-9646(X).2017.11.003.
[12] 王克全, 徐寒梅. 多肽类药物的研究进展[J]. 药学进展, 2015, 39(9): 642-650.
[13] LIAO Guangming, ZHANG Haiping, JIANG Yiren, et al. Effect of lipoxygenase-catalyzed linoleic acid oxidation on structural and rheological properties of silver carp (Hypophthalmichthys molitrix) myofibrillar protein[J]. LWT-Food Science and Technology, 2022, 161: 113388. DOI:10.1016/j.lwt.2022.113388.
[14] 张钰嘉, 万杨卓群, 石尚轩, 等. 磷酸盐-大豆分离蛋白联合处理对草鱼肌原纤维蛋白凝胶化的影响[J]. 肉类研究, 2022, 36(2): 21-26. DOI:10.7506/rlyj1001-8123-20210527-157.
[15] 李立敏, 杨豫菘, 成立新, 等. 茶多酚对羊肉肌原纤维蛋白凝胶特性的影响[J]. 肉类研究, 2020, 34(3): 8-13. DOI:10.7506/rlyj1001-8123-20200131-030.
[16] 陈旭, 蔡茜茜, 汪少芸, 等. 抗冻肽的研究进展及其在食品工业的应用前景[J]. 食品科学, 2019, 40(17): 331-337. DOI:10.7506/spkx1002-6630-20190303-025.
[17] CHEN Xu, WU Jinhong, LI Xiaozhen, et al. Investigation of the cryoprotective mechanism and effect on quality characteristics of surimi during freezing storage by antifreeze peptides[J]. Food Chemistry, 2022, 371: 131054. DOI:10.1016/j.foodchem.2021.131054.
[18] 董文明, 林奇, 邵金良. 大豆多肽功能饮料加工技术研究[J]. 饮料工业, 2006(10): 30-32.
[19] 崔金会. 虾夷扇贝裙边水解蛋白的制备工艺与生物活性研究[D]. 北京: 中国科学院, 2012.
[20] 刘雨博, 栾君笑, 佟长青, 等. 虾夷扇贝裙边糖胺聚糖的提取及其体外抗氧化活性研究[J]. 农产品加工, 2017(21): 10-14. DOI:10.16693/j.cnki.1671-9646(X).2017.11.003.
[21] 冯丁丁, 李楠, 高雨, 等. 虾夷扇贝裙边多糖提取物细胞抗氧化活性的研究[J]. 食品科技, 2017, 42(4): 188-193. DOI:10.13684/j.cnki.spkj.2017.04.038.
[22] 仪淑敏, 李睿智, 陈杨, 等. 白鲢鱼肌原纤维蛋白双向电泳分析体系的建立[J]. 食品科学, 2017, 38(1): 41-46. DOI:10.7506/spkx1002-6630-201701007.
[23] 刘聪, 赵前程, 李智博, 等. 扇贝裙边胶原蛋白酶解物清除超氧阴离子能力的研究[J]. 食品与生物技术学报, 2009, 29(3): 338-341. DOI:10.3321/j.issn:1673-1689.2009.03.011.
[24] 朱东宏, 兰冬梅, 郑惠娜, 等. 不同种类酸诱导罗非鱼肌球蛋白去折叠行为的研究[J]. 广东农业科学, 2015, 42(12): 135-140. DOI:10.16768/j.issn.1004-874x.2015.12.005.
[25] YILDIZ G, DING J, ANDRADE J, et al. Effect of plant proteinpolysaccharide complexes produced by mano-thermo-sonication and pH-shifting on the structure and stability of oil-in-water emulsions[J]. Innovative Food Science and Emerging Technologies, 2018, 47: 317-325. DOI:10.1016/j.ifset.2018.03.005.
[26] SAWAYAMA J, OKITSU T, NAKAMATA A, et al. Hydrogel glucose sensor with in vivo stable fluorescence intensity relying on antioxidant enzymes for continuous glucose monitoring[J]. Iscience, 2020, 23(6): 101243. DOI:10.1016/j.isci.2020.101243.
[27] XU Yujuan, ZHAO Xue, BIAN Guangliang, et al. Structural and solubility properties of pale, soft and exudative (PSE)-like chicken breast myofibrillar protein: effect of glycosylation[J]. LWTFood Science and Technology, 2018, 95: 209-215. DOI:10.1016/j.lwt.2018.04.051.
[28] ESTEVEZ M, KYLLI P, PUOLANNE E, et al. Fluorescence spectroscopy as a novel approach for the assessment of myofibrillar protein oxidation in oil-in-water emulsions[J]. Meat Science, 2008, 80(4): 1290-1296. DOI:10.1016/j.meatsci.2008.06.004.
[29] SARABANDI K, MAHOONAK A S, HAMISHEHKAR H, et al. Protection of casein hydrolysates within nanoliposomes: antioxidant and stability characterization[J]. Journal of Food Engineering, 2019, 251: 19-28. DOI:10.1016/j.jfoodeng.2019.02.004.
[30] WU Libo, ZHANG Jian, WATANABE W. Physical and chemical stability of drug nanoparticles[J]. Advanced Drug Delivery Reviews, 2011, 63(6): 456-469. DOI:10.1016/j.addr.2011.02.001.
[31] 周小敏, 郑万源, 李澄. 金枪鱼骨胶原多肽螯合钙的制备[J]. 食品工业, 2020, 41(7): 22-26.
[32] 李双双, 李媛, 杜春阳, 等. 活性多肽奶基质脂质体的制备及应用[J]. 国际药学研究杂志, 2020, 47(2): 150-155; 162. DOI:10.13220/j.cnki.jipr.2020.02.010.
[33] 吴彬彬, 胥伟, 傅采琪. 茶多酚-肌原纤维蛋白结构和功能特性的研究进展[J]. 食品科技, 2021, 46(3): 124-128. DOI:10.13684/j.cnki.spkj.2021.03.022.
[34] 李亚丽, 许玉娟, 徐幸莲. 多酚对肌原纤维蛋白结构与功能特性的影响研究进展[J]. 食品与发酵工业, 2021, 47(19): 296-306. DOI:10.13995/j.cnki.11-1802/ts.026950.
[35] LI Xueping, LIU Cikun, WANG Jinxiang, et al. Tea polyphenols affect oxidative modification and solution stability of myofibrillar protein from grass carp (Ctenopharyngodon idellus)[J]. Food Biophysics, 2020, 15(1): 1-12. DOI:10.1007/s11483-020-09635-x.
[36] 王鹏, 穆雅慧, 何思宁, 等. 鲢鱼骨蛋白水解物对肌原纤维蛋白凝胶特性的影响[J]. 农产品加工, 2022(2): 1-6. DOI:10.16693/j.cnki.1671-9646(X).2022.01.031.
[37] LIU Ru, ZHAO Siming, XIONG Shanbai. Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties[J]. Food Hydrocolloid, 2011, 25(5): 898-906. DOI:10.1016/j.foodhyd.2010.08.016.
[38] HAN Keying, LI Shanshan, YANG Yuling, et al. Mechanisms of inulin addition affecting the properties of chicken myofibrillar protein gel[J]. Food Hydrocolloids, 2022, 131: 107843. DOI:10.1016/j.foodhyd.2022.107843.
[39] STADTMAN E R. Protein oxidation and aging[J]. Science, 1992, 257: 1220-1224. DOI:10.1126/science.1355616.
[40] DEAN R T, FU S L, STOCKER R, et al. Biochemistry and pathology of radical-mediated protein oxidation[J]. Biochemical Journal, 1997, 324: 1-18. DOI:10.1042/bj3240001.
[41] NIKOO M, BENJAKUL S, GAVLIGHI H A, et al. Hydrolysates from rainbow trout (Oncorhynchus mykiss) processing by-products: properties when added to fish mince with different freeze-thaw cycles[J]. Food Bioscience, 2019, 30: 100418. DOI:10.1016/j.fbio.2019.100418.
[42] 贾娜, 金伯阳, 刘丹, 等. 儿茶素对肌原纤维蛋白氧化、结构及凝胶特性的影响[J]. 肉类研究, 2020, 34(4): 13-19. DOI:10.7506/rlyj1001-8123-20200220-043.
[43] LIU Qian, LU Yan, HAN Jianchun, et al. Structure-modification by moderate oxidation in hydroxyl radical-generating systems promote the emulsifying properties of soy protein isolate[J]. Food Structure, 2015, 6: 21-28. DOI:10.1016/j.foostr.2015.10.001.
[44] 张秋会, 黄现青, 李苗云, 等. 傅里叶红外光谱法研究肌肉蛋白质的二级结构[J]. 食品与发酵工业, 2015, 41(10): 247-251. DOI:10.13995/j.cnki.11-1802/ts.201510045.
[45] 刁小琴, 关海宁, 李杨, 等. 高压均质对肌原纤维蛋白乳化特性及结构的影响[J]. 食品与机械, 2019, 35(4): 26-30; 36. DOI:10.13995/j.cnki.11-1802/ts.020838.
[46] HAN Zongyuan, ZHANG Junlong, ZHENG Jinyue, et al. The study of protein conformation and hydration characteristics of meat batters at various phase transition temperatures combined with low-field nuclear magnetic resonance and Fourier transform infrared spectroscopy[J]. Food Chemistry, 2019, 280(9): 263-269. DOI:10.1016/j.foodchem.2018.12.071.
[47] WU Wenfei, LI Bafang, HOU Hu, et al. Identification of ironchelating peptides from pacific cod skin gelatin and the possible binding mode[J]. Journal of Functional Foods, 2017, 35: 418-427. DOI:10.1016/j.jff.2017.06.013.
[48] 潘丽华, 冯美琴, 孙健, 等. 不同温度下亚麻籽胶对肌原纤维蛋白凝胶特性的影响及机制[J]. 食品科学, 2016, 37(9): 1-6. DOI:10.7506/spkx1002-6630-201609001.
[49] 刘英丽, 谢良需, 丁立, 等. 小麦麸膳食纤维对猪肉肌原纤维蛋白凝胶功能特性的影响[J]. 食品科学, 2016, 37(19): 15-23. DOI:10.7506/spkx1002-6630-201619003.
[50] 任丽娜. 白鲢鱼肉肌原纤维蛋白冷冻变性的研究[D]. 无锡: 江南大学, 2014: 32-33.
[51] 孙科, 闫方华, 许晓敏, 等. 苹果多酚改性蛋清改善鲅鱼鱼糜的凝胶性质[J]. 现代食品科技, 2020, 36(10): 210-217; 164. DOI:10.13982/j.mfst.1673-9078.2020.10.0382
[52] LIU Pingping, ZHANG Zhiwei, GUO Xin, et al. μ-Calpain oxidation and proteolytic changes on myofibrillar proteins from Coregonus peled in vitro[J]. Food Chemistry, 2021, 361: 130100. DOI:10.1016/j.foodchem.2021.130100.
[53] 杨天, 耿文豪, 郑志红, 等. 褐藻寡糖对鲢鱼鱼糜稳定性、分子间作用力及肌原纤维蛋白结构的影响[J]. 肉类研究, 2021, 35(7): 1-8. DOI:10.7506/rlyj1001-8123-20210428-116.
[54] 邵晓, 张宁, 孙乐彤, 等. 槲皮素和芦丁对猪肉肌原纤维蛋白结构的影响[J]. 食品研究与开发, 2019, 40(2): 26-30.
[55] 黄渊, 岳世阳, 熊善柏, 等. 2 种天然抗氧化剂与鲢鱼肌球蛋白的相互作用[J]. 食品科学, 2019, 40(4): 14-20. DOI:10.7506/spkx1002-6630-20171221-263.
[56] ZHANG Daojiu, YANG Xu, WANG Yichun, et al. Proanthocyanidin B2 and transglutaminase synergistically improves gel properties of oxidized myofibrillar proteins[J]. Food Chemistry, 2022, 391: 133262. DOI:10.1016/j.foodchem.2022.133262.
[57] HUANG Xiang, SUN Lu, LIU Lan, et al. Study on the mechanism of mulberry polyphenols inhibiting oxidation of beef myofibrillar protein[J]. Food Chemistry, 2022, 372: 131241. DOI:10.1016/j.foodchem.2021.131241.
[58] ZHONG Yuanyuan, HAN Ping, SUN Suling, et al. Effects of apple polyphenols and hydroxypropyl-β-cyclodextrin inclusion complexes on the oxidation of myofibrillar proteins and microstructures in lamb during frozen storage[J]. Food Chemistry, 2022, 375: 131874. DOI:10.1016/j.foodchem.2021.131874.