杂环胺(heterocyclic aromatic amines,HAAs)是蛋白食品经高温加工过程产生的一类具有致畸、致癌性的化合物,目前已经分离鉴定出30 种左右,部分HAAs在埃姆斯测验中表现出比黄曲霉毒素B1和苯并(a)芘更强的诱变特性[1]。在乳腺癌[2]、前列腺癌[3]和肝癌[4]等疾病形成中,HAAs发挥的作用与其经体内转化吸收后形成的高水平DNA加合物有关。因动物源食品相对植物基食品中存在独有的肌酸(酐)[5],动物源制品尤其是肉制品含有较多种类及含量的HAAs[6],这是世界卫生组织将红肉及其制品列为致癌物的原因之一。
食品中HAAs的研究多针对其在食品加工过程中的形成[7]及抑制[8]。李雨竹等[9]发现,生姜和辣椒可以减少卤煮牛肉中HAAs,而其特征成分6-姜酚和辣椒素的抑制作用更强。薛超轶等[10]认为,组氨酸可以浓度依赖性地抑制烤牛肉饼中β-咔啉类杂环胺,脯氨酸对2-氨基-3,8-二甲基咪唑并喹喔啉(2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline,MeIQx)的抑制能力同样呈浓度依赖关系。Li Yong等[11]研究发现,盐的加入将降低烤牛肉饼的蒸煮损失,这增加了肉饼的适口性,但导致更多HAAs生成。此外,由于植物油分解的复杂性和油中抗氧化剂的差异,植物油在抑制HAAs方面仍需进一步研究[12]。除了食品加工常用的油脂、香辛料及磷酸盐等辅料或添加剂之外,蓝莓[13]、木瓜[14]和鳄梨[15]等富含抗氧化成分的水果及其提取物因具有较强的自由基清除作用而常见于抑制HAAs生成的研究中。以上研究在阻断因肉制品热加工过程HAAs生成而引起的HAAs膳食暴露方面取得了长足进展,但目前尚未有可以完全抑制高温加工熟肉制品中所有HAAs的方法。因此,基于天然植物单体成分在减少膳食摄入HAAs毒性方面的研究也有一些报道。Serap等[16] 发现叶绿素a和叶绿素b可以防止由MeIQx引起的DNA损伤;Anna等[17]证实咖啡因、己酮可可碱和茶碱可以与HAAs形成π-π堆叠复合物,并降低HAAs的致突变性;Bear等[18]研究发现,香叶木苷、柚皮苷、柚皮素和芦丁等柑橘类黄酮对由细胞色素P450 1A2介导的HAAs致突变性具有预防潜力。
Arkadiusz[19]认为,HAAs是以游离态和蛋白结合态2 种形式存在于食品中,而体外消化实验中经消化酶解测得显著高于常规有机溶剂萃取的HAAs含量证实了这一观点。蛋白质在胃肠道消化阶段被广泛水解形成游离氨基酸或肽,部分研究显示,低聚肽的吸收效率要高于游离氨基酸[20],这意味着HAAs的膳食暴露量要高于以往研究中使用有机溶剂萃取所得HAAs含量,甚至可能因为肽吸收的原因也高于消化过后的游离态HAAs含量。因此,同时测定膳食中游离态和蛋白结合态HAAs的含量可以更好地预估真实膳食暴露HAAs水平[21]。根据前述,针对食品加工过程中HAAs生成抑制的研究重点是筛选有效的天然植物及其提取物,然而目前没有明确关于这些外源添加物对于消化过程HAAs释放影响的研究报道。基于食物基质的复杂性及外源添加物对消化过程干预机制的不明确性,本研究分析生活中较为常见的苹果与葡萄对烤牛肉饼消化过程中的游离态及蛋白结合态HAAs的影响。
1 材料与方法
1.1 材料与试剂
新鲜牛里脊肉(2~3 岁鲁西公黄牛,体质量约800 kg),购于无锡华润万家超市万顺路店;新鲜苹果和葡萄购于无锡欧尚超市高浪店。
17 种HAAs标准品,包括2-氨基-9H-吡啶并[2,3-b]吲哚(2-amino-9H-pyrido[2,3-b]indole,AαC)、2-氨基-3甲基-9H-吡啶并[2,3-b]吲哚(2-amino-3-methyl-9Hpyrido[2,3-b]indole,MeAαC)、1-甲基-9H-吡啶并[3,4-b] 吲哚(1-methyl-9H-pyrido[3,4-b]indole,harman)、9H-吡啶并[3,4-b]吲哚(9H-pyrido[3,4-b]indole,norharman)、2-氨基-6-甲基二吡啶并[1,2-a:3’,2’-d]咪唑、2-氨基-1-甲基-6苯基咪唑并[4,5-b]吡啶(2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine,PhIP)、2-氨基-1,6-二甲基咪唑并[4,5-b]吡啶、2-氨基-1,5,6-三甲基咪唑并[4,5-b]吡啶、2-氨基-3-甲基-3H-咪唑并[4,5-f]喹啉(2-amino-3-methyl-3H-imidazo[4,5-f]quinoline,IQ)、 2-氨基-3,4-二甲基咪唑并[4,5-f]喹啉(2-amino-3,4-dimethylimidazo[4,5-f]quinoline,MeIQ)、2-氨基-1-甲基咪唑并[4,5-b]喹啉(2-amino-1-methylimidazo[4,5-b]quinoline,IQ[4,5-b])、2-氨基-3-甲基咪唑并[4,5-f]喹喔啉(2-amino-3-methylimidazo[4,5-f]quinoxaline,IQx)、MeIQx、2-氨基-3,4,8-三甲基咪唑并[4,5-f]喹喔啉、 2-氨基-3,7,8-三甲基咪唑并[4,5-f]喹喔啉、2-氨基-3,4,7,8-四甲基-3H-咪唑并[4,5-f]喹喔啉、2-氨基-5-苯基吡啶(2-amino-5-phenylpyridine,Phe-P-1)(纯度>99.9%) 圣克鲁斯生物技术(上海)有限公司;α-淀粉酶(酶活力12 U/mg)、胃蛋白酶(酶活力30 U/mg)、胰酶(酶活力4 U/mg)、猪胆盐(胆酸含量≥60%) 上海源叶生物技术有限公司;硅藻土、NaOH、HCl、乙酸乙酯 国药集团化学试剂(上海)有限公司;甲醇、乙腈、甲酸(色谱级) 德国Meker公司。
1.2 仪器与设备
Acquity超高效液相色谱串联三重四极杆-质谱联用仪(ultra high performance liquid chromatography-triple quadrupole tandem mass spectrometry,UPLC-MS/MS),配有电喷雾离子源(electron spray ionization,ESI) 美国Waters公司;Fotector Plus全自动固相萃取仪、AUTO EVA全自动浓缩仪 中国睿科仪器有限公司;SCC61万能蒸烤箱 德国Rational公司。
1.3 方法
1.3.1 烤牛肉饼的制备
生牛里脊肉糜(40.0±0.1) g用内径6 cm的铁圈定型成饼状后在烤箱中225 ℃烘烤20 min(每面烘烤10 min)。冷却至室温后,将所有烤牛肉饼搅碎后充分混匀。随后进行冷冻干燥,并在-80 ℃下保存。
1.3.2 牛肉饼的体外消化
实验组样品为体外消化前分别向2.5 g冻干牛肉饼中加入现搅碎新鲜苹果泥和葡萄泥(添加量分别为冻干牛肉饼质量的50%、100%和150%),再进行体外消化;对照组样品则直接称量相同质量冻干牛肉饼进行体外消化。体外消化参考Minekus等[22]的方法。
1.3.3 体外消化液中游离态HAAs的提取
体外消化结束后取全部消化液,加入一定量的NaOH调节pH值至约12.0,以抑制消化酶活性并提高HAAs的萃取效率,加入40 mL乙酸乙酯40 kHz、50 ℃超声提取45 min,收集混合液经3 000 r/min离心10 min后得上层乙酸乙酯相,重复提取2 次。氮吹浓缩乙酸乙酯相至20 mL左右,固相萃取前加入100 μL 2 mol/L HCl溶液中和残留的NaOH。提取液随后进行固相萃取。
1.3.4 体外消化液中结合态HAAs的提取
参考Chen Jing等[21]的方法,略有改动。在用乙酸乙酯提取出游离HAAs后,剩余的下层液体浓缩至约20 mL后转移到48 mL耐压瓶中,加入等体积的浓盐酸使盐酸浓度约为6 mol/L,于110 ℃烘箱中水解24 h后,将水解液过滤定容至100 mL,取10 mL进行固相萃取。
1.3.5 固相萃取
采用全自动固相萃取仪和MCX固相萃取小柱对样品进行分离富集和纯化。分别使用6 mL色谱级甲醇、超纯水、乙酸乙酯活化MCX固相萃取小柱,然后上样HAAs提取液,随后依次用6 mL 0.1 mol/L HCl和甲醇淋洗小柱,最后使用6 mL甲醇-氨溶液(19∶1,V/V)洗脱保留在小柱中的HAAs,洗脱液经氮气吹干后用0.3 mL色谱级甲醇复溶,经0.22 μm有机滤膜过滤后使用UPLC-MS/MS进行分析。
1.3.6 UPLC-MS/MS检测条件
HAAs的定性及定量分析采用本课题组前期研究[23] 中的方法,使用Waters Acquity UPLC BEH C18色谱柱分离17 种HAAs,柱温45 ℃,以100%乙腈(A)和0.1%甲酸(B)为流动相进行梯度洗脱:0~2 min,2%流动相A;2~12 min,2%~20%流动相A;12~14 min,20%~100%流动相A;14~17 min,100%~2%流动相A; 17~20 min,2%流动相A。总运行时间为20 min,流速0.3 mL/min,进样量2 μL。ESI-MS操作条件如下:正离子模式(ESI+)运行,离子源温度100 ℃,脱溶剂气(氮气)温度400 ℃,毛细管电压3.50 kV,锥孔气(氮气)流量50 L/h,脱溶剂气流量700 L/h,碰撞气(氩气)流量0.15 mL/min。MS检测采用多反应监测模式。
1.4 数据处理
UPLC-MS/MS图谱采集及定性、定量分析均采用Mass Lynx V4.1软件。数据显著性分析使用Minitab 19软件完成,做图软件为Origin 2022b教育版,主成分分析(principal component analysis,PCA)和聚类分析作图使用Metaboanalyst在线网站(https://www.metaboanalyst.ca/MetaboAnalyst/home.xhtml)完成。
2 结果与分析
2.1 苹果与葡萄对烤牛肉饼消化后游离态HAAs含量的影响
由表1可知,烤牛肉饼中存在8 种游离态HAAs,含量从低到高依次为AαC、Phe-P-1、MeIQx、IQ[4,5-b]、MeAαC、PhIP、Harman、Norharman,对照组总游离态HAAs含量达到112.41 ng/g,各HAAs含量为0.11~88.41 ng/g。PhIP、Harman和Norharman占据总游离HAAs的98%,食品组分的差异和各HAAs的生成所需前体物的不同是各HAAs在烹饪过程含量差异变化的最主要原因[7]。添加水果泥的烤牛肉饼消化液中含有更多含量的游离态HAAs,最高达到236.30 ng/g,相对提高110%。除添加苹果泥的烤牛肉饼PhIP含量略有下降外,其余各HAAs都有所增加,相对增加5%~183%。苹果泥与葡萄泥加入后,消化液中Phe-P-1、Harman、Norharman和总游离HAAs呈现含量依赖性显著增加 (P<0.05);游离态AαC和MeIQx的含量同样表现出含量依赖性增加,但不具有显著性差异;IQ[4,5-b]、MeAαC和PhIP的含量变化则未与水果泥的添加量呈现出良好规律性。
表1 苹果与葡萄对烤牛肉饼消化后游离态HAAs含量的影响
Table 1 Free HAAs content in digested products of roast beef patties affected by apple and grape ng/g
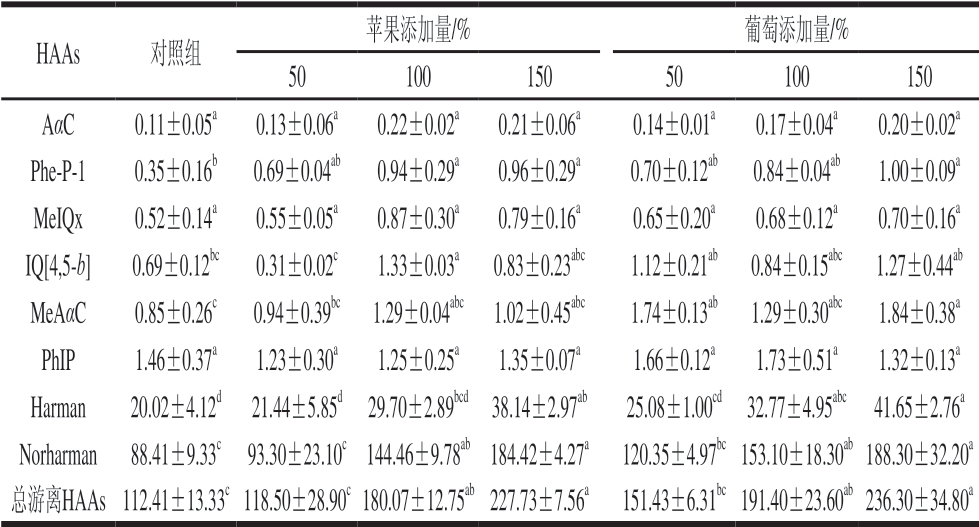
注:同行小写字母不同,表示差异显著(P<0.05)。表2同。
2.2 苹果与葡萄对烤牛肉饼消化后蛋白结合态HAAs 含量的影响
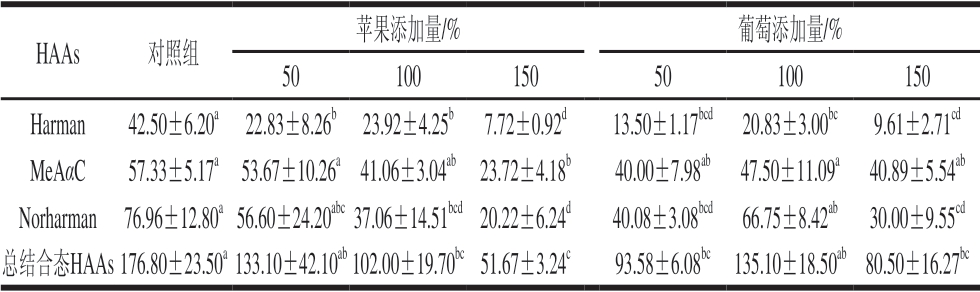
由表2可知,烤牛肉饼中存在3 种蛋白结合态HAAs,含量从低到高依次为Harman、MeAαC和Norharman,对照组总蛋白结合态HAAs含量达到176.80 ng/g,各HAAs含量为42.50~76.96 ng/g。蛋白结合态HAAs的来源可以分为蛋白对游离态HAAs的选择性物理吸附;游离HAAs与蛋白通过形成稳定的酰胺键结合;蛋白质氨基酸侧链反应直接生成结合态HAAs。添加苹果泥的烤牛肉饼消化液中除Harman外的各蛋白结合态HAAs和总结合态HAAs含量都含量依赖性显著下降 (P<0.05),结合态MeAαC、Norharman和Harman含量分别最高减少59%、74%和82%。葡萄泥的加入量与蛋白结合态HAAs之间没有明显的规律,100%葡萄泥添加量消化液中蛋白结合态HAAs含量高于其他添加量组,最高分别减少30%、61%和77%的结合态MeAαC、Norharman和Harman。
表2 苹果与葡萄对烤牛肉饼消化后蛋白结合态HAAs含量的影响
Table 2 Protein-bound HAAs content in digested products of roast beef patties affected by apple and grape ng/g
2.3 相关性分析
由图1A可知,对照组与水果泥添加组消化液中的HAAs总含量没有显著性差异,表明水果泥的引入并未引起HAAs总量的变化。由图1B可知,结合态HAAs与游离态HAAs之间呈现负相关,其中蛋白结合态Harman与游离态Harman相关系数为-0.66(P<0.01),蛋白结合态Norharman与游离态Norharman相关系数为-0.53 (P<0.05),表明水果泥的确促进了蛋白结合态HAAs在消化过程向游离态HAAs的转化。Chen Jing等[21]发现,蛋白结合态HAAs与游离态HAAs的种类并不会完全一致,而食品基质对蛋白结合态HAAs释放的种类及含量存在显著影响[24]。Xue Chaoyi等[25-26]研究发现,正常消化酶的剂量对水溶性肌浆蛋白和盐溶性肌原纤维蛋白上结合的HAAs具有有限的释放能力,随着消化酶剂量的增加,游离态HAAs的含量也会增加,并且关键消化酶为肠消化阶段的胰蛋白酶,在相同消化酶剂量下,辣椒和洋葱等香辛料及苹果等均促进了蛋白结合态HAAs的释放,这与外源添加物对消化酶活性的影响[27]、促进消化底物的暴露与消化酶的有效结合有关[28]。
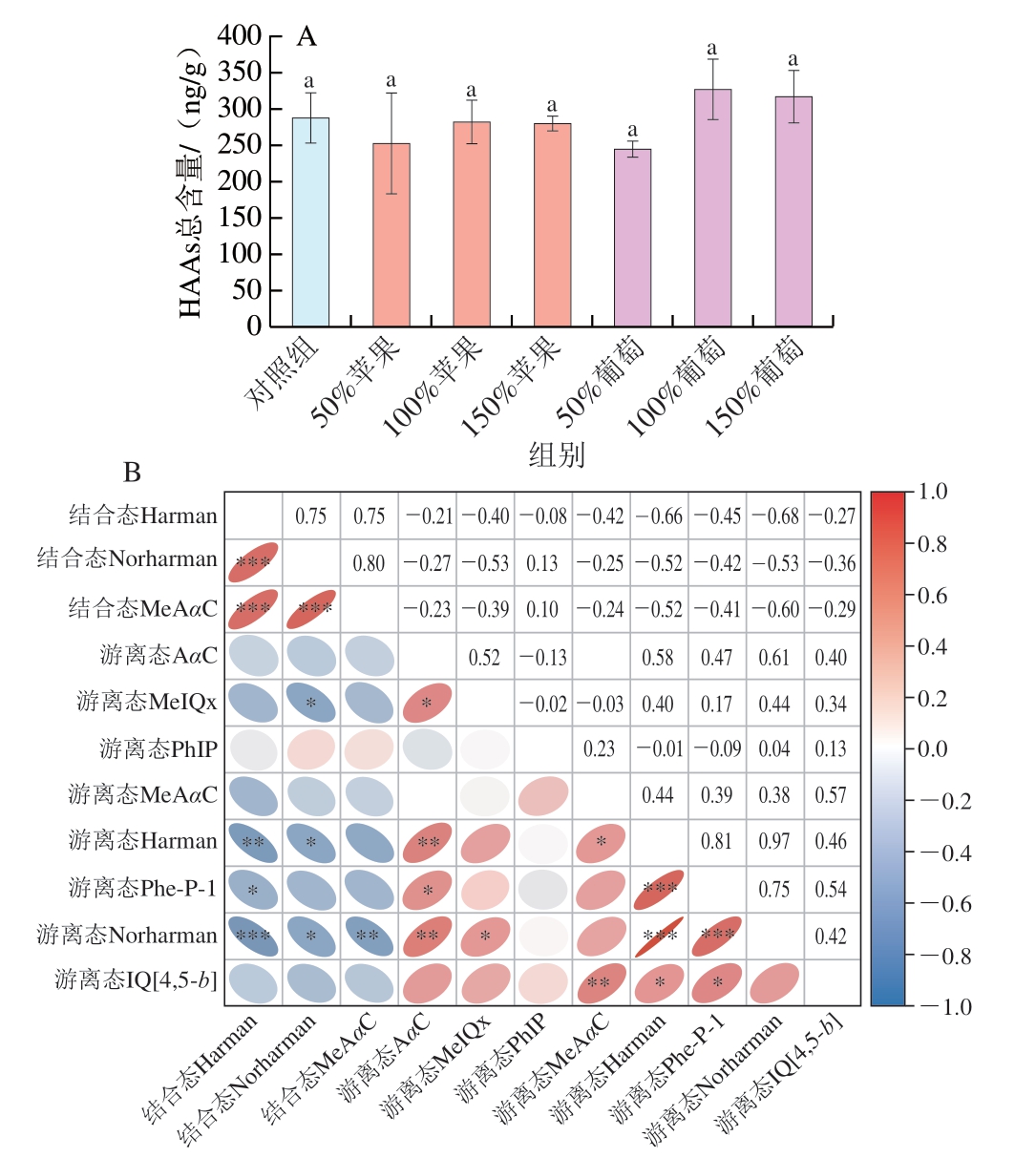
图1 消化液中总HAAs含量(A)及游离态与蛋白结合态 HAAs相关性分析(B)
Fig. 1 Total HAAs in digested products of roast beef patties (A), and correlation analysis between free and protein-bound HAAs (B)
小写字母不同,表示差异显著(P<0.05);*. 显著相关(P<0.05);**. 极显著相关(P<0.01);***. 高度显著相关(P<0.001)。
2.4 PCA与聚类分析
由图2A可知,第1和第2主成分可以解释原始数据集68.7%的特征,对照组与水果泥添加组在第1主成分方向可以较好地分离,根据PCA得分图可以确定,对消化过程HAAs释放综合影响程度从低到高依次为50%苹果、100%葡萄、100%苹果、50%葡萄、150%葡萄和150%苹果。由图2B可知,样本分类主要聚为3 类。100%葡萄与50%苹果与对照组为聚为一类,表明100%葡萄与50%苹果与对照组的组成更为接近;其次,可以看出50%葡萄与100%苹果组影响效果接近,聚为一类;最后,150%苹果与150%葡萄组合聚为一类。PCA与聚类热图相互印证,表明数据分析结果可靠。聚类热图中还显示,在测试指标中,蛋白结合态HAAs归为一簇,与游离态HAAs具有较大差异,符合实际测定。
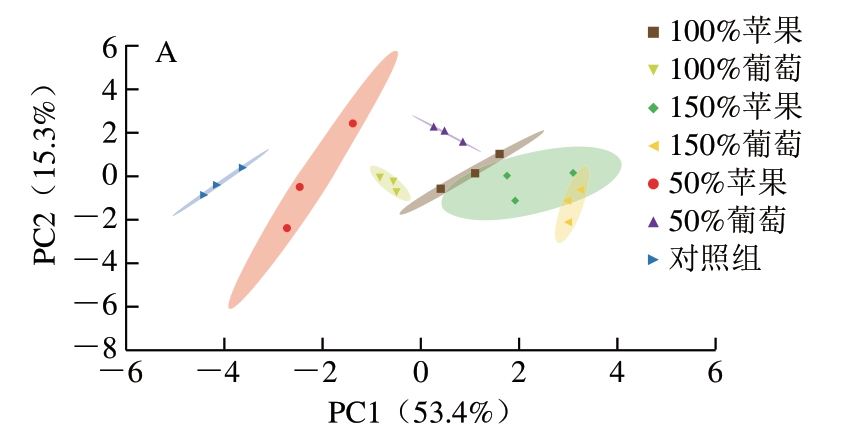
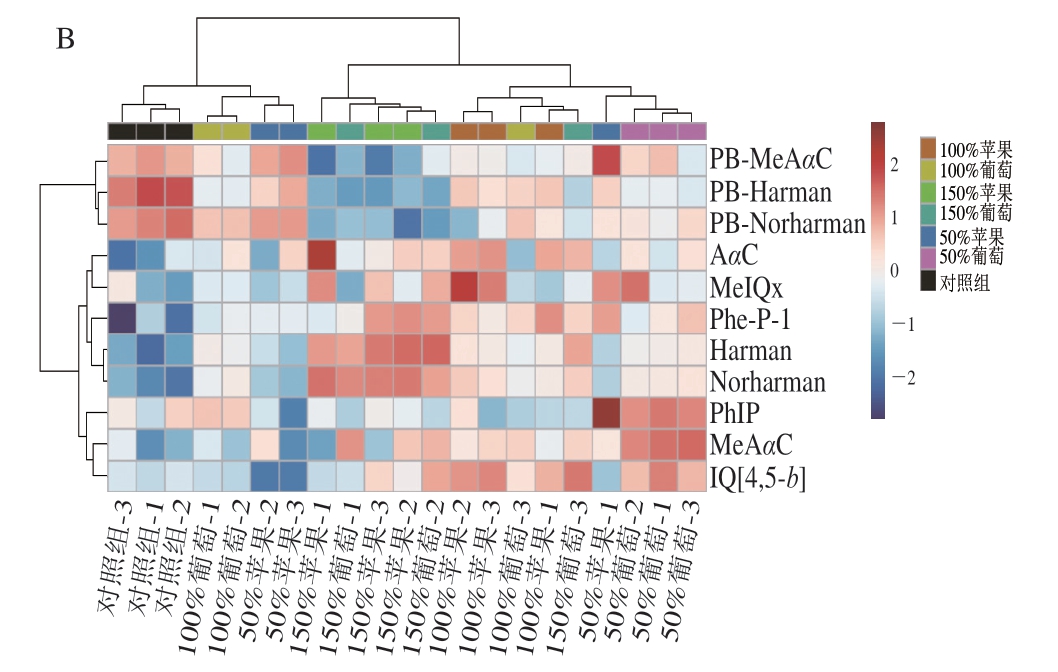
图2 各组消化液的PCA得分图(A)及聚类分析图(B)
Fig. 2 PCA score plot (A) and cluster heatmap (B) of digested products of roast beef patties with different amounts of added apple or grape puree
3 结 论
烤牛肉饼消化后存在8 种游离态HAAs和3 种蛋白结合态HAAs,水果的摄入会造成蛋白结合态HAAs的释放,并且有随着水果摄入量增加蛋白结合态HAAs释放增强的趋势。以往研究大多专注于肉制品熟制过程中游离态HAAs的生成抑制,忽视了食品中蛋白结合态HAAs在消化过程会因蛋白水解造成释放的事实,未来应加强外源添加物对蛋白结合态HAAs影响的监测和减控,以避免低估膳食暴露HAAs含量。
[1] JAMES S F, MARK G K. Occurrence, identification, and bacterial mutagenicity of heterocyclic amines in cooked food[J]. Mutation Research/Genetic Toxicology, 1991, 259(3): 205-217. DOI:10.1016/0165-1218(91)90118-6.
[2] ZHU J J, CHANG P, MELISSA L B, et al. Detection of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine-DNA adducts in normal breast tissues and risk of breast cancer[J]. Cancer Epidemiology, Biomarkers and Prevention, 2003, 12(9): 830-837.
[3] XIAO Shun, GUO Jingshu, BYEONG H Y, et al. Biomonitoring DNA adducts of cooked meat carcinogens in human prostate by nano liquid chromatography-high resolution tandem mass spectrometry: identification of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine DNA adduct[J]. Analytical Chemistry, 2016, 88(24): 12508-12515. DOI:10.1021/acs.analchem.6b04157.
[4] GWENDOLINE N, ERIN E B, DAN G, et al. DNA adduct formation of 4-aminobiphenyl and heterocyclic aromatic amines in human hepatocytes[J]. Chemical Research in Toxicology, 2011, 24(6): 913-925. DOI:10.1021/tx200091y.
[5] LI Peng, WU Guoyao. Composition of amino acids and related nitrogenous nutrients in feedstuffs for animal diets[J]. Amino Acids, 2020, 52(4): 523-542. DOI:10.1007/s00726-020-02833-4.
[6] CHIANG C F, LIAO P L, HSU K C, et al. Establishment of optimal QuEChERS conditions of various food matrices for rapid measurement of heterocyclic amines in various foods[J]. Food Chemistry, 2022, 380: 132184. DOI:10.1016/j.foodchem.2022.132184.
[7] 曾茂茂, 李洋, 何志勇, 等. 液相色谱-质谱联用法结合主成分分析考察食品中前体物质对杂环胺生成的影响[J]. 分析化学, 2014, 42(1): 71-76. DOI:10.3724/SP.J.1096.2014.30628.
[8] ZENG Maomao, WANG Junhui, ZHANG Mengru, et al. Inhibitory effects of Sichuan pepper (Zanthoxylum bungeanum) and sanshoamide extract on heterocyclic amine formation in grilled ground beef patties[J]. Food Chemistry, 2018, 239: 111-118. DOI:10.1016/j.foodchem.2017.06.097.
[9] 李雨竹, 汪永, 谢婷婷, 等. 生姜和辣椒及其活性组分对卤煮牛肉中杂环胺生成的影响[J]. 肉类研究, 2020, 34(6): 45-51. DOI:10.7506/rlyj1001-8123-20200427-106.
[10] 薛超轶, 梁玉燊, 吴家丽, 等. 氨基酸对烘烤牛肉饼中杂环胺的抑制作用[J]. 中国食品学报, 2021, 21(5): 203-211. DOI:10.16429/j.1009-7848.2021.05.024.
[11] LI Yong, HE Jialiang, QUAN Wei, et al. Effects of polyphosphates and sodium chloride on heterocyclic amines in roasted beef patties as revealed by UPLC-MS/MS[J]. Food Chemistry, 2020, 326: 127016. DOI:10.1016/j.foodchem.2020.127016.
[12] LI Yong, QUAN Wei, WANG Junhui, et al. Effects of ten vegetable oils on heterocyclic amine profiles in roasted beef patties using UPLC-MS/MS combined with principal component analysis[J]. Food Chemistry, 2021, 347: 128996. DOI:10.1016/j.foodchem.2020.128996.
[13] DAMLA G, MEVLUDE K. Comparison of the reducing effects of blueberry and propolis extracts on heterocyclic aromatic amines formation in pan fried beef[J]. Meat Science, 2022, 186: 108746. DOI:10.1016/j.meatsci.2022.108746.
[14] WANG Shoutao, ZHUO Wenling, DAN Yaqian, et al. Inhibitory effects of Chinese quince fruit proanthocyanidins with different polymerisation degrees on the formation of heterocyclic aromatic amines in chemical model systems[J]. International Journal of Food Science and Technology, 2022, 57(1): 330-341. DOI:10.1111/ijfs.15409.
[15] MAYOL I T, SOBRAL M M C, OLGA V, et al. Incorporation of avocado peel extract to reduce cooking-induced hazards in beef and soy burgers: a clean label ingredient[J]. Food Research International, 2021, 147: 110434. DOI:10.1016/j.foodres.2021.110434.
[16] SERAP K C, BÜLENT K. Effects of chlorophyll a and b in reducing genotoxicity of 2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline (MeIQx)[J]. Biology, 2022, 11(4): 602. DOI:10.3390/biology11040602.
[17] ANNA W, ANNA G W, JACEK P. Caffeine, pentoxifylline and theophylline form stacking complexes with IQ-type heterocyclic aromatic amines[J]. Bioorganic Chemistry, 2011, 39(1): 10-17. DOI:10.1016/j.bioorg.2010.11.001.
[18] BEAR W L, TEEL R W. Effects of citrus flavonoids on the mutagenicity of heterocyclic amines and on cytochrome P450 1A2 activity[J]. Anticancer Research, 2000, 20(5): 3609-3614.
[19] ARKADIUSZ S. Chemical state of heterocyclic aromatic amines in grilled beef: evaluation by in vitro digestion model and comparison of alkaline hydrolysis and organic solvent for extraction[J]. Food and Chemical Toxicology, 2013, 62: 653-660. DOI:10.1016/j.fct.2013.09.036.
[20] STEPHANIE A H, AARON A, BRIAN M C. Complex dietary protein improves growth through a complex mechanism of intestinal peptide absorption and protein digestion[J]. Journal of Parenteral and Enteral Nutrition, 2015, 39(1): 95-103. DOI:10.1177/0148607113501556.
[21] CHEN Jing, HE Zhiyong, QIN Fang, et al. Formation of free and protein-bound heterocyclic amines in roast beef patties assessed by UPLC-MS/MS[J]. Journal of Agricultural and Food Chemistry, 2017, 65(22): 4493-4499. DOI:10.1021/acs.jafc.7b01828.
[22] MINEKUS M, ALMINGER M, ALVITO P, et al. A standardised static in vitro digestion method suitable for food: an international consensus[J]. Food and Function, 2014, 5(6): 1113-1124. DOI:10.1039/c3fo60702j.
[23] YAN Yan, ZHANG Shuang, TAO Guanjun, et al. Acetonitrile extraction coupled with UHPLC-MS/MS for the accurate quantification of 17 heterocyclic aromatic amines in meat products[J]. Journal of Chromatography B, 2017, 1068/1069: 173-179. DOI:10.1016/j.jchromb.2017.10.015.
[24] XI Jun, CHEN Yang. Analysis of the relationship between heterocyclic amines and the oxidation and thermal decomposition of protein using the dry heated soy protein isolate system[J]. LWT-Food Science and Technology, 2021, 148: 111738. DOI:10.1016/j.lwt.2021.111738.
[25] XUE Chaoyi, CHEN Qiaochun, HE Zhiyong, et al. Release mechanism between sarcoplasmic protein-bound and free heterocyclic amines and the effects of dietary additives using an in vitro digestion model[J]. Food Chemistry, 2022, 377: 131993. DOI:10.1016/j.foodchem.2021.131993.
[26] XUE Chaoyi, CHEN Qiaochun, HE Zhiyong, et al. Release profiles of beef myofibril protein-bound heterocyclic amines and effects of dietary components on in vitro digestion[J]. Food Research International, 2022, 155: 111006. DOI:10.1016/j.foodres.2022.111006.
[27] CARINA L A, INGRID W L B, ISABELLE C D, et al. Biological activity of proteins from pulps of tropical fruits[J]. Food Chemistry, 2004, 85(1): 107-110. DOI:10.1016/j.foodchem.2003.06.010.
[28] GUO Anqi, XIONG Youling L.. Myoprotein-phytophenol interaction: Implications for muscle food structure-forming properties[J]. Comprehensive Reviews in Food Science and Food Safety, 2021, 20(3): 2801-2824. DOI:10.1111/1541-4337.12733.