生物胺是经由生物体内产生的、具有低分子质量的碱性含氮化合物的总称[1],也是游离氨基酸在微生物脱羧作用下生成的产物[2-3]。研究发现,生物胺普遍存在于蛋白质和氨基酸含量较高的食品中。生物胺中酪胺、组胺等与水产品中一些腐败的微生物有关,可作为水产品新鲜度的关键指标,也是重要的食品安全风险因子,可用于预测水产品的货架期[4]。人体和其他生物体内有微量的生物胺,与生理活动密切相关,是生物体所必需的,但过量生物胺会影响食品的风味和品质,甚至会对人体和其他生物体造成伤害[5]。近年来,由于食品中生物胺含量超标已致使发生多起食品安全事件[6-7]。据文献报道,组胺是生物胺中毒性最大的物质,可诱导细胞凋亡,产生急性过敏性毒害作用,当人体摄入量≥100 mg即会产生中毒、致休克,甚至危及生命[8-9];一些脂肪族生物胺易与亚硝酸盐结合产生致癌物亚硝胺,还会协同组胺增加其毒性[10]。多巴胺与疼痛引发的抑郁症密切相关,参与外周神经系统的表达,产生热痛、慢性疼痛等[11]。为此许多国家对生物胺,尤其是组胺的摄入量及限量标准都提出了严格要求。例如,欧盟、美国、澳大利亚等规定,组胺每人每餐摄入量≤50 mg/kg,水产品中组胺≤100 mg/kg[12];我国规定组胺≤40 mg/100 g(高组胺鱼类)和≤20 mg/100 g(其他鱼类)[13-14]。因此,建立一种方便、简单、准确的生物胺检测方法,防控由生物胺引起的食品安全事件,对保障食品安全具有重要意义。
1 生物胺的分类及来源
生物胺根据结构分为杂环胺、脂肪胺、芳香胺等,其中组胺、色胺、5-羟色胺等属杂环族,亚精胺、精胺、腐胺、尸胺等属脂肪胺,1-苯乙胺、β-苯乙胺、酪胺、苯甲胺等属芳香胺;根据其含有的氨基酸数量又可以分为单胺和多胺,其中酪胺、组胺、苯甲胺、1-苯乙胺、β-苯乙胺、色胺等属单胺,亚精胺、精胺、腐胺、尸胺属多胺;根据来源又分为内源性和外源性胺类,多巴胺、5-羟色胺等属内源性胺类,组胺、色胺、酪胺属外源性胺类[15]。水产制品(如咸鱼、腊鱼、腌鱼等)中常见的生物胺有精胺、亚精胺、腐胺、尸胺、β-苯乙胺、色胺、组胺、酪胺等,主要是由其自身含有的蛋白质、氨基酸及微生物等在内源酶和氨基酸脱酸酶等作用下产生[16-18];乳制品(如干酪等)中生物胺有组胺、酪胺、腐胺、尸胺、色胺等,主要是由于在生产发酵过程中,其自身含有的蛋白质降解以及在发酵微生物等的作用下产生[19-20]。据报道,原料乳含有较高含量的精胺和亚精胺[21];发酵型酒(如葡萄酒、啤酒)中生物胺有组胺、酪胺、腐胺、尸胺和苯乙胺等,主要是由葡萄酒等在酿造过程中通过酵母菌主导的酒精发酵和乳酸菌主导的苹果酸-乳酸发酵产生[22-23];发酵肉制品(如发酵香肠)中生物胺有组胺、色胺、精胺、亚精胺、酪胺、腐胺和尸胺等,主要是由于其自身含有的微量精胺、亚精胺以及在乳酸菌、肠杆菌、假单胞菌等微生物作用下产生[24-26];酱油及发酵豆制品(如腐乳、豆酱)中生物胺有腐胺、尸胺、精胺、亚精胺、β-苯乙胺、酪胺、组胺、色胺等,主要是黄豆自身含有的高蛋白在发酵过程中由微生物的作用而产生[27]。综上所述,不同类别的食品中生物胺种类可能类似,但生物胺含量和来源存在差别,可能是受到食品自身蛋白质含量、游离氨基酸含量、微生物种类和食品生产过程中的生产技术、环境条件不同等因素的影响。常见的14 种生物胺的相关信息及结构式见表1和图1[28-32]。
表1 14 种生物胺的相关信息
Table 1 Information on 14 biogenic amines
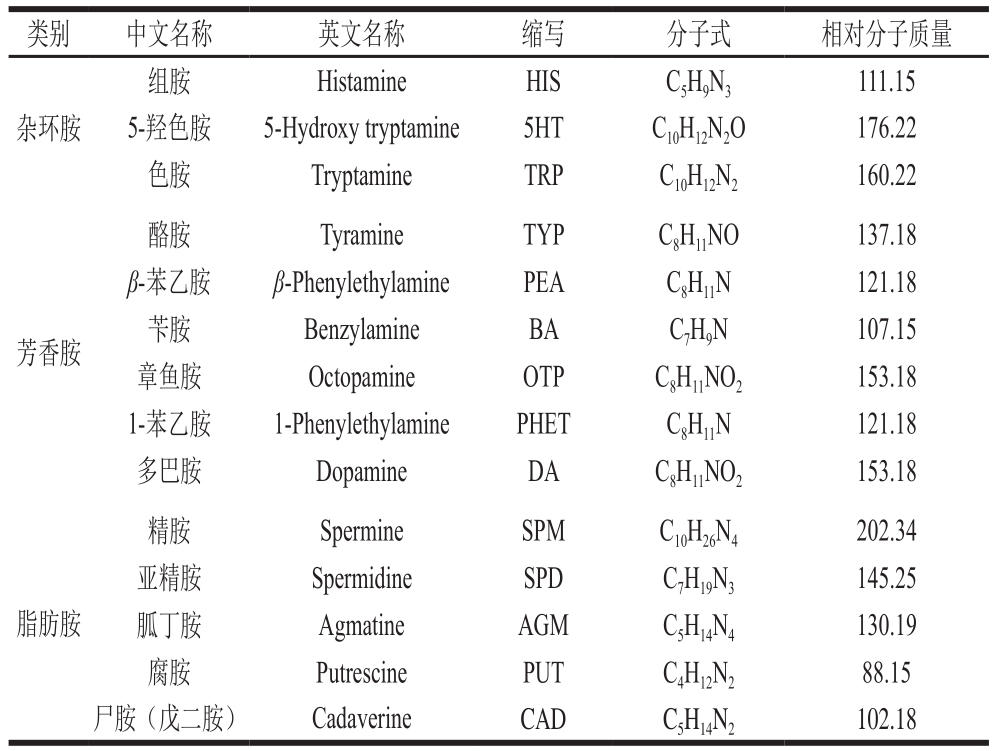
类别 中文名称 英文名称 缩写 分子式 相对分子质量杂环胺组胺 Histamine HIS C5H9N3 111.15 5-羟色胺 5-Hydroxy tryptamine 5HT C10H12N2O 176.22色胺 Tryptamine TRP C10H12N2 160.22芳香胺酪胺 Tyramine TYP C8H11NO 137.18 β-苯乙胺 β-Phenylethylamine PEA C8H11N 121.18苄胺 Benzylamine BA C7H9N 107.15章鱼胺 Octopamine OTP C8H11NO2 153.18 1-苯乙胺 1-Phenylethylamine PHET C8H11N 121.18多巴胺 Dopamine DA C8H11NO2 153.18脂肪胺精胺 Spermine SPM C10H26N4 202.34亚精胺 Spermidine SPD C7H19N3 145.25胍丁胺 Agmatine AGM C5H14N4 130.19腐胺 Putrescine PUT C4H12N2 88.15尸胺(戊二胺) Cadaverine CAD C5H14N2 102.18
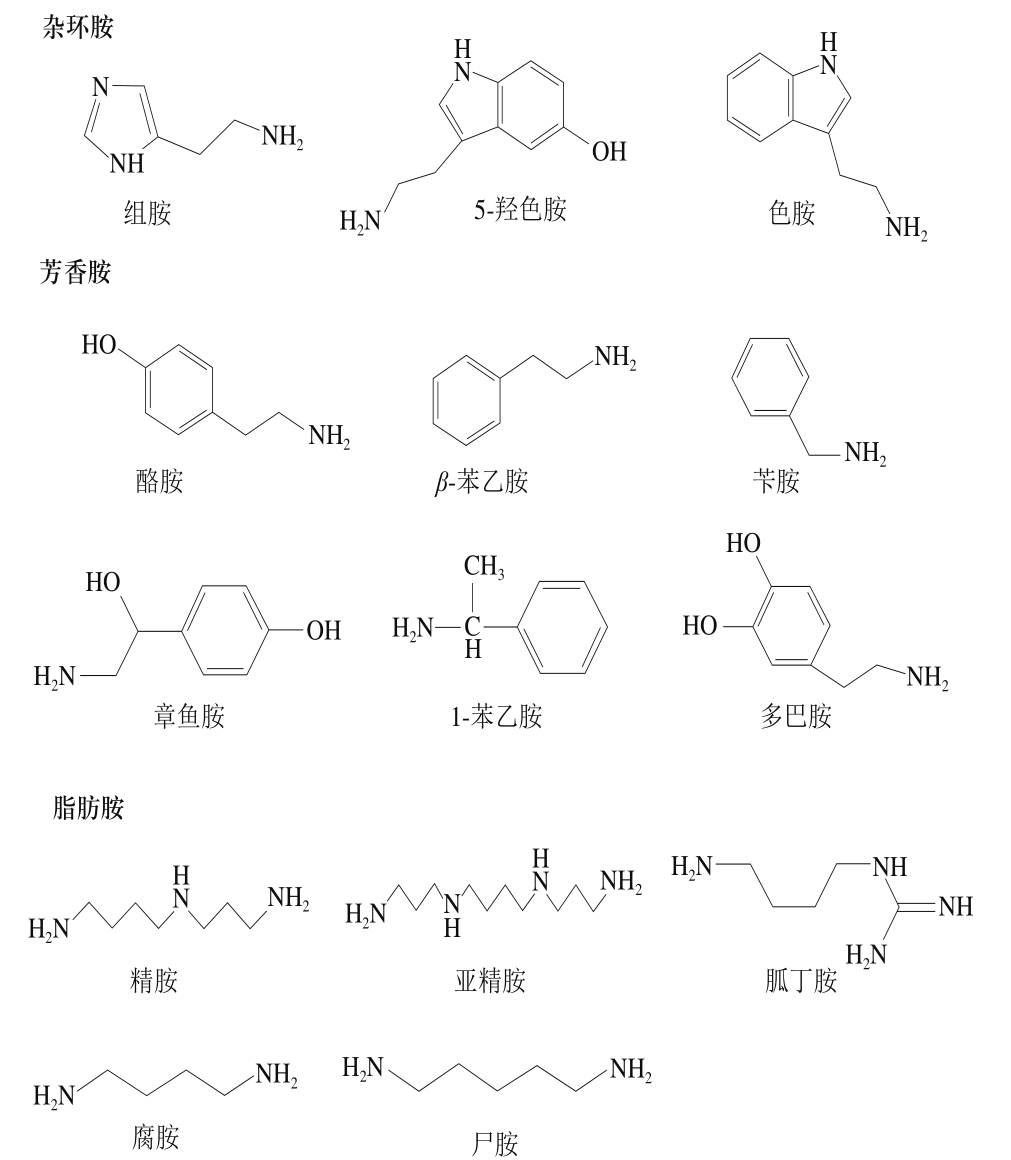
图1 14 种生物胺的结构式
Fig. 1 Structural formulae of 14 biological amines
2 样品前处理技术
前处理对于样品中生物胺的定量和定性分析至关重要,目前,生物胺测定的前处理过程一般是采用溶剂提取后,用液-液萃取或固相萃取(solid phase extraction,SPE)[33]进行富集净化,这2 种方法具有准确、专一选择性等优点,但也存在以下缺点:液-液萃取耗费提取溶剂较多,操作复杂,方法回收率低、耗时、杂质难去除等;SPE所使用的萃取柱成本高、步骤繁琐、耗时[34]。新型的中空纤维-液相微萃取、盐析萃取、分散液-液微萃取(dispersive liquid-liquid microextraction,DLLME)[35]等萃取方法具有高效、试剂消耗少等优点,但其准确性相对较低。由于食品中的生物胺通常以高含量存在于各种介质中,并且样品基质效应复杂,所以对样品进行前处理可以富集、浓缩被测组分,减少基质干扰,提高检测方法的准确性和灵敏度。这也使得探索更加简便、快捷的前处理技术以及处理过程应用新型材料成为了可能。表2列举了一些样品生物胺的前处理技术。
表2 不同样品中生物胺的前处理方法、检测方法、检出限和回收率
Table 2 Sample pretreatment methods and analytical methods along with detection limits and recoveries for biolamines in food and environmental samples
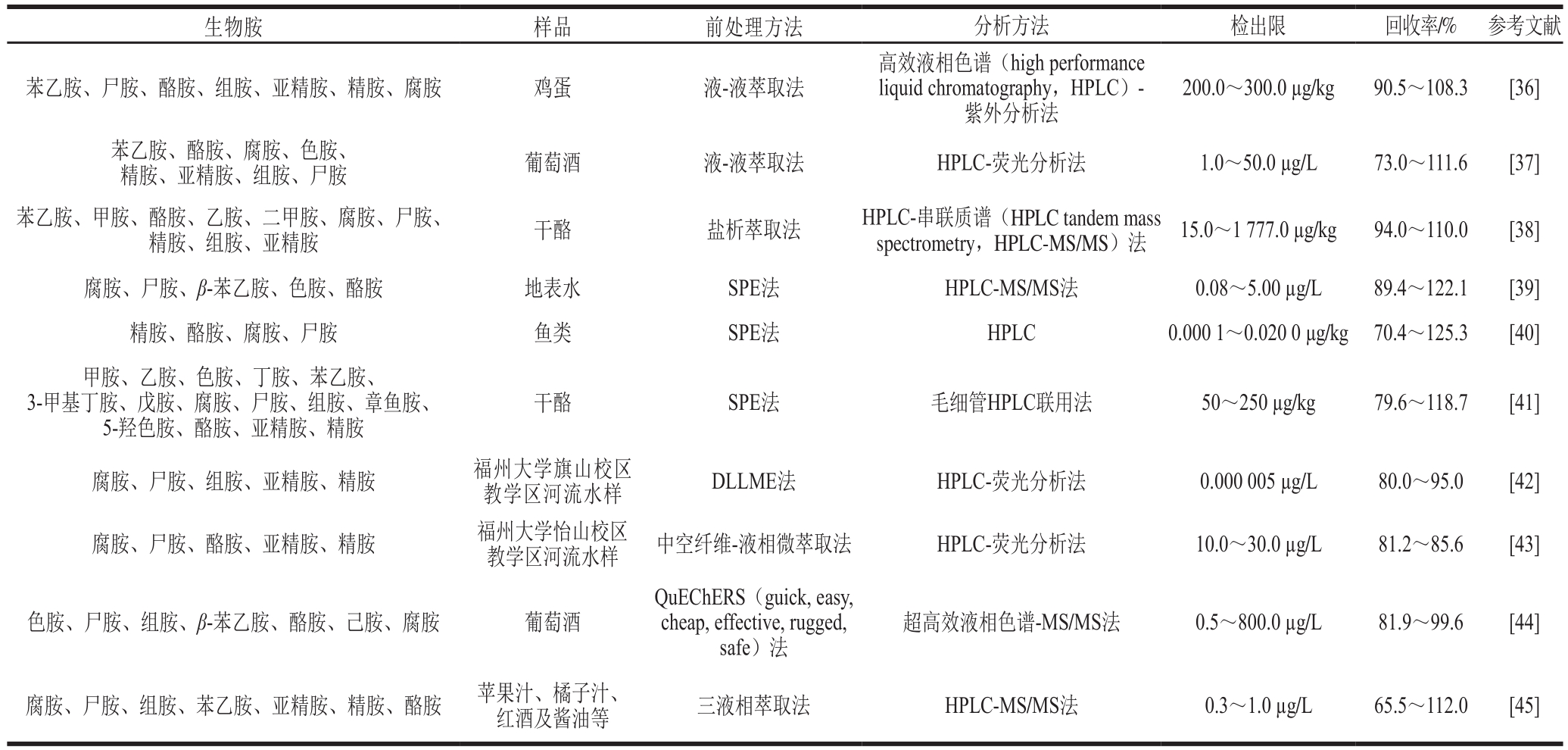
生物胺 样品 前处理方法 分析方法 检出限 回收率/% 参考文献苯乙胺、尸胺、酪胺、组胺、亚精胺、精胺、腐胺 鸡蛋 液-液萃取法高效液相色谱(high performance liquid chromatography,HPLC)-紫外分析法200.0~300.0 µg/kg 90.5~108.3 [36]苯乙胺、酪胺、腐胺、色胺、精胺、亚精胺、组胺、尸胺 葡萄酒 液-液萃取法 HPLC-荧光分析法 1.0~50.0 µg/L 73.0~111.6 [37]苯乙胺、甲胺、酪胺、乙胺、二甲胺、腐胺、尸胺、精胺、组胺、亚精胺 干酪 盐析萃取法 HPLC-串联质谱(HPLC tandem mass spectrometry,HPLC-MS/MS)法 15.0~1 777.0 µg/kg 94.0~110.0 [38]腐胺、尸胺、β-苯乙胺、色胺、酪胺 地表水 SPE法 HPLC-MS/MS法 0.08~5.00 µg/L 89.4~122.1 [39]精胺、酪胺、腐胺、尸胺 鱼类 SPE法 HPLC 0.000 1~0.020 0 µg/kg 70.4~125.3 [40]甲胺、乙胺、色胺、丁胺、苯乙胺、3-甲基丁胺、戊胺、腐胺、尸胺、组胺、章鱼胺、5-羟色胺、酪胺、亚精胺、精胺干酪 SPE法 毛细管HPLC联用法 50~250 µg/kg 79.6~118.7 [41]腐胺、尸胺、组胺、亚精胺、精胺 福州大学旗山校区教学区河流水样 DLLME法 HPLC-荧光分析法 0.000 005 µg/L 80.0~95.0 [42]腐胺、尸胺、酪胺、亚精胺、精胺 福州大学怡山校区教学区河流水样 中空纤维-液相微萃取法 HPLC-荧光分析法 10.0~30.0 µg/L 81.2~85.6 [43]色胺、尸胺、组胺、β-苯乙胺、酪胺、己胺、腐胺 葡萄酒QuEChERS(guick, easy,cheap, effective, rugged,safe)法超高效液相色谱-MS/MS法 0.5~800.0 µg/L 81.9~99.6 [44]腐胺、尸胺、组胺、苯乙胺、亚精胺、精胺、酪胺 苹果汁、橘子汁、红酒及酱油等 三液相萃取法 HPLC-MS/MS法 0.3~1.0 µg/L 65.5~112.0 [45]
2.1 液-液萃取法
液-液萃取法是一种常用的萃取方法,由于其对生物胺类物质的损害性小,从而得到广泛使用,但其主要缺点是需要大量的有毒溶剂,为使有机溶剂体积更小,常常采取盐辅助液-液萃取。Francisco等[46]采用1.0 mol/L HCl提取,并加入氯化钠辅助萃取金枪鱼罐头、沙丁鱼罐头、鸡肉肠、烧烤香肠、牛肉、肉类宠物食品等中的生物胺,结合HPLC-荧光分析法检测其中的精胺、亚精胺、酪胺、组胺和腐胺5 种生物胺,得到良好的线性,检出限和定量限分别为0.007 5~1.600 0、0.230 0~4.900 0 mg/L;应用该方法对贮存在-4、4、22 ℃条件下1 周的鱼和肉样本中生物胺含量进行检测,结果显示:贮存在-4、4 ℃样本中生物胺含量大多数变化不大,而贮存在22 ℃条件下的样本中生物胺含量增加较快,说明样本在低温条件下贮存可有效减缓生物胺的形成。该法的应用证明了盐析法可辅助液-液萃取法提取食品中的生物胺。
2.2 SPE法
SPE法在分析科学领域中被广泛应用,该方法具有处理简单、提取效率高等特点。Jia等[47]采用HLB SPE柱提取净化经丹磺酰氯衍生后的葡萄酒中的生物胺,采用HPLC-质谱法检测,该方法可有效去除葡萄酒中具有干扰性的杂质峰,提高方法灵敏度;使用该方法对18 种市售葡萄酒中的生物胺进行分析,结果显示:所有葡萄酒中均含有腐胺和酪胺,83%、78%和83%样品中分别检测到色胺、尸胺和亚精胺;44%和50%样品中分别检测到β-苯乙胺和组胺。如今SPE常代替液-液萃取,减少了大量有机试剂的使用,是测定肉制品中生物胺应用较为广泛的前处理方法。Chang Qingyun等[48]合成了一种功能化的共价有机框架(TpPa-NO2)材料,并将其作为SPE柱填料,用于从肉类样品中提取净化生物胺,提取步骤为首先使用5 g/100 mL三氯乙酸水溶液提取,其次采用丹磺酰氯衍生化处理,最后采用填有TpPa-NO2材料的SPE柱进行富集和净化;采用此法分别对带鱼、鲭鱼、猪肉、牛肉和鸡肉5 种不同基质中生物胺进行提取测定,结果显示,5 种不同基质肉类样品中检测到的生物胺含量为0.019 6~0.093 8 mg/kg,方法回收率为80.3%~115.0%,证明所制备的共价有机框架(TpPa-NO2)材料对生物胺的丹磺酰氯衍生物具有良好的提取能力。
2.3 固相微萃取(solid phase micro-extraction,SPME)法
SPME法是一种不需要提取溶剂,将采样、分离和浓缩结合为一步的方法,常常与气相色谱(gas chromatography,GC)或HPLC结合来实现在线样品前处理的技术。Basheer等[49]对比苯甲酮/2,4-二硝基苯肼、甲醛/2,4-二硝基苯肼、水杨醛/2,4-二硝基苯肼、3-羟基-4-硝基苯甲醛/2,4-二硝基苯肼、2-羟基-5-硝基苯甲醛/2,4-二硝基苯肼5 种物质作为配体原料,并结合HPLC仪测定橙汁中酪胺、组胺、苯乙胺、色胺和亚精胺,发现基于苯甲酮/2,4-二硝基苯肼合成的配体作为填料制作成μ-SPE微萃取柱,由于其含有π-π键,可显著增强其与生物胺的亲和作用,因此对生物胺的提取效果最好;比较μ-SPE与普通SPE萃取柱对生物胺的提取效果,二者方法回收率均≥71%,虽然与普通SPE萃取柱回收率无太大差别,且处理过程需要丹磺酰氯衍生,但是其减少了溶剂消耗和缩短了提取时间,因此具有较佳应用价值。Parchami等[50]使用SPME与离子迁移谱联用的方式,提取和测定罐头鱼中的组胺、酪胺等,方法回收率为91%~97%,该方法进一步提升了SPME技术,且在检测生物胺时无需任何衍生化步骤;采用GC-MS法验证该法的检测结果,结果显示,2 种方法的检测结果一致,相对误差为13%,说明该法适用于检测食品中的生物胺。
2.4 DLLME法
DLLME法是一种基于分散萃取的样品预处理新技术,该方法由Rezaee等[51]在2006年报道,在处理样品过程中使用的有机溶剂量仅为10 μL左右,用量极少,具有富集倍数高、操作简单、效率高等优势,因而受到研究者的关注。Bani等[52]建立了基于超声辅助的原位衍生DLLME法,该方法以[C4MIM][PF6]离子液作为萃取溶剂,萃取丹磺酰氯衍生物,消除了繁琐的衍生化过程,结合HPLC法检测芒果汁、马来西亚特色食品(Tempe、Budu)和沙丁鱼罐头中的色胺、组胺、酪胺、亚精胺和精胺,通过与其他文献报道的DLLME法比较,其方法回收率较好,为71%~119%,且方法前处理时间仅需20 min,[C4MIM][PF6]离子液萃取溶剂仅需100 μL,因此具有实际应用性。Wojciech等[53]建立DLLME与GC-MS/MS技术,对鸡肉、猪肉和牛肉中的尸胺、二甲胺、精胺、组胺、腐胺、色胺、β-苯乙胺等生物胺进行提取和测定,结果表明:方法回收率为79%~101%;由于样本冷藏时间不同,在不同包装材料中贮存的样本生物胺含量存在明显的差异;同时证实在贮藏过程中,禽肉生物胺的含量增加速率比猪肉和牛肉快,主要是因为禽肉中蛋白质多肽链较短,更利于产生氨基酸前体,并通过蛋白酶的水解作用产生生物胺;该方法适用于快速、准确测定鲜肉样品中生物胺。
2.5 QuEChERS法
QuEChERS法是在分散固相萃取的基础上建立起来的一种预处理技术,具有检测效率高、使用成本低等特点[54]。近年来QuEChERS被广泛应用于食品中农、兽药残留的快速检测,提高了检测效率[55-56]。由于生物胺极性强的特性,在多介质样品中存在极大的基质效应,所以QuEChERS法的萃取净化作用尤为重要。李丽萍等[57]改进了QuEChERS技术,将50 mg C18和50 mg PSA分散吸附剂混合作为填料,准确定性和定量了红酒中组胺、酪胺、色胺和苯乙胺,方法回收率为96.6%~103.1%;应用该方法对市售的20 个葡萄酒样品进行测定,结果显示,除了色胺未检出,其余3 种生物胺均有不同程度的检出,说明生物胺的积累与食品卫生和加工过程及污染的细菌活性相关。QuEChERS法在新鲜水产品和动物源性腌制食品中也得到了广泛应用,蒋林蓉等[58]采用QuEChERS法与HPLC-MS/MS技术,对73 类新鲜水产品和动物源性腌制食品中的6 种生物胺进行测定,结果表明,大部分样本中生物胺均有不同程度的检出,个别样品中6 种生物胺的总量高达248 mg/kg,可能是由于样本新鲜程度不同造成,该方法适用于新鲜水产品和动物源性腌制食品中生物胺的定量测定和定性分析。
3 生物胺检测技术研究进展
目前,国内外用于检测水产品中生物胺的方法很多,如HPLC法、HPLC-MS/MS法、GC法、薄层色谱(thin layer chromatography,TLC)法、毛细管电泳(capillary electrophoresis,CE)法、离子色谱(ion chromatography,IC)法及电化学生物传感器等。
3.1 HPLC法
HPLC法由于检测结果准确,重复性好,是常用的生物胺检测方法之一,广泛运用在环境及食品中农药残留、兽药残留、添加剂等方面的检测,该方法也是我国国标GB 5009.208—2016《食品安全国家标准 食品中生物胺的测定》推荐的生物胺检测方法。很多国家和地区将HPLC法用作检测食品中组胺的官方方法;欧盟要求从2005年起使用HPLC法分析渔业产品中的组胺,以达到监管目的。HPLC法需要复杂的前处理程序,特别是脂肪族类生物胺的紫外和荧光响应非常低,因此在使用液相色谱检测前需要对处理好的样品采用苯甲酰氯、丹磺酰氯、邻苯二甲醛等进行柱前衍生[31],过程较繁琐,前处理时间较长,且普通液相仪器测定一个样品中多种生物胺需要30~40 min。张瑀等[59]建立一种同时测定咸鱼中8 种生物胺的HPLC方法,该方法在GB 5009.208—2016方法基础上进行了一定的优化,使用5 g/100 mL三氯乙酸进行提取,加入饱和碳酸氢钠和氢氧化钠溶液调节试样提取液的pH值为11,并采用丹磺酰氯进行衍生后进行测定,所需时间为24 min,检出限(limit of detection,LOD)为0.03~0.10 mg/L、定量限(limit of quantitation,LOQ)为0.12~0.40 mg/L,测定青鱼、草鱼、大黄鱼和马鲛鱼4 类咸鱼中8 种生物胺,结果显示,在这4 类咸鱼中,8 种生物胺的含量差异较大,其中腐胺、尸胺和组胺的含量最高。陈玉峰等[60]使用HPLC荧光结合衍生化法,对三牙鱼、白立鱼、马友鱼、大黄鱼、海鲈鱼、银鲳鱼、马鲛鱼7 种腌干鱼制品中色胺、β-苯乙胺、腐胺等8 种生物胺进行测定,并比较三氯乙酸、HClO4和HCl的提取效果,结果显示,使用5 g/100 mL三氯乙酸提取效果最好,检测时间为30 min,最低LOD为0.03~0.10 μg/mL;通过对实际样品的检测结果显示,腌干鱼制品中广泛存在组胺和酪胺,且不同的腌干鱼制品,其生物胺含量差异较大,分析原因可能是由于在鱼加工制作过程中的环境因素和制作工艺造成的。因此,一些国家把组胺作为咸鱼或腌制鱼等产品质量控制的一项重要指标。
3.2 HPLC-MS/MS法
HPLC-MS/MS法相较其他方法灵敏度更高、检测时间更短且选择性更优,并且能对结构相似的生物胺进行更准确的定性定量,因此,使用HPLC-MS/MS法检测生物胺受到广大学者的关注。Shiono等[61]采用HPLC-MS/MS法对鱼及鱼肉制品中的组胺、尸胺、酪胺、β-苯乙胺进行测定,使用5 g/100 mL三氯乙酸进行提取,Py-Tag试剂衍生化15 min,分析时间为13.5 min,LOQ为0.2~40.0 ng/mL,使用该方法对3 个鱼肉和鱼肉罐头质控样品中组胺分别进行3 次测定,结果显示,该方法的测定结果均在参考值的拓展不确定度范围内,说明该方法适用于鱼及鱼肉制品中生物胺的检测;同样使用该方法对日本市场上购买的金枪鱼、沙丁鱼、鱼露、鱼干等中4 种生物胺进行检测,结果显示,35%样本检出组胺和酪胺,13%样本检出尸胺,10%样本检出β-苯乙胺,鱼的种类和生产工艺的差异导致鱼和鱼肉产品中生物胺的含量有所不同。许国旺等[62]发明了针对鱼中14 种生物胺进行靶向分析的HPLC-MS/MS检测方法,该方法使用5 mg/mL的5-磺基水杨酸溶液并加入氧化锆小球以珠打研磨方法进行提取,然后加入体积分数1%的苯甲酰氯乙腈溶液衍生10 min,分析时间为15 min;通过此方法对市售鲅鱼、黄花鱼、带鱼、鲳鱼等进行检测,发现所有样本中都存在精胺、亚精胺、尸胺和腐胺,鲅鱼、黄花鱼、鲳鱼含有少量组胺和酪胺,且组胺含量≤4.15 mg/kg,远低于国家规定的限量标准,说明市售鲅鱼、黄花鱼、带鱼、鲳鱼还未腐败。叶磊海等[63]使用酸化乙腈分2 次提取在20、35 ℃条件下分别放置1、9 d的南美白对虾、梭子蟹、大黄鱼、甲鱼等水产品中9 种生物胺,采用PriME HLB SPE柱净化并使用HPLC-MS/MS检测,该方法的LOD为5 μg/kg,LOQ为15 μg/kg,回收率为80.5%~109.5%;20 ℃放置9 d的样本中生物胺含量增加不大,而35 ℃放置的样本中组胺、尸胺、腐胺含量增加最多,达800~5 000 mg/kg,肉质腐败变质,说明贮藏温度与水产品中生物胺有直接关系,同样也说明组胺、尸胺、腐胺可以作为评判水产品新鲜程度的重要指标;此方法的优势在于其未采用衍生化处理,简化了提取净化步骤,大大节省了前处理时间。随着科学技术的发展,HPLC-MS/MS技术在检测水产品等食品中的生物胺方面会得到广泛和深入的应用研究。
3.3 GC法
GC法具有分析速度快、要求目标物能被气化的特点。Hwang等[64]采用GC法测定虾仁、冻鱼、新鲜鱼及鱼制品中组胺、腐胺和尸胺,使用含有氢氧化钠的碱性甲醇进行提取,以1,9-壬二醇作为内标进行内标法校正,方法的LOD为5 mg/g,新鲜的鱼、虾中未检出3 种生物胺,冷冻鱼及鱼制品中均检出,冷冻鱼的组胺含量比鱼制品中高出5~10 倍,说明冷冻鱼在市售过程中为了保持其货架期,放置时间较长,不够新鲜。Li Chenghui等[65]通过比较纳米TiO2、MnO2、ZnO和SiO2对挥发性脂肪族胺,如二甲胺、三甲胺、乙二胺、正丁胺、环己胺等的发射信号效果,发现纳米SiO2的增效作用最好,通过自制基于纳米SiO2涂层的介质阻挡放电-分子/自由基发射光谱法GC检测器,通过优化该方法的GC仪器参数,建立了鱼中5 种挥发性脂肪族胺的GC检测方法,LOD为1.8~4.4 μg;使用该方法对室温下连续放置45 h的鲤鱼中三甲胺进行监测,结果显示,三甲胺的含量与时间的延长呈正相关;该方法可为即时判别鱼类新鲜度提供一种新的检测方法。
3.4 GC-MS法
GC-MS法是在GC基础上联合MS的方法,因部分生物胺的热不稳定性,也使得GC和GC-MS的使用受到了限制。Chung等[66]使用0.5 mol/L HCl分2 次提取,并采用SPME结合GC-MS检测299 个鱼样本(共89 种类别)中的甲醛、二甲胺、三甲胺及其氧化物,结果显示,所有样本中(包括新鲜鱼类和冷冻鱼类)均检出三甲胺氧化物,含量为5~3 500 mg/kg;一半样本中检出二甲胺,含量为64~320 mg/kg;85%样本中检出三甲胺,有些样本的含量超过1 000 mg/kg;在6 类鱼中三甲胺的含量较高,同样也检出了高含量的甲醛,研究结果证明了三甲胺氧化物在鱼贮藏过程中通过内源酶的作用分解为二甲胺和甲醛。GC-MS法也成功应用于酒中生物胺的检测,张鹏玲等[67]自制了一种三维共价有机骨架(COF-DL229)与环氧树脂复合而成的纤维型SPME器,并结合GC-MS成功应用于葡萄酒中苯乙胺和酪胺的检测,LOD分别低至0.01、1 µg/L;使用该方法分析市售3 种葡萄酒中的苯乙胺和酪胺,结果显示,苯乙胺含量为51.72~75.56 µg/L,酪胺含量为41.58~124.55 µg/L,该法为生物胺的检测技术开辟了新的方向。
3.5 TLC法
TLC法是利用层析分离技术快速分离、鉴定和半定量分析样品中的微量物质,因此分析结果准确度较低。赖姝毓[68]将基于溶胶-凝胶法构筑的茚三酮@二氧化钛纳米直读复合显色材料与TIC法结合,开发出一种水产品中组胺的直读显色半定量快速检测方法,利用Image J软件分析结果与液相色谱法的结论证明了显色带的颜色深浅与组胺含量呈良好的正相关性,其显色结果可直接通过肉眼判别,肉眼识别LOD低至18.75 mg/kg,该方法不需要进行前处理即可实现水产品中组胺的半定量,是未来组胺快检技术发展的重点研究方向。Shalaby[69]使用TLC法定量检测食品中组胺、尸胺、腐胺、苯乙胺、酪胺、色胺、精胺及亚精胺,使用5 g/100 mL三氯乙酸提取食品样本中的生物胺,并用丹磺酰氯进行衍生化处理;在鱼、肉制品、干酪等食品中进行加标实验,发现该方法回收率较高,为85.2%~93.2%,方法LOQ低至5 ng,因此该方法适用于各类食品中生物胺的检测。
3.6 CE法
CE法是根据样品中各组分分布特性和流动性的不同进行分离,以高压电场为驱动力的检测方法,但分离重现性较差,检出限较高。Mantoanelli等[70]使用HCl进行提取,并采用丹磺酰氯作为衍生剂结合CE法检测新鲜干酪和牛乳饮品中尸胺、组胺、腐胺、色胺、酪胺5 种生物胺,标准曲线相关系数≥0.99,LOD为7~50 μg/L,结果表明,新鲜干酪和牛乳饮品中存在腐胺和尸胺,可能是样本在生产过程中受到了污染;该方法也可应用于鱼、肉基质中生物胺的检测。钱勇强[71]建立基于Ru(bpy)32+为电化学发光体系的CE-电化学发光检测方法,利用该方法对鱼露、鱿鱼丝、鲳鱼、海蛎等水产品及其制品中的色胺、腐胺、组胺、酪胺、苯乙胺和亚精胺等生物胺进行检测,以海蛎为例,研究各生物胺随贮藏时间延长的变化情况,结果表明,在0 ℃贮藏的海蛎,贮藏4 d内,其生物胺含量变化不大,超过4 d,生物胺含量随着贮藏时间的延长而增加;在4 ℃贮藏的海蛎,贮藏第2天开始其生物胺含量开始增加,贮藏4 d腐胺和亚精胺含量急速增长,说明生物胺可作为贝类新鲜度的一个指标。刘方震[72]采用直接和间接紫外结合CE法测定尸胺、腐胺、精胺及亚精胺等14 种生物胺,LOD为0.9~3.2 μmol/L;采用此法对运动员尿液中的生物胺与运动疲劳相关性进行研究,结果表明,运动员疲劳后尿液中的苯乙胺、去甲肾上腺素、肌肽含量与运动前比较有明显增加的趋势,其中肌肽含量增加显著,但尿液中尿酸会影响生物胺的定量,因此,还需对生物胺与运动疲劳的相关性进行更加深入的研究。
3.7 IC法
IC法是以离子交换原理进行分离、定性和定量。Drago等[73]建立一种IC-质谱联用方法,应用于鲜鱼和加工鱼制品中组胺、胍丁胺、酪胺、尸胺、腐胺、色胺、三甲胺、β-苯乙胺、精胺、亚精胺10 种生物胺的分析,该方法不需进行额外的衍生化操作,仅加入纯水超声5 min、旋涡25 min进行提取,前处理简便、快捷,但每个样品的分析时间较长,为50 min,通过该方法得到10 种生物胺的LOD为0.02~15.60 ng/g;使用该方法对来自7 个不同国家的腌鲣鱼、腌鲱鱼、卤鳀鱼、卤青鱼、卤凤尾鱼、卤鲣鱼、熏鲑鱼、丹麦发酵鲱鱼、意大利腌凤尾鱼、加拿大烟熏鲑鱼、挪威熏鲑鱼、挪威腌鲱鱼等各类传统加工鱼制品17 个样本中生物胺进行检测,结果显示,所有样本中均含有较高含量的组胺、腐胺、尸胺、酪胺和胍丁胺,其中部分样本中组胺的含量超过欧盟等国家规定的传统鱼类产品的限量标准(≤100 mg/kg);传统加工鱼制品中影响生物胺形成的因素差异很大,通过发酵或酶促法制成的鱼,均含有较高含量的游离氨基酸,它们是形成生物胺的前体物质,这些产物中的游离氨基酸含量又取决于内源酶的活性,而内源酶又受样本酸度的增加、脱水和氯化钠的影响,其活性不同,使得蛋白质变性并分解为氨基酸的量不同,从而影响生物胺的产生,导致其含量的差异。孙永等[74]比较0.5 mol/L甲基磺酸、0.5 mol/L高氯酸及10 g/100 mL三氯乙酸溶液对水产品中三甲胺、尸胺、腐胺、组胺、亚精胺的提取效果,采用IC法检测,结果表明,0.5 mol/L甲基磺酸溶液提取效果最好,回收率达85.2%~106.9%;以在室温下放置2 d轻度腐败的秋刀鱼为例,使用0.5 mol/L甲基磺酸溶液提取秋刀鱼中5 种生物胺,无明显基质干扰,5 种生物胺峰形和分离度均较好,说明该方法适用于快速测定水产品中常见的生物胺。赵好等[75]同样采用甲基磺酸溶液提取食品中的精胺、亚精胺、腐胺、尸胺和组胺,以IC法测定,通过在金枪鱼、鲅鱼、蒜肠、广式香肠和小龙虾中加入生物胺标准物质以检测不同基质中的提取效果,回收率为81.9%~130.0%,提取效果均较好;以小龙虾为例,在常温下放置2 d,测得腐胺和尸胺含量明显增加,说明本方法切实可行。
3.8 电化学生物传感器法
电化学生物传感器是由生物材料的敏感元件与计算机联合应用的一种检测技术,是目前分析研究中最活跃的领域之一。林汉华[76]发明了一种含有双金属[FeⅡ(bpy)(CN)4]2-[FeⅢ(H2O)6Cl]复合物的用于检测鱼类和肉类中生物胺的化学传感水凝胶,该复合物的双金属铁(Ⅱ)-铁(Ⅲ)间以氰基桥连接,当将含有一定含量组胺、腐胺、亚精胺或酪胺的样本置于存有水凝胶的密封容器中时,氰基-桥处会发生特异性断裂,基于生物胺对紫外-可见分光光度响应的敏感度,水凝胶将由第1颜色深绿色变为第2颜色橙色/红色,该方法视觉颜色对比度高,裸眼易辨别,且颜色深浅与生物胺含量成正比,可通过化学传感水凝胶的颜色来确定食品中存在的生物胺水平是否超过限值,例如:水凝胶颜色为红色/橙色,表明食品中生物胺超过预设的标准限量值;同时,由于食物样品与化学传感溶液没有直接接触,避免了食品被破坏或被化学品污染;另外,由于此方法可通过肉眼直接判别食品的新鲜度,因此适用于现场食物质量和安全无损、快速检测。李捷等[77]发明了一种内置有机场效应晶体管的生物胺气敏传感器,该晶体管在生物胺敏感层和有机半导体层形成导电沟道,当样本中有生物胺时,生物胺将与生物胺敏感层、有机半导体层产生化学反应,进而改变导电沟道的电阻,生物胺气敏传感器通过感知电阻的变化即可感测生物胺,电阻大小与生物胺含量成正比,此方法可有效提高检测的敏感度。电化学生物传感器作为一种新型的生物胺检测方法,其应用价值较高,尤其在生物胺的快速检测技术方面具有广阔的发展前景。
综上所述,水产品中生物胺的检测技术越来越注重高效、快速、灵敏,很多学者将现有的液相色谱、GC、IC等常规检测手段的前处理方法进行优化改进,同时开发或合成新型材料,用于提取净化样本中的生物胺,并结合高通量、高灵敏度、微型化、便携化的检测仪器和手段,使得检测结果更加准确、直观。因此,微小便携、可快速检测生物胺的仪器和技术值得深入探究。
4 结 语
生物胺对人体健康影响较大,建立方便、简单、准确的分析方法测定食品中的生物胺具有重要意义。因此,未来的工作将以继续开发新的检测技术为主要目的,并结合更高效的在线富集方法,以此来提高分析检测的灵敏度。主要体现在以下几方面:上述前处理方法应用已非常广泛,但是随着先进技术和新型材料的发展,需要结合新的前处理技术,以消耗更少的试剂来实现高效、快速萃取分离目标分析物,开发或合成一些吸附性能高、选择性高的填料作固体吸附剂,来萃取分离目标分析物;生物胺存在于各种类型的食品中,基质复杂,为确保检测结果的准确性和精确性,有效分析生物胺带来的风险,应朝着环保、高效及技术联用方向发展;现代的样品前处理发展方向以微型化、自动化、便携化以及高灵敏度和高准确性为主,所以需要更加关注设备的微小便携与远程实时在线监测技术联合应用的开发和利用。
[1]倪秀梅, 方芳. 融合表达过氧化氢酶提高多铜氧化酶稳定性及降解生物胺能力[J]. 生物工程学报, 2021, 37(12): 4382-4394.DOI:10.13345/j.cjb.200799.
[2]陶志华, 刘伟锜, 乔娜, 等. 广东梅香鱼生物胺含量分析研究[J]. 中国调味品, 2021, 46(8): 137-139. DOI:10.3969/j.issn.1000-9973.2021.08.030.
[3]郑越男, 曹进, 孙珊珊, 等. 液相色谱-串联质谱法测定三文鱼中生物胺的不确定度分析[J]. 安徽农业科学, 2021, 49(17): 189-194.DOI:10.3969/j.issn.0517-6611.2021.17.050.
[4]杨姗姗, 王晓雯, 林翠苹. 水产品中生物胺的研究进展[J]. 青岛农业大学学报(自然科学版), 2021, 38(1): 65-73. DOI:10.3969/j.issn.1674-148X. 2021-01-011.
[5]张成强. 贮藏过程中太平洋褶柔鱼生物胺及挥发性成分的变化规律[D]. 上海: 上海海洋大学, 2020: 2.
[6]张峰, 胡艳敏, 顾敏霞. 一起食用鲐鱼引起组胺中毒的调查[J].上海预防医学, 2017, 27(10): 639-640. DOI:10.19428/j.cnki.sjpm.2015.10.017.
[7]刘士俊. 一起变质鲣鱼引起的组胺食物中毒事件调查[J].职业与健康, 2021, 37(11): 1556-1559. DOI:10.13329/j.cnki.zyyjk.2021.0377.
[8]RIO B D, REDRUELLO B, LINARES D M, et al. The biogenic amines putrescine and cadaverine show in vitro cytotoxicity at concentrations that can be found in foods[J]. Scientific Reports, 2019,9(1): 120-127. DOI:10.1038/s41598-018-36239-w.
[9]孙项丽, 郭莹莹, 于秀娟, 等. 鲭鱼品质评价及品质变化与组胺含量研究进展[J]. 食品安全质量检测学报, 2019, 10(12): 3708-3713.DOI:10.3969/j.issn.2095-0381.2019.12.012.
[10]BULUSHI I A, POOLE S, DEETH H C, et al. Biogenic amines in fish: roles in intoxication, spoilage, and nitrosamine formation: a review[J]. Critical Reviews in Food Science and Nutrition, 2009, 49(4): 369-377. DOI:10.1080/10408390802067514.
[11]俞婷, 刘逸凡, 杜茜琳, 等. 生物胺与疼痛的关系研究进展[J].生物化工, 2021, 7(5): 150-151; 154. DOI:10.3969/j.issn.2096-0387.2021.05.039.
[12]曾立威, 蔡翔宇, 吴玉杰, 等. 超高效液相色谱法同时快速测定多种动物源食品中9 种生物胺的含量[J]. 食品安全质量检测学报, 2017, 3(8): 968-974. DOI:10.19812/j.cnki.jfsq11-5956/ts.2017.03.045.
[13]中华人民共和国国家卫生和计划生育委员会, 食品安全国家标准 鲜、冻动物性水产品: GB 2733—2015[S]. 北京: 中国标准出版社, 2015: 1-4.
[14]国家水产品质量监督检验中心. 无公害食品 水产品中有毒有害物质限量: NY 5073—2006[S]. 北京: 中国标准出版社, 2006: 1-4.
[15]戴莹, 宋海勇, 吴曦, 等. 肉制品中生物胺的形成、检测和控制研究进展[J]. 肉类研究, 2020, 34(11): 89-97. DOI:10.7506/rlyj1001-8123-20201005-236.
[16]邓建朝, 李少丽, 杨贤庆, 等. 金枪鱼中生物胺的防控技术与检测技术的研究发展[J]. 食品与发酵工业, 2019, 45(24): 262-268.DOI:10.13995/j.cnki.11-1802/ts.021623.
[17]闵娟. 马鲛鱼的生物胺控制与保鲜方法研究[D]. 厦门: 集美大学,2018: 1.
[18]白妞妞, 白锴凯, 何建林, 等. 鱼露生物胺研究进展[J]. 食品与发酵工业, 2020, 46(24): 271-277. DOI:10.13995/j.cnki.11-1802/ts.024673.
[19]杨姗姗. 食品中生物胺液相色谱检测方法的建立及应用[D]. 天津:天津科技大学, 2016: 1.
[20]刘景, 刘振民. 成熟过程对红曲霉干酪中生物胺的影响及其安全性评估[J]. 乳业科学与技术, 2021, 44(2): 1-4. DOI:10.15922/j.cnki.jdst.2021.02.001.
[21]张凤宽, 易小艳, 尤丽新, 等. 发酵牛肉香肠生产工艺优化[J]. 食品科学, 2011, 32(16): 182-186.
[22]杨静. 葡萄酒中生物胺分析方法研究进展[J]. 食品科学, 2018, 39(7):262-263. DOI:10.3969/j.issn.1007-5739.2018.07.163.
[23]李志军, 李晓瑜, 元晓梅. 国产葡萄酒中生物胺组成与含量分析[J]. 食品科学技术学报, 2016, 34(2): 46-50. DOI:10.3969/j.issn.2095-6002.2016.02.007.
[24]张春江, 杨君娜, 王芳芳, 等. 肉制品中生物胺产生与控制研究进展[J]. 中国食物与营养, 2010(7): 17-20. DOI:10.3969/j.issn.1006-9577.2010.07.005.
[25]王丹, 孙学颖, 刘建林, 等. 发酵肉制品中微生物对生物胺形成机理的影响研究[J]. 食品研究与开发, 2021, 42(8): 218-224.DOI:10.12161/j.issn.1005-6521.2021.08.036.
[26]杨春婷, 赵晓娟, 白卫东. 肉类中的生物胺形成及其在肉类新鲜度评价中的应用研究进展[J]. 肉类研究, 2017, 31(1): 55-59.DOI:10.7506/rlyj1001-8123-201701010.
[27]周朝晖. QuEChERS-UPLC-MS/MS法测定酱油中8 种生物胺[J]. 现代食品科技, 2016, 32(7): 255-260. DOI:10.13982/j.mfst.1673-9078.2016.7.039.
[28]孙文闪, 周婷婷, 诸骏杰, 等. 固相萃取净化超高液相色谱-串联质谱测定鱼粉中的组胺[J]. 粮食与饲料工业, 2020(3): 65-69.DOI:10.7633/j.issn.1003-6202.2020.03.017.
[29]侯伟, 王燕燕, 张瑛, 等. QuEChERS结合UPLC-MS/MS检测血液中3 种色胺类新精神活性物质[J]. 法医学杂志, 2021, 37(4): 516-523.DOI:10.12116/j.issn.1004-5619.2021.310205.
[30]王芳, 罗敏, 陶文波, 等. 固相萃取-气相色谱法测定腌肉中5 种生物胺[J]. 理化检验-化学分册, 2018, 54(5): 512-515. DOI:10.11973/lhjyhx201805004.
[31]杨静, 刘宗科, 邹鹏, 等. 高效液相色谱法检测食品中生物胺的不同离线衍生策略的比较分析[J]. 食品安全质量检测学报, 2021, 12(23):9035-9042. DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.23.009.
[32]戴意飞. 海产品中生物胺高通量检测体系的建立与应用[D].舟山: 浙江海洋学院, 2014: 2-7.
[33]KOSSAKOWSKA N, OLĘDZKA I, KOWALIK A, et al. Application of SPME supported by ionic liquids for the determination of biogenic amines by MEKC in clinical practice[J]. Journal of Pharmaceutical and Biomedical Analysis, 2019, 173: 24-30. DOI:10.1016/j.jpba.2019.05.021.
[34]杨华梅, 杭莉, 杨建国, 等. 丹磺酰氯柱前衍生-超高效液相色谱-串联质谱法测定人体尿样中的环己胺[J]. 分析化学, 2016(3):462-467; 488. DOI:10.11895/j.issn.0253-3820.150764.
[35]ALMEIDA C, FERNANDES J O, CUNHA S C. A novel dispersive liquid-liquid microextraction (DLLME) gas chromatography-mass spectrometry (GC-MS) method for the determination of eighteen biogenic amines in beer[J]. Food Control, 2012, 25(1): 380-388.DOI:10.1016/j.foodcont.2011.10.052.
[36]FIGUEIREDO T D, ASSIS D D, MENEZES L, et al. HPLCUV method validation for the identification and quantification of bioactive amines in commercial eggs[J]. Talanta, 2015, 142: 240-245.DOI:10.1016/j.talanta.2015.04.056.
[37]LIU Yang, HAN Fuliang, LIU Yangjie, et al. Determination of biogenic amines in wine using modified liquid-liquid extraction with high performance liquid chromatography-fluorescence detector[J].Food Analytical Methods, 2020, 13(4): 911-922. DOI:10.1007/s12161-020-01710-w.
[38]RUI M R, BRANDO P F, RODRIGUES J A. Development of a SALLE-HPLC-FLD analytical method for the simultaneous determination of ten biogenic amines in cheese[J]. Food Analytical Methods, 2020, 13(5): 1-11. DOI:10.1007/s12161-020-01730-6.
[39]林波, 赵书媛, 王雪. 高效液相色谱串联质谱检测地表水中五种生物胺[J]. 环境与发展, 2020, 32(8): 118-119. DOI:10.16647/j.cnki.cn15-1369/X.2020.08.068.
[40]刘影桃. 磁性纳米材料的修饰和表征及其在固相萃取鱼中生物胺的应用[D]. 广州: 广东药科大学, 2021: 76.
[41]杨姗姗, 杨亚楠, 李雪霖, 等. 在线固相萃取-毛细管高效液相色谱联用测定奶酪中的生物胺[J]. 分析化学, 2016(3): 396-402.DOI:10.11895/j.issn.0253-3820.150811.
[42]倪沁颜, 刘薇, 王梓. 荧光检测-高效液相色谱法测定水质中生物胺[J]. 福建分析测试, 2018, 27(1): 35-38. DOI:10.3969/j.issn.1009-8143.2018.01.07.
[43]刘薇, 倪沁颜, 李浩宽, 等. 高效液相色谱-荧光法检测水质中生物胺的方法研究[J]. 福建分析测试, 2020, 29(1): 1-6. DOI:10.3969/j.issn.1009-8143.2020.01.01.
[44]郝兰兰. 河西走廊产区葡萄酒中氨基甲酸乙酯和生物胺的检测分析[D]. 兰州: 甘肃农业大学, 2019: 26.
[45]阿孜古丽·衣该木. 膜辅助三液相萃取方法的建立及在生物胺等样品HPLC分析中的应用[D]. 乌鲁木齐: 新疆大学, 2019: 39.
[46]FRANCISCO K C A, BRANDO P F, RAMOS R M, et al. Saltingout assisted liquid-liquid extraction with dansyl chloride for the determination of biogenic amines in food[J]. International Journal of Food Science and Technology, 2020, 55(1): 248-258. DOI:10.1111/ijfs.14300.
[47]JIA S, KANG Y P, PARK J H, et al. Determination of biogenic amines in Bokbunja (Rubus coreanus Miq.) wines using a novel ultraperformance liquid chromatography coupled with quadrupole-time of flight mass spectrometry[J]. Food Chemistry, 2012, 132(3): 1185-1190.DOI:10.1016/j.foodchem. 2011.11.069.
[48]CHANG Qingyun, ZANG Xiaohuai, WU Tong, et al. Use of functionalized covalent organic framework as sorbent for the solid-phase extraction of biogenic amines from meat samples followed by highperformance liquid chromatography[J]. Food Analytical Methods, 2019,12(1): 1-11. DOI:10.1007/s12161-018-1324-9.
[49]BASHEER C, WONG W, MAKAHLE A, et al. Hydrazone-based ligands for micro-solid phase extraction-high performance liquid chromatographic determination of biogenic amines in orange juice[J].Journal of Chromatography A, 2011, 1218(28): 4332-4339. DOI:10.1016/j.chroma.2011.04.073.
[50]PARCHAMI R, KAMALABADI M, ALIZADEH N. Determination of biogenic amines in canned fish samples using head-space solid phase microextraction based on nanostructured polypyrrole fiber coupled to modified ionization region ion mobility spectrometry[J].Journal of Chromatography A, 2017, 1481: 37-43. DOI:10.1016/j.chroma.2016.12.046.
[51]REZAEE M, ASSADI Y, HOSSEINI M, et al. Determination of organic compounds in water using dispersive liquid-liquid microextraction[J]. Journal of Chromatography A, 2006,1116(1/2): 1-9. DOI:10.1016/j.chroma.2006.03.007.
[52]BANI S M, SAAID M, SAAD B. An in situ dansylation ultrasoundassisted dispersive liquid-liquid microextraction based on ionic liquid for determination of biogenic amines in foods[J]. Food Analytical Methods, 2020, 13(2): 568-577. DOI:10.1007/s12161-019-01656-8.
[53]WOJCIECH W, JACEK N, POTKA-WASYLKA J. Dispersive liquidliquid microextraction combined with gas chromatography-mass spectrometry for in situ determination of biogenic amines in meat:estimation of meat’s freshness[J]. Microchemical Journal, 2019, 145:130-138. DOI:10.1016/j.microc.2018.10.034.
[54]ANASTASSIADES M, LEHOTAY S J, ŠTAJNBAHER D,et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residues in produce[J]. Journal of AOAC International, 2003, 86(2): 412-431. DOI:10.1093/jaoac/86.2.412.
[55]吴远高, 房芳, 韩慧, 等. QuEChERS-液相色谱-串联质谱法测定葵花籽中30 种农药残留[J]. 食品安全质量检测学报, 2021, 12(3): 1032-1039. DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.03.040.
[56]刘进玺, 王铁良, 胡京枝, 等. QuEChERS结合HPLC-MS/MS同时测定鱼肉中多种兽药残留[J]. 食品与发酵工业, 2021, 47(19): 252-257.DOI:10.13995/j.cnki.11-1802/ts.026319.
[57]李丽萍, 范赛, 张楠, 等. QuEChERS-超高效液相色谱-串联质谱法测定红酒中4 种生物胺含量[J]. 食品安全质量检测学报, 2021, 12(12):4883-4888. DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.12.026.
[58]蒋林蓉, 徐志伟, 黄杰英, 等. 基于QuEChERS净化的液相色谱-串联质谱法分析食品中的6 种生物胺[J]. 中国调味品, 2017, 42(8): 127-132.DOI:10.3969/j.issn.1000-9973.2017.08.028.
[59]张瑀, 王玥. 高效液相色谱法同时测定咸鱼中8 种生物胺[J].中国食品添加剂, 2021, 32(4): 107-111. DOI:10.19804/j.issn1006-2513.2021.04.018.
[60]陈玉峰, 吴燕燕, 李来好, 等. 腌干鱼制品中8 种生物胺测定方法的优化[J]. 中国渔业质量与标准, 2014, 4(4): 41-48.
[61]SHIONO K J, TSUTSUMI T, NABESHI H, et al. Simple and rapid determination of biogenic amines in fish and fish products by liquid chromatography-tandem mass spectrometry using 2,4,6-triethyl-3,5-dimethyl pyrylium trifluoromethane sulfonate as a derivatization reagent[J]. Journal of Chromatography A, 2021, 1643: 462046-462054.DOI:10.1016/j.chroma.2021.462046.
[62]许国旺, 傅燕青, 赵春霞, 等. 一种针对鱼中生物胺的快速分析方法:CN107782834A[P]. 2020-02-21.
[63]叶磊海, 裘均陶, 钟世欢, 等. 基于PriME净化的高效液相色谱-串联质谱法检测水产品中9 种生物胺[J]. 食品工业科技, 2019, 40(9):253-257; 263. DOI:10.13386/j.issn1002-0306.2019.09.044.
[64]HWANG B S, WANG J T, CHOONG Y M. A rapid gas chromatographic method for the determination of histamine in fish and fish products[J]. Food Chemistry, 2003, 82(2): 329-334. DOI:10.1016/S0308-8146(03)00005-0.
[65]LI Chenghui, JIANG Xue, HOU Xiandeng. Dielectric barrier discharge molecular emission spectrometer as gas chromatographic detector for amines[J]. Microchemical Journal, 2015, 119: 108-113. DOI:10.1016/j.microc.2014.11.005.
[66]CHUNG S W C, CHAN B T P. Trimethylamine oxide, dimethylamine,trimethylamine and formaldehyde levels in main traded fish species in Hongkong[J]. Food Additives and Contaminants Part B: Surveillance,2009, 2(1): 44-51. DOI:10.1080/02652030902858921.
[67]张鹏玲, 李忠月. 基于3D-COF的SPME纤维的制备并应用于苯乙胺和酪胺的检测[J]. 广东化工, 2022, 49(6): 185-187. DOI:10.3969/j.issn.1007-1865.2022.06.060.
[68]赖姝毓. 基于纳米复合材料TLC直读显色检测水产品中的组胺与孔雀石绿[D]. 杭州: 浙江农林大学, 2019: 9.
[69]SHALABY A R. Simple, rapid and valid thin layer chromatographic method for determining biogenic amines in foods[J]. Food Chemistry,1999, 65(1): 117-121. DOI:10.1016/S0308-8146(98)00113-7.
[70]MANTOANELLI J, GONALVES L M, PEREIRA E A. Dansyl chloride as a derivatizing agent for the analysis of biogenic amines by CZE-UV[J]. Chromatographia, 2020, 83(6): 767-778. DOI:10.1007/s10337-020-03896-x.
[71]钱勇强. 毛细管电泳-电化学发光联用检测水产品中的生物胺[D].厦门: 集美大学, 2013: 31-57.
[72]刘方震. 毛细管电泳技术对十多种重要生物胺的分析方法开发[D].济南: 东华大学, 2015: 20-57.
[73]DRAGO K, SEVIM K, BEKIR T, et al. Determination of biogenic amines in fresh fish and processed fish products using IC-MS/MS[J].Foods, 2021, 10(8): 1746-1759. DOI:10.3390/FOODS10081746.
[74]孙永, 刘楠, 李智慧, 等. 抑制性电导检测-离子色谱法快速测定水产品中的生物胺[J]. 食品安全质量检测学报, 2015(10): 3992-3997.DOI:10.19812/j.cnki.jfsq11-5956/ts.2015.10.038.
[75]赵好, 查河霞, 赵士权. 离子色谱法快速测定动物源食品中5 种生物胺[J]. 理化检验(化学分册), 2017, 53(11): 1345-1347.DOI:10.11973/lhjy-hx201711024.
[76]林汉华. 用于生物胺检测的化学传感水凝胶: CN 107037044B[P].2021-12-14.
[77]李捷, 许东来, 曾武, 等. 有机场效应晶体管及其制备方法以及生物胺气敏传感器: CN 109946349 A[P]. 2019-06-28.