磷脂酶A2(phospholipase A2,PLA2)是最早被人类鉴定和研究的生物酶之一[1],研究发现,PLA2能特异性催化磷脂底物sn-2位置酯键,释放出游离脂肪酸和溶血磷脂,通过多种方式作用,如花生四烯酸进一步转化为脂质信号介质,再经过多种不同下游酶的作用转化为类二十碳烯酸。这些类二十碳烯酸分子可以发挥广泛的生理和病理作用[2]。PLA2存在于几乎所有类型的生物体中,在哺乳动物中,它们在大多数的细胞和组织中都普遍表达,在哺乳动物的生命过程中起着非常重要的作用,影响生物体的生长、发育和繁殖[3]。
肉品中含有丰富的脂质和蛋白质,是人类摄取营养物质的重要来源。中国是肉品消费大国,在中国居民肉类总消费中,猪肉消费占据60%左右,处于主导地位[4],肉品的食用安全性是人们所关注的问题,提高肉品在贮藏、加工等过程中的品质是研究的重点方向。研究发现,肉品的脂质水解从动物屠宰后就开始进行,且受到温度、氧气等周边环境因素的影响,生肉时期的脂质水解反应会严重影响肉类的品质和消费者的可接受性。因此,了解肉品脂质水解进程有助于提高肉品品质。
中国传统肉制品的历史十分悠久,并且种类繁多,其中的典型代表有火腿、腊肉、风干鱼、风干鸡、板鸭等[5-7]。因其肉质紧实、风味独特[8]深受欢迎,研究发现,肉制品风味物质的形成是极其复杂的过程,加工过程中发生的脂质水解是风味物质形成的重要途经[9-11]。适度的水解氧化有助于肉制品中风味物质的形成,但过度的水解氧化会产生一系列有害物质,如羟基十八碳二烯酸(hydroxyoctadecaenoic acids,HODEs)、4-羟基壬烯醛(4-hydroxynonenal,4-HNE)等[12]。由此可见,在腌腊肉制品加工过程中,控制肉制品中脂质的水解进程对于提高肉制品品质很有必要[13-14]。
磷脂的水解发生在脂质-水界面,对于PLA2的研究必须考虑实验技术将如何在这种类型的细胞环境中操作(底物聚集、膜缔合等),但现在的技术还不能够提供PLA2的完整特征,对PLA2的研究多集中在活性和生理作用方面,目前关于PLA2的概况及其对肉品加工、品质等方面影响的系统总结较少,本文从内源PLA2的概况、提取纯化及其在肉制品加工过程中的活性变化等方面进行综述,旨在系统了解PLA2,为进一步阐述PLA2功效提供参考。
1 PLA2的概况
PLA2是磷脂酶家族中的一员,具有特异性水解磷脂甘油分子上二位酰基(sn-2)生成溶血磷脂和游离脂肪酸的功能[15]。根据其序列、分子质量、二硫键模式、对Ca2+需求的不同,把PLA2划分为4 种:分泌型PLA2(sPLA2)、胞浆型PLA2(cPLA2)、钙非依赖型PLA2(iPLA2)和许多其他没有分类但具有PLA2活性的酶[16]。
1.1 sPLA2
sPLA2是一种从蛇毒、哺乳动物胰腺和哺乳动物细胞中鉴定和详细研究的PLA2[2],大多数sPLA2对阴离子磷脂,如磷脂酰甘油、磷脂酰乙醇胺(phosphatidylethanolamine,PE)和磷脂酰丝氨酸(phosphatidylserine,PS)表现出较高的活性[17]。根据sPLA2二硫键模式、发现顺序不同,对其进行编号和分组。其中,人类基因组包含9 种sPLA2,小鼠基因组包含10 种,在哺乳动物、昆虫、软体动物、爬行动物、植物和细菌中鉴定出18 种形式的sPLA2,如表1所示。该酶功能主要包括杀死革兰氏阳性菌和革兰氏阴性菌,从而影响宿主防御细菌感染的能力,调节高密度脂蛋白和低密度脂蛋白水平,并在动脉粥样硬化等炎症性疾病中发挥重要作用[18]。
表1 部分sPLA2组成[18]
Table 1 Composition of some sPLA2[18]
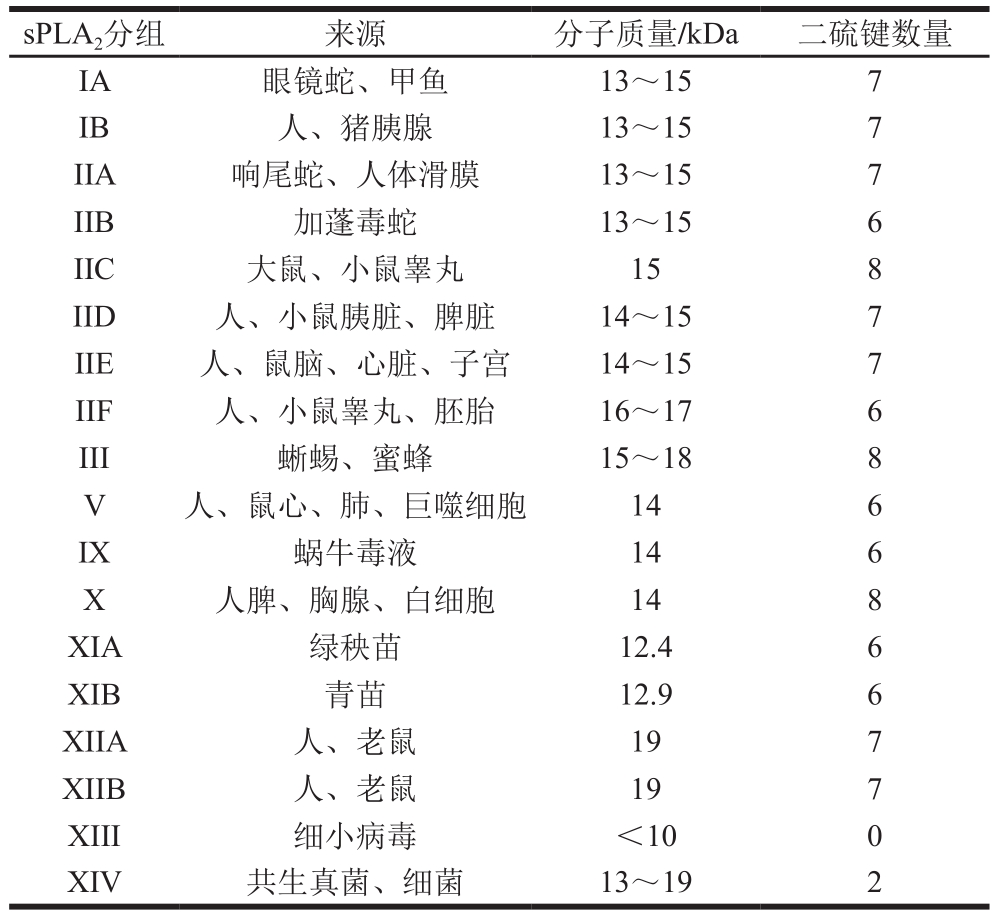
sPLA2分组 来源 分子质量/kDa 二硫键数量IA 眼镜蛇、甲鱼 13~15 7 IB 人、猪胰腺 13~15 7 IIA 响尾蛇、人体滑膜 13~15 7 IIB 加蓬毒蛇 13~15 6 IIC 大鼠、小鼠睾丸 15 8 IID 人、小鼠胰脏、脾脏 14~15 7 IIE 人、鼠脑、心脏、子宫 14~15 7 IIF 人、小鼠睾丸、胚胎 16~17 6 III 蜥蜴、蜜蜂 15~18 8 V 人、鼠心、肺、巨噬细胞 14 6 IX 蜗牛毒液 14 6 X 人脾、胸腺、白细胞 14 8 XIA 绿秧苗 12.4 6 XIB 青苗 12.9 6 XIIA 人、老鼠 19 7 XIIB 人、老鼠 19 7 XIII 细小病毒 <10 0 XIV 共生真菌、细菌 13~19 2
1.2 cPLA2
经过研究发现,cPLA2在人体免疫系统中起到非常重要的作用且和多种疾病的形成有重要联系,包括血栓的形成、癌症、动脉粥样硬化、哮喘、关节炎和鼻炎等[19]。通过剖析其晶体结构,发现cPLA2主要由C2结构域和催化结构域相连而成,二者的共同作用对cPLA2活性至关重要。目前为止,研究者已从人、小鼠等生物体中分离鉴定出6 种cPLA2,其特征总结如表2所示。研究表明,cPLA2大多能被Ca2+激活,并确定了C2结构域是主要的结合位点,对水解磷脂具有促进作用[20-21]。
表2 部分GIV组cPLA2组成[20]
Table 2 Composition of some group GIV cPLA2[20]
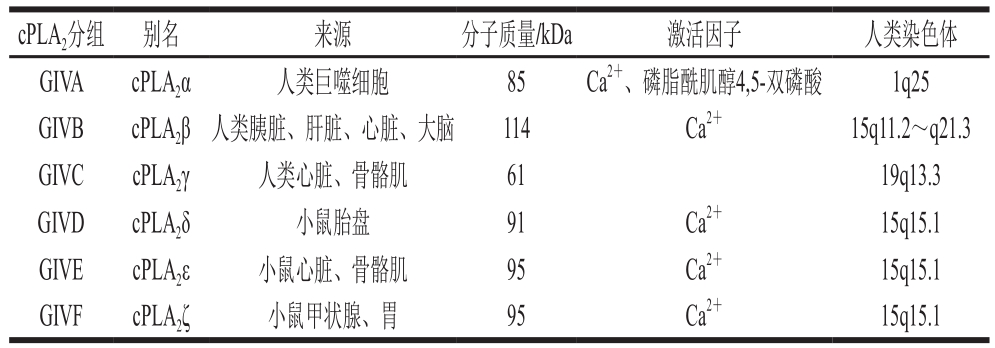
cPLA2分组 别名 来源 分子质量/kDa 激活因子 人类染色体GIVA cPLA2α 人类巨噬细胞 85 Ca2+、磷脂酰肌醇4,5-双磷酸 1q25 GIVB cPLA2β人类胰脏、肝脏、心脏、大脑 114 Ca2+ 15q11.2~q21.3 GIVC cPLA2γ 人类心脏、骨骼肌 61 19q13.3 GIVD cPLA2δ 小鼠胎盘 91 Ca2+ 15q15.1 GIVE cPLA2ε 小鼠心脏、骨骼肌 95 Ca2+ 15q15.1 GIVF cPLA2ζ 小鼠甲状腺、胃 95 Ca2+ 15q15.1
1.3 iPLA2
iPLA2已经被证实在细胞膜稳态和重塑中起到关键作用[22],它在人体组织中分布最广,包含6 个不同成员:GVIA、GVIB、GVIC、GVID、GVIE和GVIF(表3)。ATP激活已被反复证明是iPLA2活性的主要调节者[23],这种酶通常存在于线粒体中,线粒体中的ATP水平对细胞调节至关重要。iPLA2是唯一被认为受ATP调节的PLA2,并且与神经系统功能和功能性障碍密切相关,如神经传递和神经退行性变疾病等[2]。
表3 部分iPLA2组成[2]
Table 3 Composition of some iPLA2[2]
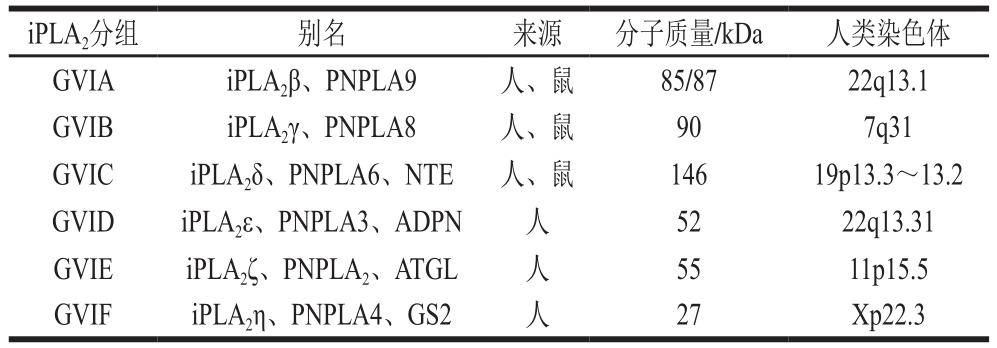
iPLA2分组 别名 来源 分子质量/kDa 人类染色体GVIA iPLA2β、PNPLA9 人、鼠 85/87 22q13.1 GVIB iPLA2γ、PNPLA8 人、鼠 90 7q31 GVIC iPLA2δ、PNPLA6、NTE 人、鼠 146 19p13.3~13.2 GVID iPLA2ε、PNPLA3、ADPN 人 52 22q13.31 GVIE iPLA2ζ、PNPLA2、ATGL 人 55 11p15.5 GVIF iPLA2η、PNPLA4、GS2 人 27 Xp22.3
2 PLA2的提取、纯化与活性测定
目前关于PLA2的提取纯化研究大多数集中在动物胰脏、肺及蛇毒等[24]。PLA2作用于磷脂,磷脂通常在水环境中聚集,形成胶束、囊泡、脂质体和其他大型结构聚集体[19],对于PLA2的研究是一项具有挑战的任务,通常PLA2都是从动植物体内获取,采用不同的提取纯化方式获得高活性PLA2,并以此为基础展开对其活性和理化性质的研究。
2.1 PLA2的提取、纯化
郝彩等[25]在广东舟山眼镜蛇的蛇毒中提取、纯化PLA2,采用化学沉淀、SephadexG-50凝胶过滤阳离子交换层析等方法,达到纯化PLA2的目的。付道莹等[26]从广西眼睛蛇的蛇毒中提取PLA2,采用CM-SepharoseCL-6B离子交换柱、SephadexG-50凝胶层析柱等相结合,对PLA2进行分离纯化,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)证实所得到的PLA2纯度大于90%。Souza等[27]从天蓝猿猴的皮肤分泌物中提取PLA2,经过冷冻干燥、反相高效液相色谱法等操作,在216 nm及280 nm处手动收集所有步骤的PLA2从而达到分离纯化的目的。Teke等[28]采用一种特别的纯化方式,基于含有PE(PLA2底物)的壳聚糖,尝试开发一种大分子水溶性树脂,结合超滤技术,从牛胰腺中纯化PLA2。一些经典技术,如高效液相色谱法、薄层色谱法、电泳法和超临界流体萃取法等,虽然可以达到纯化、分离的目的,但由于运行成本过于昂贵,并且都会使用对人体和环境有害的有机溶剂,所以不适合大规模生产纯品PLA2,且因为原材料来自自然界,导致提取率低下,成本昂贵,最终造成了纯品PLA2在市场上价格昂贵的局面[29]。
随着基因重组技术的发展,更多研究选择异源可溶表达,通过将目的PLA2基因导入原核细胞中,诱导其体外表达,通过分离、纯化的手段,获得活性强并且纯度高的PLA2。Karray等[30]将鸡心脏的PLA2基因(ChPLA2-V)插入到毕赤酵母细胞中,诱导表达,通过2 次色谱纯化得到纯化酶ChPLA2-V,其具有明显的抗炎、抗菌效果并且抗凝活性是从鸡肠道和胰腺中提取的PLA2的10 倍。马文君等[15]将人源PLA2基因导入至载体pET28+上,并在大肠杆菌中诱导其表达,使用硫酸铵盐析、Q柱纯化、Amylose柱纯化等技术,分离纯化得到重组PLA2,经过SDS-PAGE测定,纯化过后的重组酶纯度大于90%并且该酶具有较高的活性。王钦等[31]采用鲤鱼PLA2的催化活性区基因导入至不同原核细胞表达,经过镍柱纯化测定其蛋白纯度能达到95%、87%和47%,且有较强活性。通过异源可溶性表达获得的PLA2纯度、活性都远超从自然界提取的PLA2,并且成本较低,是现在一项主流技术。采取不同的方式提取、纯化PLA2,其最终目的都是为得到纯度高、活性强的PLA2,并以此为基础探究一系列生物酶活性、特定的功能效应,也为其接下来的推广应用打下基础。
2.2 PLA2活性的测定
PLA2活性的测定是进行酶研究的基础,由于PLA2活性不能直接通过荧光、紫外等直接测定,但其能够特异性水解磷脂sn-2位置,产生不饱和游离脂肪酸,常以此为基础,间接测得PLA2活性。
2.2.1 传统比色法
传统比色法是较早用于测定酶活性的方法,冯杰等[32]根据和脂蛋白相关的PLA2,将豆寇酰基-2-(4-对硝基苯酚丁二酸酐)作为反应底物,水解磷脂酰胆碱(phosphatidylcholine,PC)sn-2位,获得有色产物4-对硝基苯酚,4-对硝基苯酚在405 nm波长处会出现吸收峰,根据吸光度变化速率,可计算得出脂蛋白PLA2的活性。Gao Jianfang等[33]将大豆卵磷脂作为反应底物,通过PLA2与大豆卵磷脂、酚红混合均匀后,在室温条件下静置1 min,颜色由浅紫变为黄色的速率作为判断PLA2活性大小的依据。王钦等[31]采用偶联氧脂合酶法测定纯化后的鲤鱼PLA2活性,以二亚油酰磷脂酰胆碱为PLA2的反应底物,脂氧合酶作为偶联酶,二亚油酸被PLA2从底物中水解释放,再被脂氧合酶氧化,产生过氧化氢,在234 nm波长处吸光度发生变化,间接得到水解生成二亚油酸的量,从而测得PLA2的活性。但传统比色法的缺点是耗时较长,灵敏度和选择性不强。
2.2.2 荧光分析法
从20世纪90年代起,荧光分析法常被用于测定酶活性大小,其原理是使用特异性荧光基团标记底物作为探针,通过荧光的强弱变化测得酶活性。Malley等[34]提出iPLA2β的晶体结构,该酶显著修正了现有的力学模式,催化结构域形成紧密的二聚体,这些特征揭示了该酶细胞定位和活性调节机制,通过将PLA2放入Pyrene-PC中,在激发光波长340 nm的条件下连续测定荧光值的变化,从而测定该酶的活性大小,相比于传统比色法,荧光分析法是一种更为强大的分析手段,具有耗时短、分析量少、灵敏度高等优点。
2.2.3 液相色谱-质谱(liquid chromatography-mass spectrometry,LC-MS)分析法
伴随着高效液相色谱的普遍应用,直接测定PLA2水解磷脂产生的亚油酸(linoleic acid,LA)含量,被认为是最直观反映PLA2活性的方法。Balakrishna等[35]以1-棕榈酰-2-月桂酰-sn-甘油-3-磷酸胆碱为反应底物,采用LC-MS法测定PLA2水解产生LA的含量,从而直接测得其活性。目前普遍认为,高效液相色谱法测定PLA2活性,其测定效率、灵敏度等均远超荧光分析法,但也存在操作复杂、成本高等问题。
3 PLA2在生肉水解、氧化中的作用
生肉的脂肪组织和肌肉组织是脂肪酸的主要存在组织,后者除了含有中性脂肪外,超过50%都是以富含多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)磷脂的形式存在[13]。脂质水解的过程就是将脂质分子分解成甘油和脂肪酸的过程,这其中PLA2有重要作用,它能特异性水解磷脂sn-2位上的脂肪酸,生成不饱和游离脂肪酸等水解产物,以甘油磷脂为例,经过PLA2的水解作用,生成sn-2酰基溶血性磷脂和不饱和游离脂肪酸,如图1所示。
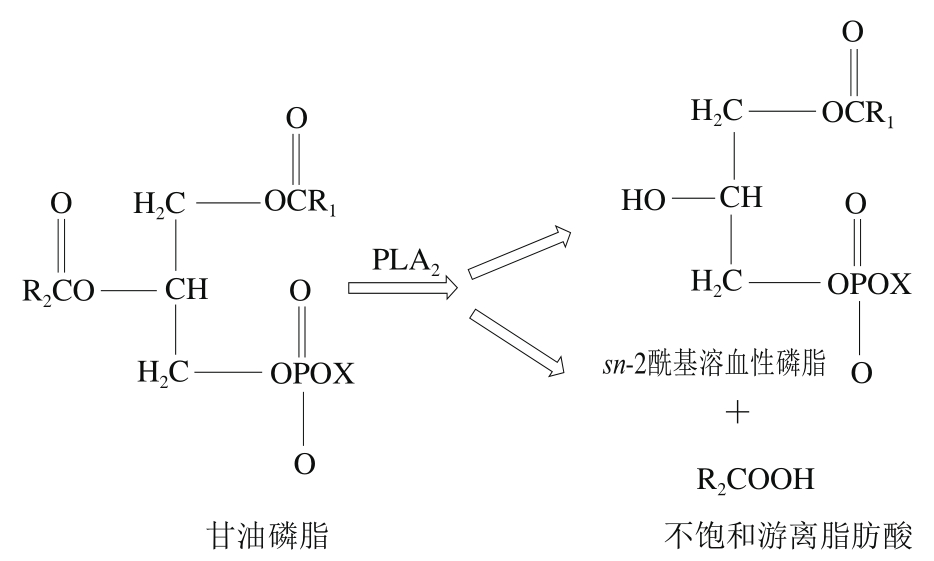
图1 甘油主链的sn-2位置由PLA2催化的特定反应
Fig. 1 Specific reactions catalyzed by PLA2 at the sn-2 position of the glycerol backbone
生肉在冷藏和冷冻期间一直发生脂质水解、氧化,二者之间的关系很复杂,直接或间接影响生肉的贮藏、运输等。Chen Tao等[36]通过测定猪肉冷冻贮藏48 h后的滴水损失,发现其变化与肌肉中的PLA2呈正相关,由此推测生肉发生水解反应与生物膜丧失作为半透性屏障的能力导致水解酶外泄有关。袁璐等[37]研究冷鲜肉在真空包装和高氧气调包装(80%氧气+20%二氧化碳)条件下的保水性变化,发现无论使用哪种包装方式,在冷鲜肉冷藏期间PLA2的活性都有上升趋势,脂质氧化进程也逐步加快。在家禽生肉中,常出现的PSE(pale, soft,exudative)肉的形成和PLA2有着密切关系,其特点为pH值迅速升高、持水力下降、颜色改变[38]。de Avila Souza等[39]发现暴露在热应激条件下,具有PSE特征鸡肉的PLA2活性是非热应激条件下的1.25 倍,PSE鸡肉的脂质氧化与PLA2呈正相关,即PLA2具有促进氧化的功能,从而影响鸡肉的品质。脂质的水解与氧化是密不可分的,二者相互影响,共同作用于生肉,PLA2又是其中重要的内源酶,因此了解其在水解、氧化中的作用,对于提高生肉品质有重要作用。
PLA2能够促进生肉的水解进程,在氧化进程中也会起到一定程度的抑制作用。Zhang Muhan等[40]利用等压标签进行蛋白质组学分析,发现冷藏3 d后,丙二醛含量较低的鸭胸脯细胞溶质PLA2的表达水平较高,这意味着该酶具有抗氧化作用。Lee等[41]研究PLA2对鳕鱼肌肉脂质氧化的抗氧化作用,发现PLA2不仅抑制初级和次级脂质氧化产物的形成,而且延缓血红素蛋白的氧化。此外,铁酰血红蛋白的形成是一种高价氧化形式的血红蛋白,被发现与鳟鱼血红蛋白的氧化作用有关,随着研究的深入,发现钙离子的有效性和pH值是控制PLA2对生肉脂质氧化的水解活性和抗氧化作用的重要因素[42-43]。
PLA2是一种依附于细胞膜上可水解磷脂的酶,因此对其进行研究从一定层面上对于调控脂质水解、氧化进程,延长生肉的货架期,提高其品质十分有益。
4 PLA2对肉制品品质的作用及其影响因素
4.1 肉制品风味形成机理
风味是肉制品最重要的特征之一,强烈影响消费者的购买欲望。风味物质包括滋味呈味物质和挥发性风味化合物[44]。脂质是肉品的重要组成成分,主要包括皮下脂肪和肌内脂肪[45]。在肉制品加工中,脂质(甘油三酯和磷脂)降解为游离脂肪酸主要与内源和外源性脂肪分解酶的活性有关[46]。研究表明,肉制品加工过程中,磷脂在内源PLA2等的作用下,游离态PUFA先被水解,再被氧化产生一系列醛、酮、醇等氧化产物,进一步分解形成小分子物质,参与风味的形成[47];适度的水解氧化有助于肉制品中风味物质的形成,但过度的水解氧化会产生一系列有害物质,如HODEs、4-HNE等,这些过程决定了产品的风味特征,并取决于几个因素之间的复杂相互作用[48]。
肌内磷脂是影响肉制品风味和营养的主要因素,其包含PC、PE、磷脂酰肌醇、PS等[49],其中PC占肌内磷脂的45%~60%[13]。徐为民等[50]提出,在腌腊肉制品中,肌内磷脂是风味物质形成的重要前体物质,因为降解酶的作用,在肉制品的加工过程中游离脂肪酸含量升高。水解反应一直伴随着整个腌制过程,并且可以进一步被反应分解生成小分子风味物质。能够水解磷脂的酶统称为磷脂酶,PLA2是其中重要的内源酶。在PLA2的作用下,磷脂水解产生大量游离态PUFA。与磷脂sn-2位上结合态的PUFA相比,游离态的PUFA更容易氧化,产生一系列风味物质或风味物质前体[51]。PLA2参与的磷脂水解对腌腊肉制品的风味、品质具有重要影响,并且腌腊肉加工程序的不同对PLA2的活性也有着不同程度的影响。
4.2 PLA2对肉制品品质的影响
肉制品的品质与其风味存在重要联系,通常评价腌腊肉品质时,风味是一项重要的指标。由前论述可知,风味物质的形成和脂肪水解有着密不可分的联系。Waraho等[52]通过测定干腌鸭肉加工过程中PLA2和磷脂酶C活性、中性脂质、游离脂肪酸和磷脂含量的变化观察到,花生四烯酸相对含量显著下降(P<0.05),同时游离脂肪酸含量显著增加(P<0.05),这进一步证实在传统的中国干腌鸭加工过程中,磷脂被PLA2水解,产生风味物质的前体物质,进而进一步被下游酶分解产生小分子风味物质,影响干腌鸭的品质。Merlo等[53]进行腊肉贮藏期间感官特性的研究,鉴定出的69 种挥发性有机化合物,如醛类、醇类、酮类和酸类等都与PLA2的水解有密不可分的联系。Huang Yechuan等[54]测定中国传统腊肉加工过程中的理化指标、磷脂酶和脂肪氧合酶活性等,发现中国传统腊肉加工过程中,肌肉内脂质中的三酰甘油和磷脂都是优先分解脂肪,脂肪分解过程是独立的,其中磷脂是游离脂肪酸的主要来源,此外,腊肉中脂质过氧化物的形成更多地与磷脂水解有关。磷脂水解在一定层面影响了脂质氧化和风味物质的形成,提升了腊肉的品质。PLA2影响腌腊肉的品质主要通过影响磷脂的水解、氧化过程,促使形成小分子风味物质,从而使腌腊肉具有不同风味,影响腌腊肉最终品质。
近年来研究发现,卵磷脂氢过氧化物是腌腊肉制品中油脂氧化的主要组分,动物肌肉PLA2具有水解卵磷脂氢过氧化物、形成HODEs前体的活性,推测出腌腊肉制品加工过程中存在基于PLA2水解磷脂氢过氧化物的磷脂降解途径[55],影响了腌腊肉的最终品质,目前还没有明确的研究阐述这条完整的途径,这将会成为未来研究的重点方向。
4.3 不同加工工艺对PLA2活性的影响
内源PLA2在水-脂界面水解磷脂sn-2位上的PUFA,残存酶活力与加工条件(水分活度、温度、盐分等)密切相关。Zhou Guanghong等[56]指出,脂肪酶、酯酶和磷脂酶是肌内磷脂水解的重要内源酶,经测定在金华火腿的腌制干燥成熟过程中磷脂酶的活性仅保留了初始活性的7.56%。Jin Guofeng等[57]发现,在培根腌制和干燥-成熟的过程中磷脂酶的活性保留了初始活性的9.1%,干腌制品的内部水分活度、盐分等是影响酶活性的重要因素。Waraho等[52]在干腌鸭的加工过程中观察到磷脂存在降解,PLA2活性随着处理时间的延长而降低,干燥结束时保留了初始活性的83.70%,在整个过程中,游离脂肪酸和中性脂质的PUFA含量逐渐增加,而磷脂的PUFA逐渐减少,PLA2的相对活性与磷脂含量的下降和游离脂肪酸含量的增加存在显著相关性,PLA2在肌内磷脂降解中起到重要作用。由此可见,加工程序会影响肉制品中PLA2的活性,从而影响脂肪分解,说明腌制方法、水分活度、pH值、盐分、温度等影响酶活性,从而影响对腌腊肉加工工艺的选择。在腊肉等加工过程中,低盐、高水分将会促进酶活性,但经过高温处理,腊肉制品的水分流失严重,细胞结构被破坏,细胞质被不断浓缩,导致PLA2活性降低[58]。众多研究结果表明,PLA2的活性变化受加工过程中众多因素的影响,如原材料的种类、被处理的部位、加工工艺的选择和微生物等[59]。
5 结 语
本文阐述了4 种PLA2对生物体的不同影响,提取、测定PLA2的不同方式以及PLA2在生肉、腌腊肉中的不同变化和影响因素。肉品的加工贮藏过程中始终伴随脂质的水解,影响其品质。适度的水解可以促进肉品的风味形成,PLA2在脂质水解过程中具有重要作用,因此了解PLA2在肉品中的作用机理和外界因素对其的影响作用,将有助于提高肉品品质,但目前对于肉品中PLA2研究较少且不深入,尚需要更多研究来证实PLA2与肉品品质之间的相关性,PLA2或将成为影响肉品品质的重要因子。
[1]TEIXEIRA S C, BORGES B C, OLIVEIRA V Q, et al. Insights into the antiviral activity of phospholipases A2 (PLA2s) from snake venoms[J]. International Journal of Biological Macromolecules, 2020,164: 616-625. DOI:10.1016/j.ijbiomac.2020.07.178.
[2]DENNIS E A, CAO J, HSU Y H, et al. Phospholipase A2 enzymes:physical structure, biological function, disease implication, chemical inhibition, and therapeutic intervention[J]. Chemical Reviews, 2011,111(10): 6130-6185. DOI:10.1021/cr200085w.
[3]SEREDA V, MALYSHKIN D, SEDNEV A, et al. Hydration thermodynamics of proton-conducting perovskite Ba4Ca2Nb2O11[C]//Conference on nonstoichiometric compounds. Institute of natural sciences and mathematics ural federal university yekaterinburg russia.Miyazaki, 2019: 67.
[4]韩磊. 中国肉类供需形势及稳产保供对策研究[J]. 价格理论与实践,2020(7): 57-61. DOI:10.19851/j.cnki.cn11-1010/f.2020.07.237.
[5]ZHOU Changyu, PAN Daodong, BAI Yun, et al. Evaluating endogenous protease of salting exudates during the salting process of Jinhua ham[J]. LWT-Food Science and Technology, 2019, 101: 76-82.DOI:10.1016/j.lwt.2018.11.026.
[6]PETRIČEVIĆ S, RADOVČIĆ N M, LUKIĆ K, et al. Differentiation of dry-cured hams from different processing methods by means of volatile compounds, physico-chemical and sensory analysis[J]. Meat Science, 2018, 137: 217-227. DOI:10.1016/j.meatsci.2017.12.001.
[7]唐静, 张迎阳, 吴海舟, 等. 传统腌腊肉制品挥发性风味物质的研究进展[J]. 食品科学, 2014, 35(15): 283-288. DOI:10.7506/spkx1002-6630-201415057.
[8]冯小敏, 王维民. 肉品风味研究进展[J]. 食品科学, 2009, 30(增刊1):216-219. DOI:10.3321/j.issn:1002-6630.2009.z1.048.
[9]崔莹莹, 耿翠竹, 王海滨, 等. 腌腊肉制品的风味物质及氧化评价技术研究进展[J]. 武汉轻工大学学报, 2016, 35(2): 16-21; 35.DOI:10.3969/j.issn.2095-7386.2016.02.003.
[10]MONIKA K, MAGORZATA A M, TERESA F J F S, et al. Volatile compounds in meat and meat products[J]. Food Science and Technology, 2017, 37(1): 1-7. DOI:10.1590/1678-457x.08416.
[11]ÖZTÜRK N. Phenolic composition and antioxidant activity of the different extracts from Thymus longicaulis C. Presl. subsp. longicaulis var. longicaulis and T. longicaulis C. Presl. subsp. longicaulis var. subisophyllus growing in Turkey[J]. Pakistan Journal of Pharmaceutical Sciences, 2015, 28(2): 465-472.
[12]PROMEYRAT A, DAUDIN J D, ASTRUC T, et al. Kinetics of protein physicochemical changes induced by heating in meat using mimetic models: (2) effects of fibre type, peroxides and antioxidants[J].Food Chemistry, 2013, 138(4): 2283-2290. DOI:10.1016/j.foodchem.2012.11.134.
[13]BIAN Huan, MA Jingjing, GENG Zhiming, et al. Changes of hydroxyl-linoleic acids during Chinese-style sausage processing and their relationships with lipids oxidation[J]. Food Chemistry, 2019, 296:63-68. DOI:10.1016/j.foodchem.2019.05.183.
[14]MA Jingjing, GENG Zhiming, SUN Chong, et al. Novel sample treatment method for the determination of free (E)-4-hydroxy-2-nonenal in meat products by liquid chromatography/tandem mass spectrometry using 4-hydroxy-2-nonenal-d3 as internal standard[J].Rapid Communications in Mass Spectrometry, 2021, 35(5): e9023.DOI:10.1002/rcm.9023.
[15]马文君, 滕琳, 田顺利, 等. 人源磷脂酶PLA2异源可溶表达纯化及酶学分析[J]. 食品工业科技, 2021, 42(2): 70-75; 82.
[16]FAROOQUI A A, HORROCKS L A. Brain phospholipases A2:a perspective on the history[J]. Prostaglandins Leukot Essent Fatty Acids, 2004, 71(3): 161-169. DOI:10.1016/j.plefa.2004.03.004.
[17]HARWIG S S, TAN L L, QU X D, et al. Bactericidal properties of murine intestinal phospholipase A2[J]. Journal of Clinical Investigation,1995, 95(2): 603-610. DOI:10.1172/JCI117704.
[18]BUCKLAND A G, WILTON D C. Inhibition of secreted phospholipases A2 by annexin V. Competition for anionic phospholipid interfaces allows an assessment of the relative interfacial affinities of secreted phospholipases A2[J]. Biochimica et Biophysica Acta (BBA)-Lipids and Lipid Metabolism, 1998, 1391(3): 367-376. DOI:10.1016/S0005-2760(98)00026-5.
[19]DENNIS E A. Liberating chiral lipid mediators, inflammatory enzymes, and LIPID MAPS from biological grease[J]. The Journal of Biological Chemistry, 2016, 291(47): 24431-24448. DOI:10.1074/jbc.X116.723791.
[20]HSU Y H, BURKE J E, STEPHENS D L, et al. Calcium binding rigidifies the C2 domain and the intradomain interaction of GIVA phospholipase A2 as revealed by hydrogen/deuterium exchange mass spectrometry[J]. Journal of Biological Chemistry, 2008, 283(15):9820-9827. DOI:10.1074/jbc.M708143200.
[21]BURKE J E, HSU Y H, DEEMS R A, et al. A Phospholipid substrate molecule residing in the membrane surface mediates opening of the lid region in group IVA cytosolic phospholipase A2[J]. Journal of Biological Chemistry, 2008, 283(45): 31227-31236. DOI:10.1074/jbc.M804492200.
[22]BALSINDE J, BALBOA M A, DENNIS E A. Antisense inhibition of group VI Ca2+-independent phospholipase A2 blocks phospholipid fatty acid remodeling in murine P388D1 macrophages[J]. Journal of Biological Chemistry, 1997, 272(46): 29317. DOI:10.1074/jbc.272.46.29317.
[23]KUDO I, MURAKAMI M. Phospholipase A2 enzymes[J].Prostaglandins and Other Lipid Mediators, 2002, 68/69: 3-58.DOI:10.1016/S0090-6980(02)00020-5.
[24]王道营, 张牧晗, 张露娟, 等. 磷脂酶的分离纯化技术研究进展[J]. 江西农业学报, 2012, 24(9): 142-145. DOI:10.3969/j.issn.1001-8581.2012.09.040.
[25]郝彩, 韩丽萍, 蒋琳兰. 广东眼镜蛇毒磷脂酶A2的分离纯化及其酶活性质[J]. 中国生物制品学杂志, 2011, 24(5): 575-578.
[26]付道莹, 张学荣, 付娆, 等. 广西眼镜蛇蛇毒磷脂酶A2的分离纯化及其对HSC-T6细胞的作用[J]. 蛇志, 2015, 27(2): 99-102. DOI:10.3969/J.ISSN.1001-5639.2015.02.002.
[27]SOUZA B B P, CARDOZO FH J L, MURAD A M, et al. Identification and characterization of phospholipases A2 from the skin secretion of Pithecopus azureus anuran[J]. Toxicon, 2019, 167: 10-19.DOI:10.1016/j.toxicon.2019.06.002.
[28]TEKE M, TELEFONCU A. Purification of bovine pancreatic phospholipase A2 by an affinity ultrafiltration technique[J]. Separation and Purification Technology, 2008, 63(3): 716-720. DOI:10.1016/j.seppur.2008.07.019.
[29]DA SILVA R M M, COIMBRA J S D R, DA SILVA C A, et al. Green extraction by aqueous two-phase systems of porcine pancreatic and snake venom phospholipase A2[J]. Separation and Purification Technology, 2015, 141: 25-30. DOI:10.1016/j.seppur.2014.11.029.
[30]KARRAY A, BOU ALI M, KHARRAT N, et al. Antibacterial,antifungal and anticoagulant activities of chicken PLA2 group V expressed in Pichia pastoris[J]. International Journal of Biological Macromolecules: Structure, Function and Interactions, 2018, 108: 127-134.DOI:10.1016/j.ijbiomac.2017.11.045.
[31]王钦, 李建林, 唐永凯, 等. 鲤鱼PLA2g3a1催化活性区的原核表达及酶活性分析[J]. 南京农业大学学报, 2020, 43(2): 339-346.
[32]冯杰, 梁辰, 薛辉, 等. 一种高灵敏度的脂蛋白相关PLA2活性检测方法[J]. 标记免疫分析与临床, 2020, 27(5): 850-855. DOI:10.11748/bjmy.issn.1006-1703.2020.05.028.
[33]GAO Jianfang, WANG Jing, YING He, et al. Proteomic and biochemical analyses of short-tailed pit viper (Gloydius brevicaudus)venom: age-related variation and composition-activity correlation[J].Journal of Proteomics, 2014, 105: 307-322. DOI:10.1016/j.jprot.2014.01.019.
[34]MALLEY K R, KOROLEVA O, MILLER I, et al. The structure of iPLA2β reveals dimeric active sites and suggests mechanisms of regulation and localization[J]. Nature Communications, 2018, 9(1):765. DOI:10.1038/s41467-018-03193-0
[35]BALAKRISHNA M, MA J, LIU T, et al. Hydrolysis of oxidized phosphatidylcholines by crude enzymes from chicken, pork and beef muscles[J]. Food Chemistry, 2019, 313: 125956. DOI:10.1016/j.foodchem.2019.125956.
[36]CHEN Tao, ZHOU Guanghong, XU Xinglian, et al. Phospholipase A2 and antioxidant enzyme activities in normal and PSE pork[J]. Meat Science, 2010, 84(1): 143-146. DOI:10.1016/j.meatsci.2009.08.039.
[37]袁璐, 高峰, 周光宏, 等. 高氧气调包装和真空包装对冷鲜肉贮藏过程中保水性和脂质氧化的影响[J]. 食品科学, 2012, 33(18): 307-311.
[38]SOARES A L, IDA E I, MIYAMOTO S, et al. Phospholipase A2 activity in poultry PSE, pale, soft, exudative, meat[J]. Journal of Food Biochemistry,2003, 27(4): 309-320. DOI:10.1111/j.1745-4514.2003.tb00285.x.
[39]DE AVILA SOUZA M A, SHIMOKOMAKI M, TERRA N N, et al.Oxidative changes in cooled and cooked pale, soft, exudative (PSE)chicken meat[J]. Food Chemistry, 2022, 385: 132471. DOI:10.1016/j.foodchem.2022.132471.
[40]ZHANG Muhan, WANG Daoying, XU Xinglian, et al. iTRAQ-based proteomic analysis of duck muscle related to lipid oxidation[J]. Poultry Science, 2021, 100(4): 101029. DOI:10.1016/j.psj.2021.101029.
[41]LEE S K, TATIYABORWORNTHAM N, GRUNWALD E W, et al.Myoglobin and haemoglobin-mediated lipid oxidation in washed muscle: observations on crosslinking, ferryl formation, porphyrin degradation, and haemin loss rate[J]. Food Chemistry, 2015, 167: 258-263.DOI:10.1016/j.foodchem.2014.06.098.
[42]TATIYABORWORNTHAM N, YIN J, RICHARDS M P. Factors influencing the antioxidant effect of phospholipase A2 against lipid oxidation promoted by trout hemoglobin and hemin in washed muscle[J]. Food Chemistry, 2020, 343(2): 128428. DOI:10.1016/j.foodchem.2020.128428.
[43]WU Haizhou, XIAO Shulan, YIN Jie, et al. Mechanisms involved in the inhibitory effects of free fatty acids on lipid peroxidation in turkey muscle[J]. Food Chemistry, 2020, 342(9): 128333. DOI:10.1016/j.foodchem.2020.12833.
[44]李敬, 杨媛媛, 赵青余, 等. 肉风味前体物质与风味品质的关系研究进展[J]. 中国畜牧杂志, 2019, 55(11): 1-7. DOI:10.19556/j.0258-7033.20190330-05.
[45]LEE B, PARK C H, KONG C, et al. Muscle fiber and fresh meat characteristics of white-striping chicken breasts, and its effects on palatability of sous-vide cooked meat[J]. Poultry Science, 2021,100(7): 101177. DOI:10.1016/j.psj.2021.101177.
[46]陈俏纯, 何志勇, 秦昉, 等. 肉制品加工过程风味和伴生危害物的生成及关联规律[J]. 食品安全质量检测学报, 2019, 10(15): 4848-4855.
[47]LI Xinfu, ZHU Jiancai, LI Cong, et al. Evolution of volatile compounds and spoilage bacteria in smoked bacon during refrigeration using an E-nose and GC-MS combined with partial least squares regression[J]. Molecules, 2018, 23(12): 3286. DOI:10.1021/jf0009908.
[48]MONTANARI C, GATTO V, TORRIANI S, et al. Effects of the diameter on physico-chemical, microbiological and volatile profile in dry fermented sausages produced with two different starter cultures[J].Food Bioscience, 2017, 22: 9-18. DOI:10.1016/j.fbio.2017.12.013.
[49]SHIRAI N, HIGUCHI T, SUZUKI H. Analysis of lipid classes and the fatty acid composition of the salted fish roe food products, Ikura,Tarako, Tobiko and Kazunoko[J]. Food Chemistry, 2006, 94(1): 61-67.DOI:10.1016/j.foodchem.2004.10.050.
[50]徐为民, 王道营, 诸永志, 等. 肌内磷脂在腌腊肉制品风味形成中的作用机制研究进展[J]. 江苏农业学报, 2010, 26(1): 204-207.DOI:10.3969/j.issn.1000-4440.2010.01.038.
[51]SCIENCE F T J M. Proteolysis and lipolysis in flavour development of dry-cured meat products[J]. Meat Science, 1998, 49: S101-S110.DOI:10.1016/S0309-1740(98)90041-9.
[52]WARAHO T, MCCLEMENTS D J, DECKER E A. Impact of free fatty acid concentration and structure on lipid oxidation in oil-in-water emulsions[J]. Food Chemistry, 2011, 129(3): 854-859. DOI:10.1016/j.foodchem.2011.05.034.
[53]MERLO T C, LORENZO J M, SALDANA E, et al. Relationship between volatile organic compounds, free amino acids, and sensory profile of smoked bacon[J]. Meat Science, 2021, 181: 108596.DOI:10.1016/j.meatsci.2021.108596.
[54]HUANG Yechuan, LI Hongjun, HUANG Tian, et al. Lipolysis and lipid oxidation during processing of Chinese traditional smokecured bacon[J]. Food Chemistry, 2014, 149: 31-39. DOI:10.1016/j.foodchem.2013.10.081.
[55]WANG Daoying, ZHANG Muhan, BIAN Huan, et al. Changes of phospholipase A2 and C activities during dry-cured duck processing and their relationship with intramuscular phospholipid degradation[J]. Food Chemistry, 2014, 145: 997-1001. DOI:10.1016/j.foodchem.2013.09.007.
[56]ZHOU Guanghong, ZHAO Gaiming. Biochemical changes during processing of traditional Jinhua ham[J]. Meat Science, 2007, 77(1):114-120. DOI:10.1016/S1872-583X(07)60011-4.
[57]JIN Guofeng, ZHANG Jianhao, YU Xiang, et al. Lipolysis and lipid oxidation in bacon during curing and drying-ripening[J].Food Chemistry, 2010, 123(2): 465-471. DOI:10.1016/j.foodchem.2010.05.031.
[58]李林, 王亚娜, 王晓君, 等. 老腊肉加工过程中脂质水解及氧化的变化研究[J]. 现代食品科技, 2016, 32(8): 252-258. DOI:10.13982/j.mfst.1673-9078.2016.8.038.
[59]黄业传. 脂肪及脂肪酶在猪肉加工过程中的变化[J]. 肉类工业,2011(2): 54-58. DOI:10.3969/j.issn.1008-5467.2011.02.017.