快节奏的现代生活中,速冻食品因其种类繁多、滋味丰富、烹饪方式简单、省时等优势,已成为人们日常生活中不可或缺的一种食品类型。但随着人们对速冻食品的需求日益增多,速冻食品市场变得鱼龙混杂,有关速冻食品肉类掺假或标注肉的种类与实际不符的报道层出不穷,给市场监管带来了极大挑战,如牛肉风味的撒尿肉丸未添加牛肉,6 元/kg的猪肉水饺实际上内馅为鸡架泥[1-3]等。目前,主要的肉类掺假方式为以价格低廉的鸡肉、鸭肉和猪肉代替市场价格更高的牛羊肉[4-7],这种掺假售假的行为不仅侵犯了消费者的合法权益,还存在导致消费者违背民族饮食习惯和发生过敏的可能,给消费者的身心健康带来了极大的安全隐患。因此,亟需一种快速、有效的检测手段来鉴别速冻食品的动物源性成分,促进监管部门对速冻食品生产原材料的品质和食品标签的真实性进行有力监管,维护消费者的合法权益。
肉制品中动物源性成分的检测方法主要有基于特征结构检测的光谱和质谱分析[8-9]、基于蛋白质检测的免疫学方法[10]和基于核酸检测的分子生物学方法[11]。与其他方法相比,分子生物学方法受加工处理方式的影响较小,且方法特异性、灵敏性高,操作简单,因此成为肉制品中动物源性成分检测方法的研究热点。目前,国内外学者针对动物源性成分核酸检测建立了等温扩增技术和热循环扩增技术。等温扩增技术作为一种新兴技术,包括环介导等温扩增(loop-mediated isothermal amplification,LAMP)法[12]和重组酶聚合酶扩增(recombinase polymerase amplification,RPA)法[13]等,其中LAMP方法引物设计较为复杂,假阳性率较高[14];RPA方法引物、探针设计较为困难,成本高,不适合大量样品多种源性成分的同时检测[15]。热循环扩增技术包括聚合酶链式反应(polymerase chain reation,PCR)方法[16]、实时荧光PCR方法[17]、限制性片段长度多态性(restriction fragment length polymorphism,RFLP)法[18]和微滴式数字PCR(droplet digital PCR,ddPCR)法[19]等,RFLP方法重复性较差,不适用于复杂成分的肉制品分析[20];ddPCR是一种绝对定量检测技术,但该方法所用试剂昂贵、检测成本较高,对操作人员的专业素质要求较高,不适用于大范围推广[21-22];而基于实时荧光PCR技术建立的动物源性成分检测方法克服了传统PCR技术易造成交叉污染的缺点[23],广泛应用于肉制品中动物源性成分的掺假鉴别。但我国应用实时荧光PCR技术建立的多种动物源性成分检测的国家或行业标准,主要是针对单一物种成分的定性鉴定,不能同时检测多种源性成分。在实际检测工作中,往往需要在短时间内对一种食品完成多种源性成分检测,以鉴别是否掺假;然而,目前单一物种的定性检测方法耗时较长,已经不能满足市场检测需求。
目前,市面上速冻食品的种类主要包括速冻水饺、馄饨(云吞)、小笼包和馅饼等,成分表中肉类以鸡肉、鸭肉、猪肉和牛肉为主。鸡转化生长因子β-3(transforming growth factor beta-3,TGFB3)基因、猪朊蛋白(prion protein,PRNP)基因和鸭、牛生长激素(growth hormone,GH)基因是鸡、鸭、猪和牛源性成分检测中常用的单拷贝基因,不仅在源性成分定性检测方面表现出良好的灵敏性,而且由于单拷贝基因在每个细胞内拷贝数固定的优势[24],在后续源性成分定量检测方面也具有极大应用潜力。故本研究基于鸡TGFB3基因、猪PRNP基因和鸭、牛GH基因,设计合成特异性引物和TaqMan探针,建立同时检测速冻食品中鸡、鸭、猪和牛源性成分的实时荧光PCR检测方法,实现4 种源性成分的快速检测。进一步运用所建立的方法对市售不同种类的速冻食品进行鸡、鸭、猪和牛源性成分检测,验证该方法的有效性和实用性。
1 材料与方法
1.1 材料与试剂
鸡、鸭、猪、牛、狐狸、水貂、鹅、驴、羊、马几种不同动物肉粉由本实验室制备并保存;速冻水饺、馄饨(云吞)、小笼包和馅饼等34 份速冻食品,均购于石家庄市不同农贸市场或超市。
食品基因组DNA提取试剂盒 美国Promega公司;探针法荧光PCR预混液(2×) 北京全式金生物技术有限公司。
1.2 仪器与设备
1-14台式离心机 德国Sigma公司;NanoDrop 2000C超微量分光光度计 美国Thermo Scientific公司;ABI 7500实时荧光PCR仪 美国ABI公司;SL 202电子天平 德国赛多利斯公司;BT-20T恒温金属浴 上海安亭仪器有限公司。
1.3 方法
1.3.1 引物和探针
参考文献[25-26]合成鸡TGFB3基因和鸭GH基因特异性引物和探针;参照GB/T 25165—2010《明胶中牛、羊、猪源性成分的定性检测方法 实时荧光PCR法》,合成猪PRNP基因及牛GH基因特异性引物和探针;所有引物和探针均由生工生物工程(上海)股份有限公司合成,序列如表1所示。
表1 所需引物和探针序列信息
Table 1 Information about the primers and probe used in this study

物种 引物名称 序列(5’-3’) 扩增片段大小/bp目的基因猪-F TTTGTGCATGACTGCGTCAAC猪 猪-R CTTGGTGGTCGTGGTCACTGT猪-P (FAM)-CACCGTCAAGCAGC-(NFQ)(MGB)60 PRNP牛-F CCGATGGATGTGTTCAGAGCT牛 牛-R GCCAAATGTCTGGGTGTAGATACC牛-P (FAM)-TGGGCTTTAGGGCTTCCGAATGTGAA-Eclipse 76 GH鸡-F TGCTGCACCTATGAAAATGAATG鸡 鸡-R AGAATGCAGTCTCAGCACAACAC鸡-P (FAM)-TGCCCCGGTCTCCCTATGGTGC-Eclipse 99 TGFB3鸭-F GCCTCCACCCCTGATCCT鸭85 GH鸭-R CGCTCCCCACAGCTCTCA鸭-P (FAM)-TGCCCACACCCAAACCCACCAC-Eclipse
1.3.2 动物肉粉基因组DNA的提取
将实验室保存的不同物种肉粉各取50 mg,分别置于1.5 mL离心管中,按照食品基因组DNA提取试剂盒操作说明提取基因组DNA,最终以100 μL ddH2O溶解基因组DNA。使用超微量分光光度计测定DNA质量浓度,再分别稀释至1.0×105 pg/μL,置于-20 ℃贮存,备用。
1.3.3 实时荧光PCR方法的建立及优化
分别以提取的鸡、鸭、猪、牛基因组DNA作为模板,采用矩阵实验分别对引物和探针的浓度及退火温度进行优化。反应体系为25 μL:2×探针法荧光PCR预混液12.5 μL,上、下游引物(10 μmol/L)终浓度分别为160、240、320、400、600 nmol/L,探针(10 μmol/L)终浓度分别为240、320、400、600 nmol/L,模板DNA 1 µL,再用ddH2O补足至25 µL。反应条件:95 ℃预变性30 s;95 ℃变性5 s,退火温度分别设置为55、58、60、63 ℃,退火延伸35 s,40 个循环,在退火延伸时采集荧光信号。在其他条件相同的情况下,以鸡、鸭、猪和牛源性成分实时荧光PCR方法中,循环阈(cycle threshold,Ct)值最低、荧光信号最强且扩增效率最高的组合为最佳的引物、探针浓度和反应条件。
1.3.4 实时荧光PCR方法的特异性实验
以鸡、鸭、猪、牛、狐狸、水貂、驴、羊、鹅、马基因组DNA为模板,无菌水为空白对照,分别按照1.3.3节优化后的最佳反应体系和反应条件,对鸡、鸭、猪和牛源性成分实时荧光PCR方法的特异性进行分析。
1.3.5 实时荧光PCR方法的灵敏性实验
将1.0×105 pg/µL的鸡、鸭、猪、牛基因组DNA按照10 倍梯度稀释的方法依次稀释至1.0×10-2 pg/µL,取1 µL为模板进行实时荧光PCR检测,通过荧光信号的有无和扩增曲线的趋势,对所建立方法的灵敏性进行评价。
1.3.6 市售速冻食品检测
将购买的34 份速冻水饺、馄饨(云吞)、小笼包和馅饼解冻至室温,使用无菌剪刀将待测样品的面皮和肉馅分离,挑取适量肉馅置于研钵中,加入液氮充分研磨成粉末。取50 mg样品粉末于1.5 mL离心管中,每份样品取2 管,分别按照1.3.2节提取基因组DNA。样品处理和核酸提取过程中应避免样品之间或与其他动物源性成分的交叉污染。采用建立的实时荧光PCR方法对所有样品同时检测鸡、鸭、猪和牛源性成分。将检出的动物源性成分与样品外包装标注的成分进行比对,对检测结果进行分析,进一步验证所建立方法的准确性和实际应用效果。
1.4 数据处理
使用ABI 7500实时荧光PCR仪系统分析软件(v1.5.1)对检测结果进行分析,获得样品Ct值;再利用Excel软件对平行实验测定结果进行分析。
2 结果与分析
2.1 实时荧光PCR方法的建立及优化
以鸡、鸭、猪和牛基因组DNA为模板,根据Ct值、荧光强度和扩增效率确定实时荧光PCR方法最佳的反应体系和反应条件。结果表明,实时荧光PCR方法同时检测鸡、鸭、猪和牛源性成分的最佳反应体系为:2×探针法荧光PCR预混液12.5 µL,上、下游引物终浓度均为400 nmol/L,探针终浓度400 nmol/L,模板DNA 1 µL,无菌水8.5 µL。反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火延伸35 s,40 个循环,在退火延伸时采集荧光信号。
2.2 特异性实验结果
由图1可知,空白对照组未出现扩增,说明反应体系未受污染,只有鸡、鸭、猪和牛源性成分出现特异性扩增曲线,其他物种均未扩增,表明鸡、鸭、猪和牛源性成分的实时荧光PCR检测方法具有良好的特异性。
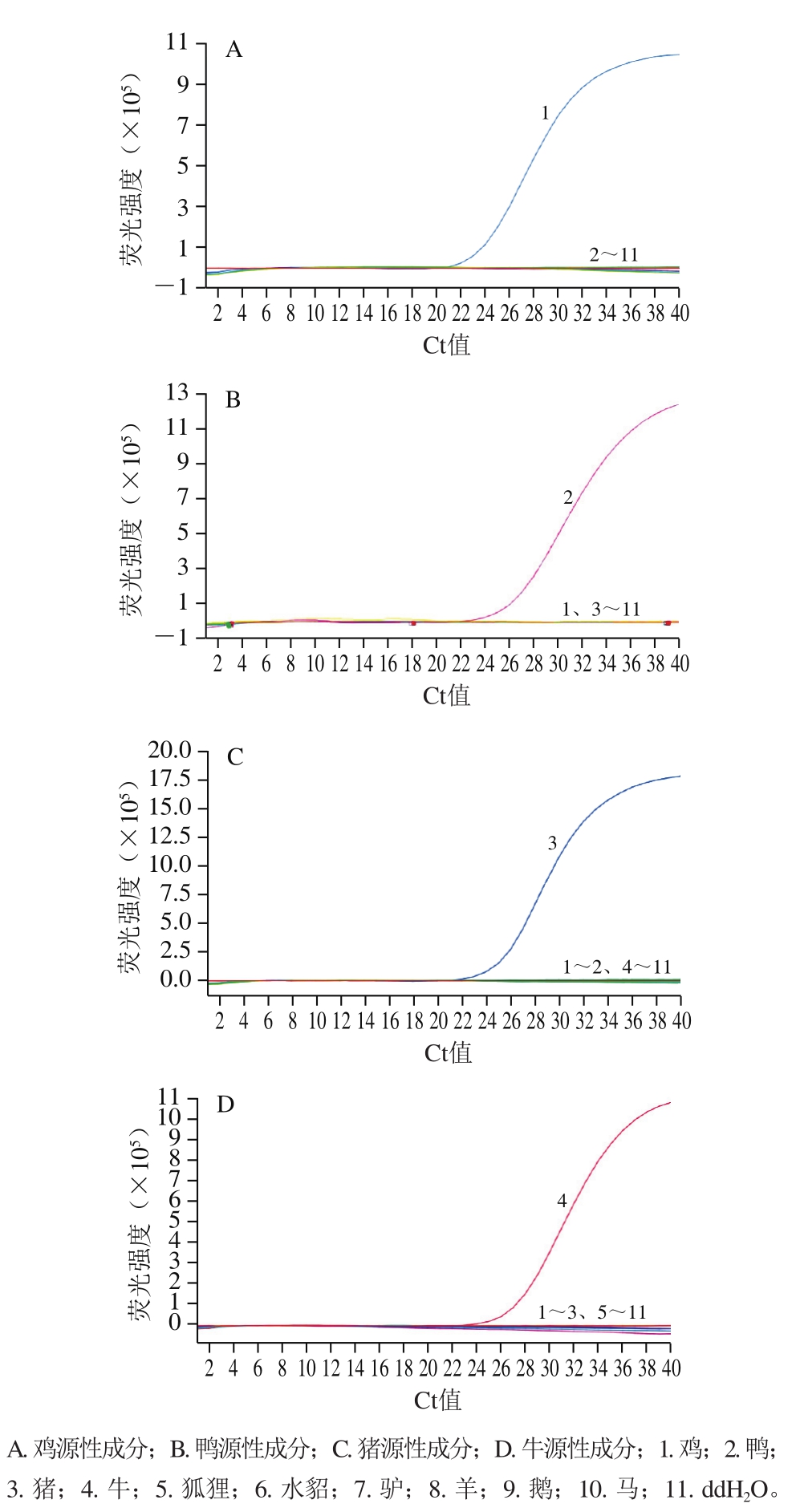
图1 鸡、鸭、猪、牛源性成分实时荧光PCR方法特异性实验结果
Fig. 1 Specificity of real-time PCR for chicken-, duck-, swine- and bovine-derived ingredients
2.3 灵敏性实验结果
将1.0×10-2~1.0×105 pg/µL的鸡、鸭、猪、牛基因组DNA作为模板,进行实时荧光PCR方法检测。由图2可知,当鸡、猪、牛基因组DNA质量浓度为10.0 pg/µL、鸭基因组DNA质量浓度为1.0 pg/µL时,实时荧光PCR方法仍出现典型扩增曲线。表明本研究所建立的同时检测鸡、鸭、猪、牛源性成分实时荧光PCR方法的灵敏性分别为10.0、1.0、10.0、10.0 pg/µL。
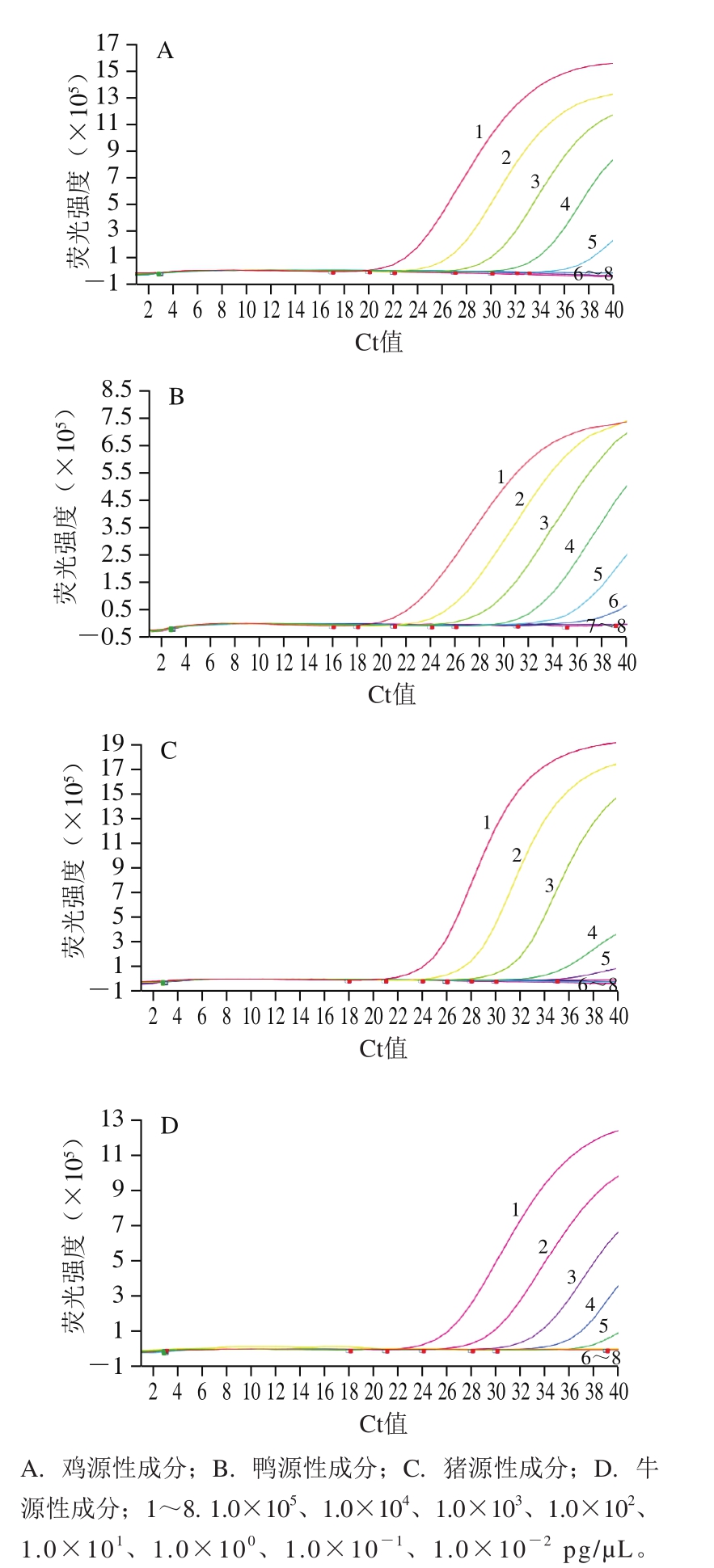
图2 鸡、鸭、猪、牛源性成分实时荧光PCR方法灵敏性实验结果
Fig. 2 Sensitivity of real-time PCR for chicken-, duck-, swine- and bovine-derived ingredients
2.4 市售速冻食品的检测结果
使用建立的实时荧光PCR检测方法,对34 份速冻食品同时进行鸡、鸭、猪、牛源性成分检测,并将检出的成分与食品外包装上标识的成分进行对比分析。结果表明,所建立的方法能够实现对34 份样品中4 种动物源性成分的有效检测,进一步分析表明,有15 份速冻食品检出的动物源性成分与食品外包装上标注的成分不一致,其中12 份未标注鸡肉成分的速冻食品检出鸡源性成分,3 份未标注鸭肉成分的速冻食品检出鸭源性成分,1 份未标注牛肉成分的速冻食品检出牛源性成分(表2)。
表2 市售速冻食品动物源性成分检测结果
Table 2 Results of real-time PCR for animal-derived ingredients in quick-frozen food
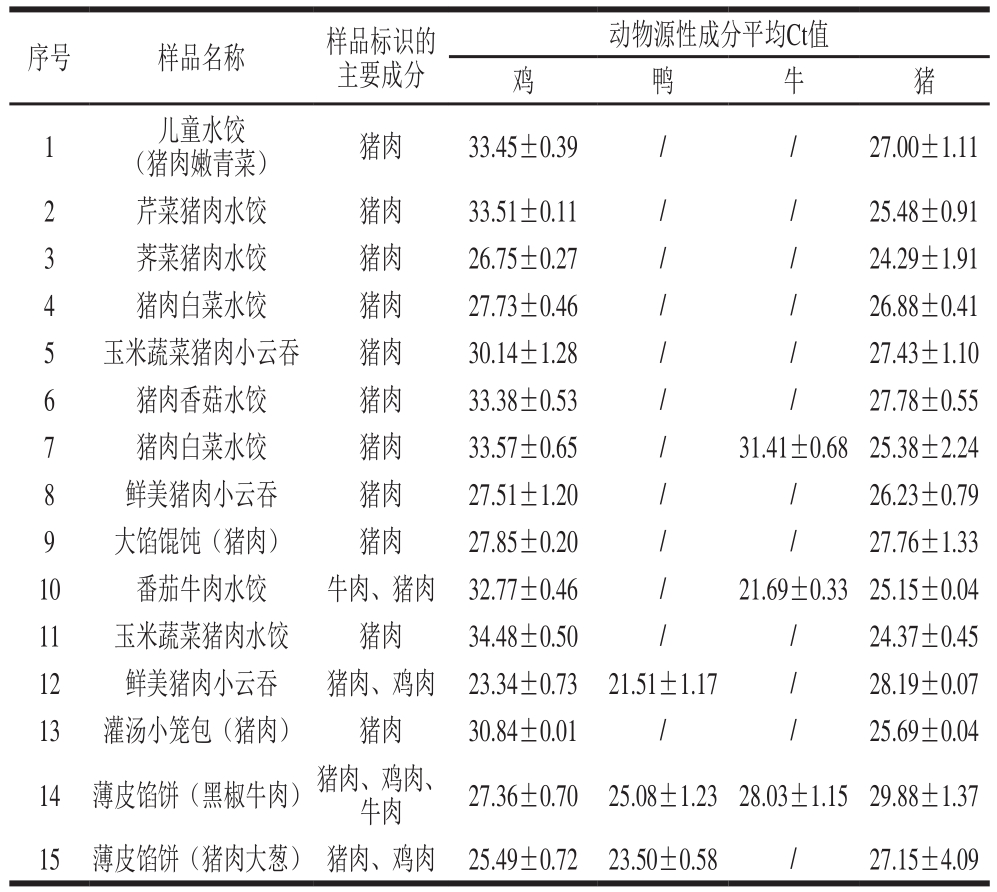
注:/. 未检出。
序号 样品名称 样品标识的主要成分 牛 猪1 儿童水饺(猪肉嫩青菜) 猪肉 33.45±0.39 / / 27.00±1.11 2 芹菜猪肉水饺 猪肉 33.51±0.11 / / 25.48±0.91 3 荠菜猪肉水饺 猪肉 26.75±0.27 / / 24.29±1.91 4 猪肉白菜水饺 猪肉 27.73±0.46 / / 26.88±0.41 5 玉米蔬菜猪肉小云吞 猪肉 30.14±1.28 / / 27.43±1.10 6 猪肉香菇水饺 猪肉 33.38±0.53 / / 27.78±0.55 7 猪肉白菜水饺 猪肉 33.57±0.65 / 31.41±0.6825.38±2.24 8 鲜美猪肉小云吞 猪肉 27.51±1.20 / / 26.23±0.79 9 大馅馄饨(猪肉) 猪肉 27.85±0.20 / / 27.76±1.33 10 番茄牛肉水饺 牛肉、猪肉 32.77±0.46 / 21.69±0.3325.15±0.04 11 玉米蔬菜猪肉水饺 猪肉 34.48±0.50 / / 24.37±0.45 12 鲜美猪肉小云吞 猪肉、鸡肉 23.34±0.73 21.51±1.17 / 28.19±0.07 13 灌汤小笼包(猪肉) 猪肉 30.84±0.01 / / 25.69±0.04 14 薄皮馅饼(黑椒牛肉)猪肉、鸡肉、牛肉 27.36±0.70 25.08±1.2328.03±1.1529.88±1.37 15 薄皮馅饼(猪肉大葱) 猪肉、鸡肉 25.49±0.72 23.50±0.58 / 27.15±4.09动物源性成分平均Ct值鸡鸭
3 讨 论
肉类掺假现象的存在不利于市场环境的公平、健康发展,涉及掺假售假的肉制品也将损害消费者的合法权益。众所周知,有宗教信仰人士和健身爱好者因自身需求会对牛肉、猪肉和鸡肉等肉制品进行严格的选择;过敏体质和疾病患者等特殊人群也需明确产品成分来规避误食风险。因此,对肉制品进行动物源性成分鉴定意义重大,已被列入我国食品安全风险的常规监测计划[27]。
高温、复杂的加工方式会造成源性成分DNA碎片化[28],从而降低检出率,导致误判,故现有大量肉源性成分检测方法主要针对热加工肉制品。然而,随着人们生活节奏的改变,速冻食品在肉类市场中的占比逐渐增大;且已有研究表明,长时间的冷冻保存也会导致源性成分DNA降解[29],因此针对速冻食品检测方法的研究至关重要。目前针对速冻食品中动物源性成分检测的报道较少,因此,本研究建立了一种可以同时对速冻食品中鸡、鸭、猪和牛源性成分进行检测的实时荧光PCR方法。
在动物源性成分的检测方法中,基于DNA扩增的分子生物学方法种类繁多且各有优势,然而实际检测工作中更需要一种简单、准确、经济、省时的方法。实时荧光PCR技术成本低,能在DNA部分降解的情况下获得足以进行扩增的片段基因[30],检测快速,因此被广泛应用于肉制品中动物源性成分的鉴定。本研究基于实时荧光PCR技术建立的同时检测鸡、鸭、猪和牛源性成分的检测方法,操作简单、检测时间较短,与常规的单一源性成分实时荧光PCR检测方法相比,检测时间从4 h减少到1 h,大大缩短了检测周期;使用异源性DNA来验证各对引物和相应探针的特异性,结果表明,本研究建立的鸡、鸭、猪和牛源性成分检测方法特异性强,能有效区分鸡、鸭、猪、牛和其他动物源性成分;对鸡、鸭、猪和牛源性成分的检测灵敏性可分别达到10.0、1.0、10.0、10.0 pg/μL,灵敏性良好。René等[31]建立的多重实时荧光PCR方法可检测到100.0 pg/μL的猪和牛源性DNA;Cheng Xin等[32]建立的同时检测鸡、鸭、猪成分的多重实时荧光PCR方法,对每种目标源性DNA的灵敏性为150.0 pg/μL,上述研究中检测方法的灵敏性均低于本研究。
根据石家庄市内不同农贸市场和超市速冻食品的销售情况,本研究选择涵盖市面上主要速冻食品品牌和种类的34 份样品,包括速冻水饺、馄饨(云吞)、小笼包和馅饼等。应用本研究建立的方法对市售34 份速冻食品进行鸡、鸭、猪和牛源性成分检测,结果表明,该方法能够实现对不同种类速冻食品中4 种肉类成分的有效检测,进一步分析发现,其中15 份速冻食品中检出的动物源性成分与食品外包装上标注的成分不一致,验证了该方法的实际应用效果。但本研究在检测过程中无法排除生产、贮藏、运输和销售等过程中样品交叉污染或原料混入造成的“假阳性”结果,考虑到生产线同时生产含其他肉类的产品,无法准确判断此次检测样品的情况属于“无意沾染”还是“恶意掺假”。因此,后续将进行动物源性成分的定量分析,以进一步准确判断。
4 结 论
本研究以鸡TGFB3基因、猪PRNP基因和鸭、牛GH基因为靶基因建立了一种能够同时检测速冻食品中鸡、鸭、猪和牛源性成分的实时荧光PCR方法,特异性强、灵敏性高,能够应用于速冻食品中鸡、鸭、猪和牛源性成分的检测。该方法操作简单、适用范围广,检测周期短,可为食品监管部门对速冻食品中肉类掺假检测提供有力的技术支持。
[1]SREENIVASAN T S, VILJOEN C D. Determining the presence of undeclared animal species using real-time PCR in canned and readyto-eat meat products in South Africa[J]. Journal of Food Science and Technology, 2021, 58(7): 2699-2704. DOI:10.1007/s13197-020-04776-w.
[2]LIU Guoqiang, LUO Jianxing, XU Weiliang, et al. Improved triplex real-time PCR with endogenous control for synchronous identification of DNA from chicken, duck, and goose meat[J]. Food Science and Nutrition, 2021, 9(6): 3130-3141. DOI:10.1002/fsn3.2272.
[3]AMARAL J S, SANTOS G, OLIVEIRA M B P, et al. Quantitative detection of pork meat by EvaGreen real-time PCR to assess the authenticity of processed meat products[J]. Food Control, 2017, 72:53-61. DOI:10.1016/j.foodcont.2016.07.029.
[4]金萍, 丁洪流, 李培, 等. 2013年苏州地区肉及其制品掺假情况调查[J]. 中国食品卫生杂志, 2014, 26(2): 168-172. DOI:10.13590/j.cjfh.2014.02.016.
[5]张媛媛, 孟镇, 仇凯, 等. 种属特异性PCR法鉴别罐头食品中猪、牛、羊、鸡、鸭源性成分[J]. 食品与发酵工业, 2021, 47(3): 164-169.DOI:10.13995/j.cnki.11-1802/ts.024477.
[6]杨冬燕, 杨永存, 李浩, 等. 双重PCR鉴别牛、羊肉掺假[J]. 中国卫生检验杂志, 2014, 24(23): 3379-3382.
[7]杨瑶, 斯能武, 严钰澳, 等. 实时荧光PCR定量检测肉制品中猪源性成分[J]. 食品工业科技, 2022, 43(3): 268-274. DOI:10.13386/j.issn1002-0306.2021050232.
[8]张颖颖, 赵文涛, 李慧晨, 等. 液相色谱串联质谱对掺假牛肉的鉴别及定量研究[J]. 现代食品科技, 2017, 33(2): 230-237. DOI:10.13982/j.mfst.1673-9078.2017.2.035.
[9]白京, 李家鹏, 邹昊, 等. 近红外特征光谱定量检测羊肉卷中猪肉掺假比例[J]. 食品科学, 2019, 40(2): 287-292. DOI:10.7506/spkx1002-6630-20180531-452.
[10]MARTIN D R, CHAN J, CHIU J Y. Quantitative evaluation of pork adulteration in raw ground beef by radial immunodiffusion and enzyme-linked immunosorbent assay[J]. Journal of Food Protection,1998, 61(12): 1686-1690. DOI:10.4315/0362-028x-61.12.1686.
[11]WANG Wenjun, WANG Xiaokang, ZHANG Qingde, et al.A multiplex PCR method for detection of five animal species in processed meat products using novel species-specific nuclear DNA sequences[J]. European Food Research and Technology, 2020, 246:1-10. DOI:10.1007/s00217-020-03494-z.
[12]CAI Shaoxin, KONG Fande, XU Shufei. Detection of porcine-derived ingredients from adulterated meat based on real-time loop-mediated isothermal amplification[J]. Molecular and Cellular Probes, 2020, 53:101609. DOI:10.1016/j.mcp.2020.101609.
[13]JONAS K, SUSANNE B, MATTHEW S F, et al. Recombinase polymerase amplification assays for the identification of pork and horsemeat[J]. Food Chemistry, 2020, 322: 126759. DOI:10.1016/j.foodchem.2020.126759.
[14]谷蒙林, 肖付刚, 王德国, 等. 核酸检测技术检测肉类种源研究进展[J]. 食品安全质量检测学报, 2021, 12(19): 7514-7519.DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.19.002.
[15]郭燕华, 陈遂, 王德莲, 等. 基于重组酶等温扩增技术快速检测生鲜肉中猪源性成分[J]. 食品安全质量检测学报, 2017, 8(6): 2012-2016.
[16]PRUSAKOVA O V, GLUKHOVA X A, AFANAS’EVA G V, et al.A simple and sensitive two-tube multiplex PCR assay for simultaneous detection of ten meat species[J]. Meat Science, 2018, 137: 34-40.DOI:10.1016/j.foodchem.2012.02.111.
[17]HAMADAH L, NUR T S, MOHAMMAD M H, et al. Development of fast and sensitive real-time qPCR assay based on a novel probe for detection of porcine DNA in food sample[J]. LWT-Food Science and Technology, 2017, 84: 686-692. DOI:10.1016/j.lwt.2017.06.043.
[18]YUNY E, MOHAMMAD Z A, EKO Y P M S, et al. Identification of pork contamination in meatballs of Indonesia local market using polymerase chain reaction-restriction fragment length polymorphism(PCR-RFLP) analysis[J]. Asian-Australasian Journal of Animal Sciences, 2014, 27(10): 1487-1492. DOI:10.5713/AJAS.2014.14014.
[19]YU Ning, REN Junan, HUANG Wensheng, et al. An effective analytical droplet digital PCR approach for identification and quantification of fur-bearing animal meat in raw and processed food[J]. Food Chemistry, 2021, 355: 129525. DOI:10.1016/j.foodchem.2021.129525.
[20]胡谦, 陈颖, 倪凯, 等. 肉制品异源基因检测技术研究进展[J]. 食品科学, 2018, 39(15): 275-282. DOI:10.7506/spkx1002-6630-201815040.
[21]任君安, 邓婷婷, 黄文胜, 等. 微滴式数字聚合酶链式反应精准定量检测羊肉中掺杂猪肉[J]. 食品科学, 2017, 38(2): 311-316.DOI:10.7506/spkx1002-6630-201702049.
[22]TEMISAK S, THANGSUNAN P, BOONNIL J, et al. Accurate determination of meat mass fractions using DNA measurements for quantifying meat adulteration by digital PCR[J]. International Journal of Food Science and Technology, 2021, 56(12): 6345-6358.DOI:10.1111/IJFS.15375.
[23]庞婕, 胥小荣, 孔庆岩, 等. 应用实时荧光PCR方法鉴别风干牛肉中的成分[J]. 食品安全导刊, 2021(24): 67-68. DOI:10.16043/j.cnki.cfs.2021.24.041.
[24]马炳存, 崔学文, 李琰歆, 等. 基于实时荧光聚合酶链式反应技术定量检测肉制品中动物源性成分研究进展[J]. 肉类研究, 2021, 35(7):44-49. DOI:10.7506/rlyj1001-8123-20210220-041.
[25]刘立兵, 陈敏娜, 孙晓霞, 等. 微滴式数字聚合酶链式反应对香肠制品中鸡、猪、牛源性成分的定量分析[J]. 肉类研究, 2020, 34(8):51-56. DOI:10.7506/rlyj1001-8123-20200508-115.
[26]刘立兵, 陈敏娜, 付琦, 等. 肉制品中鸭源性成分TaqMan探针实时荧光PCR检测方法的建立与应用[J]. 食品安全质量检测学报, 2021,12(8): 3048-3054. DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.08.012.
[27]王伊琴, 杨帆, 郭文丽, 等. 重组酶聚合酶等温扩增技术在动物源性成分鉴定中的应用[J]. 中国农学通报, 2020, 36(30): 151-157.
[28]MARÍA L, MIRIAM A, ISABEL G, et al. Detection and quantification of meat species by qPCR in heat-processed food containing highly fragmented DNA[J]. Food Chemistry, 2012, 134(1): 518-523.DOI:10.1016/j.foodchem.2012.02.111.
[29]ALI MUHAMMED M, SRI CHARAN BINDU B, JINI R, et al.Evaluation of different DNA extraction methods for the detection of adulteration in raw and processed meat through polymerase chain reaction-restriction fragment length polymorphism (PCR-RFLP)[J].Journal of Food Science and Technology, 2015, 52(1): 514-520.DOI:10.1007/s13197-013-1024-9.
[30]HIRD H, CHISHOLM J, SANCHEZ A, et al. Effect of heat and pressure processing on DNA fragmentation and implications for the detection of meat using a real-time polymerase chain reaction[J]. Food Additives and Contaminants, 2006, 23(7): 645-650.DOI:10.1080/02652030600603041.
[31]RENÉ K, FRANZISKA V V, ARTHIKA G, et al. Multiplex realtime PCR for the detection and quantification of DNA from chamois,roe, deer, pork and beef[J]. European Food Research and Technology,2020, 246: 1-9. DOI:10.1007/s00217-020-03468-1.
[32]CHENG Xin, HE Weiling, HUANG Feng, et al. Multiplex real-time PCR for the identification and quantification of DNA from duck, pig and chicken in Chinese blood curds[J]. Food Research International,2014, 60: 30-37. DOI:10.1016/j.foodres.2014.01.047.