我国是肉类生产与消费大国,肉类总产量和总消费量位居世界第一[1]。猪肉肉质鲜嫩,蛋白质和脂肪含量丰富,深受消费者喜爱[2]。冰温保鲜是指将肉品贮藏于0 ℃以下、冰点以上温度范围内的贮藏技术[3],在保持细胞的完整性、抑制酶活性及微生物生长方面效果显著[4-5],可有效保持肉品品质、延长货架期[6]。但冰温贮藏条件较难控制,温度范围较窄,限制了其大规模产业应用[7]。研究发现,电场可调节生鲜肉冰点[8],电场辅助冰温贮藏保鲜技术受到广泛关注。
目前,研究较多的电场类型为交变电场和静电场,其中交变电场以日本DENBA鲜度保持电场装置为代表,其电场强度随时间不断变化[9];而静电场通过直流电源输出稳定电压,电场强度不随时间发生变化[10]。岑剑伟等[11]研究发现,高压静电场辅助冰温结合气调包装贮藏可有效抑制罗非鱼片的微生物生长,使汁液损失率及挥发性盐基氮含量保持在较低水平,货架期也得到有效延长。段伟文等[12]研究发现,静电场结合冰温和气调包装贮藏对凡纳滨对虾的保鲜效果较好,可有效抑制贮藏期间微生物的生长繁殖及汁液流失,货架期可达14 d。胡斐斐等[13]研究表明,低压交变电场辅助冷藏可有效抑制牛肉贮藏期间菌落总数和挥发性盐基氮含量的增加,降低贮藏损失和蒸煮损失,货架期可达9 d。综上,已有研究表明交变电场和静电场辅助对生鲜肉持水力有较好的保持效果,但目前关于二者的影响差异尚不明确。
因此,本研究以猪背最长肌为实验材料,探究不同类型电场辅助冰温(-1.0±0.5) ℃贮藏对猪肉保水性的影响,以期为电场辅助冰温贮藏的应用提供理论依据和参考。
1 材料与方法
1.1 材料与试剂
6 月龄、胴体质量约为75 kg的4 头杜长大公猪背最长肌购于北京顺鑫农业股份有限公司鹏程食品分公司。
BCA蛋白定量试剂盒 美国Thermo Scientific 公司;盐酸、无水乙醇、乙酸、十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 国药集团化学试剂(北京)有限公司。
1.2 仪器与设备
K型热电偶、LK-1048U多路温度巡检仪 常州市蓝光电子有限公司;JYH-66恒温恒湿培养箱、JYH-103恒温恒湿培养箱 上海跃进医疗器械有限公司;HH-4S数显恒温水浴锅 江苏省金坛市荣华仪器制造有限公司;ML204电子天平 梅特勒-托利多仪器(上海)有限 公司;DENBA-2.0鲜度保持电场装置(由电场发生装置(220 V、50 Hz)和放电板(140 mm×120 mm)组成,输出电压3 300~4 000 V、电流0.04 A) 日本Agua商事株式会社;TCM6000i高压直流电源(输入:220 V、50 Hz;输出:3 800 V、1 mA) 大连泰思曼高压电源有限公司;DHG-9140AS电热恒温鼓风干燥箱 宁波江南仪器厂;NMI20-040H-I核磁共振成像分析仪 苏州纽迈分析仪器股份有限公司;SpectraMax 190全波长酶标仪 美国Molecular Devices公司;Neofuge15R台式高速冷冻离心机 上海力申科学仪器有限公司;Mini-PROTEAN Tetra System电泳设备、ChemiDocTM MP成像系统 美国Bio-Rad公司。
1.3 方法
1.3.1 样品采集
杜长大公猪屠宰放血后,半胴体于-28 ℃冷风隧道中快速冷却1.5 h,随后转入0~4 ℃冷却间冷却12 h。冷却结束后取一侧背最长肌,去除可见脂肪和筋膜组织,装入无菌袋后置于布满冰袋的保温箱(0~4 ℃)中,2 h内运回实验室。将每条猪背最长肌分成13 块,每块约70 g(5 cm×5 cm×3 cm),分为3 个处理组进行贮藏:交变电场辅助冰温(-1.0±0.5) ℃、静电场辅助冰温、普通冰温(对照组)。分别在贮藏0、2、4、6、8 d取样,立即进行水分含量、贮藏损失、蒸煮损失、横向弛豫时间T2的测定,并将剩余样品置于液氮中冻存,用于蛋白质表面疏水性及蛋白质组成的测定。
电场装置由电场发生装置和放电板组成,放电板在冰温(-1.0±0.5) ℃箱内产生交变电场和静电场,放电板水平放置,肉样与放电板间隔20 cm平行放置。
1.3.2 指标测定
1.3.2.1 冰点测定
参照荆红彭[14]的方法稍作修改,将生鲜猪肉切成规格约为2 cm×2 cm×1 cm肉块,将热电偶探头插入肉块中心深度约0.5 cm,用塑料托盘盛装后放入-5 ℃恒温恒湿培养箱中降温,开启多路温度巡检仪测定并记录其温度变化,读数精度为0.1 ℃,每1 s记录1 次数据。
1.3.2.2 水分含量测定
参照GB 18394—2020《畜禽肉水分限量》中的直接干燥法测定水分含量。
1.3.2.3 贮藏损失测定
称量肉样贮藏前后质量,m1为贮藏前肉样的质 量(g),m2为贮藏后肉样的质量(g),贮藏损失按 式(1)计算。
1.3.2.4 蒸煮损失测定
参考Yan Tongjing等[15]的方法对样品规格稍作修改,称取约25 g肉块,质量记为m1(g),放入蒸煮袋内并密封袋口,71 ℃水浴35 min后流水冷却30 min,取出肉样后滤纸擦干表面水分并称质量,记为m2(g),蒸煮损失按式(2)计算。
1.3.2.5 横向弛豫时间T2测定
参照王旭等[16]的方法对肉样规格稍作修改,将肉样切成约2 cm×2 cm×1 cm的立方体,置于测样管中,测定氢质子低场核磁共振波谱。实验参数如下:磁场强度0.5 T,质子共振频率23 MHz,90°脉冲时间9 μs,180°脉冲时间18 μs,采样点数59 990,重复时间3 000 ms,回波数2 000。将信号值进行反演得到T2反演谱。
1.3.2.6 肌原纤维蛋白表面疏水性测定
1 g肉样切碎后加入6 mL预冷的缓冲液(含0.1 mol/L Tris、0.01 mol/L二硫苏糖醇),冰浴匀浆(15 000 r/min,15 s/次,3 次,间隔15 s)后,4 ℃、10 000×g离心30 min,沉淀溶于8 mL 5 g/100 mL SDS溶液,匀浆30 s后置于80 ℃水浴加热20 min即为肌原纤维蛋白溶液,超纯水稀释20 倍后,用BCA法测定蛋白质量浓度,并将肌原纤维蛋白质量溶度调至2 mg/mL,-80 ℃保存备用。
参考卢骁等[17]的方法,在1 mL 2 mg/mL的肌原纤维蛋白溶液中加入40 μL 1 mg/mL的溴酚蓝溶液,室温下静置15 min后离心(3 000×g、15 min、4 ℃),取上清液在595 nm波长处测定吸光度。对照组为1 mL 20 mmol/L磷酸盐缓冲液(pH 6.5),肌原纤维蛋白表面疏水性以溴酚蓝结合量表示,按式(3)计算。
1.3.2.7 蛋白组成测定
参考Xia Xiufang等[18]的方法,进行SDS-PAGE测定。采用10%分离胶和5%浓缩胶,上样量3 μg。先在恒压90 V电泳30 min后恒压130 V继续电泳,直到样品移至分离胶底部。取出胶片后考马斯亮蓝染色12 h,脱色5 h至条带清晰可见,拍照观察。
1.4 数据处理
通过Excel和Origin 2018软件进行数据处理及作图,结果以平均值±标准差表示,采用SPSS 22.0软件对数据进行方差分析,选用Duncan’s法进行多重比较分析, 以P<0.05作为差异显著性判断标准。
2 结果与分析
2.1 生鲜猪肉冰点的测定
由图1可知,在整个降温过程中,猪肉的中心温度在降温初期快速下降,当猪肉中心温度下降到-1.7~ -1.8 ℃时温度变化较为平缓,此后温度继续下降,由此确定-1.7~-1.8 ℃为猪肉的冰点温度。冰温贮藏是将肉品置于0 ℃以下、冰点以上的温度范围内贮藏,因此选 择-1 ℃作为猪肉冰温贮藏的温度。
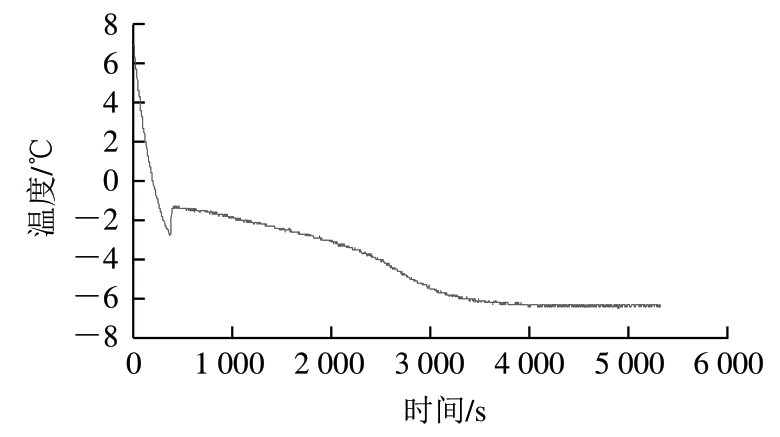
图1 猪肉降温曲线
Fig. 1 Cooling curve of fresh pork
2.2 不同类型电场辅助冰温贮藏对生鲜猪肉水分含量的影响
由图2可知,贮藏初期,生鲜猪肉的水分含量为73%,交变电场和静电场处理组贮藏8 d分别为69%和70%,对照组降至65%。随着贮藏时间的延长,3 个处理组水分含量呈下降趋势。水分含量受很多因素影响,包括肌肉组织的不同处理方式和生化变化等都会引起肌肉水分的流失[19]。贮藏4~8 d,对照组水分含量显著低于交变电场和静电场处理组(P<0.05),但交变电场和静电场处理组之间无显著差异,上述结果表明电场辅助冰温贮藏可在一定程度上减少猪肉水分含量的损失。
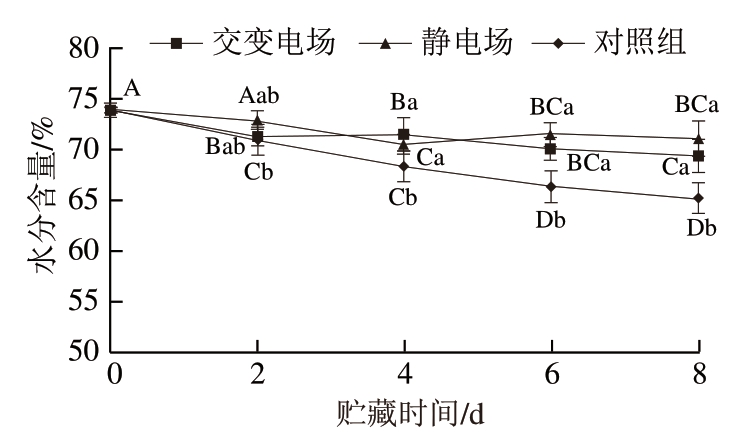
图2 不同类型电场辅助冰温贮藏对生鲜猪肉水分含量的影响
Fig. 2 Effect of different types of electric field combined with controlled freezing-point storage on water content of fresh pork
大写字母不同,表示同一贮藏条件、不同贮藏时间差异显著(P<0.05);小写字母不同,表示同一贮藏时间、不同贮藏条件差异显著(P<0.05)。图3~4、6同。
2.3 不同类型电场辅助冰温贮藏对生鲜猪肉贮藏损失和蒸煮损失的影响
由图3可知,随贮藏时间的延长,3 个处理组贮藏损失呈增加趋势,与胡斐斐等[20]对冻藏猪肉的研究结果一致。贮藏2、6、8 d,对照组贮藏损失显著高于交变电场和静电场处理组(P<0.05),但交变电场和静电场处理组之间无显著差异。冰温贮藏过程中,在内源性蛋白酶系统的作用下,肌原纤维蛋白发生降解,导致肌原纤维蛋白的结构被破坏,减弱了肌原纤维蛋白对水的束缚能力,促使水分从肌纤维内部向外部迁移,导致汁液损失[21]。
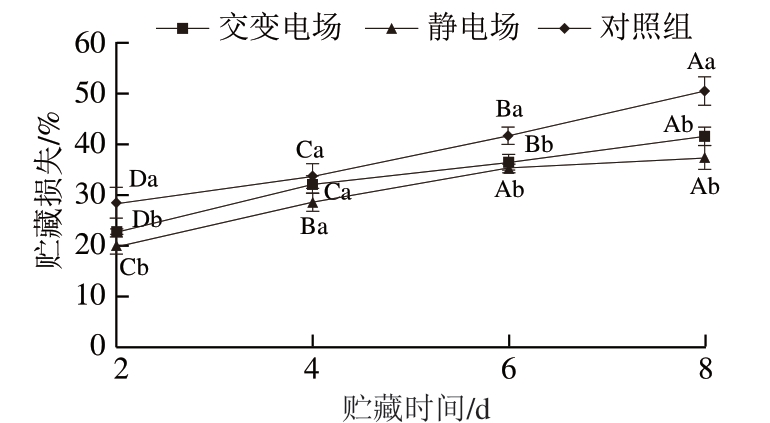
图3 不同类型电场辅助冰温贮藏对生鲜猪肉贮藏损失的影响
Fig. 3 Effect of different types electric fields combined with controlled freezing-point storage on storage loss of fresh pork
由图4可知,随着贮藏时间的延长,3 个处理组蒸煮损失呈现先减小后增大趋势,在蒸煮过程中,肌原纤维蛋白热变性程度决定了肌肉的保水能力,肌纤维随蒸煮温度的上升完全变性,产生较大的压力和张力,使得肌肉中水分不断溢出,增大蒸煮损失[22]。贮藏0~4 d,蒸煮损失降低可能是因为肉样裸露置于冰温箱中,肉表面发生了风干现象,蒸煮时肉块表面水分损失较少,因此蒸煮损失降低。贮藏后期,随贮藏时间的延长,肌原纤维蛋白束缚水能力下降,蒸煮损失增大。在整个贮藏期间,对照组蒸煮损失高于交变电场和静电场处理组,但交变电场和静电场处理组之间无显著差异。
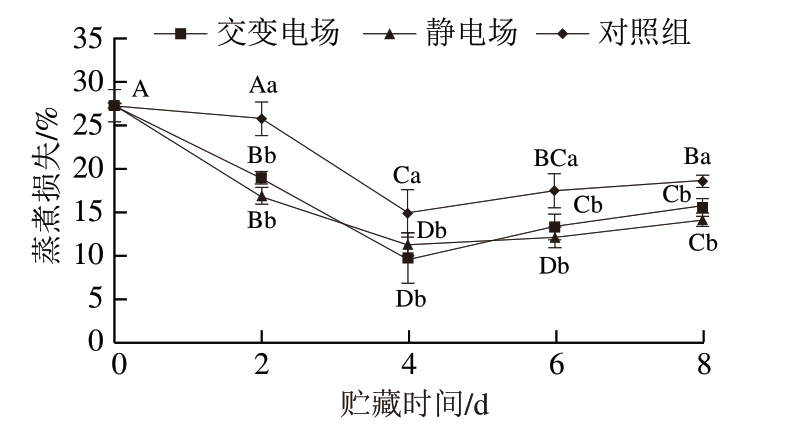
图4 不同类型电场辅助冰温贮藏对生鲜猪肉蒸煮损失的影响
Fig. 4 Effect of different types electric field combined with controlled freezing-point storage on cooking loss of fresh pork
上述研究结果表明,电场辅助冰温贮藏可在一定程度上减少生鲜猪肉贮藏过程中的汁液流失。可能是因为肌肉中水分子的氢键结构在外加电场的影响下不断重复地形成与断裂,使得水分子结构及其与肌肉蛋白的结合状态发生改变,降低了肌肉中水分流动性[23];此外,随着电场中带电粒子的活动,水分子与带电粒子产生共振作用,使得水分子与酶的结合状态发生改变,间接影响酶分子中心构象的变化,最终导致酶钝化和失活,从而达到稳定肉品持水力的目的[24]。
2.4 不同类型电场辅助冰温贮藏对生鲜猪肉横向弛豫 时间T2的影响
由图5可知,3 个峰分别代表结合水(T2b)、不易流动水(T21)和自由水(T22),峰面积比例P2表示3 种形式水的相对含量。由表1可知,随着贮藏时间的延长,交变电场、静电场处理组及对照组不易流动水弛豫峰面积比例P21呈降低趋势,自由水弛豫峰面积比例P22呈增长趋势。可能是因为在贮藏过程中,一系列反应导致肌纤维结构被破坏,使得不易流动水不断迁移,自由水相对含量增加,从而导致汁液损失率上升[25];贮藏4~8 d,交变电场和静电场处理组P21显著高于对照组(P<0.05),肌肉对不易流动水的保持能力决定肉的持水力,相较于对照组,电场处理组不易流动水含量更高,说明电场处理组肉样的持水能力更强;贮藏4 d和8 d,交变电场和静电场处理组P22显著低于对照组(P<0.05),静电场处理组P22显著高于交变电场处理组(P<0.05),自由水存在于肌细胞外和肌束外间隙,这部分水自由度大、与底物结合能力弱,流动性较强,易受贮藏温度、时间和外力等因素的影响,自由水相对含量越高,肉的保水性越差[26-27]。
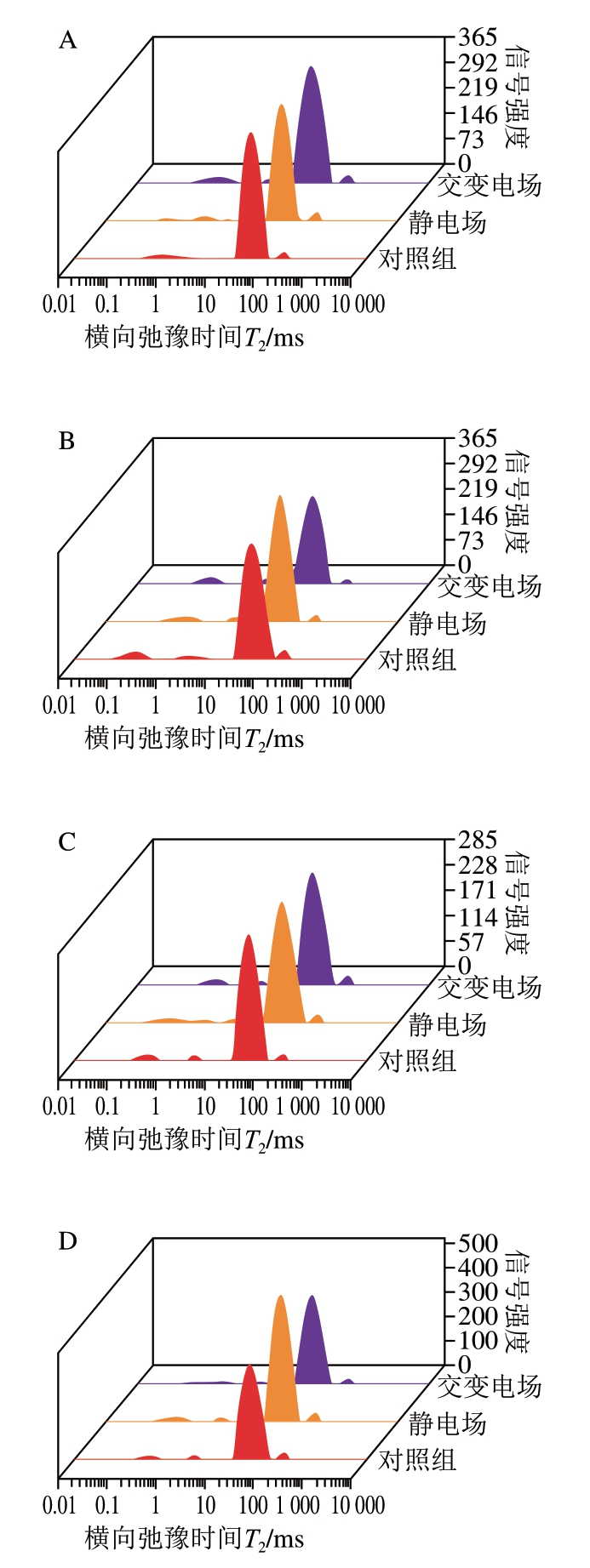
图5 不同类型电场辅助冰温贮藏对生鲜猪肉横向弛豫时间T2的影响
Fig. 5 Effect of different types electric field combined with controlled freezing-point storage on T2 of fresh pork
A~D. 贮藏时间2、4、6、8 d。
表1 不同类型电场辅助冰温贮藏对生鲜猪肉弛豫峰面积比例P2的影响
Table 1 Effect of different types electric field combined with controlled freezing-point storagee on P2 of fresh pork%
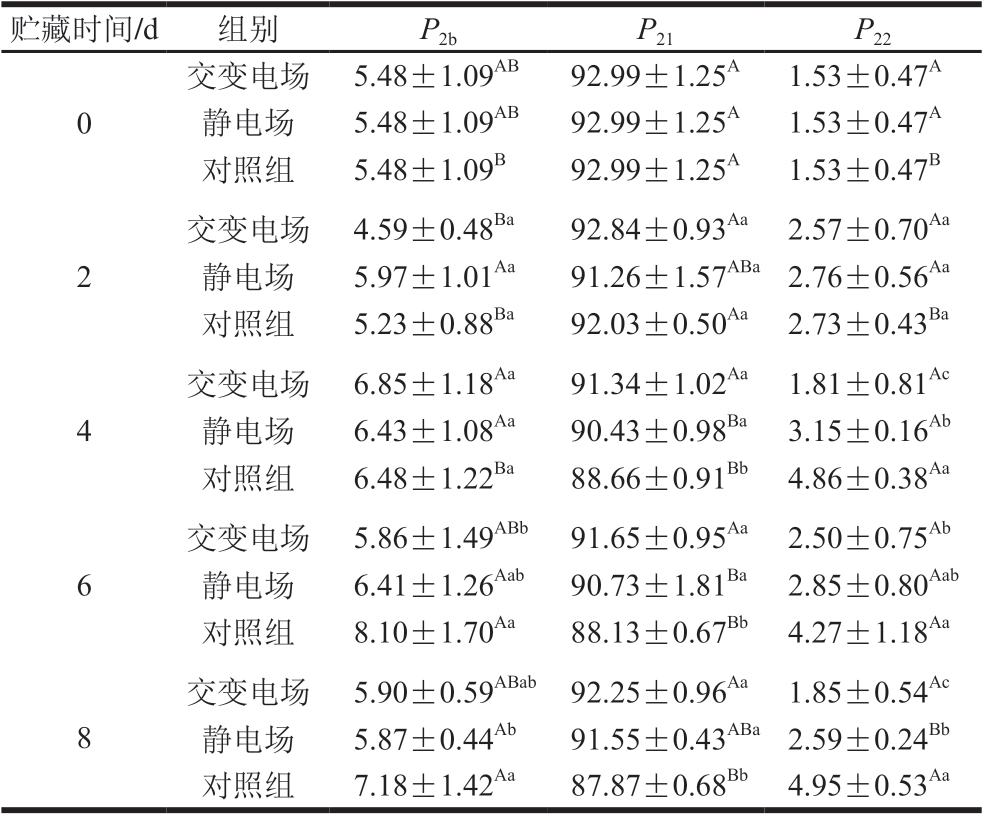
注:同列大写字母不同,表示同一贮藏条件、不同贮藏时间差异 显著(P<0.05);同列小写字母不同,表示同一贮藏时间、不同贮藏条件差异显著(P<0.05)。
2.5 不同类型电场辅助冰温贮藏对生鲜猪肉肌原纤维 蛋白表面疏水性的影响
由图6可知,随着贮藏时间的延长,交变电场、静电场处理组及对照组肌原纤维蛋白表面疏水性均呈上升趋势,这与卢骁等[17]对牛肉的研究结果基本一致。贮藏初期,猪肉肌原纤维蛋白与溴酚蓝结合量为8.7 μg,交变电场和静电场处理组贮藏8 d后分别为15.8 μg和16.2 μg,对照组达到了18.8 μg。贮藏4~8 d,交变电场和静电场处理组肌原纤维蛋白与溴酚蓝结合量显著低于对照组 (P<0.05),但2 个处理组之间无显著差异,说明对照组蛋白质变性程度高于交变电场和静电场处理组。分析原因可能是肌原纤维蛋白在贮藏过程中由于多种因素的影响导致其分子链展开,使得内部的非极性氨基酸残基暴露,进而导致肌原纤维蛋白表面疏水性上升[28]。肌原纤维蛋白的水合能力随肌原纤维蛋白表面疏水性的上升而减弱,部分不易流动水转化为自由水,从而造成肉品保水能力降低。这也进一步验证了弛豫峰面积比例P2的变化。
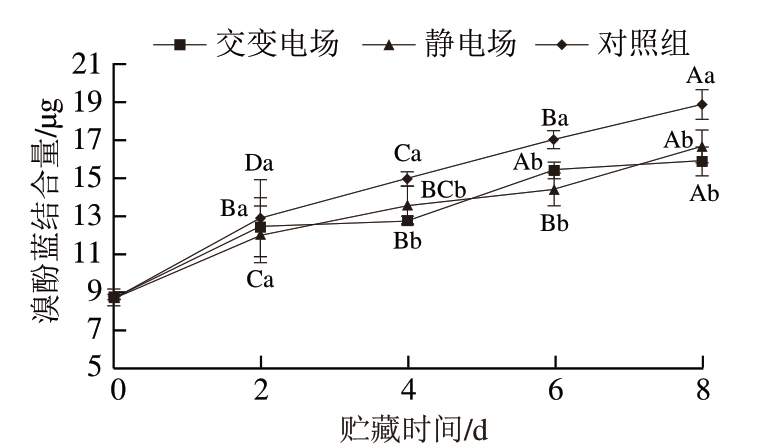
图6 不同类型电场辅助冰温贮藏对生鲜猪肉肌原纤维 蛋白表面疏水性的影响
Fig. 6 Effect of different types electric field combined with controlled freezing-point storage on surface hydrophobicity of myofibrillar protein in fresh pork
2.6 不同类型电场辅助冰温贮藏生鲜猪肉肌原纤维蛋白SDS-PAGE图谱的变化
由图7可知,对比0 d,随着贮藏时间的延长,引起肌球蛋白重链(180 kDa)的变化,说明在贮藏过程中,细胞内源酶系统会降解肌原纤维蛋白,使蛋白小分子化,产生更多的蛋白片段和小分子片段。有研究表明,肌球蛋白稳定性较差,在贮藏过程中易发生降解[29-30]。 与对照组相比,电场处理组在贮藏后期蛋白聚集减少,这可能是由于电场可以减少肌球蛋白重链的降解,维持肌球蛋白的稳定性。α-辅肌动蛋白(100 kDa)在贮藏后期出现,这可能是由于贮藏后期μ-钙蛋白酶参与了肌原纤维蛋白的降解,断裂产生新的小分子片段。对比冰温处理组,电场处理组的α-辅肌动蛋白条带色泽较浅,这可能是由于外加电场影响μ-钙蛋白酶活性,加强肌原纤维蛋白中各个小分子蛋白的交联能力。肌钙蛋白Ⅰ(20 kDa)在贮藏2 d后逐渐分解出新的肽段,在贮藏8 d时更加明显,说明肌钙蛋白Ⅰ在宰后贮藏期间发生降解,相较于电场处理组,对照组的条带更加明显,分析原因可能是电场辅助冰温贮藏维持了肌钙蛋白的稳定,减缓了肌原纤维蛋白在贮藏过程中的降解。
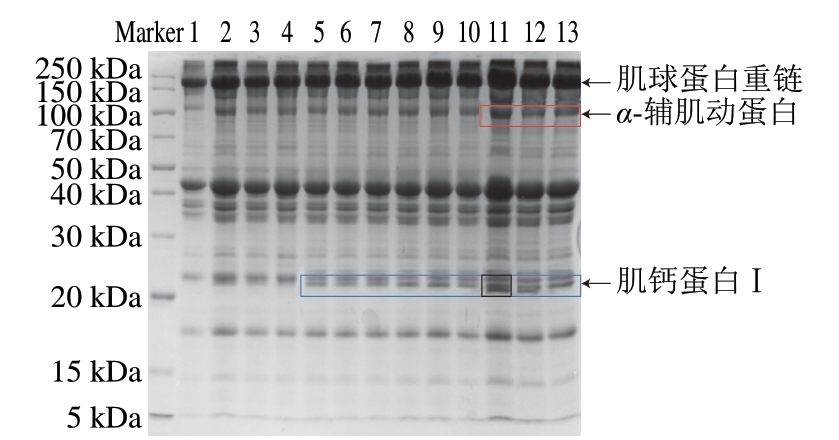
图7 不同类型电场辅助冰温贮藏对生鲜猪肉肌原纤维蛋白 SDS-PAGE图谱的影响
Fig. 7 Effect of different types electric field combined with controlled freezing-point storage on SDS-PAGE profile of myofibrillar protein in fresh pork
泳道1. 贮藏0 d;2~4、5~7 、8~10、11~13. 贮藏2、4、6、8 d的对照组、交变电场处理组、静电场处理组。
在本研究中,交变电场和静电场处理组不易流动水含量高于对照组,电场处理组猪肉的贮藏损失和蒸煮损失低于对照组,3 个处理组猪肉肌原纤维蛋白在贮藏期内出现了不同程度降解,对照组肌原纤维蛋白的变性程度较高,说明电场辅助对猪肉的保水性有一定的维持作用。随贮藏时间的延长,蛋白质变性程度提升了肌原纤维蛋白网络中不易流动水的自由度,不易流动水转化为自由水,导致对照组较差的保水性。电场辅助冰温贮藏维持了猪肉肌原纤维蛋白的稳定,延缓其降解,使得电场处理组猪肉保水性较好。
2.7 不同类型电场辅助冰温贮藏生鲜猪肉保水性指标 聚类分析
为进一步分析不同类型电场辅助冰温贮藏对生鲜猪肉保水性的影响,对交变电场辅助冰温、静电场辅助冰温、普通冰温3 个处理组生鲜猪肉贮藏期间保水性相关指标进行聚类分析。由图8可知,依据保水性变化,贮藏2 d的3 个处理组可聚为一类,表明贮藏前期3 个处理组之间无明显不同。贮藏4~8 d,交变电场和静电场处理组可聚为一类,对照组聚为一类,表明在贮藏后期3 个处理组随贮藏时间的延长保水性变化不大。整体来看,聚类分析将贮藏2~8 d的交变电场和静电场处理组与贮藏4~8 d的对照组进行了区分,说明交变电场和静电场2 个处理组保水性无明显不同,但均与对照组存在显著差异。从纵向聚类结果可以看出,水分含量与不易流动水峰面积比例P21的变化趋势相似,聚为一类,说明不易流动水含量变化与水分含量变化高度相关。
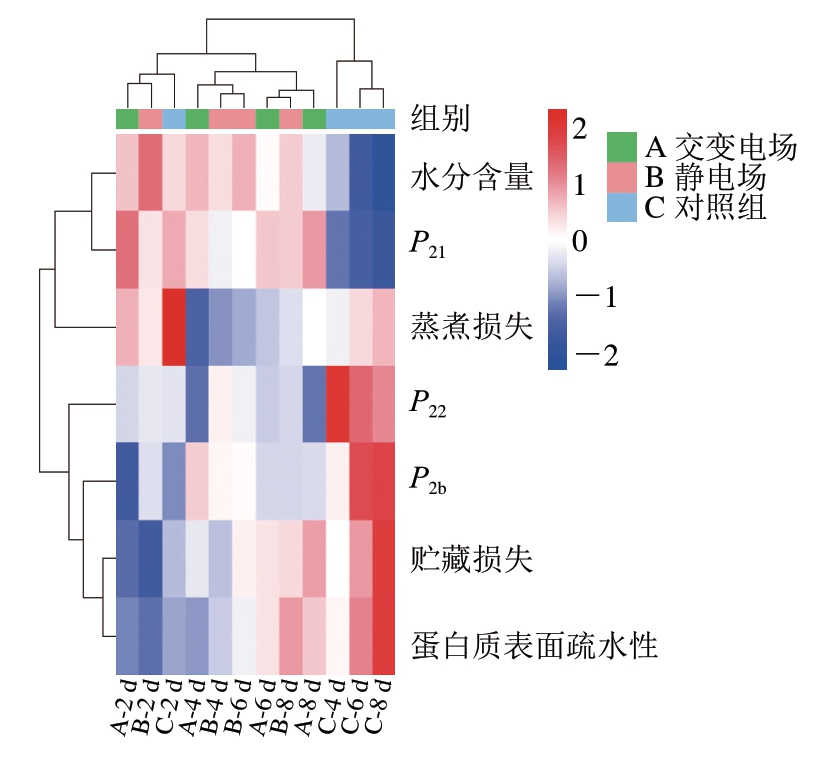
图8 不同类型电场辅助冰温贮藏生鲜猪肉保水性指标聚类分析
Fig. 8 Cluster analysis of water retention properties of fresh pork stored under controlled freezing point condition with different types of electric field
3 结 论
交变电场和静电场辅助冰温可减少生鲜猪肉贮藏过程中的汁液损失。随着贮藏时间的延长,生鲜猪肉蒸煮损失、贮藏损失、肌原纤维蛋白表面疏水性及降解程度均呈上升趋势,不易流动水逐渐转化为自由水,水分流动性增加。相比对照组,交变电场和静电场辅助冰温贮藏可延缓肌原纤维蛋白降解及不易流动水向自由水转化,从而提高生鲜猪肉的保水性,降低猪肉的汁液损失,但输出电压为3 300~4 000 V所产生的交变电场和输出电压为3 800 V所产生的静电场对猪肉保水性的影响效果区别不大。
[1] 张德权, 侯成立. 热鲜肉与冷却肉品质差异之管见[J]. 肉类研究, 2020, 34(5): 83-90. DOI:10.7506/rlyj1001-8123-20200220-041.
[2] 李丹丹, 郑丽, 刘雨晗, 等. 猪肉生物保鲜技术研究进展[J]. 肉类研究, 2020, 34(11): 98-105. DOI:10.7506/rlyj1001-8123-20200923-231.
[3] 李培迪, 李欣, 李铮, 等. 冰温贮藏对宰后肌肉成熟进程的影响[J]. 中国农业科学, 2016, 49(3): 554-562. DOI:10.3864/j.issn.0578-1752.2016.03.013.
[4] LI Xin, ZHANG Yan, LI Zheng, et al. The effect of temperature in the range of -0.8 to 4 ℃ on lamb meat color stability[J]. Meat Science, 2017, 134: 28-33. DOI:10.1016/j.meatsci.2017.07.010.
[5] LU Xiao, ZHANG Yiming, ZHU Lixian, et al. Effect of superchilled storage on shelf life and quality characteristics of M. longissimus lumborum from Chinese Yellow cattle[J]. Meat Science, 2019, 149: 79-84. DOI:10.1016/j.meatsci.2018.11.014.
[6] LIU Dekun, XU Congcong, GUO Chunxia, et al. Sub-zero temperature preservation of fruits and vegetables: a review[J]. Journal of Food Engineering, 2019, 275(4): 109881. DOI:10.1016/j.jfoodeng.2019.109881.
[7] 陈雪, 罗欣, 朱立贤, 等. 牛羊肉冰温保鲜技术研究进展[J]. 食品科学, 2019, 40(7): 314-319. DOI:10.7506/spkx1002-6630-20180123-313.
[8] MOK J H, HER J Y, KANG T Y, et al. Effects of pulsed electric field (PEF) and oscillating magnetic field (OMF) combination technology on the extension of supercooling for chicken breasts[J]. Journal of Food Engineering, 2017, 196(3): 27-35. DOI:10.1016/j.jfoodeng.2016.10.002.
[9] 魏国平, 冯志刚, 熊双丽, 等. DENBA+静电场猪肉保鲜效果研究[J]. 现代食品, 2019(23): 99-102. DOI:10.16736/j.cnki.cn41-1434/ts.2019.23.031.
[10] HSIEH C W, LAI C H, LEE C H, et al. Effects of high-voltage electrostatic fields on the quality of tilapia meat during refrigeration[J]. Journal of Food Science, 2011, 76(6): 312-317. DOI:10.1111/j.1750-3841.2011.02218.x.
[11] 岑剑伟, 蒋爱民, 李来好, 等. 高压静电场结合冰温技术对罗非鱼片贮藏期品质的影响[J]. 食品科学, 2016, 37(22): 282-288. DOI:10.7506/spkx1002-6630-201622043.
[12] 段伟文, 全沁果, 高静, 等. 低压静电场结合气调包装对凡纳滨对虾冰温贮藏期品质的影响[J]. 食品科学, 2019, 40(13): 252-259. DOI:10.7506/spkx1002-6630-20180805-041.
[13] 胡斐斐, 钱书意, 李侠, 等. 低压静电场辅助冷藏对牛肉品质的影响[J]. 食品科学, 2021, 42(1): 132-138. DOI:10.7506/spkx1002-6630-20200106-071.
[14] 荆红彭. 猪肉超冰温保鲜技术研究[D]. 天津: 天津商业大学, 2015: 8. DOI:10.7666/d.D652515.
[15] YAN Tongjing, HOU Chengli, WANG Zhenyu, et al. Effects of chilling rate on progression of rigor mortis in postmortem lamb meat[J]. Food Chemistry, 2022, 373: 131463. DOI:10.1016/j.foodchem.2021.131463.
[16] 王旭, 张德权, 赵莹鑫, 等. 干法成熟过程羊腿肉持水能力与水分迁移规律[J]. 中国农业科学, 2021, 54(1): 179-189. DOI:10.3864/j.issn.0578-1752.2021.01.013.
[17] 卢骁, 董鹏程, 张一敏, 等. 微冻贮藏对牛肉保水性的影响[J]. 食品科学, 2021, 42(7): 253-259. DOI:10.7506/spkx1002-6630-20200330-430.
[18] XIA Xiufang, KONG Baohua, LIU Qian, et al. Physicochemical change and protein oxidation in porcine Longissimus dorsi as influenced by different freeze-thaw cycles[J]. Meat Science, 2009, 83(2): 239-245. DOI:10.1016/j.meatsci.2009.05.003.
[19] KRISTENSEN L, PURSLOW P P. The effect of ageing on the waterholding capacity of pork: role of cytoskeletal proteins[J]. Meat Science, 2001, 58(1): 17-23. DOI:10.1016/s0309-1740(00)00125-x.
[20] 胡斐斐, 钱书意, 黄峰, 等. 低压静电场辅助短期冻藏对猪肉品质的影响[J]. 中国农业科学, 2021, 54(9): 1993-2005. DOI:10.3864/j.issn.0578-1752.2021.09.015.
[21] MELODY J L, LONERGAN S M, ROWE L J, et al. Early postmortem biochemical factors influence tenderness and water-holding capacity of three porcine muscles[J]. Journal of Animal Science, 2004, 82(4): 1195-1205. DOI:10.1093/ansci/82.4.1195.
[22] 郭兆斌, 余群力, 陈骋, 等. 宰后牦牛肉水分分布变化与持水性能关系研究[J]. 农业机械学报, 2019, 50(10): 343-351. DOI:10.6041/j.issn.1000-1298.2019.10.040.
[23] JIA G, NIRASAWA S, JI X, et al. Physicochemical changes in myofibrillar proteins extracted from pork tenderloin thawed by a highvoltage electrostatic field[J]. Food Chemistry, 2018, 240(1): 910-916. DOI:10.1016/j.foodchem.2017.07.138.
[24] JIA Guoliang, HAN Hao, LIU Haiji, et al. Estimating the structure of sarcoplasmic proteins extracted from pork tenderloin thawed by a highvoltage electrostatic field[J]. Journal of Food Science and Technology, 2020, 57(4): 1574-1578. DOI:10.1007/s13197-020-04253-4.
[25] BERTRAM H C, SCHFER A, ROSENVOLD K, et al. Physical changes of significance for early post mortem water distribution in porcine M. longissimus[J]. Meat Science, 2004, 66(4): 915-924. DOI:10.1016/j.foodchem.2017.07.138.
[26] 甄少波, 刘奕忍, 郭慧媛, 等. 低场核磁共振分析猪肉宰后成熟过程中的水分变化[J]. 食品工业科技, 2017, 38(22): 67-70. DOI:10.13386/j.issn1002-0306.2017.22.014.
[27] LI Xia, WEI Xiuli, WANG Hang, et al. Relationship between protein denaturation and water holding capacity of pork during postmortem ageing[J]. Food Biophysics, 2017, 13(75): 18-24. DOI:10.1007/s11483-017-9507-2.
[28] ILHAM C, PHILIPPE G, VÉRONIQUE S L, et al. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683. DOI:10.1016/j.meatsci.2006.05.019.
[29] 陈立娟, 李欣, 李铮, 等. 蛋白质磷酸化调控羊肉肌原纤维蛋白的功能[J]. 中国农业科学, 2016, 49(7): 1360-1370. DOI:10.3864/j.issn.0578-1752.2016.07.012.
[30] XIE Yong, CHEN Bo, GUO Jie, et al. Effects of low voltage electrostatic field on the microstructural damage and protein structural changes in prepared beef steak during the freezing process[J]. Meat Science, 2021, 179(2):108527. DOI:10.1016/j.meatsci.2021.108527.