蛋白质磷酸化反应是指由蛋白激酶催化的、将ATP或三磷酸鸟苷上γ位的磷酸基转移到底物蛋白质丝氨酸、苏氨酸和酪氨酸等残基侧链上的过程,在哺乳动物细胞内有1/3以上的蛋白质可以被磷酸化[1]。蛋白质磷酸化反应可以调节如信号传导、细胞凋亡、肌肉收缩等一系列新陈代谢活动[2],而在宰后肌肉向可食用肉转变的过程中,这些新陈代谢活动能够很大程度影响肉品品质,包括嫩度、保水性等[3]。
食盐是肉制品加工过程中必不可少的辅料之一,已知食盐腌制可以改善肉制品的保水性、嫩度等品质。很多研究证实在体内食盐会影响蛋白质的磷酸化,进而调控一些生化生理反应。研究发现,宰后24 h的羊肉使用3%食盐腌制16 h后,与1%食盐腌制相比,肌原纤维蛋白的整体磷酸化水平显著降低[4],体外孵育实验表明,食盐腌制可通过抑制碱性磷酸酶和蛋白激酶A活性间接调节肌原纤维蛋白磷酸化水平,从而提高肉嫩度。然而,在当前积极响应“健康中国2030”规划纲要中提出的“全国人均每日食盐摄入量降低20%”的背景下,通过增加食盐用量来改善肉品品质的方法无疑与“健康中国”的倡导背道而驰。因此,找到合适的钠盐替代物及替代比例,达到降低钠盐含量的同时保证肉制品品质的目标是当前研究的重点。
前期研究表明,碱性氨基酸可以改善肉及肉制品的风味、质构及保水性。尹敬等[5]发现,含KCl、氨基酸的低钠盐替代食盐比例为75%时制得的风干草鱼咸味纯正,无异味,接受度较高;Zhang Yawei等[6]发现,用L-组氨酸(L-histidine,L-His)及L-赖氨酸(L-lysine,L-Lys)替代50%的食盐可有效增加猪肉的持水力和结合水含量,保持良好的质构和色泽。此外,在抑制蛋白质和脂质氧化方面,含L-Lys和L-His的盐替代物被发现在加工过程中能够加速干腌草鱼蛋白质和脂质的水解,抑制蛋白质和脂质的氧化[7],添加L-His后还能在一定程度上提高肌球蛋白热诱导凝胶性质[8]。为了完善低盐条件下添加L-His/L-Lys能够保持或提高肉品品质的机制,宰后磷酸化水平的变化规律及其与鸡胸肉加工特性之间的关联性是一个值得研究的方向。
因此,本实验通过在宰后120 min低盐条件下分别添加L-His和L-Lys,探究肌原纤维蛋白磷酸化水平的变化规律,结合质谱(mass spectrometry,MS)技术找出磷酸化差异表达的蛋白,进行磷酸化差异表达蛋白与鸡胸肉加工特性的相关性分析,为L-His和L-Lys在鸡胸肉及其他肉品中的食盐替代作用提供理论依据。
1 材料与方法
1.1 材料与试剂
36 只同一批次的黄羽肉鸡(3 月龄,2.0~2.2 kg) 南京市玄武区孝陵卫农贸市场。
BCA蛋白浓度测定试剂盒 北京索莱宝生物科技有限公司;蛋白酶抑制剂、磷酸酶抑制剂 瑞士Roche公司;非预染蛋白Marker 美国Thermo公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)预制胶、Tris-MOPS-SDS Running Buffer、LDS Sample Buffer(4×) 美国GenScript公司;Pro-Q Diamond染液、Sypro Ruby染液 美国Invitrogen公司;其余试剂均为国产分析纯。
1.2 仪器与设备
T25 digtal Ultra Turrax高速匀浆机 德国IKA公司; Allegra 64R高速冷冻台式离心机 美国Beckman Coulter公司;HH-8数显恒温水浴锅 常州国华电器有限公司; TA-XT质构仪 英国Stable Micro Systems公司;MCR301流变仪 奥地利安东帕公司;Mini-PROTEAN Tetra电泳槽、PowerPac Basic基础型电源 美国Bio-Rad 公司;Typhoon Trio多功能激光成像系统 美国GE公司; eStain L1蛋白快速染色系统 美国GenScript公司;SpeedVac真空浓缩机、Orbitrap Exploris 480 MS仪 美国Thermo公司。
1.3 方法
1.3.1 肌肉样品的准备
参考方芮等[9]的样品处理方法并稍作修改,取鸡左胸,在宰后120 min时添加肉质量0% NaCl、1% NaCl、3% NaCl、1% NaCl+0.06% L-His、1% NaCl+0.06% L-Lys进行腌制,腌制条件为4 ℃腌制24 h,腌制完后液氮速冻,置于-80 ℃备用。
将样品制成肉糜,取一部分进行蒸煮损失、硬度、蛋白溶解度及流变特性测定。
1.3.2 肌原纤维蛋白的提取
取1 g腌制后的肌肉组织加入6 mL预冷的匀浆缓冲液(100 mmol/L Tris-HCl缓冲液,pH 8.3,每50 mL加1 片蛋白酶抑制剂、2 片磷酸酶抑制剂),冰浴匀浆(9 500 r/min、2×30 s,13 500 r/min、2×30 s)。匀浆液在4 ℃、15 000×g下离心20 min,去掉上清液,将沉淀溶解于5 g/100 mL SDS溶液(60 ℃),匀浆 (9 500 r/min、30 s)后80 ℃加热20 min即为肌原纤维蛋白溶液。使用BCA蛋白浓度测定试剂盒测定肌原纤维蛋白溶液质量浓度,并用5 g/100 mL SDS溶液将样品质量浓度调至4 mg/mL,4 ℃保存备用。
1.3.3 蛋白质磷酸化水平测定
参考张彩霞[4]的方法并稍作修改,进行电泳样品的制备,将制备好的电泳样品进行SDS-PAGE。电泳初始电压70 V,待溴酚蓝指示带进入分离胶后将电压调整为120 V,当溴酚蓝指示带距离凝胶底部0.5 cm处停止电泳,取出胶片。
将胶片放置在染色盒中,用固定液轻摇固定过夜。结束后用双蒸水洗脱固定液(3×10 min),首先进行磷酸化蛋白染色,胶片加入Pro-Q Diamond染料避光染色2 h, 用Pro-Q Diamond脱色液避光脱色1.5 h,用蒸馏水洗去脱色液(4×5 min)后使用Typhoon Trio多功能激光成像系统进行第1次荧光扫描。扫描参数设置:采集模式设为荧光扫描,发射波长580 nm,激发波长532 nm,灵敏度正常,分辨率100 μm。接着进行全蛋白染色,胶片加入Sypro Ruby染色液避光染色过夜,用Sypro Ruby脱色液避光脱色0.5 h,用蒸馏水洗去脱色液(4×5 min)后用Typhoon扫描仪进行第2次荧光扫描。扫描参数设置:采集模式设为荧光扫描,发射波长610 nm,激发波长 532 nm,灵敏度正常,分辨率100 μm。使用ImageQuant TL软件对条带灰度进行定量分析,按式(1)计算每个条带的相对灰度,即每个条带的磷酸化水平。
式中:P为磷酸化蛋白的灰度;T为全蛋白的灰度。
样品的整体磷酸化水平按式(2)计算。
式中:P1为该泳道所有条带的P值之和;T1为所有条带的T值之和。
1.3.4 蒸煮损失测定
参考贾娜等[10]的方法,称取一定质量的均匀肉糜,质量记为m1(g),放入自封袋中,再将肉样置于85 ℃水浴锅中,浸渍蒸煮30 min,蒸煮后冷却至室温,用滤纸吸干水分,然后称肉糜质量,记为m2(g),按式(3)计算蒸煮损失。
1.3.5 硬度测定
参考孟林等[11]的方法并稍作修改,将煮熟的肉糜切成1 cm×1 cm×1 cm的块状,质构仪参数设定为:P50铝合金探头,测试前探头速率2.00 mm/s,测试后探头速率5.00 mm/s,2 次测试时间间隔3.00 s,触发类型自动,测定压缩比50%,触发力5.0 g,每组重复3 次。
1.3.6 蛋白溶解度测定
参考张雅玮等[12]的方法,取30 g肉糜加入100 mL 1 g/100 mL NaCl溶液,冰浴冷却下用高速组织匀浆机进行匀浆处理(8 000 r/min、30 s)。匀浆液在4 ℃下静置24 h后,用纱布过滤。收集粗滤液经离心(8 000×g、20 min)后得到上清液,并用BCA试剂盒测定离心前后的蛋白质量浓度(mg/mL),按式(4)计算蛋白溶解度。
1.3.7 流变学特性测定
利用流变仪测定流变学特性,采用50 mm平行板,频率0.1 Hz,应变2%,上下板间距1 mm。25 ℃预热5 min后,18.0 mg/mL肌原纤维蛋白溶液以2 ℃/min的升温速率从25 ℃升温至85 ℃。板间缝隙的蛋白表面覆上液体硅油,防止挥发。记录加热过程中储能模量(G’)的变化,计算储能模量变化率(ΔG’),按式(5)[13]计算。
式中:G1’为85 ℃时的G’/Pa;G0’为25 ℃时的G’/Pa。
1.3.8 MS鉴定
将磷酸化水平差异显著的条带切碎后脱色脱水,加入20 μL 10 mmol/L二硫苏糖醇在56 ℃还原1 h,冷却至室温后,吸干,快速避光,加入20 μL 55 mmol/L碘代乙酰胺,置于暗室45 min进行烷基化。依次用25 mmol/L NH4HCO3、25 mmol/L NH4HCO3+体积分数50%乙腈和乙腈洗涤,乙腈脱水到胶粒完全变白为止,向溶液中加入0.2 μg胰蛋白酶进行蛋白质消化。然后将所得肽产物用Ziptip C18枪头型脱盐柱脱盐,得到可供MS进样分析的溶液。利用MS仪对胶点内蛋白质进行定性测定。样品在分析柱(AcclaimPepMap®RSLC C18柱(75 μm×15 cm,3 μm,100 Å),Thermo Scientific)上以体积分数3%~35%的洗脱缓冲液(体积分数80%乙腈,含0.1%甲酸)梯度分离,接着在高效液相色谱级水中以 300 nL/min的流速分析90 min。从高分辨率MS1扫描中,选取最高强度的母离子在1 s循环时间内进行高能碰撞碎裂以产生MS/MS图,归一化碰撞能量为30.0 eV,MS/MS图的分辨率为15 000(m/z 200)。根据从NCBI网站下载的Ovis aries蛋白质数据库,使用Proteome Discoverer软件(2.0版,Thermo Fisher Scientific,Waltham,MA,USA)进行蛋白质鉴定。按照Sequest HT算法的置信度大于99.0%鉴定MS/MS图中的肽。
1.4 数据处理
使用ImageQuant TL(GE)软件处理电泳胶拍照后的图像,对电泳条带进行灰度分析后得到相对灰度,使用UniProtKB确定蛋白质种类和功能,所有数据用Microsoft Excel 2016软件进行分析,结果用平均值±标准差表示。使用Origin pro 9.0软件作图,使用SPSS软件进行单因素方差分析,采用Duncan’s法分析数据差异显著性, P<0.05表示差异显著,并进行Pearson相关性分析。
2 结果与分析
2.1 一维SDS-PAGE图与磷酸化水平分析
由图1可知,肌原纤维蛋白条带平直且清晰,分离效果较好,可以进行下一步磷酸化水平分析。选取16 个较清晰的蛋白条带,利用IQTL软件对其相对灰度进行分析,从而得到不同处理组肌原纤维蛋白的整体磷酸化水平。
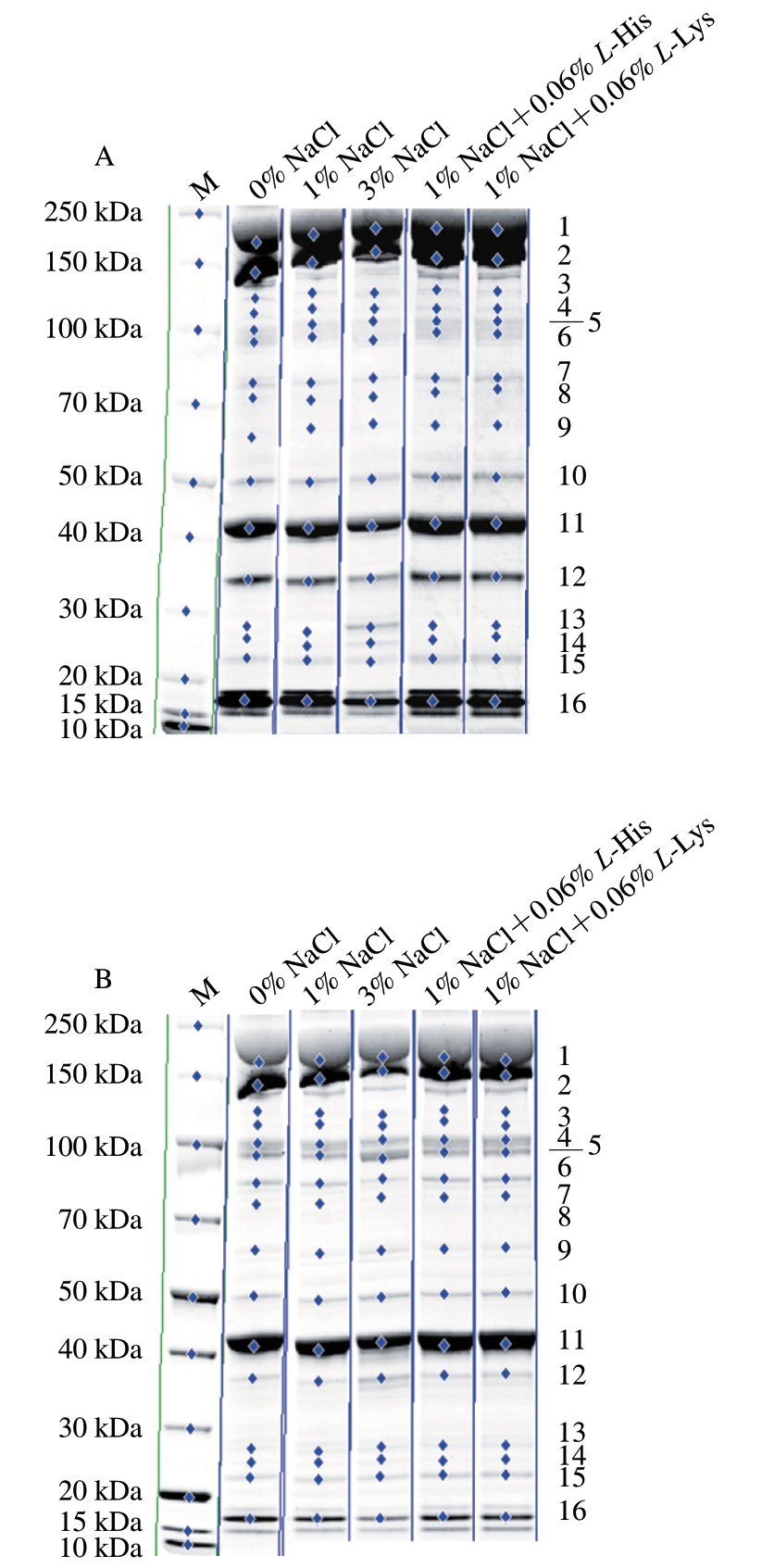
图1 肌原纤维蛋白荧光染色图
Fig. 1 Images of stained myofibrillar protein
A. 磷酸化肌原纤维蛋白;B. 全肌原纤维蛋白。
由图2可知,添加L-His和L-Lys处理后,各处理组之间整体磷酸化水平无显著差异。表明宰后120 min添加碱性氨基酸对肌原纤维蛋白的整体磷酸化水平无显著影响。
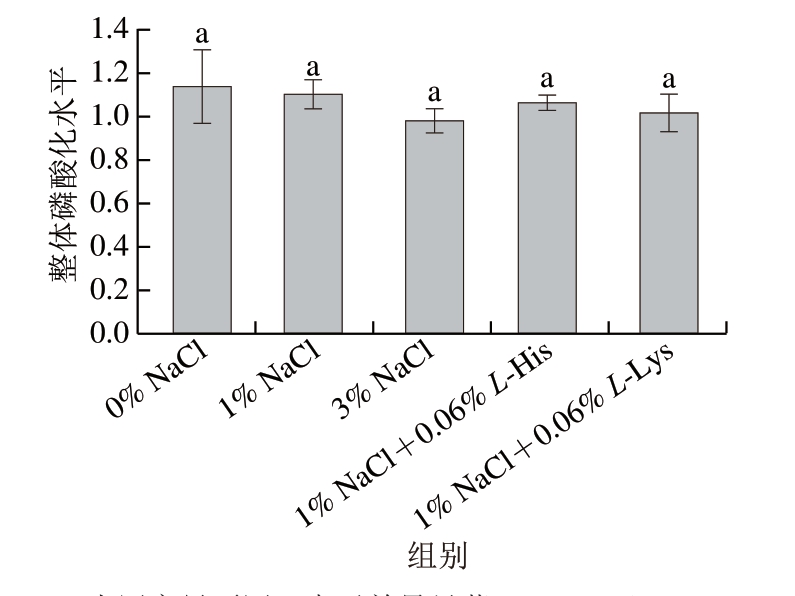
图2 L-His/L-Lys处理肌原纤维蛋白的整体磷酸化水平比较
Fig. 2 Comparison of overall phosphorylation levels of myofibril proteins treated with L-His/L-Lys
小写字母不同,表示差异显著(P<0.05)。
为进一步明确L-His和L-Lys对肌原纤维蛋白磷酸化的作用,选取11 条较重要的肌原纤维蛋白条带,分析不同处理对其磷酸化水平的影响。
由表1可知,大部分蛋白质条带的磷酸化水平受到L-His及L-Lys的调控。其中,与1% NaCl处理相比,3% NaCl处理可以显著提高2 个条带(13、14)的磷酸化水平,显著降低6 个条带(6、7、9、10、12、16)的磷酸化水平,而其余3 个条带(1、2、11)的磷酸化水平差异不显著。与添加1% NaCl相比,添加0.06% L-His后,6 个条带(2、7、9、10、12、16)的磷酸化水平显著降低,条带13的磷酸化水平显著提高,其余4 个条带(1、6、11、14)变化不显著;添加0.06% L-Lys后,3 个条带(6、9、10)的磷酸化水平显著降低,条带13的磷酸化水平显著提高。与添加3% NaCl相比,添加1% NaCl+0.06% L-His,3 个条带(2、13、14)的磷酸化水平显著降低,3 个条带(9、10、12)的磷酸化水平显著升高;添加1% NaCl+0.06% L-Lys,条带6、13、14的磷酸化水平显著降低,条带9、12的磷酸化水平显著提高。
表1 L-His/L-Lys处理对鸡胸肉肌原纤维蛋白单个条带磷酸化水平的影响
Table 1 Effects of L-His/L-Lys addition on single band phosphorylation levels of chicken breast myofibrillar proteins
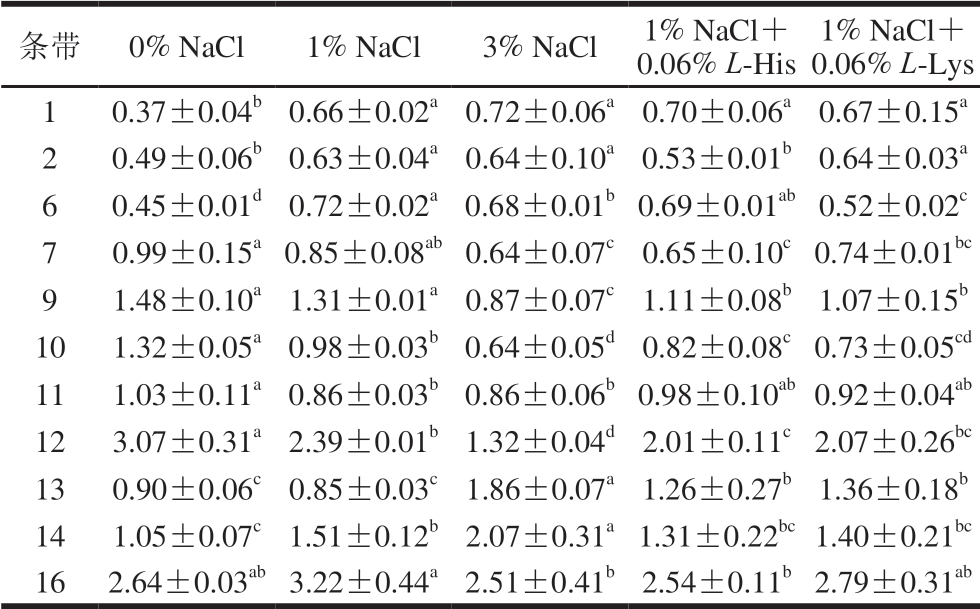
注:同行小写字母不同,表示差异显著(P<0.05)。
1% NaCl+0.06% L-Lys 1 0.37±0.04b0.66±0.02a0.72±0.06a0.70±0.06a0.67±0.15a 2 0.49±0.06b0.63±0.04a0.64±0.10a0.53±0.01b0.64±0.03a 6 0.45±0.01d0.72±0.02a0.68±0.01b0.69±0.01ab0.52±0.02c 7 0.99±0.15a0.85±0.08ab0.64±0.07c0.65±0.10c0.74±0.01bc 9 1.48±0.10a1.31±0.01a0.87±0.07c1.11±0.08b1.07±0.15b 10 1.32±0.05a0.98±0.03b0.64±0.05d0.82±0.08c0.73±0.05cd 11 1.03±0.11a0.86±0.03b0.86±0.06b0.98±0.10ab0.92±0.04ab 12 3.07±0.31a2.39±0.01b1.32±0.04d2.01±0.11c2.07±0.26bc 13 0.90±0.06c0.85±0.03c1.86±0.07a1.26±0.27b1.36±0.18b 14 1.05±0.07c1.51±0.12b 2.07±0.31a1.31±0.22bc1.40±0.21bc 16 2.64±0.03ab3.22±0.44a2.51±0.41b2.54±0.11b2.79±0.31ab条带 0% NaCl 1% NaCl 3% NaCl 1% NaCl+0.06% L-His
综合以上结果可知,尽管L-His和L-Lys不影响肌原纤维蛋白的整体磷酸化水平,但是可以改变单个蛋白质的磷酸化水平。
2.2 L-His和L-Lys对鸡胸肉蒸煮损失、硬度和蛋白溶解度的影响
由表2可知,伴随着NaCl的加入,鸡胸肉的蒸煮损失显著下降,而与1% NaCl(14.14%)处理相比,3% NaCl(15.37%)处理并不能显著降低蒸煮损失。关于提高肌肉持水力方面,僵直前盐腌被认为是维持肌肉持水力和减少蒸煮损失的有效方法[13]。研究发现,与2% NaCl相比[14],僵直前添加同样水平的氯化钾处理的肉糜蒸煮损失无显著差异,展示了僵直前低盐处理的可能。而与3% NaCl相比,1% NaCl+0.06% L-His/L-Lys处理能够显著降低鸡胸肉的蒸煮损失,这说明L-His和L-Lys可以改善肉糜的持水能力。
表2 L-His/L-Lys处理对鸡胸肉蒸煮损失、硬度和蛋白溶解度的影响
Table 2 Effects of L-His/L-Lys on cooking loss, heat-induced gel hardness and protein solubility of chicken breast meat
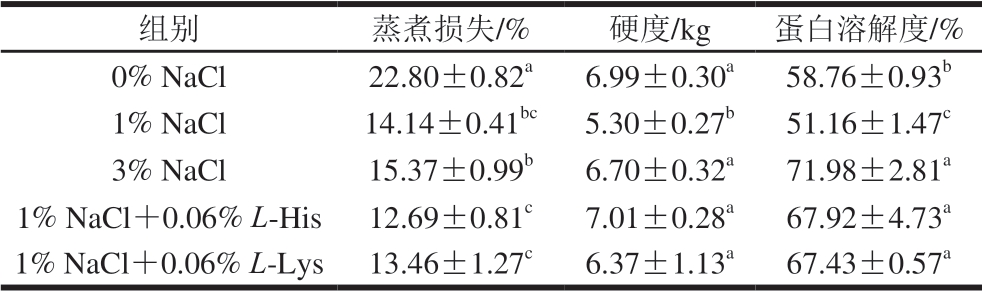
注:同列小写字母不同,表示差异显著(P<0.05)。
肉制品的硬度影响消费者对其的偏好程度[15],与1% NaCl处理相比,提高NaCl添加量(3% NaCl)可以显著增加肉糜硬度,这与Kim等[16]的研究结果一致。这可能是因为NaCl的加入增大了蛋白溶解度,溶解的蛋白质在小肉块之间形成连接,提高了肉糜硬度[17]。Youssef等[18] 研究表明,肉的质地直接受到凝胶形成过程中肌球蛋白的影响,相互作用的肌球蛋白数量越多,蒸煮后产生的肉糜质地越坚硬。此外,L-His在1 mmol/L NaCl条件下可促进肌原纤维凝胶小孔结构的形成,从而使其获得良好的结构特 性[19]。在本实验中,这可能是1% NaCl+0.06% L-His/L-Lys处理与3% NaCl处理组相比硬度无显著差异的原因。
盐溶性肌原纤维蛋白溶解度是影响肉制品保水能力和质地最重要的功能特性之一[20]。在低盐条件(<0.3 mol/L NaCl/KCl)及水溶液条件下,肌原纤维蛋白易聚集成纤维丝,将功能基团掩埋于内部,表现出低溶解度[21]。本实验中,同样的盐浓度下,所有添加氨基酸处理组的鸡胸肉蛋白质溶解度均高于未添加氨基酸处理组鸡胸肉,且与3% NaCl处理组无显著差异。Guo Xiuyun等[22]研究发现,在低盐条件下(1 mmol/L、0.15 mol/L NaCl)添加5 mmol/L L-Lys能够使肌球蛋白分子发生解折叠,蛋白构象发生改变,显著提高肌球蛋白溶解性。这也与蒸煮损失的结果一致,盐溶性蛋白的溶解度提高使得蛋白质结构充分展开,水分子运动受到束缚,形成致密的三维网状结构,减少了肉糜的蒸煮损失[23]。
2.3 L-His和L-Lys对肌原纤维蛋白流变特性的影响
肌原纤维蛋白受热后发生变性展开,通过蛋白分子间的聚合作用形成三维凝胶网络结构,这是一个不稳定的动态流变过程。G’表示凝胶的弹性特征。由图3可知,随着温度的升高,所有处理组的流变特性曲线变化趋势基本一致。肌原纤维蛋白的流变曲线主要呈现出3 个阶段的变化:温度为25~50 ℃时,G’增加缓慢,曲线平坦,45 ℃左右没有出现峰值,较低的G’说明蛋白质的稳定性较差;50~70 ℃时,G’迅速上升;70~85 ℃时,1% NaCl+0.06% Lys、1% NaCl处理组在温度未升到85 ℃时已达到最大G’,而其余处理组的G’在温度达到85 ℃时达到最大值。
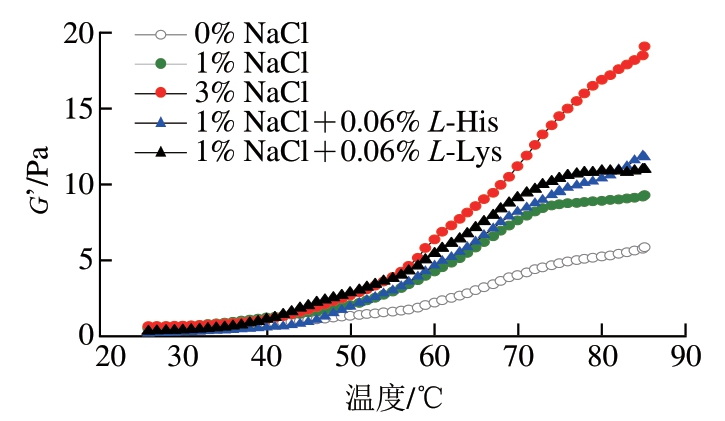
图3 L-His/L-Lys处理对热诱导肌原纤维蛋白凝胶动态流变特性的影响
Fig. 3 Effect of L-His/L-Lys on dynamic rheological properties of heat-induced myofibrillar protein gel
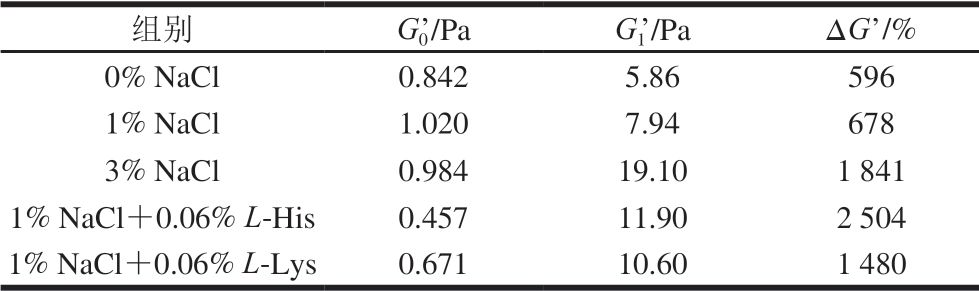
由表3可知,初始温度下,1% NaCl处理组G0’为1.020 Pa,3% NaCl处理组为0.984 Pa,L-His、L-Lys处理组使得肌原纤维蛋白体系初始G0’分别降至0.457、0.671 Pa。L-His、L-Lys增加了肌原纤维蛋白溶解度,增加了蛋白质体系的流动性,从而引起初始G0’的降低[24]。 经计算,0% NaCl、1% NaCl、3% NaCl、1% NaCl+0.06% L-His、1% NaCl+0.06% L-Lys组的∆G’分别为596%、678%、1 841%、2 504%、1 480%,与1% NaCl相比,L-His和L-Lys的加入将∆G’分别升高至2 504%、1 480%。特别是L-His,呈现出比3% NaCl处理组更高的∆G’。这也说明,宰后120 min L-His及L-Lys的加入有助于改善低盐条件下盐溶性肌原纤维蛋白的凝胶特性。
表3 L-His/L-Lys处理对热诱导肌原纤维蛋白凝胶形成过程中∆G’的影响
Table 3 Effect of L-His/L-Lys on ∆G’ during heat-induced gelation of myofibrillar protein
2.4 蛋白质磷酸化水平与蒸煮损失、硬度、蛋白溶解度的相关性分析
由图4可知,条带1、6的磷酸化水平与蒸煮损失呈极显著负相关(P<0.01),条带7、9、10、12的磷酸化水平与蒸煮损失呈显著正相关(P<0.05)。肉糜的硬度与蛋白质磷酸化水平没有显著相关性;条带7、9、10、12、16的磷酸化水平与蛋白溶解度呈显著负相关,条带13的磷酸化水平与蛋白溶解度呈显著正相关。单个蛋白条带的磷酸化水平之间同样也存在一定的相关性,如条带2、6、13、14的磷酸化水平与条带1的磷酸化水平呈显著正相关,条带7、9、10、11、12的磷酸化水平与条带1的磷酸化水平呈显著负相关。一些条带的磷酸化水平不受其他蛋白质磷酸化的影响,如条带16;一些条带的磷酸化水平受到多个条带的影响,如条带14与条带1、2、6、7、9、10、11、12、13呈显著正相关或负相关。这说明宰后蛋白质磷酸化水平不仅可以调控肉的蒸煮损失及蛋白溶解度等加工特性,且单个蛋白质的磷酸化水平还会受到其他蛋白质磷酸化水平的影响,最终决定肉品品质的优劣。为进一步明确这些蛋白对肉加工特性的影响,将这11 条磷酸化差异显著的条带进行MS鉴定。
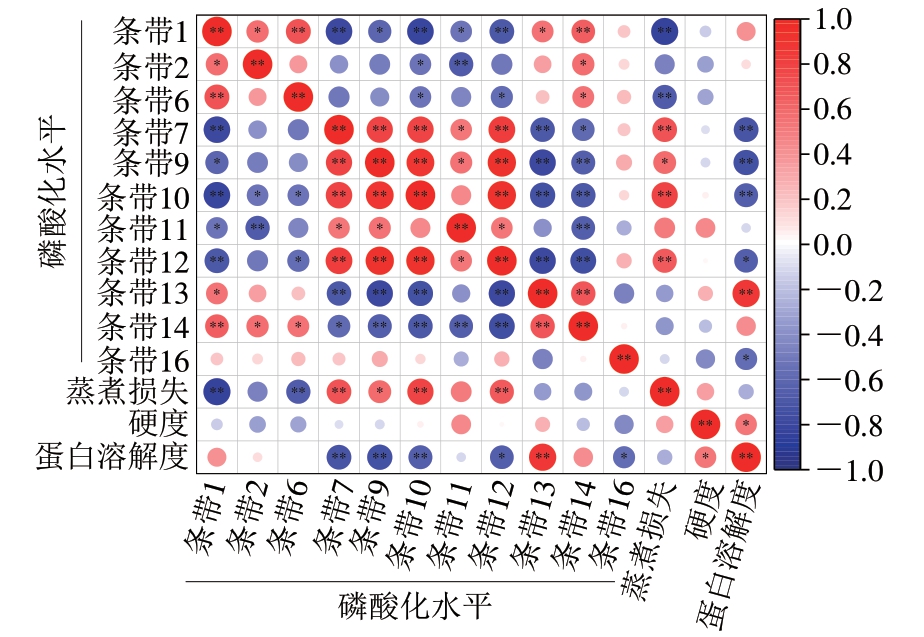
图4 蛋白质磷酸化水平与蒸煮损失、硬度、蛋白溶解度的 Pearson相关性分析
Fig. 4 Pearson correlation analysis between protein phosphorylation level and cooking loss, gel hardness and protein solubility
*. P<0.05;**. P<0.01。
2.5 磷酸化差异蛋白条带MS鉴定
由表4可知,MS鉴定结果发现,条带1中检测到的是肌球蛋白重链,它是一种肌肉收缩相关蛋白[25],NaCl的加入可以显著提高其磷酸化水平,而NaCl处理组与加氨基酸处理组之间并无显著差异。由于其磷酸化水平与蒸煮损失呈显著负相关,表明NaCl的加入通过提高其磷酸化水平促进了肌动球蛋白的解离,进而促进宰后肉的嫩化[26]。条带12中检测到的是原肌球蛋白α1链, 条带13中检测到的是肌钙蛋白T,条带16中检测到的是肌球蛋白调节轻链2。条带12、13、16中检测到的蛋白质均与肌肉收缩有关,说明这些蛋白质的磷酸化水平会对宰后肉的僵直产生影响。已有研究发现,原肌球蛋白α1链磷酸化后不容易被钙蛋白酶降解,不利于肉品嫩度[27]; 肌钙蛋白T本身是肌钙蛋白的抑制亚基,能高度抑制肌球蛋白中ATP酶的活性,有阻止肌动蛋白和肌球蛋白结合的功能,心肌肌钙蛋白T的磷酸化可以影响肌肉收 缩[28];肌球蛋白调节轻链2磷酸化修饰后会破坏肌肉粗丝和细丝的相互作用,使肌球蛋白重链头部远离粗丝[29]。动物宰后,由于ATP的缺失,肌动蛋白和肌球蛋白之间交联结合形成肌动球蛋白,肌动球蛋白复合体的解离是影响肉品嫩度的重要因素之一,肌动球蛋白的解离程度越大,相互作用力越小,肉嫩度越好。研究发现,肌钙蛋白T磷酸化能够降低肌球蛋白与肌动蛋白之间的相互作用力(肌动球蛋白ATPase活力较低),促进肌动球蛋白的解离,从而改善肉品嫩度[26]。同时,与1% NaCl处理相比,加氨基酸组的条带12、16的磷酸化水平明显下降,条带13的磷酸化水平则显著提高。可能是因为条带12、16的磷酸化水平与蛋白溶解度呈显著的负相关,条带13的磷酸化水平与蛋白溶解度呈显著的正相关。
表4 鸡胸肉肌原纤维蛋白11 条磷酸化差异显著条带的MS鉴定结果
Table 4 MS identification of 11 differentially phosphorylated bands of chicken breast myofibrillar protein
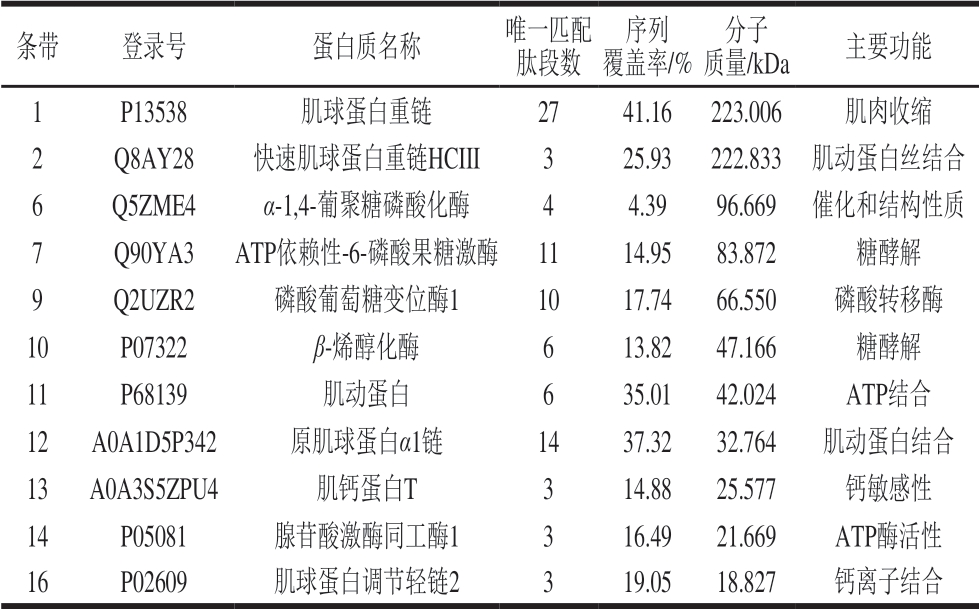
条带 登录号 蛋白质名称 唯一匹配肽段数序列覆盖率/%分子质量/kDa 主要功能1 P13538 肌球蛋白重链 27 41.16 223.006 肌肉收缩2 Q8AY28 快速肌球蛋白重链HCIII 3 25.93 222.833 肌动蛋白丝结合6 Q5ZME4 α-1,4-葡聚糖磷酸化酶 4 4.39 96.669 催化和结构性质7 Q90YA3 ATP依赖性-6-磷酸果糖激酶 11 14.95 83.872 糖酵解9 Q2UZR2 磷酸葡萄糖变位酶1 10 17.74 66.550 磷酸转移酶10 P07322 β-烯醇化酶 6 13.82 47.166 糖酵解11 P68139 肌动蛋白 6 35.01 42.024 ATP结合12 A0A1D5P342 原肌球蛋白α1链 14 37.32 32.764 肌动蛋白结合13 A0A3S5ZPU4 肌钙蛋白T 3 14.88 25.577 钙敏感性14 P05081 腺苷酸激酶同工酶1 3 16.49 21.669 ATP酶活性16 P02609 肌球蛋白调节轻链2 3 19.05 18.827 钙离子结合
糖酵解和肌肉收缩都是影响宰后肉品质变化的关键因素,条带7、9、10中检测到了与糖酵解有关的磷酸化酶。条带7中检测到了ATP依赖性-6-磷酸果糖激酶,条带9中检测到了磷酸葡萄糖变位酶1,条带10中检测到了β-烯醇化酶。已有研究发现,糖酵解酶磷酸化后活性更高[30],如ATP依赖性-6-磷酸果糖激酶磷酸化后可以稳定其四聚体构象,从而使其活性增大[31]。而磷酸化介导的酶活性增大有利于促进糖酵解反应,从而进一步影响肉的色泽、保水性等。与1% NaCl相比,L-His及L-Lys的加入能够显著降低条带7、9、10的磷酸化水平。而条带7、9、10的磷酸化水平均与蒸煮损失呈正相关,与蛋白溶解度呈负相关,这表明L-His及L-Lys的添加可以有效改善产品的蒸煮损失,与本实验蒸煮损失的结果一致。在糖酵解代谢中,磷酸葡萄糖变位酶1发挥重要作用,研究发现,嫩牛肉中的磷酸葡萄糖变位酶1磷酸化水平低于硬牛肉[32],表明磷酸葡萄糖变位酶1的低磷酸化水平有助于改善肉的嫩度。本实验中,L-His和L-Lys的引入导致磷酸葡萄糖变位酶1的磷酸化水平降低,可能是1% NaCl+0.06% L-His/L-Lys处理相比于1% NaCl处理具有良好质构特性的原因之一。
3 结 论
宰后120 min添加L-His、L-Lys对肌原纤维蛋白的整体磷酸化水平无显著影响,但是可以改变单个肌原纤维蛋白条带的磷酸化水平。与1% NaCl相比,L-His可以显著降低ATP依赖性-6-磷酸果糖激酶、磷酸葡萄糖变位酶1、 β-烯醇化酶、原肌球蛋白α-1链、肌球蛋白调节轻链2 的磷酸化水平,显著提高肌钙蛋白T的磷酸化水平;L-Lys显著降低了α-1,4-葡聚糖磷酸化酶、磷酸葡萄糖变位酶1和β-烯醇化酶的磷酸化水平,显著提高了肌钙蛋白T的磷酸化水平。相关性分析表明,单个蛋白质磷酸化水平与肉品品质显著正相关或负相关。这说明L-His、L-Lys的添加可能通过对肌原纤维蛋白磷酸化水平产生正面效应,影响肌肉收缩和宰后僵直成熟过程,并在降低肉品中NaCl用量的同时调控肉品品质。
[1] 任驰, 侯成立, 李欣, 等. 温度、pH值对离体模型中肌原纤维蛋白去磷酸化反应的影响[J]. 食品科学, 2019, 40(16): 1-7. DOI:10.7506/spkx1002-6630-20180926-279.
[2] 任驰. 贮藏温度和时间对宰后羊肉蛋白质磷酸化的影响[D]. 北京: 中国农业科学院, 2019: 1-11.
[3] SCHEFFLER T L, GERRARD D E. Mechanisms controlling pork quality development: the biochemistry controlling postmortem energy metabolism[J]. Meat Science, 2007, 77(1): 7-16. DOI:10.1016/j.meatsci.2007.04.024.
[4] 张彩霞. 食盐腌制对肌肉蛋白质磷酸化的影响[D]. 北京: 中国农业科学院, 2016: 38-44.
[5] 尹敬, 任晓镤, 钱烨, 等. 含KCl、氨基酸的低钠盐替代食盐对风干草鱼加工过程中理化特性的影响[J]. 食品工业科技, 2019(3): 12-19. DOI:10.13386/j.issn1002-0306.2019.03.003.
[6] ZHANG Yawei, ZHANG Lu, HUI Teng, et al. Influence of partial replacement of NaCl by KCl, L-histidine and L-lysine on the lipase activity and lipid oxidation in dry-cured loin process[J]. LWTFood Science and Technology, 2015, 64: 966-973. DOI:10.1016/j.lwt.2015.06.073.
[7] GUO Xiuyun, CHEN Shanshan, CAO Jiayue, et al. Hydrolysis and oxidation of protein and lipids in dry-salted grass carp (Ctenopharyngodon idella) as affected by partial substitution of NaCl with KCl and amino acids[J]. RSC Advances, 2019, 9: 39545-39560. DOI:10.1039/c9ra07019b.
[8] ZHANG Yawei, JAMALI M A, PENG Zengqi. Influence of salt substitute containing KCl, L-histidine and L-lysine on the secondary structure and gel properties of myosin[J]. CyTA-Journal of Food, 2019, 17(1): 44-50. DOI:10.1080/19476337.2018.1550442.
[9] 方芮, 朱宗帅, 郭秀云, 等. L-赖氨酸对鸡腿肉肌原纤维蛋白磷酸化的影响[J]. 食品科学, 2020, 41(20): 1-6. DOI:10.7506/spkx1002-6630-20190825-267.
[10] 贾娜, 张风雪, 王乐田, 等. 槲皮素抑制冷藏猪肉糜氧化及改善其品质特性[J]. 食品科学, 2019, 40(21): 196-202. DOI:10.7506/spkx1002-6630-20181025-287.
[11] 孟林, 李艳萍, 康壮丽, 等. 谷氨酰胺转氨酶对鸭胸肉糜凝胶性能的影响[J]. 肉类研究, 2019, 33(8): 25-28. DOI:10.7506/rlyj1001-8123-20190617-131.
[12] 张雅玮, 郭秀云, 尹敬, 等. 低钠盐对猪肉盐溶性蛋白凝胶特性的影响[J]. 食品工业科技, 2017, 38(19): 6-10; 20. DOI:10.13386/j.issn1002-0306.2017.19.002.
[13] 郭秀云. HL-低钠盐及其组分组氨酸和赖氨酸对猪肉肌球蛋白理化特性与热诱导凝胶特性的影响[D]. 南京: 南京农业大学, 2016: 46-59.
[14] SONG D H, HAM Y K, HA J H, et al. Impacts of pre-rigor salting with KCl on technological properties of ground chicken breast[J]. Poultry Science, 2020, 99(1): 597-603. DOI:10.3382/ps/pez527.
[15] 荣良燕, 蔺艳婷, 何青, 等. 复配膳食纤维对低盐香肠食用品质的影响[J]. 肉类研究, 2019, 33(7): 30-35. DOI:10.7506/rlyj1001-8123-20190505-098.
[16] KIM H W, HWANG K E, SONG D H, et al. Effect of pre-rigor salting levels on physicochemical and textural properties of chicken breast muscles[J]. Korean Journal for Food Science of Animal Resources, 2015, 35(5): 577-584. DOI:10.5851/kosfa.2015.35.5.577.
[17] 郭添玥. 氯化钠和三聚磷酸钠对超高压鸡肉制品凝胶特性的 影响[D]. 南京: 南京农业大学, 2015: 20-27.
[18] YOUSSEF M K, BARBUT S. Effects of protein level and fat/oil on emulsion stability, texture, microstructure and color of meat batters[J]. Meat Science, 2009, 82(2): 228-233. DOI:10.1016/j.meatsci.2009.01.015.
[19] CHEN Xing, LI Yong, ZHOU Ruiyun, et al. L-histidine improves water retention of heat-induced gel of chicken breast myofibrillar proteins in low ionic strength solution[J]. International Journal of Food Science and Technology, 2016, 51: 1195-1203. DOI:10.1111/ijfs.13086.
[20] WU Lijun, WU Tao, WU Juqing, et al. Effects of cations on the “salt in” of myofibrillar proteins[J]. Food Hydrocolloids, 2016, 58: 179-183. DOI:10.1016/j.foodhyd.2016.02.028.
[21] 吴佳, 赵鸾, 魏娜, 等. 动态高压微射流处理对低盐肌原纤维蛋白溶解度和结构的影响[J]. 食品与发酵工业, 2022, 48(11): 129-135. DOI:10.13995/j.cnki.11-1802/ts.027887.
[22] GUO Xiuyun, PENG Zengqi, ZHANG Yawei, et al. The solubility and conformational characteristics of porcine myosin as affected by the presence of L-lysine and L-histidine[J]. Food Chemistry, 2015, 170: 212-217. DOI:10.1016/j.foodchem.2014.08.045.
[23] NUNES V. Effect of salt and MTGase on the production of high quality gels from farmed sea bass[J]. Journal of Food Engineering, 2010, 101(1): 98-105. DOI:10.1016/j.jfoodeng.2010.06.017.
[24] ZHANG Yawei, WU Junjun, JAMALI M A, et al. Heat-induced gel properties of porcine myosin in a sodium chloride solution containing L-lysine and L-histidine[J]. LWT-Food Science and Technology, 2017, 85: 16-21. DOI:10.1016/j.lwt.2017.06.059.
[25] LI Zheng, LI Xin, GAO Xing, et al. Phosphorylation prevents in vitro myofibrillar proteins degradation by μ-calpain[J]. Food Chemistry, 2017, 218: 455-462. DOI:10.1016/j.foodchem.2016.09.048.
[26] 高星, 李欣, 李铮, 等. 宰后肌肉中肌球蛋白磷酸化调控肌动球蛋白解离作用机制[J]. 中国农业科学, 2016, 49(16): 3199-3207. DOI:10.3864/j.issn.0578-1752.2016.16.013.
[27] ZHANG Xuyun, LIU Chang, NEPAL S, et al. A hybrid approach for scalable sub-tree anonymization over big data using MapReduce on cloud[J]. Journal of Computer and System Sciences, 2014, 80(5): 1008-1020. DOI:10.1016/j.jcss.2014.02.007.
[28] STRENG A S, DE B D, JOLANDA V D V, et al. Posttranslational modifications of cardiac troponin T: an overview[J]. Journal of Molecular and Cellular Cardiology, 2013, 63: 47-56. DOI:10.1016/j.yjmcc.2013.07.004.
[29] 张业军, 张德权, 侯成立, 等. 蛋白质磷酸化对肌动球蛋白解离及其乙酰化水平的影响[J]. 中国农业科学, 2022, 55(7): 1433-1444.
[30] SCHWAGELE F, HASCHKE C, KRAUSS G, et al. Comparative studies of pyruvate kinase from PSE and normal pig muscles[J]. Europe Research and Technology, 1996, 203(1): 14-20. DOI:10.1007/BF01267763.
[31] SOLA-PENNA M, DA SILVA D, COELHO W S, et al. Regulation of mammalian muscle type 6-phosphofructo-1-kinase and its implication for the control of the metabolism[J]. Iubmb Life, 2010, 62(11): 791-796. DOI:10.1002/iub.393.
[32] ANDERSON M J, LONERGAN S M, HUFF-LONERGAN E. Differences in phosphorylation of phosphoglucomutase 1 in beef steaks from the Longissimus dorsi with high or low star probe values[J]. Meat Science, 2014, 96(1): 379-384. DOI:10.1016/j.meatsci.2013.07.017.