肉制品中添加的食盐(NaCl)在人们日常食盐摄入中占有较大的比重[1],而过量的钠盐摄入会增加患心脑血管疾病的风险[2]。但是,单纯降低肉制品中的食盐含量会损害肉制品的风味、质构等品质[3]。肉制品的科学减钠已成为肉类科技领域的研究热点之一。
钙盐常用于改善肉的嫩度,也是低钠盐肉制品开发研究中常用的一种替代盐,并可作为肉制品的营养强化剂使用[4],显示出重要的生理功能[5-6],广泛应用于各类食品的开发[7-8]。高静压加工(high pressure processing,HPP) 在食品行业中除了具有非热杀菌功能[9]之外,也是一种有效实现凝胶类肉制品低盐化的前处理加工方式,可以防止低盐化给肉制品带来的凝胶质构、保水等一系列品质劣变[10-11]。
目前,低钠盐肉制品的研究主要集中于产品减钠盐后的品质劣变补偿问题,以期改善减钠盐肉制品食用前的品质特性[12]。而对于肉制品减钠盐后的消化、吸收、代谢等特性变化研究却鲜有文献报道。蛋白质的消化率越高,越容易被人体吸收[13],意味着蛋白质的生物利用率也越高。有研究表明,钙盐和HPP都会影响肉蛋白的溶解性与聚集行为,从而影响低钠盐凝胶肉制品的 品质[14-15];同时,这也可能导致肉制品表现出不同的蛋白质消化特性,进而影响蛋白质的吸收、代谢等[16]。前期的研究结果显示,适当添加量的氯化钙(0.2%)与合适的HPP条件(200 MPa、10 min、25 ℃)会协同改善蛋白质的溶解与凝胶特性[17],而这种减钠盐蛋白质凝胶特性的改善是否会影响蛋白质的体内消化吸收及其生理功能值得探究。
本研究选择小鼠作为实验动物,以经过氯化钙与HPP复合加工的减钠盐鸡肉凝胶喂食小鼠,探究减钠盐鸡肉凝胶蛋白质在小鼠体内的消化情况及其对小鼠生长性能的影响,为综合提升减钠盐肉制品的质量提供理论支持。
1 材料与方法
1.1 材料与试剂
鸡胸肉(参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》的凯氏定氮法、GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》的索氏抽提法和GB 5009.3—2016《食品安全国家标准 食品中水分的测定》的直接干燥法,分别测得蛋白质、粗脂肪和水分含量为(23.24±0.83)%、(2.11±0.47)%和(74.43±1.23)%) 滨州高盛食品有限公司。
氯化钙、三聚磷酸钠(食品级) 浙江一诺生物科技有限公司;氯化钠、无水乙醇、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、磷酸盐缓冲液(0.01 mol/L NaH2PO4·2H2O-Na2HPO4·12H2O,pH 7.0)(均为分析纯) 国药集团化学试剂(上海)有限公司;酪蛋白磷酸肽标准物(纯度80%) 上海阿拉丁生物技术有限公司;BCA试剂盒 碧云天生物技术有限公司。
实验动物:4 周龄雄性C57BL/6小鼠 北京维通利华实验动物技术有限公司。
实验小鼠饲料配方用料:玉米淀粉、麦芽糊精、蔗糖、大豆油、纤维素(均为食品级);L-胱氨酸、氯化胆碱、叔丁基对苯二酚、AIN-93G混合维生素(VA、VB6、VB12、VD3、VE、VK1、生物素、叶酸、烟酸、泛酸钙、核黄素、硫胺素)、AIN-93G混合矿物质(碳酸钙、硫酸钾、氧化镁、氯化钠、碳酸铜、碘酸钾、碳酸锰、硒酸钠、碳酸锌、氯化锂、硼酸、氟化钠、碳酸镍、钒酸铵、磷酸二氢钾、一水合柠檬酸钾、柠檬酸铁、十二水合硫酸铬钾、四水合钼酸铵、九水合硅酸钠)(均为分析纯) 国药集团化学试剂(上海)有限公司。
1.2 仪器与设备
600 MPa/0.6 L超高压处理装置 内蒙古包头科发高压科技有限责任公司;CT14RD高速冷冻离心机 上海天美科技有限公司;SCX-8/2A绞肉机 上海双碟厨具有限公司;AU680全自动生化分析仪 美国Beckman Coulter公司;FD-1A-50冷冻干燥机 北京博医康实验仪器有限公司;DYY-6D电泳仪 北京六一生物科技有限公司; Tanon-1600凝胶成像系统 上海天能科技有限公司; MS-2000激光粒度仪 英国马尔文公司;Varioskan Flash全波长酶标仪 美国热电公司。
1.3 方法
1.3.1 实验小鼠饲料配制与样品采集
4 种鸡肉凝胶粉的制备:将冷冻鸡胸肉放在4 ℃环境下解冻12 h,剔去可见脂肪和筋膜,用绞肉机搅碎后称取一定量的鸡胸肉糜,按照表1的配料比例进行配料后混合、斩拌;斩拌后的混合物真空包装,冰浴保存1 h以内,在25 ℃环境下200 MPa处理10 min后,放入水温为80 ℃的水浴锅中煮制30 min;取出并自来水冷却后,-18 ℃冷冻,再冷冻干燥至恒质量,粉碎后即为鸡肉凝胶粉。
表1 鸡肉凝胶粉配方及用量
Table 1 Composition of chicken gel powders g
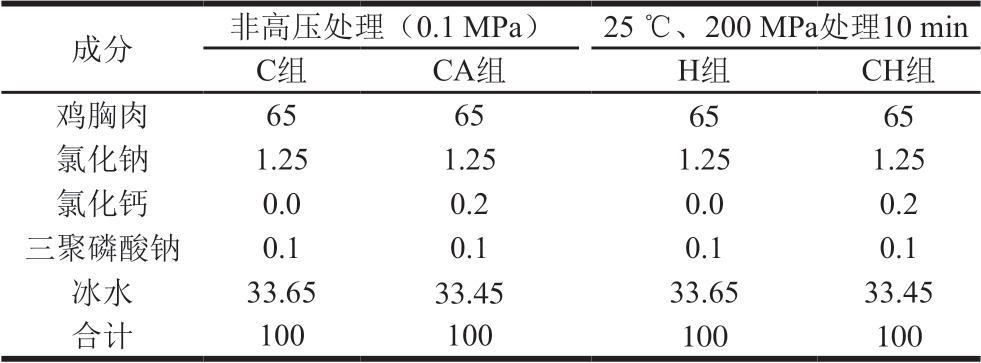
小鼠饲料的制备:参照美国营养学会AIN-93G《鼠类实验动物生长饲料配方标准》[18]配制小鼠饲料,采用4 种不同的鸡肉凝胶粉替代饲料配方中的酪蛋白,将其他配料加入到相应的鸡肉凝胶粉中,混匀,挤压呈球形(直径约2 cm),经冷冻干燥、真空包装、辐照杀菌后,即得到小鼠的4 种饲料,配方如下:相应组的鸡肉凝胶粉200 g、玉米淀粉397 g、麦芽糊精132 g、蔗糖100 g、大豆油70 g、纤维素50 g、L-胱氨酸3 g、氯化胆碱2.5 g、AIN-93G混合矿物质35 g、AIN-93G混合维生素10 g和叔丁基对苯二酚0.014 g。其中,4 种鸡肉凝胶粉分别为:氯化钙添加量0%+0.1 MPa(未经HPP)标记为C组;氯化钙添加量0.2%+0.1 MPa标记为CA组;氯化钙添加量0%+200 MPa(25 ℃、10 min)标记为H组,氯化钙添加量0.2%+200 MPa(25 ℃、10 min) 标记为CH组。
小鼠饲养:小鼠实验经合肥工业大学动物实验伦理审查委员会批准(编号:HFUT2021-1008-001),饲养环境为SPF级动物房。小鼠置于洁净饲养笼内自由饮食、饮水,按照12 h/12 h的明暗循环;每周更换2 次垫料,温度控制在(25.0±0.5) ℃,相对湿度控制在(50±5)%;用普通小鼠饲料适应性喂养2 周,将48 只实验小鼠随机分成4 组(12 只/组),分别使用上述4 种饲料喂养4 周后眼球取血、处死小鼠,取脏器和各部位脂肪,用于分析检测。
1.3.2 体质量和脏器质量的测定
体质量测定:实验期间,每隔7 d称量并记录小鼠体质量。
脂肪组织质量测定:小鼠取血、处死后,采集小鼠皮下脂肪组织、附睾脂肪组织,精确称量各脂肪组织的质量。
1.3.3 血清生化指标的测定
取小鼠眼球血,置于1 mL灭菌离心管,4 ℃静置12 h后,5 000×g、4 ℃高速离心15 min,取离心后的上清液得到血清。将血清在全自动生化分析仪上样测定。血清生化指标包括总蛋白、尿素氮、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、 高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)含量。
1.3.4 胃和小肠食糜醇沉蛋白组分的测定
参照Wang Yu[17]、Wen Siying[19]等方法,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)测定。精确称量胃食糜/小肠食糜0.2 g,加入3 倍体积的无水乙醇,涡旋振荡摇匀,10 000×g、4 ℃高速离心20 min,倒去上清;向离心沉淀物中加入8 倍体积的全蛋白提取液(含4 g/100 mL SDS、0.01 mol/L磷酸钠盐缓冲溶液,pH 7.0),在均质机中高速匀浆2 次(13 500 r/min,每次30 s),匀浆后的混合物离心15 min(1 500×g、4 ℃);用BCA试剂盒测定离心后上清液的蛋白质质量浓度,调整蛋白质质量浓度到1 mg/mL,与上样缓冲液按体积比4∶1混匀,在95 ℃水浴中加热5 min。采用4%~15%的Bis-Tris标准预制胶,Marker上样量5 µL,其他各泳道上样量10 µL。在80 V条件下电泳10 min,随后在120 V条件下电泳至样品条带消失。使用Tanon凝胶成像仪扫描凝胶并获得图像。
1.3.5 胃和小肠食糜粒径大小及分布的测定
食糜粒径的测定参照Sun Weizheng等[20]的方法,精确称量胃食糜/小肠食糜0.2 g,加入4 mL生理盐水,涡旋振荡摇匀。采用马尔文激光粒度仪测定混合溶液的粒径。设定粒径类型为非球形,密度为0.95 g/cm2,分散剂为水,相对折射率和相对吸收率分别设定为1.54和0.001。以D4,3反映平均粒径;D1,0、D5,0和D9,0分别表示样品累计粒度分布比例达到10%、50%和90%所对应的粒径大小。
1.3.6 小肠食糜小肽含量的测定
参照王兴等[21]方法,精确称量小肠食糜0.2 g,加入1 mL磷酸钠盐缓冲溶液(0.01 mol/L,pH 7.0),振荡摇匀后离心20 min(12 000×g、4 ℃),取上清液,按体积比1∶1加入10 g/100 mL的三氯乙酸溶液,充分混匀,4 ℃静置10 min后离心10 min(8 000×g、4 ℃);再取上清液,加入4 倍体积的双缩脲试剂(0.1 g/mL氢氧化钠+0.01 g/mL硫酸铜),充分混匀后,室温下静置反应30 min,在540 nm波长处测定吸光度,并通过标准曲线计算混合溶液中的小肽质量浓度。
标准曲线绘制:精确称量0.5 g酪蛋白磷酸肽标准物(纯度80%),置于50 mL容量瓶中定容,得到质量浓度为8 mg/mL的标准溶液;分别吸取0、0.2、0.4、0.6、0.8、1.0 mL上述标准溶液置于试管中,加入超纯水补足至1.0 mL,再加入4.0 mL双缩脲试剂(0.1 g/mL氢氧化钠+0.01 g/mL硫酸铜),充分混匀后,室温下静置反应30 min,在540 nm波长处测定吸光度,根据酪蛋白磷酸肽的质量浓度及对应的吸光度绘制标准曲线。
1.4 数据处理
数据分析用SPSS 25.0(SPSS Inc.,Chicago,IL,USA) 软件进行,结果均表示为平均值±标准差;实验数据的差异性分析使用单因素方差分析中Tukey检验,显著性水平为0.05;使用GraphPad Prism 5软件作图。
2 结果与分析
2.1 小鼠体质量变化
由图1可知,随着饲养时间的延长,4 组小鼠体质量均呈现依次增加的趋势,且4 组小鼠饲养4 周后体质量增量之间均无显著差异。
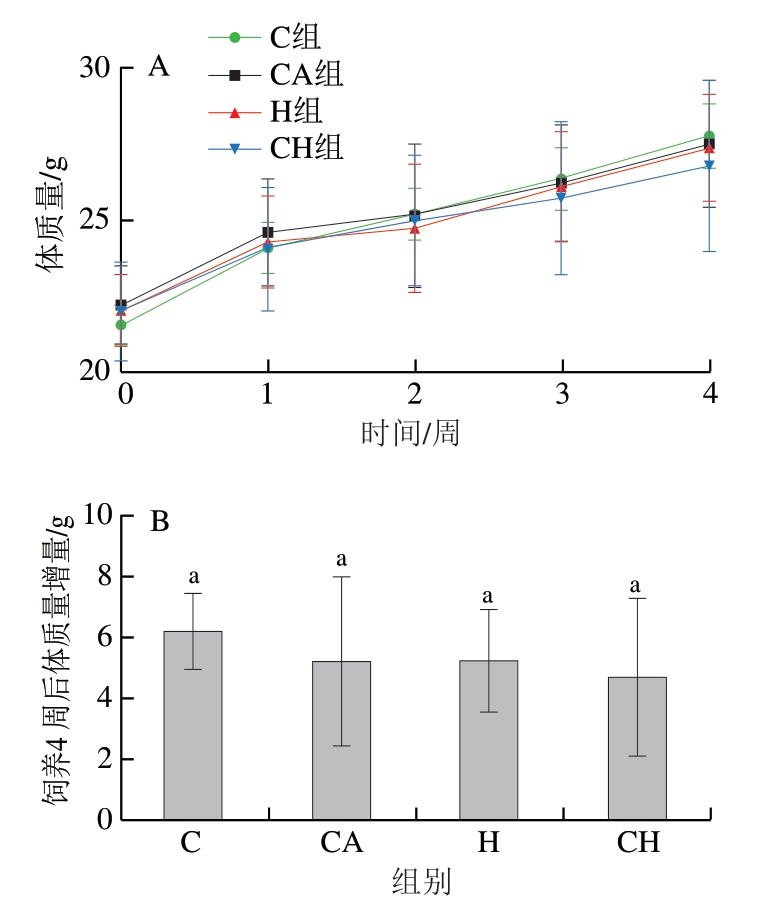
图1 4 种饮食对小鼠体质量的影响
Fig. 1 Effect of four diets with chicken gels on body mass of mice
小写字母不同,表示组间差异显著(P<0.05)。下同。
2.2 小鼠脂肪组织质量变化
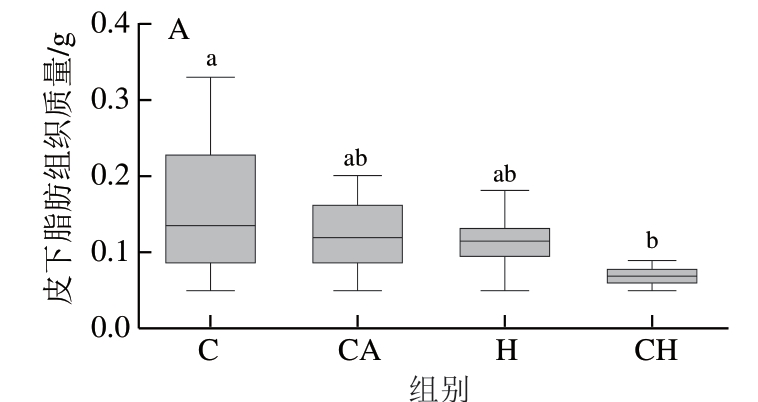
由图2可知,CH组小鼠的皮下脂肪质量显著低于C组(P<0.05),而4 组小鼠的附睾脂肪质量之间无显著 差异。
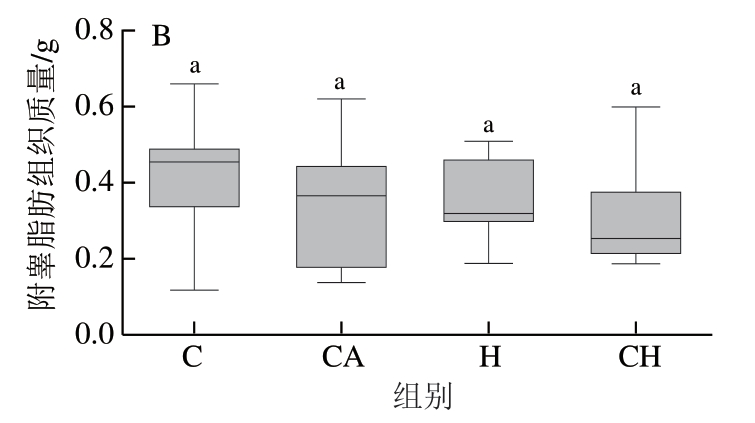
图2 4 种饮食对小鼠脂肪组织质量的影响
Fig. 2 Effect of four diets with chicken gels on adipose tissue mass of mice
2.3 小鼠血清生化指标变化
由表2可知:4 组小鼠血清中TG、TC、HDL-C和LDL-C含量均未发生显著变化;CA组和CH组小鼠血清中的总蛋白含量显著低于C组(P<0.05);受压的H组和CH组小鼠血清中尿素氮含量显著低于未受压的C组和 CA组(P<0.05)。
表2 4 种饮食对小鼠血清生化指标的影响(n=6)
Table 2 Effect of four diets with chicken gels on blood serum biochemical indices of mice (n = 6)
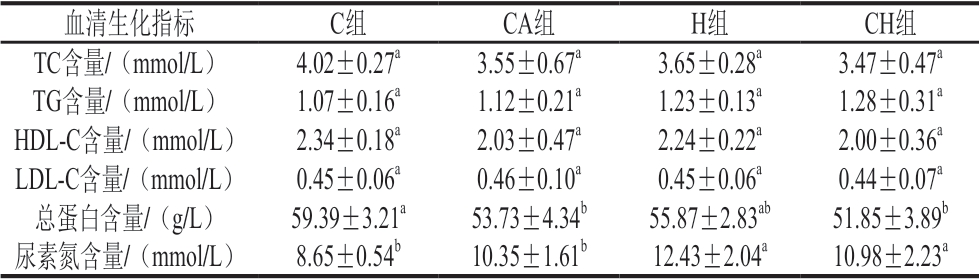
注:同行小写字母不同,表示组间差异显著(P<0.05)。
2.4 小鼠胃和小肠食糜醇沉蛋白组分变化
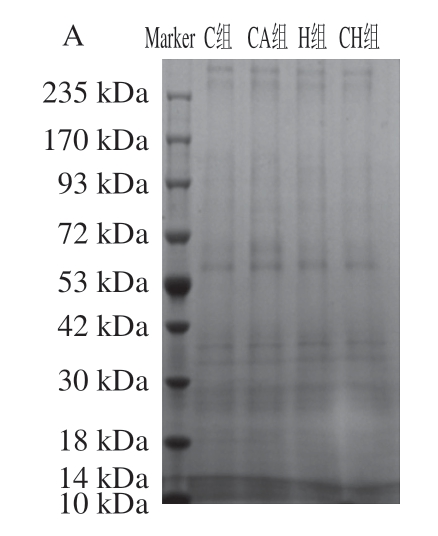
SDS-PAGE显示了4 组小鼠胃、小肠食糜的蛋白质降解情况。由图3A可知,在经过胃消化后的4 组食糜中均含有一部分的高分子质量蛋白条带(235 kDa),同时在93 kDa处也均有蛋白条带。而由图3B可知,通过小肠阶段的进一步消化后的食糜中,4 组高分子质量的蛋白条带数量显著减少或消失,均在低分子质量(<72 kDa)处出现大量的蛋白质片段,值得注意的是,在42~53 kDa处,H组和CH组仍有可见的蛋白条带出现,而C组和 CA组都只在更小的分子质量处有蛋白条带。
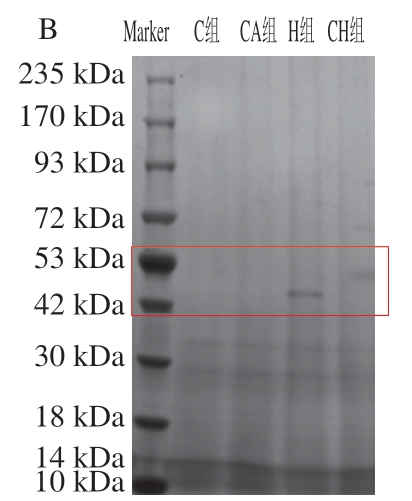
图3 4 种饮食对小鼠胃和小肠食糜醇沉蛋白组分SDS-PAGE图谱的影响
Fig. 3 Effect of four diets with chicken gels on SDS-PAGE patterns of ethanol-insoluble proteins from gastric and small intestinal digesta
A. 胃食糜;B. 小肠食糜。
2.5 胃和小肠食糜粒径大小及分布
由表3可知,经过胃消化后,受压H组的胃食糜粒径D4,3和D9,0显著高于CA组(P<0.05),D1,0显著高于C组和CH组 (P<0.05),D5,0显著高于其他3 组(P<0.05)。经过小肠阶段消化后,食糜粒径均呈现较胃消化后减小的趋势,且H组D4,3显著高于C组和CA组(P<0.05),CA组D5,0显著低于H组及CH组(P<0.05),2 个受压组(H组与CH组)D9,0显著高于非受压组(C组与CA组)(P<0.05)。
表3 4 种饮食对小鼠胃和小肠食糜粒径的影响(n=6)
Table 3 Effect of four diets with chicken gels on particle size of gastric and small intestine digesta (n = 6)µm
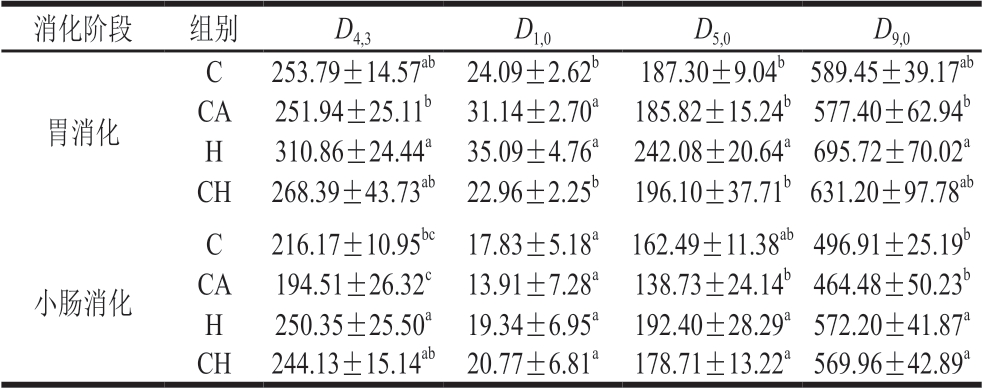
注:同列小写字母不同,表示组间差异显著(P<0.05)。
2.6 小鼠小肠食糜小肽含量变化
由图4可知,未添加氯化钙的受压H组小肽含量显著高于添加氯化钙的CA组(P<0.05),而其他各组之间均无显著差异。
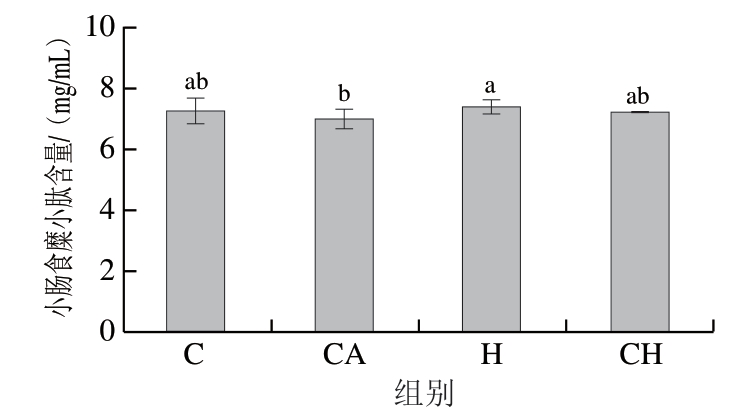
图4 4 种饮食对小鼠小肠食糜小肽含量的影响
Fig. 4 Effect of four diets with chicken gels on peptide content of small intestinal digesta
3 讨 论
已有研究结果表明,HPP可能会通过改变蛋白质的构象而影响蛋白酶的酶解效率,产生不同的蛋白消化降解结果[22];而食糜的消化粒径也可以反映食物在咀嚼及消化过程中的降解程度[23],食糜粒径的减小会增大其比表面积,利于促进酶促反应和食糜的消化[24-25]。另一方面,HPP会通过影响二硫键和疏水相互作用等引起蛋白质的聚集和变性[26];而且蛋白质的聚集也会导致蛋白质粒径的增大和消化率的降低[27]。从SDS-PAGE结果可以看出,相比于非受压凝胶饲喂组,受压组的小鼠胃和小肠食糜中53 kDa的大分子质量蛋白条带较宽,反映出受压组中未被消化的蛋白质较多;而表3中2 个受压组(H组和CH组)的食糜粒径大于非受压组,也证实了受压后的肉蛋白更加难以消化降解。由此可以推测,HPP处理可能会通过改变肉蛋白的聚集行为及凝胶微观结构,导致较大的食糜粒径和较宽的高分子质量条带,降低肉蛋白的消化性;HPP也可能通过改变肉蛋白的构象,减少蛋白质与酶作用的切割位点,降低酶解效率,导致肉蛋白降解不完全。
小肽作为机体摄入蛋白质后消化吸收的中间产物或终产物,在蛋白质营养中发挥着重要作用[28]。小肠中的小肽含量可以反映摄入蛋白质的消化降解情况,也可以间接反映胃肠消化阶段酶解蛋白质成为小肽的蛋白酶活性[29]。经过胃和小肠的消化,H组所含的小肽含量显著高于CA组,其原因可能在于HPP诱导的密实蛋白质凝胶结构[30]会通过阻滞蛋白质降解产物小肽的吸收、增大小肽进一步转化为氨基酸等小分子的空间位阻,导致受压组(H组)小肽含量增高。同时,根据CH组小肽含量相对于H组的减小趋势,可以进一步推测氯化钙具有减缓HPP抑制蛋白质消化降解的作用。
Alomaim等[31]研究发现,相对于正常饮食,高钙饮食会降低小鼠胆固醇的吸收,增加胆汁酸的排泄,并降低不饱和脂肪酸和反式脂肪酸的消化率,对降低脂肪积累产生积极影响。本研究发现,经过4 周不同饮食干预后,4 组小鼠的体质量增量没有因蛋白质消化降解的区别而产生显著差异;但是添加氯化钙/HPP都会减少小鼠的皮下脂肪积累量,且饲喂添加氯化钙的受压CH组小鼠降低皮下脂肪积累的效果显著,其皮下脂肪积累量显著低于C组,说明HPP和氯化钙具有协同减少小鼠皮下脂肪积累量的作用。
血清蛋白具有维持血液正常胶体渗透压和pH值、运输多种代谢物、免疫及营养等多种重要生理功能,是机体蛋白质的重要来源,而未被机体利用的蛋白质会通过脱氨基等反应生成尿素并最终排出体外,通过检测血清总蛋白和尿素氮的含量,可以反映不同饮食组小鼠对于蛋白质或氨基酸的吸收代谢情况[32]。受压组(H组和 CH组)更低的血清总蛋白及更高的尿素氮含量,可以反映出HPP处理会降低鸡肉蛋白质和氨基酸的利用率。
4 结 论
经HPP加工和未经HPP加工组蛋白质在小鼠体内消化降解,消化后食糜粒径存在显著差异,未经HPP加工组蛋白质在经过胃和小肠消化后,降解成更小的片段,粒径更小,结合血清的生化指标,HPP处理会降低鸡肉蛋白质和氨基酸的利用率。此外,HPP和氯化钙具有协同减少小鼠皮下脂肪积累的作用。低钠盐凝胶肉制品中引入氯化钙后,在改善品质特性的同时对摄入后的营养功能方面起到了积极作用,而经过HPP加工的鸡肉凝胶制品在营养功能方面仍存在不足,氯化钙及HPP在低钠盐凝胶肉制品方面的应用以及对于肉蛋白消化特性的机理仍需要进一步研究。
[1] DESMOND E. Reducing salt: a challenge for the meat industry[J]. Meat Science, 2006, 74(1): 188-196. DOI:10.1016/j.meatsci.2006.04.014.
[2] HE Yuna, LI Yanping, YANG Xiaoguang, et al. The dietary transition and its association with cardiometabolic mortality among Chinese adults, 1982–2012: a cross-sectional population-based study[J]. The Lancet Diabetes and Endocrinology, 2019, 7(7): 540-548. DOI:10.1016/S2213-8587(19)30152-4.
[3] CANDO D, HERRANZ B, BORDERIAS J A, et al. Effect of high pressure on reduced sodium chloride surimi gels[J]. Food Hydrocolloids, 2015, 51: 176-187. DOI:10.1016/j.foodhyd.2015.05.016.
[4] 张蒙蒙, 罗欣, 张一敏, 等. 钙盐对肉与肉制品肉色的影响及其机理研究进展[J]. 食品科学, 2019, 40(23): 327-333. DOI:10.7506/spkx1002-6630-20181210-122.
[5] 汪学荣, 彭顺清, 吴峰. 钙代谢及生理功能研究进展[J]. 肉类研究, 2005, 19(2): 20-22.
[6] BURGOYNE R D. Neuronal calcium sensor proteins: generating diversity in neuronal Ca2+ signalling[J]. Nature Reviews Neuroscience, 2007, 8(3): 182-193. DOI:10.1038/nrn2093.
[7] RIBEIRO L R, LEONEL S, SOUZA J M A, et al. Improving the nutritional value and extending shelf life of red guava by adding calcium chloride[J]. LWT-Food Science and Technology, 2020, 130: 109655. DOI:10.1016/j.lwt.2020.109655.
[8] FAN Chuanhui, CHEN Xueling, HE Jianjun. Effect of calcium chloride on emulsion stability of methyl-esterified citrus pectin[J]. Food Chemistry, 2020, 332: 127366. DOI:10.1016/j.foodchem.2020.127366.
[9] 许世闯, 徐宝才, 奚秀秀, 等. 超高压技术及其在食品中的应用进展[J]. 河南工业大学学报(自然科学版), 2016, 37(5): 111-117. DOI:10.16433/j.cnki.issn1673-2383.2016.05.020.
[10] SIKES A L, TOBIN A B, TUME R K. Use of high pressure to reduce cook loss and improve texture of low-salt beef sausage batters[J]. Innovative Food Science and Emerging Technologies, 2009, 10(4): 405-412. DOI:10.1016/j.ifset.2009.02.007.
[11] YANG Huijuan, HAN Minyi, BAI Yun, et al. High pressure processing alters water distribution enabling the production of reduced-fat and reduced-salt pork sausages[J]. Meat Science, 2015, 102: 69-78. DOI:10.1016/j.meatsci.2014.10.010.
[12] 甄宗圆, 陈旭, 万双菊, 等. 肉制品低钠盐工艺研究进展[J]. 肉类研究, 2020, 34(4): 100-106. DOI:10.7506/rlyj1001-8123-20200131-029.
[13] 张丹, 王锡昌. 中华鳖腿肉蛋白质体内外消化研究[J]. 食品科学, 2014, 35(21): 113-117. DOI:10.7506/spkx1002-6630-201421022.
[14] JIA Dan, YOU Juan, HU Yang, et al. Effect of CaCl2 on denaturation and aggregation of silver carp myosin during setting[J]. Food Chemistry, 2015, 185: 212-218. DOI:10.1016/j.foodchem.2015.03.130.
[15] SUZUKI A, SUZUKI N, IKEUCHI Y, et al. Effects of high pressure treatment on the ultrastructure and solubilization of isolated myofibrils[J]. Agricultural and Biological Chemistry, 1991, 55(10): 2467-2473. DOI:10.1080/00021369.1991.10871015.
[16] BAX M L, AUBRY L, FERREIRA C, et al. Cooking temperature is a key determinant of in vitro meat protein digestion rate: investigation of underlying mechanisms[J]. Journal of Agricultural and Food Chemistry, 2012, 60(10): 2569-2576. DOI:10.1021/jf205280y.
[17] WANG Yu, ZHOU Ying, LI Peijun, et al. Combined effect of CaCl2 and high pressure processing on the solubility of chicken breast myofibrillar proteins under sodium-reduced conditions[J]. Food Chemistry, 2018, 269: 236-243. DOI:10.1016/j.foodchem.2018.06.107.
[18] REEVES P G. Components of the AIN-93 diets as improvements in the AIN-76A diet[J]. Journal of Nutrition, 1997, 21: 413-416. DOI:10.1038/sj.ijo.0800426.
[19] WEN Siying, ZHOU Guanghong, SONG Shangxin, et al. Discrimination of in vitro and in vivo digestion products of meat proteins from pork, beef, chicken, and fish[J]. Proteomics, 2015, 15(21): 3688-3698. DOI:10.1002/pmic.201500179.
[20] SUN Weizheng, ZHAO Mouming, BAO Yang, et al. Oxidation of sarcoplasmic proteins during processing of Cantonese sausage in relation to their aggregation behaviour and in vitro digestibility[J]. Meat Science, 2011, 88(3): 462-467. DOI:10.1016/j.meatsci.2011.01.027.
[21] 王兴, 黄忠明, 王莉, 等. 苦荞蛋白模拟消化产物抗氧化活性及组成研究[J]. 中国食品学报, 2009, 9(6): 10-15. DOI:10.3969/j.issn.1009-7848.2009.06.002.
[22] KAUR L, ASTRUC T, VÉNIEN A, et al. High pressure processing of meat: effects on ultrastructure and protein digestibility[J]. Food and Function, 2016, 7(5): 2389-2397. DOI:10.1039/c5fo01496d.
[23] CHEN G, KRAVCHUK O, SOPADE P A. Kinetics of starch digestion in Australian sweetpotato as affected by particle size[C]//15th triennial symposium of the international society for tropical root crops. International Potato Centre, Lima, Peru. 2009. DOI:10.1016/j.jfoodeng.2009.06.051.
[24] 崔亚丽. 颗粒度对豆浆品质及蛋白质消化率的影响[D]. 杨凌: 西北农林科技大学, 2012: 12.
[25] 王卫国, 卢萍, 王俊卿, 等. 7 种饲料原料粉碎粒度与蛋白质体外消化率及能耗的研究[J]. 中国畜牧杂志, 2003, 39(5): 18-20. DOI:10.3969/j.issn.0258-7033.2003.05.008.
[26] CHATTONG U, APICHARTSRANGKOON A. Dynamic viscoelastic characterisation of ostrich-meat yor (Thai sausage) following pressure, temperature and holding time regimes[J]. Meat Science, 2009, 81(3): 426-432. DOI:10.1016/j.meatsci.2008.09.006.
[27] QIN Xiaojie, SHEN Qingshan, GUO Yujie, et al. Physicochemical properties, digestibility and anti-osteoporosis effect of yak bone powder with different particle sizes[J]. Food Research International, 2021, 145: 110401. DOI:10.1016/j.foodres.2021.110401.
[28] 史瑜婷, 王志耕, 方玉明, 等. 双酶法水解β-乳球蛋白[J]. 食品与发酵工业, 2010(6): 94-97.
[29] 郑云峰, 许云英, 徐玉娟. 蛋白质营养中小肽的研究新进展[J]. 饲料研究, 2006(2): 7-9. DOI:10.3969/j.issn.1002-2813.2006.02.003.
[30] WANG Yu, ZHOU Ying, WANG Xixi, et al. Origin of high-pressure induced changes in the properties of reduced-sodium chicken myofibrillar protein gels containing CaCl2: physicochemical and molecular modification perspectives[J]. Food Chemistry, 2020, 319: 126535. DOI:10.1016/j.foodchem.2020.126535.
[31] ALOMAIM H, GRIFFIN P, SWIST E, et al. Dietary calcium affects body composition and lipid metabolism in rats[J]. PLoS ONE, 2019, 14(1): e0210760. DOI:10.1371/journal.pone.0210760.
[32] 王思宇, 李银江, 欧阳依娜, 等. 饲粮蛋白质水平对云南半细毛羊空怀母羊体增重、血清尿素氮、瘦素及繁殖激素的影响[J]. 中国饲料, 2019(15): 80-84. DOI:10.15906/j.cnki.cn11-2975/s.20191519.