食盐作为最普通的咸味剂,对肉制品风味、质构、货架期及加工过程起着至关重要的作用[1]。在肉制品的加工过程中,通常需要添加较高含量(3%~4%)的食盐以获得良好的产品品质。据统计,人们从肉制品中摄入的食盐约占食盐总摄入量的25%[2]。我国是传统高盐饮食国家,过多摄入食盐容易引发高血压等心血管疾病,降低食盐用量已引起足够重视。目前,针对降低肉中食盐用量国内外已进行了广泛研究,主要通过直接降低氯化钠(sodium chloride,NaCl)用量、利用钾盐、镁盐及钙盐进行部分替代、改变加工工艺等途径来减少食盐的 摄入[3]。然而降低肉中食盐用量,或采用钾盐、镁盐或钙盐替代部分食盐将影响肉品的加工特性,主要表现在盐渗透速率减慢、弹性及硬度下降等[4-6]。
近年来,氨基酸在肉制品中的应用越来越受到国内外学者们的关注,已有诸多文献报道,L-组氨酸(L-histidine,His)作为风味增强剂,在协同增强咸味感知的同时能够显著改善肌肉蛋白理化特性、凝胶特性及乳化特性,从而提高肉制品保水、质构、色泽等品质特性。Zhang Yawei等[7]研究发现,His对咸味具有协同增强的作用。Guo Xiuyun等[8]研究发现,低盐浓度溶液中,His的添加能够引起肌球蛋白分子发生解折叠,二级结构中的α-螺旋结构转变成β-折叠、β-转角、无规则卷曲结构,暴露更多的疏水基团和巯基基团至肌球蛋白表面,从而提高了蛋白溶解度。Hayakawa等[9-10]研究发现,His能够拉长肌球蛋白杆状区域,从而使得肌球蛋白纤丝弱化,进而增加肌球蛋白在低离子强度条件下的溶解度。Zhang Yawei等[11]进一步研究发现,His能够改变肌球蛋白热诱导凝胶特性,减少凝胶网络中水的移动性和自由水含量,提高凝胶硬度、保水性,降低蒸煮损失。此外,Guo Xiuyun等[12]研究表明,低盐条件下His能够通过改变界面肌原纤维蛋白(myofibrillar protein,MP)结构及吸附特性进而提高乳液的稳定性。
随着生活水平的日益提高,人们越来越注重产品的营养价值。肉制品作为人类膳食优质蛋白的主要来源,对人体具有重要的生物学意义。因而如何维持或提高肉制品的营养特性是研究热点。蛋白质消化率是反映食物中的蛋白质在消化道内被消化酶分解程度的一项指标,是评价食物蛋白质营养价值的重要指标之一。而蛋白质的消化率和营养价值与肉类加工及贮藏过程中发生的蛋白质结构改变密切相关。前期研究表明,His能够改变肌球蛋白结构,进而改善低盐条件下蛋白的功能特性,而蛋白的结构改变可能会引起其消化特性的变化,最终影响肉制品营养价值。但关于低盐(0.2 mol/L)条件下His的添加对MP消化特性的影响规律及作用机制尚不清楚。
因此,本研究以高盐(0.6 mol/L NaCl)条件作为对照,通过研究低盐(0.2 mol/L NaCl)及高盐条件下添加His对猪肉MP结构及体外消化特性的影响,为研究低盐条件下His对MP营养价值的影响提供依据,为低盐肉制品的开发和应用提供参考。
1 材料与方法
1.1 材料与试剂
猪背最长肌购于菜大全江苏省南京市玄武区孝陵卫市场店。
His、胃蛋白酶、胰蛋白酶 北京索莱宝科技有限公司;NaCl、KCl、Tris、Na2HPO4、NaH2PO4、MgCl2、HCl、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、乙二醇双(2-氨基乙基醚)四乙酸(ethylenebis(oxyethylenenitrilo)tetraacetic acid,EGTA)均为市售分析纯。
1.2 仪器与设备
Allegra 64R高速离心机 美国贝克曼库尔特有限公司; T25 digital高速匀浆机 德国IKA公司;Varioskan Flash酶标仪(多功能读数仪) 赛默飞世尔科技有限公司;Labram HR 800显微激光拉曼光谱仪 法国Jobin-Yvon公司;MASTERSIZER 3000激光粒度分析仪 英国马尔文仪器有限公司;GelDoc XR+凝胶电泳成像仪 美国Bio-Rad公司;HJ-4多头磁力加热搅拌器 上海越众仪器设备有限公司。
1.3 方法
1.3.1 MP的提取
参考Han Minyi等[13]的方法并稍作修改。将约300 g切碎的猪背最长肌解冻,加入4 倍体积的僵直提取缓冲液(含100 mmol/L Tris、10 mmol/L EDTA,pH 8.3),高速组织捣碎机搅碎约30 s,1 000×g(<4 ℃)离心20 min,收集沉淀。沉淀加入4 倍体积的提取缓冲液(含100 mmol/L KCl、20 mmol/L Na2HPO4/NaH2PO4、2 mmol/L MgCl2、1 mmol/L EGTA,pH 7.0)溶解,高速分散10 s,1 000×g、4 ℃离心10 min,收集沉淀,并重复2 次此步骤,后2 次离心前用2 层纱布过滤。沉淀加入4 倍体积的提取缓冲液(含体积分数1% Triton X-100,pH 7.0)溶解,高速分散10 s,1 500×g、4 ℃离心10 min,收集沉淀,重复1 次。沉淀加入4 倍体积0.1 mol/L KCl溶液溶解,高速分散10 s,1 500×g、4 ℃离心10 min,收集沉淀,重复此步骤。沉淀加入4 倍体积蒸馏水溶解,高速分散10 s,1 500×g、4 ℃离心10 min,收集沉淀得到纯化的猪肉无盐MP于塑料烧杯中,24 h内使用。以上操作均需在冷库(<4 ℃)中进行。提取的猪肉MP用双缩脲法测定质量浓度。
1.3.2 蛋白样品制备
将5 g MP分别溶于50 mL不同处理溶液中,分别为0.2 mol/L NaCl、0.2 mol/L NaCl+0.2 g/100 mL His、0.2 mol/L NaCl+0.4 g/100 mL His、0.6 mol/L NaCl、0.6 mol/L NaCl+0.2 g/100 mL His、0.6 mol/L NaCl+0.4 g/100 mL His,制得6 组不同MP样品,并将pH值调至6.5。
1.3.3 MP二级结构的测定
采用拉曼光谱仪测定MP二级结构。拉曼光谱所用功率为100 mW。使用前,需要通过单晶硅进行光谱频率校正,为使激光聚焦在载玻片上,可用50 倍长焦距镜头调节,以便于测试样品。需要设置光谱参数为:开孔200 μm,光栅600 g/mm,光谱分辨率2 cm-1,获取的光谱范围400~3 600 cm-1,光谱数据获取速率120 cm-1·min-1, 设定积分时间为60 s。α-螺旋、β-折叠、β-转角和无规则卷曲的相对含量用Alix等[14]的方法计算。
1.3.4 MP表面疏水性的测定
通过8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)荧光探针法[15]测定MP的表面疏水性。将1 mg/mL MP样品用0.01 mol/L磷酸缓冲液(pH 7.0)溶解,搅拌均匀,用上述缓冲液将溶液稀释至质量浓度0.01~0.10 g/100 mL,保持在20 ℃,静置稳定12 h。用移液枪分别吸取样品2 mL,加入20 μL 8 mmol/L ANS,通过微型旋涡混合仪使其混合均匀,静置5 min。设定参数:激发波长374 nm,狭缝校正5 nm,发射波长485 nm,狭缝校正5 nm。用荧光强度对蛋白质质量浓度作曲线的斜率表示蛋白质表面疏水性。
1.3.5 体外消化率的测定
参考Wen Siying等[16]方法并作修改。建立体外胃-肠道消化模型,分别称取5 mL 30 mg/mL MP溶液,加入37 mL 10 mmol/L HCl溶液,用均质机在7 500 r/min条件下均质30 s,随后加入8 mL 1 mg/mL胃蛋白酶(溶于10 mmol/L HCl)。所得混合物终浓度为:蛋白质量浓度4 mg/mL、胃蛋白酶含量4%(m/m,以蛋白质量为基准),pH 2.0。混合均匀后置于37 ℃水浴中酶解1 h。用1 mol/L NaOH调节pH值为7.5以灭活胃蛋白酶,结束反应。随后加入相应剂量的胰蛋白酶(4%,m/m,以蛋白质量为基准,pH 7.5)于37 ℃水浴中保温消化2 h。反应结束后,反应物于沸水中加热灭酶10 min,冷却至室温,离心(11 000×g、15 min、4 ℃),收集上清液即为体外胃肠道消化产物。上清液蛋白质含量通过凯氏定氮法测定,体外消化率计算公式如下。
1.3.6 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)
参照Laemmli[17]的方法进行。反应结束后,经过胃蛋白酶、胃蛋白酶和胰蛋白酶水解的每管反应液内分别加入4×样品缓冲液,95 ℃下加热10 min,室温冷却。取10 μL上样,使用4%浓缩胶、12%分离胶,用考马斯亮蓝R-250染色。
1.3.7 消化产物粒径的测定
参照Gatellier等[18]方法并稍作修改。取匀浆后、胃蛋白酶酶解、胃蛋白酶和胰蛋白酶酶解后的溶液,使用激光粒度仪测定物质粒度大小。获取的数据如下: Dx(10)、Dx(50)、Dx(90)分别表示样品的累计粒度分布数达到10%、50%、90%时所对应的粒径;D(4,3)表示体积平均径,D(3,2)表示表面积平均径。
1.4 数据处理
所有实验设置3 个重复,结果以平均值±标准差表示。采用SPSS软件进行双因素方差分析。采用邓肯多重比较法(Duncan’s multiple range test)进行差异显著性分析(P<0.05)。采用Origin 8软件作图。
2 结果与分析
2.1 MP二级结构分析
由图1可知,在低盐或高盐浓度条件下,His处理均使MP的α-螺旋结构减少,并转变成其他二级结构。在低盐浓度条件下,0.2 g/100 mL His和0.4 g/100 mL His处理使得MP的α-螺旋结构相对含量由61.09%分别降至59.87%和57.33%(P<0.05);在高盐浓度条件下,0.2 g/100 mL His和0.4 g/100 mL His处理使得α-螺旋结构相对含量由68.45%分别降至56.58%和47.16% (P<0.05)。这与Guo Xiuyun等[8]研究结果相一致,该研究认为His可通过静电相互作用与肌球蛋白中酸性氨基酸残基结合,从而破坏肌球蛋白分子内及分子间的离子键,导致肌球蛋白发生解折叠。同时,随着His添加量的增加,MP的α-螺旋结构相对含量明显降低,MP解折叠程度与His添加量之间呈现明显的剂量依赖性关系。
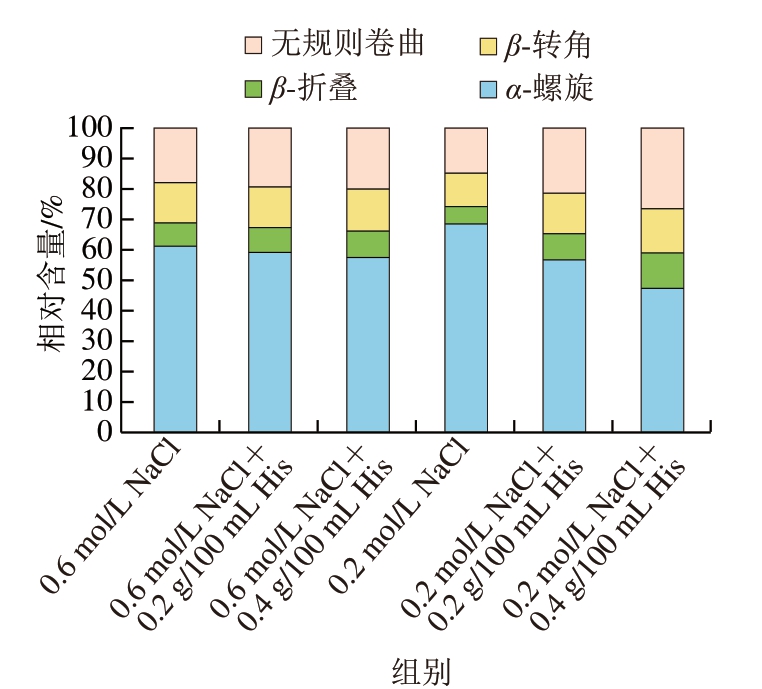
图1 不同盐浓度条件下His对MP二级结构的影响
Fig. 1 Effect of His on secondary structure of MP at different salt concentrations
2.2 MP表面疏水性分析
蛋白质表面疏水性的变化情况可以用来衡量蛋白质分子空间结构的变化[19]。由表1可知,MP表面疏水性随着盐浓度的提高而提高,这与Supanwa等[20]的研究结果相一致。随着盐浓度的升高,MP开始解聚集,呈单体状态,疏水基团逐渐暴露。在低盐浓度下,0.2 g/100 mL His和0.4 g/100 mL His处理使得表面疏水性分别升高21.75%和28.91%(P<0.05);高盐浓度下,0.2 g/100 mL His和0.4 g/100 mL His处理使得表面疏水性分别升高5.54%和10.50%(P<0.05)。说明在不同盐浓度条件下,His处理都能明显提高MP的表面疏水性。His处理破坏了MP的分子结构,使得芳香氨基酸基团暴露至肌球蛋白表面。同时,相同盐浓度条件下,0.4 g/100 mL His的作用显著高于0.2 g/100 mL His (P<0.05),这与MP二级结构变化相一致。在pH 6.5条件下,His带有正电荷,而MP带有负电荷。His可通过静电作用与MP中酸性氨基酸残基相结合,破坏维持MP二级结构稳定性的分子间及分子内离子键,从而导致MP解折叠并暴露MP分子内以及由于蛋白聚集而埋藏的疏水基团。王耀松等[21]也曾研究发现,His在一定程度上能促进乳清蛋白分子间解聚集、单个蛋白分子结构展开,从而使更多的疏水性基团外露。
表1 不同盐浓度条件下His对MP表面疏水性的影响
Table 1 Effect of His on surface hydrophobicity of MP at different salt concentrations
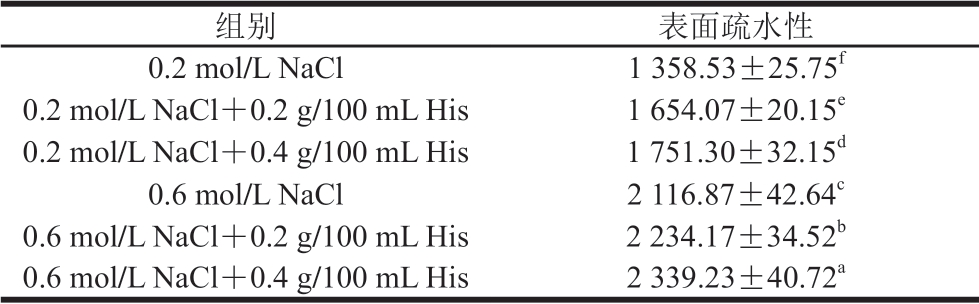
注:同列小写字母不同,表示不同处理组间差异显著(P<0.05)。下同。
2.3 MP体外消化率分析
由表2可知,在胃蛋白酶消化阶段,MP得到初步消化,消化率在50%左右(46.81%~51.66%)。这与马纪兵等[22]研究传统风干牦牛肉加工中MP氧化与体外蛋白酶消化阶段消化率的变化结果一致。相比于胃蛋白酶消化阶段,胰蛋白酶消化后中各样品的消化率显著上升 (P<0.05),说明在胰蛋白酶的作用下,MP进一步被水解消化。这是因为在蛋白质的胃消化阶段,胃蛋白酶主要作用的部位是蛋白质中酸性氨基酸或芳香族氨基酸所组成的肽键。于娜[23]的研究表明,胃蛋白酶倾向于剪切氨基端或羧基端为芳香族氨基酸(如苯丙氨酸、色氨酸和酪氨酸)或亮氨酸的肽键,而如果某一肽键氨基端第3个氨基酸为碱性氨基酸(如赖氨酸、精氨酸和组氨酸)或者该肽键的氨基端为精氨酸时,则不能有效对此肽键进行剪切。胰蛋白酶能选择性水解蛋白质中由赖氨酸或精氨酸的羧基所构成的肽链,并能在胃蛋白酶初步消化的基础上继续消化变性的蛋白质,因而胰蛋白酶消化后消化率显著高于胃蛋白酶消化阶段的消化率。
表2 不同盐浓度条件下His对MP体外消化率的影响
Table 2 Effect of His on in vitro digestibility of MP at different salt concentrations
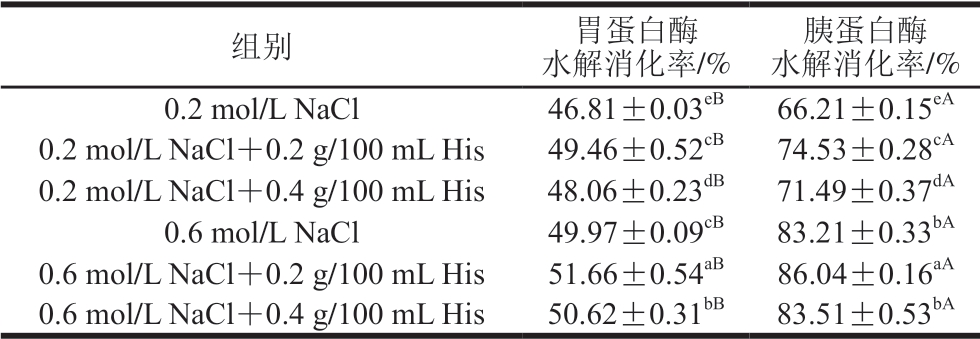
注:同行大写字母不同,表示胃蛋白酶水解与胰蛋白酶水解消化率差异显著(P<0.05)。下同。
胰蛋白酶水解消化率/%0.2 mol/L NaCl 46.81±0.03eB 66.21±0.15eA 0.2 mol/L NaCl+0.2 g/100 mL His 49.46±0.52cB 74.53±0.28cA 0.2 mol/L NaCl+0.4 g/100 mL His 48.06±0.23dB 71.49±0.37dA 0.6 mol/L NaCl 49.97±0.09cB 83.21±0.33bA 0.6 mol/L NaCl+0.2 g/100 mL His 51.66±0.54aB 86.04±0.16aA 0.6 mol/L NaCl+0.4 g/100 mL His 50.62±0.31bB 83.51±0.53bA组别 胃蛋白酶水解消化率/%
此外,不论在胃蛋白酶消化阶段还是胰蛋白酶消化阶段,MP体外消化率随着盐浓度的提高而提高。且添加His处理后的MP消化率均显著高于对照组 (P<0.05),而0.2 g/100 mL His处理组MP消化率显著高于0.4 g/100 mL His处理组(P<0.05)。蛋白质的结构变化会影响蛋白质被蛋白酶水解的速率。MP结构信息研究结果表明,0.2 g/100 mL His处理可引起MP结构的轻度变化,使其发生部分解折叠,暴露出更多的酶切位点,使得胃蛋白酶、胰蛋白酶更容易与MP结合[24],利于酶消化,从而提高MP体外消化率。而0.4 g/100 mL His处理组的MP解折叠程度显著高于0.4 g/100 mL His处理组,这可能导致MP与胃蛋白酶、胰蛋白酶结合的位点被修饰,从而降低胃蛋白酶、胰蛋白酶对其水解的 敏感性[25],因而0.4 g/100 mL His处理组的MP体外消化率低于0.2 g/100 mL His处理组。总而言之,在低盐或高盐浓度条件下,添加His均能提高MP的消化率,从而使更多的可溶性蛋白在胃肠道中得以释放,进而更有利于人体的吸收[26]。
2.4 SDS-PAGE分析
由图2A可知,MP经胃蛋白酶消化后,大分子蛋白被水解,MP中的主要蛋白质肌球蛋白重链和肌动蛋白均部分水解成不同多肽片段,且胃蛋白酶对肌球蛋白重链的水解作用强于对肌动蛋白的水解作用。高盐浓度(0.6 mol/L NaCl)处理后的条带灰度明显低于低盐浓度(0.2 mol/L NaCl)处理,这是由于高盐浓度条件下蛋白溶解度高,蛋白更加分散,更易于胃蛋白酶消化。此外,His处理组的条带灰度均明显低于未添加His的处理组,说明His促进了胃蛋白酶对MP的水解。由图2B可知,MP经胰蛋白酶进一步水解后,大分子的蛋白或多肽均被完全水解,形成小分子的多肽或氨基酸。总之,经过胃蛋白酶、胰蛋白酶2 步消化后,不同处理组电泳条带灰度与消化前相比发生明显变化,显著变浅甚至消失,蛋白发生大幅降解,这与Paolella等[27]研究的模拟体外胃肠道消化后火腿MP的电泳结果一致。而低盐或高盐条件下添加His均能显著促进胃蛋白酶/胰蛋白酶对MP的水解,与体外消化率结果相一致。
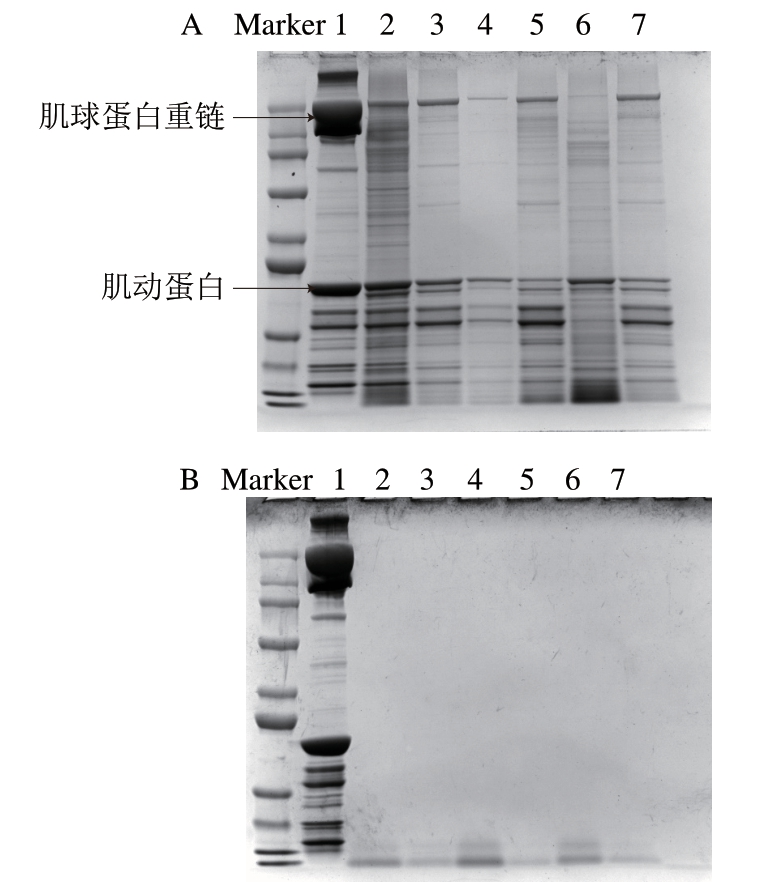
图2 体外消化产物的SDS-PAGE图谱
Fig. 2 SDS-PAGE patterns of in vitro digested MP
A. 胃蛋白酶消化;B. 胃蛋白酶+胰蛋白酶消化;1. MP;2. 0.2 mol/L NaCl;3. 0.2 mol/L NaCl+0.2 g/100 mL His;4. 0.2 mol/L NaCl+0.4 g/100 mL His;5. 0.6 mol/L NaCl;6. 0.6 mol/L NaCl+0.2 g/100 mL His;7. 0.6 mol/L NaCl+0.4 g/100 mL His。
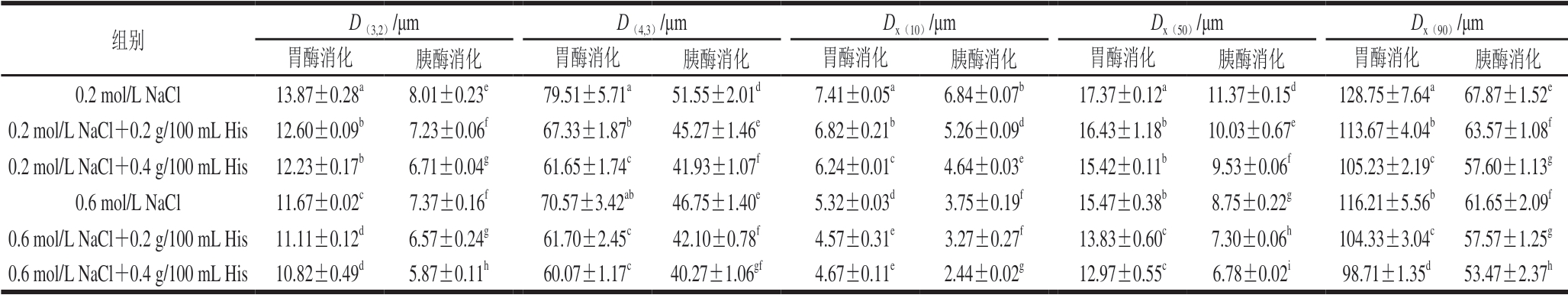
2.5 消化产物粒径分析
由表3可知,经胃蛋白酶消化后,高盐浓度处理组的MP消化产物粒径均显著低于低盐处理组,且添加His处理的MP经消化后其粒径指标D(3,2)、D(4,3)、Dx(10)、 Dx(50)和Dx(90)均显著降低(P<0.05)。再经过胰蛋白酶消化后,MP消化产物的各项粒径指标与胃蛋白酶消化后相比进一步减小,这与詹光等[28]的研究结果相一致。且胰蛋白酶消化结果与经过胃蛋白酶消化后的变化趋势一致,高盐浓度处理组MP消化产物粒径均显著低于低盐处理组,且添加His处理的MP经消化后其粒径指标D(3,2)、D(4,3)、Dx(10)、Dx(50)和Dx(90)均显著降低 (P<0.05)。如SDS-PAGE图谱所示,经胃蛋白酶和胰蛋白酶水解后,MP发生降解,大分子质量蛋白被水解成小分子质量的多肽或氨基酸,进而使得消化产物粒径下降[29]。而His的添加能够进一步促进MP水解,从而降低消化产物粒径。Promeyrat等[30]研究表明,蛋白质疏水性与粒径相关。经His处理的MP表面疏水性增大,疏水基团暴露增加,进而提供了更多酶切位点,使得MP中的疏水性氨基酸基团组成的肽键能被胃蛋白酶和胰蛋白酶更加高效地水解,MP降解程度更高,从而导致胃蛋白酶和胰蛋白酶消化后的MP粒径小于未添加His处理组。
表3 不同盐浓度条件下His对MP体外消化产物粒径的影响
Table 3 Effect of His on particle size of in vitro digested MP at different salt concentrations
3 结 论
本研究分析低盐及高盐条件下0、0.2、0.4 g/100 mL的His添加量对猪肉MP结构及体外消化特性的影响。结果表明,在低盐和高盐条件下,His的添加均引起MP发生解折叠,从而暴露出更多酶切位点,促进胃蛋白酶和胰蛋白酶对MP的酶解作用,降低酶解粒径并提高MP体外消化率。本研究结果为低盐肉制品的开发和应用提供了参考。
[1] EOIN D. Reducing salt: a challenge for meat industry[J]. Meat Science, 2006, 74(1): 188-196. DOI:10.1016/j.meatsci.2006.04.014.
[2] HE F J, MACGREGOR G A. Reducting population salt intake worldwide: from evidence to implementation[J]. Progress in Cardiovascular Diseases, 2010, 52(5): 363-382. DOI:10.1016/j.pcad.2009.12.006.
[3] TAYLOR C, DOLYE M, WEBB D. The safety of sodium reduction in the food supply: a cross-discipline balancing act-workshop proceedings[J]. Critical Reviews in Food Science and Nutrition, 2018, 58(10): 1650-1659. DOI:10.1080/10408398.2016.1276431.
[4] ALIÑO M, GRAU R, FUENTES A, et al. Influence of low-sodium mixtures of salts on the post-salting stage of dry-cured ham process[J]. Journal of Food Engineering, 2010, 99(2): 198-205. DOI:10.1016/j.jfoodeng.2010.02.020.
[5] GUÀRDIA M D, GUERRERO L, GELABERT J, et al. Sensory characterization and consumer acceptability of small calibre fermented sausages with 50% substitution of NaCl by mixtures of KCl and potassium lactate[J]. Meat Science, 2008, 80(4): 1225-1230. DOI:10.1016/j.meatsci.2008.05.031.
[6] GOU P, GUERRERO L, GELABERT J, et al. Potassium chloride, potassium lactate and glycine as sodium chloride substitutes in fermented sausages and in dry-cured pork loin[J]. Meat Science, 1996, 42(1): 37-48. DOI:10.1016/j.meatsci.2008.05.031.
[7] ZHANG Yawei, CHENG Qiliang, YAO Yao, et al. A preliminary study: saltiness and sodium content of aqueous extracts from plants and marine animal shells[J]. European Food Research and Technology, 2014, 238(4): 565-571. DOI:10.1007/s00217-013-2136-1.
[8] GUO Xiuyun, PENG Zengqi, ZHANG Yawei, et al. The solubility and conformational characteristics of porcine myosin as affected by the presence of L-lysine and L-histidine[J]. Food Chemistry, 2015, 170: 212-217. DOI:10.1016/j.foodchem.2014.08.045.
[9] HAYAKAWA T, ITO T, WAKAMATSU J, et al. Myosin is solubilized in a neutral and low ionic strength solution containing L-histidine[J]. Meat Science, 2009, 82(2): 151-154. DOI:10.1016/j.meatsci.2009.01.002.
[10] HAYAKAWA T, ITO T, WAKAMATSU J, et al. Myosin filament depolymerizes in a low ionic strength solution containing L-histidine[J]. Meat Science, 2010, 84(4): 742-746. DOI:10.1016/j.meatsci.2009.11.010.
[11] ZHANG Yawei, WU Junjun, JAMALI M A, et al. Heat-induced gel properties of porcine myosin in a sodium chloride solution containing L-lysine and L-histidine[J]. LWT-Food Science and Technology, 2017, 85: 16-21. DOI:10.1016/j.lwt.2017.06.059.
[12] GUO Xiuyun, GAO Feng, ZHANG Yawei, et al. Effect of L-histidine and L-lysine on the properties of oil-in-water emulsions stabilized by porcine myofibrillar proteins at low/high ionic strength[J]. LWTFood Science and Technology, 2021, 141: 1-8. DOI:10.1016/j.lwt.2021.110883.
[13] HAN Minyi, ZHANG Yijun, FEI Ying, et al. Effect of microbial transglutaminase on NMR relaxometry and microstructure of pork myofibrillar protein gel[J]. European Food Research and Technology, 2009, 228(4): 665-670. DOI:10.1007/s00217-008-0976-x.
[14] ALIX A J P, PEDANOU G, BERJOT M. Fast determination of the quantitative secondary structure of proteins by using some parameters of the Raman amide I band[J]. Journal of Molecular Structure, 1988, 174: 159-164. DOI:10.1016/0022-2860(88)80151-0.
[15] 余晶梅, 林东强, 童红飞, 等. 荧光探针法研究牛血清白蛋白和免疫球蛋白的表面疏水特性[J]. 高校化学工程学报, 2014, 28(4): 771-776. DOI:10.3969/j.issn.1003-9015.2014.04.013.
[16] WEN Siying, ZHOU Guanghong, SONG Shangxin, et al. Discrimination of in vitro and in vivo digestion products of meat proteins from pork, beef, chicken, and fish[J]. Proteomics, 2015, 15(21): 3688-3698. DOI:10.1002/pmic.201500179.
[17] LAEMMLI U K. Cleavage of structural proteins during assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685. DOI:10.1038/227680a0.
[18] GATELLIER P, SANTÉ-LHOUTELLIER V. Digestion study of proteins from cooked meat using an enzymatic microreactor[J]. Meat Science, 2009, 81(2): 405-409. DOI:10.1016/j.meatsci.2008.09.002.
[19] 贾娜, 林世文, 王乐田, 等. 没食子酸诱导肌原纤维蛋白巯基含量和表面疏水性变化对蛋白凝胶特性的影响[J]. 食品科学, 2020, 41(22): 1-7. DOI:10.7506/spkx1002-6630-20190829-323.
[20] SUPANWA T, PARK J W. Role of ionic strength in biochemical properties of soluble fish proteins isolated from cryoprotected Pacific whiting mince[J]. Journal of Food Biochemistry, 2005, 29(2): 132-151. DOI:10.1111/j.1745-4514.2005.00005.x.
[21] 王耀松, 马天怡, 胡荣蓉, 等. L-组氨酸修饰乳清蛋白结构及其热诱导凝胶特性[J]. 食品科学, 2021, 42(6): 16-23. DOI:10.7506/spkx1002-6630-20200128-282.
[22] 马纪兵, 宋艳艳, 张丽, 等. 传统风干牦牛肉加工中肌原纤维蛋白氧化与体外消化性变化[J]. 农业工程学报, 2020, 36(12): 296-302. DOI:10.11975/j.issn.1002-6819.2020.12.035.
[23] 于娜. 卵黄多肽的分离纯化及降血脂活性研究[D]. 沈阳: 沈阳农业大学, 2012: 10-12.
[24] CHEN Lin, LI Chunbao, ULLAH N, et al. Different physicochemical, structural and digestibility characteristics of myofibillar protein from PSE and normal pork before and after oxidation[J]. Meat Science, 2016, 121: 228-237. DOI:10.1016/j.meatsci.2016.06.010.
[25] SANTE-LHOUTELLIER V, ENGEL E, AUBRY L, et al. Effect of animal (lamb) diet and meat storage on myofibrillar protein oxidation and in vitro digestibility[J]. Meat Science, 2008, 79(4): 777-783. DOI:10.1016/j.meatsci.2007.11.011.
[26] 韩志文, 刘义, 吴昊, 等. 茶多酚添加量对发酵型豆乳中蛋白质消化特性的影响[J]. 常熟理工学院学报, 2022, 36(2): 49-54. DOI:10.16101/j.cnki.cn32-1749/z.2022.02.014.
[27] PAOLELLA S, FALAVIGNA C, FACCINI A. Effect of drycured ham maturation time on simulated gastrointestinal digestion: characterization of the released peptide fraction[J]. Food Research International, 2015, 67: 136-144. DOI:10.1016/j.foodres.2014.10.026.
[28] 詹光, 乐怡, 王颖, 等. 不同地域典型干腌火腿肌原纤维蛋白的氧化特性及体外消化性对比[J]. 食品科学, 2019, 40(23): 97-103. DOI:10.7506/spkx1002-6630-20181005-021.
[29] 李莹, 刘源, 张丹妮, 等. 传统与现代工艺金华火腿蛋白质的体外消化特性研究[J]. 南京农业大学学报, 2018, 41(1): 163-171. DOI:10.7685/jnau.201704007.
[30] PROMEYRAT A, GATELLIER P, LEBRET B, et al. Evaluation of protein aggregation in cooked meat[J]. Food Chemistry, 2010, 121(2): 412-417. DOI:10.10161/.foodchem.2009.12.057.