武昌鱼(Megalobrama amblycephala)又名团头鲂、鳊鲂,原产于湖北省鄂州市梁子湖,是我国淡水鱼类养殖品种之一[1]。武昌鱼具有生长速度快、抗病能力强、肉质鲜美、细嫩等特点。2020年中国鳊鱼养殖总产量为78.17 万t,其中湖北总养殖量达到31.11%,而青海、西藏、海南等地合计总养殖量占比低于0.03%[2]。武昌鱼养殖地主要分布在湖北,以鲜活零售为主,但由于分布地区的局限性,难以满足其他省份的实际需求。活鱼安全性和营养价值较高,并且可较好地保持原有肉质风味和滋味,工厂也一般会选用鲜活的武昌鱼用于加工。目前,活鱼的主要运输方式仍是有水运输,通过专门的活鱼运输车实现鲜活武昌鱼跨地域调配,解决资源缺乏和过剩的问题[3]。影响运输过程中活鱼肌肉品质的主要因素是氧气、运输时间、温度和运输密度等[4]。因此实际运输过程中为保障鱼类存活率,会采用通液氧、加冰块和更换水体等措施[5]。
鱼体由头、躯干、尾、鳍4 部分组成,肌肉是主要食用部分[6]。肌肉品质对产品的加工特性和贮藏特性有决定性影响,并最终影响消费者接受程度。鱼肉中优质蛋白、维生素含量高,鲜味特征明显,且消化吸收率高,因此广受消费者的喜爱[7]。通常通过营养价值、组织结构、风味特征、感官品质和物理性质五方面来评价鱼类肌肉品质[5],其中色度和持水性是鱼肌肉重要物理性质,影响肉色、口感等食用品质。已有研究表明,鱼类在受到各种应激源刺激后,容易造成鱼体过度消耗能量物质、代谢紊乱,从而影响肌肉品质。Hultmann等[8]研究发现,鳕鱼(Gadus morhua)在过度运动后,其肉的持水性和硬度降低,肉色变黄;Wu Yiwen等[9]报道了短时运输虹鳟(Oncorhynchus mykiss)会导致肌肉的pH值、剪切力、红度值(a*)增加,而亮度值(L*)降低;Lefèvre等[10]研究表明,低氧胁迫会导致虹鳟的肉色变浅,肉质变软。但目前关于武昌鱼保活运输过程中肌肉品质如何变化尚不明确。
因此,本研究模拟商业武昌鱼保活运输过程,利用色彩色差计、紫外分光光度计、超高效液相色谱等技术手段研究运输后武昌鱼肌肉品质的变化,以期为武昌鱼保活运输提供理论参考依据。
1 材料与方法
1.1 材料与试剂
武昌鱼平均体长(3 3.5±5.0) c m、体质量(575±20) g,购于湖北省武汉市东西湖养殖基地。实验用水为池塘水,水温21.2~22.5 ℃,溶氧量9.32~9.89 mg/L,pH值7.31。
无水乙醇、浓硫酸、氢氧化钠、磷酸、磷酸二氢钾、酒石酸钾钠、无水硫酸铜(均为分析纯) 国药集团化学试剂有限公司;甲醇、乙腈(均为色谱纯)美国Muskegon公司;乳酸、糖原试剂盒 南京建成生物工程研究所;次黄嘌呤(hyperxanthine,Hx)、次黄嘌呤核苷(inosine,HxR)、5’-次黄嘌呤核苷酸(inosinic acid,IMP)、5’-一磷酸腺苷(5’-adenosine monophosphate,AMP)、5’-二磷酸腺苷(5’-adenosine diphosphate,ADP)、5’-三磷酸腺苷(5’-adenosine triphosphate,ATP) 上海源叶生物科技有限公司。
1.2 仪器与设备
汽车模拟运输平台 星梭智能设备(厦门)有限公司;气体汇流排 上海擎煌贸易有限公司;氧气 武汉双龙和商贸有限责任公司;TESTO 205 pH测量仪 德图仪器国际贸易(上海)有限公司;分析天平 上海奥豪斯国际贸易有限公司;TGL-16GA台式高速离心机 湖南星科科学仪器有限公司;722可见分光光度计 上海精密科学仪器有限公司;CR-400色差仪 日本柯尼卡-美能达公司;IKA2000高速分散均质机 德国IKA仪器设备有限公司;BS210电子分析天平 德国赛多利斯公司;UPT-I-10/20高纯水制备仪 上海向帆仪器有限公司;Waters 2D超高效液相色谱仪 美国Waters公司。
1.3 方法
1.3.1 模拟运输实验
武昌鱼捕捞后,随机分成4 组,每组10 条,立即转入塑料保温箱(54.5 cm×37 cm×34.5 cm)中,按照质量加入2 倍体积的水,加入冰袋,2 h内运输到实验室,再转置到模拟运输平台上继续运输,在该过程中保持振动频率为120 r/ min。在全程运输过程中,水温维持在(12±1) ℃,溶氧量>10 mg/L。实验中运输程序和条件参考中国运输武昌鱼的商业化模式[5]。
1.3.2 取样
从4 个运输箱中分别取运输时间(从捕捞后开始计时)为3、6、12、24 h的鱼。取自背鳍以下、侧线以上的背部肌肉。鱼肉切成20 mm×20 mm×10 mm小块,用于色度分析;剩余背部肌肉一部分用于测定pH值、持水性,一部分-80 ℃冷冻,后续用于测定乳酸、肌糖原、ATP及其代谢关联产物。
1.3.3 pH值测定
将插入式pH计的电极插入鱼肉中,显示屏读数即为武昌鱼背部肌肉的pH值。
1.3.4 持水性测定
参考Subbaiah等[11]的方法,略有改动。称取约3 g样品用双层定性滤纸包裹,4 000 r/min离心15 min。持水性按式(1)计算。
式中:m1为离心前质量/g;m2为离心后质量/g。
1.3.5 色度测定
参考Shi Liu等[12]的方法,略有改动。背部鱼肉切成20 mm×20 mm×10 mm小块,采用便携式色彩色差计,使用前用标准白板校准,记录下L*、a*、黄度值(b*)。白度(W)按式(2)计算。
式中:L*表示样品的亮度;a*为正表示样品偏红,为负表示样品偏绿;b*为正表示样品偏黄,为负表示样品偏蓝。
1.3.6 乳酸、肌糖原含量测定
采用乳酸和肌糖原试剂盒,按照其说明书进行实验。肌糖原测定波长为620 nm,含量以鱼肉为基准;乳酸测定波长为530 nm,含量以蛋白质为基准。
1.3.7 ATP及其代谢关联产物测定
样品采用超高效液相色谱仪进行分离鉴定,参考刘敬科[13]的方法。在Acquity UPLC BEH Amide色谱柱(2.1 mm×100 mm,1.7 μm,Waters)上进行分离。流动相组成:A为乙腈、B为10 mmol/L磷酸二氢钠溶液、C为体积分数0.1%磷酸水溶液;梯度洗脱程序:0~6 min,88%~80% A、7%~17.5% B、5%~2.5% C;6 ~8 m i n,8 0%~7 7% A、1 7.5 0%~2 2% B、2.5%~1% C;8~9 min,77%~65% A、22%~35% B、1%~0% C;9 ~1 0.7 m i n,6 5%~5 5% A、35%~45% B;10.7~10.8 min,55%~88% A、45%~7% B、0%~5% C;10.8~23.0 min,88% A、7% B、5% C。色谱分离条件设置如下:柱温50 ℃;流速0.5 mL/ min;进样量5 μL。采用团队前期测定的ATP及其代谢关联产物的标准曲线(表1),横坐标(x)为ATP及其代谢关联产物浓度(pmol/μL),纵坐标(y)为峰面积,参考刘敬科[13]的方法进行含量计算,结果表示为mg/100 g。
表 1 ATP及其代谢关联产物标准曲线
Table 1 Standard curves for quantification of ATP and its related metabolites

ATP及其代谢关联产物 标准曲线 R2 Hx y=1 601.34x+2 224.80 0.992 HxR y=3 473.10x-3 621.80 0.991 IMP y=6 316.42x-39 896.33 0.997 AMP y=4 675.10x-25 614.67 0.997 ADP y=1 182.20x+54 022.00 0.990 ATP y=4 107.35x-54 725.94 0.992
1.4 数据处理
采用Origin 2021软件作图,用SAS V8软件进行分析,显著性分析方法为最小显著性差异法,P<0.05表示差异显著。
2 结果与分析
2.1 保活运输对武昌鱼肌肉pH值的影响
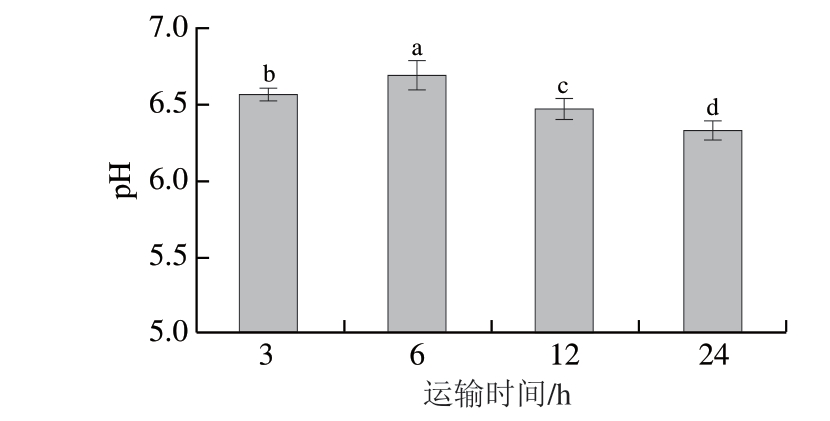
图 1 保活运输时间对武昌鱼背部肌肉pH值的影响
Fig. 1 Effect of live transportation time on the pH value of the dorsal muscle of Wuchang bream
小写字母不同,表示差异显著(P<0.05)。图2~4同。
由图1可知,武昌鱼肌肉pH值随着运输时间的延长呈现先增加再降低的趋势(P<0.05)。运输3 h后武昌鱼肌肉pH值为6.57,运输6 h后上升到6.69,然后在运输12、24 h后分别下降6.47和6.33。与运输6 h相比,运输24 h后pH值下降5%。Refaey等[14]报道,随着运输时间的延长,斑点叉尾鮰pH值下降,运输前为6.22,运输24 h后下降至5.97,运输72 h后下降至5.90;丁亚涛[15]研究表明,鳊鱼运输前肌肉pH值为6.92,运输12 h后下降至6.78,24 h后下降至6.71;秦旭[16]研究也表明,彭泽鲫在运输38 h后,肌肉pH值由6.97下降至6.88;以上研究均表明,长时间的有水保活运输会导致鱼肌肉pH值降低,与本实验的研究结果一致。
综上所述,随着保活运输时间的延长,武昌鱼肌肉pH值会显著降低(P<0.05)。肌肉pH值下降的原因可能是:1)鱼体受到捕捞、饥饿、惊吓、拥挤等应激源的刺激,肌肉活动(游泳、逃避行为)增加,这些行为导致肌肉中储备的能量被消耗,肌肉组织中的糖原发生有氧或无氧酵解,生成乳酸、丙酮酸等有机酸,有机酸在肌肉中积累[17];2)随着有水保活运输时间的延长,水体中氨氮浓度升高,非离子氨会与氧气竞争血红蛋白,导致鱼体组织缺氧,无氧糖酵解反应加剧,pH值下降[18];3)磷酸肌酸途径合成ATP过程中还会产生肌酸,肌酸也会导致pH值下降。
2.2 保活运输对武昌鱼肌肉持水性的影响
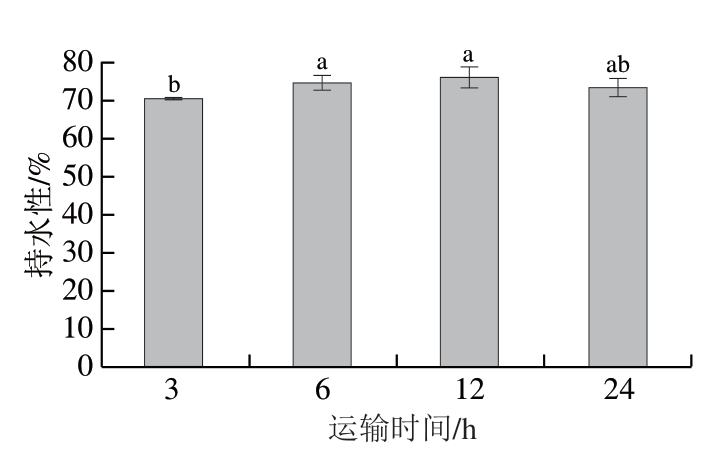
图 2 保活运输时间对武昌鱼背部肌肉持水性的影响
Fig. 2 Effect of live transportation time on the water-holding capacity of the dorsal muscles of Wuchang bream
由图2可知,武昌鱼在有水运输3 h后其肌肉持水性为70.33%,当运输时间延长至6 h时,持水性显著升高为74.48%(P<0.05),但随着运输时间继续延长到12、24 h时,持水性分别为76.05%和73.33%,无显著性变化(P<0.05)。刘骁等[19]研究表明,无水运输团头鲂,在运输14 h后其肌肉持水性没有显著变化;秦旭[16]研究表明,彭泽鲫在低温保活运输38 h后,肌肉持水性没有显著变化。以上实验结果与本实验结果相似。
持水性是肌肉品质的一个重要指标,是指肌肉在外力作用下保持原有水分的能力。Gornik等[20]报道,肌肉pH值变化与肌原纤维蛋白上的净表面电荷数量有关。鱼体在运输过程中肌肉发生收缩,肌球蛋白和肌动蛋白在ATP的存在下形成肌动球蛋白[21]。随着pH值下降,肌原纤维蛋白上的净表面电荷数量减少,由此使得肌肉丧失部分保水能力。运输3 h后持水性较低是由于鱼体在此运输阶段经历捕捞、装箱、转运等多种应激源应激,导致厌氧糖酵解反应加快,乳酸积累,pH值下降,持水性下降。但是运输6 h后,鱼体适应所处的环境,应激行为减少,持水性又缓慢升高。
2.3 保活运输对武昌鱼肌肉色度的影响
表 2 保活运输时间对武昌鱼背部肌肉色度的影响
Table 2 Effect of live transportation time on color parameters of the dorsal muscle of Wuchang bream

注:同列小写字母不同,表示差异显著(P<0.05)。表3同。
运输时间/h L* a* b* W 3 52.27±0.34a 0.29±0.10b -2.11±0.69a 52.22±0.35a 6 52.63±2.25a -0.30±0.12c -1.95±0.99a 52.58±2.28a 12 50.12±0.87b 0.15±0.06b -2.29±0.71a 50.06±0.89b 24 47.71±1.15c 1.31±0.32a -2.31±0.52a 47.64±1.15c
由表2可知,随着运输时间的延长,武昌鱼肌肉W、L*先升高后显著降低,a*先显著下降后升高,b*无显著变化。运输6 h后,W、L*分别升高至52.58、52.63,a*下降至-0.30。而运输24 h后,鱼背部肌肉的W、L*分别降低至47.64、47.71,a*升高至1.31。
综上所述,武昌鱼肌肉的W和L*随着运输时间的延长而降低,a*随着运输时间的延长而升高。a*显著增加可能是运输过程中,武昌鱼受到应激后肌肉收缩加快,影响了鱼体内的虾青素和角黄素与肌动球蛋白酸复合物的结合能力[22]。也可能是与鱼体在应激条件下,肌肉组织发生充血(这与实验时观察到鱼体表面泛红现象一致)有关[23]。a*在运输6 h时突然降低,这可能是由于鱼体适应了环境,不再剧烈挣扎,但是随着运输时间的继续延长,鱼体逐渐疲惫,水质劣变,导致其色度品质继续变化。L*表示样品的明暗程度,L*降低,表明鱼体的体色变暗,这可能与应激导致黑色素细胞刺激素释放增加有关[24]。W的变化主要与L*有关,所以变化趋势与L*基本一致。
2.4 保活运输对武昌鱼肌肉乳酸含量的影响
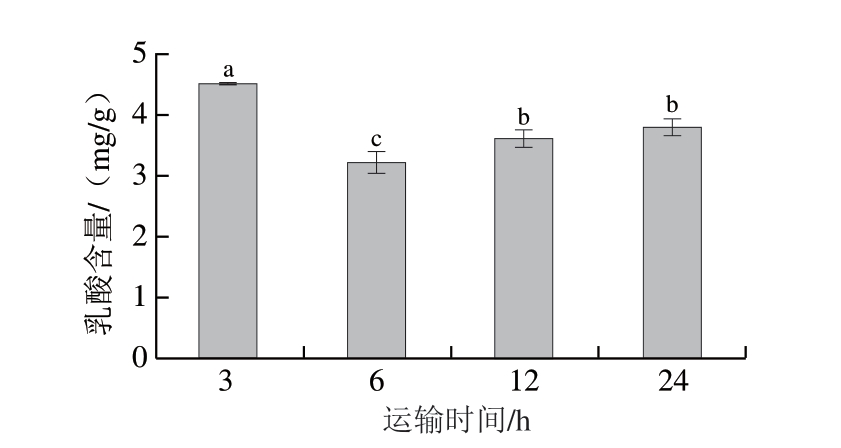
图 3 保活运输时间对武昌鱼背部肌肉乳酸含量的影响
Fig. 3 Effect of live transportation time on the lactic acid content of the dorsal muscle of Wuchang bream
由图3可知,随着运输时间的延长,武昌鱼肌肉乳酸含量先下降后升高,从4.50 mg/g下降至3.21 mg/g,再升高至3.81 mg/g,与上文pH值变化趋势一致(图1)。鱼体在运输3 h期间经历捕捞、装箱、转运等多个环节,产生了急性应激和剧烈的肌肉活动,导致鱼体的厌氧糖酵解增加,乳酸急剧积累[25],结果与pH值变化趋势一致。运输时间6 h时,鱼体适应所处的环境,应激行为减少,厌氧糖酵解反应减弱,乳酸产生量减少。但是随着运输时间继续延长至12、24 h,乳酸含量显著升高,可能是由于长时间运输,鱼体疲惫且水体被污染后氨氮浓度升高,造成缺氧,厌氧糖酵解反应加快,乳酸积累。鱼体长时间处于应激条件下,储备的能量将耗尽,肌肉中积累的乳酸将被循环系统代谢[17],因此运输12、24 h的乳酸含量升高可能是由于糖酵解过程造成的,但24 h后乳酸含量并未高于运输3 h可能是由于乳酸通过循环系统被代谢。
2.5 保活运输对武昌鱼肌肉肌糖原含量的影响
由图4可知,运输3~12 h,武昌鱼肌肉的肌糖原含量没有显著变化,但在运输24 h后,含量显著下降至1.25 mg/g。与12 h相比,运输24 h后肌糖原含量下降28%。鱼类在运输过程中体内可能存在未经消化的残饵,鱼类可从这些物质中获取所需的碳水化合物以及利用肝脏和肌肉中的糖原来合成生命活动所需的ATP[26-27],所以在运输3~12 h内,肌糖原的含量变化不显著。当运输时间延长至24 h时,残饵几乎全部消耗完,鱼体无法从外界获取碳水化合物,加快利用肝脏和肌肉中的糖原,导致肌糖原含量显著下降(P<0.05);且随着运输时间的延长,鱼体受到氨氮胁迫,分子氨和氧气竞争结合血红蛋白,降低循环系统对氧的输送能力,造成鱼类组织缺氧[21]。
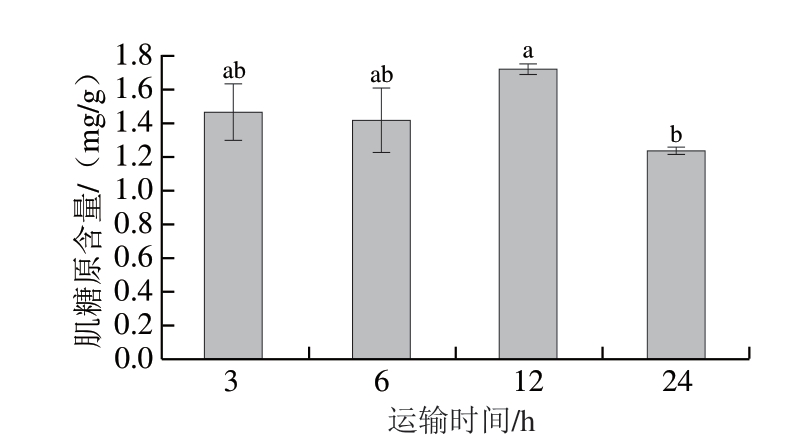
图 4 保活运输时间对武昌鱼背部肌肉肌糖原含量的影响
Fig. 4 Effect of live transportation time on muscle glycogen content of the dorsal muscles of Wuchang bream
2.6 保活运输对武昌鱼肌肉ATP及其代谢关联产物含量的影响
表 3 保活运输时间对武昌鱼背部肌肉ATP及其代谢关联产物含量的影响
Table 3 Effect of live transportation time on the contents of ATP and its related metabolites in the dorsal muscles of Wuchang bream mg/100 g
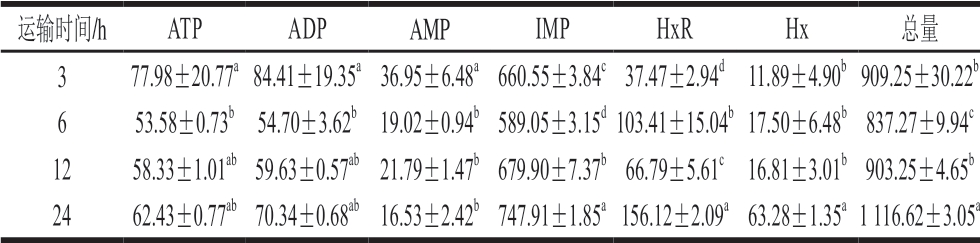
运输时间/h ATP ADP AMP IMP HxR Hx 总量3 77.98±20.77a 84.41±19.35a 36.95±6.48a 660.55±3.84c 37.47±2.94d 11.89±4.90b 909.25±30.22b 6 53.58±0.73b 54.70±3.62b 19.02±0.94b 589.05±3.15d 103.41±15.04b 17.50±6.48b 837.27±9.94c 12 58.33±1.01ab 59.63±0.57ab 21.79±1.47b 679.90±7.37b 66.79±5.61c 16.81±3.01b 903.25±4.65b 24 62.43±0.77ab 70.34±0.68ab 16.53±2.42b 747.91±1.85a 156.12±2.09a 63.28±1.35a 1 116.62±3.05a
由表3可知,随着运输时间的延长,武昌鱼肌肉中ATP、ADP、AMP含量减少,Hx、HxR、IMP含量增加,表明ATP在不断降解。IMP所占比例最高,为鱼肉中的主要核苷酸类滋味物质,与曹杰等[28]的研究结果一致。ATP分解会产生ADP,导致ADP含量增加;2 分子ADP可以产生1 分子ATP和1 分子AMP;AMP在AMP脱氨酶的作用下分解为IMP和氨,IMP在肌肉中积累。因此鱼类中IMP含量较高。IMP会发生进一步降解,生成Hx和HxR[29]。鱼肉中的IMP是主要鲜味物质,使得鱼肉具有令人愉悦的甜味和新鲜风味,而HxR和Hx是引起异味的主要物质,Hx积累多过会导致鱼肉产生苦味[30]。
运输时间为3 h时,武昌鱼肌肉中ATP、ADP和AMP含量显著高于其他组别,但随着运输时间的延长(6~24 h),ATP含量稳定,可能是由于ATP、ADP和AMP的合成速率和分解速率达到了平衡。AMP含量的减少说明其在不断发生降解,不断生成IMP,IMP含量显著升高。运输6~24 h,肌肉中的HxR、Hx含量显著升高,表明IMP不断降解生成这些物质,在运输24 h时此现象尤其明显,表明长时间的运输会加快ATP的降解。
3 结 论
运输时间会显著影响武昌鱼的肌肉品质,其主要原因可能与应激反应和鱼体能量物质的消耗有关。短时运输(3 h)内,受强烈应激影响,武昌鱼的肌肉品质较差;随着运输时间延长(6 h),鱼体可能增强了对环境应激的适应,肌肉品质有所提升,表现为乳酸含量降低,持水性、W升高;但随着运输时间的继续延长(>12 h),武昌鱼的能量物质(糖原、ATP)含量呈现下降的趋势,导致乳酸积累,pH值、持水性、W和L*下降,a*升高、鲜味物质(IMP)、苦味物质(HxR、Hx)含量均升高,肌肉品质在运输后变化显著。
[1] ZHANG Yuanyuan, LIU Bo, GE Xianping, et al. The influence of various feeding patterns of emodin on growth, non-specific immune responses, and disease resistance to Aeromonas hydrophila in juvenile Wuchang bream (Megalobrama amblycephala)[J]. Fish and Shellfish Immunology, 2014, 36(1): 187-193. DOI:10.1016/j.fsi.2013.10.028.
[2] 农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 2021中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2022: 25-31.
[3] 母运龙, 李慧, 彭海川, 等. 鱼类保活运输技术的研究进展[J]. 四川农业科技, 2021(12): 62-64; 67. DOI:10.3969/j.issn.1004-1028.2021.12.019.
[4] HUR J W, GIL H W, CHOI S H, et al. Anesthetic efficacy of clove oil and the associated physiological responses in olive flounder(Paralichthys olivaceus)[J]. Aquaculture Reports, 2019, 15(C):100227. DOI:10.1016/j.aqrep.2019.100227.
[5] 彭玲, 尤娟, 熊光权, 等. 物流运输对鱼类肌肉品质影响研究进展[J].肉类研究, 2021, 35(12): 54-63. DOI:10.7506/rlyj1001-8123-20210531-164.
[6] PERIAGO M J, AYALA M D, LÓPEZ-ALBORS O, et al. Muscle cellularity and flesh quality of wild and farmed sea bass, Dicentrarchus labrax L.[J]. Aquaculture, 2005, 249(1): 175-188. DOI:10.1016/j.aquaculture.2005.02.047.
[7] TILAMI S K, SAMPELS S. Nutritional value of fish: lipids,proteins, vitamins, and minerals[J]. Reviews in Fisheries Science and Aquaculture, 2017, 26(2): 243-253. DOI:10.1080/23308249.2017.139 9104.
[8] HULTMANN L, PHU T M, TOBIASSEN T, et al. Effects of preslaughter stress on proteolytic enzyme activities and muscle quality of farmed Atlantic cod (Gadus morhua)[J]. Food Chemistry, 2012,134(3): 1399-1408. DOI:10.1016/j.foodchem.2012.03.038
[9] WU Yiwen, YOU Xiaopeng, SUN Weiqing, et al. Insight into acute heat stress on meat qualities of rainbow trout (Oncorhynchus mykiss)during short-time transportation[J]. Aquaculture, 2021, 543(15):737013. DOI:10.1016/j.aquaculture.2021.737013.
[10] LEFÈVRE F, BUGEON J, AUPÉRIN B, et al. Rearing oxygen level and slaughter stress effects on rainbow trout flesh quality[J]. Aquaculture, 2008, 284(1): 81-89. DOI:10.1016/j.aquaculture.2008.07.017.
[11] SUBBAIAH K, MAJUMDAR R K, CHOUDHURY J, et al. Protein degradation and instrumental textural changes in fresh nile tilapia(Oreochromis niloticus) during frozen storage[J]. Journal of Food Processing and Preservation, 2015, 39(6): 2206-2214. DOI:10.1111/jfpp.12465.
[12] SHI Liu, YIN Tao, WANG Lan, et al. Effect of pre-chilling time on the physicochemical properties of channel catfish during frozen storage[J].International Journal of Refrigeration, 2020, 115: 56-62. DOI:10.1016/j.ijrefrig.2020.01.015.
[13] 刘敬科. 鲢鱼风味特征及热历史对鲢鱼风味的影响[D]. 武汉: 华中农业大学, 2009: 57-58.
[14] REFAEY M M, TIAN X, TANG R, et al. Changes in physiological responses, muscular composition and flesh quality of channel catfish Ictalurus punctatus suffering from transport stress[J]. Aquaculture,2017, 478(1): 9-15. DOI:10.1016/j.aquaculture.2017.01.026.
[15] 丁亚涛. 鳊鱼保活运输技术的研究[D]. 上海: 上海海洋大学, 2019:43-44.
[16] 秦旭. 彭泽鲫的低温休眠保活运输技术研究[D]. 南昌: 南昌大学,2018: 38-39.
[17] DASKALOVA A. Farmed fish welfare: stress, post-mortem muscle metabolism, and stress-related meat quality changes[J]. International Aquatic Research, 2019, 11(2): 113-124. DOI:10.1007/s40071-019-0230-0.
[18] 刘峰, 王舒淇, 朱绍彰, 等. 鱼类保活运输及其对肌肉和血液生理生化指标影响研究进展[J]. 食品安全质量检测学报, 2021, 12(16):6310-6316. DOI:10.19812/j.cnki.jfsq11-5956/ts.2021.16.002.
[19] 刘骁, 谢晶, 杨茜, 等. 无水保活条件下团头鲂生理应激及鱼肉品质的变化[J]. 农业工程学报, 2016, 32(3): 295-300. DOI:10.11975/j.issn.1002-6819.2016.03.042.
[20] GORNIK S G, ALBALAT A, ATKINSON R J A, et al. The influence of defined ante-mortem stressors on the early post-mortem biochemical processes in the abdominal muscle of the Norway lobster, Nephrops norvegicus (Linnaeus, 1758)[J]. Marine Biology Research, 2010, 6(3):223-238. DOI:10.1080/17451000903147468.
[21] 夏文水, 罗永康, 熊善柏, 等. 大宗淡水鱼贮运保鲜与加工技术[M].北京: 中国农业出版社, 2014: 56-57.
[22] BRIZIO P, BENEDETTO A, RIGHETTI M, et al. Astaxanthin and canthaxanthin (Xanthophyll) as supplements in rainbow trout diet:in vivo assessment of residual levels and contributions to human health[J]. Journal of Agricultural and Food Chemistry, 2013, 61(46):10954-10959. DOI:10.1021/jf4012664.
[23] DIGRE H, ERIKSON U, MISIMI E, et al. Bleeding of farmed atlantic cod: residual blood, color, and quality attributes of pre- and postrigor fillets as affected by perimortem stress and different bleeding methods[J]. Journal of Aquatic Food Product Technology, 2011, 20(4):391-411. DOI:10.1080/10498850.2011.576380.
[24] URTON D B, VOKEY J E. The relative in vitro responsiveness of melanophores of winter flounder to α-MSH and MCH[J]. Journal of Fish Biology, 2010, 56(5): 1192-1200. DOI:10.1111/j.1095-8649.2000.tb02133.x.
[25] POLI B M, PARISI G, SCAPPINI F, et al. Fish welfare and quality as affected by pre-slaughter and slaughter management[J]. Aquaculture International, 2005, 13(1): 29-49. DOI:10.1007/s10499-004-9035-1.
[26] 曹昕昱, 章小英, 叶建平. 线粒体ATP合成酶抑制因子1在细胞能量代谢中的调节作用[J]. 中国细胞生物学学报, 2020, 42(4): 682-690.DOI:10.11844/cjcb.2020.04.0016.
[27] YADA T, TORT L. Stress and disease resistance: immune system and immunoendocrine interactions[M]//Biology of Stress in Fish-Fish Physiology. Academic Press, 2016: 365-403. DOI:10.1016/B978-0-12-802728-8.00010-2.
[28] 曹杰, 王琪, 梅俊, 等. 有水与无水保活运输对大菱鲆生理应激及鱼肉品质的影响[J]. 水产学报, 2021, 45(7): 1034-1042. DOI:10.11964/jfc.20210512830.
[29] WU Leilei, PU Hongbin, SUN Dawen. Novel techniques for evaluating freshness quality attributes of fish: a review of recent developments[J]. Trends in Food Science and Technology, 2019, 83:259-273. DOI:10.1016/j.tifs.2018.12.002.
[30] ZHANG Longteng, LI Qian, LYU Jian, et al. The impact of stunning methods on stress conditions and quality of silver carp(Hypophthalmichthys molitrix) fillets stored at 4 ℃ during 72 h postmortem[J]. Food Chemistry, 2017, 216: 130-137. DOI:10.1016/j.foodchem.2016.08.004.