明胶是一种从动物胶原中提取的强亲水性蛋白,因其具有来源广泛、成本低廉、安全无毒以及良好的胶凝性和乳化性等优点,被广泛应用于食品工业和纳米材料等领域[1-2]。传统明胶干燥主要是采用凝冻后冷风干燥,最后再粉碎的方法,该方法能够保持更好的凝胶特性,但具有耗时长、成本高等缺点[3]。近年来,热风干燥和喷雾干燥等因耗时短、效率高等优势逐渐被应用于食品的工业化生产中[1,4]。众所周知,明胶由α-链、β-链、γ-链和其他小分子亚基组成,然而,通常情况下,高温处理会降解胶原亚基组分,从而导致凝胶特性的下降[5],使得这些干燥技术没有被应用于明胶的工业化干燥过程中。
目前,据联合国粮食及农业组织估计,全球每年有渔业废弃物约2 000 万t,占渔业生产总量的25%[6]。这种鱼类加工废弃物没有得到合理利用,导致环境被污染,资源被浪费[6-7]。鱼皮明胶是渔业副产物开发利用的方向之一,因其亚氨基酸含量较低,导致凝胶强度、胶凝温度和融化温度等凝胶特性较低,极大限制了鱼皮明胶的应用[8]。近年来,Pickering乳液研究逐步成为热点,为鱼皮明胶的应用提供了新途径[9]。研究表明,鱼皮明胶可以用于制备稳定的乳液,尤其是高内相乳液(high internal phase emulsions,HIPEs)[10-11],其不仅参与油-水界面膜的形成,还在连续相中形成致密的三维网络结构,进而维持乳液的稳定[4,12-14]。在鱼皮明胶乳化性调控方面,本课题组研究了冷冻温度对微波-冻融耦合法提取明胶乳化特性的影响。在较低的冷冻温度(-80 ℃)下,明胶的三螺旋结构被破坏,导致更多的亲水性氨基酸被暴露,表面疏水性降低,不利于明胶在油-水界面的吸附,表现出较差的界面特性和乳化特性[14]。此外,课题组以转谷氨酰胺酶(transglutaminase,TGase)为交联剂制备了鱼皮明胶微凝胶,并用于稳定食品级HIPEs。TGase交联增强了乳液中的凝胶网络结构,使得HIPEs具有优异的贮藏稳定性和热稳定性,同时在3D打印中显示出优异的打印性能[11]。综上,鱼皮明胶可以将乳化型明胶作为开发方向,从而拓宽其应用途径。
本课题组前期研究发现,喷雾干燥技术可降低大目金枪鱼皮明胶的氧化和降解[1]。此外,相比于热风干燥和冷冻干燥,喷雾干燥获得的明胶具有较好的两亲性,可明显降低界面张力,促进明胶的吸附,进而维持乳液的稳定[12]。然而,目前关于喷雾干燥入口温度对大目金枪鱼皮明胶乳化特性的影响鲜有报道。因此,本研究以大目金枪鱼皮为原料提取明胶,初步分析不同喷雾干燥入口温度(130、160、190 ℃)对鱼皮明胶乳化特性的影响,以期为乳化型鱼皮明胶的生产制备和工业化应用提供理论依据。
1 材料与方法
1.1 材料与试剂
大目金枪鱼皮 山东省中鲁远洋(烟台)食品有限公司;十二烷基苯磺酸钠(sodium dodecyl benzene sulfonate,SDBS,分析纯)、溴化钾(光谱纯) 成都科龙化学试剂厂;双对氯苯基三氯乙烷(分析纯)、三羟甲基氨基甲烷(Tris,优级纯)、考马斯亮蓝R-250(优级纯)、四甲基乙二胺(分析纯) 美国Bio Basic公司;丙烯酰胺(质量分数30%,优级纯) 北京索莱宝科技有限公司;标准蛋白(分子质量10~200 kDa)加拿大Fermentas公司。
1.2 仪器与设备
JA3003B电子天平 上海精天电子仪器有限公司;Heraeus Multifuge X3R台式高速冷冻离心机 美国赛默飞世尔科技公司;MAS-II plus微波合成萃取反应工作站上海新仪微波化学科技有限公司;KQ-100B超声波清洗器昆山超声仪器有限公司;YC-510喷雾干燥器 上海亚诚仪器设备有限公司;T18高速分散器 美国IKA公司;TA.XT 2i物性测定仪 英国Stable Micro Systems公司;F-4500荧光分光光度计 日本日立公司;Spectrun 100红外光谱仪 美国Perkin Elmer公司;BX53光学显微镜日本Olympus公司。
1.3 方法
1.3.1 鱼皮样品的制备
参考课题组之前的方法[1,15],将鱼皮脱脂、除杂蛋白备用。鱼皮在室温解冻,去除鱼鳞、鱼肉并清洗干净,切成4 mm×4 mm小块,按料液比1:2(m/V)加入0.75 g/100 mL的SDBS进行超声(25 ℃、120 W、2 h)脱脂,每1 h更换一次脱脂液。脱脂完成后,多次清洗鱼皮并沥干,按料液比1:5(m/V)加入1 g/100 mL NaCl溶液,磁力搅拌6 h,每2 h更换一次NaCl溶液。除杂蛋白结束后,用去离子水将鱼皮洗涤干净并沥干,用聚乙烯袋分装(25 g/袋),于-20 ℃保存备用。
1.3.2 明胶的提取和喷雾干燥
参考课题组之前的方法提取明胶[1,15]。具体步骤如下:1)微波预处理:将1 袋鱼皮(25 g)和150 mL去离子水混合后微波预处理15 min(75 ℃、350 W、270 r/min);2)鱼皮冻融:将预处理后的鱼皮滤出,用液氮快速冷冻,滤液放入30 ℃水浴锅备用,冷冻结束的鱼皮放入滤液中搅拌解冻;3)微波辅助提取:将解冻结束的鱼皮和滤液转移到四颈烧瓶中,并按体积比50:1加入6 g/100 mL硅藻土溶液,微波加热提取1 h(55 ℃、350 W、270 r/min);4)过滤、烘干:微波提取结束后,滤除鱼皮,滤液过中速滤纸抽滤后,用喷雾干燥机进行干燥。调整喷雾干燥机蠕动泵速率为10 r/min,入口温度分别为130、160、190 ℃,出口温度为100 ℃。
1.3.3 乳化性测定
1.3.3.1 乳液的制备
参考Feng Xin等[4]的方法制备乳液。在60 ℃水浴下配制不同质量浓度的明胶溶液(0.25~1.00 g/100 mL),然后将3 mL明胶溶液加入10 mL离心管中,再加入3 mL大豆油,用均质机在15 000 r/min下将混合物均质化1 min以获得乳液。
1.3.3.2 乳析指数测定
乳液制备完成后,立即测定乳液透明层高度和乳液总高度,参考Zhang Huan等[16]的方法,乳析指数按下式计算。
1.3.3.3 光学显微镜测定
将10 μL乳液滴在载玻片上,然后盖上盖玻片,放置在载物台上。使用安装在计算机上的带有cellSens软件的数码相机获取乳液的显微照片。每个样品随机选取5 张图片记录所有液滴尺寸,使用Nano Measure软件计算乳液液滴的平均尺寸。
1.3.4 表面疏水性测定
采用ANS荧光探针法进行表面疏水性指数(H0)的测定[17-18]。激发波长为390 nm,发射波长为470 nm,缝隙宽度为5 nm。以荧光强度对明胶的质量浓度作线性拟合,以拟合曲线的斜率表示明胶的H0[4]。
1.3.5 分子质量分布测定
参考Chen Liqing等[19]的方法,通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳测定样品的分子质量分布。
1.3.6 凝胶强度测定
参考GB 6783—2013《食品安全国家标准 食品添加剂 明胶》[20]测定明胶的凝胶强度。
1.3.7 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)测定
使用红外光谱仪在4 000~600 cm-1波数范围内以4 cm-1的分辨率扫描32 次[18],使用Peak Fit v 4.0软件进行图谱的基线校正和分析。用Spectrum和Origin 8.0软件去卷积,计算AⅢ/A1 450 cm-1,其中AⅢ为酰胺Ⅲ带的吸光度,A1 450 cm-1为在1 450 cm-1处的吸光度。
1.4 数据处理
每个实验至少重复3 次,所得数据以平均值±标准差表示。使用SPSS Statistics 17.0和Origin 8.0软件进行显著性分析和作图。P<0.05被认为数据间差异具有统计学意义。所有测量均在25 ℃下进行。
2 结果与分析
2.1 不同喷雾干燥入口温度对明胶乳化性的影响
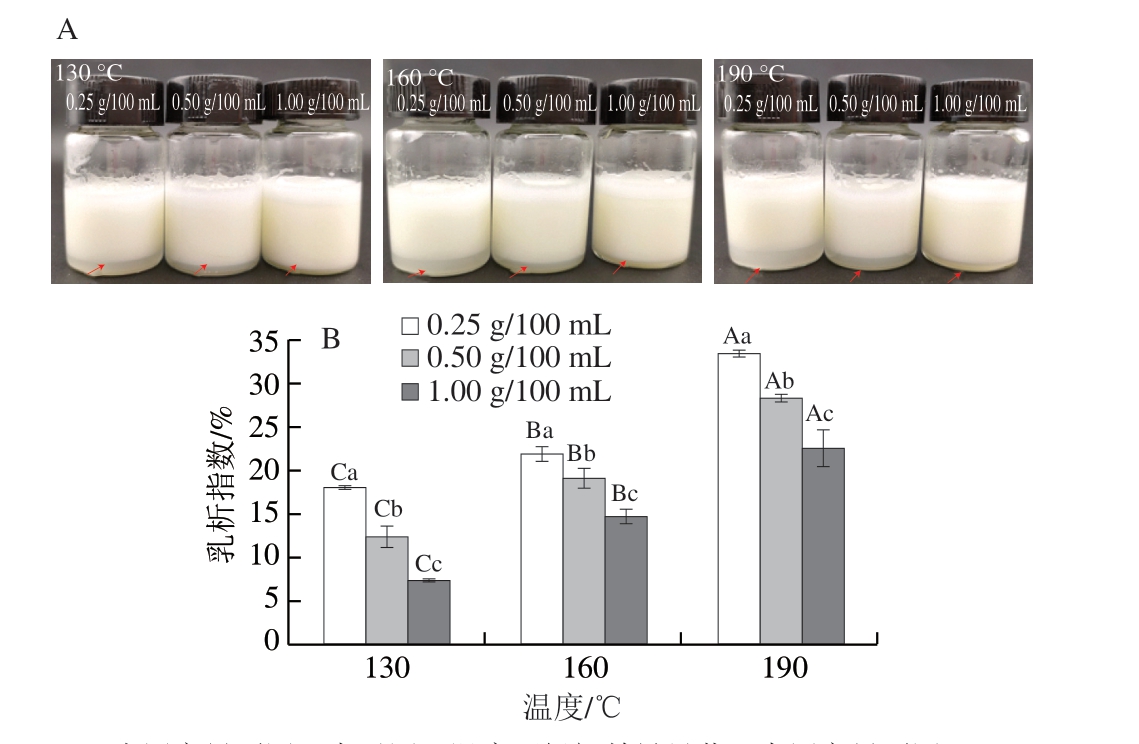
图 1 不同喷雾干燥入口温度对大目金枪鱼皮明胶乳液直观图(A)和乳析指数(B)的影响
Fig. 1 Effect of different spray drying inlet temperatures on the emulsion (A) and creaming index (B) of bigeye tuna skin gelatin emulsion
小写字母不同,表示同一温度下组间差异显著;大写字母不同,表示同一明胶质量浓度下组间差异显著(P<0.05)。图2同。
由图1可知,所有明胶均可以形成稳定的乳液,部分有水层产生,表明乳液在持水力方面存在差异[21-22]。随着喷雾干燥入口温度的升高(130~190 ℃),乳析指数逐渐增大(7.14%~33.93%),表明乳液的保水性逐渐下降,这可能与连续相中网络形成情况有关。通常情况下,连续相网络结构越致密,乳液保水性和稳定性越好[17,21]。此外,随着明胶质量浓度(0.25~1.00 g/100 mL)的增加,乳析指数逐渐降低,归因于明胶质量浓度的增加使得更多的明胶分子参与油-水界面和致密三维网络结构的形成,进而提高乳液的持水力和稳定性[17,23]。
2.2 不同喷雾干燥入口温度对明胶乳液微观结构的影响
由图2A可知,随着喷雾干燥入口温度的升高,乳液中的大液滴数量明显增加,导致液滴呈现不均匀的状态。为清楚表明液滴尺寸的变化,采用Nano Measure软件计算乳液液滴的平均粒径,由图2B可知,随着喷雾干燥入口温度的升高,乳液液滴粒径从60.53 μm增加到85.17 μm,表明明胶在油-水界面的吸附能力可能降低,使得乳液更容易发生絮凝和聚集[17]。此外,随着明胶质量浓度的增大,乳液液滴逐渐均匀,液滴粒径逐渐减小,乳液稳定性提高,这是由于更多的明胶分子参与了界面吸附和连续相三维网络结构的形成[17,23]。
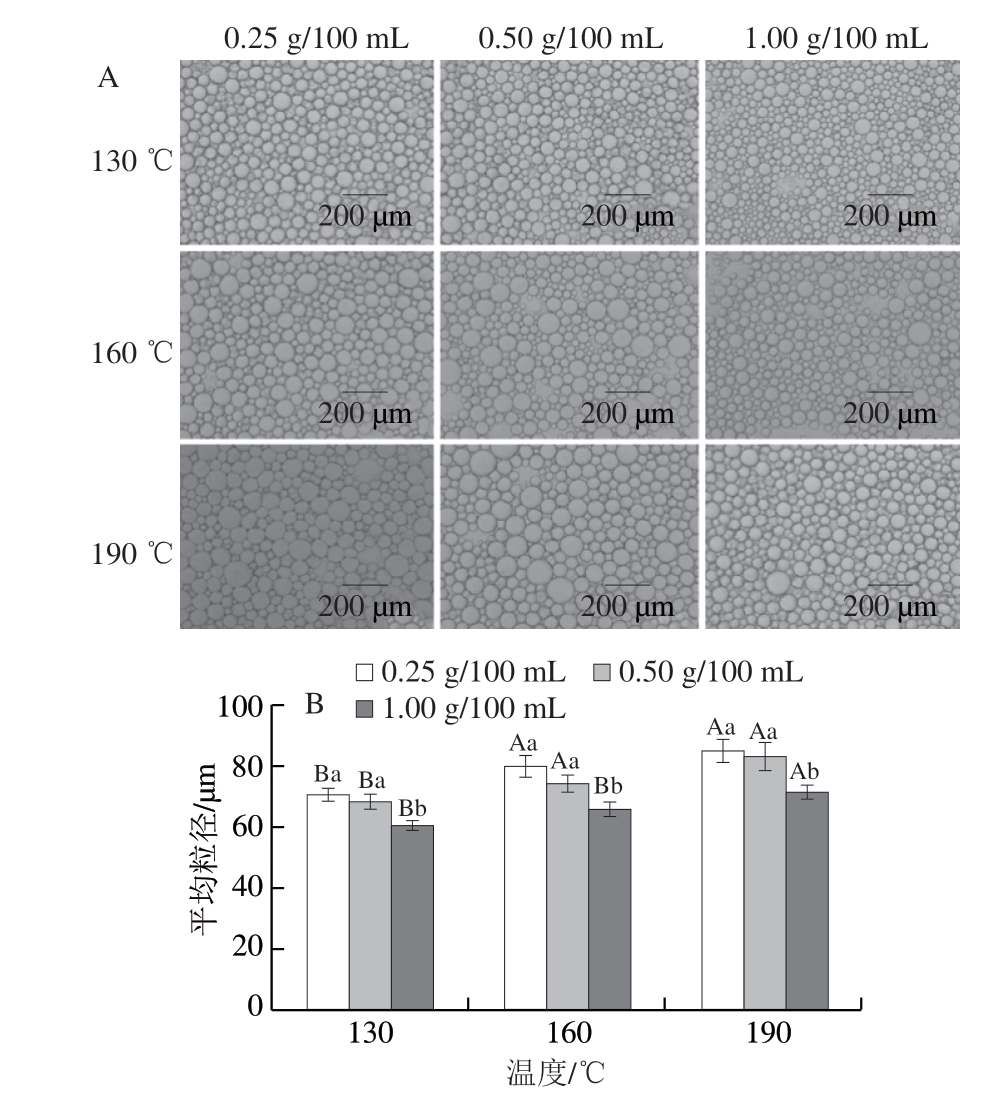
图 2 不同喷雾干燥入口温度对大目金枪鱼皮明胶乳液微观结构(A)和液滴粒径(B)的影响
Fig. 2 Effect of different spray drying inlet temperatures on the microstructure (A) and droplet size (B) of bigeye tuna skin gelatin emulsion
2.3 不同喷雾干燥入口温度对明胶表面疏水性的影响
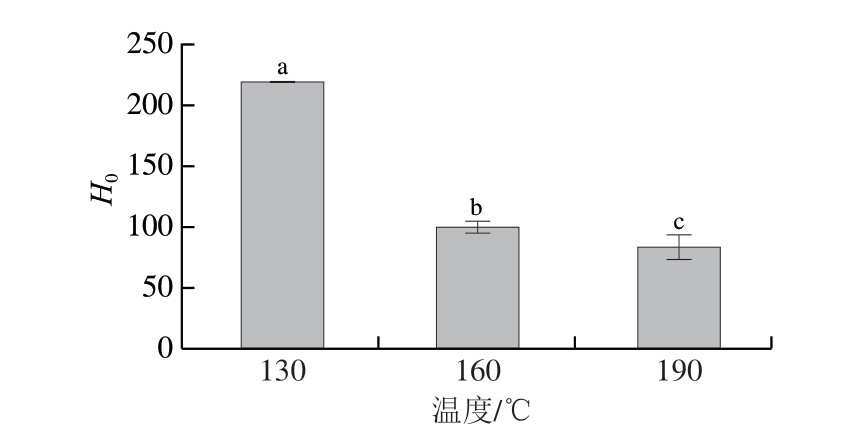
图 3 不同喷雾干燥入口温度对大目金枪鱼皮明胶表面疏水性的影响
Fig. 3 Effect of different spray drying inlet temperatures on the surface hydrophobicity of bigeye tuna skin gelatin
小写字母不同,表示差异显著(P<0.05)。图4同。
由图3可知,随着喷雾干燥入口温度的升高,明胶的H0显著降低,这表明更多的亲水性氨基酸暴露[24-25]。通常,蛋白质的表面疏水性取决于疏水性氨基酸(即亮氨酸和缬氨酸等)在蛋白表面暴露区域的占比。然而,这些疏水性氨基酸在明胶中的含量都非常低。已有研究表明,明胶内部三螺旋结构区域含有大量重复序列(Gly-X-Y)n,其中X通常代表脯氨酸,Y代表4-羟脯氨酸,甘氨酸位于三螺旋内部的交界处[26],其中脯氨酸和羟脯氨酸均为亲水性氨基酸。因此,随着喷雾干燥入口温度的升高,明胶的三螺旋结构逐渐被破坏,可能造成更多的亲水性氨基酸暴露,进而降低明胶的表面疏水性[17],不利于明胶的界面吸附,进而降低明胶的乳化性。
2.4 不同喷雾干燥入口温度对明胶分子质量分布和凝胶强度的影响
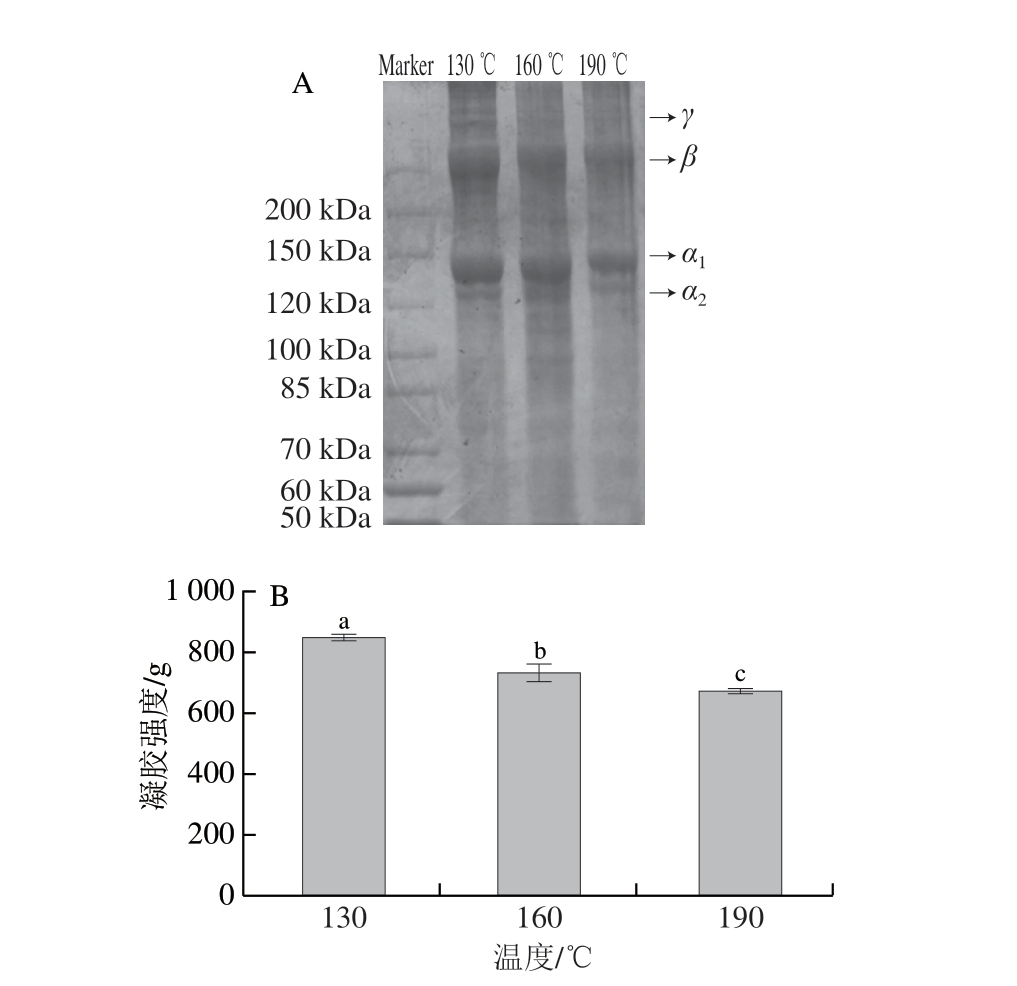
图 4 不同喷雾干燥入口温度对大目金枪鱼皮明胶分子质量分布(A)和凝胶强度(B)的影响
Fig. 4 Effect of different spray drying inlet temperatures on the molecular mass distribution (A) and gel strength (B) of bigeye tuna skin gelatin
由图4A可知,所有明胶样品均含有α条带(α1和α2)、β条带和γ条带。随着喷雾干燥入口温度的升高,α条带、β条带和γ条带的颜色均逐渐变浅,可能是较高的温度导致了明胶分子的降解[24],这可能是明胶分子内部亲水性氨基酸暴露的主要原因。由图4B可知,随着喷雾干燥入口温度的升高,明胶的凝胶强度逐渐减小(851.29~676.65 g),这与电泳结果一致。明胶凝胶强度的降低不利于明胶在连续相中形成致密的网络结构,进而降低了明胶基乳液的稳定性[1]。
2.5 不同喷雾干燥入口温度明胶的FTIR图谱
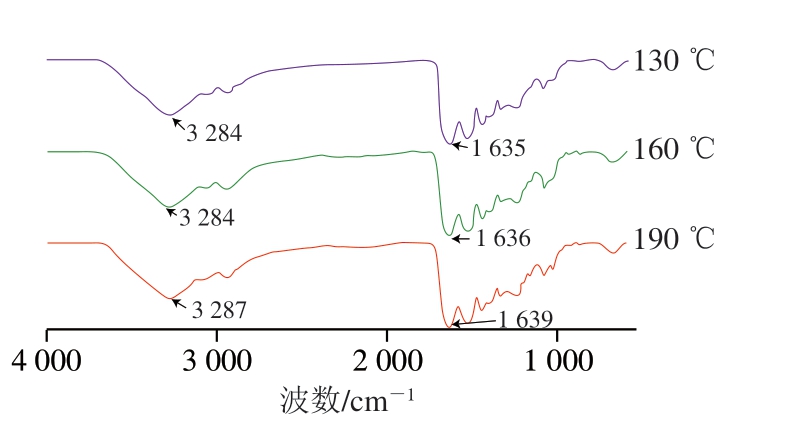
图 5 不同喷雾干燥入口温度对大目金枪鱼皮明胶FTIR图谱的影响
Fig. 5 Effect of different spray drying inlet temperatures on the FTIR spectrum of bigeye tuna skin gelatin
明胶在3 400 cm-1处的峰归因于酰胺A带的N-H拉伸,1 634 cm-1处的峰被指定为酰胺Ⅰ带,其由明胶的C=O伸缩振动、C-N拉伸或N-H弯曲引起[1,27]。由图5可知,随着喷雾干燥入口温度的升高(130~190 ℃),明胶酰胺A带的峰位置由3 284 cm-1移动到3 287 cm-1,表明参与氢键形成的N-H基团数逐渐减少,这可能不利于凝胶形成过程中三螺旋结构的形成[28-29],从而引起明胶的凝胶强度降低。同时,明胶的酰胺Ⅰ带峰位置由1 635 cm-1移动到1 639 cm-1,表明温度升高破坏了明胶的分子构象[30]。此外,AⅢ/A1 450 cm-1与保持三螺旋结构的完整性有关。当AⅢ/A1 450 cm-1<1时,表明三螺旋结构损坏,AⅢ/A1 450 cm-1越小,表明损坏程度越大;当AⅢ/A1 450 cm-1≥1时,表明三螺旋结构完整[31]。由计算可得,随着喷雾干燥入口温度的升高,AⅢ/A1 450 cm-1逐渐降低,表明明胶的三螺旋结构逐渐被破坏,这不利于致密凝胶网络的形成,从而影响乳液连续相的稳定性[12];此外,三螺旋结构的破坏造成三螺旋区域亲水性氨基酸暴露,降低了明胶的两亲性,从而降低了鱼皮明胶界面稳定性[14]。
3 结 论
本研究主要分析不同喷雾干燥入口温度(130、160、190 ℃)对大目金枪鱼皮明胶乳化特性的影响。随着喷雾干燥入口温度的升高,明胶的亚基组分被降解,三螺旋结构被破坏,这可能更有利于亲水性氨基酸的暴露,进而降低明胶的凝胶特性和表面疏水性,不利于明胶在油-水界面的吸附以及三维网络结构的形成,乳液稳定性降低。此外,随着明胶质量浓度的增加,更多的明胶分子参与油-水界面和三维网络结构的形成,使得乳液的液滴粒径和乳析指数减小,稳定性提高。在后续的研究中,将进一步研究不同喷雾干燥工艺参数对明胶结构和稳定乳液界面特性的影响,解析相关构效关系和调控机制,以期为乳化型鱼皮明胶的生产制备和工业化应用提供理论依据。
[1] 朱俊成, 冯鑫, 李璐思, 等. 不同干燥方式对明胶特性的影响[J]. 食品与发酵工业, 2021, 47(8): 34-39. DOI:10.13995/j.cnki.11-1802/ts.025644.
[2] 冯鑫, 马良, 戴宏杰, 等. 食品级Pickering乳液的稳定性及β-胡萝卜素的装载研究[J]. 食品与发酵工业, 2021, 47(6): 18-25.DOI:10.13995/j.cnki.11-1802/ts.025179.
[3] 王珊珊, 吴中华, 李凯, 等.不同干燥方法对鱼明胶干燥特性的影响[J]. 天津科技大学学报, 2019, 34(2): 30-34. DOI:10.13364/j.issn.1672-6510.20180016.
[4] FENG Xin, DAI Hongjie, MA Liang, et al. Effect of drying methods on the solubility and amphiphilicity of room temperature soluble gelatin extracted by microwave-rapid freezing-thawing coupling[J]. Food Chemistry, 2021, 351: 129226. DOI:10.1016/j.foodchem.2021.129226.
[5] 马明思. 兔皮胶原快速明胶化机理及明胶制备过程中胶原结构变化[D]. 重庆: 西南大学, 2018: 3-4.
[6] YANG Huijuan, WANG Haifeng, HUANG Min, et al. Repurposing fish waste into gelatin as a potential alternative for mammalian sources: a review[J]. Comprehensive Reviews in Food Science and Food Safety, 2022, 21(2): 942-963. DOI:10.1111/1541-4337.12920.
[7] ALFARO A T, BILUCA F C, MARQUETTI C, et al. African catfish(Clarias gariepinus) skin gelatin: extraction optimization and physicalchemical properties[J]. Food Research International, 2014, 65: 416-422.DOI:10.1016/j.foodres.2014.05.070.
[8] 韩霜, 马良, 杨晖, 等. 大目金枪鱼皮明胶的理化性质及结构分析[J].食品科学, 2018, 39(10): 40-45. DOI:10.7506/spkx1002-6630-201810007.
[9] FENG Xin, DAI Hongjie, MA Liang, et al. Properties of Pickering emulsion stabilized by food-grade gelatin nanoparticles:influence of the nanoparticles concentration[J]. Colloids and Surfaces B: Biointerfaces, 2020, 196: 111294. DOI:10.1016/j.colsurfb.2020.111294.
[10] WANG Hongxia, HU Ludan, DU Jie, et al. Development of rheologically stable high internal phase emulsions by gelatin/chitooligosaccharide mixtures and food application[J].Food Hydrocolloids, 2021, 121: 107050. DOI:10.1016/j.foodhyd.2021.107050.
[11] DU Jie, DAI Hongjie, WANG Hongxia, et al. Preparation of high thermal stability gelatin emulsion and its application in 3D printing[J]. Food Hydrocolloids, 2021, 113: 106536. DOI:10.1016/j.foodhyd.2020.106536.
[12] FENG Xin, DAI Hongjie, MA Liang, et al. Effect of microwave extraction temperature on the chemical structure and oil-water interface properties of fish skin gelatin[J]. Innovative Food Science and Emerging Technologies, 2021, 74: 102835. DOI:10.1016/j.ifset.2021.102835.
[13] ZHANG Ting, XU Jiamin, ZHANG Yangyi, et al. Gelatins as emulsifiers for oil-in-water emulsions: extraction, chemical composition, molecular structure, and molecular modification[J].Trends in Food Science and Technology, 2020, 106: 113-131.DOI:10.1016/j.tifs.2020.10.005.
[14] FENG Xin, DAI Hongjie, MA Liang, et al. Effect of freezing temperature on molecular structure and functional properties of gelatin extracted by microwave-freezing-thawing coupling method[J]. LWTFood Science and Technology, 2021, 149: 111894. DOI:10.1016/j.lwt.2021.111894.
[15] 杜杰, 刘廷薇, 马良, 等. 微波-快速冻融耦合鱼皮明胶理化性质分析[J].食品科学, 2021, 42(11): 108-115. DOI:10.7506/spkx1002-6630-20200612-161.
[16] ZHANG Huan, CHEN Yuan, WANG Shanshan, et al. Extraction and comparison of cellulose nanocrystals from lemon (Citrus limon) seeds using sulfuric acid hydrolysis and oxidation methods[J]. Carbohydrate Polymers, 2020, 238: 116180. DOI:10.1016/j.carbpol.2020.116180.
[17] FENG Xin, DAI Hongjie, ZHU Juncheng, et al. Improved solubility and interface properties of pigskin gelatin by microwave irradiation[J].International Journal of Biological Macromolecules, 2021, 171: 1-9.DOI:10.1016/j.ijbiomac.2020.12.215.
[18] 曾茂茂, 王霄, 陈洁. 蛋白质疏水性测定方法的相关性及适用性[J].食品科学, 2011, 32(15): 117-120.
[19] CHEN Liqing, MA Liang, ZHOU Mengrou, et al. Effects of pressure on gelatinization of collagen and properties of extracted gelatins[J]. Food Hydrocolloids, 2014, 36: 316-322. DOI:10.1016/j.foodhyd.2013.10.012.
[20] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品添加剂 明胶: GB 6783—2013[S]. 北京: 中国标准出版社,2013.
[21] 于玮, 王雪蒙, 马良, 等. 超高压作用时间影响胶原蛋白明胶化的分子机制[J]. 现代食品科技, 2015, 31(12): 250-255. DOI:10.13982/j.mfst.1673-9078.2015.12.037.
[22] LIU Wei, GAO Hongxia, MCCLEMENTS D J, et al. Stability,rheology, and β-carotene bioaccessibility of high internal phase emulsion gels[J]. Food Hydrocolloids, 2019, 88: 210-217.DOI:10.1016/j.foodhyd.2018.10.012.
[23] LACROIX A, HAYERT M, BOSC V, et al. Batch versus microfluidic emulsification processes to produce whey protein microgel beads from thermal or acidic gelation[J]. Journal of Food Engineering, 2022, 312:110738. DOI:10.1016/j.jfoodeng.2021.110738.
[24] CHANDRA M V, SHAMASUNDAR B A. Rheological properties of gelatin prepared from the swim bladders of freshwater fish Catla catla[J]. Food Hydrocolloids, 2015, 48: 47-54. DOI:10.1016/j.foodhyd.2015.01.022.
[25] KANWATE B W, BALLARI R V, KUDRE T G. Influence of spraydrying, freeze-drying and vacuum-drying on physicochemical and functional properties of gelatin from Labeo rohita swim bladder[J].International Journal of Biological Macromolecules, 2019, 121:135-141. DOI:10.1016/j.ijbiomac.2018.10.015.
[26] ABDELMALEK B E, GOMEZ-ESTACA J, SILA A, et al.Characteristics and functional properties of gelatin extracted from squid (Loligo vulgaris) skin[J]. LWT-Food Science and Technology,2016, 65: 924-931. DOI:10.1016/j.lwt.2015.09.024.
[27] NAGARAJAN M, BENJAKUL S, PRODPRAN T, et al.Characteristics and functional properties of gelatin from splendid squid(Loligo formosana) skin as affected by extraction temperatures[J].Food Hydrocolloids, 2012, 29(2): 389-397. DOI:10.1016/j.foodhyd.2012.04.001.
[28] WANG Lei, XING Xishuang, LIU Yang, et al. Effects of different drying methods on the functional and structural properties of dietary fiber from peanut shell[J]. Agricultural Biotechnology, 2020, 9(3):128-132. DOI:10.19759/j.cnki.2164-4993.2020.03.032.
[29] KUAI Lingyun, LIU Fei, MA Yun, et al. Regulation of nanoencapsulated tea polyphenol release from gelatin films with different Bloom values[J]. Food Hydrocolloids, 2020, 108: 106045.DOI:10.1016/j.foodhyd.2020.106045.
[30] YANG Guochao, HUANG Xinxin, CAI Jingrui, et al. Curing mechanism of triglycidylamine crosslinked soybean protein adhesive analyzed by Fourier transform infrared, second derivative infrared and two-dimensional correlation spectroscopy[J]. International Journal of Adhesion and Adhesives, 2021, 107: 102825. DOI:10.1016/j.ijadhadh.2021.102825.
[31] TRONCI G, DOYLE A, RUSSELL S J, et al. Triple-helical collagen hydrogels via covalent aromatic functionalisation with 1,3-phenylenediacetic acid[J]. Journal of Materials Chemistry B, 2013,1(40): 5478-5488. DOI:10.1039/c3tb20218f.