肉及肉制品富含蛋白质、脂类、维生素以及铁、锌等矿物质,是优质动物蛋白的重要来源[1],同时我国肉及肉制品产量巨大,近10 年肉类平均年产量近8 505 万t[2], 其中肉制品产量占15%~20%[3-5],其食用安全性备受人们关注。2021年国家市场监督管理总局及各省、直辖市、自治区公布的本年度监督抽检情况显示,肉及肉制品共1 264 批次不合格,不合格项目类别主要涉及兽药、微生物、添加剂、质量指标、污染物、标签、非法添加等,其中微生物不合格数量达到346 批次,占不合格总数的27.4%[6](注:因国家市场监督管理总局及各地市场监督管理局抽检公告较多,此处仅列出国家市场监督管理总局2021年最后一项抽检公告)。本文介绍肉及肉制品中微生物限量要求,分析传统微生物检测方法的弊端,综述快速测试片法、三磷酸腺苷(adenosine triphosphate,ATP)生物荧光法、分子诊断法、免疫分析法、光谱法及仪器法等新技术在肉及肉制品微生物检测应用中的研究进展。
1 我国肉及肉制品相关标准中微生物限量要求
肉及肉制品的营养成分适宜微生物的生长繁殖,微生物数量也是肉及肉制品相关标准中的重要卫生指标和安全指标,相关标准中对微生物的限量要求如表1~2所示。
表 1 肉类(原料肉)相关标准中的微生物限量要求
Table 1 Microbial limit requirements specified in meat standards

注:/. 未作要求。
现行有效标准 菌落总数/(CFU/g) 大肠菌群/(MPN/100 g) 沙门氏菌 致泻大肠埃希氏菌出血性大肠埃希氏菌(O157:H7) 志贺氏菌 金黄色葡萄球菌溶血性链球菌GB/T 17238—2008《鲜、冻分割牛肉》,GB/T 9960—2008《鲜、冻四分体牛肉》 鲜:1×106,冻:5×105 鲜:<1×104,冻:<×103 不得检出 不得检出 / / / /GB/T 9959.2—2008《分割鲜、冻猪瘦肉》,NY/T 632—2002《冷却猪肉》 1×106 ≤1×104 不得检出 / / / / /GB 16869—2005《鲜、冻禽产品》 鲜:1×106,冻:5×105 鲜:≤1×104,冻:≤5×103 0/25 g,取样个数为5 / 0/25 g,取样个数为5 / / /GB/T 9961—2008《鲜、冻胴体羊肉》,NY/T 1165—2006《羔羊肉》 5×105 ≤1×103 不得检出 不得检出 / 不得检出 不得检出 /NY/T 633—2002《冷却羊肉》 5×105 ≤1×103 不得检出 / / 不得检出 不得检出 不得检出GB/T 17239—2008《鲜、冻兔肉》 鲜:1×106,冻:5×105 鲜:≤1×104,冻:≤5×103 不得检出 / / / / /
表 2 肉制品相关标准中的微生物采样方案及限量要求
Table 2 Microbial sampling scheme and limit requirements specified in processed meat standards
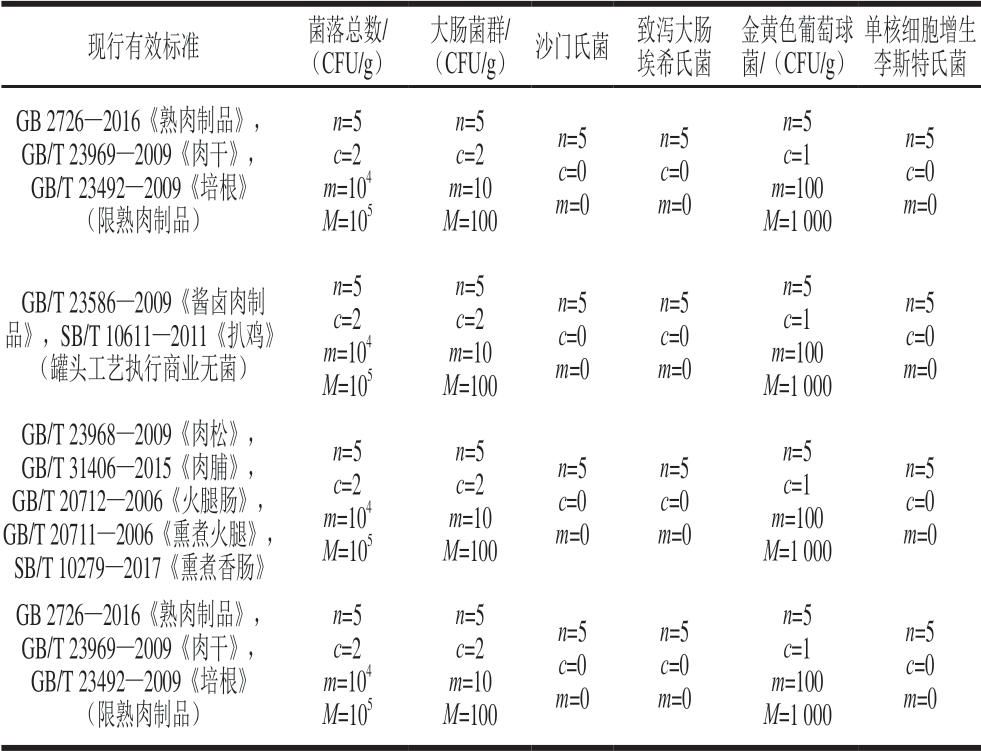
注:n为同一批次产品应采集的样品数;c为最大可允许超出m值的样品数;m为微生物指标可接受水平的限量值;M为微生物指标的最高安全限量值。
现行有效标准 菌落总数/(CFU/g)大肠菌群/(CFU/g) 沙门氏菌 致泻大肠埃希氏菌金黄色葡萄球菌/(CFU/g)单核细胞增生李斯特氏菌GB 2726—2016《熟肉制品》,GB/T 23969—2009《肉干》,GB/T 23492—2009《培根》(限熟肉制品)n=5 c=2 m=104 M=105 n=5 c=2 m=10 M=100 n=5 c=0 m=0 n=5 c=0 m=0 n=5 c=1 m=100 M=1 000 n=5 c=0 m=0 GB/T 23586—2009《酱卤肉制品》,SB/T 10611—2011《扒鸡》(罐头工艺执行商业无菌)n=5 c=2 m=104 M=105 n=5 c=2 m=10 M=100 n=5 c=0 m=0 n=5 c=0 m=0 n=5 c=1 m=100 M=1 000 n=5 c=0 m=0 GB/T 23968—2009《肉松》,GB/T 31406—2015《肉脯》,GB/T 20712—2006《火腿肠》,GB/T 20711—2006《熏煮火腿》,SB/T 10279—2017《熏煮香肠》n=5 c=2 m=104 M=105 n=5 c=2 m=10 M=100 n=5 c=0 m=0 n=5 c=0 m=0 n=5 c=1 m=100 M=1 000 n=5 c=0 m=0 GB 2726—2016《熟肉制品》,GB/T 23969—2009《肉干》,GB/T 23492—2009《培根》(限熟肉制品)n=5 c=2 m=104 M=105 n=5 c=2 m=10 M=100 n=5 c=0 m=0 n=5 c=0 m=0 n=5 c=1 m=100 M=1 000 n=5 c=0 m=0
由表1~2可知,对肉及肉制品有限量要求的微生物种类包括菌落总数、大肠菌群、沙门氏菌、致泻大肠埃希氏菌、出血性大肠埃希氏菌(O157:H7)、志贺氏菌、金黄色葡萄球菌、溶血性链球菌和单核细胞增生李斯特氏菌,其中菌落总数和大肠菌群代表产品的卫生情况,在鲜牛肉、肉松、肉脯、火腿肠、熏煮火腿、熏煮香肠等产品标准中为出厂检验指标,每批次均需检验合格后方能出厂。
2 传统微生物检测方法
传统微生物检测采用食品安全国家标准食品微生物检验4789系列标准,如GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》、GB 4789.3—2016《食品安全国家标准 食品微生物学检验 大肠菌群计数》、GB 4789.4—2016《食品安全国家标准 食品微生物学检验 沙门氏菌检验》、GB 4789.6—2016《食品安全国家标准 食品微生物学检验 致泻大肠埃希氏菌检验》、GB 4789.36—2016《食品安全国家标准 食品微生物学检验 大肠埃希氏菌O157:H7/NM检验》、GB 4789.5—2012《食品安全国家标准 食品微生物学检验 志贺氏菌检验》、GB 4789.10—2016《食品安全国家标准 食品微生物学检验 金黄色葡萄球菌检验》、GB 4789.11—2014《食品安全国家标准 食品微生物学检验 β型溶血性链球菌检验》及GB 4789.30—2016《食品安全国家标准 食品微生物学检验 单核细胞增生李斯特氏菌检验》。通常需提前配制稀释管、培养基,对使用的稀释管、培养基和相关耗材进行高压灭菌,经样品处理、稀释、加样、培养、计数等环节才能得到检测结果,通常需2 d以上,操作费时费力。为能得到准确结果的同时缩短检测时间、降低检测成本,研究人员开发了新型的微生物检测技术。
3 肉及肉制品微生物检测新技术
3.1 快速测试片法
快速测试片法是将培养基系统预先制备在测试片上,微生物菌落在测试片上呈红色或粉红色,可增强微生物计数效果。赵立冬等[7]分别使用快速测试片法与 GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》检测熟肉样品、人工污染熟肉样品的菌落总数结果一致性,发现2 种方法检测结果相关系数分别为0.897、0.964,检测结果一致性较好。快速测试片法与传统的平板计数法原理相同,但该方法无需提前配制培养基、稀释液,检测步骤较少、效率高,培养时间仅需24 h,可大幅节省检测时间,同时可节省菌落总数检测过程中的时间和人力成本,目前已形成成熟的商业化产品。
3.2 ATP生物荧光法
ATP广泛存在于生物活体内,且每个微生物活菌细胞中均有含量近似的ATP[8],荧光素酶是一种生物活性催化剂,可将ATP的化学能转化为光能[9]。ATP在具备荧光素酶、氧气、镁离子的环境中可与荧光素反应产生荧光,荧光强度与ATP含量呈线性关系,通过检测生物荧光即可间接获得菌落总数[10]。黄彬等[11]优化肉及肉制品中微生物ATP提取方法,分别采用十六烷基三甲基溴化铵和β-环糊精为微生物细胞ATP的提取剂和中和剂,发现当肉制品中微生物浓度为103~107 CFU/mL时测得的发光强度对数值与平板计数结果对数值相关系数为0.929 1,可用于实际检测,但因无法排除体细胞ATP的影响而不适用于原料肉的菌落总数检测。
3.3 分子诊断法
3.3.1 多重实时聚合酶链式反应(polymerase chain reaction,PCR)法
多重实时PCR是在常规PCR的基础上加入多对特异性引物,通过DNA聚合酶催化及碱基配对实现对引物界定的DNA样品中不同序列扩增[12],具有检测通量高、灵敏度高、成本低等优势,近年来发展迅速[13]。Elisa等[14] 利用多重实时PCR方法同步检测肉制品中沙门氏菌、大肠埃希氏菌O157:H7和单核细胞增生李斯特氏菌,若样品中只含有这3 种致病菌中的一种,则检测限可达10 CFU/g, 若样品中有3 种致病菌,则检测限为102 CFU/g。范维等[15] 使用多重实时PCR的方法同步检测散装即食肉制品中沙门氏菌、金黄色葡萄球菌和蜡样芽孢杆菌,增菌5 h后,3 种微生物的检出限分别达到3.8、4.9、5.7 CFU/mL。 熊苏玥等[16]利用多重实时PCR方法同步检测香肠中的金黄色葡萄球菌、单核细胞增生李斯特氏菌、沙门氏菌、大肠杆菌O157:H7及霉菌,5 种致病微生物在20 h内的检出限均可达100 CFU/25 g。Nguyen等[17]先将鸡肉中沙门氏菌、大肠杆菌O157:H7与单核细胞增生李斯特氏菌增菌12 h,再使用多重实时PCR检测,与不增菌直接检测相比可将检出限降低1 个数量级。闫琳等[18]将人为接种沙门氏菌的禽肉增菌12 h后,再利用多重实时PCR检测,检出限可低至100 CFU/25 g。由此可见,多重实时PCR检测微生物,尤其是致病菌的高灵敏度是建立在增菌培养处理的前提下,增菌时间越长,灵敏度越高,实际检测过程中需根据样品情况在检测时间和检测限二者间进行平衡。
3.3.2 等温扩增技术
等温扩增技术仅需简单的恒温仪器既可实现核酸体外扩增,已成为PCR扩增技术的替代性选择,包括环介导等温扩增、滚环扩增、单引物扩增等技术[19-20]。 Ledlod等[21]开发了基于环介导等温扩增技术和双向侧流试纸相结合的方法,可在45 min内快速检测肉品中单核细胞增生李斯特氏菌,检出限达20 CFU/g。Chen Xingxing等[22]开发了基于等温扩增技术的猪肉制品金黄色葡萄球菌快检方法,检出限达50 CFU/mL。等温扩增技术的缺点在于对引物设计的要求较高,同时易形成气溶胶,造成假阳性,影响检测结果。
3.4 免疫分析法
3.4.1 胶体金免疫层析技术
胶体金免疫层析技术是一种以胶体金作为标记物应用于检测特定抗原或抗体的一种新型免疫标记技术。胶体金在弱碱性环境下带负电荷,可与带正电荷基团的蛋白质分子、伴刀豆球蛋白A、植物血浆凝集素、萄球菌A蛋白等生物大分子结合,在显微镜下呈黑褐色,若有大量结合物聚集则用肉眼即可观察到粉红斑点,可用于定性或半定量的快速免疫检测[23]。刘志科等[24]开发出鸡白痢沙门氏菌胶体金免疫层析快速检测试纸条,与其他病原菌无交叉反应,检测结果与平板凝集实验符合率达到96.4%。Song Chunmei等[25]成功研制出一种胶体金免疫层析试纸条,用于快速检测肉冻等食品中志贺氏菌和大肠杆菌O157:H7。胶体金免疫层析技术的缺点在于无法实现高通量检测,且其准确性高度依赖抗体的特异性。
3.4.2 荧光量子免疫试纸条法
荧光量子表面具有不同的官能团,通过修饰即可与抗体等生物大分子偶联,同时荧光量子点具有稳定性好、荧光强度高等特点,可提高免疫层析试纸条的灵敏度和稳定性[26-27]。朱芳茜等[28]利用自制的量子点偶联志贺氏菌单克隆抗体,研制了一种可视化检测志贺氏菌的量子点免疫荧光试纸条,该试纸条在猪肉、火腿肠等样品中的检测限为1×104 CFU/mL,单样品检测时间为15 min。荧光量子免疫试纸条法的缺点在于检测限较高,目前仍无法满足肉制品中致病菌的检测限量要求。
3.5 光谱检测
3.5.1 近红外光谱法
近红外光谱波长为780~2 526 nm,是介于可见光与中红外光之间的电磁波,可反映分子化学键基频振动的倍频和合频吸收,结合化学计量学方法(如偏最小二乘法)可实现快速、无损、多组分同步检测含氢官能团的有机物,已广泛应用于猪胴体[29]、鲜猪肉[30]、鲜牛肉及冻牛肉[31-33]、鲜羊肉[34-35]、鲜鸡肉[36-37]、羊肉卷[38]、牛肉汉堡饼[39]等肉及肉制品的检测。Alexandrakis等[40]利用近红外光谱法可定性识别鸡胸肉中是否含李斯特菌、荧光假单胞菌、恶臭假单胞菌、门多萨假单胞菌和大肠杆菌。Argyri[41]、Panagou[42]等采用傅里叶变换红外光谱建立了冷却牛肉腐败程度预测模型,新鲜、半新鲜、腐败冷却牛肉识别准确率分别达到91.7%、81.2%和94.1%,并可直接预测菌落总数。Grau等[43]开发了基于短波近红外光谱技术的包装切片鸡胸肉新鲜度快速定性检测技术,可与腐败特征指标菌落总数的指示作用保持一致。
3.5.2 表面增强拉曼光谱法
光束照射到物体表面时出现的少部分折射光方向和波长均发生变化的散射为拉曼光谱[44-46]。不同的被照射物质分子中的官能团各不相同,由此产生振动的拉曼光谱可提供分子结构信息,从而实现对被照射物质的快速检测[47-48]。但是拉曼光谱易受干扰,导致信号较弱,通过贵金属表面糙化处理可使拉曼信号增强,这种现象被称为表面增强拉曼,可实现痕量物质的快速检测[49-51]。Ma Xiaoyuan等[52]在多刺纳米金粒子上修饰巯基化适配体作为表面增强拉曼纳米探针,检测猪肉样品中的沙门氏菌,检测限为4 CFU/mL,加标回收率为96.55%~105.45%。Zhang Hui等[53]利用适配体固定化磁性纳米金粒子捕获猪肉样品中的金黄色葡萄球菌,经优化后表面增强拉曼法检出限为35 CFU/mL,加标回收率为94.12%~102.75%。拉曼光谱也可反映肉中蛋白质结构变化,从而反映肉的腐败变质程度[54-55]。
3.5.3 高光谱成像技术
高光谱成像技术是一种光谱和图像融合的光电检测技术,能同时反映样品内外部的信息,光谱波段覆盖了紫外、近红外、可见光区域,分辨率可达纳米级别,是一种融合光学、计算机、信号处理学的检测技术[56-59]。Peng Yankun等[60]开发基于高光谱成像系统的猪肉菌落总数检测技术,使用逐步判别法筛选出可表征菌落总数的5 个最佳波长,通过最小二乘支持向量机建立了理想的预测模型。郭中华等[61]开发了可检测羊肉表面菌落总数的高光谱成像系统,经优化的人工神经网络模型相关系数可达0.998 8。赵俊华等[62]利用高光谱成像技术开发腊肉菌落总数的定量分析技术,校正集和预测集相关系数分别为0.808和0.798。李文采等[63]以市售冷藏鸡胸肉为研究对象,建立基于高光谱成像技术的菌落总数快速预测模型,校正集和验证集相关系数分别为0.93和0.86。 王伟等[64]以生鲜猪肉为研究对象,选用最小二乘支持向量机的建模方法构建基于高光谱成像技术的细菌总数预测模型,与标准平板菌落总数记数法所检测的细菌总数相关系数达到0.94以上。
光谱法对肉及肉制品中有机物含量有较好的预测效果,同时具有一定的定性判别能力,但目前光谱类设备价格较高,未开发出针对不同产品基质的微生物检测专用设备,且多为预测方法,仍需对其预测准确性进行大量验证才可进行实际应用。
3.6 仪器法
3.6.1 流式细胞术
流式细胞术是融合流体力学、激光学、荧光染色科学和计算机科学的细胞分析技术,具有快速、多指标、分析全面等特点[65]。随着流式细胞术在各领域[66-71]中的应用越来越多,商品化的流式细胞仪也越来越成熟。微生物通常由分析型的流式细胞仪检测,该设备包括液流系统、光路检测系统和检测分析系统,将待测样品制成单细胞悬液,经液流系统进入光路检测系统,细胞在激光照射下发生散射和折射,产生的散射光信号和荧光信号由不同的通道接收,经计算机分析处理得出检测结果[72]。 黄韵[73]分别采用Guava EasyCyte 6-2 L流式细胞仪和平板计数法对冷鲜肉中的单增李斯特菌进行检测,研究发现,单增李斯特菌在4 ℃冷鲜肉中经过16 d培养后流式细胞仪和平板计数法检测结果分别为5.4×107、5.3×107 CFU/g, 二者结果十分接近。流式细胞术的缺点在于只能对细胞等生物分子进行分析检测,肉及肉制品等食品中不同基质需使用不同的荧光染料标记,存在荧光信号重叠的可能性,会降低检测准确性。
3.6.2 电化学法
微生物在培养过程中,生理代谢作用使培养基的电惰性物质(如碳水化合物、类脂、蛋白质)转化为电活性物质,大分子物质转化成小分子物质,体系的阻抗降低,因此可以通过测定体系中电流或电位的变化规律,构建电流或电位与微生物浓度的关系模型,进而测定出体系中微生物的浓度。这种方法具有测定快速、直观、操作简单、测定设备成本低和信号可控等特点[74-76]。 刘飞等[77]依据微生物呼吸作用的电子传递规律,采用原电池的工作原理,开发基于电化学法的冷鲜肉中菌落总数快速预测技术,预测值和实测值的差异(预测值和实测值差值的绝对值与其平均值的比率)在15%以内。
4 结 语
食品安全法规定,食品应检验合格后方可出厂或销售,而传统微生物检测方法检验周期较长,菌落总数和大肠菌群2~3 d、食源性致病菌3~5 d,对鲜牛肉、熏煮香肠等保质期较短且出厂必须检测微生物的肉及肉制品造成了极大的流通压力和经济损失,因此微生物检测新技术和仪器在肉类领域具有巨大的市场需求。本文综述6 种类型、11 种肉及肉制品微生物检测新技术的研究进展,多数具备节省检测时间的优势,满足了肉类企业缩短检测周期的需求,但多数检测方法仍停留在实验室研究阶段,存在实际检测应用对比数据偏少、仪器商品化程度低等问题,建议加强检测新技术与传统检测方法在实际样品检测应用中的比对工作,改进检测方法细节,进一步提高检测准确率,同时推动新技术的标准化,加快新技术与设备在实际检测中的应用。
[1] 张凯华, 臧明伍, 赵洪静, 等. 国内外素肉监管法规标准对比分析与借鉴[J]. 食品科学, 2022, 43(1): 298-305. DOI:10.7506/spkx1002-6630-20210420-271.
[2] 中华人民共和国统计局. 中国统计年鉴[M]. 北京: 中国统计出版社, 2021.
[3] 张德权, 惠腾, 王振宇. 我国肉品加工科技现状及趋势[J]. 肉类研究, 2020, 34(1): 1-8. DOI:10.7506/rlyj1001-8123-20191029-256.
[4] 中商产业研究院. 2019年全国肉制品产量将达1 775 万吨, 低温肉制品市场份额持续扩大[EB/OL]. (2018-11-21) [2022-03-21]. https://www.askci.com/news/chanye/20181121/1052141137115.shtml.
[5] 东方财富网. 2020年肉制品加工产业链中游发展现状分析: 高温肉制品占主导市场[EB/OL]. (2020-09-10) [2022-03-21]. https://baijiahao.baidu.com/s?id=1677442192942392860&wfr=spider&for=pc.
[6] 食品安全抽检司. 市场监管总局关于9 批次食品抽检不合格情况的通报[EB/OL]. (2021-12-31) [2022-03-21]. https://gkml.samr.gov.cn/nsjg/spcjs/202112/t20211231_338739.html.
[7] 赵立冬, 赵红阳, 石业娇, 等. 3MTM PetrifilmTM快速菌落总数测试片法与食品中菌落总数检测国标方法 (GB 4789.2—2010)的比较[J]. 中国微生态学杂志, 2018, 30(10): 1203-1216. DOI:10.13381/j.cnki.cjm.201810022.
[8] HAWRONSKYJ J M, HOLAH J. ATP: a universal hygiene monitor[J]. Trends in Food Science and Technology, 1997, 8(3): 79-84.DOI:10.1016/S0924-2244(97)01009-1.
[9] SPUDICH J A, GERHART J, MCKNIGHT S L. Annual review of cell and developmental biology[J]. Annual Review of Cell and Developmental Biology, 1998, 14: 197-230. DOI:10.1146/annurev.cb.23.113007.100001.
[10] 罗金平, 田青, 岳伟伟, 等. 快速检测细菌总数的便携式生物荧光传感器[J]. 分析化学, 2009, 37(2): 306-310. DOI:10.3321/j.issn:0253-3820.2009.02.029.
[11] 黄彬, 于元善, 唐道邦, 等. CATB提取ATP的生物荧光法快速检测细菌总数准确性研究[J]. 现代食品科技, 2014, 30(2): 269-273. DOI:10.13982/j.mfst.1673-9078.2014.02.008.
[12] 陆贞玉, 石朝晖, 秦金勇, 等. 多重PCR技术在食源性致病菌检测中的应用进展[J]. 应用预防医学, 2016, 22(6): 554-556. DOI:10.3969/j.issn.1673-758X.2016.06.029.
[13] ALEJANDRO G M, DAVID T F, MARTA P R. The use of multiplex real-time PCR for the simultaneous detection of foodborne bacterial pathogens[J]. Food Weekly News, 2019, 23: 418-423. DOI:10.1007/978-1-4939-9000-9_3.
[14] ELISA C, LUCA R, GIORGIO B, at al. Rapid and simultaneous detection of Salmonella spp., Escherichia coli O157, and Listeria monocytogenes by magnetic capture hybridization and multiplex real-time PCR[J]. Folia Microbiologica, 2018, 63(6): 735-742. DOI:10.1007/s12223-018-0617-0.
[15] 范维, 高晓月, 李贺楠, 等. 3 种致病菌多重real-time PCR检测方法的建立及其在散装即食肉制品中的应用[J]. 食品科学, 2022, 43(2): 332-338. DOI:10.7506/spkx1002-6630-20210416-230.
[16] 熊苏玥, 米瑞芳, 陈曦, 等. 多重PCR同时检测食品中4 种细菌与常见霉菌[J]. 食品科学, 2019, 40(4): 305-311. DOI:10.7506/spkx1002-6630-20180521-283.
[17] NGUYEN T T, GIAU V V, VO T K. Multiplex PCR for simultaneous identification of E. coli O157:H7, Salmonella spp. and L. monocytogenes in food[J]. Biotech, 2016, 6(2): 205-214. DOI:10.1007/ s13205-016-0523-6.
[18] 闫琳, 王晓英, 郭云昌, 等. 增菌-PCR法与传统方法检测禽肉中沙门氏菌的比较研究[J]. 卫生研究, 2011, 40(3): 348-351; 354.
[19] 王瑞. 快速核酸扩增及可视化策略用于食源性致病菌和转基因作物检测[D]. 杭州: 浙江大学, 2019: 16. DOI:10.27461/d.cnki.gzjdx.2019.000339.
[20] REID M S, LE X C, ZHANG Hongquan. Exponential isothermal amplification of nucleic acids and assays for proteins, cells, small molecules, and enzyme activities: an EXPAR example[J]. Angewandte Chemie International Edition, 2018, 57(37): 11856-11866. DOI:10.1002/anie.201712217.
[21] LEDLOD S, BUNRODDITH K, AREEKIT S, et al. Development of a duplex lateral flow dipstick test for the detection and differentiation of Listeria spp. and Listeria monocytogenes in meat products based on loopmediated isothermal amplification[J]. Journal of Chromatography B, 2020, 1139: 121834. DOI:10.1016/j.jchromb.2019.121834.
[22] CHEN Xingxing, WU Xiaoli, GAN Min, et al. Rapid detection of Staphylococcus aureus in dairy and meat foods by combination of capture with silica-coated magnetic nanoparticles and thermophilic helicase-dependent isothermal amplification[J]. Journal of Dairy Science, 2015, 98(3): 1563-1570. DOI:10.3168/jds.2014-8828.
[23] 孔玉方, 王慧煜, 韩雪清. 胶体金免疫层析技术在食源性致病微生物检测中的应用[J]. 中国兽医杂志, 2019, 55(4): 82-84.
[24] 刘志科, 杨宁宁, 徐明国, 等. 鸡白痢沙门氏菌胶体金免疫层析快速检测试纸条的研制及初步应用[J]. 河南科技学院学报, 2018, 46(1): 39-48. DOI:10.3969/j.issn.1008-7516.2018.01.008.
[25] SONG Chunmei, LIU Cheng, WU Shuyan, et al. Development of a lateral flow colloidal gold immunoassay strip for the simultaneous detection of Shigella boydii, and Escherichia coli O157:H7 in bread, milk and jelly samples[J]. Food Control, 2016, 59: 345-351. DOI:10.1016/j.foodcont.2015.06.012.
[26] 林章碧, 苏星光, 张皓, 等. 用水溶液合成的量子点作为生物荧光标记物的研究[J]. 高等学校化学学报, 2003, 24(2): 216-220. DOI:10.3321/j.issn:0251-0790.2003.02.005.
[27] 李广强, 王升启, 姜海, 等. 量子点标记免疫层析技术检测布鲁氏菌病的方法研究[J]. 中国人兽共患病学报, 2019, 35(5): 389-392. DOI:10.3969/j.issn.1002-2694.2019.00.049.
[28] 朱芳茜, 何扩, 张秀媛, 等. 量子点标记荧光免疫试纸条可视化检测肉品中志贺氏菌研究[J]. 食品研究与开发, 2021, 42(3): 136-140. DOI:10.12161/j.issn.1005-6521.2021.03.022.
[29] GJERLAUG-ENGER E, KONGSRO J, AASS L, et al. Prediction of fat quality in pig carcasses by near-infrared spectroscopy[J]. Animal, 2011, 5(1): 1829-1841. DOI:10.1017/S1751731111000814.
[30] 王辉, 田寒友, 张顺亮, 等. 便携式中波近红外光谱仪在线无损检测生鲜猪肉胆固醇[J]. 光谱学与光谱分析, 2017, 37(6): 1759-1764. DOI:10.3964/j.issn.1000-0593(2017)06-1759-06.
[31] MARCHI M. On-line prediction of beef quality traits using near infrared spectroscopy[J]. Meat Science, 2013, 94(4): 455-460. DOI:10.1016/j.meatsci.2013.03.003.
[32] MORSY N, SUN D W. Robust linear and non-linear models of NIR spectroscopy for detection and quantification of adulterants in fresh and frozen-thawed minced beef[J]. Meat Science, 2013, 93(2): 292-302. DOI:10.1016/j.meatsci.2012.09.005.
[33] 王辉, 田寒友, 张顺亮, 等. 基于中波近红外光谱定量分析生鲜牛肉胆固醇[J]. 食品科学, 2016, 37(24): 185-189. DOI:10.7506/spkx1002-6630-201624029.
[34] 邹昊, 田寒友, 刘文营, 等. 应用便携式近红外仪检测生鲜羊通脊肉的嫩度[J]. 肉类研究, 2014, 28(10): 15-19. DOI:10.7506/rlyj1001-8123-201410004.
[35] 邹昊, 田寒友, 刘飞, 等. 近红外光谱的预处理对羊肉TVB-N模型的影响[J]. 食品科学, 2016, 37(22): 180-186. DOI:10.7506/spkx1002-6630-201622027.
[36] 王辉, 田寒友, 张顺亮, 等. 基于中波近红外光谱构建生鲜鸡肉胆固醇定量分析模型[J]. 食品科学, 2016, 37(20): 134-140. DOI:10.7506/spkx1002-6630-201620022.
[37] MARCHI M, RIOVANTO R, PENASA M, et al. At-line prediction of fatty acid profile in chicken breast using near infrared reflectance spectroscopy[J]. Meat Science, 2012, 90(3): 653-657. DOI:10.1016/j.meatsci.2011.10.009.
[38] 白京, 李家鹏, 邹昊, 等. 近红外特征光谱定量检测羊肉卷中猪肉掺假比例[J]. 食品科学, 2019, 40(2): 287-292. DOI:10.7506/spkx1002-6630-20180531-452.
[39] 白京, 李家鹏, 邹昊, 等. 近红外光谱定性定量检测牛肉汉堡饼中猪肉掺假[J]. 食品科学, 2019, 40(8): 287-292. DOI:10.7506/spkx1002-6630-20180802-016.
[40] ALEXANDRAKIS D, DOWNEYG, SCANNELL A G M, et al. Detection and identification of selected bacteria, inoculated on chicken breast, using near infrared spectroscopy and chemometrics[J]. Sensing and Instrumentation for Food Quality and Safety, 2011, 5(2): 57-62. DOI:10.1007/s11694-011-9111-y.
[41] ARGYRI A A, PANAGOU E Z, TARANTILIS P A, et a1. Rapid qualitative and quantitative detection of beef fillets spoilage based on Fourier transform infrared spectroscopy data and artificial neural networks[J]. Sensors and Actuators B: Chemical, 2010, 145(1): 146-154. DOI:10.1016/j.snb.2009.11.052.
[42] PANAGOU E Z, MOHAREB F R, ARGYRI A A, et al. A comparison of artificial neural networks and partial least squares modelling for the rapid detection of the microbial spoilage of beef fillets based on Fourier transform infrared spectral fingerprints[J]. Food Microbiology, 2011, 28(4): 782-790. DOI:10.1016/j.fm.2010.05.014.
[43] GRAU R, SANCHEZ A J, GIRON J, et al. Nondestructive assessment of freshness in packaged sliced chicken breasts using SW-NIR spectroscopy[J]. Food Research International, 2011, 44(1): 331-337. DOI:10.1016/j.foodres.2010.10.011.
[44] ZHU Chuhong, HU Xiaoye, WANG Xiujuan. Silver nanocubes/ graphene oxide hybrid film on a hydrophobic surface for effective molecule concentration and sensitive SERS detection[J]. Applied Surface Science, 2019, 470(15): 423-429. DOI:10.1016/j.apsusc.2018.11.169.
[45] LOMBARDI J R, BIRKE R L. A unified view of surface-enhanced Raman scattering[J]. Accounts of Chemical Research, 2009, 42(6): 734-742. DOI:10.1021/ar800249y.
[46] RAMAN C V, KRISHNAN K S. A new type of secondary radiation[J]. Nature, 1928, 121: 501-502. DOI:10.1038/121501c0.
[47] XU Menglei, GAO Yu, HAN Xiaoxia, et al. Detection of pesticide residues in food using surface-enhanced Raman spectroscopy: a review[J]. Journal of Agricultural and Food Chemistry, 2017, 65(32): 6719-6726. DOI:10.1021/acs.jafc.7b02504.
[48] STÖCKEL S, KIRCHHOFF J, NEUGEBAUER U, et al. The application of Raman spectroscopy for the detection and identification of microorganisms[J]. Journal of Raman Spectroscopy, 2016, 47(1): 89-109. DOI:10.1002/jrs.4844.
[49] ALTHAGAFI I I, AHMED S A, EL-SAIDID W A. Fabrication of gold/graphene nanostructures modified ITO electrode as highly sensitive electrochemical detection of aflatoxin B1[J]. PLoS ONE, 2019, 14(1): e0210652. DOI:10.1371/journal.pone.0210652.
[50] JEANMAIRE D L, VAN DUYNE R P. Surface Raman spectroelectrochemistry: Part I. Heterocyclic, aromatic, and aliphatic amines adsorbed on the anodized silver electrode[J]. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry, 1977, 84(1): 1-20. DOI:10.1016/S0022-0728(77)80224-6.
[51] ALBRECHT M G, CREIGHTON J A. Anomalously intense Raman spectra of pyridine at a silver electrode[J]. Journal of the Amercian Chemical Society, 1977, 99(15): 5215-5217. DOI:10.1021/ja00457a071.
[52] MA Xiaoyuan, XU Xumin, XIA Yu, et al. SERS aptasensor for Salmonella typhimurium detection based on spiny gold nanoparticles[J]. Food Control, 2018, 84: 232-237. DOI:10.1016/j.foodcont.2017.07.016.
[53] ZHANG Hui, MA Xiaoyuan, LIU Ying, et al. Gold nanoparticles enhanced SERS aptasensor for the simultaneous detection of Salmonella typhimurium and Staphylococcus aureus[J]. Biosensors and Bioelectronics, 2015, 74: 872-877. DOI:10.1016/j.bios.2015.07.033.
[54] SOWOIDNICH K, SCHMIDT H, MAIWALD M, et al. Application of diode-laser Raman spectroscopy for in situ investigation of meat spoilage[J]. Food Bioprocess Technology, 2010, 3: 878-882. DOI:10.1007/s11947-010-0360-2.
[55] SCHMIDT H, SOWOIDNICH K, KRONFELDT H D.A prototype hand-held ramansensor for the in situ characterization of meat quality[J]. Applied Spectroscopy, 2010, 64(8): 888-894. DOI:10.1366/000370210792081028.
[56] 徐爽, 何建国, 马瑜, 等. 高光谱图像技术在水果品质检测中的研究进展[J]. 食品研究与开发, 2013, 34(10): 4-8. DOI:10.3969/j.issn.1005-6521.2013.010.002.
[57] 刘燕德, 张光伟. 高光谱成像技术在农产品检测中的应用[J].食品与机械, 2012, 28(5): 223-226. DOI:10.3969/j.issn.1003-5788.2012.05.059.
[58] 张晶晶. 基于高光谱成像技术的杏成熟度判别研究[D]. 晋中: 山西农业大学, 2015: 11.
[59] 张达, 郑玉权. 高光谱遥感的发展与应用[J]. 光学与光电技术, 2013, 11(3): 67-73.
[60] PENG Yankun, WANG Wei. Prediction of pork meat total viable bacteria count using hyperspectral imaging system and support vector machines[J]. Food Processing Automation Conference Proceedings, 2008, 6: 28-29. DOI:10.13031/2013.24558.
[61] 郭中华, 郑彩英, 金灵. 基于近红外高光谱成像的冷鲜羊肉表面细菌总数检测[J]. 食品工业科技, 2014, 20(12): 66-81. DOI:10.13386/j.issn1002-0306.2014.20.005.
[62] 赵俊华, 郭沛源, 邢素霞, 等. 基于高光谱成像的腊肉细菌总数预测建模方法研究[J]. 中国调味品, 2016, 41(2): 74-78. DOI:10.3969/j.issn.1000-9973.2016.02.015.
[63] 李文采, 刘飞, 田寒友, 等. 基于高光谱成像技术的鸡肉菌落总数快速无损检测[J]. 肉类研究, 2017, 31(3): 35-39. DOI:10.7506/rlyj1001-8123-201703007.
[64] 王伟, 彭彦昆, 张晓莉. 基于高光谱成像的生鲜猪肉细菌总数预测建模方法研究[J]. 光谱学与光谱分析, 2010, 30(2): 411-415. DOI:10.3964/j.issn.1000-0593(2010)02-0411-05.
[65] 梁智辉, 朱慧芬, 陈九武. 流式细胞术基本原理与实用技术[M]. 武汉: 华中科技大学出版社, 2008.
[66] 张月霞, 张立营, 赵权. 流式细胞术的医学应用现状与前景[J]. 中国当代医药, 2019, 26(34): 28-30. DOI:10.3969/j.issn.1674-4721.2019.34.009.
[67] 赵苑, 董逸, 李海波, 等. 流式细胞术检测海洋浮游异养细菌异质性的研究进展[J]. 海洋通报, 2020, 39(1): 12-23. DOI:10.11840/j.issn.1001-6392.2020.01.002.
[68] 黄生权, 付萌, 唐青涛, 等. 流式细胞术检测单增李斯特菌与酿酒酵母[J]. 现代食品科技, 2014, 30(3): 195-200.
[69] 李松波, 金卫东, 王隽, 等. 流式细胞术在体育科研中的应用[J].北京体育大学学报, 2008, 31(8): 1102-1104. DOI:10.3969/j.issn.1007-3612.2008.08.026.
[70] 何方洋, 万宇平, 贾芳芳, 等. 流式细胞仪在检测食品中微生物的应用研究[J]. 山东畜牧兽医, 2016, 37(8): 82-84. DOI:10.3969/j.issn.1007-1733.2016.08.057.
[71] 刘婷婷. 流式细胞术在微生物检测中应用研究[D]. 上海: 上海师范大学, 2021: 2-6. DOI:10.27312/d.cnki.gshsu.2021.000668.
[72] 文刚, 王静怡, 黄廷林, 等. 流式细胞仪在水处理中的应用现状与展望[J]. 中国给水排水, 2014, 30(18): 58-62.
[73] 黄韵. 冷鲜肉中单增李斯特菌活菌分子检测技术研究[D]. 广州: 华南理工大学, 2014: 33-45.
[74] PEREZ F, TRYLAND I, MASCINI M, et al. Rapid detection of Escherichia coli in water by a culture-based amperometrie method[J]. Analytica Chimica Acta, 2001, 427: 149-154. DOI:10.1016/S0003-2670(00)00984-3.
[75] BOYAC S H, AGUILAR Z P, HOSSAIN M, et al. Amperometric determination of live Escherichia coli using antibody-coated paramagnetic beads[J]. Analytical and Bioanalytical Chemistry, 2005, 382(5): 1234-1241. DOI:10.1007/s00216-005-3263-8.
[76] PENG Tuzhi, CHENG Quan, RAYMOND C. Amperometric detection of Escherichia coli heat-labile enterotoxin by redox diacetylenic vesicles on a sol-gel thin-film electrode[J]. Analytical Chemistry, 2000, 72(7): 1611-1617. DOI:10.1021/ac990406y.
[77] 刘飞, 李文采, 田寒友, 等. 猪肉剩余货架期快速预测电化学设备的设计与试验[J]. 农业工程学报, 2016, 32(12): 261-266. DOI:10.11975/j.issn.1002-6819.2016.12.037.