黄羽肉鸡是由我国地方品种杂交培育而成的优质肉鸡品种[1],肉质具有韧性和咀嚼性,更适合中式炖煮烹饪。黄羽肉鸡主要通过现买现杀的形式销售,但是随着活禽定点屠宰政策的施行,加之我国黄羽肉鸡的产品加工率较低,黄羽肉鸡销售模式陷入瓶颈期[2]。除此之外,由于禽流感频发及活禽交易被禁,热鲜鸡也逐渐退出历史舞台[3]。因而经过加工的黄羽肉鸡产品仍要符合消费者的口感需求,同时还要尽可能延长产品的货架期。中式烹饪专用原料肉制作的产品研究较少,有关禽肉专用原料的研究也处于起步阶段。
宰后肉的成熟嫩化影响肉的品质,肉的成熟嫩化与内源蛋白酶水解蛋白紧密相关,内源蛋白酶的主要组成包括钙蛋白酶、组织蛋白酶(B、L、D等)、细胞凋亡酶等[4]。不同于猪、牛和羊等哺乳动物肉的成熟期,鸡肉在冷藏温度(2±2) ℃下24 h内即可完成成熟[5]。同时有研究表明,PSE(pale, soft, exudative)鸡肉的蛋白水解物及蛋白酶活力显著高于正常鸡肉[6]。可见,过度的肌原纤维蛋白酶解在一定程度上会破坏鸡肉的质地[7]。目前,鸡肉的屠宰加工方式主要为放血净膛后对胴体迅速降温(预冷)以减缓胴体生化反应进程和减少腐败微生物繁殖[8],但是后续低温冷藏过程中蛋白酶解反应仍在持续,随着冷藏时间的延长,肉品质地会发生一定程度的劣化。因此,开展基于内源酶钝化的冰鲜鸡肉产品品质控制研究将有助于解决黄羽肉鸡加工产业的问题。
低温加热(50~80 ℃)是当前肉类加工领域的研究热点,该技术可降低肉的韧性,改善其质构特性,降低水分流失速率,提高鸡肉的保水性,并延缓脂质氧化进程,有利于保持肉的色泽和风味,同时加热可杀死微生物,显著提升肉制品品质[9]。目前常用热处理方法为微波热处理,微波热处理通过食物中极性分子的快速碰撞和挤压使温度迅速上升,微波可以引起酶的二级和三级结构变化[10]。采用微波加热的优点为:1)加热均匀且温度可控[11];2)加热载体不会吸收微波能量,节约成本[12]; 3)不会破坏食物原有营养价值[13];4)杀菌灭酶[14]。Liu Peng等[15]研究表明,甘薯发芽前采用微波预处理进行干燥,花青素保留率达59.34%。秦静等[16]研究发现,微波(231 W、30 s)能够显著降低紫花苜蓿鲜草中蛋白酶活力,同时能保持较高的营养价值。由于微波处理的肉品中水分等物质容易流失,从而导致肉品颜色、保水性等品质较差[17]。采用蒸汽协同微波热处理,可以有效避免肉在加热中因温度过高导致肉品品质下降。韩忠等[18]研究蒸汽协同微波热处理对鱼肉品质的影响发现,蒸汽协同微波热处理鱼肉水分含量较高,鱼肉色差变化不明显。
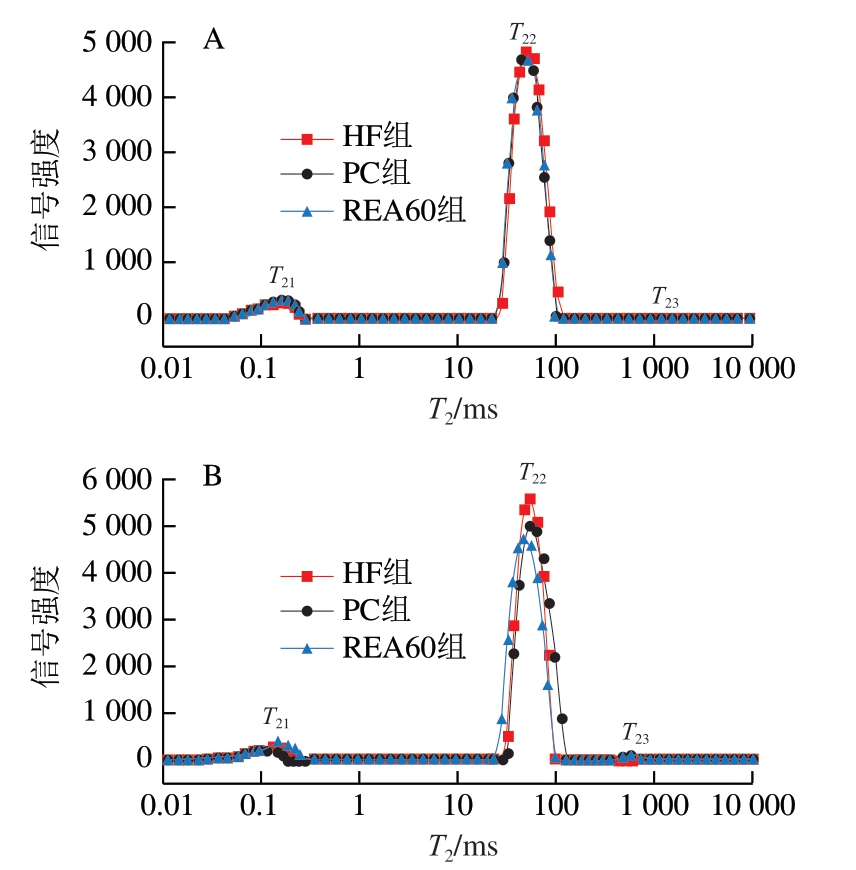
图 1 黄羽肉鸡原料肉腌制后水分分布
Fig. 1 Water distribution of yellow-feathered broilers raw meat after curing
A、B. 食盐溶液质量浓度分别为0、3 g/100 mL。
已通过预实验获得合适的蒸汽协同微波低温热处理方式钝化鸡肉总蛋白酶(微波条件:100 W/10 s;蒸汽条件:50 ℃/120 s),并获得了冷藏后以质构为主的综合品质最佳的钝酶状态鸡肉,即残余酶活(the residual enzyme activity,REA)为60%的黄羽肉鸡原料肉(REA60)。本研究以黄羽肉鸡原料肉(REA60)为研究对象,以热鲜鸡(hot fresh chicken,HF)和预冷鸡(pre-cooling chicken,PC)为对照,测定黄羽肉鸡原料肉腌制后盐扩散能力(咸味)、鲜味、持水性(蒸煮损失率、离心损失率和水合能力)、水分分布、质构(硬度、咀嚼性、弹性和胶黏性)和微观结构(组织切片)的变化,分析钝酶后鸡肉腌制后品质的变化。
1 材料与方法
1.1 材料与试剂
活黄羽肉鸡(体质量约1.5 kg,饲养约300 d) 南京孝陵卫农贸市场;食盐 南京市下马坊华润苏果超市;FluoroTM荧光蛋白酶分析试剂盒 美国G-Biosciences公司。
1.2 仪器与设备
PG23EOW变频微蒸微波炉烤箱 广东美的厨房电器制造有限公司;Astre电子舌检测系统 法国Alpha M.O.S公司;HH-8数显恒温水浴锅 常州国华电器有限公司;TVT-300XP质构仪 瑞典TexVol公司;MesoMR23微型核磁共振仪 上海纽曼电子科技有限公司; Eclipse E100正置光学显微镜 日本尼康公司;Synergy 2 多功能酶标仪 美国BioTek公司。
1.3 方法
1.3.1 黄羽肉鸡的处理
黄羽肉鸡宰杀后,迅速取出鸡胸肉,去除表面脂肪及结缔组织,切成50 mm×50 mm×10 mm大小的肉块进行预处理,肉块分为3 组:热鲜组(不经过预冷池预冷,HF组)、预冷组(经预冷池预冷,PC组)和钝酶组(微波蒸汽热处理,REA组)。预冷处理的预冷水温度控制在5 ℃以下,预冷时间为0.5 h。鸡肉在微波热处理基础上再单独进行蒸汽热处理,按此过程分别循环0、2、4、6、8 次,获得不同钝酶率(REA100、REA80、REA60、REA40、REA20)的黄羽肉鸡原料肉。为保证鸡肉的中心温度处于较低水平(50~80 ℃),选取微波和蒸汽混合处理参数分别为100 W/10 s和50 ℃/120 s来钝化鸡肉总蛋白酶,采用荧光蛋白酶分析试剂盒测定总蛋白酶活。将上述样品进行真空包装后置于4 ℃冷藏,预实验得出REA60组的质构、鲜度、微生物等综合 品质最佳。
1.3.2 鸡肉的腌制
将处理过的鸡胸肉分为HF、PC、REA60 3 组,分别加入1.5 倍体积质量浓度0、3 g/100 mL的食盐溶液,腌制20 min,每个处理设置6 个平行。
1.3.3 鸡肉盐分扩散能力(咸味)测定
采用电子舌测定腌制后鸡肉的咸味,测定咸味的传感器为CTO,其检测器一般用于酱油、汤、各种调味汁测定,该传感器的响应物质包括NaCl、KCl等。取50 g鸡胸肉放置在食品料理机中,打碎搅拌1 min,随后肉样放置于40 ℃水浴锅中,直至肉中心温度为40 ℃,按照1∶5的比例添加250 mL的40 ℃蒸馏水后于料理机中混匀1 min,3 000 r/min离心10 min,静置分层,用移液管取上清液测试。
1.3.4 鸡肉鲜味测定
采用电子舌测定,测定鲜味的传感器为AAE,该传感器可检测汤、调味汁、肉中氨基酸和核酸等引起的鲜味,可检测的鲜味物质为肌苷酸(inosine monophosphate,IMP)等。测定方法同1.3.3节。
1.3.5 腌制后鸡肉持水性测定
1.3.5.1 水合能力测定
测定肉品初始质量记为m1(g),将腌制后的各组鸡胸肉表面擦干并控水5 min,称质量,记为m2(g),水合能力根据式(1)计算。
1.3.5.2 蒸煮损失率测定
根据李明奇等[19]方法,稍作改动。将腌制后的样品擦干表面水分,称质量(m1,g),肉块于85 ℃水浴加热至中心温度为75 ℃,冰水冷却擦干后称质量(m2,g),蒸煮损失率根据式(2)计算。
1.3.5.3 离心损失率测定
取3 g样品(m1,g)用滤纸轻轻包裹后离心(3 000 r/min、10 min),离心后拿下滤纸并擦干肉品表面水分称质量(m2,g),重复3 次,取平均值,离心损失率根据式(3)计算。
1.3.6 鸡肉水分分布测定
根据高子武等[20]方法,取3 g组织完整的鸡肉放置于玻璃核磁共振管中,质子共振频率设定为22 MHz。测定前,所有样品应在25 ℃下平衡30 min,于32 ℃进行低场核磁共振测定。使用CPMG脉冲序列测定横向弛豫时间(T2)。测定参数设置如下:采样等待时间2 000 ms,采样频率100 kHz,重复扫描次数8,回波个数3 500。由此产生的衰减曲线由MultiExp Inv分析软件进行反演操作。
1.3.7 鸡肉质构测定
取1.3.5.2节蒸煮后的肉块,用直尺与手术刀沿鸡胸肉纤维方向切成15 mm×15 mm×10 mm的肉块,置于物性测定仪水平台上,选用TA-35平底柱形探头。2 次压缩(TPA模式)测定样品的质构参数(硬度、弹性、咀嚼性和黏性)。测试速率120 mm/min,形变量50%,触发力5 g。每组结果取6 个样品的平均值。
1.3.8 鸡肉微观结构测定
将处理过的鸡胸肉加入1.5 倍体积质量浓度分别为0、3、6、9 g/100 mL的食盐溶液,腌制20 min,然后切成10 mm×10 mm×5 mm的小块,用体积分数3%戊二醛固定,送样前置于4 ℃贮藏,制成横纵石蜡切片,观察组织结构。
1.4 数据处理
数据以平均值±标准差表示。采用SPSS 18.0软件对数据进行单因素方差分析,在P<0.05的显著性水平下,采用Duncan’s检验进行多重比较。
表 1 黄羽肉鸡原料肉腌制后咸味和鲜味的变化
Table 1 Changes of saltiness and umami taste of yellow-feathered broilers after pickling
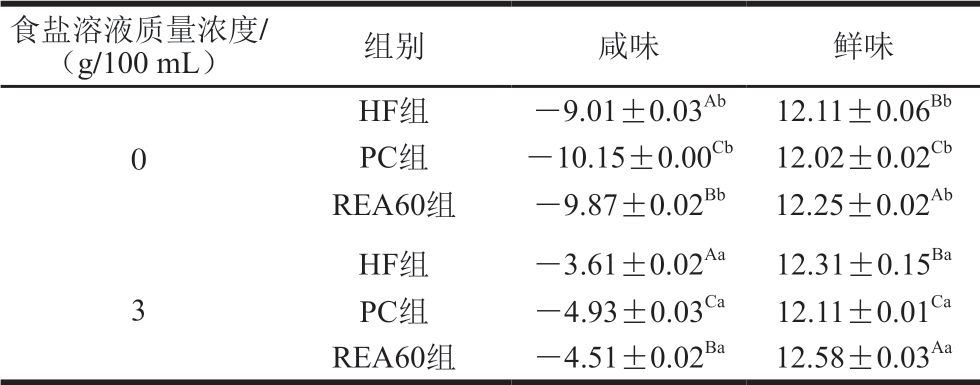
注:同列大写字母不同,表示食盐溶液质量浓度相同、不同处理方式差异显著(P<0.05);同列小写字母不同,表示相同处理方式、不同食盐溶液质量浓度差异显著(P<0.05)。下同。
食盐溶液质量浓度/(g/100 mL) 组别 咸味 鲜味0 HF组 -9.01±0.03Ab 12.11±0.06Bb PC组 -10.15±0.00Cb 12.02±0.02Cb REA60组 -9.87±0.02Bb 12.25±0.02Ab HF组 -3.61±0.02Aa 12.31±0.15Ba PC组 -4.93±0.03Ca 12.11±0.01Ca REA60组 -4.51±0.02Ba 12.58±0.03Aa 3
2 结果与分析
2.1 钝酶对鸡肉腌制后咸味和鲜味的影响
由表1可知,PC和REA60 2 组在未经腌制时咸味较HF组分别降低12.62%和9.51%。HF、PC和REA60 3 组腌制后的咸味较初始值分别增加59.93%、51.42%和54.31%,PC和REA60 2 组的咸味较HF组分别降低36.56%和24.93%。未经腌制的REA60组咸味值较低的原因可能是在微波蒸汽热处理时导致肉中的汁液流失及大量蒸汽喷出,降低了REA60组本身的钠离子和氯离子浓度。PC组在预冷过程中水分含量增多,肉中盐浓度降低。已有研究表明,钠离子是引起咸味感知的主要因素。钠离子的扩散能力与蛋白质的变性程度相关。蛋白质聚集体会阻断钠离子在肉中的扩散[21]。REA60组经微波蒸汽热处理后,蛋白质充分膨胀并进一步形成大聚集体,咸味降低。腌制后,各组肉的咸味显著升高。研究表明,微波蒸汽热处理可能增强了肉中水(不易流动水和游离水)的迁移率[22],高迁移率的水分子促进了盐的扩散,从而提高了鸡肉(REA60)的咸味,使之显著高于PC组。以上结果说明,钝酶后鸡肉的盐分扩散能力介于预冷鸡和热鲜鸡之间。
未经腌制的HF、PC和REA60 3 组的鲜味分别为12.11、12.02和12.25。腌制后HF、PC和REA60 3 组的鲜味较其初始值分别增加1.65%、0.75%和2.69%,REA60和HF组较PC组分别高1.65%和3.88%。未经腌制的REA60组热处理钝酶时会促进肉中ATP转化成鲜味物质IMP,累积较多的IMP。REA60组内源蛋白酶活性较低,IMP分解生成的苦味物质次黄嘌呤较少[23]。所以,REA60组的鲜味显著高于其他组(P<0.05)。PC组的鲜味降低可能是在预冷过程中一磷酸腺苷脱氨酶活性受到抑制[24],延缓了ATP转化生成IMP的进程,减少了IMP的累积量。腌制后各组的鲜味显著升高,盐处理能促进ATP分解为IMP的速率,同时也抑制了IMP的分解,有利于IMP的累积,使肉具有良好滋味。汪之颖等[25]研究表明,添加2 g/100 mL食盐腌制草鱼后IMP的分解速率降低,该结果与本研究相似。所以,腌制后钝酶鸡肉的IMP分解速率较低,IMP累积量较多,保持鲜味能力较强。
表 2 黄羽肉鸡原料肉腌制后持水性的变化
Table 2 Changes of water holding capacity of yellow-feathered broilers after pickling
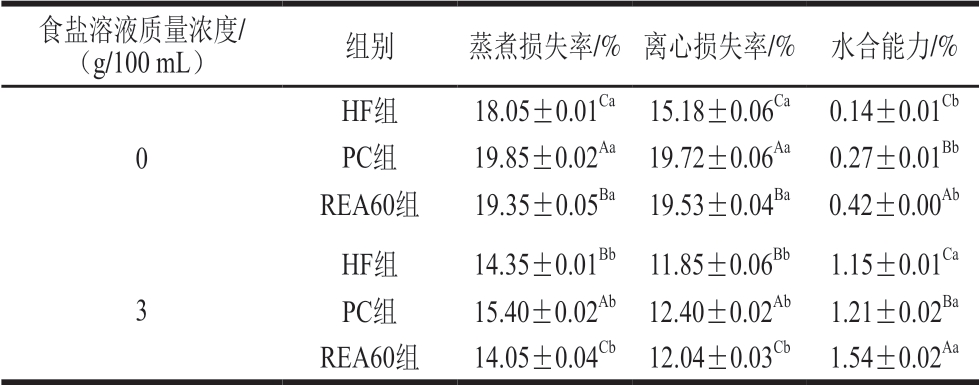
食盐溶液质量浓度/(g/100 mL) 组别 蒸煮损失率/% 离心损失率/% 水合能力/%0 HF组 18.05±0.01Ca 15.18±0.06Ca 0.14±0.01Cb PC组 19.85±0.02Aa 19.72±0.06Aa 0.27±0.01Bb REA60组 19.35±0.05Ba 19.53±0.04Ba 0.42±0.00Ab 3 HF组 14.35±0.01Bb 11.85±0.06Bb 1.15±0.01Ca PC组 15.40±0.02Ab 12.40±0.02Ab 1.21±0.02Ba REA60组 14.05±0.04Cb 12.04±0.03Cb 1.54±0.02Aa
2.2 钝酶对鸡肉腌制后持水性的影响
由表2可知,各组腌制后的蒸煮损失率和离心损失率显著减少,水合能力显著增强(P<0.05)。未经腌制的HF、PC和REA60 3 组的初始蒸煮损失率分别为18.05%、19.85%和19.35%,PC和REA60 2 组的水合能力较HF组分别增加0.128%和0.273%。腌制后,HF、PC和REA60 3 组的蒸煮损失率显著下降(P<0.05),分别为14.35%、15.40%和14.05%,较初始值分别减少20.50%、22.41%和27.39%。腌制后的PC和REA60 2 组的离心损失较HF组分别增加4.64%和1.60%。HF、PC和REA60 3 组的水合能力较未腌制时分别增加1.01%、0.94%和1.12%,PC和REA60 2 组的水合能力较HF组分别增加5.22%和33.91%。未经腌制的PC和REA60 2 组蒸煮损失率和离心损失率显著高于HF组,PC组的内源蛋白酶活性较高,分解蛋白造成蛋白锁水能力下降,不能锁住预冷处理过程中吸收的水分,从而蒸煮损失率较高。REA60组的内源蛋白酶活性较低,蛋白分解能力弱,钝酶后肌原纤维蛋白变性,使得蛋白在蒸煮/离心过程中不能保留水分,因而REA60组的蒸煮损失较HF组显著增大。热处理和预冷处理后造成部分肉纤维破损,水分流出,PC和REA60 2 组的水合能力较差。腌制后,各组肉的保水性和水合能力提高。研究表明,盐溶液的离子水合作用会增强肉的保水能力,有效降低肉中水分的流失[26]。微波蒸汽热处理能够增强肉中水(不易流动水和游离水)的迁移率[22],迁移率高的水分子促进了盐的扩散,肉的离子强度增大,氢键结合水分子的位点增多,水合能力增大,肉的保水性提高[27]。由以上结果可知,钝酶后的鸡肉经腌制处理,蒸煮损失率和离心损失率显著减小,水合能力增大。
2.3 钝酶对鸡肉腌制后水分分布的影响
为了解盐作用下钝酶鸡肉的水分如何保持,进一步测定鸡肉水分分布,说明鸡肉持水性变化的原因。T21(0~10 ms)是与肉中极性基团(蛋白质等)紧密结合的水,即结合水,T22(10~100 ms)是主要存在于外膜、肌周和肌内膜组织之间的水,即不易流动水,占肌肉水分的绝大多数,T23(100~1 000 ms)是分散在细胞外或肉表面比例相对较低的水,即自由水[28]。T21、T22和T23的峰面积比例代表不同水分的相对含量,分别表示为P21、P22和P23。
表 3 黄羽肉鸡原料肉腌制后T2和P2的变化
Table 3 Changes in the T2 and P2 of yellow-feathered broilers raw meat after curing

食盐溶液质量浓度/(g/100 mL) 组别 T21/ms T22/ms T23/ms P21/% P22/% P23/%0 HF组 0.13±0.00Ca50.77±0.07Ca932.60±0.12Ba7.20±0.01Ba92.50±0.02Ab0.15±0.00Bb PC组 0.14±0.01Ba52.22±0.02Aa705.48±0.11Cb5.90±0.10Cb92.40±0.25Bb0.26±0.00Aa REA60组 0.18±0.02Aa53.22±0.02Ba1 232.80±0.10Aa7.55±0.00Aa92.37±0.31Cb0.08±0.12Cb 3 HF组 0.11±0.01Bb48.77±0.04Cb705.48±0.21Bb7.01±0.00Ab92.78±0.45Ba0.21±0.11Ba PC组 0.10±0.02Cb49.77±0.03Bb10 000.0±0.30Aa6.48±0.01Ba92.69±0.45Ca0.00±0.09Cb REA60组 0.12±0.03Ab46.77±0.01Bb533.67±0.40Cb3.70±0.02Cb95.54±0.16Aa0.76±0.01Aa
由图1及表3可知,与HF组相比,未经腌制的REA60和PC 2 组T21和T22变大,REA60组的T22较PC和HF组分别增大1.91%和4.82%,REA60组的P22显著小于HF组和PC组,PC组的自由水含量(P23)显著高于其他组 (P<0.05)。腌制后,各组的T21和T22显著减小,REA60组的T22较PC和HF组分别减小6.03%和4.10%,HF、REA60和PC 3 组的峰面积比例P22显著增加,较初始值分别增加0.28%、0.29%和3.17%(P<0.05)。未经腌制时,钝酶处理和预冷处理引起鸡肉结构变化,使结合水与蛋白质或与其他分子结合程度降低,持水性下降。REA60和PC 2 组的不易流动水流动性变强,表明微波蒸汽热处理显著提高了鸡肉不易流动水的流动性,这与2.2节的结论相同。未经腌制的REA60组在热处理后不易流动水(T22)含量下降,REA60组经热处理后蛋白变性收缩,不易流动水被挤出。PC组在预冷过程中吸收大量水分,提高了鸡肉的自由水含量[29]。腌制后各组的结合水结合得更加紧密,蛋白质水合作用加强,结合水和不易流动水迁移率降低[30]。经盐处理的鸡肉不易流动水含量增加可能是自由水转化形成[31]。NaCl电离产生的Cl-可以与肌肉组织蛋白中带正电的基团结合,以增加肌原纤维之间的排斥力,从而增加肌肉纤维之间的间隙,允许大量水流入,使P22增大[32]。微波蒸汽热处理后肉的不易流动水迁移率较高,有利于盐的扩散,肉的离子强度增大,氢键的水分子结合位点增多,水合能力增大,肉的保水性提高。所以,腌制后REA60组T22最小,不易流动水迁移率较低。有文献指出,决定肉保水性的主要是不易流动水(T22)[33]。所以,钝酶鸡肉腌制后结合水和不易流动水迁移率降低,保水性显著提高。
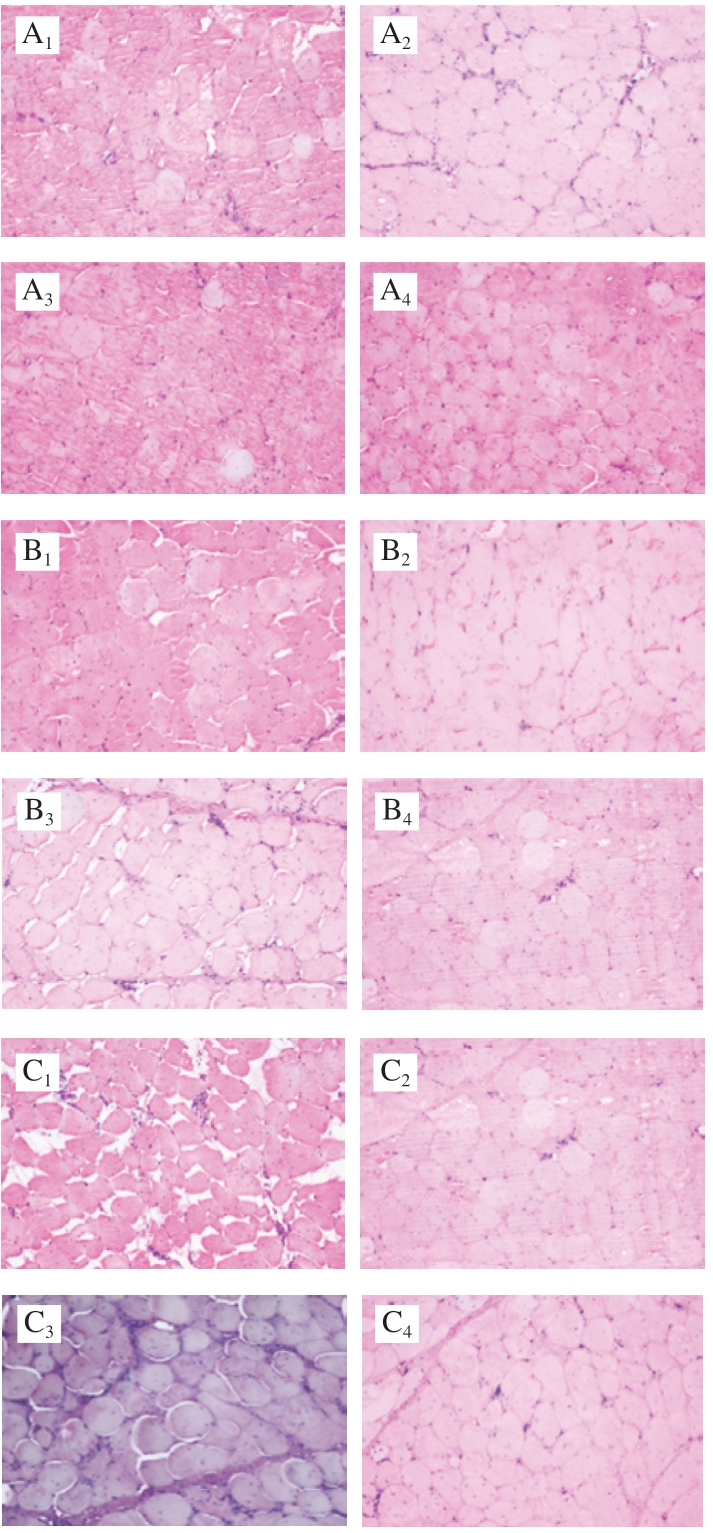
图 2 黄羽肉鸡原料肉腌制后组织结构横截面的变化
Fig. 2 Changes in cross sections of tissue structure of yellow-feathered broilers raw meat after curing
A. HF组;B. PC组;C. REA60组;下标1~4. 食盐 溶液质量浓度分别为0、3、6、9 g/100 mL。
表 4 黄羽肉鸡原料肉腌制后质构的变化
Table 4 Changes of texture of yellow-feathered broilers after pickling
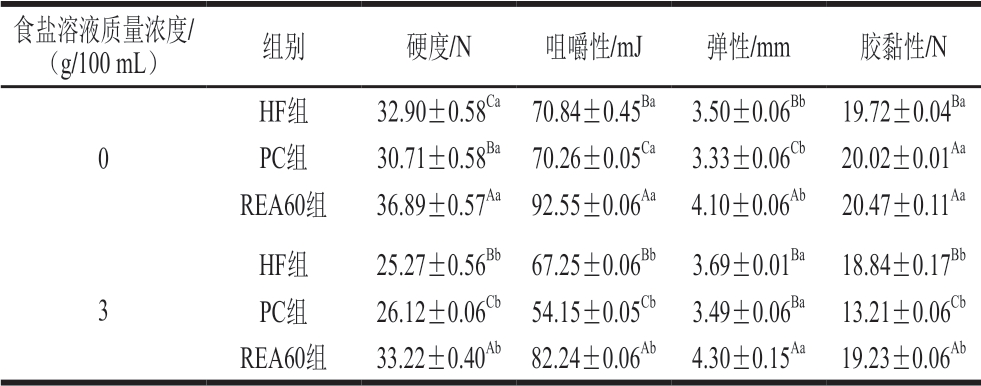
食盐溶液质量浓度/(g/100 mL) 组别 硬度/N 咀嚼性/mJ 弹性/mm 胶黏性/N 0 HF组 32.90±0.58Ca 70.84±0.45Ba 3.50±0.06Bb 19.72±0.04Ba PC组 30.71±0.58Ba 70.26±0.05Ca 3.33±0.06Cb 20.02±0.01Aa REA60组 36.89±0.57Aa 92.55±0.06Aa 4.10±0.06Ab 20.47±0.11Aa 3 HF组 25.27±0.56Bb 67.25±0.06Bb 3.69±0.01Ba 18.84±0.17Bb PC组 26.12±0.06Cb 54.15±0.05Cb 3.49±0.06Ba 13.21±0.06Cb REA60组 33.22±0.40Ab 82.24±0.06Ab 4.30±0.15Aa 19.23±0.06Ab
2.4 钝酶对鸡肉腌制后质构的影响
由表4可知,未经腌制的REA60组鸡肉的硬度、咀嚼性、弹性和胶黏性较HF组分别高12.13%、30.67%、17.14%和3.80%。腌制后,各组的硬度、咀嚼性和胶黏性显著下降,弹性显著上升。REA60组的硬度、咀嚼性、胶黏性和弹性显著高于其他组(P<0.05),HF、PC和REA60 3 组的硬度分别为初始值的76.81%、85.05%和90.05%。未经腌制的REA60组通过微波蒸汽热处理钝化了酶和微生物活性,减弱了蛋白分解软化。HF和PC 2 组受到酶和微生物作用,肌原纤维蛋白发生水解,硬度、咀嚼性和胶黏性下降。腌制后,鸡肉的离子强度提高,可能促进肌球蛋白溶出,蛋白降解程度增加[34],各组肉的硬度和咀嚼性下降。REA60组经热处理后肌球蛋白可能未发生解离而变性,因此肌球蛋白溶出量较低,降解程度较低,所以,腌制后REA60组的硬度和咀嚼性显著高于预冷鸡和热鲜鸡。
2.5 钝酶对鸡肉腌制后肌肉微观结构的影响
由图2可知,未经腌制的HF组肌肉组织呈紧密连接、光滑的网状结构,而且肌纤维束的缝隙均匀细小、结构完整,肌肉纤维基本充满了肌内膜网络。未经腌制的PC组肌纤维直径较HF组较大,PC组在宰后进行预冷过程中肌肉收缩,导致直径增大。REA60组的肌纤维内部出现明显的空隙,微波蒸汽热处理(REA60组)导致鸡肉肌纤维收缩,蛋白质发生变性。随着腌制液中食盐添加量的增大,各组的肌纤维直径变小,肌纤维密集。当食盐添加量为6 g/100 mL时,各组的肌纤维直径达到最小状态。Kim等[35]研究发现,用2.5 g/100 mL氯化钠溶液处理牛肉后发现肌肉的横截面肌纤维直径减小,嫩度上升。在食盐添加量为9 g/100 mL时,肌纤维直径开始变大。肌肉嫩度与肌纤维直径密切相关,肉的嫩度随着肌纤维直径增大而降低[36]。REA60组在食盐添加量0~9 g/100 mL的范围内其肌纤维直径都大于HF和PC组,推测其硬度显著大于其他组。综上可知,钝酶的鸡肉在腌制后肌纤维直径随着食盐添加量增加先减小后增大,且其肌纤维直径始终大于其他组,推测钝酶鸡肉腌制后的硬度和咀嚼性等质地优于热鲜鸡和预冷鸡。
3 结 论
采用电子舌测定咸味、鲜味,分析得出,钝酶后鸡肉(REA60组)的咸味显著高于PC组,腌制后REA60组IMP累积量多,保持鲜味能力较强;钝酶后鸡肉经腌制处理的蒸煮损失率和离心损失率显著减小,水合能力增大,进一步分析得出,钝酶鸡肉腌制后结合水和不易流动水迁移率较低,导致钝酶后肉的保水性较高;钝酶鸡肉腌制后的硬度和咀嚼性等显著高于预冷鸡和热鲜鸡,肌纤维直径随着食盐添加量的增大先减小后增大,且显著高于其他组。因此,宰后低温预加热能够显著改善黄羽肉鸡原料肉的腌制品质,同时本研究成果可为研究适合中式炖煮的黄羽肉鸡原料肉提供理论支撑。
[1] 陈兵. 我国首个屠宰型优质肉鸡新品种在江苏诞生[J]. 食品界, 2022(1): 141.
[2] 卞欢, 徐为民, 黄志明, 等. 江苏省黄羽肉鸡屠宰行业发展情况调研报告[J]. 中国农村科技, 2021(11): 60-63.
[3] 夏婷, 杨浩鹏, 何军. 后新冠肺炎疫情时期肉鸡产业发展思考[J]. 中国家禽, 2021, 43(4): 117-120. DOI:10.16372/j.issn.1004-6364.2021.04.021.
[4] 刘瑞. 一氧化氮在猪肉成熟过程中的作用机理研究[D]. 南京: 南京农业大学, 2018: 10-20. DOI:10.27244/d.cnki.gnjnu.2018.000380.
[5] WILHELM A E, MAGANHINI M B, HERNANDEZ-BLAZQUEZ F J, et al. Protease activity and the ultrastructure of broiler chicken PSE (pale, soft, exudative) meat[J]. Food Chemistry, 2010, 119(3): 1201-1204. DOI:10.1016/j.foodchem.2009.08.034.
[6] DESAI M A, JACKSON V, ZHAI W, et al. Proteome basis of pale, soft, and exudative-like (PSE-like) broiler breast (Pectoralis major) meat[J]. Poultly Science, 2016, 95(11): 2696-2706. DOI:10.3382/ps/pew213.
[7] LI Pengpeng, SUN Liangge, WANG Daoying, et al. Effects of combined ultrasound and low-temperature short-time heating pretreatment on proteases inactivation and textural quality of meat of yellow-feathered chickens[J]. Food Chemistry, 2021, 355: 129645. DOI:10.1016/j.foodchem.2021.129645.
[8] 贾友刚, 王连杰. 白羽肉鸡屠宰加工工艺研究进展[J]. 肉类工业, 2019(4): 36-42.
[9] 陈美玉. 基于水分迁移及肌原纤维蛋白特性研究真空低温加热对牛肉品质的影响[D]. 杭州: 浙江大学, 2021: 3-5. DOI:10.27461/d.cnki.gzjdx.2021.001488.
[10] 梁雯雯, 杨天, 郭建, 等. 升温方式对鲢鱼肌球蛋白结构和理化性质的影响[J]. 食品科学, 2021, 42(21): 24-31. DOI:10.7506/spkx1002-6630-20201012-086.
[11] LI Zhiyun, WANG Jianyi, ZHENG Baodong, et al. Impact of combined ultrasound-microwave treatment on structural and functional properties of golden threadfin bream (Nemipterus virgatus) myofibrillar proteins and hydrolysates[J]. Ultrasonics Sonochemistry, 2020, 65: 105063. DOI:10.1016/j.ultsonch.2020.105063.
[12] 吴永清, 吴国杰, 秦燕, 等. 微波在食品中的应用及发展[J]. 广州食品工业科技, 1999(4): 51-53. DOI:10.13982/j.mfst.1673-9078.1999.04.021.
[13] 白青云, 刘海影, 赵立, 等. 微波灭酶对牛蒡褐变及腌渍过程中品质的影响[J]. 食品与发酵科技, 2016, 52(6): 16-21. DOI:10.3969/j.issn.1674-506X.2016.06-004.
[14] SRIMAGAL A, MISHRA S, PRADHAN R C. Effects of ethyl oleate and microwave blanching on drying kinetics of bitter gourd[J]. Journal of Food Science and Technology-Mysore, 2017, 54(5): 1-7. DOI:10.1007/s13197-017-2518-7.
[15] LIU Peng, MUJUMDAR A S, ZHANG Min, et al. Comparison of three blanching treatments on the color and anthocyanin level of the microwave-assisted spouted bed drying of purple flesh sweet potato[J]. Drying Technology, 2015, 33(1): 66-71. DOI:10.1080/07373937.2014.936558.
[16] 秦静, 李元晓, 席思藤, 等. 微波预处理对紫花苜蓿鲜草中蛋白酶活力及其后期品质的影响[J]. 黑龙江畜牧兽医, 2021(5): 123-126. DOI:10.13881/j.cnki.hljxmsy.2020.04.0029.
[17] 徐文思, 杨祺福, 赵子龙, 等. 微波熟制对小龙虾营养与风味的影响[J]. 食品与机械, 2022, 38(2): 216-221; 227. DOI:10.13652/j.issn.1003-5788.2022.02.036.
[18] 韩忠, 王君翠, 唐相伟, 等. 蒸汽微波加热对鱼肉品质的影响[J].中国农业科技导报, 2015(5): 157-161. DOI:10.13304/j.nykjdb.2015.516.
[19] 李明奇, 贺稚非, 李少博, 等. 氯化钙-无花果蛋白酶-猕猴桃蛋白酶复合嫩化剂体系改善兔肉嫩度和保水性的工艺优化[J]. 食品与发酵工业, 2019, 45(18): 120-129. DOI:10.13995/j.cnki.11-1802/ts.021040.
[20] 高子武, 吴丹璇, 王恒鹏, 等. 腌制方式对牛肉肌原纤维蛋白特性及水分分布的影响[J]. 食品与发酵工业, 2021, 47(24): 179-186. DOI:10.13995/j.cnki.11-1802/ts.027285.
[21] KUO Wanyuan. Effect of food matrix on saltiness perceptionimplications for sodium reduction[J]. Comprehensive Review in Food Science and Food Safety, 2014, 13(5): 906-923. DOI:10.1111/1541-4337.12094.
[22] MATHLOUTHI M, SEUVRE A M. Solution properties and the sweet taste of small carbohydrates[J]. Journal of the Chemical Society, Faraday Transactions 1, 1988, 84(8): 2641-2650. DOI:10.1039/f19888402641.
[23] 金睿, 曹满湖, 黄泰来, 等. 鸡肉肌苷酸含量影响因素研究进展[J]. 中国家禽, 2021, 43(10): 87-93. DOI:10.16372/j.issn.1004-6364.2021.10.013.
[24] 谷文静, 金银哲, 金英善, 等. 水产品加工贮藏中ATP及其关联产物的变化概述[J]. 食品工业, 2020, 41(12): 252-257. DOI:10.11841/j.issn.1007-4333.2015.06.32.
[25] 汪之颖, 陈静茹, 陈可欣, 等. 低盐腌制对生鲜草鱼片冷藏过程中品质变化的影响[J]. 中国农业大学学报, 2015, 20(6): 249-255. DOI:10.11841/j.issn.1007-4333.2015.06.32.
[26] 陶硕, 马仁超, 郭秀霞, 等. 氯化钠和三聚磷酸钠添加量对蒸煮火腿品质的影响[J]. 肉类研究, 2019, 33(12): 18-24. DOI:10.7506/rlyj1001-8123-20190916-218.
[27] 瞿丞, 贺稚非, 王兆明, 等. 不同食盐添加量腌制对鸡肉脂质氧化,蛋白质氧化及食用品质的影响[J]. 食品科学, 2020, 41(16): 77-85. DOI:10.7506/spkx1002-6630-20190504-012.
[28] WANG Xuejiao, WANG Xingwei, FENG Tingting, et al. Saltiness perception enhancement of fish meat treated by microwave: the significance of conformational characteristics, water and sodium mobility[J]. Food Chemistry, 2021, 347(6): 129033. DOI:10.1016/j.foodchem.2021.129033.
[29] 吴亮亮, 罗瑞明, 孔丰, 等. 食盐添加量对滩羊肉蒸煮损失、嫩度及水分分布的影响[J]. 食品工业科技, 2016, 37(2): 322-325; 366. DOI:10.13386/j.issn1002-0306.2016.02.056.
[30] PERISIC N, AFSETH N K, OFSTAD R, et al. Characterising protein, salt and water interactions with combined vibrational spectroscopic techniques[J]. Food Chemistry, 2013, 138(1): 679-686. DOI:10.1016/j.foodchem.2012.10.117.
[31] MCDONNELL C K, ALLEN P, DUGGAN E, et al. The effect of salt and fibre direction on water dynamics, distribution and mobility in pork muscle: a low field NMR study[J]. Meat Science, 2013, 95(1): 51-58. DOI:10.1016/j.meatsci.2013.04.012.
[32] SHAO Junhua, DENG Yamin, JIA Na, et al. Low-field NMR determination of water distribution in meat batters with NaCl and polyphosphate addition[J]. Food Chemistry, 2016, 200: 308-314. DOI:10.1016/j.foodchem.2016.01.013
[33] 孔保华, 韩建春. 肉品科学与技术[M]. 北京: 中国轻工业出版社, 2011.
[34] ZHANG Quanbin, LI Ning, ZHOU Gefei, et al. In vivo antioxidant activity ofpolysaccharide fraction from Porphyra haitanesis (Rhodephyta) in aging mice[J]. Pharmacological Research, 2003, 48(2): 151-155. DOI:10.1016/S1043-6618(03)00103-8.
[35] KIM H W, CHOI Y S, CHOI J H, et al. Tenderization effect of soy sauce on beef M. biceps femoris[J]. Food Chemistry, 2013, 139(1/4): 597-603. DOI:10.1016/j.foodchem.2013.01.050.
[36] 李继昊, 黄明远, 王虎虎, 等. 热鲜和冷鲜处理对白切鸡食用品质,微观结构以及体外消化率的影响[J]. 食品工业科技, 2018, 39(21): 15-21. DOI:10.13386/j.issn1002-0306.2018.21.004.