腌腊制品在我国有着上千年的历史,深受人们的喜爱。生肉经过腌制和成熟后,肉色腊红,耐贮存,有着独特的腌腊风味[1-2]。传统腌腊肉制品开放式的制作模式、漫长的制作周期以及适宜微生物生长的条件,是满足微生物繁殖、代谢的绝佳天然培养基[3-4]。加之千百年的工艺传承、特定的区域环境,一定程度上是对相关微生物的定向驯化与选择,或许也正是因此才形成了我国多种地区性腌腊肉制品。
刀板香是安徽黄山地区特有的一种腌腊肉制品,由当地土猪肉制成,肥而不腻,具有极强的地域特色,这与黄山地区独特的气候环境有着密不可分的关系,但难以实现异地生产。黄山属亚热带季风湿润气候,独特的水土环境和气候条件使得当地形成了独特稳定、成分复杂且难以复制的微生物群落环境,这也可能是刀板香独特风味形成的主要因素。刀板香原料采用徽州地区土杂猪厚度均匀的五花肉,在适当的环境条件下(温度、湿度),经预处理、腌制、晾晒(轻发酵)等核心工艺加工而成,具有典型特征品质,是体现浓郁地方特色的中式传统肉制品。微生物可通过自身分泌的丰富酶系参与肉制品发酵中的一系列过程,如脂肪氧化[5-6]、蛋白质降解[7-8]、碳水化合物水解[9]等,生成醛、酸、酮、酯和短肽等物质,而这些物质存在的量及相互间的比例,对区域腌腊肉制品独特风味和色泽的形成影响显著。
微生物在腌腊肉制品风味形成过程中起重要作用。黄艾祥[10]研究云南干腌火腿品质特征形成规律及微生物对其品质特征形成的作用,结果发现,微生物将火腿中蛋白质、脂肪降解生成一系列的游离氨基酸和脂肪酸。此外,Lizaso等[11]研究西班牙干腌香肠成熟过程中脂质和蛋白质的变化,发现高亚硝酸细菌和微球菌引起蛋白质的水解,导致香肠中游离氨基酸含量增加,对最终的感官品质形成具有重要作用。Zhao Dandan等[12]研究不同发酵阶段干腌鱼风味与微生物之间的关系,发现葡萄球菌是干腌鱼发酵过程的优势菌属,参与发酵过程风味的形成。Prado等[13]研究西班牙传统发酵香肠中微生物的作用,发现主要微生物为植物乳杆菌,该菌有效抑制了腐败微生物的生长并促进了风味的形成。可见,不同的腌腊肉制品中有不同的优势微生物。从中筛选出 产生独特风味、优良品质的土著菌种并研发发酵剂成为新的趋势。
目前,较多研究直接将已知的发酵剂应用到肉制品中,据此分析不同发酵剂对特定肉制品品质的影响,如Ravyts[14]、Stahnke[15]、Hu Yingying[16]等将发酵剂直接应用到干腌香肠中。从传统的肉制品中分离,并通过一系列筛选得到具有良好发酵性能的菌株,有助于新发酵剂的开发。不同发酵肉制品具有不同的特征,其中关键发酵微生物的筛选标准并不一致,因此需要对传统肉制品建立符合其特征的筛选体系。刀板香作为一种传统的徽派腌腊肉制品,仍然依赖作坊式生产,工艺相对落后、品质不稳定,已经不适应现代社会的需求;其中优势微生物的分离鉴定及相应发酵剂研制的需求迫切。本研究组前期[17]采用高通量测序技术对不同加工阶段刀板香中的微生物进行测序,发现刀板香的主要优势菌属为葡萄球菌和嗜冷杆菌,这与刀板香生产环境为低温环境相吻合。鉴于此,本研究在低温环境下对刀板香的优势菌属进行选择性分离培养,采用形态学观察、生理生化鉴定和分子生物学的方法对分离纯化的微生物进行菌株鉴定,以获得在刀板香风味形成过程中发挥重要作用的菌株,进而建立刀板香发酵剂的筛选体系,对于优良微生物种质资源的挖掘以及地方传统特色腌腊肉制品的规模化、标准化生产均有重要意义。
1 材料与方法
1.1 材料与试剂
刀板香冬季成品取自安徽黄山全江生态农业科技有限公司。
MSA培养基、LB培养基、营养琼脂、革兰氏染色液、产H2S培养基、硝酸盐还原培养基、氨基酸脱羧酶培养基、生化鉴定管 广东环凯微生物科技有限公司。
细菌基因组DNA快速抽提试剂盒、Taq酶、引物、Marker、琼脂糖 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
ME204E-02电子分析天平 瑞士梅特勒-托利多仪器有限公司;Synergy H1酶标仪 美国BioTek仪器 公司;BSD-150振荡培养箱 上海博迅医疗生物仪器股份有限公司;AC2-4S1超净工作台 苏州安泰空气技术有限公司。
1.3 方法
1.3.1 样品制备
原料在低温下使用粗盐腌制,辅以少量的白酒和香辛料,腌制时间为30 d。腌制结束后经过冷水洗盐,然后转移到室外晾晒30 d左右,晾晒后进行真空包装即得到成品。
1.3.2 菌株的分离和纯化
依据GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[18]并进行部分修改。在无菌条件下,称取10 g刀板香样品于无菌均质袋中,再加入90 mL生理盐水,利用拍打式均质机将样品拍打1~2 min,制成1∶10的样品匀液,然后将其进行10 倍梯度稀释至质量浓度分别为10-3、10-4、10-5 g/mL,分别涂布于MSA培养基,放置于10 ℃培养48 h,涂布于LB培养基,放置于4 ℃培养7 d左右,挑取生长状况良好的单菌落,划线分离纯化2~3 次。
1.3.3 形态学观察
将分离纯化得到的菌株分别在MSA培养基和LB培养基进行划线,37 ℃培养24 h后观察菌落生长情况,并通过革兰氏染色和显微镜观察其菌落状态,选取革兰氏阳性菌株。
1.3.4 菌株筛选实验
产黏性实验:直接挑取平板上的单菌落观察,筛选出不产黏液的菌株。
发酵葡萄糖产气实验[19]:将平板上的菌株接种于葡萄糖发酵管(内置杜氏小管)中,放置于37 ℃培养18~24 h,若内置倒管内有气泡产生,则菌株产气。
产过氧化氢实验[20]:用接种环挑取平板上的单菌落于无菌玻片上,滴加1 滴体积分数3%的过氧化氢试剂,观察是否有气泡产生。
产H2S实验[19]:用接种针挑取平板上的单菌落穿刺接种于H2S生化鉴定管中,于37 ℃培养18~24 h,若显黑色则呈阳性,否则为阴性,筛选出不产H2S的菌株。
产氨实验[19]:将待测菌株接种于产氨培养基中,以不接种作为空白对照,37 ℃培养24 h,在菌液中加入3~5 滴奈氏试剂,有黄色或棕红色沉淀出现者为阳性,无沉淀为阴性,筛选出不产氨的菌株。
硝酸盐还原酶实验[21]:挑取平板上的单菌落接种于硝酸盐还原酶的生化鉴定管中,培养18~24 h后,加入硝酸盐还原试剂甲、乙液各2 滴,混匀,若显深红色则为阳性,筛选出硝酸盐还原酶阳性的菌株。
氨基酸脱羧酶实验[20]:将待测菌株接种于氨基酸脱羧酶生化鉴定管的实验管和对照管中,并加入灭菌液体石蜡5~8 滴覆盖培养基表面;培养18~24 h,若实验管为黄绿色,对照管变黄,则呈阴性,筛选氨基酸脱羧酶阴性的菌株。
蛋白酶检测实验[22]:将待测菌株以点种法接种于酪蛋白检测培养基上,37 ℃培养48 h后,在菌落周围滴加10 g/100 mL三氯乙酸溶液,若菌落周围有透明圈出现,则为阳性。
脂肪酶检测实验[22]:将待测菌株以点种法接种于脂肪酶检测培养基上,37 ℃培养48 h后,若菌落颜色变红,则为阳性。
1.3.5 分子生物学鉴定
挑取平板上的单菌落接种于营养琼脂培养基中,37 ℃培养过夜,取1.5 mL菌液12 000 r/min离心2 min后,弃去上清,然后按照细菌基因组DNA快速抽提试剂盒说明书操作,所得的基因组利用0.02 g/mL琼脂糖凝胶电泳查看提取结果。
16S rDNA扩增序列所用引物,正向引物为27F:5’-AGAGCCTGGCTCAGTTTGAT-3’;反向引物为1492R:5’-GGTTACCTTGTTACGACTT-3’。
聚合酶链式反应(polymerase chain reaction,PCR)体系(50 μL):上、下游引物各1 μL、模板DNA 1 μL、2×Taq Master Mix 25 μL、dd H2O 21 μL[23]。
将电泳检测后的PCR产物送至生工生物工程(上海)股份有限公司进行测序,获得16S rRNA基因序列。测序结果在美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的比对搜索工具(basic local alignment search tool,BLAST)分析比对。
1.3.6 菌株生长曲线和耐受特性测定
菌株生长曲线测定:将筛选得到的菌株接种于营养肉汤培养基中,37 ℃培养,每隔2 h测1 次600 nm波长处光密度(OD600 nm)。
菌株对温度适应能力:将筛选得到的菌株接种于营养肉汤培养基中,分别在4、10、15、25、37、45 ℃培养24 h后,测其OD600 nm。
菌株耐盐能力测定:将筛选得到的菌株接种于盐(NaCl)质量浓度分别为0、2、4、6、8 g/100 mL的营养肉汤培养基中,培养24 h后,测其OD600 nm。
菌株耐乙醇能力测定:将筛选得到的菌株接种于乙醇体积分数分别为0%、3%、6%、9%、12%的营养肉汤培养基中,培养24 h后,测其OD600 nm。
1.4 数据处理
所有数据测定均重复3 次,使用Excel 2019软件(Microsoft,USA)进行数据统计和分析,使用Origin 2020软件(OriginLab,USA)进行绘图。使用MEGA 7软件(version 7.0,Mega Limited,Auckland,New Zealand)对分离、纯化优势菌株的测序结果构建进化树。
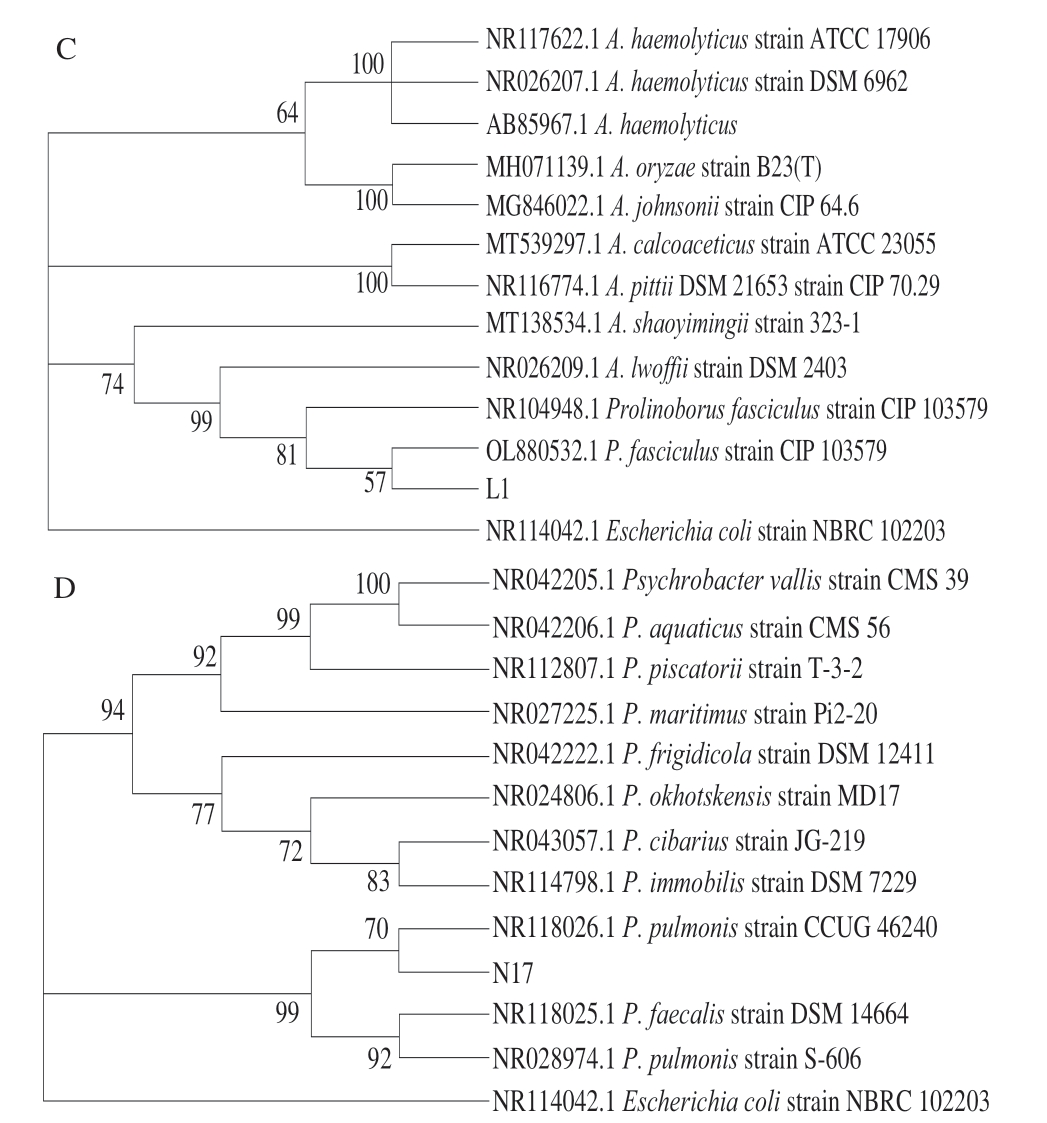
图 1 以16S rDNA基因序列为分子标记的4 株菌株系统发育树
Fig. 1 Phylogentic trees for four isolates based on their 16S rDNA sequences
A~D分别为菌株A3、A4、L1、N17的系统发育树。
2 结果与分析
2.1 细菌的菌落形态和镜检结果
通过对刀板香中葡萄球菌和嗜冷菌的选择性分离培养,MSA培养基得到35 株菌株,LB培养基得到40 株菌株。MSA培养基形成圆形凸起、边缘整齐、表面光滑、湿润、不透明的菌落,LB培养基培养7 d后形成浅黄色、圆形、边缘整齐、不透明的菌落。通过革兰氏染色和镜检,共筛选到27 株革兰氏阳性葡萄球菌和32 株革兰氏阴性嗜冷菌。
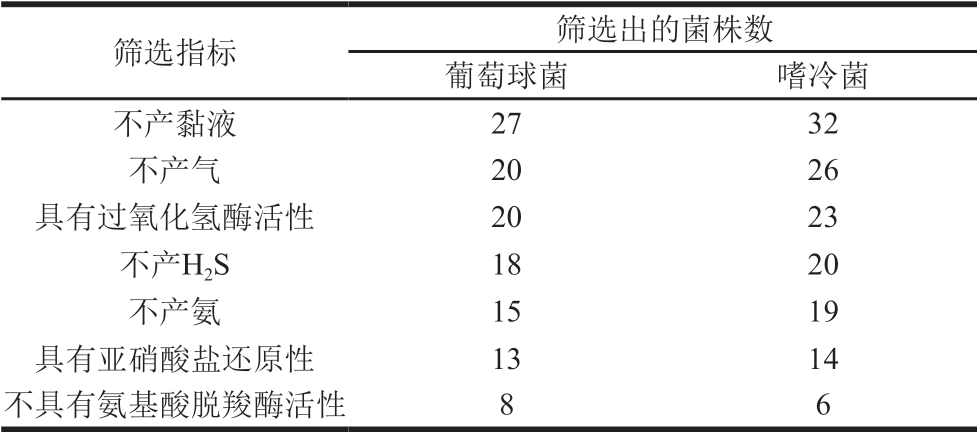
表 1 刀板香优势菌株筛选结果
Table 1 Results of screening of dominant strains in DBX
2.2 菌株筛选结果
利用发酵剂的主要目的是缩短加工周期,改善肉制品的质地、风味和色泽,延长食品的货架期[24]。因此对于发酵剂的筛选主要有以下标准:不产黏液、发酵葡萄糖不产气、过氧化氢酶阳性、不产H2S、不产氨、具有较高的亚硝酸盐还原酶活性和不具有氨基酸脱羧酶活性[25]。
对于革兰氏染色和镜检后筛选到的菌株进一步筛选,由表1可知,27 株葡萄球菌和32 株嗜冷菌不产黏液,20 株葡萄球菌和26 株嗜冷菌不产气,18 株葡萄球菌和20 株嗜冷菌不产H2S,15 株葡萄球菌和19 株嗜冷菌不产氨,13 株葡萄球菌和14 株嗜冷菌具有亚硝酸盐还原酶活性,8 株葡萄球菌和6 株嗜冷菌不具有氨基酸脱羧酶活性。
将这些初步筛选到的菌株作进一步脂肪酶和蛋白酶活性检测实验,发现共有5 株葡萄球菌和6 株嗜冷菌具有较强的蛋白酶和脂肪酶活性。
2.3 分子生物学鉴定结果
通过筛选得到5 株葡萄球菌和6 株嗜冷菌,将葡萄球菌分别命名为A3、A4、A7、A10、A11,嗜冷菌分别命名为L1、N1、L17、N3、N17、T7。将这些菌株的扩增序列测序结果在NCBI数据库中进行比对,选取同源性≥99%的菌株序列,利用Mega 7.0软件构建系统发育树[26]。发现这几株菌中有3 株菌与马胃葡萄球菌(Staphylococcus equorum)序列相似度达到99%,2 株与木糖葡萄球菌(Staphylococcus xylosus)序列相似度达到99%,1 株与小束噬脯氨酸菌(Prolinoborus sp.)序列相似度达到99%,1 株与沙雷氏菌(Serratia sp.)序列相似度达到99%,4 株与嗜冷杆菌(Psychrobacter faecalis)序列相似度达到99%。由于发酵剂的选择需要具有蛋白酶和脂肪酶活性,葡萄球菌具有较好的脂肪酶和蛋白酶活性,小束噬脯氨酸菌具有脂肪酶活性,而嗜冷杆菌则具有耐受低温特性,因此选取1 株马胃葡萄球菌A3、1 株木糖葡萄球菌A4、1 株小束噬脯氨酸菌L1、1 株嗜冷杆菌N17制作系统发育树。
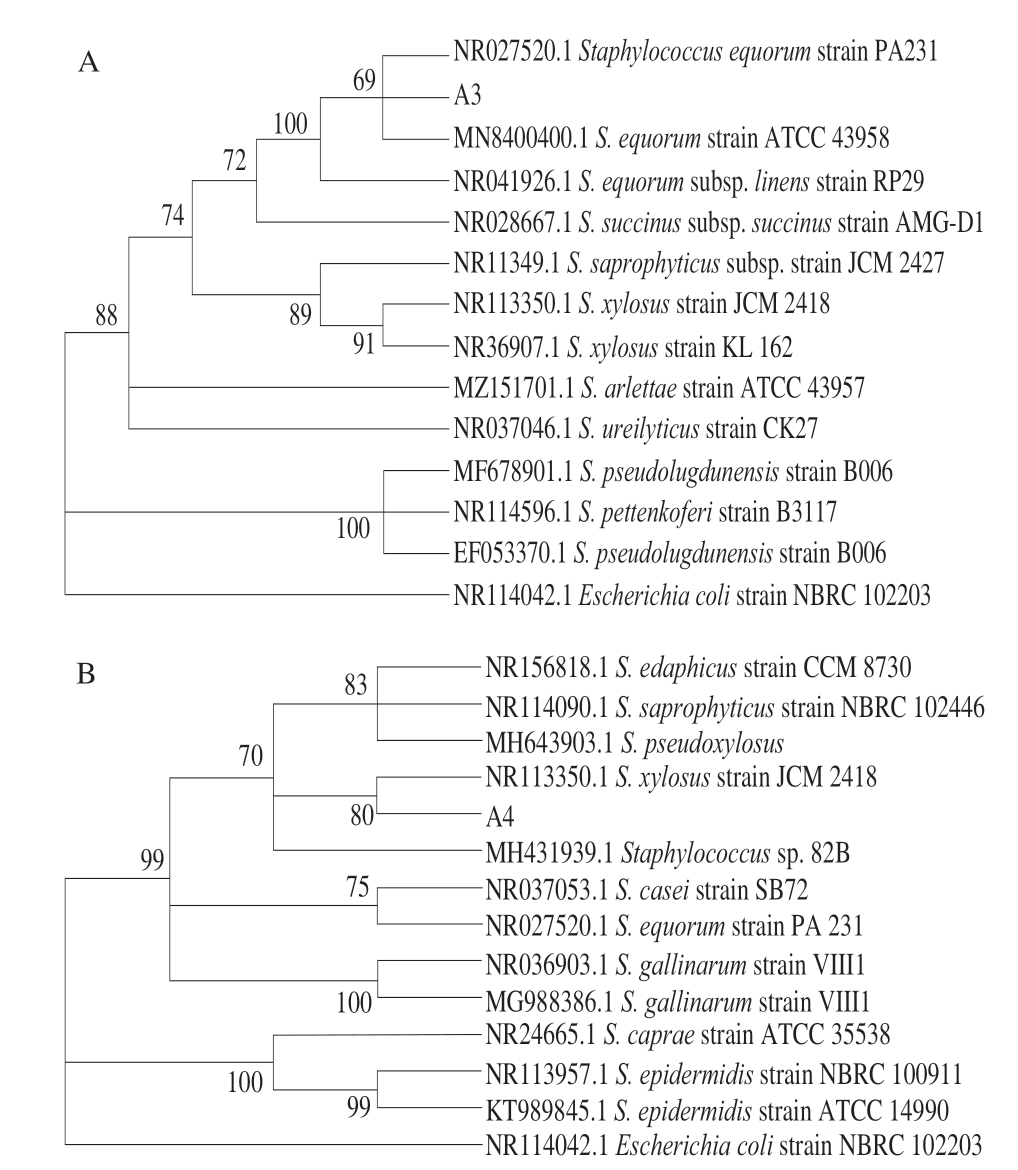
由图1可知,菌株A3与Staphylococcus equorum strain PA 231和Staphylococcus equorum strain ATCC 43958在同一分支上,且通过Bootstrap的验证具有较高的置信度,因此可以将菌株A3初步确定为马胃葡萄球菌。菌株A4与Staphylococcus xylosus strain JCM 2418在同一分支上,且通过Bootstrap的验证具有较高的置信度,因此可以将菌株A4初步确定为木糖葡萄球菌。菌株L1与Prolinoborus fasciculus strain CIP 103579在同一分支上,且通过Bootstrap的验证具有较高的置信度,因此可以将菌株L1初步确定为小束噬脯氨酸菌。菌株N17与Psychrobacter pulmonis train CCUG 46240在同一分支上,且通过Bootstrap的验证具有较高的置信度,因此可以将菌株N17初步确定为嗜冷杆菌。
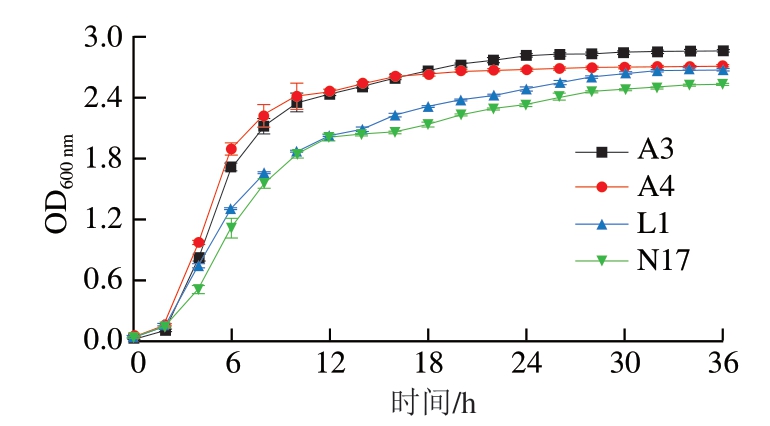
图 2 菌株A3、A4、L1和N17的生长曲线
Fig. 2 Growth curves of strains A3, A4, L1 and N17
大多数肉制品中分离的微生物主要为乳酸菌、葡萄球菌、酵母菌和霉菌等菌株,这些微生物可以分解蛋白质,是发酵肉制品风味物质的主要来源[27-28],也是筛选发酵剂的主要来源。本实验从刀板香分离得到的马胃葡萄球菌和木糖葡萄球菌,都是肉制品中常见的发酵微生物。Irlinger等[29]从法国干酪中分离出马胃葡萄球菌,发现它有助于发酵食品香气的形成。Hu Meizhong等[30]从腊肉中筛选分离得到1 株木糖葡萄球菌(Staphylococcus xylosus P2),将其接种到肉制品中,发现是肉制品良好的发酵剂。Xiao Yaqing等[31]将木糖葡萄球菌接种到中国传统干腌肉制品中,发现接种后肉制品的游离氨基酸和游离脂肪酸含量均增加。张诗意[32]、陈学云[33]等分别从威宁火腿和盐干带鱼中分离得到木糖葡萄球菌和马胃葡萄球菌。目前,对于小束噬脯氨酸菌和嗜冷杆菌的研究较少,小束噬脯氨酸菌可能参与肉制品脂肪氧化过程,嗜冷杆菌可以很好地适应低温环境,还需要对这2 株菌株作进一步研究。
2.4 菌株生长情况和生长适应性测定结果
通过分子生物学共鉴定出11 株菌株,选取其中1 株马胃葡萄球菌A3、1 株木糖葡萄球菌A4、1 株小束噬脯氨酸菌L1和1 株嗜冷杆菌N17,分别进行生长情况和耐受实验测定。
2.4.1 菌株的生长情况
发酵剂中的功能菌在肉制品生产过程中良好生长是发酵剂的一项重要指标。由图2可知:在0~2 h内,菌株处于迟缓期,OD600 nm变化不大;培养2 h后,菌株A3、A4和L1进入指数期,菌株N17在培养4 h后进入指数期,OD600 nm显著上升,这说明菌株A3、A4和L1的调整期较短,能够快速繁殖,此时菌株的生长旺盛,活力最强;菌株A3在培养24 h后进入稳定期,菌株A4在培养16 h后进入稳定期,菌株L1和N17在培养30 h后进入稳定期,菌株L1处于指数期时间最长,说明在发酵过程中可以长时间保持活力最强的状态,有良好的发酵能力。到达稳定期后,菌株A3、A4、L1和N17的OD600 nm分别为2.4、2.5、2.6和2.9,活菌数都可以达到109 CFU/mL。
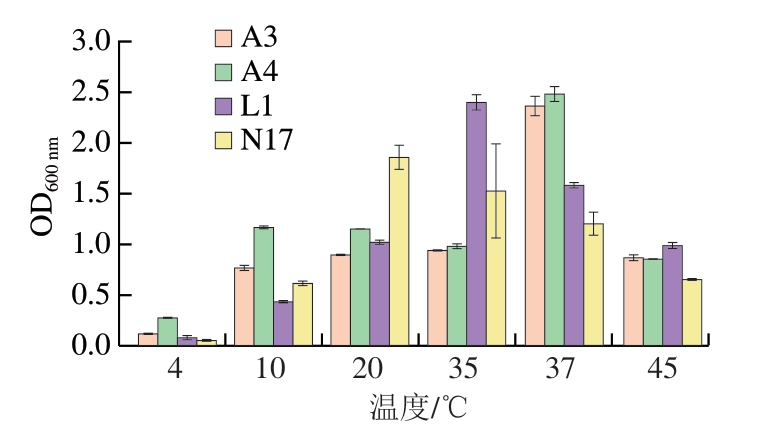
图 3 菌株A3、A4、L1和N17在不同温度条件下的生长能力
Fig. 3 Growth ability of strains A3, A4, L1 and N17 at different temperatures
2.4.2 菌株适应温度的能力
温度在发酵肉制品的生产过程起着至关重要的作用,一般情况下,发酵肉制品的腌制温度为4 ℃,发酵温度为20~25 ℃,因此对温度的适应能力也是发酵剂的一项重要指标[34]。
由图3可知:菌株A3和A4在4~37 ℃温度条件下,随着温度的升高生长能力不断增强;菌株L1在4~25 ℃温度条件下,随着温度的升高生长能力不断增强;菌株N17在4~20 ℃温度条件下,随着温度的升高生长能力不断增强。菌株A3和A4在37 ℃培养,生长能力较其他温度显著提高,且其他温度下生长能力较低,说明这2 株菌株的温度适应能力较差。菌株L1和N17的最适生长温度分别为25 ℃和20 ℃,且在20~37 ℃菌株的生长能力较好,说明这2 株菌株的温度适应能力较好,因此对于较低温环境生产的发酵肉制品有一定发酵作用。低温环境可以抑制大多数腐败菌的生长,可以有效延长产品的货架期,这2 株菌对于开发低温生产发酵肉制品有一定的潜力。4 株菌株在4、10、45 ℃下生长能力都较差,说明4 株菌株在较低温和高温状态下生长能力都较差。但是肉制品的发酵温度一般在25 ℃左右,所以4 株菌株都能适应肉制品的发酵温度。
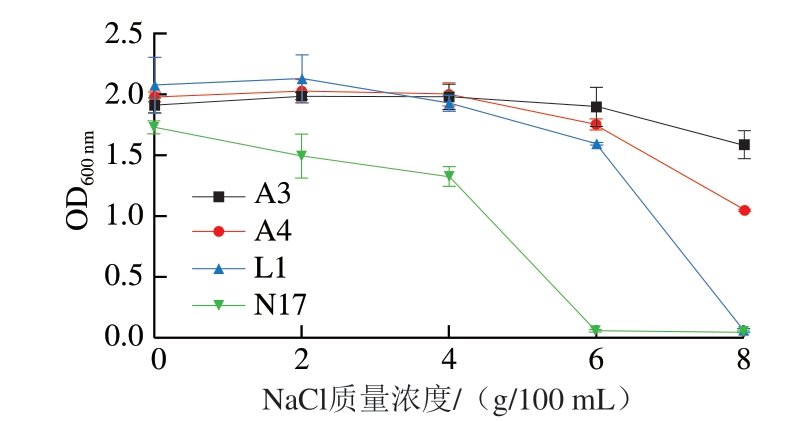
图 4 菌株A3、A4、L1和N17的耐盐能力
Fig. 4 Salt tolerance of strains A3, A4, L1 and N17
2.4.3 菌株的耐盐能力
耐盐能力是选择发酵肉制品发酵剂的另一项重要指标,一般发酵肉制品的盐含量为6.0%~9.0%[35-36], 这对于发酵肉制品的风味形成和安全性有重要的影响[37-38]。由图4可知,菌株A3和A4在NaCl质量浓度为0~6 g/100 mL时,其生长能力较强,OD600 nm变化不明显,在NaCl质量浓度达到8 g/100 mL时,菌株的生长能力受到一定程度的抑制,OD600 nm稍有下降,这说明菌株A3和A4有着较好的耐盐能力,适合作为肉制品发酵剂。菌株L1和N17在NaCl质量浓度为0~4 g/100 mL时,其生长能力较强,而在NaCl质量浓度达到6 g/100 mL以上时,菌株的生长能力受到较大程度的抑制,且在NaCl质量浓度为8 g/100 mL时,菌株基本不生长,说明菌株L1和N17对盐的耐受性较差,尽管发酵肉制品中盐的质量分数一般为6.0%~9.0%,但由于目前发酵肉制品的生产都向低盐的方向发展,加上发酵剂自身的抑菌作用,对于盐的添加量可以适当降低,所以小束噬脯氨酸菌和嗜冷杆菌具有作为肉制品发酵剂的潜力。
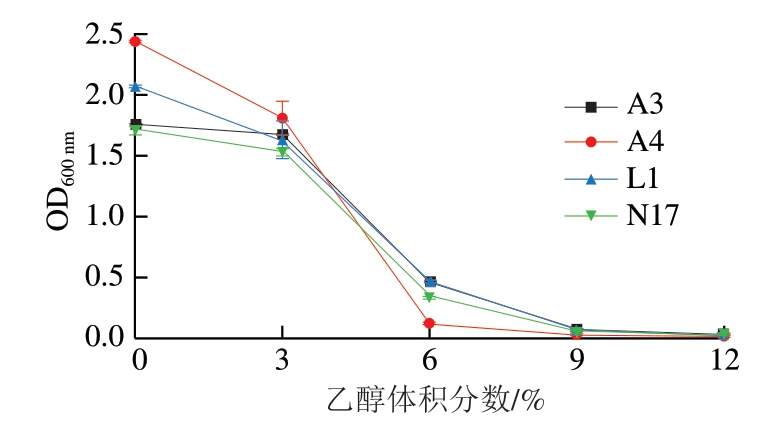
图 5 菌株A3、A4、L1和N17的耐乙醇能力
Fig. 5 Ethanol tolerance of strain A3, A4, L1 and N17
2.4.4 菌株的耐乙醇能力
在刀板香腌制过程中会添加少量的白酒用于杀菌去腥,因此菌株对乙醇的耐受能力也是筛选发酵剂的重要指标。由图5可知,在乙醇体积分数为0%~3%时,4 株菌株的生长能力较强,OD600 nm变化不明显,而在乙醇体积分数达到6%时,菌株的生长能力有较大程度的下降,且在乙醇体积分数达到9%时,菌株的生长能力完全受到抑制,基本不生长。这说明4 株菌株对于乙醇的耐受程度较低,但由于发酵肉制品中添加的白酒含量较少,且在加工过程中有大部分挥发,所以耐乙醇能力对于菌株作为发酵剂影响较小。
3 结 论
本研究对刀板香的优势微生物进行分离纯化,并通过生理生化实验及分子生物学鉴定筛选得到4 株具有脂肪酶和蛋白酶活性、可作为发酵剂的菌株,包括2 株葡萄球菌A3和A4、1 株小束噬脯氨酸菌L1和1 株嗜冷杆菌N17。对4 株菌株作进一步的生物学特性和发酵特性分析,结果表明:菌株A3和A4分别在培养24、16 h进入稳定期,菌株L1和N17在培养30 h进入稳定期,菌株A3和A4生长较迅速,菌株L1在生长过程中可以长时间保持活力最强状态,有较好的发酵潜力;菌株A3和A4对于温度的适应性较差,而菌株L1和N17对于温度的适应性较好,对于低温发酵肉制品的开发有着一定的潜力;菌株A3和A4有着较好的食盐耐受能力,而L1和N17的耐盐能力则较差;4 株菌株对于乙醇的耐受能力均较差。菌株A3和A4可作为良好的发酵剂,L1和N17有作为低温发酵剂的潜力。对刀板香的优势微生物进行分离纯化并对其发酵潜能进行研究,对于后续刀板香的工艺改善和标准化生产有很好的借鉴作用。
[1] GUO Xin, HUANG Feng, ZHANG Hong, et al. Classification of traditional Chinese pork bacon based on physicochemical properties and chemometric techniques[J]. Meat Science, 2016, 117: 182-186. DOI:10.1016/j.meatsci.2016.02.008.
[2] 粟桂蓉, 彭钰媛, 周璐璐, 等. 传统土家腊肉加工过程中风味物质研究[J]. 食品科技, 2017, 42(3): 118-123. DOI:10.13684/j.cnki.spkj.2017.03.026.
[3] 周光宏, 赵改名, 彭增起. 我国传统腌腊肉制品存在的问题及对策[J]. 肉类研究, 2003, 17(1): 3-7.
[4] ASHAOLU T J, KHALIFA I, MESAK M A, et al. A comprehensive review of the role of microorganisms on texture change, flavor and biogenic amines formation in fermented meat with their action mechanisms and safety[J]. Critical Review Food Science and Nutrition, 2021: 1-18. DOI:10.1080/10408398.2021.1929059.
[5] BRUNA J M, HIERRO E M, DE LA HOZ L, et al. Changes in selected biochemical and sensory parameters as affected by the superficial inoculation of Penicillium camemberti on dry fermented sausages[J]. International Journal of Food Microbiology, 2003, 85(2): 111-125. DOI:10.1016/s0168-1605(02)00505-6.
[6] 姬晓颖, 马国源, 陈耀祥, 等. 腌制过程中亚硝酸钠对羊肉脂肪酸组成以及脂质氧化的影响[J]. 甘肃农业大学学报, 2020, 55(5): 195-202. DOI:10.13432/j.cnki.jgsau.2020.05.023.
[7] FLORES M, TOLDRÁ F. Microbial enzymatic activities for improved fermented meats[J]. Trends in Food Science and Technology, 2011, 22(2/3): 81-90. DOI:10.1016/j.tifs.2010.09.007.
[8] DE ALMEIDA M A, SALDANA E, DA SILVA PINTO J S, et al.A peptidomic approach of meat protein degradation in a low-sodium fermented sausage model using autochthonous starter cultures[J]. Food Research International, 2018, 109: 368-379. DOI:10.1016/j.foodres.2018.04.042.
[9] NIE Xiaohua, LIN Shengli, ZHANG Qilin. Proteolytic characterisation in grass carp sausage inoculated with Lactobacillus plantarum and Pediococcus pentosaceus[J]. Food Chemisty, 2014, 145: 840-844. DOI:10.1016/j.foodchem.2013.08.096.
[10] 黄艾祥. 云南干腌火腿品质特征形成与微生物作用研究[D]. 重庆: 西南大学, 2006: 95-115.
[11] LIZASO G, CHASCO J, BERIAIN M J. Microbiological and biochemical changes during ripening of salchichón, a Spanish dry cured sausage[J]. Food Microbiology, 1999, 16: 219-228. DOI:10.1006/fmic.1998.0238.
[12] ZHAO Dandan, HU Jun, CHEN Wenxuan. Analysis of the relationship between microorganisms and flavour development in dry-cured grass carp by high-throughput sequencing, volatile flavour analysis and metabolomics[J]. Food Chemistry, 2022, 368: 130889. DOI:10.1016/j.foodchem.2021.130889.
[13] PRADO N, SAMPAYO M, GONZALEZ P, et al. Physicochemical, sensory and microbiological characterization of Asturian Chorizo, a traditional fermented sausage manufactured in Northern Spain[J]. Meat Science, 2019, 156: 118-124. DOI:10.1016/j.meatsci.2019.05.023.
[14] RAVYTS F, STEEN L, GOEMAERE O, et al. The application of staphylococci with flavour-generating potential is affected by acidification in fermented dry sausages[J]. Food Microbiology, 2010, 27(7): 945-954. DOI:10.1016/j.fm.2010.05.030.
[15] STAHNKE L H, HOLCK A, JENSEN A, et al. Maturity acceleration of Italian dried sausage by Staphylococcus carnosus-relationship between maturity and flavor compounds[J]. Journal of Food Science, 2020, 67(5): 1914-1921. DOI:10.1111/j.1365-2621.2020.08746.x.
[16] HU Yingying, CHEN Qian, WEN Rongxin, et al. Quality characteristics and flavor profile of Harbin dry sausages inoculated with lactic acid bacteria and Staphylococcus xylosus[J]. LWTFood Science and Technology, 2019, 114: 108392. DOI:10.1016/j.lwt.2019.108392.
[17] 周莹, 王兆明, 涂健, 等. 基于16S rRNA的徽派腊肉加工过程中微生物群落结构分析[J]. 肉类研究, 2021, 35(3): 1-7. DOI:10.7506/rlyj1001-8123-20201215-289.
[18] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品微生物学检验 菌落总数测定: GB 4789.2—2016[S]. 北京: 中国标准出版社, 2016.
[19] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[20] SANTOS M H S. Amino acid decarboxylase capability of microorganisms isolated in Spanish fermented meat products[J]. International Journal of Food Microbiology, 1998, 39(3): 227-230. DOI:10.1016/S0168-1605(97)00129-3.
[21] 王燚. 抗氧化肉品发酵剂的筛选及其在羊肉香肠中的应用[D].雅安: 四川农业大学, 2008: 38-40.
[22] OZTURKOGLU-BUDAK S, WIEBENGA A, BRON P A, et al.Protease and lipase activities of fungal and bacterial strains derived from an artisanal raw ewe’s milk cheese[J]. International Journal of Food Microbiology, 2016, 237: 17-27. DOI:10.1016/j.ijfoodmicro.2016.08.007.
[23] 牛雪峰. 发酵火腿中产香葡萄球菌的筛选及在发酵香肠中的 应用[D]. 哈尔滨: 哈尔滨商业大学, 2020: 20-22.
[24] COLLINS-THOMPSON K L D A D L. Nitrite tolerance and nitrite reduction in lactic acid bacteria associated with cured meat products[J]. International Journal of Food Microbiology, 1984, 1(3): 163-170. DOI:10.1016/0168-1605(84)90007-2.
[25] 赵婧含, 鞠铭, 孙德鹏, 等. 火腿微生物发酵剂研究进展[J]. 农业与技术, 2021, 41(20): 16-21. DOI:10.19754/j.nyyjs.20211030004.
[26] 张坤煜, 赵舒欣, 王红丁, 等. 神农架豆豉样品中微生物的分离鉴定[J]. 绿色科技, 2020(20): 167-170. DOI:10.16663/j.cnki.lskj.2020.20.055.
[27] 刘柳, 刘学文, 张鑫燚. 发酵肉传统制作工艺参数优化研究[J].食品工业科技, 2008, 20(1): 202-204. DOI:10.13386/j.issn1002- 0306.2008.01.054.
[28] 王正莉, 王卫, 陈林, 等. 传统腌腊肉制品中微生物多样性研究进展[J].食品研究与开发, 2021, 42(8): 202-206.
[29] IRLINGER F, LOUX V, BENTO P, et al. Genome sequence of Staphylococcus equorum subsp. equorum Mu2, isolated from a French smear-ripened cheese[J]. Journal of Bacteriology, 2012, 194(18): 5141-5142. DOI:10.1128/JB.01038-12.
[30] HU Meizhong, YU Jiansheng, YU Jianping, et al. Isolation and screening of Staphylococcus xylosus P2 from Chinese bacon: a novel starter culture in fermented meat products[J]. International Journal of Food Engineering, 2018, 15(2): 1-7. DOI:10.1515/ijfe-2018-0021.
[31] XIAO Yaqing, LIU Yingnan, CHEN Conggui, et al. Effect of Lactobacillus plantarum and Staphylococcus xylosus on flavour development and bacterial communities in Chinese dry fermented sausages[J]. Food Research International, 2020, 135: 109247. DOI:10.1016/j.foodres.2020.109247.
[32] 张诗意, 唐楠, 黄攀, 等. 威宁火腿中微生物的分离鉴定及其耐受特性[J]. 肉类研究, 2019, 33(8): 12-17. DOI:10.7506/rlyj1001-8123-20190625-147.
[33] 陈学云, 侯鲁娜, 丁玉庭, 等. 盐干带鱼中葡萄球菌的分离鉴定及其特性研究[J]. 肉类工业, 2010(5): 35-38.
[34] 马德功, 王成忠, 崔文文. 发酵香肠乳酸菌发酵剂筛选标准[J]. 肉类研究, 2007, 21(12): 31-33.
[35] 马德功. 发酵香肠中乳酸菌的分离,筛选及其应用[D]. 济南: 山东轻工业学院, 2008: 5-11.
[36] DOS SANTOS B A, CAMPAGNOL P C B, FAGUNDES M B, et al. Adding blends of NaCl, KCl, and CaCl2 to low-sodium dry fermented sausages: effects on lipid oxidation on curing process and shelf life[J]. Journal of Food Quality, 2017, 2017: 7085798. DOI:10.1155/2017/7085798.
[37] OSHIBANJO D O, OLUSOLA O O, ADESHOLA A T, et al. Sensory acceptability and microbial load of partial, combined and total replacement of sodium chloride in beef sausage[J]. Annual Conference of the Nigerian Society for Animal Productio, 2018(1): 906-909.
[38] 扈莹莹, 温荣欣, 陈佳新, 等. 低盐对发酵肉制品品质形成影响及减盐手段研究进展[J]. 食品工业科技, 2019, 40(16): 324-328. DOI:10.13386/j.issn1002-0306.2019.16.054.