滋味是猪肉的主要风味之一,其在肉品品质评价中起着至关重要的作用[1]。鲜味作为五大基本滋味之一[2],更是消费者所追求的关键感官品质。猪肉中呈鲜味的物质包括游离氨基酸及其盐类、核苷酸及其盐类、无机盐类、有机酸类和肽类等[3],其中主要鲜味氨基酸为谷氨酸和天冬氨酸[4],主要鲜味核苷酸为5’-肌苷酸、5’-腺苷酸和5’-鸟苷酸[5]。肉中5’-肌苷酸和5’-腺苷酸由三磷酸腺苷酶解生成[6],5’-鸟苷酸主要存在于少数植物和微生物中,在畜禽肉中含量极低,但鲜味是5’-肌苷酸的3~4 倍[7]。不同核苷酸对肉的整体风味具有复杂的影响,5’-肌苷酸降解产物肌苷与次黄嘌呤具有苦味,会给肉的整体风味带来负面作用[8]。因此全面分析猪肉中呈味核苷酸的种类和含量对于了解猪肉的风味特征具有重要意义。
肉中呈味核苷酸的含量受贮运条件[9]、加工方式[10]和检测方法的影响较大。针对呈味核苷酸的检测方法,目前有离子交换色谱法[11]、毛细管电泳法[12]、液相色谱-质谱联用法[13]、紫外分光光度法[14]和高效液相色谱法[15]等,其中高效液相色谱法应用最普遍。当前研究报道中的检测方法存在分析时间较长、检测物质偏少等问题,且一般以生猪背最长肌为研究对象,一定程度上无法全面反映熟制猪肉的呈味核苷酸特征。本研究在前人研究的基础上对仪器条件适当优化,建立猪肉样品中5 种呈味核苷酸的高效液相色谱检测方法。选择市场上4 款高端品牌猪肉的通脊肉和五花肉,确保其从屠宰后到取样前仅冷藏贮运,以常规烹饪方式熟制后分别分析熟肉和肉汤中5’-鸟苷酸、5’-肌苷酸、次黄嘌呤、5’-腺苷酸和肌苷的含量差异,了解其对猪肉鲜味特征的影响,为评价市场上不同品牌猪肉鲜味核苷酸差异和消费者体验提供理论参考。
1 材料与方法
1.1 材料与试剂
选取市场上2 款高端黑猪HZ1(北京盒马超市)、HZ2(北京伊藤洋华堂)和2 款高端白猪BZ1、BZ2(北京物美超市)的通脊肉和五花肉产品,其中通脊肉为整条背最长肌,每款猪肉6 份,五花肉取自第5根和第7根肋骨间,每款猪肉4 份。
5’-鸟苷酸二钠、5’-肌苷酸二钠、5’-腺苷酸、次黄嘌呤、肌苷 美国Sigma公司;高氯酸、氢氧化钠、磷酸二氢钠、磷酸氢二钠(均为分析纯) 国药集团化学试剂有限公司;0.45 μm水系滤膜 天津科亿隆实验设备有限公司;中速定性滤纸 杭州特种纸业有限公司。
1.2 仪器与设备
LC-20A高效液相色谱仪(配有SPD-M20A紫外检测器) 美国Waters公司;Diamonsil Plus C18-A色谱柱(250 mm×4.6 mm,5 μm) 北京迪科马科技有限公司;ME 3002E分析天平、S210 pH计 瑞士Mettler-Toledo公司;5810R高速离心机 德国Eppendorf公司;KQ-250DE超声仪 昆山市超声仪器有限公司;HR-500均质机 上海沪析实业有限公司;FP3010绞肉机德国Braun公司;C22电磁炉 浙江苏泊尔股份有限公司。
1.3 方法
1.3.1 标准品处理
分别称取5’-鸟苷酸二钠、5’-肌苷酸二钠、5’-腺苷酸、次黄嘌呤、肌苷标准品溶解于水中,采用容量瓶定容,配制得到5 mg/mL 5’-鸟苷酸、10 mg/mL 5’-肌苷酸、2 mg/mL 5’-腺苷酸、0.5 mg/mL次黄嘌呤、5 mg/mL肌苷单一标准品溶液。将上述溶液等体积混合后,再加入同等体积水,得到混合标准溶液。将混合标准溶液分别稀释2、3、4、5 倍,过滤膜,采用高效液相色谱检测。
1.3.2 样品前处理
修整猪肉样品(五花肉样品去皮),切成3 cm×3 cm×3 cm小块,均匀混样,称取500 g(精确至0.1 g),加入1 000 g纯净水,中火煮制1 h后加冷水至煮制前质量,放置,温度降至室温,捞出肉块,再次称质量,计算熟肉率。将肉块样品绞碎,称取10 g(精确至0.1 g)于50 mL离心管中,加入25 mL体积分数6%高氯酸,均质混匀,10 000 r/min离心10 min,上清液采用中速定性滤纸过滤,剩余沉淀重复提取,上清液同样过滤,2 次滤液采用5 mol/L氢氧化钠溶液调节pH值至5.4,加水定容至100 mL,摇匀,过滤膜,采用高效液相色谱检测。肉汤样品以10 000 r/min离心10 min取上清液,再次离心后上清液过滤膜,采用高效液相色谱检测。
1.3.3 色谱条件
采用Diamonsil Plus C18-A色谱柱,紫外检测波长为254 nm,进样量为10 μm,流动相为0.05 mol/L磷酸二氢钾(用8 g/100 mL磷酸氢二钾调pH值至5.4),以0.8 mL/min等梯度洗脱,柱温40 ℃。
1.3.4 核苷酸含量计算
肉样中核苷酸含量按式(1)计算。
式中:X1为肉样中待测物含量/(g/kg);ρ1为样品溶液中待测物质量浓度/(g/L);V1为样品溶液体积/mL;M1为生肉熟制后肉样质量/g;m1为用于提取的熟肉质量/g;m为生肉质量/g。
肉汤中核苷酸含量按式(2)计算。
式中:X2为肉汤中待测物含量/(g/kg);ρ2为样品溶液中待测物质量浓度/(g/L);m2为生肉熟制后汤样质量/g。
1.4 数据处理
采用Microsoft Excel 2013软件拟合数据,得到线性方程,通过2 次验证,计算加标回收率和精密度。采用SPSS 20.0软件进行显著性分析,并采用Microsoft Excel 2013软件作图。
2 结果与分析
2.1 高效液相色谱法检测猪肉中核苷酸方法的建立
2.1.1 线性关系、定量限和检出限
按照优化后的前处理和仪器条件进样检测,以色谱图峰面积对标准品质量浓度绘制标准曲线,拟合线性方程。由表1可知,除5’-鸟苷酸和5’-肌苷酸保留时间较近外,其他核苷酸间隔较远,能较好地读取峰面积,计算目标物含量。5 种核苷酸在一定质量浓度范围内呈现良好线性关系,相关系数(R2)均大于0.996。以3 倍信噪比确定检出限,10 倍信噪比确定定量限。5’-鸟苷酸、5’-肌苷酸、次黄嘌呤、5’-腺苷酸和肌苷的定量限分别为0.002、0.040、0.002、0.016、0.011 mg/L,检出限分别为0.007、0.132、0.007、0.052、0.038 mg/L。
表1 呈味核苷酸的线性关系、定量限和检出限
Table 1 Linear relationships, limits of detection and limits of quantification of flavor nucleotides
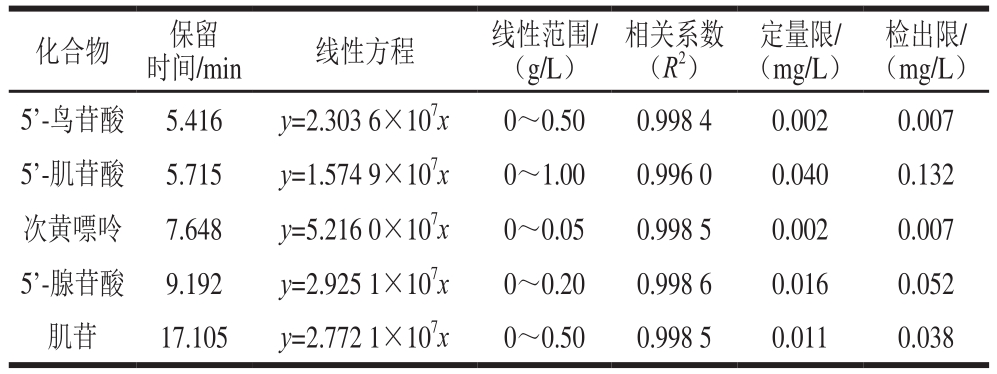
检出限/(mg/L)5’-鸟苷酸 5.416 y=2.303 6×107x 0~0.50 0.998 4 0.002 0.007 5’-肌苷酸 5.715 y=1.574 9×107x 0~1.00 0.996 0 0.040 0.132次黄嘌呤 7.648 y=5.216 0×107x 0~0.05 0.998 5 0.002 0.007 5’-腺苷酸 9.192 y=2.925 1×107x 0~0.20 0.998 6 0.016 0.052肌苷 17.105 y=2.772 1×107x 0~0.50 0.998 5 0.011 0.038化合物 保留时间/min 线性方程 线性范围/(g/L)相关系数(R2)定量限/(mg/L)
2.1.2 加标回收率和精密度
取熟制后绞碎样品10 g,按表2加标量加入2 个水平的标准品溶液,由表2可知,5 种核苷酸加标回收率为89.74%~112.48%,相对标准偏差为0.63%~5.37%,表明该方法精密度良好,满足要求,可用于熟制猪肉样品的呈味核苷酸含量测定。混合标准品、提取溶剂、通脊肉样品及加标通脊肉样品色谱图如图1所示。
表2 呈味核苷酸的加标回收率和精密度
Table 2 Recoveries and precision of flavor-active nucleotides from spiked samples
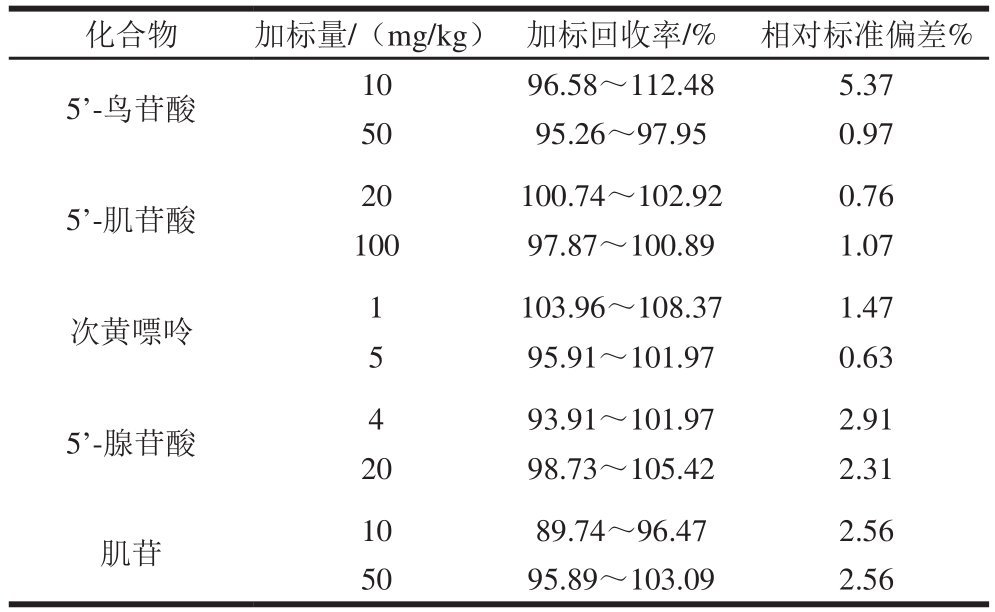
化合物 加标量/(mg/kg) 加标回收率/% 相对标准偏差%5’-鸟苷酸 10 96.58~112.48 5.37 50 95.26~97.95 0.97 5’-肌苷酸 20 100.74~102.92 0.76 100 97.87~100.89 1.07次黄嘌呤 1 103.96~108.37 1.47 5 95.91~101.97 0.63 5’-腺苷酸 4 93.91~101.97 2.91 20 98.73~105.42 2.31肌苷 10 89.74~96.47 2.56 50 95.89~103.09 2.56
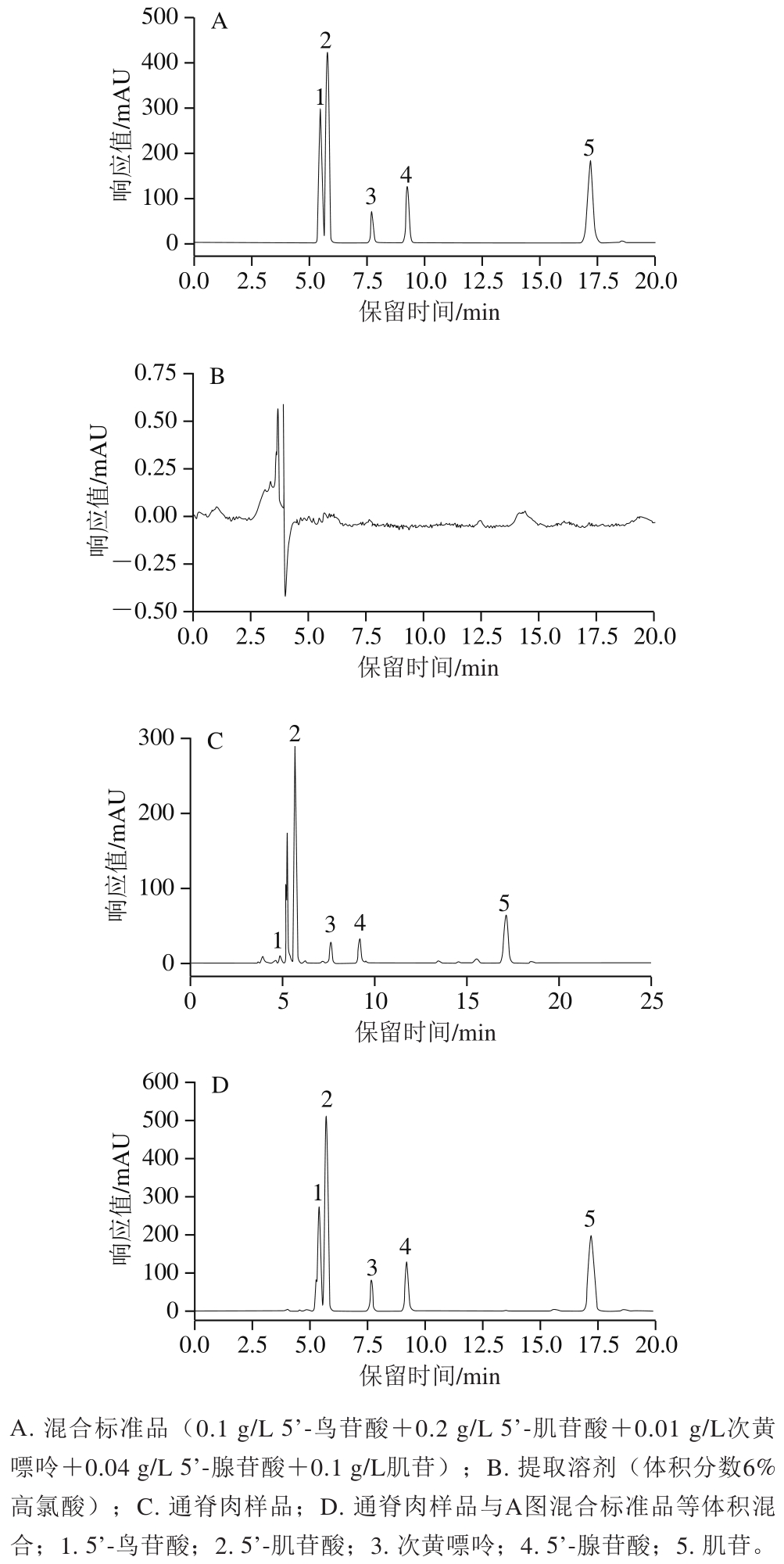
图1 不同试样色谱图
Fig. 1 Chromatograms of different samples
2.2 不同品牌猪肉熟肉率
对比不同品牌猪肉产品熟肉率,由表3可知:2 款黑猪通脊肉产品熟肉率均高于2 款白猪;BZ1白猪五花肉产品熟肉率最高,为84.20%,高于2 款黑猪五花肉产品,另一款白猪产品相对最低。因熟肉率各不相同,后续对比核苷酸含量均基于生肉质量(约500 g)计算。
表3 不同品牌猪肉熟肉率
Table 3 Cooking yield of pork tenderloin and belly %
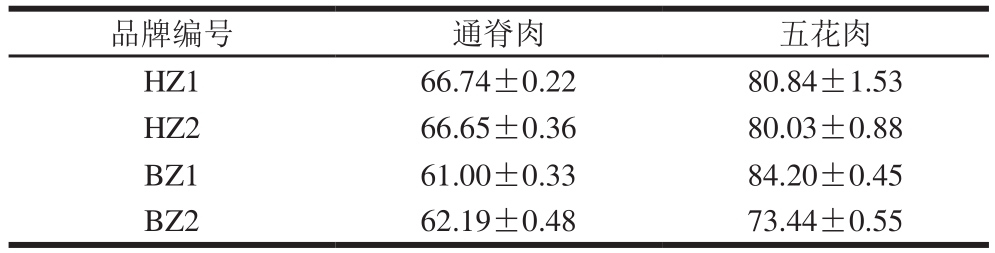
品牌编号 通脊肉 五花肉HZ1 66.74±0.22 80.84±1.53 HZ2 66.65±0.36 80.03±0.88 BZ1 61.00±0.33 84.20±0.45 BZ2 62.19±0.48 73.44±0.55
2.3 不同品牌猪通脊肉中核苷酸含量比较分析
猪肉中5’-肌苷酸含量高低可间接反映肉品食用风味的优劣[16],其降解产物和5’-鸟苷酸、5’-腺苷酸均不程度影响感官风味[17]。由图2可知,4 款猪通脊肉熟制后肉和汤中5’-肌苷酸含量均明显高于其他核苷酸含量,肌苷次之,5’-鸟苷酸含量最低。不同品牌间,BZ1通脊肉和汤中5’-肌苷酸含量均最高(0.826、1.339 g/kg),HZ1最低(0.521、0.682 g/kg),且2 款白猪通脊肉显著高于黑猪(P<0.05)。对比分析5’-肌苷酸降解产物肌苷与次黄嘌呤,不同品牌间,HZ1通脊肉中肌苷含量最高(0.356 g/kg),其他品牌间无显著差异(P<0.05),而HZ2通脊肉汤中肌苷含量最高(0.583 g/kg),2 款黑猪通脊肉汤显著高于白猪(P<0.05)。就次黄嘌呤而言,HZ1通脊肉和汤中含量最高(0.107、0.155 g/kg),均显著高于其他品牌(P<0.05),且2 款白猪通脊肉均显著低于黑猪,白猪煮制后通脊肉和汤中含量均无显著差异。就5’-腺苷酸而言,不同品牌间,BZ1通脊肉和汤中含量最高(0.073、0.087 g/kg),BZ2处于中等水平,黑猪与白猪的5’-腺苷酸含量未见相关性趋势。就5’-鸟苷酸而言,不同品牌间,BZ2通脊肉和汤中含量均最高(0.019、0.024 g/kg),2 款白猪通脊汤中显著高于黑猪(P<0.05)。上述结果表明,猪通脊肉中主要呈味核苷酸以5’-肌苷酸为主,熟制后更多核苷酸存在于汤中。白猪通脊肉熟制后在鲜味呈味上更具优势,且BZ1最优。
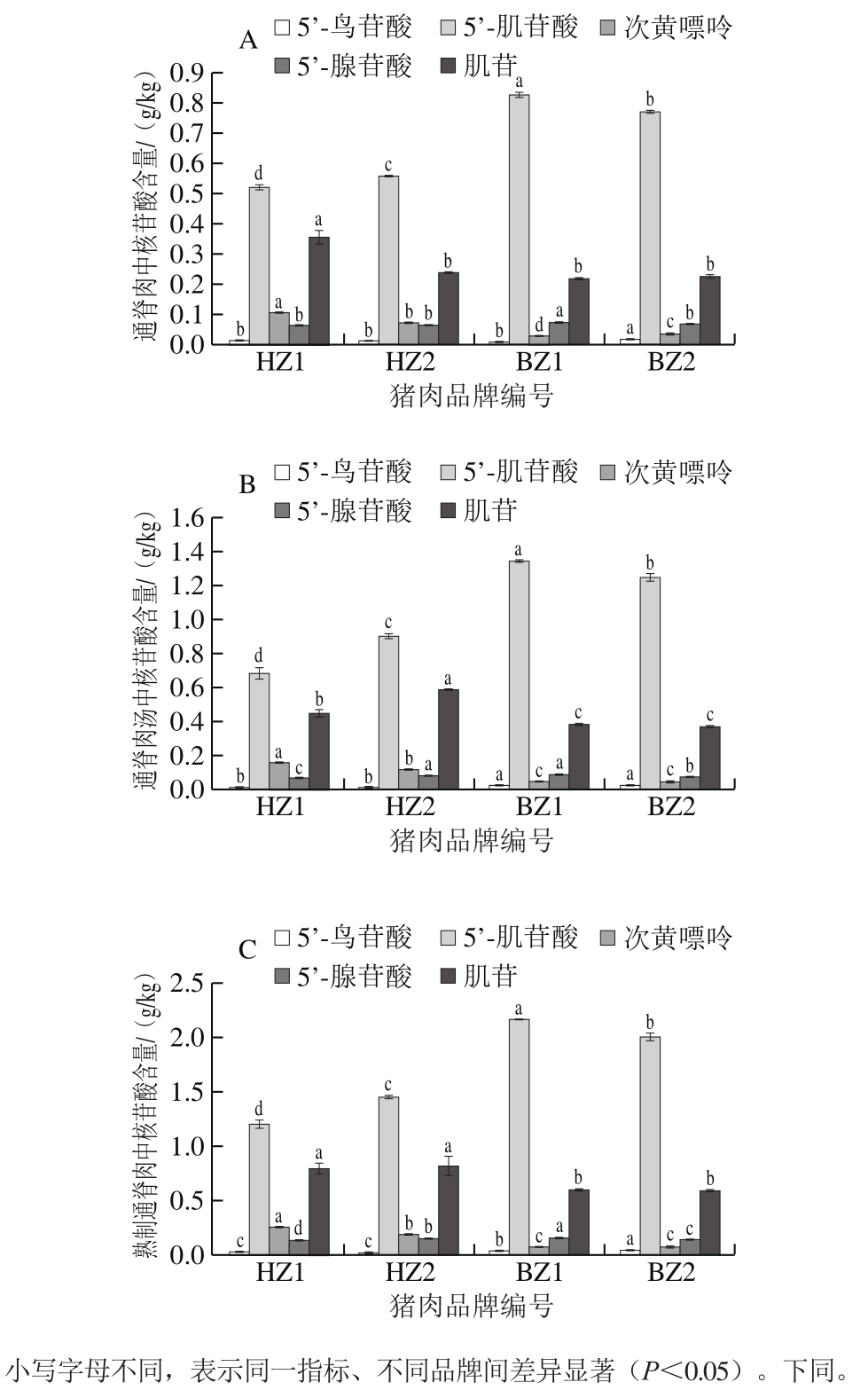
图2 不同品牌猪通脊肉(A)、肉汤(B)、熟制通脊肉(C)核苷酸含量
Fig. 2 Nucleotide contents in raw pork tenderloin (A), broth (B) and cooked pork tenderloin (C)
目前,以猪背最长肌为研究对象,对比不同品种核苷酸含量差异的研究较多。席斌等[18]发现,地方品种甘肃黑猪的5’-肌苷酸含量低于有外来品种基因的甘肃长白猪,肌苷和次黄嘌呤含量高于后者。葛倩倩等[1]同样发现,杜长大杂交猪中5’-肌苷酸含量(2.092 g/kg)显著高于北京黑猪(1.988 g/kg),肌苷含量显著低于北京黑猪,次黄嘌呤含量无显著差异。本研究中2 款白猪通脊5’-肌苷酸总量(BZ1为2.165 g/kg,BZ2为2.011 g/kg)均显著高于黑猪(HZ1为1.202 g/kg,HZ2为1.453 g/kg),且肌苷总量和次黄嘌呤总量显著低于黑猪,不同品种间含量差异趋势与上述研究结果一致,白猪5’-肌苷酸含量差异不大,但本研究黑猪5’-肌苷酸含量明显偏低。有研究表明,定远黑猪的5’-肌苷酸和5’-鸟苷酸含量均显著高于瘦肉型猪肉[19]。造成这些不同结果的原因可能与日粮[1]、饲养方式[20]和贮藏条件[21-22]等差异有关,如日粮中蛋白质水平不同[23]或添加黄酮类物质[24],均会导致畜禽肉中5’-肌苷酸含量的显著变化。畜禽肉解僵过程中,5’-肌苷酸在5’-核苷酸酶和核苷水解酶的作用下生成肌苷和次黄嘌呤[6],因此鲜猪肉5’-肌苷酸含量越高,肌苷和次黄嘌呤含量会降低,熟制猪肉风味可能越好。瘦猪肉的风味物质以水溶性物质为主[25],煮制后一部分会溶解在汤中。杨平等[26]也发现,猪肉汤中5’-肌苷酸含量明显高于其他核苷酸,本研究中2 款白猪肉汤中5 种呈味核苷酸含量趋势与熟肉一致,但2 款黑猪汤与肉之间略有差别,表现为HZ2肉中肌苷含量高于HZ1,而汤中相反,这可能与其肌纤维差异导致的系水力不同有关[27]。5’-肌苷酸是畜禽肉中主要呈鲜物质,其他核苷酸含量较低或不呈鲜味,且5’-肌苷酸与其他鲜味氨基酸具有协同作用,并对苦味和酸味具有缓冲作用[28],因此综合分析,猪肉煮制后肉和汤的鲜味还需进一步研究,如采用鲜味强度评价并结合专业感官测试分析。
2.4 不同品牌猪五花肉中核苷酸含量比较分析
五花肉肥瘦相间,脂肪含量高,其风味物质主要是脂质氧化及降解产生的醛类、酯类和醇类化合物等挥发性物质[29]。目前对五花肉滋味尤其是鲜味成分研究较少。由图3可知,4 款猪五花肉熟制后肉和汤中5’-肌苷酸含量均明显高于其他核苷酸含量,肌苷次之,5’-鸟苷酸含量最低,与通脊肉一致,说明5’-肌苷酸是猪肉中最主要的呈味核苷酸。不同品牌间,BZ1五花肉中5’-肌苷酸含量最高(0.319 g/kg),BZ2五花肉汤中5’-肌苷酸含量最高(0.493 g/kg),与BZ1五花肉汤无显著差异,2 款白猪五花肉和汤均显著高于黑猪(P<0.05)。对比通脊肉和五花肉5’-肌苷酸含量发现,五花肉中含量远低于通脊肉,表明核苷酸主要存在于肌肉组织。对比分析5’-肌苷酸降解产物肌苷与次黄嘌呤,不同品牌间,HZ2五花肉中肌苷含量相对最高(0.120 g/kg),BZ2五花肉汤中最高(0.199 g/kg),黑猪与白猪的肌苷含量未见相关性趋势。就次黄嘌呤而言,HZ2五花肉中含量最高(0.076 g/kg),显著高于其他品牌(P<0.05);HZ1五花肉汤中含量最高(0.115 g/kg),与HZ2无显著差异,显著高于白猪(P<0.05)。不同品牌间五花肉中5’-腺苷酸含量无显著差异(P<0.05),BZ2五花肉汤中最高(0.041 g/kg),其他品牌无显著差异(P<0.05);不同品牌间,HZ1五花肉和汤中5’-鸟苷酸含量最低,显著低于其他品牌,其他品牌间无显著差异(P<0.05)。上述结果表明,在核苷酸含量、熟制后含量分布和鲜味呈味方面五花肉均与通脊肉一致,即白猪优于黑猪,且BZ1最佳。
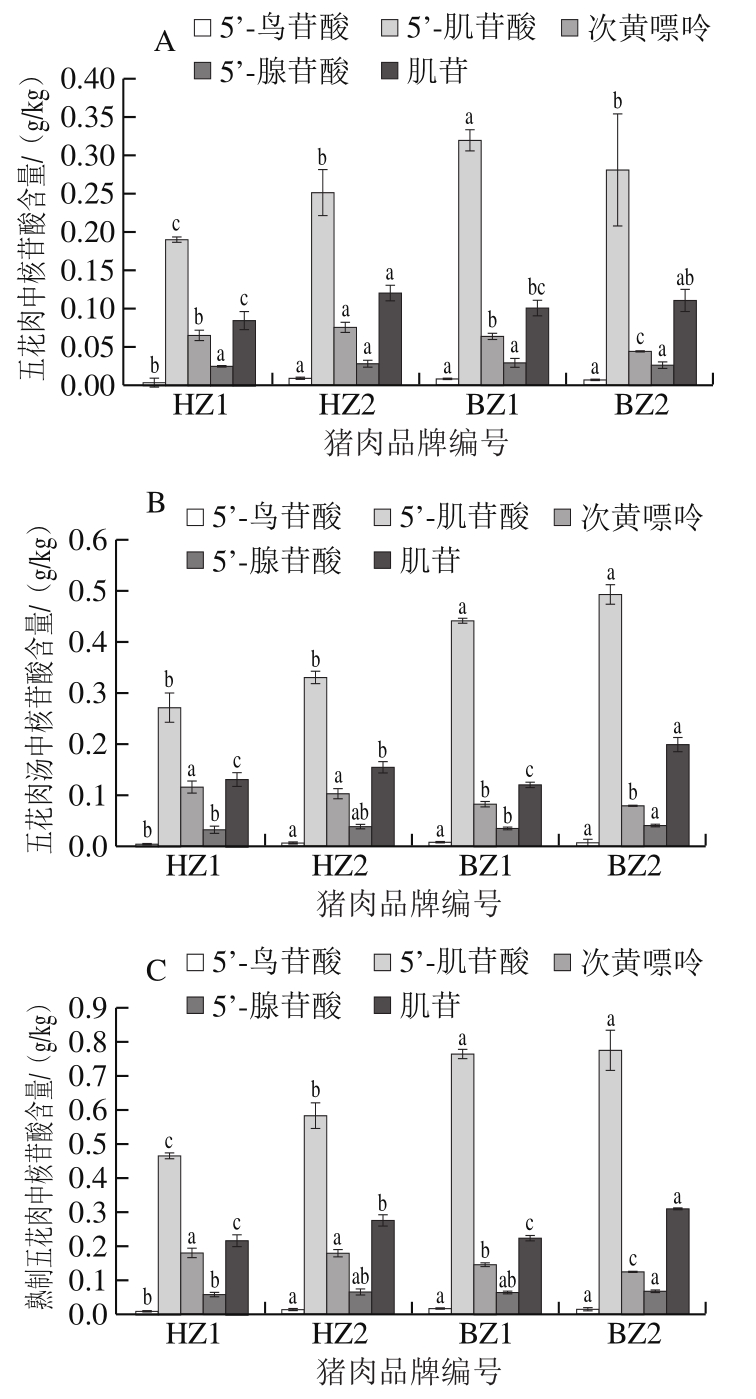
图3 不同品牌猪五花肉(A)、肉汤(B)、熟制五花肉(C)核苷酸含量
Fig. 3 Nucleotide contents in pork belly (A), broth (B) and cooked pork belly (C)
目前针对五花肉的研究集中于其营养成分、挥发性风味物质和加工特性分析。针对脂肪含量较高的猪肉部位,其香气特征更受关注。王蒙等[30]以猪后腿肉为研究对象,发现肉汤中的风味物质由呈味氨基酸与多肽与还原糖发生美拉德反应和脂质降解氧化反应得到。Zhao Jian等[31]对比发现,黑猪肉和白猪肉汤中香气成分几乎相同,但黑猪肉汤较白猪肉汤有更多的烤肉香味,因前者含有较多的单不饱和脂肪酸[30]。王瑞花等[32]利用模糊数学综合评价法优化获得红烧肉的最佳工艺,并成功分离鉴定出关键风味物质,结果显示均与脂质相关。亦有研究发现,脂肪同样能够提供鲜味[33],脂肪味也可能对其他基本味觉产生影响[34]。Iida等[35]对比不同粗脂肪含量牛肉风味发现,一定程度内粗脂肪含量增多,鲜味增强,另外,多不饱和脂肪酸含量相对较高则可能使肉品风味变差[36]。五花肉由于脂肪含量较高,其整体风味易受脂肪性质及其反应产物影响,仅对五花肉中呈味核苷酸进行研究并不能准确呈现其鲜味特征。五花肉作为人们最喜爱食用的部位之一,在本研究中5 种核苷酸水平与通脊熟肉和汤中基本一致,为综合评价不同部位猪肉的感官特征提供了新依据。
3 结 论
初步建立5 种呈味核苷酸的高效液相色谱检测方法,该法线性关系良好、分析时间短(20 min内)、精密度高。利用该法检测对比4 款高端品牌猪肉2 个部位(通脊和五花)的呈味核苷酸含量,发现猪肉中5’-肌苷酸含量明显高于其他核苷酸,五花肉中呈味核苷酸含量远低于通脊肉,表明5’-肌苷酸是猪肉中最主要的核苷酸,且主要存在于肌肉组织;白猪肉和汤中5’-肌苷酸含量均显著高于黑猪(P<0.05),肌苷与次黄嘌呤含量总体低于黑猪,白猪BZ1通脊肉和BZ2五花肉汤中5’-腺苷酸含量最高,白猪BZ2通脊肉中5’-鸟苷酸含量最高,黑猪HZ1五花肉中5’-鸟苷酸含量最低。综上,无论通脊还是五花,白猪在鲜味呈现上比黑猪更具优势,用于烹饪肉菜和汤品均更理想,白猪BZ1最佳,黑猪HZ1最差。猪肉中风味物质繁多,相互作用影响明显,单一的鲜味成分并不能评判猪肉综合品质,猪肉熟制后整体的口感风味还需结合其他呈味物质,如呈味氨基酸、挥发性风味物质等综合分析。
[1]葛倩倩, 汤晓艳, 涂婷, 等.不同品种猪肉鲜味特征比较研究[J]. 肉类研究, 2020, 34(9): 1-5. DOI:10.7506/rlyj1001-8123-20200619-155.
[2]GHIRRI A, BIGNETTII E. Occurrence and role of umami molecules in foods[J]. International Journal of Food Sciences and Nutrition,2012, 63(7): 871-881. DOI:10.3109/09637486.2012.676028.
[3]GISPERT M, OLIVER M A, VELARDE A, et al. Carcass and meat quality characteristics of immunocastrated male, surgically castrated male, entire male and female pigs[J]. Meat Science, 2010, 85(4): 664-670.DOI:10.1016/j.meatsci.2010.03.021.
[4]郇思琪, 刘登勇, 王笑丹, 等.食品中呈鲜味物质研究进展[J].食品工业科技, 2020, 41(21): 333-339. DOI:10.13386/j.issn1002-0306.2020020157.
[5]王晓方, 常文环, 刘国华, 等.畜禽肌肉肌苷酸研究进展[J].中国畜牧兽医, 2012, 39(5): 221-224. DOI:10.3969/j.issn.1671-7236.2012.05.054.
[6]唐修君, 杨星星, 樊艳凤, 等.不同贮藏条件下鸡肉肌苷酸含量的变化规律[J]. 食品工业科技, 2019, 40(2): 266-270. DOI:10.13386/j.issn1002-0306.2019.02.046.
[7]杜琨, 张亚宁, 方多. 呈味核苷酸及其在食品中的应用[J]. 中国酿造,2005, 24(10): 50-52. DOI:10.3969/j.issn.0254-5071.2005.10.018.
[8]TIKK M, TIKK K M A, RNGREN M T, et al. Development of inosine monophosphate and its degradation products during aging of pork of different qualities in relation to basic taste and retronasal flavor perception of the meat[J]. Journal of Agricultural and Food Chemistry,2006, 54(20): 7769-7777. DOI:10.1021/jf060145a.
[9]李意. 离子交换色谱法测定小球藻提取物中的核苷酸[J]. 分析化学,2004, 32(8): 1077-1079. DOI:10.3321/j.issn:0253-3820.2004.08.025.
[10]孙承锋, 周楠, 朱亮, 等. 卤猪肉加工过程中游离脂肪酸、游离氨基酸及核苷酸变化分析[J]. 现代食品科技, 2016, 32(6): 200-206.DOI:10.13982/j.mfst.1673-9078.2016.6.032.
[11]陈超, 王真, 任南, 等. 超高效液相色谱-串联质谱法测定鸡肉中肌苷及其关联物[J]. 肉类研究, 2021, 35(10): 41-47. DOI:10.7506/rlyj1001-8123-20210709-185.
[12]郑胜彪, 唐婧. 紫外分光光度法同时测定鸡精中谷氨酸钠和呈味核苷酸[J]. 中国调味品, 2009, 34(5): 92-94. DOI:10.3969/j.issn.1000-9973.2009.05.021.
[13]温泉, 吴轶. 采用高效液相色谱法测定猪肉中的呈味核苷酸[J]. 现代食品科技, 2010, 26(1): 117-120. DOI:10.3969/j.issn.1673-9078.2010.01.030.
[14]章杰, 彭新书, 何航. 反复冻融对猪肉营养成分的影响[J]. 食品与发酵工业, 2018, 44(2): 166-171. DOI:10.13995/j.cnki.11-1802/ts.014680.
[15]葛倩倩. 猪肉中呈味核苷酸变化规律及肌苷酸基体标准样品研制[D]. 北京: 中国农业科学院, 2020: 5-6.
[16]CLAUSEN M P, CHRISTENSEN M, DJURHUUS T H, et al. The quest for umami: can sous vide contribute?[J]. International Journal of Gastronomy and Food Science, 2018, 13(10): 129-133. DOI:10.1016/j.ijgfs.2018.03.002.
[17]杨露, 谭会泽, 温志芳, 等. 鸡肉中鲜味核苷酸测定方法研究[J]. 粮食与饲料工业, 2021(5): 63-65. DOI:10.7633/j.issn.1003-6202.2021.05.015.
[18]席斌, 郭天芬, 杨晓玲, 等. 对不同品种猪肉中脂肪酸,氨基酸及肌苷酸的比较研究[J]. 饲料研究, 2019, 42(7): 31-34. DOI:10.13557/j.cnki.issn1002-2813.2019.07.010.
[19]潘见, 杨俊杰, 朱双杰, 等. 四种不同品种猪肉滋味成分差异研究[J]. 食品工业科技, 2015, 36(14): 161-164. DOI:10.13386/j.issn1002-0306.2015.14.025.
[20]罗彬彬. 划区轮牧饲养模式对鸡肉品质及草地土壤形状得影响[D].贵阳: 贵州大学, 2019: 26-27.
[21]朱荣生, 王怀中, 林松, 等. 冷藏期间猪肌肉中肌苷酸沉积规律研究[J]. 山东农业科学, 2017, 49(2): 147-150. DOI:10.14083/j.issn.1001-4942.2017.02.031.
[22]UTAMA D T, LEE S G, BAEK K H, et al. Effects of high-pressure processing on taste-related ATP breakdown compounds and aroma volatiles in grass-fed beef during vacuum aging[J]. Asian-Australasian Journal of Animal Sciences, 2018, 31(8): 1336-1344. DOI:10.5713/ajas.17.0677.
[23]凌俊, 李吕木, 陶小平, 等. 不同蛋白源日粮对猪肌肉中呈鲜物质含量及肉香味的影响[J]. 食品科学, 2007, 28(6): 59-63.
[24]WANG Xiaofang, LIU Guohua, CAI Huiyi, et al. Attempts to increase inosinic acid in broiler meat by using feed additives[J]. Poultry Science, 2014, 3(11): 2802-2808. DOI:10.3382/ps.2013-03815.
[25]林宇山, 岑泳延. 对猪肉风味的探讨[J]. 食品工业科技, 2006(9):194-197. DOI:10.13386/j.issn1002-0306.2006.09.058.
[26]杨平, 王瑶, 宋焕禄, 等. 不同熬制条件下猪肉汤中滋味成分的变化[J].中国食品学报, 2018, 18(12): 247-258. DOI:10.16429/j.1009-7848.2018.12.032.
[27]黄微. 肌肉组织结构对猪肉风味品质的影响[J]. 中国猪业, 2011,5(11): 39-40. DOI:10.16174/j.cnki.115435.2011.11.023.
[28]罗桂芬, 孙世铎, 陈继兰, 等. 肉类风味物质: 肌苷酸[J].中国家禽,2004, 26(3): 41-43. DOI:10.3969/j.issn.1004-6364.2004.03.023.
[29]刘薇, 陈敏, 徐雅倩, 等. 烤制时间对中式烤五花肉挥发性风味物质的影响[J]. 中国调味品, 2021, 46(10): 54-57. DOI:10.3969/j.issn.1000-9973.2021.10.010.
[30]王蒙, 侯莉, 曹长春, 等. 清炖猪肉汤香气物质的分析鉴定[J].食品科学, 2015, 36(24): 105-111. DOI:10.7506/spkx1002-6630-201524018.
[31]ZHAO Jian, WANG Meng, XIE Jianchen, et al. Volatile flavor constituents in the pork broth of black-pig[J]. Food Chemistry, 2017,226: 51-60. DOI:10.1016/j.foodchem.2017.01.011.
[32]王瑞花, 姜万舟, 汪倩, 等. 红烧猪肉工艺优化及其挥发性风味成分的分离与鉴定[J]. 中国食品学报, 2017, 17(5): 208-215.DOI:10.16429/j.1009-7848.2017.05.027.
[33]龚骏, 陶宁萍, 顾赛麒. 食品中鲜味物质及其检测研究方法概述[J]. 中国调味品, 2014, 39(1): 129-135. DOI:10.3969/j.issn.1000-9973.2014.01.034.
[34]KENZO K. Umami the fifth basic taste: history of studies on receptor mechanisms and role as a food flavor[J]. Biomed Research International, 2015, 6(7): 189-202. DOI:10.1155/2015/189402.
[35]IIDA F, SAITOU K, KAWAMURA T, et al. Effect of fat content on sensory characteristics of marbled beef from Japanese Black steers[J].Animal Science Journal, 2015, 86: 707-715. DOI:10.1111/asj.12342.
[36]鲁云风, 张晓娜, 张征田. 南阳黑猪和大白猪脂肪酸分析及其综合评价[J]. 中国畜牧兽医, 2017, 44(4): 1032-1036. DOI:10.16431/j.cnki.1671-7236.2017.04.014.