大鲵(Andrias davidianus)分布广泛,是有“活化石”之称的两栖动物,具有极高的营养价值和药用价值,被誉为“生物界的活宝藏”[1]。大鲵肉占体质量的50%左右,滋味鲜美、营养丰富,富含多种生物活性物质,经常食用大鲵肉有益气、养血、益智的功效,对神经衰弱、贫血、痢疾等疾病有辅助治疗作用[2-3]。近年来对大鲵肉的研究主要集中在营养成分分析[4-5]、贮藏保鲜[6-7]、活性肽[8-9]等领域,而对大鲵肉肌基质蛋白中胶原蛋白肽和弹性蛋白肽特性的研究报道极少。
大鲵肉含有肌浆蛋白、肌原纤维蛋白及肌基质蛋白,3 种蛋白占肌肉总蛋白比例为肌浆蛋白28.75%、肌原纤维蛋白52.87%、肌基质蛋白13.35%,将肌浆蛋白、肌原纤维蛋白提取后的剩余肉渣主要为肌基质蛋白,肌基质蛋白中主要含有胶原蛋白和弹性蛋白[9-10]。胶原蛋白具有特殊的三螺旋结构,分子中含有糖及大量的羟脯氨酸、甘氨酸、脯氨酸等[11]。迄今为止,已发现的胶原蛋白有29 种,主要为Ⅰ、Ⅱ、Ⅲ、Ⅳ、V五大类型,其中Ⅰ型含量较丰富[12]。弹性蛋白是一种高度不溶于稀酸、碱和盐溶液,大量存在于皮肤、血管(主动脉)和肺组织中负责延展和弹性回缩的结构蛋白[13-14]。而胶原蛋白肽和弹性蛋白肽是胶原蛋白和弹性蛋白经特定蛋白酶酶解为小分子质量的多肽。胶原蛋白肽有利于皮肤胶原蛋白形成,也可增强骨胶原结构,促进动物体骨骼的形成,具有保护胃黏膜、抗过敏、防治骨质疏松、降血压、促进毛发生长等作用[15-16]。弹性蛋白肽具有较强的抗氧化能力,在皮肤衰老进程中发挥着重要作用,可促进细胞迁移、生长和增殖,使皮肤具有较强的韧性和弹性[17]。目前,胶原蛋白肽和弹性蛋白肽在医药、化妆品、食品等高附加值领域中得到广泛开发和应用[18-19]。
本研究以大鲵肌肉中提取获得的肌基质蛋白为原料,分别用胶原蛋白酶及弹性蛋白酶酶解制备胶原蛋白肽和弹性蛋白肽,研究其特性,以期实现大鲵肉利用率最大化,为大鲵肉肌基质蛋白进一步开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
大鲵肌肉 汉中龙鲵生物工程股份有限公司。
风味蛋白酶(1.0×105 U/g)、胃蛋白酶(5.0×104 U/g)、胶原蛋白酶(1.0×105 U/g) 陕西源优生物科技有限公司;弹性蛋白酶 南宁庞博生物工程有限公司;碳酸氢钠、柠檬酸、甲醇、冰乙酸、盐酸、氢氧化钠、体积分数95%乙醇溶液(均为分析纯) 天津市富宇精细化工有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、蛋白Marker、考马斯亮蓝G250、丙烯酰胺、四甲基乙二胺、乙二胺四乙酸、三羟甲基氨基甲烷、过硫酸铵、甘氨酸、溴酚蓝、β-巯基乙醇、甘油(均为电泳级) 生工生物工程(上海)股份有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、邻苯三酚 上海源叶生物科技有限公司。
1.2 仪器与设备
DFY-1000摇摆式高速万能粉碎机 温岭市林大机械有限公司;JA5003分析天平 上海舜宇恒平科学仪器有限公司;Xinyi-100F真空冷冻干燥机 宁波新艺超声设备有限公司;TGL-20M冷冻离心机 湖南湘仪离心机仪器有限公司;DK-98-Ⅱ恒温水浴锅 天津市泰斯特仪器有限公司;PE28 pH计 瑞士梅特勒-托利多仪器有限公司;UV-1750紫外-可见分光光度计 日本岛津仪器公司;VERTEX70傅里叶红外光谱仪 德国Bruker公司;Biochrom 30+全自动氨基酸分析仪 大昌华嘉商业有限公司;DYCZ-24DN垂直电泳仪 北京六一生物科技有限公司;SNB-2数字黏度计 上海伦捷机电仪表有限公司;Phenom台式扫描电子显微镜 美国FEI公司。
1.3 方法
1.3.1 大鲵肉肌基质蛋白中胶原蛋白肽和弹性蛋白肽制备
原材料预处理:大鲵肌肉解冻后,加入1%食盐,水中浸泡30 min,流水清洗干净,沥干、绞碎。
大鲵肉肌基质蛋白制备:取大鲵肉糜500 g,加入4 倍体积0.05 mol/L、pH 7.5的磷酸盐缓冲液,磁力搅拌辅助提取3 h,4 ℃、10 000 r/min离心10 min,收集上清液,沉淀物中再加入上述磷酸盐缓冲液,重复上述操作,将上清液合并即得水溶性肌浆蛋白;向沉淀中加入4 倍体积含0.6 mol/L NaCl的磷酸盐缓冲液,磁力搅拌辅助提取8 h,4 ℃、10 000 r/min离心10 min,重复上述操作,合并上清液,即得盐溶性肌原纤维蛋白;所得沉淀用蒸馏水反复洗涤3 次,即得肌基质蛋白。将肌基质蛋白冷冻干燥,粉碎成粉末置于-20 ℃冰箱备用[10]。
胶原蛋白肽制备:称取肌基质蛋白粉末20.000 g,按料液比1∶2、pH 7.0加入0.200 g胶原蛋白酶于37 ℃水浴锅中,搅拌酶解4.5 h后,沸水浴10 min灭酶,冷却至室温;将酶解液于10 000 r/min离心10 min,取上清液冷冻干燥得胶原蛋白肽粉。
弹性蛋白肽制备:称取肌基质蛋白粉末20.000 g,按料液比1∶2、pH 7.8加入0.200 g弹性蛋白酶于37 ℃水浴锅中,搅拌酶解4.5 h后,沸水浴10 min灭酶,冷却至室温;将酶解液于10 000 r/min离心10 min,取上清液冷冻干燥得弹性蛋白肽粉。
胶原蛋白肽和弹性蛋白肽提取率分别按式(1)~(2)计算。
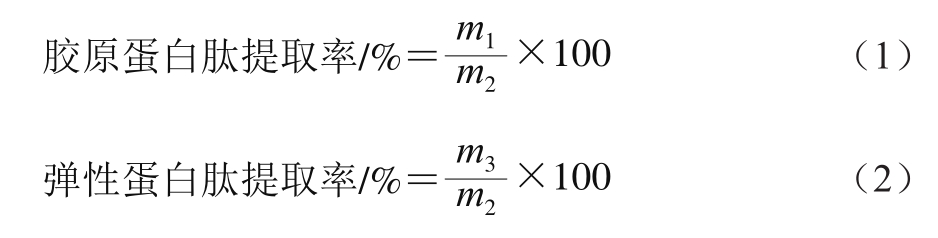
式中:m1为胶原蛋白肽粉质量/g;m2为肌基质蛋白粉质量/g;m3为弹性蛋白肽粉质量/g。
1.3.2 胶原蛋白肽和弹性蛋白肽紫外光谱测定
配制质量浓度为1 mg/mL样品溶液,用紫外-可见分光光度计测定200~800 nm波长的吸光度,测定胶原蛋白肽和弹性蛋白肽紫外光谱。
1.3.3 胶原蛋白肽和弹性蛋白肽红外光谱测定
准确称取100.0 mg溴化钾粉末3 份,1 份为空白对照,另2 份分别与1 mg胶原蛋白肽粉和1 mg弹性蛋白肽粉样品混匀,置于玛瑙钵体中研成细粉后进行压片。使用红外光谱仪测定4 000~400 cm-1区间内的红外光谱[10]。
1.3.4 胶原蛋白肽和弹性蛋白肽氨基酸组成及含量测定
参考陈德经[20]方法稍作修改,分别称取0.500 g胶原蛋白肽和弹性蛋白肽样品于安培瓶内,加入10 mL 6 mol/L盐酸溶液,充氮气30 s重复3 次,封口,于110 ℃恒温干燥箱内水解24 h,取出冷却后,将水解液过滤,定容至50 mL容量瓶,吸取滤液1 mL定容至5 mL容量瓶内,在50 ℃真空干燥箱干燥,残留物用1 mL 6 mol/L盐酸溶液水解,再干燥,重复2 次,最后蒸干,加入1 mL pH 2.2的0.2 mol/L柠檬酸缓冲液溶解,过0.22 μm微孔滤膜后注入Biochrom 30+全自动氨基酸分析仪测定氨基酸组成及含量。
1.3.5 胶原蛋白肽和弹性蛋白肽的SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electropheresis,SDS-PAGE)分析
采用5%浓缩胶、12%分离胶对胶原蛋白肽和弹性蛋白肽进行SDS-PAGE测定[21]。
1.3.6 胶原蛋白肽和弹性蛋白肽物理特性测定
1.3.6.1 黏度测定
准确称取一定量胶原蛋白肽和弹性蛋白肽样品于试管中加蒸馏水混匀后,配制成2.5 mg/mL样品溶液,用黏度计测定SP2、SP3转子下的黏度。
1.3.6.2 扫描电子显微镜观察
取一定量胶原蛋白肽和弹性蛋白肽粉末,将直径12 mm双面碳导电胶片粘贴在钉型样品台上,而后将样品均匀覆盖在胶片表面,用镊子将钉型样品台夹起放置于电镜标准样品杯中,旋转样品杯,动力除尘器除去灰尘后放置于电镜载物台,调节最佳视野和放大倍数对样品进行微观结构观察。
1.3.7 胶原蛋白肽和弹性蛋白肽体外抗氧化活性测定
1.3.7.1 DPPH自由基清除率测定
将胶原蛋白肽和弹性蛋白肽分别加蒸馏水溶解,配制质量浓度2.0~10.0 mg/mL样品溶液。取3 mL样品溶液于试管中,加入3 mL 0.1 mmol/L DPPH溶液(用体积分数95%乙醇溶液配制),振荡混匀后避光放置30 min,在517 nm波长处测定吸光度,用蒸馏水调零,0.5 mg/mL抗坏血酸溶液作为阳性对照。平行测定3 次。DPPH自由基清除率按式(3)计算[22]。
式中:A0为蒸馏水+DPPH溶液吸光度;A1为样品+DPPH溶液吸光度;A2为样品+体积分数95%乙醇溶液吸光度。
1.3.7.2 O-2·清除率测定
将胶原蛋白肽和弹性蛋白肽分别加蒸馏水溶解,配制质量浓度2.0~10.0 mg/mL样品溶液。取1 mL样品溶液于试管中,各加入4.5 mL 50 mmol/L Tris-HCl缓冲液和0.1 mL 3 mmol/L邻苯三酚溶液充分混匀,于25 ℃水浴反应10 min,加入1 mL 8 mmol/L盐酸溶液终止反应。在320 nm波长处测定吸光度,以蒸馏水作为空白对照,0.5 mg/mL抗坏血酸溶液作为阳性对照。实验重复3 次,O-2·清除率按式(4)计算[23]。
式中:A3为不加样品溶液、加邻苯三酚溶液吸光度;A4为加样品溶液和邻苯三酚溶液吸光度;A5为加样品溶液、不加邻苯三酚溶液吸光度。
1.4 数据处理
采用Origin Pro 2021软件进行绘图,Excel软件进行数据统计分析,结果以平均值±标准差表示。
2 结果与分析
2.1 胶原蛋白肽和弹性蛋白肽提取率
蛋白酶中含有特定蛋白酶切位点,能最大化地将大分子蛋白切割成较小分子的多肽。采用胶原蛋白酶及弹性蛋白酶酶解大鲵肉肌基质蛋白,由图1可知,胶原蛋白酶的提取率为(45.11±2.11)%,高于弹性蛋白酶的提取率(37.36±2.98)%,表明大鲵肉肌基质蛋白中胶原蛋白含量高于弹性蛋白含量。
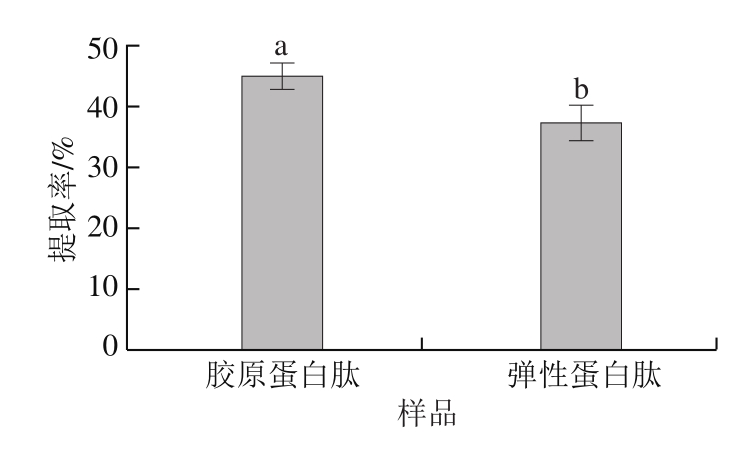
图1 胶原蛋白肽和弹性蛋白肽的提取率
Fig.1 Yields of peptides with collagenase and elastase
小写字母不同,表示差异显著(P<0.05)。
2.2 胶原蛋白肽和弹性蛋白肽紫外光谱分析
蛋白质存在的不饱和结构肽键、羧基、苯环等都会对紫外光区有吸收。在波长200~800 nm对胶原蛋白肽和弹性蛋白肽样品进行紫外波长扫描,由图2可知:胶原蛋白肽最大吸收峰出现在210~230 nm,符合胶原蛋白肽的特征吸收峰[24],在波长260~280 nm也有一定的吸收,但吸收峰较小,说明大鲵肉肌基质蛋白中胶原蛋白肽含有一定量的芳香族氨基酸;弹性蛋白肽最大吸收峰出现在200~220 nm,在波长260~280 nm没有明显吸收峰,说明大鲵肉肌基质蛋白中弹性蛋白肽的芳香族氨基酸含量较少。
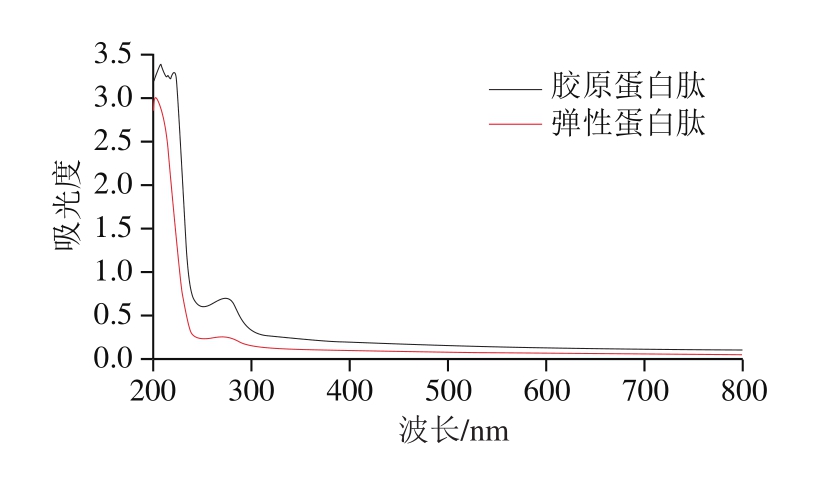
图2 大鲵肉肌基质蛋白中胶原蛋白肽和弹性蛋白肽紫外光谱图
Fig.2 UV spectra of collagen-derived and elastin-derived peptides from muscle matrix protein of giant salamander
2.3 胶原蛋白肽和弹性蛋白肽红外光谱分析
在红外光谱中,红外辐射样品,其中一部分被吸收,一部分被透射,不同的样品会产生不同的红外光谱。由图3可知,2 种样品有相似的红外光谱特征吸收峰,均在酰胺A带(3 295.37 cm-1左右)、酰胺B带(2 925.90 cm-1左右)和酰胺Ⅱ带(1 500~1 600 cm-1)有明显的吸收峰,但也存在一定差异。酰胺A带与N—H和—OH基团伸缩振动有关,波数区间为3 300~3 340 cm-1,2 种样品在3 295.37 cm-1有特征吸收峰,可能是因为氢键的形成,N—H基团的伸缩振动向低波数移动100 cm-1[25]。胶原蛋白肽在1 657.09 cm-1处有明显吸收峰,位于酰胺Ⅰ带(1 600~1 660 cm-1),是C=O基团的特征谱带,在1 243.73 cm-1处有明显吸收峰,位于酰胺Ⅲ带(1 245~1 235 cm-1),是胶原蛋白特有吸收峰,说明胶原蛋白肽具有三螺旋结构[26]。弹性蛋白肽在1 398.54 cm-1处有明显吸收峰,可能是C—H弯曲振动引起的[27]。
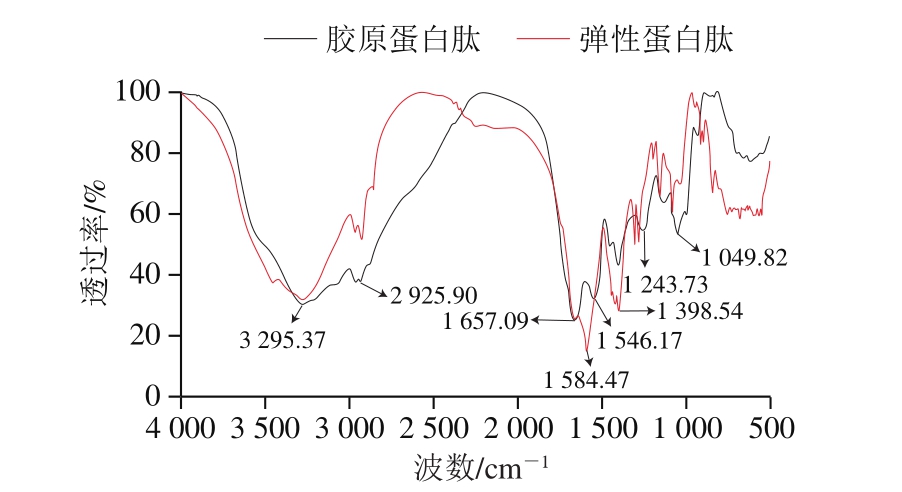
图3 大鲵肉肌基质蛋白中胶原蛋白肽和弹性蛋白肽红外光谱图
Fig.3 Infrared spectra of collagen-derived peptide and elastin-derived peptides from muscle matrix protein of giant salamander
2.4 胶原蛋白肽和弹性蛋白肽氨基酸组成及含量测定结果
蛋白质的生物活性与其氨基酸分布及R基团和芳香族氨基酸侧链组成密切相关[28]。由表1可知:大鲵肉肌基质蛋白中胶原蛋白肽和弹性蛋白肽含有7 种人体必需氨基酸,分别是苏氨酸、缬氨酸、甲硫氨酸、苯丙氨酸、异亮氨酸、亮氨酸和赖氨酸;胶原蛋白肽TAA和必需氨基酸含量均高于弹性蛋白肽,这是因为大鲵肉肌基质蛋白中胶原蛋白含量高于弹性蛋白;与胶原蛋白肽氨基酸组成相比,弹性蛋白肽HAA含量相对较高,AAA含量较低,这与紫外光谱结果一致;弹性蛋白肽中谷氨酸、天冬氨酸、甘氨酸、丙氨酸、缬氨酸、脯氨酸和亮氨酸含量相对较高,组氨酸、胱氨酸、甲硫氨酸含量较低,均低于1.00 g/100 g,符合刘洋[29]所测不同酶解时间弹性蛋白水解产物的总氨基酸组成。
表1 胶原蛋白肽和弹性蛋白肽氨基酸组成及含量
Table 1 Amino acid composition and content of collagen-derived and elastin-derived peptides g/100 g
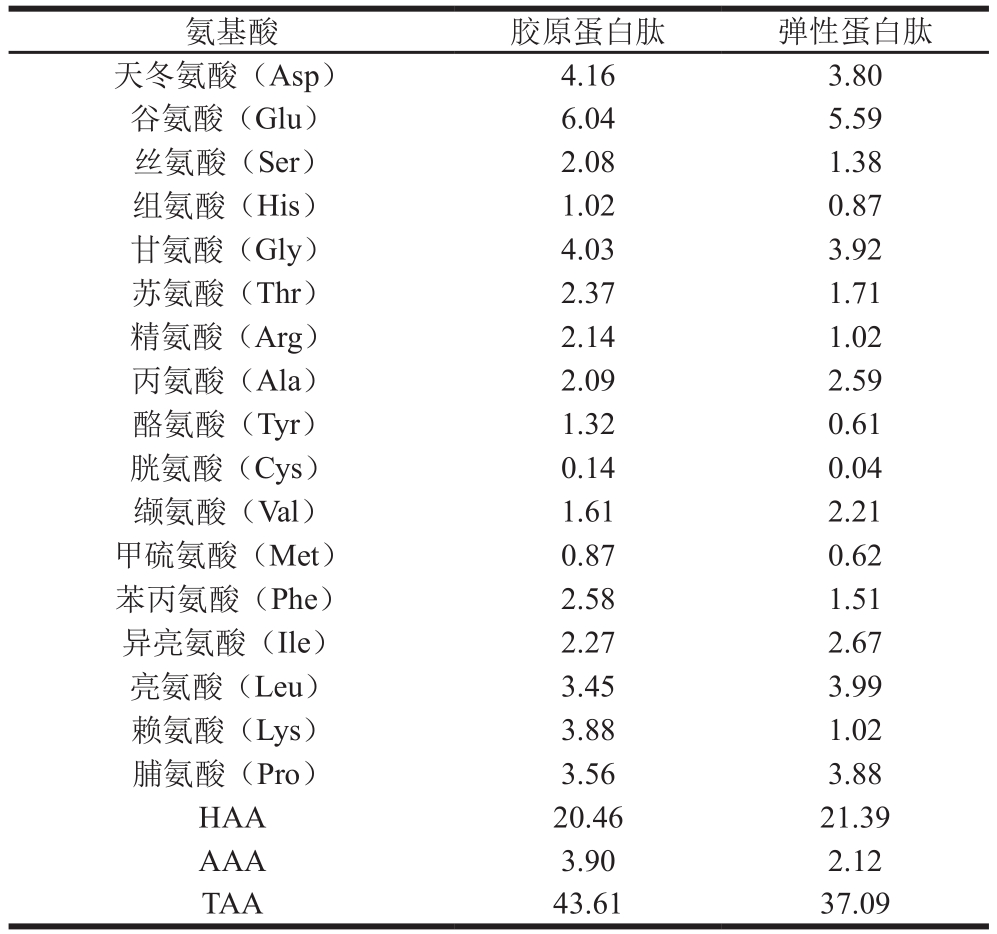
注:HAA.疏水性氨基酸(hydrophobic amino acids);AAA.芳香族氨基酸(aromatic amino acids);TAA.总氨基酸(total amino acid)。
氨基酸 胶原蛋白肽 弹性蛋白肽天冬氨酸(Asp) 4.16 3.80谷氨酸(Glu) 6.04 5.59丝氨酸(Ser) 2.08 1.38组氨酸(His) 1.02 0.87甘氨酸(Gly) 4.03 3.92苏氨酸(Thr) 2.37 1.71精氨酸(Arg) 2.14 1.02丙氨酸(Ala) 2.09 2.59酪氨酸(Tyr) 1.32 0.61胱氨酸(Cys) 0.14 0.04缬氨酸(Val) 1.61 2.21甲硫氨酸(Met) 0.87 0.62苯丙氨酸(Phe) 2.58 1.51异亮氨酸(Ile) 2.27 2.67亮氨酸(Leu) 3.45 3.99赖氨酸(Lys) 3.88 1.02脯氨酸(Pro) 3.56 3.88 HAA 20.46 21.39 AAA 3.90 2.12 TAA 43.61 37.09
2.5 胶原蛋白肽和弹性蛋白肽SDS-PAGE测定结果
由图4可知,在分子质量13~150 kDa的Marker标记范围内,几乎没有胶原蛋白肽和弹性蛋白肽的条带存在,说明在酶解作用下,大鲵肉肌基质蛋白中胶原蛋白和弹性蛋白大分子完全被酶解为小于13 kDa的小分子多肽。
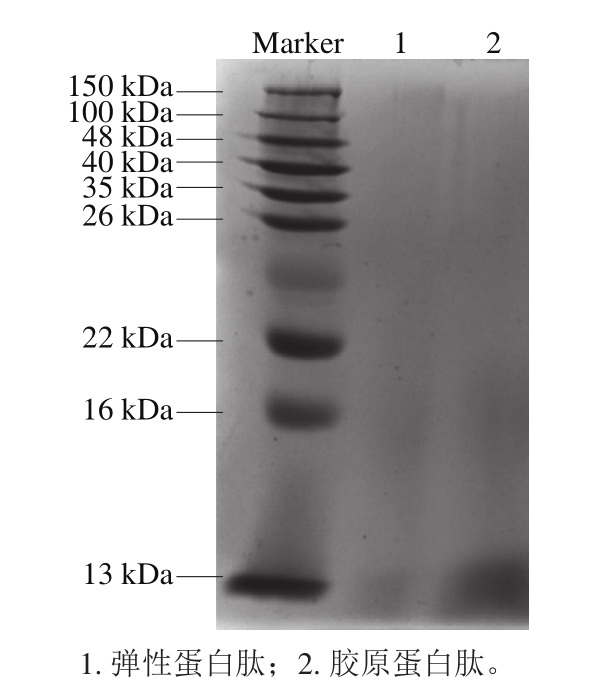
图4 大鲵肉肌基质蛋白中胶原蛋白肽和弹性蛋白肽SDS-PAGE图
Fig.4 SDS-PAGE profiles of collagen-derived and elastin-derived peptides from muscle matrix protein of giant salamander
2.6 胶原蛋白肽和弹性蛋白肽物理特性测定结果
2.6.1 黏度
蛋白黏度的主要影响因素是其分子质量、温度、浓度等。由图5可知,在相同浓度、温度下,弹性蛋白肽样品在SP2和SP3转子下的黏度分别为(0.050±0.002)、(0.089±0.003)Pa·s,高于胶原蛋白肽的(0.027±0.002)、(0.067±0.002)Pa·s,这可能是因为弹性蛋白肽的分子质量较大,使其黏度高于胶原蛋白肽[30]。
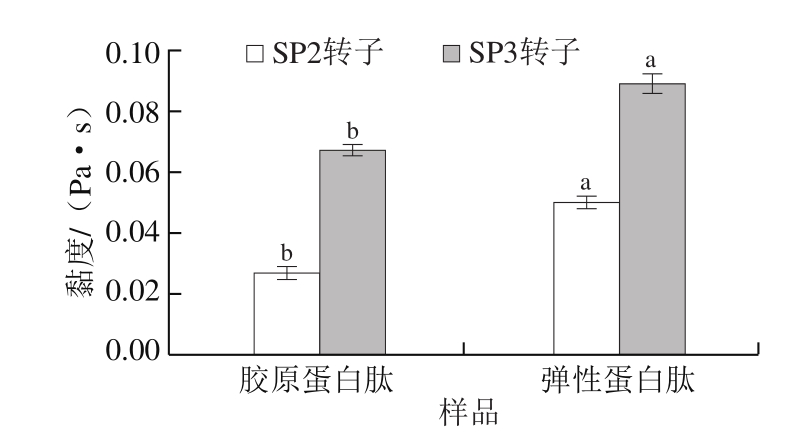
图5 大鲵肉肌基质蛋白中胶原蛋白肽和弹性蛋白肽黏度
Fig.5 Viscosity of collagen-derived and elastin-derived peptides from muscle matrix protein of giant salamander
小写字母不同,表示相同转子、不同样品间差异显著(P<0.05)。
2.6.2 扫描电子显微镜观察
由图6可知,大鲵肉肌基质蛋白分别用胶原蛋白酶和弹性蛋白酶酶解后,其微观结构明显不同,胶原蛋白肽结构呈海绵状,片状较大,交联度高;弹性蛋白肽结构呈现出大小不一的碎片状,结构较为松散,交联度较低。

图6 大鲵肉肌基质蛋白中胶原蛋白肽和弹性蛋白肽扫描电子显微镜图(×740)
Fig.6 Scanning electron micrographs of collagen-derived and elastin-derived peptides from muscle matrix protein of giant salamander (× 740)
A、B为不同角度胶原蛋白肽;C、D为不同角度弹性蛋白肽。
2.7 胶原蛋白肽和弹性蛋白肽体外抗氧化活性
2.7.1 DPPH自由基清除率
由图7可知,胶原蛋白肽和弹性蛋白肽对DPPH自由基均有一定的清除作用,在样品质量浓度为2.0~10.0 mg/mL,随着样品质量浓度增大,对DPPH自由基的清除能力增大。在10 mg/mL时,胶原蛋白肽对DPPH自由基清除率为(72.05±1.17)%,其半抑制质量浓度(IC50)为6.95 mg/mL,高于弹性蛋白肽对DPPH自由基的清除率(62.12±1.34)%,IC50为8.48 mg/mL。这可能是因为胶原蛋白肽中氨基酸含量高于弹性蛋白肽。而抗坏血酸的清除能力较强,在质量浓度为0.5 mg/mL时DPPH自由基清除率已超过90%。
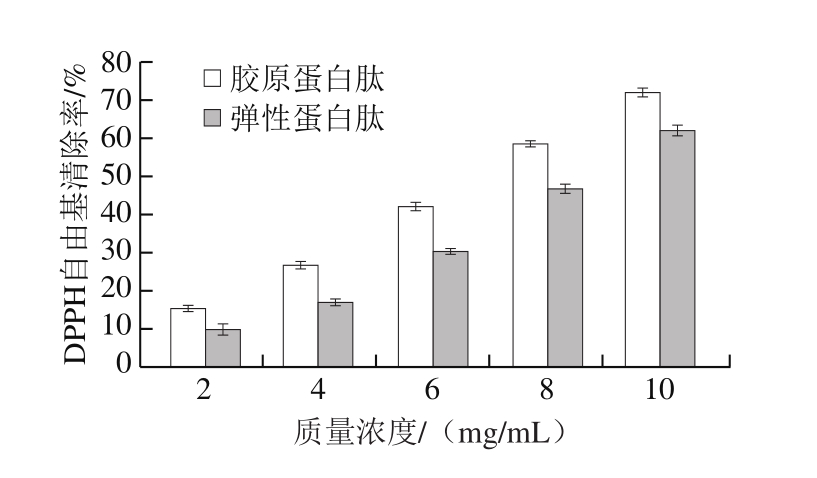
图7 大鲵肉肌基质蛋白中胶原蛋白肽和弹性蛋白肽对DPPH自由基的清除率
Fig.7 DPPH radical scavenging effect of collagen-derived and elastin-derived peptides from muscle matrix protein of giant salamander
2.7.2 O-2·清除率
由图8可知,胶原蛋白肽和弹性蛋白肽对O-2·均有一定的清除作用,在样品质量浓度为2.0~10.0 mg/mL范围内,随着样品质量浓度增大,对O-2·清除能力增大。在10 mg/mL时,胶原蛋白肽对O-2·的清除率为(75.47±0.58)%,其IC50为6.39 mg/mL,高于弹性蛋白肽对O-2·的清除率(64.34±1.34)%,IC50为8.17 mg/mL。而抗坏血酸的清除能力较强,在质量浓度为0.5 mg/mL时O-2·清除率已超过90%。
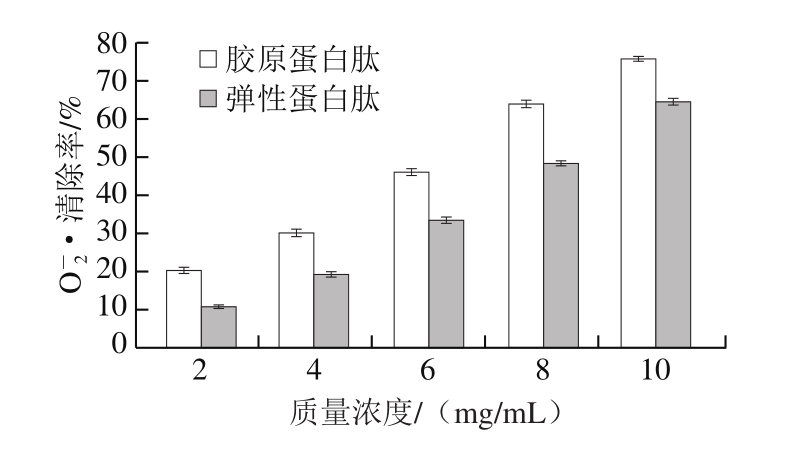
图8 大鲵肉肌基质蛋白中胶原蛋白肽和弹性蛋白肽对O-2·的清除率
Fig.8 Superoxide anion radical scavenging effect of collagen-derived and elastin peptides from muscle matrix protein of giant salamander
3 结 论
以大鲵肌肉中提取获得的肌基质蛋白为原料,分别用胶原蛋白酶及弹性蛋白酶酶解制备胶原蛋白肽和弹性蛋白肽,研究其基础特性,并测定其对DPPH自由基、O-2·的清除能力。结果表明,按料液比1∶2、加酶量1%,在37 ℃条件下,分别用胶原蛋白酶(pH 7.0)和弹性蛋白酶(pH 7.8)酶解肉渣4.5 h,得到胶原蛋白酶的提取率为(45.11±2.11)%,高于弹性蛋白酶的提取率(37.36±2.98)%,说明大鲵肉肌基质蛋白中胶原蛋白的含量高于弹性蛋白。
胶原蛋白肽紫外吸收波长主要为210~230、260~280 nm,而弹性蛋白肽主要为200~220 nm,在波长260~280 nm没有明显吸收,表明弹性蛋白肽中芳香族氨基酸含量较少;胶原蛋白肽和弹性蛋白肽的红外光谱图均在酰胺A带(3 295.37 cm-1左右)、酰胺B带(2 925.90 cm-1左右)和酰胺Ⅱ带(1 500~1 600 cm-1)带有特征吸收峰,胶原蛋白肽在1 243.73 cm-1处有明显吸收峰,位于酰胺Ⅲ带(1 245~1 235 cm-1),是胶原蛋白特有吸收峰,说明胶原蛋白肽具有三螺旋结构。胶原蛋白肽和弹性蛋白肽中氨基酸组成丰富,含有7 种人体必需氨基酸,其中必需氨基酸含量分别占总氨基酸的42.61%和44.54%,胶原蛋白肽氨基酸总量和必需氨基酸含量均高于弹性蛋白肽。
SDS-PAGE分析结果表明,大鲵肉肌基质蛋白中胶原蛋白和弹性蛋白大分子蛋白完全被酶解为分子质量小于13 kDa的小分子多肽;胶原蛋白肽和弹性蛋白肽均具有一定的黏性,在相同浓度下,弹性蛋白肽黏性高于胶原蛋白肽;扫描电子显微镜结果表明,不同酶酶解大鲵肉肌基质蛋白后样品的微观结构不同,与胶原蛋白肽结构相比,弹性蛋白肽结构较为松散,交联度较低。体外抗氧化实验结果表明,胶原蛋白肽和弹性蛋白肽对DPPH自由基、O-2·均具有良好的清除效果,且质量浓度与清除率呈正比,胶原蛋白肽清除能力优于弹性蛋白肽,说明将大鲵肉肌浆蛋白、肌原纤维蛋白提取后的剩余肉渣,仍可以利用胶原蛋白酶和弹性蛋白酶制备胶原蛋白肽和弹性蛋白肽,提高大鲵肉的利用率及经济价值。
[1]马东林, 杨絮, 郭全友, 等.大鲵营养组成、功能成分及加工利用研究进展[J].食品与发酵工业, 2020, 46(24): 242-248.DOI:10.13995/j.cnki.11-1802/ts.024606.
[2]KIRKNESS M W H, LEHMANN K, FORDE N R.Mechanics and structural stability of the collagen triple helix[J].Current Opinion in Chemical Biology, 2019, 53: 98-105.DOI:10.1016/j.cbpa.2019.08.001.
[3]HE Dong, ZHU Wenming, ZENG Wen, et al.Nutritional and medicinal characteristics of Chinese giant salamander (Andrias davidianus) for applications in healthcare industry by artificial cultivation: a review[J].Food Science and Human Wellness, 2018,7(1): 1-10.DOI:10.1016/j.fshw.2018.03.001.
[4]李林强, 昝林森.中国大鲵肌内脂肪酸组成及其抗氧化研究[J].食品工业科技, 2010, 31(1): 364-366.DOI:10.13386/j.issn1002-0306.2010.01.066.
[5]李莉, 顾赛麒, 王锡昌, 等.人工养殖大鲵肌肉和鲵皮营养成分分析及评价[J].食品工业科技, 2012, 33(24): 385-388.DOI:10.13386/j.issn1002-0306.2012.24.059.
[6]杨慧, 陈德经, 陈海涛, 等.不同冻结方式对大鲵肉品质的影响[J].食品科技, 2019, 44(5): 121-127.DOI:10.13684/j.cnki.spkj.2019.05.023.
[7]胡云峰, 路敏, 胡晗艳, 等.气调小包装对冷鲜人工养殖大鲵分割肉货架品质的影响[J].食品与发酵工业, 2015, 41(5): 199-202.DOI:10.13995/j.cnki.11-1802/ts.201505036.
[8]徐阳, 孙强, 青维, 等.复合酶法制备大鲵多肽的研究[J].食品工业科技, 2015, 36(24): 180-185; 189.DOI:10.13386/j.issn1002-0306.2015.24.030.
[9]董梦尧, 陈德经, 杨慧, 等.大鲵肌肉与皮中胶原蛋白比较研究[J].肉类研究, 2020, 34(12): 11-17.DOI:10.7506/rlyj1001-8123-20200917-226.
[10]杨慧, 陈德经, 陈海涛, 等.大鲵肌肉分离蛋白特性[J].肉类研究,2020, 34(7): 28-32.DOI:10.7506/rlyj1001-8123-20200515-121.
[11]SAN A J D, JACENKO O, FERTALA A, et al.Collagen structurefunction mapping informs applications for regenerative medicine[J].Bioengineering, 2020, 8(1): 1-23.DOI:10.3390/bioengineering8010003.
[12]陈诗妍.胶原蛋白在食品中的应用分析[J].现代食品, 2019(18):27-28; 31.DOI:10.16736/j.cnki.cn41-1434/ts.2019.18.009.
[13]GIROTTI A, FERNÁNDEZ-COLINO A, LÓPEZ I M, et al.Elastinlike recombinamers: biosynthetic strategies and biotechnological applications[J].Biotechnology Journal, 2011, 6(10): 1174-1186.DOI:10.1002/biot.201!00116.
[14]VAZQUEZ-PORTALATIN N, ALFONSO-GARCIA A, LIU J C, et al.Physical, biomechanical, and optical characterization of collagen and elastin blend hydrogels[J].Annals of Biomedical Engineering, 2020,48(12): 2924-2935.DOI:10.1007/s10439-020-02605-x.
[15]毛瑞雪, 刘睿, 刘欣然, 等.胶原蛋白肽生理功能的研究进展[J].中国食物与营养, 2021, 27(7): 49-53.DOI:10.19870/j.cnki.11-3716/ts.2021.07.007.
[16]曾允灏, 陈德经, 兰晨, 等.胶原蛋白肽补充方式对皮肤中羟脯氨酸的影响[J].日用化学品科学, 2022, 45(4): 25-28; 42.
[17]ZHANG Zejun, ZHU Huawei, ZHENG Yating, et al.The effects and mechanism of collagen peptide and elastin peptide on skin aging induced by D-galactose combined with ultraviolet radiation[J].Journal of Photochemistry and Photobiology B: Biology, 2020, 210: 111964.DOI:10.1016/j.jphotobiol.2020.111964.
[18]刘娜娜, 李汀, 王凡凡, 等.弹性蛋白在化妆品中的应用研究进展[J].化学工程与装备, 2018(4): 242-243.DOI:10.19566/j.cnki.cn35-1285/tq.2018.04.090.
[19]SIONKOWSKA A, SKOPINSKA-WISNIEWSKA J, GAWRON M,et al.Chemical and thermal cross-linking of collagen and elastin hydrolysates[J].International Journal of Biological Macromolecules,2010, 47(4): 570-577.DOI:10.1016/j.ijbiomac.2010.08.004.
[20]陈德经.大鲵黏液、皮肤及肉中氨基酸分析[J].食品科学, 2010,31(18): 375-376.
[21]朱云飞, 初正云, 李洪江.SDS-PAGE凝胶电泳法对不同种鹿茸蛋白质差异化研究[J].辽宁中医药大学学报, 2017, 19(6): 48-51.DOI:10.13194/j.issn.1673-842x.2017.06.013.
[22]罗敏, 陈德经, 韩豪, 等.硒化米胚多糖的抗氧化性[J].食品科学,2018, 39(19): 58-63.DOI:10.7506/spkx1002-6630-2018190010.
[23]ZENG Ni, ZHANG Guowen, HU Xing, et al.Mechanism of fisetin suppressing superoxide anion and xanthine oxidase activity[J].Journal of Functional Foods, 2019, 58: 1-10.DOI:10.1016/j.jff.2019.04.044.
[24]化璟琳, 谢莹莹, 徐鹤然, 等.胶原蛋白肽分析方法及透皮吸收特征[J].中国组织工程研究, 2021, 25(34): 5544-5551.
[25]王杉杉.牦牛皮胶原蛋白的提取及其活性肽的制备[D].绵阳: 西南科技大学, 2018.
[26]WU Wenmin, HE Lichao, LIANG Yanhui, et al.Preparation process optimization of pig bone collagen peptide-calcium chelate using response surface methodology and its structural characterization and stability analysis[J].Food Chemistry, 2019, 284: 80-89.DOI:10.1016/j.foodchem.2019.01.103.
[27]陶琳丽, 黄伟, 杨秀娟, 等.20 种氨基酸近红外光谱及其分子结构的相关性[J].光谱学与光谱分析, 2016, 36(9): 2766-2773.DOI:10.3964/j.issn.1000-0593(2016)09-2766-08.
[28]KARAMI Z, AKBARI-ADERGANI B.Bioactive food derived peptides: a review on correlation between structure of bioactive peptides and their functional properties[J].Journal of Food Science and Technology, 2019, 56(2): 535-547.DOI:10.1007/s13197-018-3549-4.
[29]刘洋.弹性蛋白肽的抗皮肤光老化功效及其作用机制研究[D].广州: 华南理工大学, 2019.DOI:10.27151/d.cnki.ghnlu.2019.000329.
[30]王碧, 王坤余, 贾冬英, 等.胶原蛋白及多肽的黏度特性[J].中国皮革, 2003, 32(11): 22-25.DOI:10.3969/j.issn.1001-6813.2003.11.005.