脂肪是肉制品的重要原料之一,能够直接影响肉品的感官、营养、安全等特性。利用植物油替代动物脂肪能减少脂肪带来的胆固醇和饱和脂肪酸含量,并且能较好保持肉制品的整体风味。肌原纤维蛋白(myofibrillar protein,MP)是畜禽肌肉中含量最高的蛋白质,其乳化特性对乳化型肉糜类制品的保水保油性、质地等均有显著影响。因此,已有许多学者研究了不同种类油脂条件下MP的乳化性及其结构变化。吴满刚[1]比较在分别添加花生油和猪油的条件下,猪肉MP的乳化活性指数(emulsifying activity index,EAI)、乳化稳定性指数(emulsifying stability index,ESI)和二级结构。孙迪[2]在分别添加猪油、大豆油、黄油的条件下,测定猪肉MP的EAI、ESI和二级结构,发现在添加大豆油时MP的乳化稳定性最好,添加猪油居中,添加黄油时最差,并认为乳状液的稳定性与二级结构有关。陈晨[3]分别利用鱼油、棕榈油、玉米油制备牛肉MP乳液,结果表明,含15%鱼油的MP乳液的乳化稳定性最好。作为我国特有的植物油,山茶油含有多种天然抗氧化物,如茶多酚、山茶苷,能预防多种疾病的发生并延缓衰老[4-6]。Wang Xiaoxi等[7]制备山茶油凝胶乳液来替代部分哈尔滨香肠中的猪肉脂肪,发现哈尔滨香肠的品质得到改善。Luo Shuizhong等[8]制备了以山茶油乳液为基质的脂肪替代品,通过稳定性测试、微观结构、流变学特性等表征发现,乳液具有优良的贮藏稳定性和乳化特性。Zhou Xi等[9]利用山茶油、魔芋葡甘露聚糖、角叉菜胶制备涂膜剂,此涂膜剂能抑制鸡肉中脂质和蛋白质的氧化。本团队研究了添加山茶油对鸡肉MP凝胶特性的影响[10-11],但目前少有关于研究山茶油对鸡肉MP乳化性影响的报道。
高速剪切均质(high-speed shear homogenization,HSSH)是制备乳状液的技术之一,能使油脂短暂、快速地分散在水相中,并在乳化剂的作用下形成乳液。Kong Xiangzhen等[12]报道,HSSH处理能显著提高核桃饮料的稳定性。Zhou Lei等[13-14]研究不同HSSH处理条件下MP凝胶特性和结构的变化趋势。Li Ruren等[15]研究不同剪切均质速率对MP-橄榄油乳液稳定性的影响。目前关于HSSH处理对MP乳化特性影响的报道几乎没有。本研究旨在探讨在山茶油存在条件下,不同剪切速率和时间的HSSH处理对MP乳化活性、乳化稳定性、二级结构和三级结构的影响,并测定与之相关的溶解度和粒径变化,为HSSH技术应用于乳化型肉制品加工提供理论依据。
1 材料与方法
1.1 材料与试剂
肉鸡(质量约2 kg)购于南京市一养鸡场,屠宰后取鸡胸肉并存放在冰箱冷冻室中。
山茶油 杭州久晟生物科技有限公司;乙醇、KH2PO4、KCl、HCl、K2HPO4、NaN3、二硫苏糖醇、十二烷基硫酸钠、5,5’-二硫代双(2-硝基苯甲酸)(5,5’-dithio-bis(2-nitrobenzoic acid),DTNB)、8-苯胺基-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)、乙二醇双(2-氨基乙基醚)四乙酸(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
Avanti J-26XP高速冷冻离心机 美国Beckman Coulter公司;DS-1高速组织捣碎机 上海标本模型厂;T10 Basic高速剪切均质机 德国IKA公司;U-3900紫外分光光度仪、F-7000荧光分光光度计 日本日立公司;LABRAM 800激光拉曼光谱仪 法国Jobin Yvon公司;Nano-ZS90 Zeta电位分析仪 英国马尔文公司。
1.3 方法
1.3.1 MP提取
将鸡胸肉从冰箱中取出化冻20 min后,先去除包膜等杂质,再切成体积约1 mm3的小肉丁,挑出带结缔组织和脂肪的小肉丁弃去,剩余的纯肌肉丁用Han Keying等[16]的方法提取MP。
1.3.2 样品处理
用磷酸盐-氯化钾缓冲液(含10 mmol/L KH2PO4、0.6 mol/L KCl,pH 6.0)配制质量浓度为10 mg/mL的MP溶液。取24 mL MP溶液于100 mL烧杯内,加入6 mL山茶油并充分混合,用高速剪切均质机对混合液进行HSSH处理,在预实验的基础上,将剪切速率确定为11 500、14 500、20 500 r/min,时间确定为3、5、7 min,对2因素的3水平进行组合,共得到9 组不同HSSH处理的新鲜乳液。此新鲜乳液直接用于MP溶解度的测定;将乳液稀释为MP质量浓度分别为1.000、0.500、0.250、0.125 mg/mL,用于表面疏水性的测定;MP质量浓度为1 mg/mL的乳液用于除溶解度和表面疏水性外的其他指标测定。
1.3.3 乳化活性和乳化稳定性测定
利用紫外分光光度计测定MP-山茶油乳液中MP的EAI和ESI[17]。取0.050 mL稀释乳液与5 mL 0.1 g/100 mL十二烷基硫酸钠充分混合后,在500 nm波长处测定吸光度(A0)。将稀释乳液放置3 h再取0.050 mL进行同样的处理后测定吸光度(A1),EAI和ESI分别按照式(1)~(2)计算。
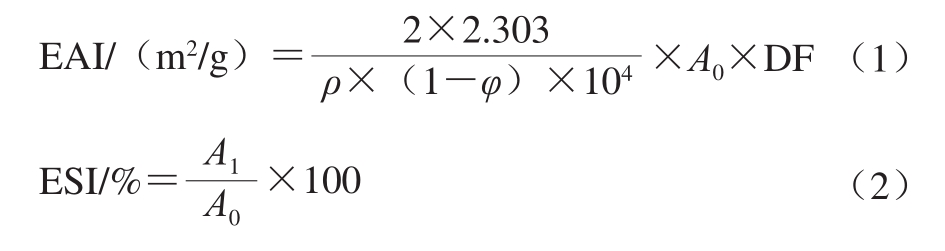
式中:ρ为MP质量浓度/(g/mL);φ为油脂体积分数(0.2);DF为稀释因子(100)。
1.3.4 溶解度测定
将1.3.2节制备的新鲜乳液进行冷冻离心(10 000×g、10 min、4 ℃),MP的溶解度按式(3)计算,实验重复3 次[18]。
1.3.5 粒径测定
采用Zeta电位仪测定乳液的粒径,测定参数为:散射角90°、平衡时间2 min、温度25 ℃。实验重复测定3 次。
1.3.6 二级结构测定
参照本实验室Zhang Ziye等[19]的方法,用拉曼光谱仪进行测定。设定拉曼光谱的激光波长和频率分别为515 nm和10 mW,狭缝为200 μm。将样品置于载玻片上,调节好焦距,测定波数400~2 000 cm-1内的伸缩振动强度。通过波数1 660~1 670 cm-1内的强度变化对MP的二级结构含量进行测定。各处理组进行3 次平行实验。
1.3.7 表面疏水性测定
使用荧光分光光度计测定乳液中MP表面疏水性(S0)[20]。测定前预先将经HSSH处理的新鲜乳液进行稀释,得到MP质量浓度分别为1.000、0.500、0.250、0.125 mg/mL的系列乳液样品。将4 mL样品分别与20 μL ANS缓冲液(含8 mmol/L ANS、0.1 mol/L K2HPO4,pH 6.0)反应25 min后进行测定。
1.3.8 活性巯基含量测定
采用Zhang Ziye等[20]的方法测定样品中活性巯基含量。将5.5 mL稀释乳液与0.1 mL Ellman试剂(含0.01 mol/L DTNB、0.01 mmol/L K2HPO4,pH 6.0)混合均匀并反应完全后,用紫外分光光度计测定其吸光度。测定条件为波长412 nm、比色皿厚度1 cm。按照式(4)计算巯基含量,各处理组进行3 次平行实验。
式中:ρ为MP质量浓度/(g/mL);D为稀释系数(D=1.02)。
1.4 数据处理
使用SPSS 24.0软件进行方差分析,采用Duncan’s multiple range test分析各组间显著差异性(P<0.05)。
2 结果与分析
2.1 不同剪切处理条件下MP的乳化活性和乳化稳定性
由图1可知:当剪切时间一致,即同为3、5 min或7 min时,随着剪切速率增加,MP的EAI均呈显著升高趋势,且剪切7 min的样品均明显高于剪切3、5 min的样品;而剪切速率相同时,EAI随剪切时间延长而显著增加(P<0.05);20 500 r/min、7 min和115 00 r/min、3 min分别是EAI获得最大值和最小值的处理条件。机械剪切能导致蛋白质一定程度的变性,分子链展开,疏水基团暴露,从而改变其乳化性能[21]。Zhou Lei等[14]研究鸡脂肪乳液中MP的乳化活性时也发现,HSSH处理能增加MP的EAI。
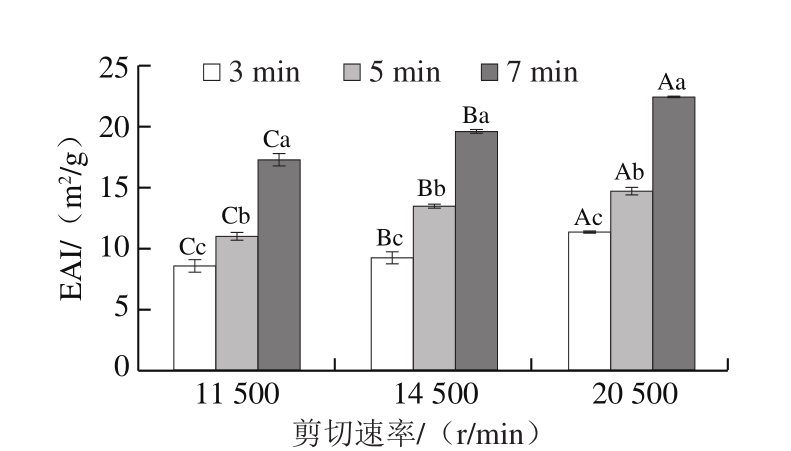
图1 不同剪切速率和时间条件下MP的EAI
Fig.1 EAI of MP at different shear rates and times
大写字母不同,表示相同剪切时间、不同剪切速率组间差异显著(P<0.05);小写字母不同,表示相同剪切速率、不同剪切时间组间差异显著(P<0.05)。图2~4、6~7同。
由图2可知:在剪切速率14 500 r/min条件下,ESI几乎不受剪切时间影响且均获得较高值(>90%),说明此剪切速率下的乳液稳定性最好;而低于和高于此速率时,延长剪切时间对ESI造成显著的不良影响(P<0.05),特别是经20 500 r/min、7 min处理的样品,在放置3 h后甚至出现了肉眼可见的分层状态,ESI降低到2.45%。分析相同剪切时间、不同剪切速率对ESI的影响时发现,在剪切3 min时,剪切速率14 500 r/min与20 500 r/min对ESI没有显著影响,但显著优于11 500 r/min;剪切时间为5 min和7 min时,剪切速率14 500 r/min时的ESI明显高于其他2 个剪切速率。依据EAI和ESI进行评价,发现HSSH处理条件为14 500 r/min、7 min时,MP具有较好的乳化活性和乳化稳定性。
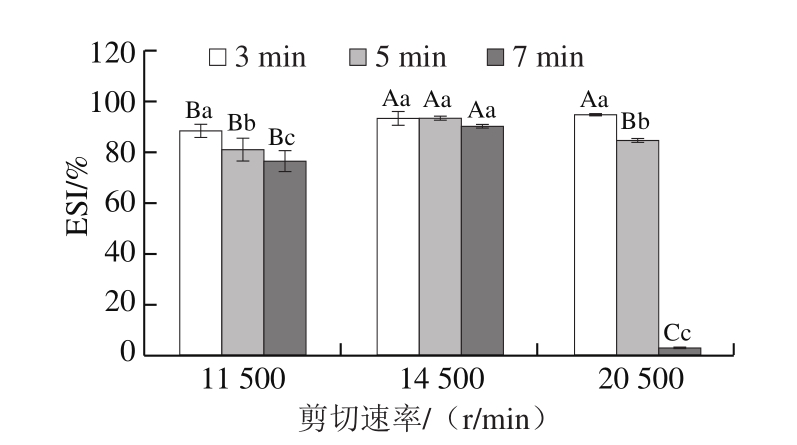
图2 不同剪切速率和时间条件下MP的ESI
Fig.2 ESI of MP at different shear rates and times
2.2 不同剪切处理条件下MP的溶解度
由图3可知,剪切速率为14 500 r/min乳液中MP溶解度明显高于剪切速率11 500 r/min和20 500 r/min乳液中MP溶解度。在剪切速率为14 500 r/min乳液中,剪切时间3 min时MP溶解度获得最大值70.36%,显著高于处理5 min时的67.76%和处理7 min时的61.19%。MP溶解度最小值的处理条件为20 500 r/min、7 min,仅为16.42%。适当的HSSH处理能打散MP的聚集状态,使MP分子均匀分散,增加其与水和油的接触面积,从而导致其溶解度和乳化性能的增加[14]。但过度的HSSH处理导致MP溶解度降低,这可能是MP分子变性程度增大引起的。这种HSSH处理与超声波处理导致蛋白质溶解度的变化趋势一致[22],而HSSH处理与超声波处理均能产生空穴效应[23]。
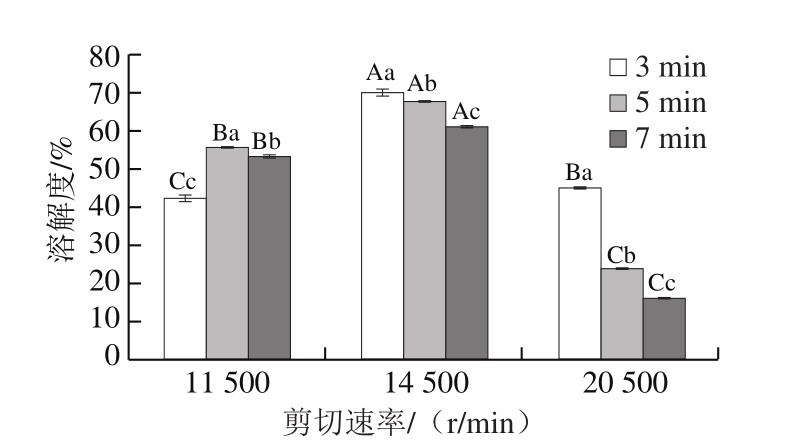
图3 不同剪切速率和时间条件下乳液中MP的溶解度
Fig.3 Solubility of MP in emulsions at different shear rates and times
2.3 不同剪切处理条件下乳液的液滴粒径
由图4可知:剪切速率为11 500 r/min时,剪切3 min的乳液粒径显著高于剪切5、7 min的乳液粒径(P<0.05);而剪切速率为14 500、20 500 r/min乳液中,样品粒径均随剪切时间延长而明显增大。HSSH处理条件为14 500 r/min、3 min和20 500 r/min、7 min时,乳液样品粒径分别出现最小值和最大值。机械剪切能打断蛋白质间的非共价键,导致其聚集体解聚,因而能降低样品粒径,但过度处理则导致颗粒发生聚集。Zhou Lei等[14]在对MP-鸡脂乳液进行高速剪切处理1 min时也发现,剪切速率低于14 500 r/min时能降低乳液粒径,剪切速率进一步增大则导致乳液粒径迅速增大。对蛋白质进行高压均质处理时也出现相似的趋势,即适当的均质处理能降低蛋白质粒径,而过度处理则引起蛋白质分子聚集[24-25]。
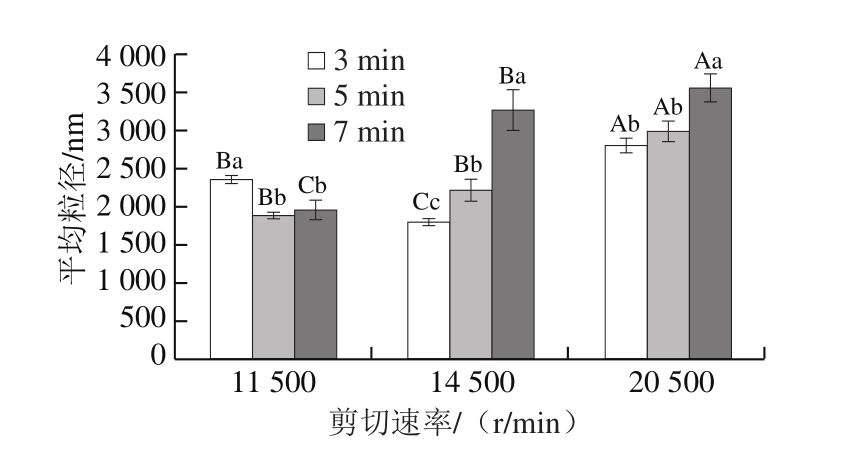
图4 不同剪切速率和时间条件下乳液液滴的粒径
Fig.4 Emulsion droplet size at different shear rates and times
2.4 不同剪切处理条件下MP的二级结构
由图5和表1可知,11 500、14 500 r/min组乳状液中MP的α-螺旋、β-转角、β-折叠和无规卷曲结构含量随时间延长变化趋势均一致,即前2 个指标随着时间延长逐渐下降,后2 个指标则显著升高(P<0.05)。剪切速率为20 500 r/min组的乳状液中,α-螺旋含量随着时间延长显著升高(P<0.05),β-转角含量没有发生显著变化,β-折叠和无规卷曲含量则逐渐降低。Zhou Lei等[14]对MP进行HSSH处理时,其α-螺旋和β-折叠的含量变化趋势与11 500 r/min、14 500 r/min组乳状液的变化趋势一致,并且他们认为MP的二级结构展开有助于乳化性的提高。
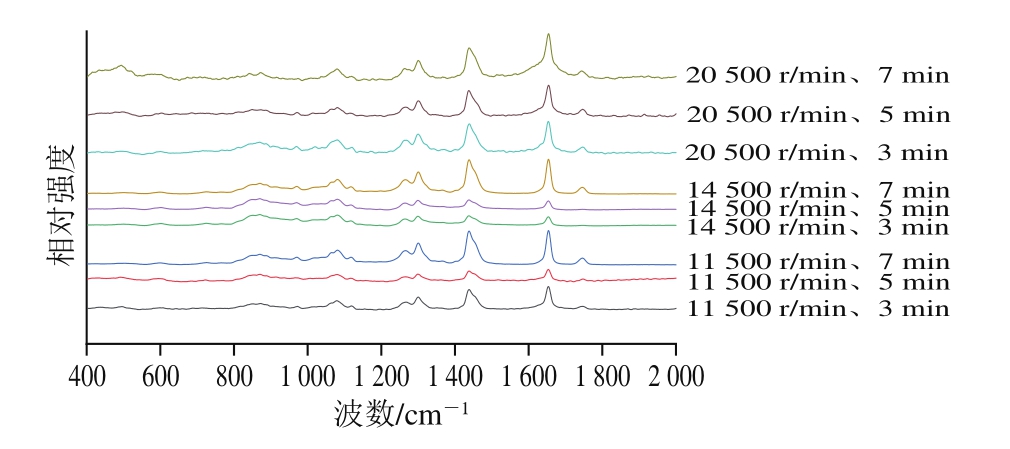
图5 不同剪切速率和时间条件下乳液中MP的拉曼光谱
Fig.5 Raman spectra of MP in emulsions at different shear rates and times
表1 不同剪切速率和时间条件下MP的二级结构含量
Table 1 Secondary structures of MP in emulsions at different shear rates and times%
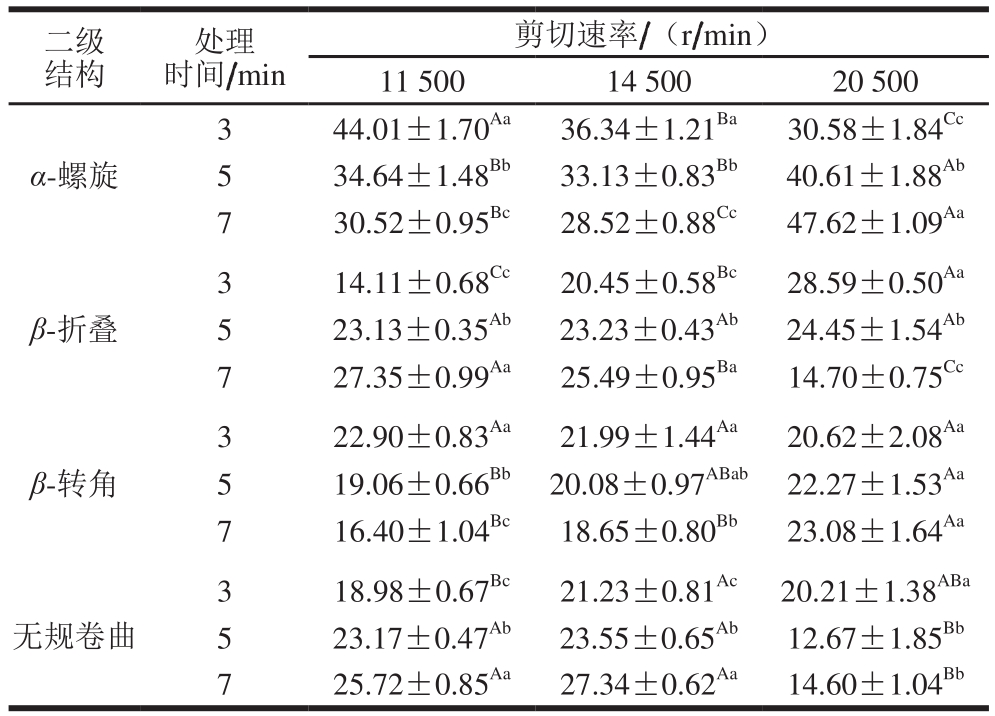
注:同行大写字母不同,表示相同剪切时间、不同剪切速率组间差异显著(P<0.05);同列小写字母不同,表示相同剪切速率、不同剪切时间组间差异显著(P<0.05)。
二级结构处理时间/min剪切速率/(r/min)11 500 14 500 20 500 α-螺旋3 44.01±1.70Aa 36.34±1.21Ba 30.58±1.84Cc 5 34.64±1.48Bb 33.13±0.83Bb 40.61±1.88Ab 7 30.52±0.95Bc 28.52±0.88Cc 47.62±1.09Aa β-折叠3 14.11±0.68Cc 20.45±0.58Bc 28.59±0.50Aa 5 23.13±0.35Ab 23.23±0.43Ab 24.45±1.54Ab 7 27.35±0.99Aa 25.49±0.95Ba 14.70±0.75Cc β-转角3 22.90±0.83Aa 21.99±1.44Aa 20.62±2.08Aa 5 19.06±0.66Bb 20.08±0.97ABab 22.27±1.53Aa 7 16.40±1.04Bc 18.65±0.80Bb 23.08±1.64Aa无规卷曲3 18.98±0.67Bc 21.23±0.81Ac 20.21±1.38ABa 5 23.17±0.47Ab 23.55±0.65Ab 12.67±1.85Bb 7 25.72±0.85Aa 27.34±0.62Aa 14.60±1.04Bb
2.5 不同剪切处理条件下MP的表面疏水性
蛋白质三级结构的形成是不同基团之间相互作用的结果,疏水氨基酸残基的重新分布是蛋白质高级结构改变的重要特征之一[26],因此通过蛋白质疏水氨基酸残基的暴露情况可以从侧面反映蛋白质三级结构的变化[27]。
由图6可知:11 500 r/min与14 500 r/min组乳状液中MP的S0随剪切时间延长变化趋势一致,剪切5 min时样品的S0比剪切3 min时略大,并明显大于剪切7 min时的S0;20 500 r/min组乳状液中MP的S0随剪切时间延长而显著增加(P<0.05)。在所有9 份处理样品中,获得S0最大值的处理条件为20 500 r/min、7 min,表明此时MP的三级结构最大程度展开,暴露出最大量的疏水基团。蛋白质的S0适当增加能使其具有更好的乳化性[28];但过度的HSSH处理(如20 500 r/min、7 min)却导致MP的乳化稳定性明显变差(图2),Zhou Lei等[14]用HSSH处理鸡脂肪-MP乳液时也得到了相同的结论。这是因为分布在蛋白质表面的大量疏水基团之间产生了强烈的疏水相互作用,乳液间相互吸引,因此乳液的稳定性变差,液滴间容易发生聚集。处理条件为20 500 r/min、7 min的样品S0、ESI和粒径之间的关系为上述观点提供了证据。
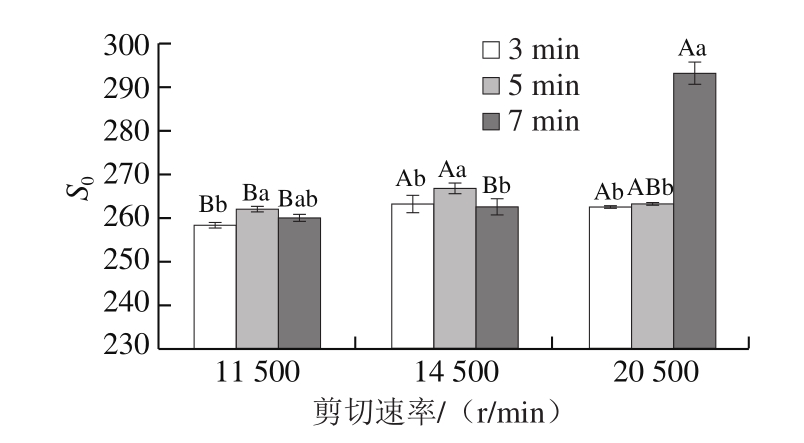
图6 不同剪切速率和时间条件下MP的S0
Fig.6 S0 of MP in emulsions at different shear rates and times
2.6 不同剪切处理条件下MP的活性巯基含量
活性巯基是指暴露在蛋白质分子表面的巯基[29],活性巯基变化能从另一个侧面反映出蛋白质三级结构的变化[23]。由图7可知:对相同剪切速率的3 组乳状液而言,MP活性巯基含量均随剪切时间延长而逐渐增加;对剪切时间相同的3 组乳状液而言,MP活性巯基含量则均随剪切速率增加而显著增加(P<0.05)。在所有9 份处理样品中,11 500 r/min、3 min和20 500 r/min、7 min分别是活性巯基含量最小值和最大值的样品处理条件。说明剪切时间延长、剪切速率增加均导致MP三级结构破坏程度增加,更多的巯基基团暴露于蛋白质分子表面。活性巯基含量与S0获得最大值的HSSH处理条件相同,2 个指标从不同侧面反映了MP分子三级结构的展开程度。MP分子高级结构的过度展开会导致乳液的稳定性下降。大豆蛋白的ESI也随着活性巯基含量增加出现先增加后下降的变化趋势[30]。
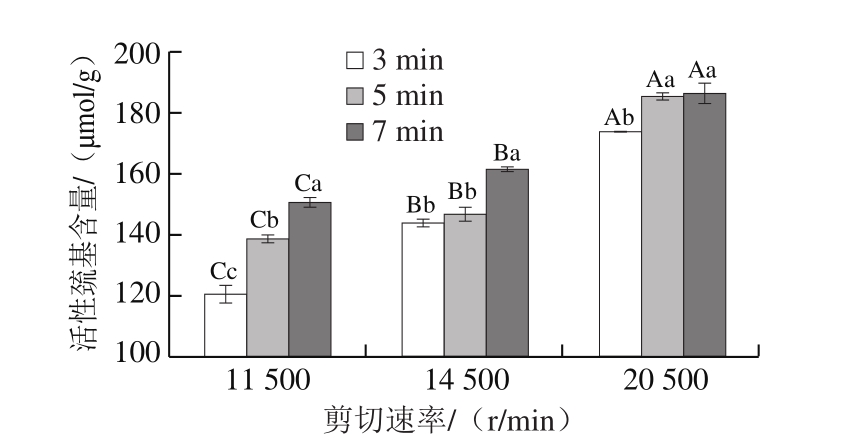
图7 不同剪切速率和时间条件下乳液中MP活性巯基含量
Fig.7 Reactive sulfhydryl content of MP in emulsions at different shear rates and times
3 结 论
MP-山茶油乳液中MP的EAI随剪切速率(11 500~20 500 r/min)增加和剪切时间(3~7 min)延长而增大。在20 500 r/min条件下处理7 min时,乳液的乳化活性最好但乳化稳定性最差,放置3 h后ESI降到2.45%;在剪切速率为14 500 r/min时,ESI几乎不受剪切时间影响且均获得高值(>90%)。综合EAI和ESI,HSSH处理MP乳液的最佳条件为14 500 r/min、7 min。剪切速率为14 500 r/min的处理组MP溶解度最高。剪切速率为11 500 r/min与14 500 r/min组乳状液中MP的二级结构含量随剪切时间延长变化趋势一致,即α-螺旋和β-转角含量随剪切时间延长逐渐下降,β-折叠和无规卷曲含量显著升高(P<0.05);剪切时间与剪切速率的增加均导致MP三级结构破坏程度增加,更多疏水基团和巯基基团暴露于蛋白质分子表面。活性巯基含量与S0均在20 500 r/min条件下剪切7 min后获得最大值。MP分子的二、三级结构变化显著影响其乳化特性。适当的HSSH导致MP分子适度展开,改善MP的乳化活性和乳化稳定性;但过度剪切却致使乳状液失稳,这是由于分布在蛋白质表面的大量疏水基团之间能产生强烈的疏水相互作用,乳液液滴间相互吸引,更易发生聚集,因此乳液的稳定性变差。
[1]吴满刚.脂肪和淀粉对肌原纤维蛋白凝胶性能的影响机理[D].无锡: 江南大学, 2010: 1-11.
[2]孙迪.不同脂肪对肌原纤维蛋白乳化液稳定性及肉糜凝胶特性的影响[D].锦州: 渤海大学, 2019: 7-10.
[3]陈晨.不同油脂处理对肌原纤维蛋白乳化液稳定性及牛肉糜凝胶特性的影响[D].南京: 南京财经大学, 2021: 1-9.DOI:10.27705/d.cnki.gnjcj.2021.000087.
[4]WANG Xiaoqin, ZENG Qumei, MARÍA D M C, et al.Profiling and quantification of phenolic compounds in camellia seed oils: natural tea polyphenols in vegetable oil[J].Food Research International, 2017,102(12): 184-194.DOI:10.1016/j.foodres.2017.09.089.
[5]ZHOU Xuxia, JIANG Shan, ZHAO Dandan, et al.Changes in physicochemical properties and protein structure of surimi enhanced with camellia tea oil[J].LWT-Food Science and Technology, 2017,84: 562-571.DOI:10.1016/j.lwt.2017.03.026.
[6]毛方华, 王鸿飞, 周明亮.山茶油的功能特性[J].食品科技, 2010,35(1): 181-185.
[7]WANG Xiaoxi, XIE Yangyang, LI Xingmin, et al.Effects of partial replacement of pork back fat by a camellia oil gel on certain quality characteristics of a cooked style Harbin sausage[J].Meat Science,2018, 146: 154-159.DOI:10.1016/j.meatsci.2018.08.011.
[8]LUO Shuizhong, HU Xiangfang, PAN Lihua, et al.Preparation of camellia oil-based W/O emulsions stabilized by tea polyphenol palmitate: structuring camellia oil as a potential solid fat replacer[J].Food Chemistry, 2019, 276: 209-217.DOI:10.1016/j.foodchem.2018.09.161.
[9]ZHOU Xi, ZONG Xinxiang, ZHANG Min, et al.Effect of konjac glucomannan/carrageenan-based edible emulsion coatings with camellia oil on quality and shelf-life of chicken meat[J].International Journal of Biological Macromolecules, 2021, 183: 331-339.DOI:10.1016/j.ijbiomac.2021.04.165.
[10]韩柯颖, 冯潇, 杨玉玲, 等.添加山茶油对肌原纤维蛋白凝胶特性的影响[J].中国农业科学, 2021, 54(20): 4446-4455.
[11]HAN Keying, FENG Xiao, YANG Yuling, et al.Effects of camellia oil on the properties and molecular forces of myofifibrillar protein gel induced by microwave heating[J].International Journal of Food Science and Technology, 2021, 56(11): 5708-5716.DOI:10.1111/IJFS.15089.
[12]KONG Xiangzhen, ZHANG Lina, LU Xu, et al.Effect of high-speed shearing treatment on dehulled walnut proteins[J].LWT-Food Science and Technology, 2019, 116: 108500.DOI:10.1016/j.lwt.2019.108500.
[13]ZHOU Lei, FENG Xiao, YANG Yuling, et al.Effects of high-speed shear homogenization on properties and structure of the chicken myofibrillar protein and low-fat mixed gel[J].LWT-Food Science and Technology, 2019, 110: 19-24.DOI:10.1016/j.lwt.2019.04.061.
[14]ZHOU Lei, FENG Xiao, YANG Yuling, et al.Effects of high-speed shear homogenization on the emulsifying and structural properties of myofibrillar protein under low-fat conditions[J].Journal of the Science of Food and Agriculture, 2019, 99(14): 6500-6508.DOI:10.1002/jsfa.9929.
[15]LI Ruren, HE Qing, RONG Liangyan, et al.High homogenization speeds for preparing unstable myofibrillar protein-olive oil emulsions[J].Journal of Food Science, 2019, 84(5): 1113-1121.DOI:10.1111/1750-3841.14502.
[16]HAN Keying, LI Shanshan, YANG Yuling, et al.Mechanisms of inulin addition affecting the properties of chicken myofibrillar protein gel[J].Food Hydrocolloids, 2022, 131: 107843.DOI:10.1016/j.foodhyd.2022.107843.
[17]LI Yan, LI Fangfang, LIU Gongming, et al.The characteristics of gelation of myofibrillar proteins combined with salt soluble Rhodotorula glutinis proteins by enzymatic crosslinking[J].Food Chemistry, 2020, 343:128505.DOI:10.1016/j.foodchem.2020.128505.
[18]CHEN Lin, CHEN Jianshe, YU Lin, et al.Improved emulsifying capabilities of hydrolysates of soy protein isolate pretreated with high pressure microfluidization[J].LWT-Food Science and Technology,2016, 69: 1-8.DOI:10.1016/j.lwt.2016.01.030.
[19]ZHANG Ziye, YANG Yuling, ZHOU Peng, et al.Effects of high pressure modification on conformation and gelation properties of myofibrillar protein[J].Food Chemistry, 2017, 217: 678-686.DOI:10.1016/j.foodchem.2016.09.04.
[20]ZHANG Ziye, YANG Yuling, TANG Xiaozhi, et al.Effects of ionic strength on chemical forces and functional properties of heat-induced myofibrillar protein gel[J].Food Science and Technology Research,2015, 21(4): 597-605.DOI:10.3136/fstr.21.597.
[21]王璋, 许时婴, 汤坚.食品化学[M].北京: 中国轻工业出版社, 2016:128-139.
[22]WANG Jingyu, YANG Yuling, TANG Xiaozhi, et al.Effects of pulsed ultrasound on rheological and structural properties of chicken myofibrillar protein[J].Ultrasonics Sonochemistry, 2017, 38: 225-233.DOI:10.1016/j.ultsonch.2017.03.018.
[23]高友生, 徐凯, 张裕中.高剪切均质在果蔬汁均质中的应用[J].包装与食品机械, 2003(4): 5-7.DOI:10.3969/j.issn.1005-1295.2003.04.002.
[24]SONG Xiaozhou, ZHOU Chengjun, FU Feng, et al.Effect of highpressure homogenization on particle size and film; properties of soy protein isolate[J].Industrial Crops and Products, 2013, 43(1): 538-544.DOI:10.1016/j.indcrop.2012.08.005.
[25]YU Cuiping, WU Fan, CHA Yue, et al.Effects of high-pressure homogenization on functional properties and structure of mussel(Mytilus edulis) myofibrillar proteins[J].International Journal of Biological Macromolecules, 2018, 118: 741-746.DOI:10.1016/j.ijbiomac.2018.06.134.
[26]李珊珊.大豆低聚糖、菊糖、桃胶多糖对肌原纤维蛋白凝胶特性的影响[D].南京: 南京财经大学, 2021: 21-23.DOI:10.27705/d.cnki.gnjcj.2021.000064.
[27]LIU Ru, ZHAO Siming, XIE Bijun, et al.Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties[J].Food Hydrocolloids, 2011, 25(5): 898-906.DOI:10.1016/j.foodhyd.2010.08.016.
[28]CHEN Xing, ZHOU Ruiyun, XU Xinglian, et al.Structural modification by high-pressure homogenization for improved functional properties of freeze-dried myofibrillar proteins powder[J].Food Research International, 2017, 100(1): 193-200.DOI:10.1016/j.foodres.2017.07.007.
[29]ZHAO Yan, CHEN Zhangyi, LI Jianke, et al.Formation mechanism of ovalbumin gel induced by alkali[J].Food Hydrocolloids, 2016, 61:390-398.DOI:10.1016/j.foodhyd.2016.04.041.
[30]李慧娜.大豆分离蛋白和浓缩蛋白乳液稳定性的比较及改性研究[D].郑州: 河南工业大学, 2018: 1-10.