亚硝酸盐作为一种发色剂及抑菌剂被广泛应用于肉制品加工[1]。然而,亚硝酸盐可与肉制品中多种氨基化合物作用生成具有致癌性的亚硝基化合物,如亚硝胺是一类强致癌物质[2]。如果亚硝酸盐添加过量,轻者会造成机体缺氧,重者会生成强致癌物,对人体具有致癌、致畸及致突变作用[3]。随着食品安全意识和绿色食品观念愈发深入人心,人们对肉制品中添加亚硝酸盐持消极态度[4]。最近几年,生物医学相关研究报道,NO能实现对多种细菌较好的抑制效果[5],因此,如果将NaNO2直接转化成NO进行抑菌,可在根源上阻断亚硝基化合物的生成,进而降低致癌致突变风险。由于NO的半衰期较短(3~5 s)[6-8],这一特性极大限制了NO作为一种抑菌剂被应用于肉品表面抑菌,亟待探索能控制NaNO2缓慢释放NO的控释技术来延缓NO的释放速率,进而延长NaNO2的抑菌效果。
微球是一种用高分子材料制备、包埋一种或多种药物的微小球状聚合物,其粒径从几微米到几百微米[9]。由于微球具有比表面积大、表面能高、流动性和扩散性好、载药率和封装率高等特点,已成为一种应用比较广泛的药物载体形式[10]。微球可持续几周至几个月释放包埋的药物,并且可以控制药物的释放行为,并最终达到长期有效的治疗作用,同时还能保护药物,尤其是蛋白多肽类药物不受破坏或减少破坏[11-12]。常用的制备微球的高分子材料主要分为天然高分子材料、半合成及合成高分子材料三大类。其中,天然高分子材料由于其来源广泛、性质稳定、无毒、价格低廉、可生物降解和成球性好等优点获得了广泛关注,主要包括明胶、壳聚糖、海藻酸钠、血清蛋白等[13]。
明胶是由动物皮肤、骨、肌腱等结缔组织中的胶原部分降解而成的白色或淡黄色、半透明、微带光泽的薄片或粉粒。由于其来源广泛、性质稳定、无毒、价格低廉、可生物降解、生物相容性好、容易发生交联反应且易于被化学改性等优点,明胶纳米和微球在组织工程和药物递送等应用中引起广泛关注[14]。按照制备方法不同,明胶可分为2 类,胶原蛋白经过酸性预处理可得到A型明胶,经过碱性预处理得到B型明胶[15]。A型和B型明胶具有不同的性质,碱性预处理产生的B型明胶具有更大的羧基比例,使B型明胶带负电荷并降低了B型明胶的等电点(等电点为4~5);而经酸预处理产生的A型明胶具有更大的等电点(等电点为8~9)[16]。明胶包裹、保护和释放抑菌剂的功能特性与其组成和结构具有非常大的相关性[17]。因此,A型和B型明胶制备的微球物理物化性质及被包埋物质的释放情况也可能存在显著差异。
本研究通过油包水乳化交联法,利用谷氨酰胺转氨酶(transglutaminase,TGase)交联A型和B型明胶制备包埋NaNO2的明胶微球,分别命名为A型明胶微球(gelatin type A microspheres,GAMs)与B型明胶微球(gelatin type B microspheres,GBMs),并对其物理化学特性进行表征,最后将GAMs与GBMs应用于牛肉干和猪肉脯进行防腐保鲜效果研究,以期为缓释微球在肉制品防腐抑菌方面的应用提供理论参考,同时降低使用NaNO2带来的危害。
1 材料与方法
1.1 材料与试剂
牛肉干 内蒙古蒙都羊业食品股份有限公司;猪肉脯 湖北良品铺子食品工业有限公司。
A型、B型明胶 上海茂康生物科技有限公司;食品级玉米油 山东三星玉米产业科技有限公司;TGase(1 mL,120 U/mL) 天津市西玛试剂公司;Griess试剂 西格玛上海贸易有限公司;平板计数琼脂 青岛海博生物有限公司;其他试剂均为分析纯。
1.2 仪器与设备
TDZ5-WS离心机 湘仪离心机仪器有限公司;Thermo Nicolet Avatar 370傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 德国布鲁克仪器公司;Model 680多功能酶标仪 美国Bio-Rad公司;SU 1510扫描电子显微镜(scanning electron microscope,SEM)日本Hitachi公司;MARS 60动态流变仪 德国哈克公司;Bettersize 2600激光粒度仪丹东百特仪器有限公司。
1.3 方法
1.3.1 明胶微球的制备
参考Tian Xiaojing等[18]的方法。将1 g明胶(A、B型)粉末溶于20 mL去离子水中,用磁力搅拌器将溶液在50~55 ℃的水浴中搅拌至完全溶解,然后加入100 mg NaNO2。将TGase(0、10、20、30、40 U/g)添加到明胶溶液中,通过持续搅拌的方式交联2 h。将交联后的溶液逐滴加入到160 mL预热玉米油(55 ℃)中,玉米油含乳化剂Span 80(2 mL)和Tween-80(1 mL),搅拌1 h。将乳液在持续搅拌的条件下冷却至室温,然后在冰水浴条件下将乳液超声处理10 min(功率200 W、超声3 s、间歇2 s)以形成微球。为了继续固化明胶微球,将反应体系的容器置于冰水浴中持续搅拌30 min。向乳液混合物中加入100 mL预冷的无水乙醇(4 ℃),在冰水浴中搅拌30 min以洗涤微球。采用顶置式机械搅拌器以400 r/min的速率持续搅拌30 min直到洗涤步骤结束。使用真空抽滤装置将微球与玉米油和无水乙醇分离,将分离的微球在100 mL预冷的无水乙醇中洗涤2 次,然后将获得的GAMPs与GBMPs(粉末状)放置在4 ℃条件下保存。
1.3.2 明胶微球的表征
1.3.2.1 SEM观察明胶微球形态
参考Tian Xiaojing等[18]的方法。将1~2 mg明胶微球放在二氧化硅晶片上,用导电胶将其粘在样品台上,然后在氩气环境下将所有样品喷金处理3 min,加速电压6.0 kV,放大倍数1 000 倍。
1.3.2.2 明胶微球粒径测定
使用激光粒度分析仪测量微球的粒径,将0.5 g微球分散在5 mL去离子水中测定其粒径分布,该仪器的测量范围为0.02~2 600.00 μm。将微球的水分散液添加到测量室中(600 mL),遮光率达到5%~10%即可开始测定。
1.3.2.3 明胶微球的FTIR测定
使用FTIR仪获取微球的FTIR图。取1 mg冻干的微球粉末加入研钵中,加入150 mg溴化钾研细并移入模具中进行压片处理。对每个样品进行4 000~500 cm-1的扫描,并通过Omnic 8.2软件进行分析。
1.3.2.4 明胶微球的流变学特性测定
使用动态流变仪测定微球水分散液的流变学特性(室温),用珀尔帖效应系统控制温度。
黏度测定:取0.1 g不同浓度TGase交联的明胶微球分散在2 mL去离子水中,在室温下进行黏度测定。将剪切速率从0.1 s-1增加到100.0 s-1,测定黏度与剪切速率的关系。
频率扫描:使用振荡幅度扫描测定微球的线性黏弹性区域,在1 Pa的固定应力下进行动态振荡频率扫描,并绘制微球的弹性模量(G’)和黏性模量(G”)随频率变化曲线(频率扫描范围0.1~10.0 Hz)。
1.3.2.5 明胶微球中NO释放量测定
参考Sarkar等[19]的方法,使用Griess试剂盒测定明胶微球在120 h内NO的累积释放量。将0.03 g微球粉末悬浮在1 mL 3 g/100 mL抗坏血酸溶液中,并置于37 ℃培养箱,以100 r/min速率避光振荡。在每个测定时间点,收集150 μL上述溶液上清液,并补充等量的抗坏血酸溶液,-20 ℃冷冻直至进行测定。取50 μL解冻的样品加入到96 孔板中,随后将50 μL Griess试剂(4 g/L)添加到每孔。将孔中的内容物在室温下孵育10 min,使用酶标仪在524 nm波长处测定吸光度。
NO标准曲线的绘制:参考Griess试剂盒说明书,取0.015 g分析纯NaNO2溶于100 mL水中,稀释10 倍得标准溶液。取7 支10 mL比色管,按照试剂盒说明书步骤操作,绘制标准曲线。根据NO标准曲线计算微球中NO的释放量。
1.3.2.6 明胶微球的NaNO2包埋率测定
将0.1 g微球粉末分散到足量的3 g/100 mL抗坏血酸溶液中,放置于37 ℃,直至NaNO2充分转化为NO(4~5 h),加入与微球分散液等量的Griess试剂(4 g/L)测定明胶微球中NO的释放总量,NaNO2包埋率按下式计算。
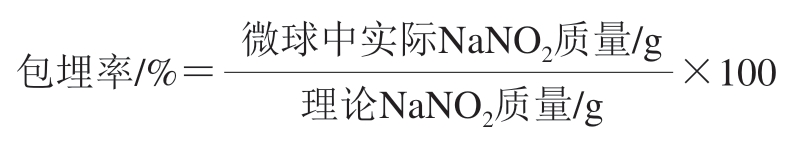
1.3.3 明胶微球对牛肉干和猪肉脯的抑菌防腐效果研究
明胶微球涂敷:综合NaNO2包埋率及NO释放量的研究结果,采用30 U/g TGase交联的明胶微球用于牛肉干和猪肉脯的防腐实验研究。将市售的牛肉干和猪肉脯随机平均分为2 组(对照组和实验组),每组100 g样品,均预先喷涂3 g/100 mL抗坏血酸溶液。TGase添加量为30 U/g的GAMs的NaNO2包埋率为46%,TGase添加量为30 U/g的GBMs的NaNO2包埋率为31%。根据GB 5009.33—2016《食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定》中规定的限值0.15 g NaNO2/kg肉,实验组添加0.42 g GAMs、0.62 g GBMs,添加15 mg NaNO2的样品为对照组,确保实验组与对照组的NaNO2含量相同。喷涂微球后的样品于45 ℃鼓风干燥箱中风干10 min,以除去表面水分,确保干燥前与干燥后水分含量相同,牛肉干水分含量16%,猪肉脯水分含量18%。干燥的样品真空包装后,置于25 ℃条件下进行贮藏。每隔4 d取样1 次,测定菌落总数(total viable colony,TVC)。
TVC测定:牛肉干与猪肉脯中TVC的测定参考GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》中的方法进行测定。
1.4 数据处理
每个处理进行3 次重复实验,通过SPSS 24.0软件进行统计分析。使用单因素方差分析比较样品间的显著性差异(P<0.05)。
2 结果与分析
2.1 明胶微球的表征
2.1.1 明胶微球的微观形态
由图1可知,不加入TGase交联的明胶能成球但成球率低。经过TGase交联的明胶微球显示出接近球形的形态。随着TGase添加量增加(0~30 U/g),微球粒径减小,原因可能是随着交联度的增加,明胶具有较高的致密结构。这一现象可以解释为TGase能催化肽链中谷氨酰胺残基的γ-羧酰胺基团与有机胺中的伯胺基团交联[20-21],进而导致分子内和分子间交联,提高明胶的乳化性能[22]。因此,上升的明胶蛋白乳化能力提高了微球的形成速率。但是,当明胶微球中TGase的添加量为40 U/g时,微球粒径迅速增加,平均粒径为25~40 μm。分析原因主要是添加过量的交联剂可能生成了明胶聚合物,导致微球的粒径增大,一定程度上也会影响NaNO2的负载和NO的释放。与等浓度TGase交联的GAMs(图A)相比,GBMs(图B)的粒径略大些,这可能是因为B型明胶分子经交联后其凝胶强度增加,分子间发生聚集,形成的微球粒径较大。无论是GAMs还是GBMs,各个球体之间都没有表现出明显的黏连,这表明明胶微球具有良好的分散性能。
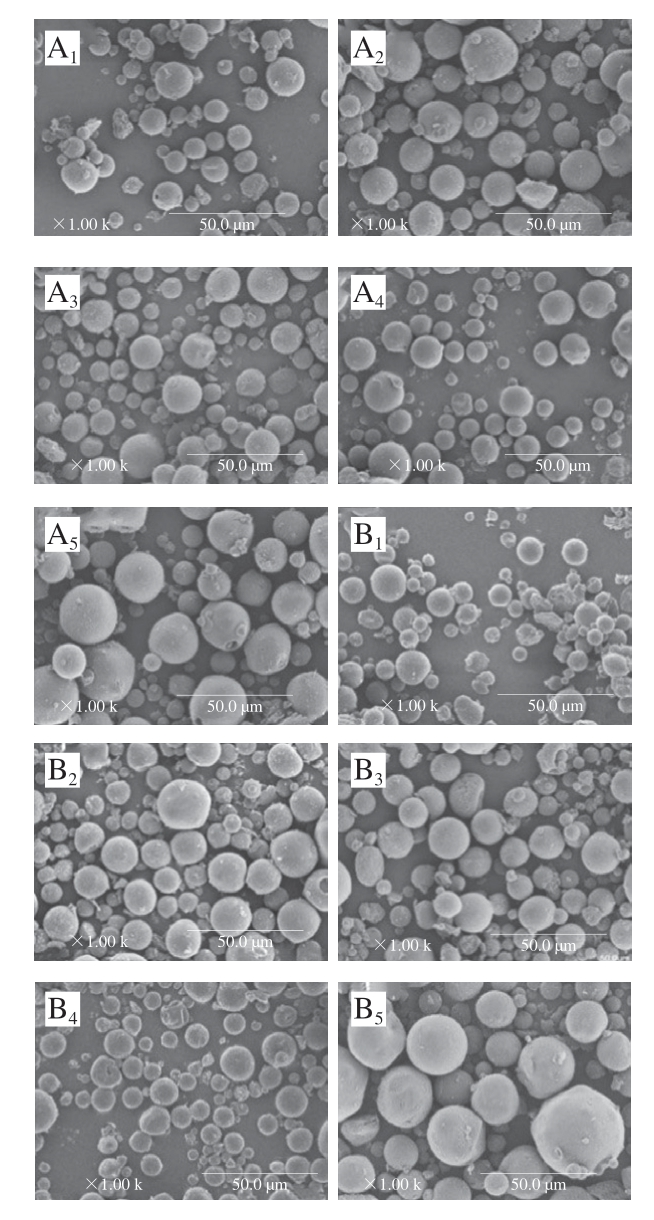
图1 TGase交联、包埋NaNO2的GAMs(A)和GBMs(B)的SEM图
Fig.1 SEM images of GAMs (A) and GBMs (B) cross-linked with TGase loaded with NaNO2
下标1~5.TGase添加量分别为0、10、20、30、40 U/g。
2.1.2 明胶微球的粒径
由图2可知,当TGase添加量为0~30 U/g时,微球的粒径随着TGase添加量的增加而减小,粒径范围为5~35 μm。原因可能是在增大交联剂的量时,明胶大分子在更多的位点以更快的速率发生交联,从而得到粒径逐渐减小的微球[23]。随着TGase添加量进一步增加至40 U/g,微球的粒径迅速增加至39.2 μm,这与SEM观察到的结果相一致。分析原因可能是40 U/g的TGase添加量较高,引起明胶分子过度交联,乳化过程不能够使过度交联的明胶分散成均匀且粒径较小的微球,导致交联效果较差。值得注意的是,没有经过TGase交联的明胶微球,其粒径小于TGase交联的样品,这可能是由于未交联的明胶分子质量小于交联的明胶,导致其粒径较小[24],并且明胶分子碎片较多。与等量的TGase交联,GBMs的粒径比GAMs略大些,这可能是由于A型明胶与TGase交联度较高,在TGase的作用下GAMs分子间和分子内形成更多的氢键和酰胺键,使微球内部结构更加紧密,从而降低了GAMs的溶胀率[25]。
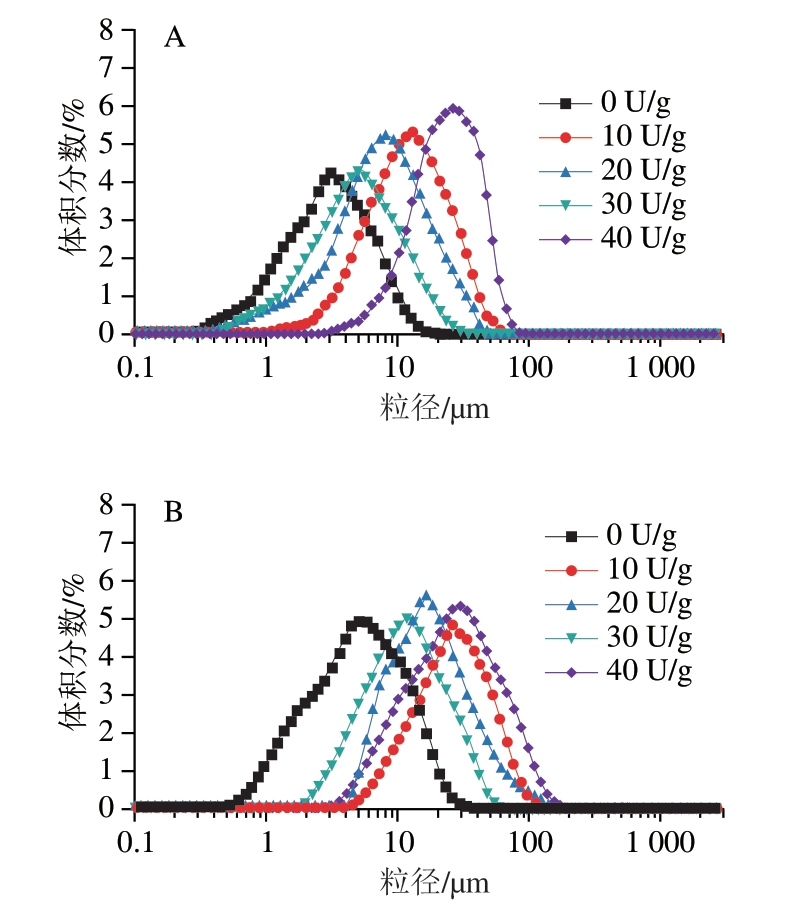
图2 TGase交联的GAMs(A)和GBMs(B)的粒径
Fig.2 Particle size of GAMs (A) and GBMs (B) cross-linked with TGase
2.1.3 明胶微球的FTIR谱图
FTIR可以测定不同添加量TGase交联微球的条带及二级结构变化。由图3可知,经过TGase交联后,酰胺A带的波数随TGase交联程度的增加而降低,这归因于TGase交联明胶形成分子内及分子间氢键。与交联后的GBMs相比,交联后的GAMs酰胺A带的波数降低更显著,形成更多的氢键,这表明A型明胶比B型明胶与TGase交联效果更好,并且GAMs在交联后的结构更稳定。1 600~1 700 cm-1的酰胺Ⅰ带是红外光谱分析蛋白质二级结构最为常用的。1 650 cm-1处的酰胺Ⅰ带的变化主要是由于C=O基团的拉伸振动所致。Li Chunyang等[26]的研究也表明,酰胺Ⅰ带的波长向较低波数的移动与羧基和氨基之间形成的酰胺键有关。NaNO2的红外吸收光谱显示了2 个明显的特征吸收峰,将其与标准NaNO2的红外光谱图比较后,结果一致。NaNO2在1 270、827 cm-1的光谱区域有2 个特征峰,但在明胶微球光谱中NaNO2的特征峰几乎消失,这表明NaNO2被包埋在微球颗粒内部,在明胶微球的表面不存在附着的NaNO2。
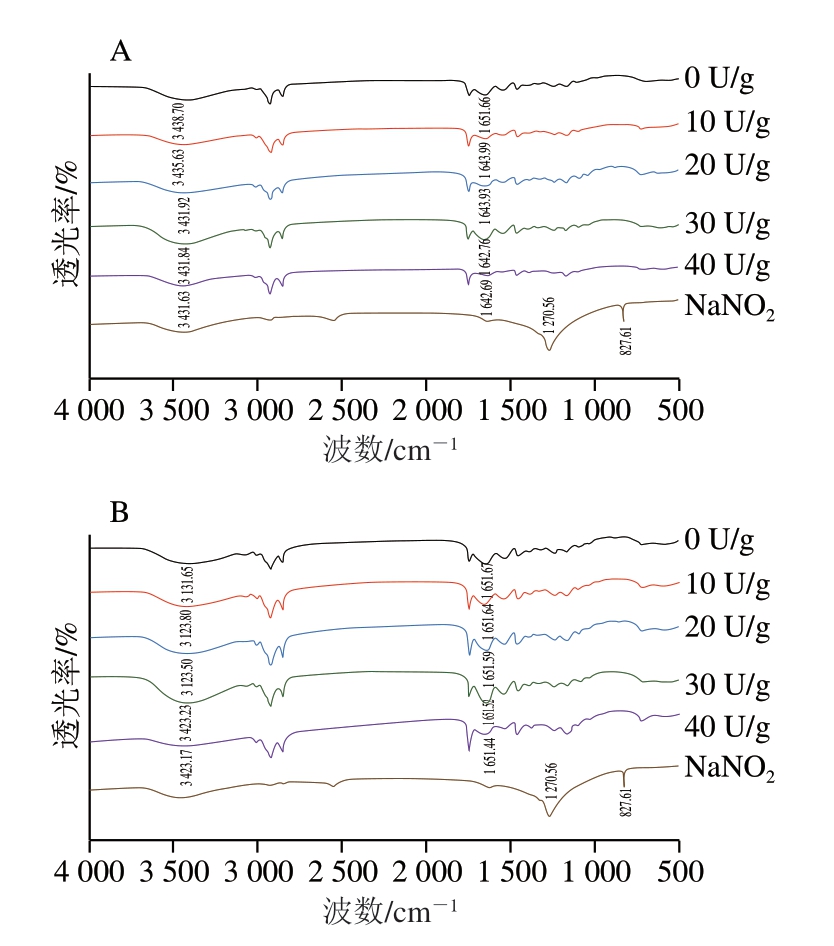
图3 TGase交联的GAMs(A)和GBMs(B)的FTIR图
Fig.3 FTIR spectra of GAMs (A) and GBMs (B) cross-linked with TGase
2.1.4 明胶微球的流变学特性分析
流变学特性对微球的稳定性及物理性能起着至关重要的作用。本研究对微球进行黏度和振荡频率扫描,探讨微球的流变学和微观结构之间的关系。由图4可知,微球的黏度随剪切速率的增加而降低,表明明胶微球水分散液存在剪切稀化行为,呈现出非牛顿流体的流动特性[27]。剪切力破坏了微球内部明胶经TGase交联在分子内及分子间形成的稳定结构,导致其黏度降低。且随着剪切速率的增大,微球结构被破坏的程度增大,因此黏度减小。与未交联的样品相比,添加TGase的明胶微球的黏度增加。这可能是由于明胶与TGase相互作用,导致微球内部分子链的流体动力学半径增加,并抑制了高分子链的迁移[28]。在相同添加量的TGase交联下,GAMs(图4A)比GBMs(图4B)黏度偏高,这是由于GAMs比GBMs与TGase交联效果更好,GAMs比GBMs粒径小,并且在经过TGase交联后形成的GAMs中分子间和分子内作用力增加,结构更稳定[29]。因此,同添加量的TGase交联GAMs的黏度更高。
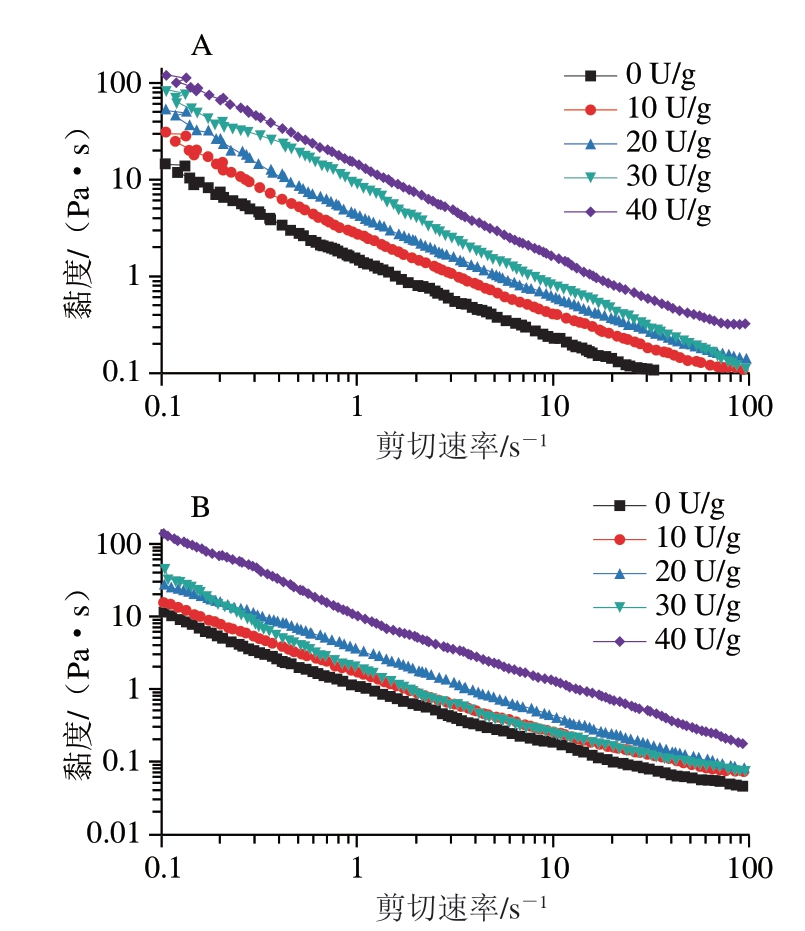
图4 TGase交联的GAMs(A)和GBMs(B)黏度随剪切速率的变化
Fig.4 Viscosity versus shear rate curves of GAMs (A) and GBMs (B)cross-linked with TGase
由图5可知,在0.1~10 Hz的整个测量频率范围内,微球的G’均高于相应的G’’,表现出类固体的黏弹性内部结构。TGase添加量的增加导致G’逐渐增加,而凝胶强度增加则归因于通过TGase介导的酰基转移反应形成的强大交联网络[30]。在相同添加量的TGase交联下,GAMs比GBMs的G’和G’’均偏高,这是由于GAMs比GBMs与TGase交联效果好,形成较强大的交联网络,使凝胶强度增加。
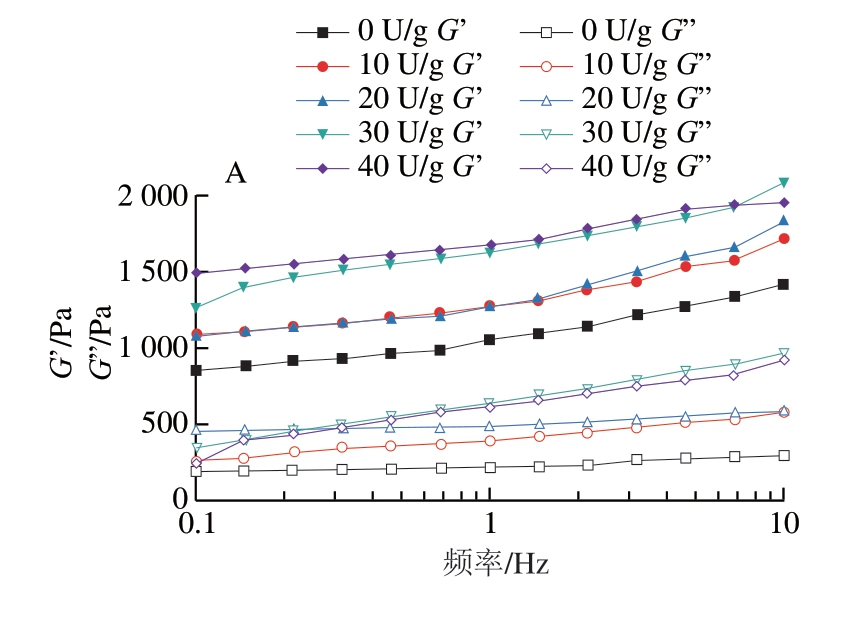
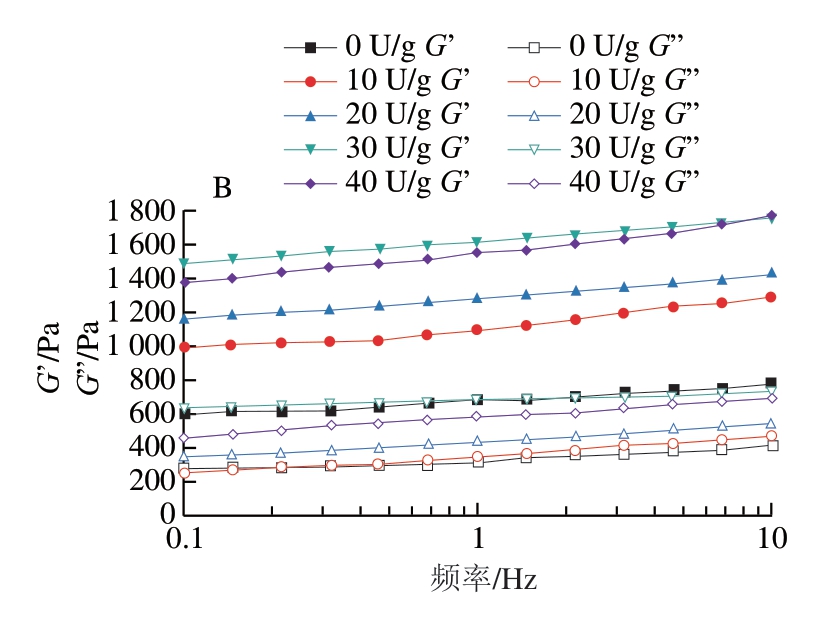
图5 TGase交联的GAMs(A)和GBMs(B)的G’和G”随频率的变化
Fig.5 Variation of G’ and G” of GAMs (A) and GBMs (B) crosslinked with TGase with frequency
2.1.5 明胶微球的NaNO2包埋率
由图6可知,随着TGase添加量增加至30 U/g,NaNO2的包埋率逐渐增加,最大为46%,GBMs较GAMs低,最大为31%。当TGase添加量增加至40 U/g时,GAMs和GBMs的NaNO2包埋率分别降低21%和10%,这是因为此添加量下微球的粒径较大,微球中分子间和分子内作用力比粒径小的微球弱,不易包埋NaNO2,导致其包埋率降低[18]。
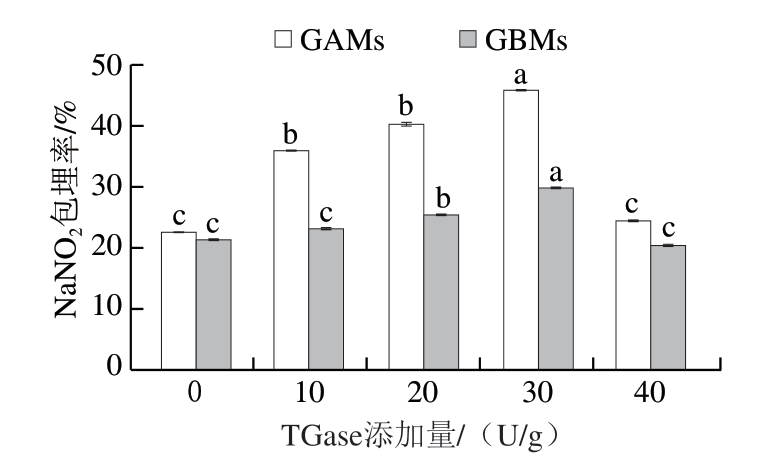
图6 TGase交联的GAMs和GBMs的NaNO2包埋率
Fig.6 Encapsulating rates of NaNO2 in GAMs and GBMs cross-linked with TGase
小写字母不同,表示不同添加量TGase处理的GAMs(或GBMs)组间差异显著(P<0.05)。
2.1.6 明胶微球的NO释放量
由图7可知,释放的NO总量为48~62 μg/mL,NaNO2包埋率越高,NO释放量越大。包埋率低的GBMs,在开始释放的前1~2 h,NO释放较快,随后缓慢释放;包埋率高的GAMs,在释放的前1~2 h,NO释放较快,2~4 h释放速率减缓,随后释放缓慢。无论对于GAMs还是GBMs,前期较快释放的NO可能来自于微球外层,而后期NO释放较慢可能是由于内部NO释放需要跨过外层明胶,导致释放速率较慢[18,31]。同时,随着TGase添加量增加至30 U/g,NO释放量增加,GAMs从53 μg/mL增加至62 μg/mL,GBMs从48 μg/mL增加至56 μg/mL。这种现象与微球的大小密切相关。40 U/g TGase交联的微球粒径较大,约为25~40 μm,这使得NO的释放量比其他样品低,GAMs为54 μg/mL,GBMs为49 μg/mL。在相同添加量的TGase交联下,GAMs比GBMs的NO释放总量高,这是由于GAMs比GBMs与TGase交联效果好,GAMs的粒径比GBMs小,并且在经过TGase交联后形成的GAMs结构更稳定。因此,同添加量的TGase交联GAMs的包埋率高,NO释放量高。对照组将NaNO2直接加入到抗坏血酸溶液内,因其瞬间释放NO,故无法进行测量计算。
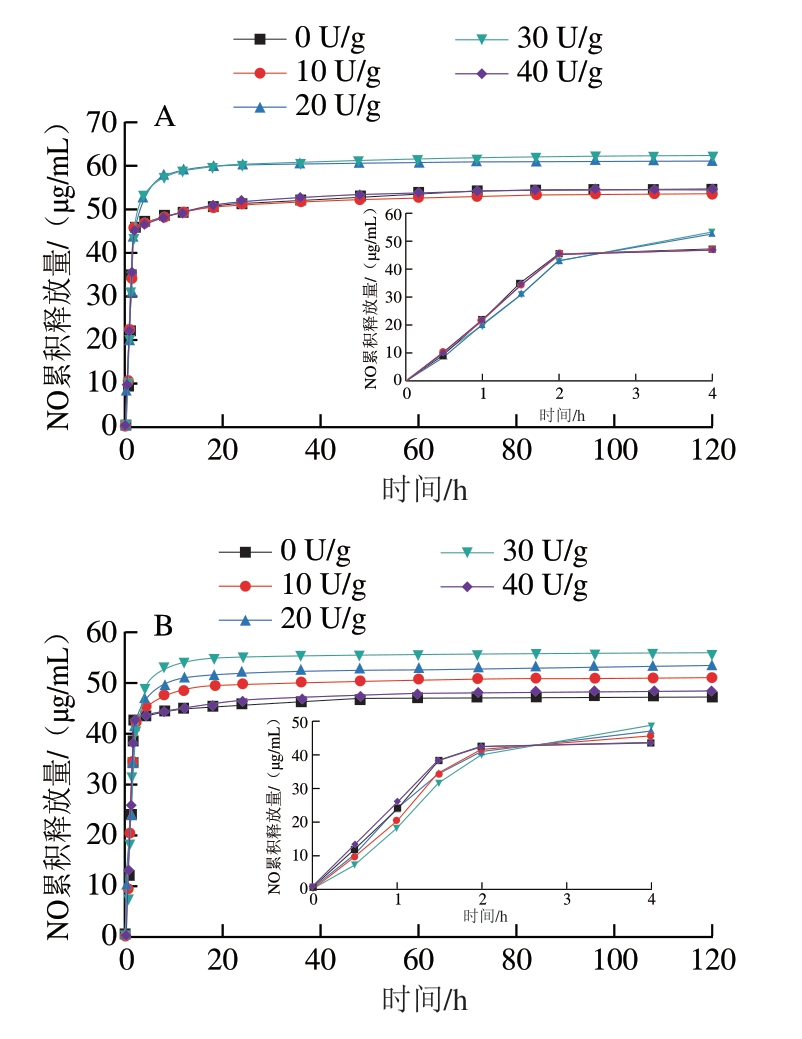
图7 TGase交联、包埋NaNO2的GAMs(A)和GBMs(B)的NO累积释放量
Fig.7 Cumulative release of NO from GAMs (A) and GBMs (B)cross-linked with TGase encapsulated with NaNO2
2.2 明胶微球对牛肉干和猪肉脯抑菌防腐的影响
由表1~2可知,各组样品的TVC随贮藏期延长均显著增加(P<0.05)。与空白对照组相比,微球组的增加幅度较小,且GAMs比GBMs效果更好,表明包埋NaNO2的微球具有一定的抑菌效果。与NaNO2组相比,包埋NaNO2微球的TVC增加幅度较小,表明将NaNO2包埋于明胶内实现了较好抑菌效果。同时,实验结果再次验证了包埋NaNO2的明胶微球在弱酸性环境下对NO具有缓释作用,进而延长对牛肉干和猪肉脯的防腐抑菌作用。阳星等[32]报道了相似研究结果,他们通过S-亚硝基海藻酸钠水凝胶缓慢释放NO对大肠杆菌与金黄色葡萄球菌都展示了较好的抑菌效果。
表1 牛肉干贮藏过程中的TVC变化
Table 1 Changes in TVC of beef jerky at different storage times lg(CFU/g)
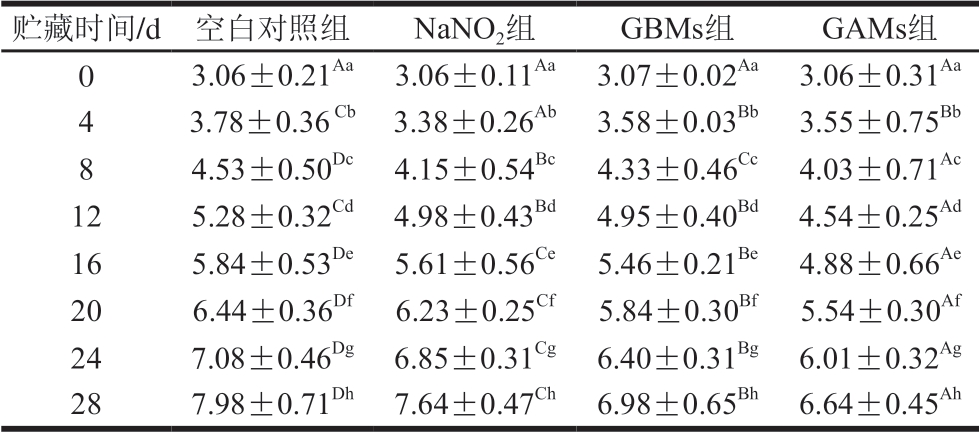
注:同列大写字母不同,表示不同贮藏时间差异显著(P<0.05);同行小写字母不同,表示不同处理组差异显著(P<0.05)。表2同。
贮藏时间/d空白对照组NaNO2组GBMs组GAMs组03.06±0.21Aa3.06±0.11Aa3.07±0.02Aa3.06±0.31Aa 43.78±0.36 Cb3.38±0.26Ab3.58±0.03Bb3.55±0.75Bb 84.53±0.50Dc4.15±0.54Bc4.33±0.46Cc4.03±0.71Ac 125.28±0.32Cd4.98±0.43Bd4.95±0.40Bd4.54±0.25Ad 165.84±0.53De5.61±0.56Ce5.46±0.21Be4.88±0.66Ae 206.44±0.36Df6.23±0.25Cf5.84±0.30Bf5.54±0.30Af 247.08±0.46Dg6.85±0.31Cg6.40±0.31Bg6.01±0.32Ag 287.98±0.71Dh7.64±0.47Ch6.98±0.65Bh6.64±0.45Ah
表2 猪肉脯贮藏过程中的TVC变化
Table 2 Changes in TVC of pork jerky at different storage times lg(CFU/g)
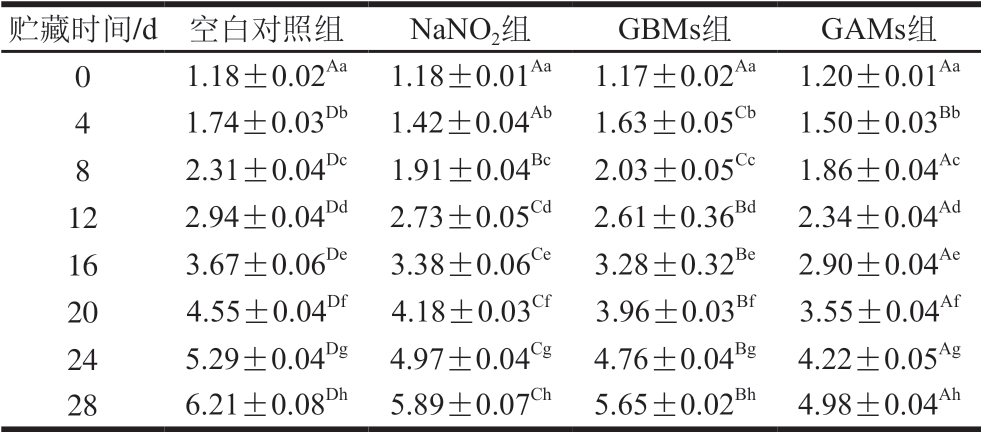
贮藏时间/d空白对照组NaNO2组GBMs组GAMs组01.18±0.02Aa1.18±0.01Aa1.17±0.02Aa1.20±0.01Aa 41.74±0.03Db1.42±0.04Ab1.63±0.05Cb1.50±0.03Bb 82.31±0.04Dc1.91±0.04Bc2.03±0.05Cc1.86±0.04Ac 122.94±0.04Dd2.73±0.05Cd2.61±0.36Bd2.34±0.04Ad 163.67±0.06De3.38±0.06Ce3.28±0.32Be2.90±0.04Ae 204.55±0.04Df4.18±0.03Cf3.96±0.03Bf3.55±0.04Af 245.29±0.04Dg4.97±0.04Cg4.76±0.04Bg4.22±0.05Ag 286.21±0.08Dh5.89±0.07Ch5.65±0.02Bh4.98±0.04Ah
3 结 论
本研究利用不同添加量TGase(0、10、20、30、40 U/g)交联A型与B型明胶,然后对NaNO2进行包封。结果表明:明胶微球的粒径约为5~40 μm,红外光谱实验表明,TGase交联使明胶微球的分子质量增加,随着TGase添加量增加,微球的G’和G”均增加,表现出类固体的黏弹性内部结构;30 U/g的TGase交联制备的GAMs NaNO2包埋率较高,为46%;NO在前4 h释放速率较快,后缓慢释放;将微球应用到牛肉干和猪肉脯的表面进行抑菌,随着贮藏时间的延长,与对照组相比,微球的TVC增加速率较慢,说明微球对微生物生长具有抑制作用,GAMs效果比GBMs好。总体来说,将NaNO2包封于明胶内,可以实现NO的缓慢释放,进而延长NO的抑菌效果,最终延长肉制品货架期。
[1] LAMAS A, MIRANDA J M, VAZQUEZ B, et al.An evaluation of alternatives to nitrites and sulfites to inhibit the growth of Salmonella enterica and Listeria monocytogenes in meat products[J].Foods, 2016,5(4): 1-11.DOI:10.3390/foods5040074.
[2] GÓMEZ I, JANARDHANAN R, IBAEZ F C, et al.The effects of processing and preservation technologies on meat quality: sensory and nutritional aspects[J].Foods, 2020, 9: 1416.DOI:10.3390/foods9101416.
[3] GASSARA F, KOUASSI A P, BRAR S K, et al.Green alternatives to nitrates and nitrites in meat-based products: a review[J].Critical Reviews in Food Science and Nutrition, 2015, 56(13): 2133-2148.DOI:10.1080/10408398.2013.812610.
[4] 周亚军, 李宗豪, 李圣桡, 等.肉加工中亚硝酸盐的作用及其替代物应用研究进展[J].农产品加工, 2019(11): 77-81.
[5] JJDA B, DPMH C, MILLER B C, et al.Discovery and development of gaseous nitric oxide under increased atmospheric pressure as an antimicrobial[J].Clinics in Podiatric Medicine and Surgery, 2020,37(2): 231-246.DOI:10.1016/j.cpm.2019.11.001.
[6] MIHU M R, CABRAL V, PATTABHI R, et al.Sustained nitric oxide-releasing nanoparticles interfere with methicillinresistant Staphylococcus aureus adhesion and biofilm formation in a rat central venous catheter model[J].Antimicrobial Agents Chemotherapy, 2017,61(1): e02020-16.DOI:10.1128/AAC.02020-16.
[7] SEABRA A B, FITZPATRICK A, PAUL J, et al.Topically applied S-nitrosothiol-containing hydrogels as experimental and pharmacological nitric oxide donors in human skin[J].British Journal of Dermatology, 2015, 151(5): 977-983.DOI:10.1111/j.1365-2133.2004.06213.x.
[8] SADREARHAMI Z, SHAFIEE F N, HO K K K, et al.Antibiofilm nitric oxide-releasing polydopamine coatings[J].ACS Applied Materials and Interfaces, 2019, 11(7): 7320-7329.DOI:10.1021/acsami.8b16853.
[9] 姚清艳, 王燕清, 朱建华, 等.微球制剂的研究进展[J].食品与药,2018, 20(5): 382-386.DOI:10.3969/j.issn.1672-979X.2018.05.017.
[10] OROWITZ T E, SOMBO P, RAHAYU D, et al.Microsphere polymers in molecular imprinting: current and future perspectives[J].Molecules,2020, 25(14): 3256.DOI:10.3390/molecules25143256.
[11] BINTI R, HWEI N M, SULAIMAN S B.Gelatin microsphere for cartilage tissue engineering: current and future strategies[J].Polymers,2020, 12(10): 2404.DOI:10.3390/polym12102404.
[12] 郭小炜, 李玉妍, 王秀丽, 等.pH敏感水凝胶微球的制备及二甲酸钾缓释和抗菌性能分析[J].材料工程, 2021, 49(4): 142-149.
[13] ZHANG Jian, WANG Yulin, QU Qingli, et al.Preparation of single, heteromorphic microspheres, and their progress for medical applications[J].Macromolecular Materials and Engineering, 2020,306(2): 2000593.DOI:10.1002/mame.202000593.
[14] ELZOGHBY A O.Gelatin-based nanoparticles as drug and gene delivery systems: reviewing three decades of research[J].Journal of Controlled Release, 2013, 172(3): 1075-1091.DOI:10.1016/j.jconrel.2013.09.019.
[15] YANG W, MEYERS M A, RITCHIE R O.Structural architectures with toughening mechanisms in nature: a review of the materials science of type-I collagenous materials[J].Progress in Materials Science, 2019, 103: 425-483.DOI:10.1016/j.pmatsci.2019.01.002.
[16] TIAN Xiaojing, ZHAO Kaixuan, TENG Anguo, et al.A rethinking of collagen as tough biomaterials in meat packaging: assembly from native to synthetic[J].Critical Reviews in Food Science and Nutrition,2022, 2022: 2111401.DOI:10.1080/10408398.2022.2111401.
[17] SHEWAN H M, STOKES J R.Review of techniques to manufacture micro-hydrogel particles for the food industry and their applications[J].Journal of Food Engineering, 2013, 119(4): 781-792.DOI:10.1016/j.jfoodeng.2013.06.046.
[18] TIAN Xiaojing, YANG Ning, SUN Mengjiao, et al.Preparation,physicochemical, and antibacterial properties of bovine serum albumin microspheres loaded with sodium nitrite[J].LWT-Food Science and Technology, 2022, 154: 112835.DOI:10.1016/j.lwt.2021.112835.
[19] SARKAR A, KARMAKAR S, BHATTACHARYYA S, et al.Nitric oxide release by N-(2-chloroethyl)-N-nitrosoureas: a rarely discussed mechanistic path towards their anticancer activity[J].RSC Advances,2014, 5(3): 2137-2146.DOI:10.1039/c4ra11137k.
[20] GASPAR A L, DE GOES-FAVONI S P.Action of microbial transglutaminase (MTGase) in the modification of food proteins:a review[J].Food Chemistry, 2015, 171: 315-322.DOI:10.1016/j.foodchem.2014.09.019.
[21] LUISA A, GASPAR C, DE GOES-FAVONI S P.Action of microbial transglutaminase (MTGase) in the modification of food proteins: a review[J].Food Chemistry, 2015, 171: 315-322.DOI:10.1016/j.foodchem.2014.0.
[22] STAROSZCZYK H, PIELICHOWSKA J, SZTUKA K, et al.Molecular and structural characteristics of cod gelatin films modified with EDC and TGase[J].Food Chemistry, 2012, 130(2): 335-343.DOI:10.1016/j.foodchem.2011.07.047.
[23] PAL A, KUMAR BAJPAI A, BAJPAI J.Study on facile designing:swelling properties and structural relationship of gelatin nanoparticles[J].Journal of Macromolecular Science: Part A, 2019,56(3): 206-214.DOI:10.1080/10601325.2019.1565542.
[24] PENG Zhiyuan, LI Zhiping, SHEN Yongqiang.Influence of chemical cross-linking on properties of gelatin/chitosan microspheres[J].Polymer-Plastics Technology and Engineering, 2012, 51(4): 381-385.DOI:10.1080/03602559.2011.639830.
[25] XIAO Jing, MA Yunhao, WANG Wenhang, et al.Incorporation of gelatin improves toughness of collagen films with a homo-hierarchical structure[J].Food Chemistry, 2021, 345(1/2): 128802.DOI:10.1016/j.foodchem.2020.128802.
[26] LI Chunyang, DU Changwen, MA Fei, et al.Diagnosis of nitrogen status in Chinese cabbage (Brassica rapa chinensis) using the ratio of amide II to amide I in leaves based on mid-infrared photoacoustic spectroscopy[J].Journal of Plant Nutrition and Soil Science, 178(6):888-895.DOI:10.1002/jpln.201500283.
[27] ANDRADE R, SKURTYS O, OSORIO F.Development of a new method to predict the maximum spread factor for shear thinning drops[J].Journal of Food Engineering, 2015, 157: 70-76.DOI:10.1016/j.jfoodeng.2015.02.017.
[28] SAFANDOWSKA M, PIETRUCHA K.Effect of fish collagen modification on its thermal and rheological properties[J].International Journal of Biological Macromolecules, 2013, 53(12): 32-37.DOI:10.1016/j.ijbiomac.2012.10.026.
[29] LIU Yihan, HUANG Lin, ZHENG Dong, et al.Characterization of transglutaminase from Bacillus subtilis and its cross-linking function with a bovine serum albumin model[J].Food Function, 2018, 9(11):5560-5568.DOI:10.1039/ c8fo01503a.
[30] AHAMMED S, LIU F, WU J, et al.Effect of transglutaminase crosslinking on solubility property and mechanical strength of gelatinzein composite films[J].Food Hydrocolloids, 2021, 116: 106649.DOI:10.1016/j.foodhyd.2021.106649.
[31] ZHU Zhu, MIN Tiantian, ZHANG Xueji, et al.Microencapsulation of thymol in poly (lactide-co-glycolide) (PLGA): physical and antibacterial properties[J].Materials, 2019, 12(7): 1133.DOI:10.3390/ma12071133.
[32] 阳星, 刘桥, 余达威,等.S-亚硝基海藻酸钠抗菌水凝胶的制备与表征[J].南方水产科学, 2022, 18(2): 74-82.DOI:10.12131/20210325.