鲢鱼,又称白鲢,属于鲤形目、鲤科,是著名的四大家鱼之一。根据中国渔业年鉴统计数据,2021年我国鲢鱼产量为383.7 万t[1],是我国产量第二高的淡水鱼类,分布在全国各大水系。鲢鱼生长速度快、营养价值高、价格低廉,肉色白、质嫩、加工性能优良,是加工前景非常广阔的淡水鱼种[2]。但由于富含水分和蛋白质,鲢鱼在贮藏过程中极易发生腐败变质。目前市场上白鲢鱼销售通常以鲜活为主,而且不容易保活,有很大的产地局限性;而大型超市低温冷藏销售的鲢鱼片也存在质量劣变快、货架期短的问题。然而,随着经济发展、生活水平的提高以及消费观念的转变,人们越来越关注水产品的新鲜度。新鲜度是水产品重要的品质指标,也是决定其价格及市场的主要因素[3],因此亟需研发针对淡水鱼类的高效保鲜技术。目前,水产品保鲜主要有冷冻保鲜和化学保鲜等,但以上技术存在蛋白质变性、营养成分流失和化学药品残留等问题[4],因而安全、无毒的天然保鲜剂的应用越来越受到青睐。
壳寡糖,学名β-1,4-寡糖-葡萄糖胺,是壳聚糖经过物理、化学或生物等方法降解得到的一种聚合度在20以下、分子质量小于3 900 Da的糖[5]。许多科学家把壳寡糖与蛋白质、脂肪、糖类、维生素、矿物质并列,誉为第六生命要素。根据《中华人民共和国食品安全法》和《新食品原料安全性审查管理办法》有关规定,已批准壳寡糖为新的食品原料应用于食品加工领域。与大分子质量的壳聚糖相比,壳寡糖分子链较短,水溶性较好,生物活性更高,更容易被生物吸收。同时,壳寡糖具有抗氧化、抗衰老、降胆固醇及免疫调节等功能活性[6-8],因此,在农业、食品、化妆品、医药等领域具有广泛应用。目前,壳寡糖在食品保鲜领域的应用越来越广泛,大量研究表明,用壳寡糖制成的纯天然保鲜剂,保鲜效果显著,可满足果蔬贮藏、运输和销售等环节的保鲜要求[9-10],然而,壳寡糖应用于水产品保鲜上的研究较少。
鲢鱼冷藏过程中的腐败主要是由微生物引起[11],了解鲢鱼冷藏过程中的菌相变化,进而筛选能够控制优势腐败菌生长的保鲜剂具有重要意义。因此,本研究主要应用Illumina MiSeq高通量测序技术分析壳寡糖对鲢鱼冷藏过程中菌相组成的影响,并通过测定鲢鱼片冷藏过程中菌落总数、总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量、三磷酸腺苷(adenosine triphosphate,ATP)关联物含量及K值等指标探究壳寡糖对鲢鱼的保鲜作用。
1 材料与方法
1.1 材料与试剂
鲜活鲢鱼30 条(平均体质量(1 203±76) g,体长(47.5±1.7) cm)购自北京小月河农贸市场,所有鱼均活体送至实验室。
壳寡糖(分子质量≤1 000 Da,脱乙酰度≥90%,聚合度2~6) 大连中科格莱克生物科技有限公司;ATP、二磷酸腺苷(adenosine-5’-diphosphate,ADP)、一磷酸腺苷(adenosine-5’-monophosphate,AMP)、肌苷酸(inosine-5’-monophosphate,IMP)、肌苷(inosine,HxR)、次黄嘌呤(hypoxanthine,Hx)标准品(均为色谱纯) 美国Sigma公司;细菌基因组DNA快速提取试剂盒 北京博迈德基因技术有限公司;AxyPrepDNA凝胶回收试剂盒 美国Axygen公司;其他试剂均为分析纯 北京化学试剂公司。
1.2 仪器与设备
CXTH-3000高效液相色谱仪 北京创新通恒科技有限公司;FE20/EL20插入式pH计 梅特勒-托利多(上海)仪器有限公司;GL-21M高速冷冻离心机 长沙湘仪离心机仪器有限公司;5424R高速台式冷冻离心机德国Eppendorf公司;IKA-T18高速匀浆机 艾卡(广州)仪器设备有限公司;QL-901旋涡混合器 海门其林贝尔仪器制造有限公司;ABI GeneAmp®9700聚合酶链式反应(polymerase chain reaction,PCR)仪 美国应用生物系统公司;YT-CJ-1ND超净工作台 北京亚泰科隆实验科技开发中心;高压灭菌锅 合肥华泰医疗设备有限公司。
1.3 方法
1.3.1 鲢鱼片样品制备
鲢鱼击晕后,立即去鳞和内脏,用流动自来水冲洗干净后切成鱼片,将鱼片清洗干净并沥水后放入聚乙烯保鲜袋中。将准备好的鱼片(158±7) g随机分为2 组:对照组(未处理鱼片)和壳寡糖组(0.5 g/100 mL壳寡糖溶液浸泡30 min的鱼片)。将2 组鱼片分别装入聚乙烯保鲜袋中,置于4 ℃冰箱中冷藏。于0、2、4、6、8 d随机选取3 个鱼片进行指标测定。
1.3.2 感官评价
参照Meilgaard等[12]的方法进行,感官小组成员根据感官评价标准(表1)对鱼片的感官指标(色泽、气味、质地及总体评价)进行打分。打分使用9 分制,1 分代表质量最差,9 分代表质量最好,低于5 分表示鱼片感官不能接受。
表1 鲢鱼感官评分标准
Table 1 Criteria for sensory evaluation of silver carp fillets

评分色泽气味质地总体评价8~9 色泽正常,肌肉内切面富有光泽,腹部为亮白色具有鱼肉固有的香味,清新肌肉组织致密、完整,坚实有弹性,手压后凹陷即消失非常新鲜6~7 色泽正常,肌肉内切面有光泽,腹部为白色具有鱼肉固有的香味,较清新肌肉组织致密,坚实有弹性,手压后凹陷较快消失新鲜3~5 色泽稍暗淡,肌肉切面稍有光泽,腹部轻微发黄鱼肉固有香味清淡,略带异味肌肉组织不致密,有弹性,但手压后凹陷消失较慢不新鲜0~2 色泽较暗淡,肌肉切面无光泽,腹部为黄色鱼肉固有香味消失,有腥臭味或氨臭味肌肉组织不致密,稍有弹性,手压后凹陷消失很慢腐败变质
1.3.3 菌落总数测定
参照GB 4789.2—2010《食品安全国家标准 食品微生物学检验 菌落总数测定》进行菌落总数测定。准确称取5.0 g背部肌肉鱼片于无菌均质袋中,加入45 mL无菌生理盐水,于拍打式均质机中拍打30 s,制得1∶10的样品稀释液。随后将0.5 mL样品稀释液用4.5 mL无菌生理盐水进行连续10 倍梯度稀释。选择2~3 个合适稀释度,取100 μL样品均匀涂布于平板计数琼脂培养基。以上操作在超净工作台中进行,将平板置于30 ℃培养箱中培养48 h后计数。
1.3.4 菌相组成测定
1.3.4.1 DNA提取及16S rDNA PCR扩增
细菌DNA提取主要参照Zhuang Shuai等[13]的方法,采用细菌基因组DNA快速提取试剂盒提取基因组,-20 ℃冻藏,PCR扩增前融化,将3 次取样均匀混合后,通过PCR扩增细菌16S rRNA的V3~V4区,引物为338F(5’-barcode-ACTCCTACGGGAGGCAGCAG-3’)和907R(5’-GGACTACHVGGGTWTCTAAT-3’)。PCR反应体系(20 μL):4 μL 5×FastPfu缓冲液、2 μL 2.5 mmol/L dNTPs、0.8 μL正向引物(5 μmol/L)、0.8 μL反向引物(5 μmol/L)、0.4 μL Trans Gen FastPfu DNA聚合酶、10 ng模板DNA,ddH2O补齐至20 μL。PCR扩增反应程序:95 ℃变性3 min;以95 ℃、30 s,55 ℃、30 s,72 ℃、45 s扩增25 个循环;72 ℃、5 min。2%琼脂糖凝胶电泳检测PCR产物,等浓度混样,通过凝胶回收试剂盒回收纯化PCR产物。
1.3.4.2 Illumina MiSeq高通量测序
MiSeq建库及基因测序委托上海美吉生物医药科技有限公司进行,DNA序列测序、拼接、质控及生物信息学高级分析由该公司协助完成。
1.3.5 ATP关联物含量及K值测定
ATP关联物的测定采用反相高效液相色谱法,参照Zhang Longteng等[14]的方法并稍作修改。称取1.00 g绞碎鱼肉,加入预冷的体积分数10%高氯酸2 mL,研磨,浆液在4 000 r/min条件下离心3 min,取上清液,沉淀用2 mL预冷的体积分数5%高氯酸洗涤并离心,重复该步骤1 次,合并上清液。用1 mol/L NaOH溶液调节pH值至6.40±0.04,4 000 r/min离心3 min,沉淀用pH 6.40的高氯酸洗涤,合并上清液并定容至10 mL。样液用0.22 μm滤膜过滤,用反相高效液相色谱法进行分析。色谱条件:COSMOSIL 5C18-PAQ色谱柱(4.6 mm×250 mm,5 μm);流动相为pH 6.8的磷酸盐缓冲液;流速1 mL/min、进样量50 μL、检测波长254 nm、室温。将ATP、ADP、AMP、IMP、HxR和Hx标准品分别配制成质量浓度梯度为0.01、0.02、0.04、0.08、0.10、0.20 mg/mL的标准品溶液,在与样品相同的高效液相色谱条件下进行测定,利用各标准溶液的质量浓度和相应峰面积建立标准曲线,ATP关联物含量按照标准曲线来定量。K值按下式计算。

式中:各物质含量单位均为μmol/g。
1.3.6 TVB-N含量测定
采用凯氏定氮仪按半微量蒸馏法[15]测定TVB-N含量。
1.4 数据处理
所有实验均重复3 次,数据表示为平均值±标准差。采用SPSS 20.0软件进行单因素方差分析,Duncan’s多重检验进行数据间的显著性差异分析。
2 结果与分析
2.1 壳寡糖对冷藏鲢鱼片感官特性的影响
由表2可知,0.5 g/100 mL壳寡糖对鲢鱼片的原始风味、色泽及质地均没有显著影响。对照组和实验组鲢鱼片的感官特性在贮藏过程中均呈下降趋势。其中,壳寡糖组鱼片的气味、质地和色泽分别从贮藏2、2、4 d开始显著优于对照组鱼片。就总体接受程度而言,壳寡糖组鱼片从贮藏4 d开始显著优于对照组鱼片。随着贮藏时间的延长,贮藏6 d时,对照组鱼片出现腐败气味,感官不能接受,而壳寡糖组鱼片此时感官特性均良好。对照组鱼片贮藏8 d时彻底腐败,同时壳寡糖组鱼片也开始出现腐败气味,感官不能接受。
表2 壳寡糖对4 ℃贮藏鲢鱼片感官评分的影响
Table 2 Effects of COS on sensory score of silver carp fillets during storage at 4 ℃
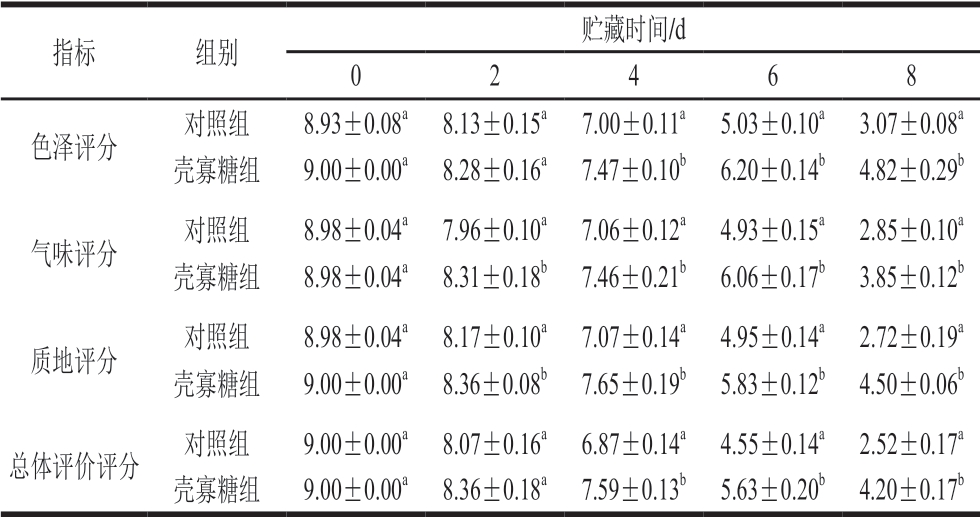
注:同列小写字母不同,表示组间差异显著(P<0.05)。
指标组别贮藏时间/d 0 2 4 6 8色泽评分对照组8.93±0.08a8.13±0.15a7.00±0.11a5.03±0.10a3.07±0.08a壳寡糖组9.00±0.00a8.28±0.16a7.47±0.10b6.20±0.14b4.82±0.29b气味评分对照组8.98±0.04a7.96±0.10a7.06±0.12a4.93±0.15a2.85±0.10a壳寡糖组8.98±0.04a8.31±0.18b7.46±0.21b6.06±0.17b3.85±0.12b质地评分对照组8.98±0.04a8.17±0.10a7.07±0.14a4.95±0.14a2.72±0.19a壳寡糖组9.00±0.00a8.36±0.08b7.65±0.19b5.83±0.12b4.50±0.06b总体评价评分对照组9.00±0.00a8.07±0.16a6.87±0.14a4.55±0.14a2.52±0.17a壳寡糖组9.00±0.00a8.36±0.18a7.59±0.13b5.63±0.20b4.20±0.17b
2.2 壳寡糖对冷藏鲢鱼片菌落总数的影响
由图1可知,对照组和壳寡糖组鱼片的初始菌落总数分别为4.15、4.08(lg(CFU/g))。随着贮藏时间延长,2 组鱼片菌落总数均呈上升趋势。从贮藏2 d至贮藏末期,壳寡糖组鱼片菌落总数均显著低于对照组鱼片(P<0.05)。随着贮藏时间的延长,贮藏4 d时,对照组鱼片菌落总数达到7.22(lg(CFU/g)),而壳寡糖组鱼片此时菌落总数仅为6.59(lg(CFU/g)),但贮藏6 d时,壳寡糖组鱼片菌落总数达到7.45(lg(CFU/g))。国际微生物规格委员会将菌落总数≤7.0(lg(CFU/g))作为淡水鱼微生物数量可接受范围[16]。对照组和壳寡糖组鱼片菌落总数分别于贮藏4、6 d超过7.0(lg(CFU/g))。这主要与壳寡糖的抗菌作用有关,同时,先前研究表明,壳寡糖对革兰氏阳性菌及革兰氏阴性菌均具有广谱抑制活性[17]。
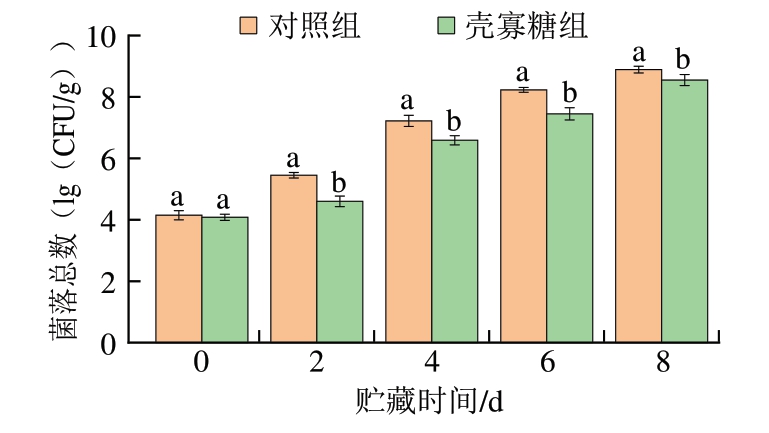
图1 壳寡糖对鲢鱼4 ℃贮藏过程中菌落总数的影响
Fig.1 Effects of COS on total viable count of silver carp fillets during storage at 4 ℃
小写字母不同,表示相同贮藏时间组间差异显著(P<0.05)。图4~5同。
2.3 基于Illumina MiSeq高通量测序技术的菌相分析
基于感官分析结果,选取对照组和壳寡糖组贮藏0、6 d的鱼肉样品进行菌相分析。对鲢鱼贮藏过程中菌群相对丰度≥1%的21 个菌属(属水平)进行分析。由图2可知,随着贮藏时间的延长,对照组和壳寡糖组鱼片菌群多样性水平均降低,这与Huang Zhan等[18]对草鱼冷藏的研究结果一致。贮藏第0天,对照组鱼片的优势菌属为气单胞菌属(Aeromonas)(20.5%)、假单胞菌属(Pseudomonas)(20.0%)和不动杆菌属(Acinetobacter)(8.1%);壳寡糖组鱼片的优势菌属为气单胞菌属(41.1%)、假单胞菌属(35.3%)和不动杆菌属(8.3%)。随着贮藏时间的延长,2 组鱼肉菌群结构均发生明显变化,贮藏6 d时,对照组鱼片的优势菌属为假单胞菌属(79.8%)和气单胞菌属(6.5%),而不动杆菌属的相对丰度降至4.7%;壳寡糖组鱼片的优势菌属为不动杆菌属(54.7%)、假单胞菌属(34.4%),而气单胞菌属的相对丰度降至1.6%。值得注意的是,壳寡糖处理后的鱼肉菌群中假单胞菌属和气单胞菌属的相对丰度明显减少,而不动杆菌属成为优势菌属。有研究发现,假单胞菌属和气单胞菌属是淡水鱼冷藏过程中的特定腐败菌,而不动杆菌属对淡水鱼肉的致腐能力较弱[19]。Katikou等[20]研究发现,鱼肉中与腐败相关的生物胺类的产生与假单胞菌属密切相关。Wang Guangxian等[21]研究发现,气单胞菌属能够导致有氧包装蓝圆鰺的腐败。因此,壳寡糖组鱼片在贮藏过程中的品质明显优于对照组,可能与壳寡糖对假单胞菌属和气单胞菌属的抑制作用相关。
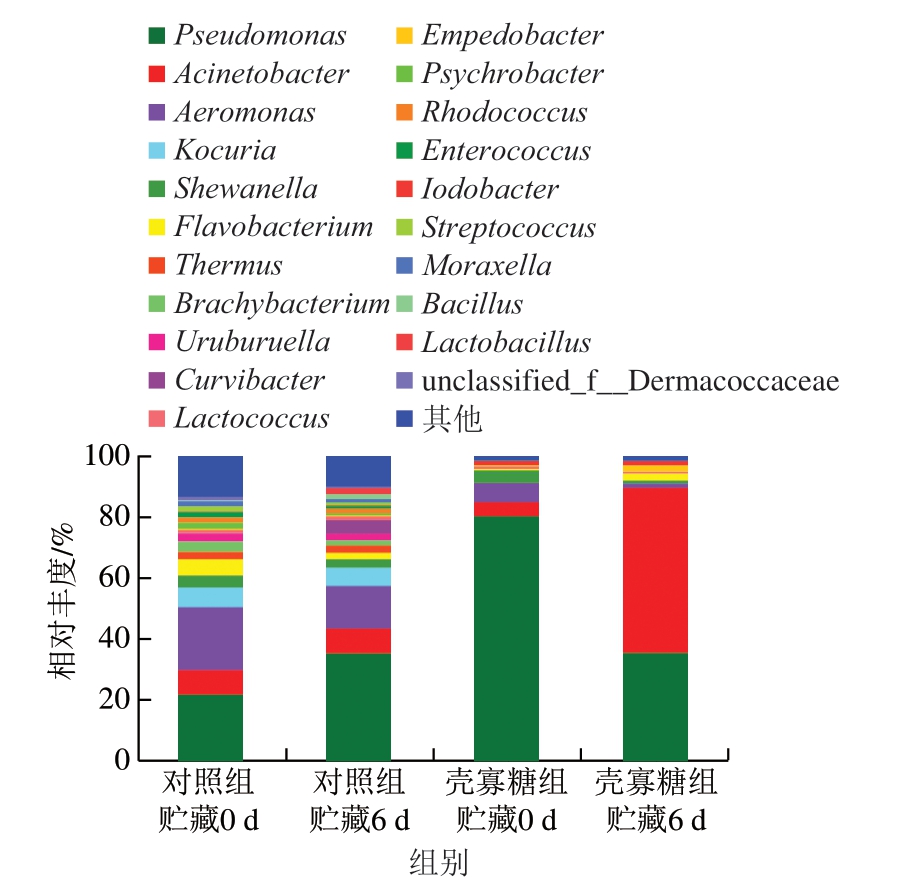
图2 壳寡糖对鲢鱼4 ℃贮藏过程中菌属相对丰度的影响
Fig.2 Effects of COS on relative abundance of bacteria (at the genus level) of silver carp fillets during storage at 4 ℃
为进一步可视化分析对照组和壳寡糖组鱼片菌相变化,对壳寡糖组及对照组鱼片菌群组成(丰度前50的菌属)进行热图分析。热图是以颜色梯度来表征二维矩阵或表格中数据的大小,并呈现群落物种组成信息。通常根据物种或样本间丰度的相似性进行聚类,并将结果呈现在菌落热图上,可使高丰度和低丰度的物种分块聚集,通过颜色变化与相似程度来反映冷藏鲢鱼片在属水平上群落组成的相似性和差异性。
由图3可知,假单胞菌属、气单胞菌属和不动杆菌属作为2 组鱼片高丰度菌属被归为一类,剩余47 个菌属归为另一大类。对对照组和壳寡糖组样本间丰度的相似性进行聚类分析,发现对照组和壳寡糖组贮藏0 d时的菌相相似,可以归为一类,而随着贮藏时间的延长,2 组鱼片的菌相发生明显变化且对照组和壳寡糖组贮藏6 d时的菌相相似,可以归为一类。
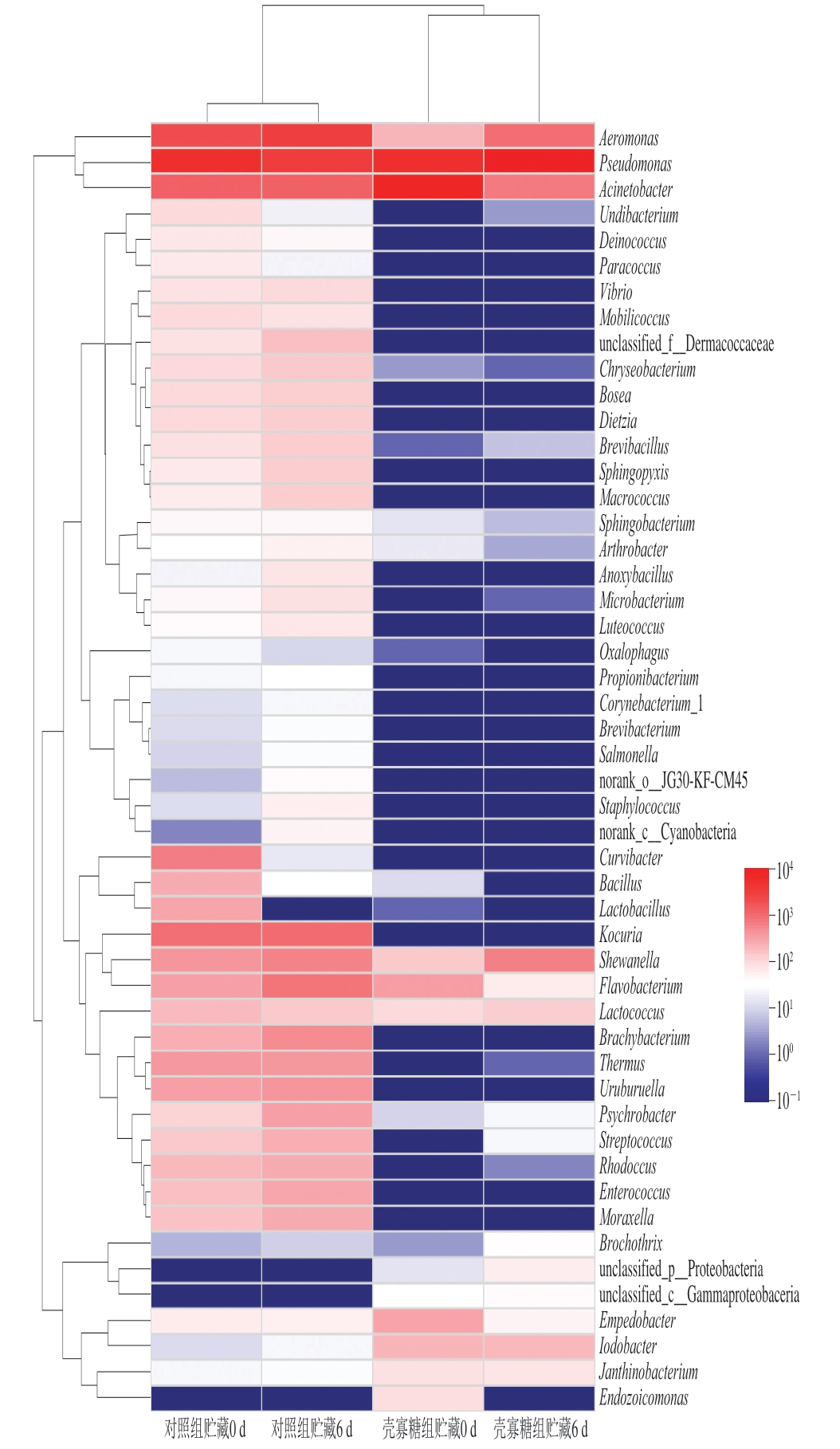
图3 壳寡糖对鲢鱼4 ℃贮藏过程中菌相影响的热图分析
Fig.3 Heat map showing the effects of COS on the microbiota composition of silver carp fillets during storage at 4 ℃
2.4 壳寡糖对冷藏鲢鱼片ATP关联物含量及K值的影响
IMP是鱼肉中主要的呈鲜味物质,其含量与鱼肉的鲜度有很大的相关性。由图4A可知,对照组和壳寡糖组鱼肉中IMP的含量变化均呈先上升后下降的趋势。鱼肉贮藏过程中IMP含量的下降主要由鱼肉自溶作用及微生物酶的作用引起。从贮藏4 d开始至贮藏末期,壳寡糖组鱼片的IMP含量显著高于对照组(P<0.05),表明壳寡糖能够延缓鱼肉中IMP的降解,使鱼片在贮藏过程中保留更多的鲜味成分。
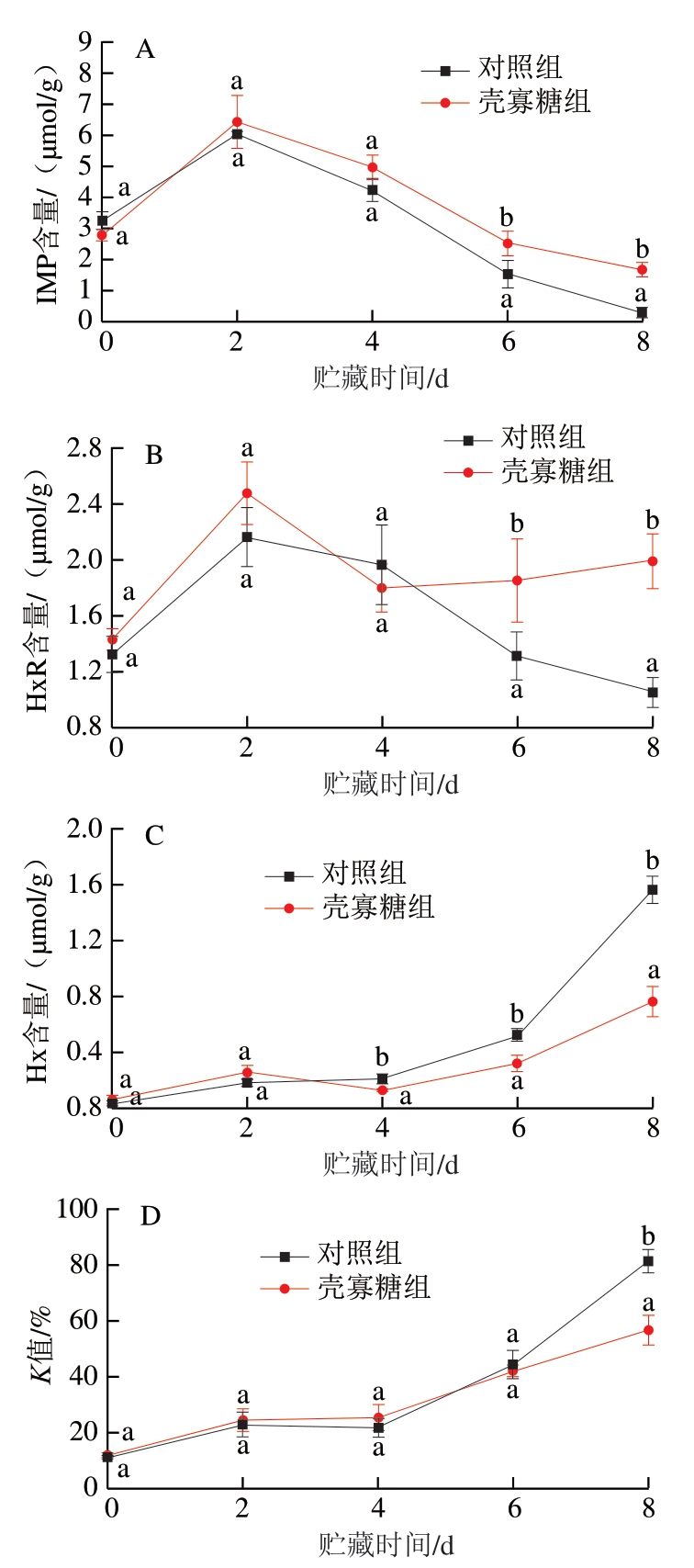
图4 壳寡糖对鲢鱼4 ℃贮藏过程中IMP、HxR、Hx含量及K值的影响
Fig.4 Effects of COS on IMP, HxR, Hx content, and K value of silver carp fillets during storage at 4 ℃
随着贮藏时间的延长,IMP在鱼肉自溶作用及微生物酶的作用下逐渐被分解为HxR和Hx[22]。HxR和Hx是核苷酸降解的主要产物,其中高含量的Hx与腐败鱼肉的苦味有关,Hx的积累会导致鱼肉风味品质下降。由图4B可知,对照组和壳寡糖组HxR的含量变化均呈先上升后下降的趋势,从贮藏6 d开始至贮藏末期,壳寡糖组鱼片的HxR含量显著高于对照组(P<0.05),表明壳寡糖能够抑制HxR的降解,减少苦味成分Hx的生成。
由图4C可知,随着贮藏时间的延长,对照组和壳寡糖组鱼片中Hx含量均呈逐渐上升趋势,其初始值分别为0.03、0.06 μmol/g,从贮藏6 d开始至贮藏末期,壳寡糖组鱼片的Hx含量显著低于对照组(P<0.05)。贮藏8 d时,对照组鱼片的Hx含量为1.57 μmol/g,接近壳寡糖组鱼片Hx含量(0.79 μmol/g)的2 倍。结果表明,从贮藏6 d开始至贮藏末期,壳寡糖组鱼片含有更高的HxR含量及更低的Hx含量。Hernández-Cázares等[23]研究发现,Hx的生成与腐败微生物产生的核苷磷酸化酶有关。因此,壳寡糖组鱼片较对照组具有更好的品质,这可能与壳寡糖抑制假单胞菌属和气单胞菌属等微生物的生长进而抑制HxR分解为Hx有关。
K值经常用于评价鱼肉的新鲜度[13],由图4D可知,随着贮藏时间的延长,对照组与壳寡糖组鱼片的K值均呈上升趋势。当K值大于60%时,鱼肉品质达到不可接受范围[13]。对照组鱼片K值于贮藏8 d时超过该限值,而壳寡糖组鱼片在贮藏8 d的K值为56.39%,显著低于对照组。感官评价结果表明,对照组与壳寡糖组鱼片分别于贮藏6、8 d时达到感官不可接受程度,这说明不能仅通过K值评价淡水鱼鱼片新鲜度,要通过综合的感官及物理化学指标对鱼片的新鲜度作出综合评价。
2.5 壳寡糖对冷藏鲢鱼片TVB-N含量的影响
由图5可知,对照组和壳寡糖组鱼片初始TVB-N含量分别为11.37、10.73 mg/100 g。在贮藏2 d时2 组TVB-N含量略有下降,之后逐渐升高且从贮藏4 d开始至贮藏末期,壳寡糖组鱼片TVB-N含量显著低于对照组(P<0.05)。TVB-N的产生主要由腐败菌引起[24],因此,壳寡糖对鱼肉中TVB-N的抑制作用主要是通过抑制冷藏鲢鱼优势菌属假单胞菌属和气单胞菌属的增长实现。
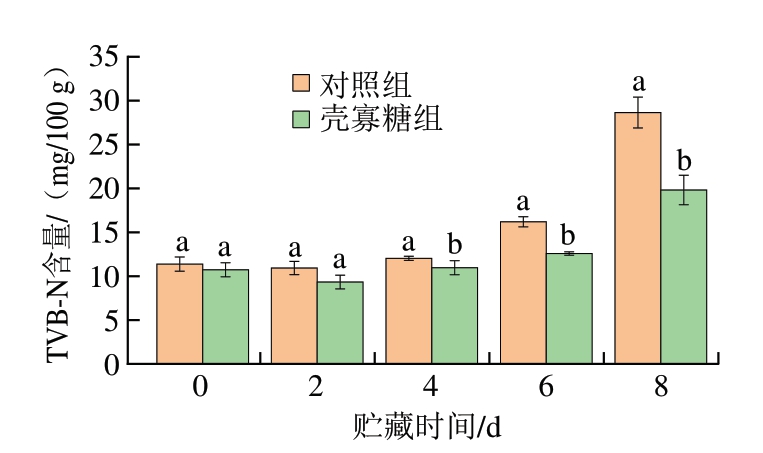
图5 壳寡糖对鲢鱼4 ℃贮藏过程中TVB-N含量的影响
Fig.5 Effects of COS on TVB-N content of silver carp fillets during storage at 4 ℃
3 结 论
本研究主要通过Illumina MiSeq高通量测序技术分析壳寡糖对鲢鱼冷藏过程中鱼肉菌相的影响。结果表明:0.5 g/100 mL壳寡糖能够显著抑制冷藏鲢鱼的菌落总数并明显改变冷藏鲢鱼的菌相,主要表现为抑制鲢鱼冷藏过程中假单胞菌属和气单胞菌属等腐败菌属的增长,延缓鱼肉贮藏过程中的品质劣变,而不动杆菌属能够耐受壳寡糖处理,成为壳寡糖处理组鱼肉的优势菌属;同时,壳寡糖能够显著延缓鱼肉中IMP及HxR的降解,抑制苦味物质Hx及TVB-N的生成,进而提高鲢鱼的品质,这可能与壳寡糖抑制假单胞菌属和气单胞菌属等腐败菌属的生长有关。综上,作为一种新型的食品保鲜剂,壳寡糖通过改变鲢鱼贮藏过程中的菌相,抑制鲢鱼冷藏过程中假单胞菌属和气单胞菌属等腐败菌属的增长,进而提高鲢鱼的贮藏品质。
[1] 农业部渔业渔政管理司.2022中国渔业统计年鉴[M].北京: 中国农业出版社, 2022.
[2] 胡永金, 刘晓永, 朱仁俊.不同气调包装对冷藏白鲢鱼片质量的影响[J].食品工业科技, 2007(5): 185-189.DOI:10.13386/j.issn1002-0306.2007.05.052.
[3] ISHIMURA G, BAILEY M.The market value of freshness:observations from the swordfish and blue shark longline fishery[J].Fisheries Science, 2013, 79(3): 547-553.DOI:10.1007/s12562-013-0609-6.
[4] 张杰, 邢志宾.生物技术在水产品保鲜应用的研究进展[J].河北渔业, 2014(7): 57-58; 69.
[5] LODHI G, KIM Y S, HWANG J W, et al.Chitooligosaccharide and its derivatives: preparation and biological applications[J].BioMed Research International, 2014, 2014: 654913.DOI:10.1155/2014/654913.
[6] JIA Shiliang, LU Zheng, GAO Zhaolan, et al.Chitosan oligosaccharides alleviate cognitive deficits in an amyloid-β1-42-induced rat model of Alzheimer’s disease[J].International Journal of Biological Macromolecules, 2016, 83: 416-425.DOI:10.1016/j.ijbiomac.2015.11.011.
[7] 王晗, 米生权, 孙雅煊, 等.壳寡糖对秀丽隐杆线虫寿命的影响[J].食品科学, 2015, 36(1): 229-233.DOI:10.7506/spkx1002-6630-201501044.
[8] 崔杨, 郭红莲, 路玉荣.壳寡糖诱导采后番茄储藏品质的研究[J].食品科技, 2014, 39(10): 64-69.DOI:10.13684/j.cnki.spkj.2014.10.013.
[9] 蒋丹丹, 王延康, 唐文竹, 等.壳寡糖对黑豆芽营养成分及抗氧化活性的影响[J].食品与发酵工业, 2022(10): 1-10.DOI:10.13995/j.cnki.11-1802/ts.032713.
[10] 赵韩栋, 秦畅, 郭风军, 等.采后壳寡糖处理减轻皇冠梨果皮褐变的研究[J].中国食品学报, 2022, 22(4): 276-284.DOI:10.16429/j.1009-7848.2022.04.027.
[11] ZHUANG Shuai, HONG Hui, ZHANG Longteng, et al.Spoilage-related microbiota in fish and crustaceans during storage: research progress and future trends[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(1): 252-288.DOI:10.1111/1541-4337.12659.
[12] MEILGAARD M C, CARR B T, CIVILLE G V.Sensory evaluation techniques[M].3rd ed.Boca Raton: CRC Press, 1999.
[13] ZHUANG Shuai, TAN Yuqing, HONG Hui, et al.Exploration of the roles of spoilage bacteria in degrading grass carp proteins during chilled storage: a combined metagenomic and metabolomic approach[J].Food Research International, 2022, 152: 110926.DOI:10.1016/j.foodres.2021.110926.
[14] ZHANG Longteng, LI Qian, LYU Jian, et al.The impact of stunning methods on stress conditions and quality of silver carp(Hypophthalmichthys molitrix) fillets stored at 4 ℃ during 72 h postmortem[J].Food Chemistry, 2017, 216: 130-137.DOI:10.1016/j.foodchem.2016.08.004.
[15] YU Dawei, ZHAO Wenyu, DONG Junli, et al.Multifunctional bioactive coatings based on water-soluble chitosan with pomegranate peel extract for fish flesh preservation[J].Food Chemistry, 2022, 374:131619.DOI:10.1016/j.foodchem.2021.131619.
[16] International Commission on Microbiological Specifications for Foods(ICMSF).Microorganisms in foods 2.Sampling for microbiological analysis: principles and specific applications[M].Toronto: University of Toronto Press, 1986: 181-196.
[17] VISHU KUMAR A B, VARADARAJ M C, GOWDA L R, et al.Characterization of chito-oligosaccharides prepared by chitosanolysis with the aid of papain and Pronase, and their bactericidal action against Bacillus cereus and Escherichia coli[J].Biochemical Journal, 2005,391: 167-175.DOI:10.1042/BJ200580093.
[18] HUANG Zhan, LIU Xiaochang, JIA Shiliang, et al.Antimicrobial effects of cinnamon bark oil on microbial composition and quality of grass carp (Ctenopharyngodon idellus) fillets during chilled storage[J].Food Control, 2017, 82: 316-324.DOI:10.1016/j.foodcont.2017.07.017.
[19] LIU Xiaochang, HUANG Zhan, JIA Shiliang, et al.The roles of bacteria in the biochemical changes of chill-stored bighead carp (Aristichthys nobilis): proteins degradation, biogenic amines accumulation, volatiles production, and nucleotides catabolism[J].Food Chemistry, 2018, 255:174-181.DOI:10.1016/j.foodchem.2018.02.069.
[20] KATIKOU P, GEORGANTELIS D, PALEOLOGOS E K, et al.Relation of biogenic amines’ formation with microbiological and sensory attributes in Lactobacillus-inoculated vacuum-packed rainbow trout (Oncorhynchus mykiss) fillets[J].Journal of Agricultural and Food Chemistry, 2006, 54: 4277-4283.DOI:10.1021/jf0602121.
[21] WANG Guangxian, LIU Jing, YUE Feiling, et al.Dual enzyme electrochemiluminescence sensor based on in situ synthesis of ZIF-67@AgNPs for the detection of IMP in fresh meat[J].LWTFood Science and Technology, 2022, 165: 113659.DOI:10.1016/j.lwt.2022.113658.
[22] LI Dapeng, ZHANG Longteng, SONG Sijia, et al.The role of microorganisms in the degradation of adenosine triphosphate (ATP) in chill-stored common carp (Cyprinus carpio) fillets[J].Food Chemistry,2017, 224: 347-352.DOI:10.1016/j.foodchem.2016.12.056.
[23] HERNÁNDEZ-CÁZARES A S, ARISTOY M C, TOLDRÁ F.Nucleotides and their degradation products during processing of dry-cured ham, measured by HPLC and an enzyme sensor[J].Meat Science, 2011, 87: 125-129.DOI:10.1016/j.meatsci.2010.09.010.
[24] BEKHIT A E D A, HOLMAN B W B, GITERU S G, et al.Total volatile basic nitrogen (TVB-N) and its role in meat spoilage:a review[J].Trends in Food Science and Technology, 2021, 109:280-302.DOI:10.1016/j.tifs.2021.01.006.