传统的物理嫩化技术,如电刺激、水分灌注技术和传统嫩度拉伸技术等,虽然广泛应用于肉及肉制品的嫩化加工,但在线应用差这一缺陷导致消费者接受度较低,因此推进了新兴物理嫩化技术的研究[1]。目前在牛肉生产中新引入的脉冲电场(pulsed electric field,PEF)、超声波(ultrasonic,US)和高压加工(high pressure processing,HPP)等技术在牛肉生产领域得到广泛关注[2]。
嫩度对肉类及其制品的感官和品质特性有很大影响[3-5]。 肉类产品的不一致性和纹理不均匀是肉类行业遇到的主要问题,影响嫩度和顾客的满意度[6-7]。同时,肉的嫩度与肉的色泽、保水性、安全性和氧化稳定性等其他品质密切相关,物理嫩化技术在改善肉嫩度的同时需要考虑对其他肉品质的影响。目前已经有许多研究证实PEF、US和HPP在肉嫩化方面具有巨大潜力[8-12],但是它们对改善其他肉品质方面存在各自的应用缺陷。PEF作为一种新型冷杀菌技术,最适合应用于没有气泡和低导电性的食品[13],对肉品的杀菌效果研究较少且存在争议,在牛乳、果汁等流质食品杀菌中已得到广泛应用[14-16]。US作为一种新型食品加工技术,其产生的负面影响同样不容忽视,特别是由空穴效应产生的局部高温高压和高活性自由基引发的自由基链式反应[17],促使脂肪和蛋白质发生氧化[18]。通常,脂质氧化会产生不愉快风味,而蛋白质氧化会对肉嫩度产生不良影响[19]。肉的HPP处理对肉的颜色有很大影响,无论“红肉”还是“白肉”,即使在低压水平(350 MPa)下处理也能观察到肉的变色,而肉的颜色是消费者在购买肉品时最关注的质量特征之一[20]。
可见确定物理嫩化对肉其他品质的影响是发展该技术的前提,同时提出相应的改善措施也至关重要。因此,本文就PEF、US和HPP技术的作用机理及应用效果进行综述,同时,针对它们在嫩化时的不足和缺陷,分析其影响因素并提出相应的改善措施。
1 肉品的嫩度
肌肉由存在于复杂的结缔组织网络中高度收缩的肌原纤维结合形成,其中的结缔组织相互交叉融合,形成应力和黏连,直接或间接与骨骼相连[21]。肌原纤维和肌内结缔组织是肌肉的主要结构成分,它们的结构和性质共同决定了肉的嫩度。
1.1 肌纤维特性对嫩度的影响
单个肌纤维主要由不同类型的肌原纤维蛋白组成,这些肌原纤维蛋白分为收缩性、细胞骨架性、肌浆性和调节性蛋白质[22],它们具有高度组织化的超微结构,由称为肌节的重复结构交替形成[23]。肌节是肌原纤维的重复构造单位,也是肌肉伸缩与松弛的基本单元,故肌纤维类型、密度、直径和肌节长度等因素的不同会引起肉嫩度的差异[1]。肌球蛋白重链(myosin heavy chain,MyHC)亚型在肌肉收缩中起作用,因为它们具有ATPase活性,为肌肉收缩提供能量[22],MyHC基因的多态性表达决定肌纤维类型,可分为I、2a、2x、2b型4 种类型,I、2a型属偏氧化型肌纤维,2x、2b型属偏酵解型肌纤维,氧化型肌纤维含量高则肌肉品质较好,酵解型肌纤维含量高则肌肉品质较差[24]。如Zlotnicka斑点猪的特点是胸长肌中2b型肌纤维的比例明显较小,I和2a型肌纤维的比例较高,由其获得的烟熏生腰肉在相比较的3 个品种(Zlotnicka斑点猪、杜洛克猪和波兰大白猪)中最嫩[25]。 此外,肉的嫩度与成熟过程中肌原纤维结构的变化有直接联系,特别是肌原纤维直径、肌原纤维之间的间距及其相互作用;而肌原纤维直径、肌原纤维之间的间距、肌节长度和蒸煮损失解释了肉嫩度的非均匀性[26]。
1.2 结缔组织特性对嫩度的影响
肌内结缔组织是肌肉组织的重要组成部分,对肉的质地和品质具有重要作用,在很大程度上影响了肉的 嫩度[27]。结缔组织呈网状且质地较硬,构成肌肉的支撑骨架,它的结构特性决定了肉的背景嫩度,其中胶原蛋白是结缔组织最主要的成分[28]。肌内结缔组织对肉嫩度的贡献主要是通过肌束膜和肌内膜中的胶原蛋白变化实现的,胶原蛋白的含量、溶解性、酶解性、热性质等特性均与肌内结缔组织的强度密切相关[29]。Zhang Min等[30] 研究发现,增加辐照剂量可以通过引起胶原蛋白片段的降解而显著降低样品的剪切力。与肌原纤维蛋白不同的是,胶原蛋白的热变性即胶原的明胶化会导致肉嫩度的下降,而烹饪是消费者完成消费的最后一步,也是至关重要的一步,因此研究胶原蛋白的热稳定性具有重要意义。加热过程中结缔组织的主要变化之一是胶原蛋白的准晶体结构转变为随机状结构,这种分子变化导致结缔组织缩短,并使它们具有橡胶样的性能[29]。在这种状态下,它们的机械性能取决于肌肉单位体积存在的交联键总数,这里的交联键主要是指分子内交联,即成熟交联,具有更好的热稳定性,有研究[31]表明,熟肉中胶原蛋白交联键数量的增加与肉嫩度降低的幅度接近一致。此外,肌内脂肪沉积与胶原蛋白交联有关,Liu Xiangdong等[32]研究发现,大理石纹等级更高的牛肉嫩度更好,而这与较低的胶原蛋白交联程度有关。
2 PEF嫩化技术
2.1 PEF的作用机理
PEF是一种新型的非热技术,其改变细胞膜结构和增强传质的能力引起了肉类科学家和技术专家的关注[33]。 PEF根据电压大小分为高压脉冲电场(high voltage pulsed electric field,HPEF)和低压脉冲电场(low voltage pulsed electric field,LPEF)。PEF的作用模式是在2 个电极之间施加电流,从而诱导电穿孔现象,实现对组织结构的非侵入性改变[34]。电穿孔现象(图1)是指HPEF可以改变脂肪的分子结构和增大部分蛋白质通道的开放度,此时,细胞膜在外加电场的作用下收缩并形成小孔,使细胞膜失去半透膜性质,小分子物质,如水分子可透过细胞膜进入细胞内,致使细胞体积膨胀而死 亡[35]。在低PEF强度下,电穿孔通常是可逆的,可逆穿孔往往在电场消失后自主恢复,而要形成不可逆穿孔则需要更高强度的PEF[36]。这也是经过HPEF处理后一些微生物会处于亚致死状态的原因,如热杀索丝菌,它们会在贮藏过程中恢复一定的生长量,最终参与肉品的 腐败变质[37]。
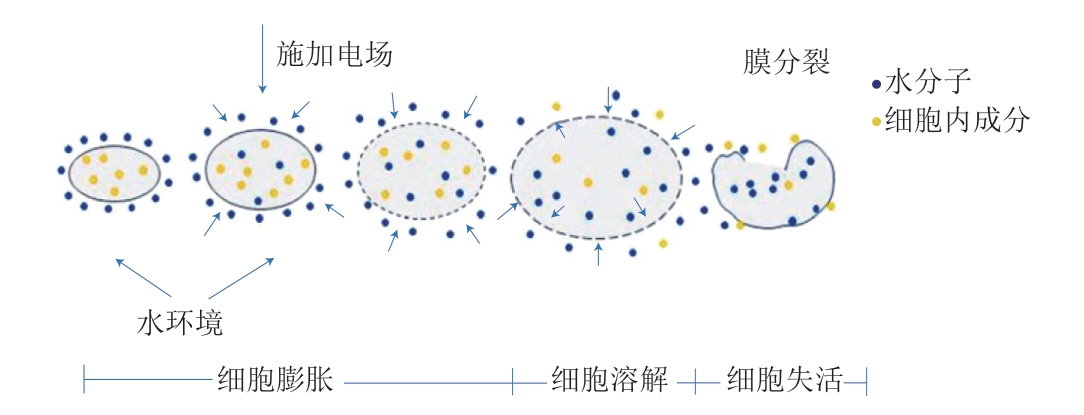
图1 PEF作用下细胞膜穿孔模型机理示意图[36]
Fig. 1 Schematic diagram of cell membrane perforation model under the action of PEF[36]
PEF的参数设置会影响它的应用效果,其中,主要部件的几何形状、脉冲特性等工艺参数决定了生物效应[38],生物效应主要指改变膜的通透性和使微生物 失活[39],细胞膜因电穿孔而变得更加通透,从而引起肉品质的变化。细胞膜损伤会导致以下3 个变化[40]:一是从细胞器中释放钙,从而激活钙依赖性蛋白酶-钙蛋白酶;二是从溶酶体中释放组织蛋白酶;三是由于钙的释放,会加速前期肌肉的糖酵解,这些都可以通过加速肌原纤维蛋白和胶原蛋白的降解提高肉的嫩度。
另外,基于空穴理论[41],当液体食品流经HPEF时,主间隙放电产生强大的脉冲电流,使液体汽化成温度高达数万摄氏度以上的等离子体,形成高压通路。正是由于这种高压脉冲能量直接转化成的冲压式机械能,引起液体食品中微生物细胞内部的强烈振动和细胞膜破裂等现象,从而对液体食品产生良好的杀菌效应[42]。
2.2 PEF在肉嫩化方面的应用
PEF对肉嫩度的作用效果与工艺参数、肌肉类型密切相关。表1列出了一些PEF处理对肉品嫩度的影响。
表1 PEF处理对肉嫩度的影响
Table 1 Effect of PEF treatment on meat tenderness
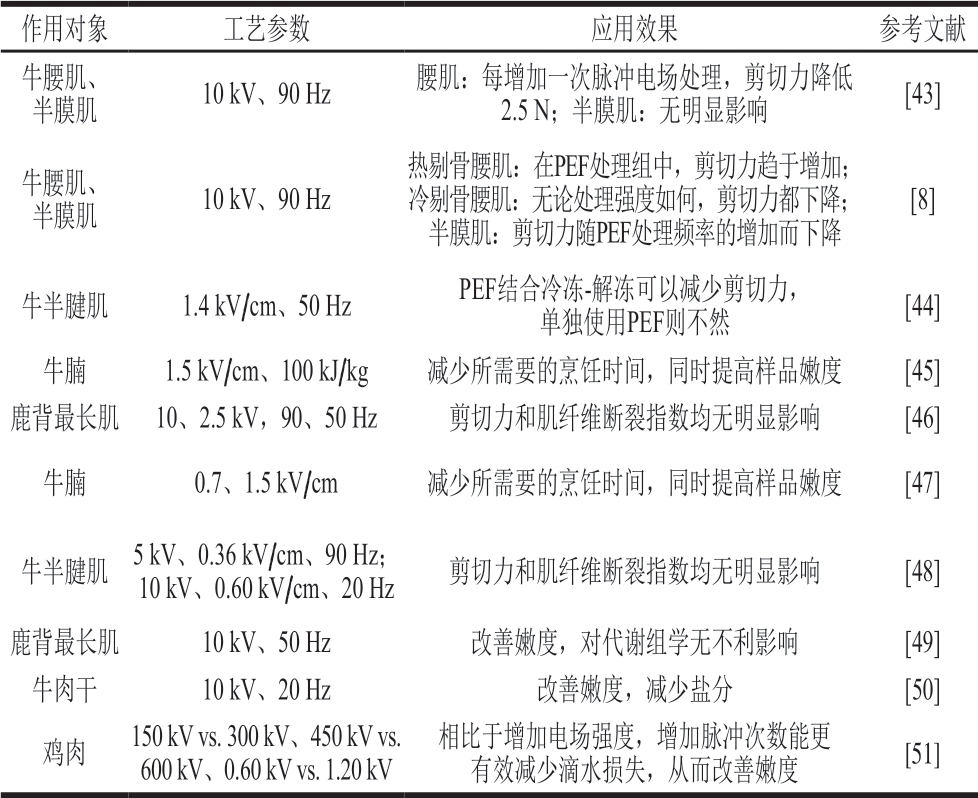
作用对象 工艺参数 应用效果 参考文献牛腰肌、半膜肌 10 kV、90 Hz 腰肌:每增加一次脉冲电场处理,剪切力降低2.5 N;半膜肌:无明显影响 [43]牛腰肌、半膜肌 10 kV、90 Hz热剔骨腰肌:在PEF处理组中,剪切力趋于增加;冷剔骨腰肌:无论处理强度如何,剪切力都下降;半膜肌:剪切力随PEF处理频率的增加而下降[8]牛半腱肌 1.4 kV/cm、50 Hz PEF结合冷冻-解冻可以减少剪切力,单独使用PEF则不然 [44]牛腩 1.5 kV/cm、100 kJ/kg 减少所需要的烹饪时间,同时提高样品嫩度 [45]鹿背最长肌 10、2.5 kV,90、50 Hz 剪切力和肌纤维断裂指数均无明显影响 [46]牛腩 0.7、1.5 kV/cm 减少所需要的烹饪时间,同时提高样品嫩度 [47]牛半腱肌 5 kV、0.36 kV/cm、90 Hz;10 kV、0.60 kV/cm、20 Hz 剪切力和肌纤维断裂指数均无明显影响 [48]鹿背最长肌 10 kV、50 Hz 改善嫩度,对代谢组学无不利影响 [49]牛肉干 10 kV、20 Hz 改善嫩度,减少盐分 [50]鸡肉 150 kV vs. 300 kV、450 kV vs. 600 kV、0.60 kV vs. 1.20 kV相比于增加电场强度,增加脉冲次数能更有效减少滴水损失,从而改善嫩度 [51]
PEF主要通过加速肌原纤维蛋白的水解和破坏肌肉的微结构2 个途径来改善肉嫩度[52],同时它的嫩化效果对样品本身的依赖程度很大,样品的温度、类型、pH值和预处理都对结果有影响。Suwandy等[8]评估PEF处理(5、10 kV,0、50、90 Hz)对牛肉腰长肌和半膜肌嫩度的影响。结果表明,随着处理频率的增加,牛腰长肌变得更坚韧,而半膜肌的剪切力降低21.6%;但是与未处理的对照样品相比,低强度PEF处理(20 Hz)后的腰长肌显示肌钙蛋白和肌间线蛋白的降解均有所增加。与该研究结果不同的是,Suwandy等[43]利用重复(1、2、3 次)PEF(10 kV、90 Hz、20 μs)处理腰肌和半膜肌时发现,每增加1 次PEF处理,腰肌的剪切力降低2.5 N,而半膜肌无明显变化。而Bhat等[53]通过对鹿肉进行相近的PEF处理(2.5 kV、50 Hz;10 kV、90 Hz),结果显示,剪切力并没有显著下降,但是钙蛋白酶活性和蛋白质降解均有小幅度增长的趋势。以上结果表明,应继续探索适用于不同部位、不同种类肉品的PEF工艺参数。此外,对样品进行一些合适的预处理有助于肉的嫩化,Faridnia等[44]研究发现,在PEF处理前进行冻融处理有助于牛肉的嫩化,同时该处理工艺并不改变处理后牛肉的脂肪酸组成。Suwandy等[8]利用PEF对低pH值(5.5~5.8)与高pH值(大于6.1)样品分别进行处理,结果表明,相比于高pH值样品,PEF改善低pH值样品嫩度的效果更明显。同时,也有研究表明,PEF处理对肉品结缔组织的胶原蛋白特性有显著影响,PEF能够降低结缔组织的热稳定性,可以将其应用于富含结缔组织的低值分割[34]。 Alahakoon等[45]研究发现,PEF处理可以减少硬肉切块的烹饪时间,因为它可以增加胶原蛋白的溶解性。
2.3 PEF与其他技术联用改善肉品安全性
PEF对肉制品的杀菌效果不及果汁、饮料等液体物料,仅可减少肉胴体表面部分革兰氏阴性菌,而且加大PEF在处理固体食品时的电场强度也不能使其杀菌效果达到较理想的水平[54]。因此考虑到PEF在肉品杀菌方面的局限性,需要结合其他方式来保障肉品的安全性。
PEF会使微生物的细胞膜受损,从而增强对乳酸链球菌素等抗菌剂的敏感性[55]。由于一些乳酸菌菌株对HPEF处理具有耐受能力,经HPEF处理后仍能够在低温条件下生长繁殖[37]。对此,李霜[37]研究HPEF(30.5 kHz、45 kV/cm、7 min)结合乳酸链球菌素处理对调理牛排货架期的影响,结果表明,乳酸链球菌素与该HPEF联合使用的最佳质量浓度为0.006 g/100 mL,经联合处理后,调理牛排的货架期较单独经HPEF处理的样品延长约7 d。此外,PEF联合精油、有机酸等天然防腐剂在改善肉品安全性方面也有相关研究。Clemente等[56]研究表明,仅经过HPEF处理不足以降低生鸡肉上肠炎沙门氏菌、大肠杆菌和空肠弯曲杆菌的数量,而联合精油、有机酸的协同处理对鸡腿肉中空肠弯曲杆菌的杀菌效果明显优于单独使用HPEF杀菌,这种协同杀菌方式可使空肠弯曲杆菌的最大减少量接近1.5 CFU/g。该研究表明,HPEF与多种精油、有机酸结合可用作禽肉加工中控制胴体空肠弯曲杆菌水平的措施。另外,Aşık-Canbaz等[57]研究中等强度PEF(2.50、4.67、7.00 kV/cm)对冷藏(4 ℃)期间鸡胸肉品质特性和一些致病菌(铜绿假单胞菌、空肠弯曲杆菌、金黄色葡萄球菌、单核细胞增生李斯特菌、肠炎沙门氏菌和大肠杆菌)生长情况的影响。实验测定了各处理样品在一定时间段内的总嗜温需氧菌数,结果表明,未经PEF处理的样品在贮藏6 d时的总嗜温需氧菌数为7.04(lg(CFU/g)),已超过腐败限值 7(lg(CFU/g)),而经4.67、7.00 kV/cm PEF处理的样品在贮藏8 d后的总嗜温需氧菌数才高于腐败限值,将保质期延长2 d以上。该研究表明,使用中等强度的直流脉冲结合冷藏可实现对鸡胸肉片的微生物抑制,从而改善肉品的安全性。
3 US嫩化技术
3.1 US的作用机理
US是21世纪90年代提出的一种物理嫩化技术,凭借安全性高、绿色环保、高效节能、运行成本低等优点而广泛应用于肉及肉制品中[1]。US已成功用于肉类嫩化,是传统肉类嫩化方法的替代方法,用于改善肉类的 品质[58]。US是一种频率高于20 kHz的声波,属于机械波的范畴,在人类的可听频率范围之外[59]。US在液体介质中的声物理效应和声化学效应包括空化效应、弥散效应及机械效应(高剪切力、搅拌和破碎效应等)[60-63],这些效应会影响肉的品质。
US的空化效应是指当介质中存在水时,水流发生空化后,US会引起液体中的微气泡经过振荡生成、长大、收缩、溃灭(图2),气泡溃灭之后会导致微气泡附近的液体生成强烈的激波,引发局部点的极端高温与高压,这种局部点的高能量足以使水分子内部的键断裂,进而发生反应,产生羟自由基和氢自由基[64]。
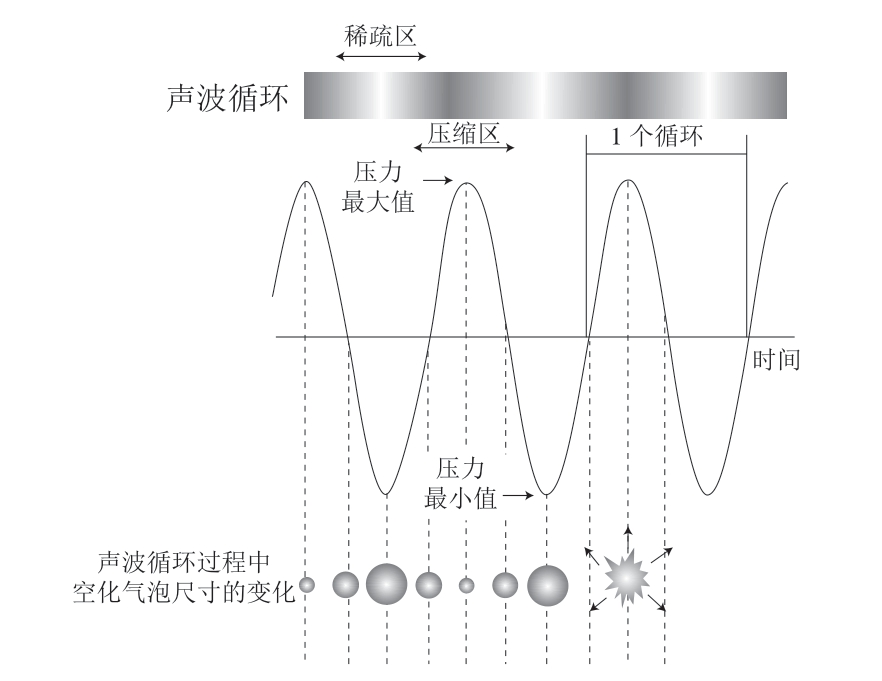
图2 空化气泡的增长及崩溃[65]
Fig. 2 Growth and collapse of cavitation bubbles[65]
机械效应是指空化效应过程中伴随的局部高压、湍流及高能剪切力;热效应是指介质吸收超声波产生能量后发生剧烈振荡,介质之间相互摩擦导致温度上升的过程;弥散效应是指超声波强化液体介质中物质的扩散过程[65],具体来说,US可以通过上述效应改善与肌肉嫩度有关的肌纤维(主要由肌原纤维构成)和肌内结缔组织(主要由胶原纤维构成)的特性,以达到嫩化肉制品的目的。总的来说归因于2 个主要方面:直接破坏肌肉组织结构完整性和间接激活相关酶的活性[19]。
3.2 US在肉嫩化方面的应用
US对肉嫩度的作用效果与工艺参数、肌肉类型密切相关。表2列出了一些US处理对肉嫩度的影响。
表2 US处理对肉嫩度的影响
Table 2 Effect of US treatment on meat tenderness
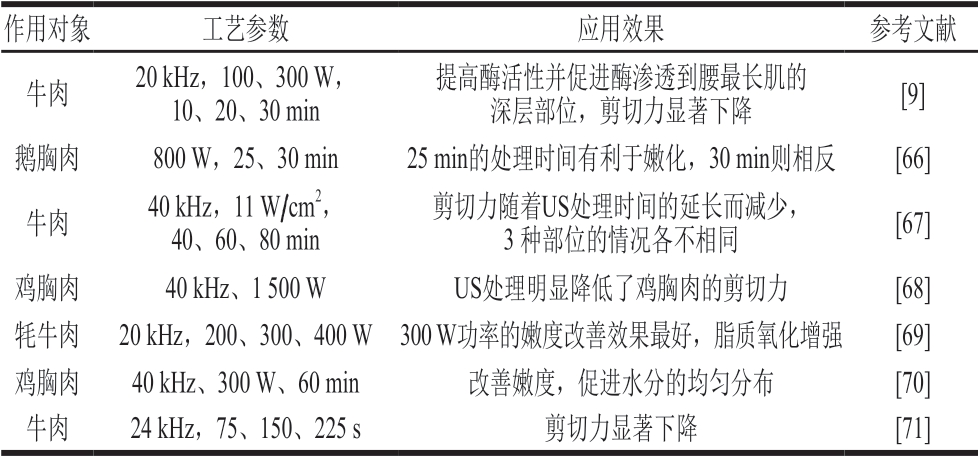
作用对象 工艺参数 应用效果 参考文献牛肉 20 kHz,100、300 W,10、20、30 min提高酶活性并促进酶渗透到腰最长肌的深层部位,剪切力显著下降 [9]鹅胸肉 800 W,25、30 min 25 min的处理时间有利于嫩化,30 min则相反 [66]牛肉 40 kHz,11 W/cm2,40、60、80 min剪切力随着US处理时间的延长而减少,3 种部位的情况各不相同 [67]鸡胸肉 40 kHz、1500 W US处理明显降低了鸡胸肉的剪切力 [68]牦牛肉 20 kHz,200、300、400 W 300 W功率的嫩度改善效果最好,脂质氧化增强 [69]鸡胸肉 40 kHz、300 W、60 min 改善嫩度,促进水分的均匀分布 [70]牛肉 24 kHz,75、150、225 s 剪切力显著下降 [71]
US嫩化作用的机制可归结为以下几点:肌肉结构的物理破坏;促进肌原纤维蛋白水解,该过程主要与内源性蛋白酶系统有关,例如激活钙蛋白酶、增加肌纤维断裂指数[72]。已有的研究表明,US处理对酶活性有激活或抑制作用,如Barekat等[9]通过US结合木瓜蛋白酶处理牛肉,研究发现,US处理可以作为改善酶扩散的新工艺,达到提高酶活性、促进酶渗透的效果,从而更好改善肉的嫩度,这也促使更多的相关研究集中于探究US处理对肉成熟进程的影响。Chen Lin等[68]对宰后5 d的鸡肉进行US处理(1500 W、40 kHz),研究发现,US通过影响细胞凋亡过程促进了肌原纤维蛋白的降解,缩短了肉的成熟进程。Gonzalez-Gonzalez等[67]研究发现,相较于其他部位,高强度超声对牛腰部肌肉的成熟有更明显的促进作用,并发现这与总胶原蛋白含量显著降低有关。Wang Lin等[73]评估US处理(0、300、600 W,20 min,20 kHz)结合宰后成熟时间(0、4、8 d)对牛半腱肌品质的影响,研究表明,300 W US处理是提高组织蛋白酶B、L活性的最优功率,在成熟进程中提高了胶原蛋白的热溶解性,可以将成熟进程缩短到4 d。以上的研究表明,US嫩化处理可以作为肉类企业缩短肉成熟时间的一个有效措施。
3.3 US与其他技术联用改善肉品氧化稳定性
应用US嫩化技术时,由空穴效应产生的局部高温高压和高活性自由基引发的自由基链式反应会使得肉品在加工和保质期极易受到氧化,随之而来的是质量的劣化,氧化现象包括脂质氧化和蛋白质氧化[74-75]。脂质氧化对肉的质量有潜在的负面影响,会引起肉品的感官和营养特性发生不理想变化[76],而蛋白质氧化则主要对肉品嫩度产生不良影响[19]。具体来说,肉品的氧化会导致异味的产生、颜色的恶化以及由于必需脂肪酸和维生素的分解而导致营养质量的下降[77]。
抗氧化物质可以通过清除氧化引发的自由基、打破链式反应、分解过氧化物、降低局部氧浓度以及与金属离子催化剂等形成链式的催化剂结合来抑制脂质氧化[78]。 目前的研究多集中于天然抗氧化物质,其中的多酚类物质因为具有相当于或优于合成抗氧化剂的抗氧化性及抗微生物活性而备受相关研究者的关注[79]。de Araujo等[80]研究US处理结合针叶樱桃提取物腌制对猪肉嫩度和脂质氧化的影响,结果表明,US协同该天然抗氧化提取物的处理方式在改善肉硬度和咀嚼性的同时,抑制了肉品的脂质氧化,最终提高了肉的品质。Demir等[81]研究未腌制组、洋葱汁腌制组及US联合腌制处理组对牛背最长肌嫩度和脂质氧化水平的影响,结果表明,联合处理可以在显著降低牛肉硬度的同时降低脂质氧化水平。原因在于洋葱汁中含有阿魏酸、没食子酸、原儿茶酸、槲皮素和有机硫酸等抗氧化物质,该研究也表明US协同天然抗氧化提取物腌制处理在改善肉品氧化稳定性方面具有显著作用。此外,Zhang Mingcheng等[82]通过180 W超声辅助浸泡冷冻处理猪背最长肌,结果表明,该方法得到的冰晶小且分布均匀,有助于在长期冷冻贮藏期间显著降低脂质氧化程度。Vaz Leaes等[83]研究US联合碱性电解水处理对低钠熟香肠氧化特征的影响(5 ℃下贮藏90 d),结果表明,US处理时碱性电解水的存在会加速脂质氧化和蛋白质氧化,而US处理结合2 种质量浓度的氯化钠溶液(2.50、1.75 g/100 mL)均不会加速贮藏期间的脂质氧化。
4 HPP嫩化技术
4.1 HPP的作用机理
HPP通过液体传输器将压力以等静压的方式均匀地传递到产品上[40]。HPP在食品和肉类中的应用侧重于延长保质期和提高食品安全性,其改善肉类嫩度的作用也已经得到证实[84]。HPP可以在环境温度、低温及高温下应用,对肉的蛋白质和质地产生不同的影响:高温变性的蛋白质有聚集趋势,并且聚集体在冷却后保持稳定;而压力有利于蛋白质的解离和展开,一旦压力消除,就会重新折叠和重新结合[85]。肉类的嫩化通常与蛋白质溶解度的增加有关,HPP处理似乎通过增加蛋白质的溶解度来诱导嫩化,这是蛋白质在压力下解聚的结果[86]。超高压作用下,蛋白质分子间的氢键作用逐渐减小,蛋白质分子间的相互作用逐渐减弱,从而导致氢键断裂,蛋白质分子展开,非极性基团暴露出来,肌球蛋白和肌动蛋白的二级结构被破坏,最终导致蛋白质变性并提高肉制品嫩度(图3)[87]。
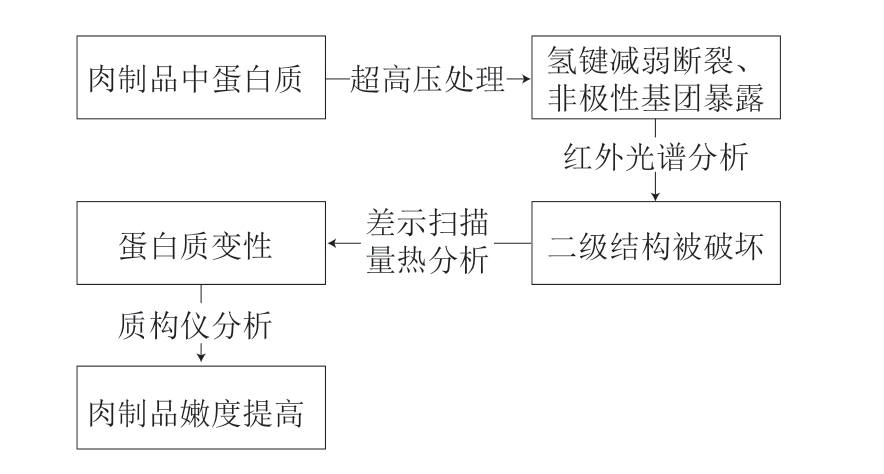
图3 超高压诱导下的蛋白质变性提高肉制品嫩度过程[87]
Fig. 3 Protein denaturation induced by ultra-high pressure improves the tenderness of meat products[87]
然而,HPP处理不适用于生肉,因为它会导致生肉的亮度值和黄度值增加,有时会出现“煮熟”的 外观[88]。可能的原因包括高压诱导的蛋白质变性、非共价键的破坏、色素在不透明的肉中不易表现以及肌红蛋白的氧化[89]。有研究表明,超高压处理导致肉的黄度值增大,这与肌红蛋白二级结构中α-螺旋的减少有关[87]。
4.2 HPP在肉嫩化方面的应用
HPP对肉嫩度的作用效果取决于肌肉的类型和宰后时间以及所使用的压力、温度、时间等,这些条件的不同会导致截然不同的结果出现[40]。Morton等[90]研究发现,HPP嫩化的原理与肉的低温长时间成熟嫩化原理不同,低温长时间成熟导致的嫩化主要是基于内源酶系统对蛋白质的水解。而该实验中HPP处理(175 MPa、3 min)会导致肌纤维断裂指数降低、肌节缩短和钙蛋白酶1激活减少,而这些参数变化在低温长时间成熟过程中会导致肉嫩度的下降。同时,HPP也直接破坏了Z盘、 M线和A带的组织结构,嫩度显著改善,说明HPP主要通过对肌纤维结构完整性造成物理破坏来改善肉的嫩度。与之不同的是,Zhang Huijuan等[91]对猪腰肌进行HPP处理(300~400 MPa),发现肌纤维断裂指数随着压力的增加而线性增加,同时钙蛋白酶活性降低,该处理可以有效抑制僵直的发生并改善肉的嫩度。Zhou Yajun等[92]利用HPP处理鹿肉,发现肌纤维断裂指数和胶原蛋白的热溶解度均增加,肉的硬度和咀嚼度分别下降58.7%和75.0%。
4.3 HPP与其他技术联用改善肉品色泽
当HPP应用在生肉上时,压力超过400 MPa会导致肉品质显著下降,主要是颜色和气味上的变化[93]。其原因在于肌红蛋白在约400 MPa时变性,同时肉中血红色素和铁蛋白的复合物释放出铁,此时肉的色泽会呈现褐色[11]。而Zhang Huijuan等[91]的研究则发现,压力超过200 MPa时,猪肉色泽有变白的趋势,当压力超过300 MPa时,肉的颜色会变成灰色,该颜色变化趋势变得不可接受。
肉的颜色变化主要取决于色素肌红蛋白的氧化或还原程度[94]。氧化作用最终在宰后肌肉中占主导地位,促氧化因子和抗氧化因子之间平衡的转变是肉色的一个重要决定因素[95]。因此控制氧化稳定性对色泽的控制也发挥着重要作用。天然来源的抗氧化剂是目前的一个研究热点,但是关于HPP结合天然抗氧化剂处理对肉品色泽的影响研究较少,近期有以下研究表明天然抗氧化物质的添加并不能在HPP中起到改善肉品色泽的作用。Cunha等[96]研究表明,HPP处理(500 MPa、10 min)结合微胶囊化的火龙果皮提取物(100、1000 mg/kg)对猪肉馅饼的颜色没有改善作用。Villamonte等[97]的研究表明,HPP处理(500 MPa、20 ℃、6 min)结合抗坏血酸钠(0.05%,m/m)和迷迭香提取物(0.05%,m/m)处理不影响猪肉氧化过程的颜色变化。值得关注的是,HPP技术结合气调包装技术在肉品护色方面具有改善作用,张慧娟等[98]研究表明,2% CO协同300 MPa以内的压力可以在一定范围内对冷却肉进行有效杀菌,同时能够保证肉的颜色,且先充气包装后HPP处理效果更显著。具体来说,CO无杀菌效果,但有一定的抑菌效果,其协同超高压可以延长肉的贮藏期,该技术的重点在于寻找合适的气体组成以获取最佳颜色并提高颜色稳定性。
5 结语
化学嫩化法和生物嫩化法分别存在安全性低和过度嫩化的缺陷,而物理嫩化法因其绿色、高效等优点在肉类企业具有巨大的应用前景。但是随着消费者对预制食品需求的快速增长,如预制牛排等,现有的一些物理嫩化技术并不能达到所需要的效果,因此仍需要探索新的物理嫩化技术并改良传统的腌制工艺。同时,为满足消费者对营养、健康类肉制品的需求,天然来源的提取物与物理嫩化技术联用将是一个研究热点,这将为研究和开发绿色、健康的肉类产品提供相应的理论支撑。
[1] 王颂萍, 王雪羽, 杨欣悦, 等. 超声波技术嫩化机理及其在肉制品中应用效果的研究进展[J]. 食品工业科技, 2022, 43(9): 423-431. DOI:10.13386/j.issn1002-0306.2021040166.
[2] 季现秋, 罗欣, 朱立贤, 等. 新型牛肉嫩化技术研究进展[J]. 食品与发酵工业, 2021, 47(1): 327-333. DOI:10.13995/j.cnki.11-1802/ts.024809.
[3] BOJORGES H, RÍOS-CORRIPIO M A, HERNÁNDEZ-CÁZARES A S, et al. Effect of the application of an edible film with turmeric (Curcuma longa L.) on the oxidative stability of meat[J]. Food Science and Nutrition, 2020, 8(8): 4308-4319. DOI:10.1002/fsn3.1728.
[4] MA Danyi, KIM Y H B. Proteolytic changes of myofibrillar and small heat shock proteins in different bovine muscles during aging: their relevance to tenderness and water-holding capacity[J]. Meat Science, 2020, 163: 108090. DOI:10.1016/j.meatsci.2020.108090.
[5] BURKE R M, MONAHAN F J. The tenderisation of shin beef using a citrus juice marinade[J]. Meat Science, 2003, 63(2): 161-168. DOI:10.1016/S0309-1740(02)00062-1.
[6] ZHOU Yang, ZHOU Changyu, PAN Daodong, et al. The effect of sodium chloride levels on the taste and texture of dry-cured ham[J]. Journal of Food Measurement and Characterization, 2020, 14(5): 2646-2655. DOI:10.1007/s11694-020-00511-3.
[7] ROMANOV D, KOROSTYNSKA O, LEKANG O I, et al. Towards human-robot collaboration in meat processing: challenges and possibilities[J]. Journal of Food Engineering, 2022, 331: 111117. DOI:10.1016/j.jfoodeng.2022.111117.
[8] SUWANDY V, CARNE A, VAN DE VEN R, et al. Effect of pulsed electric field treatment on hot-boned muscles of different potential tenderness[J]. Meat Science, 2015, 105: 25-31. DOI:10.1016/j.meatsci.2015.02.009.
[9] BAREKAT S, SOLTANIZADEH N. Effects of ultrasound on microstructure and enzyme penetration in beef Longissimus lumborum muscle[J]. Food and Bioprocess Technology, 2018, 11(3): 680-693. DOI:10.1007/s11947-017-2043-8.
[10] KANG Dacheng, GAO Xueqin, GE Qingfeng, et al. Effects of ultrasound on the beef structure and water distribution during curing through protein degradation and modification[J]. Ultrasonics Sonochemistry, 2017, 38: 317-325. DOI:10.1016/j.ultsonch.2017.03.026.
[11] MA Hanjun, LEDWARD D A. High pressure processing of fresh meat: is it worth it?[J]. Meat Science, 2013, 95(4): 897-903. DOI:10.1016/j.meatsci.2013.03.025.
[12] LI Zhen, YANG Zongyun, ZHANG Yulong, et al. Innovative characterization based on stress relaxation and creep to reveal the tenderizing effect of ultrasound on wooden breast[J]. Foods, 2021, 10(1): 195. DOI:10.3390/foods10010195.
[13] ALIREZALU K, MUNEKATA P E S, PARNIAKOV O, et al. Pulsed electric field and mild heating for milk processing: a review on recent advances[J]. Journal of the Science of Food and Agriculture, 2020, 100(1): 16-24. DOI:10.1002/jsfa.9942.
[14] DELSO C, MANUEL MARTINEZ J, CEBRIAN G, et al. Understanding the occurrence of tailing in survival curves of Salmonella typhimurium treated by pulsed electric fields[J]. Bioelectrochemistry, 2020, 135: 107580. DOI:10.1016/j.bioelechem.2020.107580.
[15] MENDES-OLIVEIRA G, JIN T Z, CAMPANELLA O H. Modeling the inactivation of Escherichia coli O157:H7 and Salmonella typhimurium in juices by pulsed electric fields: the role of the energy density[J]. Journal of Food Engineering, 2020, 282: 110001. DOI:10.1016/j.jfoodeng.2020.110001.
[16] SHINDE G P, KUMAR R, REDDY K R, et al. Effect of pulsed electric field processing on reduction of sulfamethazine residue content in milk[J]. Journal of Food Science and Technology-Mysore, 2022, 59(5): 1931-1938. DOI:10.1007/s13197-021-05207-0.
[17] KANG Dacheng, ZOU Yunhe, CHENG Yuping, et al. Effects of power ultrasound on oxidation and structure of beef proteins during curing processing[J]. Ultrasonics Sonochemistry, 2016, 33: 47-53. DOI:10.1016/j.ultsonch.2016.04.024.
[18] PEÑA M, ALARCON-ROJO A, RENTERIA A, et al. Quality and sensory profile of ultrasound-treated beef[J]. Italian Journal of Food Science, 2017, 29: 463-475.
[19] 黄亚军, 周存六. 超声波技术在肉及肉制品中的应用研究进展[J]. 肉类研究, 2020, 34(5): 91-97. DOI:10.7506/rlyj1001-8123-20200319-079.
[20] BAK K H, BOLUMAR T, KARLSSON A H, et al. Effect of high pressure treatment on the color of fresh and processed meats: a review[J]. Critical Reviews in Food Science and Nutrition, 2019, 59(2): 228-252. DOI:10.1080/10408398.2017.1363712.
[21] LISTRAT A, LEBRET B, LOUVEAU I, et al. How muscle structure and composition influence meat and flesh quality[J]. The Scientific World Journal, 2016, 2016: 1-14. DOI:10.1155/2016/3182746.
[22] GAGAOUA M, PICARD B. Muscle fiber properties in cattle and their relationships with meat qualities: an overview[J]. Journal of Agricultural and Food Chemistry, 2020, 68(22): 6021-6039. DOI:10.1021/acs.jafc.0c02086.
[23] CHOI Y M, KIM B C. Muscle fiber characteristics, myofibrillar protein isoforms, and meat quality[J]. Livestock Science, 2009, 122(2): 105-118. DOI:10.1016/j.livsci.2008.08.015.
[24] 欧秀琼, 李睿, 张晓春, 等. 肌纤维类型组成对猪肌肉品质与能量代谢的影响研究进展[J]. 浙江农业学报, 2022, 34(1): 196-203.
[25] SZULC K, WOJTYSIAK D, MIGDAL L, et al. The muscle fibre characteristics and the meat quality of M. longissimus thoracis from polish native zlotnicka spotted pigs and the crossbreed fatteners from the crossing of Duroc and polish large white boars[J]. Applied Sciences-Basel, 2022, 12(6): 3051. DOI:10.3390/app12063051.
[26] SOJI Z. Effect of the muscle nanostructure changes during postmortem aging on tenderness of different beef breeds[J]. Animal Bioscience, 2021, 34(11): 1849-1858. DOI:10.5713/ajas.20.0488.
[27] 汪洋, 王稳航. 肌内结缔组织与肉嫩度的关联机制及相关肉嫩化技术的研究进展[J]. 食品科学, 2021, 42(11): 332-340. DOI:10.7506/spkx1002-6630-20200427-354.
[28] 刘晶晶. 结缔组织热变化对牛肉嫩度影响的研究[D]. 北京: 中国农业科学院, 2018: 2-3.
[29] 汪洋, 王稳航. 肌内结缔组织的组成、分布及生长调控研究进展[J]. 中国食品学报, 2021, 21(7): 349-359. DOI:10.16429/j.1009-7848.2021.07.042.
[30] ZHANG Min, HE Lichao, LI Chengliang, et al. Effects of gamma ray irradiation-induced protein hydrolysis and oxidation on tenderness change of fresh pork during storage[J]. Meat Science, 2020, 163: 108058. DOI:10.1016/j.meatsci.2020.108058.
[31] LATORRE M E, PALACIO M I, VELAZQUEZ D E, et al. Specific effects on strength and heat stability of intramuscular connective tissue during long time low temperature cooking[J]. Meat Science, 2019, 153: 109-116. DOI:10.1016/j.meatsci.2019.03.016.
[32] LIU Xiangdong, MOFFITT-HEMMER N R, DEAVILA J M, et al. Wagyu-angus cross improves meat tenderness compared to angus cattle but unaffected by mild protein restriction during late gestation[J]. Animal, 2021, 15(2): 100144. DOI:10.1016/j.animal.2020.100144.
[33] BHAT Z F, MORTON J D, MASON S L, et al. Current and future prospects for the use of pulsed electric field in the meat industry[J]. Critical Reviews in Food Science and Nutrition, 2019, 59(10): 1660-1674. DOI:10.1080/10408398.2018.1425825.
[34] GOMEZ B, MUNEKATA P E S, GAVAHIAN M, et al. Application of pulsed electric fields in meat and fish processing industries: an overview[J]. Food Research International, 2019, 123: 95-105. DOI:10.1016/j.foodres.2019.04.047.
[35] 谢媚, 曹锦轩, 张玉林, 等. 高压脉冲电场杀菌技术在肉品加工中的应用进展[J]. 核农学报, 2014, 28(1): 97-100.
[36] 熊强, 董智勤, 朱芳州. 脉冲电场技术在食品工业上的应用进展[J]. 现代食品科技, 2022, 38(2): 326-339; 255. DOI:10.13982/j.mfst.1673-9078.2022.2.0428.
[37] 李霜. 高压脉冲电场联合乳酸链球菌素对调理牛肉保鲜效果的研究[D]. 雅安: 四川农业大学, 2019: 5-6. DOI:10.27345/d.cnki.gsnyu.2019.000772.
[38] BARSOTTI L, MERLE P, CHEFTEL J C. Food processing by pulsed electric fields. I. physical aspects[J]. Food Reviews International, 1999, 15(2): 163-180. DOI:10.1080/87559129909541185.
[39] BARSOTTI L, CHEFTEL J C. Food processing by pulsed electric fields. ii. biological aspects[J]. Food Reviews International, 1999, 15(2): 181-213. DOI:10.1080/87559129909541186.
[40] WARNER R D, MCDONNELL C K, BEKHIT A E D, et al. Systematic review of emerging and innovative technologies for meat tenderisation[J]. Meat Science, 2017, 132: 72-89. DOI:10.1016/j.meatsci.2017.04.241.
[41] 何进武, 黄惠华. 食品高压脉冲电场杀菌技术[J]. 食品与机械, 2007(4): 155-158. DOI:10.13652/j.issn.1003-5788.2007.04.040.
[42] 袁丽佳, 何博, 姜彬, 等. 食品高压脉冲电场杀菌技术[J]. 科技信息, 2011(7): 26; 36.
[43] SUWANDY V, CARNE A, VAN DE VEN R, et al. Effect of repeated pulsed electric field treatment on the quality of cold-boned beef loins and topsides[J]. Food and Bioprocess Technology, 2015, 8(6): 1218-1228. DOI:10.1007/s11947-015-1485-0.
[44] FARIDNIA F, MA Q L, BREMER P J, et al. Effect of freezing as pre-treatment prior to pulsed electric field processing on quality traits of beef muscles[J]. Innovative Food Science and Emerging Technologies, 2015, 29: 31-40. DOI:10.1016/j.ifset.2014.09.007.
[45] ALAHAKOON A U, OEY I, SILCOCK P, et al. Understanding the effect of pulsed electric fields on thermostability of connective tissue isolated from beef pectoralis muscle using a model system[J]. Food Research International, 2017, 100: 261-267. DOI:10.1016/j.foodres.2017.08.025.
[46] BHAT Z F, MORTON J D, MASON S L, et al. Effect of pulsed electric field on calpain activity and proteolysis of venison[J]. Innovative Food Science and Emerging Technologies, 2019, 52: 131-135. DOI:10.1016/j.ifset.2018.11.006.
[47] JEONG S H, KIM E C, LEE D U. The impact of a consecutive process of pulsed electric field, sous-vide cooking, and reheating on the properties of beef Semitendinosus muscle[J]. Foods, 2020, 9(11): 1674. DOI:10.3390/foods9111674.
[48] KHALED A Y, PARRISH C A, ADEDEJI A. Emerging nondestructive approaches for meat quality and safety evaluation: a review[J]. Comprehensive Reviews in Food Science and Food Safety, 2021, 20(4): 3438-3463. DOI:10.1111/1541-4337.12781.
[49] MUNGURE T E, FAROUK M M, BIRCH E J, et al. Effect of PEF treatment on meat quality attributes, ultrastructure and metabolite profiles of wet and dry aged venison Longissimus dorsi muscle[J]. Innovative Food Science and Emerging Technologies, 2020, 65: 102457. DOI:10.1016/j.ifset.2020.102457.
[50] BHAT Z F, MORTON J D, MASON S L, et al. The application of pulsed electric field as a sodium reducing strategy for meat products[J]. Food Chemistry, 2020, 306: 125622. DOI:10.1016/j.foodchem.2019.125622.
[51] BHAT Z F, MORTON J D, MASON S L, et al. Cooking does not impair the impact of pulsed electric field on the protein digestion of venison (Cervus elaphus) during in vitro gastrointestinal digestion[J]. International Journal of Food Science and Technology, 2021, 56(6): 3026-3033. DOI:10.1111/ijfs.14946.
[52] KAUR L, HUI S X, MORTON J D, et al. Endogenous proteolytic systems and meat tenderness: influence of post-mortem storage and processing[J]. Food Science of Animal Resources, 2021, 41(4): 589-607. DOI:10.5851/kosfa.2021.e27.
[53] BHAT Z F, MORTON J D, MASON S L, et al. Effect of pulsed electric field on calpain activity and proteolysis of venison[J]. Innovative Food Science and Emerging Technologies, 2019, 52: 131-135. DOI:10.1016/j.ifset.2018.11.006.
[54] 齐梦圆, 刘卿妍, 石素素, 等. 高压电场技术在食品杀菌中的应用研究进展[J]. 食品科学, 2022, 43(11): 284-292. DOI:10.7506/spkx1002-6630-20210313-175.
[55] BHAT Z F, MORTON J D, MASON S L, et al. Current and future prospects for the use of pulsed electric field in the meat industry[J]. Critical Reviews in Food Science and Nutrition, 2019, 59(10): 1660-1674. DOI:10.1080/10408398.2018.1425825.
[56] CLEMENTE I, CONDON-ABANTO S, PEDROS-GARRIDO S, et al. Efficacy of pulsed electric fields and antimicrobial compounds used alone and in combination for the inactivation of Campylobacter jejuni in liquids and raw chicken[J]. Food Control, 2020, 107: 106491. DOI:10.1016/j.foodcont.2019.01.017.
[57] AŞIK-CANBAZ E, ÇÖMLEKÇI S, CAN SEYDIM A. Effect of moderate intensity pulsed electric field on shelf-life of chicken breast meat[J]. British Poultry Science, 2022, 63(6): 1-9. DOI:10.1080/00071668.2022.2051431.
[58] DELIA ALARCON-ROJO A, MANUEL CARRILLO-LOPEZ L, REYES-VILLAGRANA R, et al. Ultrasound and meat quality: a review[J]. Ultrasonics Sonochemistry, 2019, 55: 369-382. DOI:10.1016/j.ultsonch.2018.09.016.
[59] CAREL J A, GARCIA-PEREZ J V, BENEDITO J, et al. Food process innovation through new technologies: use of ultrasound[J]. Journal of Food Engineering, 2012, 110(2): 200-207. DOI:10.1016/j.jfoodeng.2011.05.038.
[60] AREFI-OSKOUI S, KHATAEE A, SAFARPOUR M, et al. A review on the applications of ultrasonic technology in membrane bioreactors[J]. Ultrasonics Sonochemistry, 2019, 58: 104633. DOI:10.1016/j.ultsonch.2019.104633.
[61] FU Xizhen, BELWAL T, CRAVOTTO G, et al. Sono-physical and sono-chemical effects of ultrasound: primary applications in extraction and freezing operations and influence on food components[J]. Ultrasonics Sonochemistry, 2020, 60: 104726. DOI:10.1016/j.ultsonch.2019.104726.
[62] PILLI S, BHUNIA P, YAN S, et al. Ultrasonic pretreatment of sludge: a review[J]. Ultrasonics Sonochemistry, 2011, 18(1): 1-18. DOI:10.1016/j.ultsonch.2010.02.014.
[63] JIANG Qiyong, ZHANG Min, XU Baoguo. Application of ultrasonic technology in postharvested fruits and vegetables storage: a review[J]. Ultrasonics Sonochemistry, 2020, 69: 105261. DOI:10.1016/j.ultsonch.2020.105261.
[64] 姬长舟, 任建武. 超声空化效应及其对植物活性成分抗氧化性的影响[J]. 绿色科技, 2017(4): 148-151; 155. DOI:10.16663/j.cnki.lskj.2017.04.054.
[65] SORIA A C, VILLAMIEL M. Effect of ultrasound on the technological properties and bioactivity of food: a review[J]. Trends in Food Science and Technology, 2010, 21(7): 323-331. DOI:10.1016/j.tifs.2010.04.003.
[66] CICHOSKI A J, DA SILVA J S, VAZ LEAES Y S, et al. Effects of ultrasonic-assisted cooking on the volatile compounds, oxidative stability, and sensory quality of mortadella[J]. Ultrasonics Sonochemistry, 2021, 72: 105443. DOI:10.1016/j.ultsonch.2020.105443.
[67] GONZALEZ-GONZALEZ L, ALARCON-ROJO A D, CARRILLOLOPEZ L M, et al. Does ultrasound equally improve the quality of beef? An insight into Longissimus lumborum, Infraspinatus and Cleidooccipitalis[J]. Meat Science, 2020, 160: 107963. DOI:10.1016/j.meatsci.2019.107963.
[68] CHEN Lin, CHAI Yuwei, LUO Jun, et al. Apoptotic changes and myofibrils degradation in post-mortem chicken muscles by ultbaorasonic processing[J]. LWT-Food Science and Technology, 2021, 142: 110985. DOI:10.1016/j.lwt.2021.110985.
[69] BAO Pengqi, CHEN Li, WANG Yu, et al. Quality of frozen porcine Longissimus lumborum muscles injected with L-arginine and L-lysine solution[J]. Meat Science, 2021, 179: 108530. DOI:10.1016/j.meatsci.2021.108530.
[70] AL-HILPHY A R, AL-TEMIMI A B, AL RUBAIY H H M, et al. Ultrasound applications in poultry meat processing: a systematic review[J]. Journal of Food Science, 2020, 85(5): 1386-1396. DOI:10.1111/1750-3841.15135.
[71] ALP H, KARAKAYA M. Textural and microstructural characteristics of beef M. longissimus thoracis[J]. Fleischwirtschaft, 2022, 102(3): 130-137.
[72] OJHA K S, TIWARI B K, O’DONNELL C P. Effect of ultrasound technology on food and nutritional quality[M/OL]//STEVE T. Advances in food and nutrition research. Elsevier, 2018: 207-240. DOI:10.1016/bs.afnr.2018.01.001.
[73] WANG Lin, LI Jingjun, TENG Shuang, et al. Changes in collagen properties and cathepsin activity of beef M. semitendinosus by the application of ultrasound during post-mortem aging[J]. Meat Science, 2022, 185: 108718. DOI:10.1016/j.meatsci.2021.108718.
[74] ZAMUZ S, LÓPEZ-PEDROUSO M, BARBA F J, et al. Application of hull, bur and leaf chestnut extracts on the shelf-life of beef patties stored under map: evaluation of their impact on physicochemical properties, lipid oxidation, antioxidant, and antimicrobial potential[J]. Food Research International, 2018, 112: 263-273. DOI:10.1016/j.foodres.2018.06.053.
[75] HORITA C N, BAPTISTA R C, CATURLA M Y R, et al. Combining reformulation, active packaging and non-thermal post-packaging decontamination technologies to increase the microbiological quality and safety of cooked ready-to-eat meat products[J]. Trends in Food Science and Technology, 2018, 72: 45-61. DOI:10.1016/j.tifs.2017.12.003.
[76] MUNEKATA P E S, ROCCHETTI G, PATEIRO M, et al. Addition of plant extracts to meat and meat products to extend shelf-life and health-promoting attributes: an overview[J]. Current Opinion in Food Science, 2020, 31: 81-87. DOI:10.1016/j.cofs.2020.03.003.
[77] DOMÍNGUEZ R, PATEIRO M, GAGAOUA M, et al. A comprehensive review on lipid oxidation in meat and meat products[J]. Antioxidants, 2019, 8(10): 429. DOI:10.3390/antiox8100429.
[78] LEE S Y, LEE D Y, KIM O Y, et al. Overview of studies on the use of natural antioxidative materials in meat products[J]. Food Science of Animal Resources, 2020, 40(6): 863-880. DOI:10.5851/ kosfa.2020.e84.
[79] VELAZQUEZ L, QUINONES J, DIAZ R, et al. Natural antioxidants from endemic leaves in the elaboration of processed meat products: current status[J]. Antioxidants, 2021, 10(9): 1396. DOI:10.3390/antiox10091396.
[80] DE ARAUJO C D L, DA SILVA G F G, DE ALMEIDA J L S, et al. Use of ultrasound and acerola (Malpighia emarginata) residue extract tenderness and lipid oxidation of pork meat[J]. Food Science and Technology, 2022, 42: e66321. DOI:10.1590/fst.66321.
[81] DEMIR H, ÇELIK S, SEZER Y Ç. Effect of ultrasonication and vacuum impregnation pretreatments on the quality of beef marinated in onion juice a natural meat tenderizer[J]. Food Science and Technology International, 2022, 28(4): 340-352. DOI:10.1177/10820132211012919.
[82] ZHANG Mingcheng, XIA Xiufang, LIU Qian, et al. Changes in microstructure, quality and water distribution of porcine Longissimus muscles subjected to ultrasound-assisted immersion freezing during frozen storage[J]. Meat Science, 2019, 151: 24-32. DOI:10.1016/j.meatsci.2019.01.002.
[83] VAZ LEAES Y S, SILVA J S, ROBALO S S, et al. Combined effect of ultrasound and basic electrolyzed water on the microbiological and oxidative profile of low-sodium mortadellas[J]. International Journal of Food Microbiology, 2021, 353: 109310. DOI:10.1016/j.ijfoodmicro.2021.109310.
[84] MA Qianli, HAMID N, OEY I, et al. The impact of high-pressure processing on physicochemical properties and sensory characteristics of three different lamb meat cuts[J]. Molecules, 2020, 25(11): 2665. DOI:10.3390/molecules25112665.
[85] SMELLER L. Pressure-temperature phase diagrams of biomolecules[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology, 2002, 1595(1): 11-29. DOI:10.1016/S0167-4838(01)00332-6.
[86] SUN Xiangdong, HOLLEY R A. High hydrostatic pressure effects on the texture of meat and meat products[J]. Journal of Food Science, 2010, 75(1): R17-R23. DOI:10.1111/j.1750-3841.2009.01449.x.
[87] 贺玉珊, 吴琼, 吴酉芝, 等. 超高压嫩化肉制品机理的研究进展[J]. 食品工业, 2018, 39(8): 224-227.
[88] NETO O C, ROSENTHAL A, DELIZA R, et al. Effects of hydrostatic pressure processing on texture and color of zebu beef[J]. Food and Bioprocess Technology, 2015, 8(4): 837-843. DOI:10.1007/s11947-014-1451-2.
[89] CHEAH P B, LEDWARD D A. High pressure effects on lipid oxidation in minced pork[J]. Meat Science, 1996, 43(2): 123-134. DOI:10.1016/0309-1740(96)84584-0.
[90] MORTON J D, LEE H Y Y, PEARSON R G, et al. The physical and biochemical effects of pre-rigor high pressure processing of beef[J]. Meat Science, 2018, 143: 129-136. DOI:10.1016/j.meatsci.2018.04.021.
[91] ZHANG Huijuan, PAN Jian, WU Zeyu. Investigation of the effects of high pressure processing on the process of rigor in pork[J]. Meat Science, 2018, 145: 455-460. DOI:10.1016/j.meatsci.2018.07.013.
[92] ZHOU Yajun, HE Qin, SU Dan, et al. Effects of ultra-high pressure tenderizing treatment on the quality characteristics of venison[J]. Journal of Food Process Engineering, 2016, 39(2): 196-203. DOI:10.1111/jfpe.12214.
[93] RAJENDRAN S, MALLIKARJUNAN P K, O’NEILL E. High pressure processing for raw meat in combination with other treatments: a review[J]. Journal of Food Processing and Preservation, 2022, 98(1): 16049. DOI:10.1111/jfpp.16049.
[94] PURSLOW P P, GAGAOUA M, WARNER R D. Insights on meat quality from combining traditional studies and proteomics[J]. Meat Science, 2021, 174: 108423. DOI:10.1016/j.meatsci.2020.108423.
[95] RAMANATHAN R, HUNT M C, PRICE T, et al. Strategies to limit meat wastage: focus on meat discoloration[M/OL]//Advances in food and nutrition research. Elsevier, 2021: 183-205. DOI:10.1016/bs.afnr.2020.08.002.
[96] CUNHA L C M, MONTEIRO M L G, COSTA-LIMA B R C, et al. Effect of microencapsulated extract of pitaya (Hylocereus costaricensis) peel on color, texture and oxidative stability of refrigerated ground pork patties submitted to high pressure processing[J]. Innovative Food Science and Emerging Technologies, 2018, 49: 136-145. DOI:10.1016/j.ifset.2018.08.009.
[97] VILLAMONTE G, POTTIER L, DE LAMBALLERIE M. Influence of high-pressure processing on the oxidative processes in pork batters: efficacy of rosemary extract and sodium ascorbate[J]. European Food Research and Technology, 2017, 243(9): 1567-1576. DOI:10.1007/s00217-017-2865-7.
[98] 张慧娟, 潘见. 含CO的气调包装协同超高压对冷却猪肉杀菌护色效果的研究[J]. 食品研究与开发, 2021, 42(12): 84-89. DOI:10.12161/j.issn.1005-6521.2021.12.01.