炎症是机体对外界刺激、感染和内源性组织损伤的一种免疫应激反应。炎症的发生通常伴随细胞因子(肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-6、IL-8等)的过量分泌和释放,进而引发组织或器官的炎症级联反应[1]。据流行病学调查显示,长时间的免疫失调与炎症性肠病、血脂异常、肥胖等代谢疾病密切相关[2-3]。因此,缓解和减少炎症的发生对预防慢性代谢类疾病尤为重要。生物活性肽是一类源于蛋白质的多功能活性物质,一般由2~20 个氨基酸组成,具有抗菌、抗病毒、抗氧化、降血压、降血脂及调节激素等生理功能[4]。在炎症调节方面,大豆[5]、鸡蛋[6]、牛乳[7]等食源性蛋白降解产生的生物活性肽均可抑制细胞中炎症因子的释放,从而缓解炎症的发生。
干腌火腿是一种传统发酵肉制品,其主要特点在于发酵周期长,特定的发酵温度和湿度使火腿中的肌肉蛋白质发生水解,进而产生丰富的肽类物质。前期研究发现,发酵成熟8 个月火腿中多肽含量为2.34%,随着发酵时间的延长,肽含量随蛋白质水解程度的加深而逐步增加[8]。在生物活性方面,干腌火腿肽具有清除自由基、减少细胞活性氧的产生、减少细胞炎症因子释放、抑制腐败致病菌的产生等多种功能[9-11]。然而在消化吸收过程中,胃肠道中的消化酶会改变多肽的结构,进而影响其生物活性。为了进一步探究火腿肽的抗炎功能,本研究以体外模拟消化和Caco-2细胞跨膜转运为重点,探究多肽序列变化及其抑制巨噬细胞炎症因子分泌的功能,从而进一步阐释火腿肽在消化吸收前后的活性变化。
1 材料与方法
1.1 材料与试剂
宣威火腿 宣威浦记火腿有限公司。
人克隆结肠腺癌细胞Caco-2 江苏凯基生物技术股份有限公司;RAW264.7巨噬细胞 武汉普通诺赛生命科技有限公司。
氯化钠、盐酸、氢氧化钠、磷酸氢二钠、磷酸二氢钠、邻苯二甲醛、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、β-巯基乙醇、硼砂 国药集团化学试剂有限公司;脂多糖(lipopolysaccharide,LPS)、胃蛋白酶(3000~3500 U/mg) 美国Sigma-Aldrich公司;DMEM细胞培养基、磷酸盐缓冲液(pH 7.4)、胎牛血清、胰蛋白酶 美国Thermo Gibco公司;细胞培养瓶及培养板 美国Corning Costar公司;合成肽(纯度95%) 强耀生物科技有限公司;一氧化氮(NO)检测试剂盒 上海碧云天生物科技有限公司;酶联免疫吸附测定试剂盒(IL-6、TNF-α) 上海欣博盛生物科技有限公司。
1.2 仪器与设备
FE28-Standard pH计 瑞士Mettler Toledo公司;TC 12E绞肉机 意大利Sirman公司;Avanti J-E高效离心机 美国Beckman Coulter公司;ES2030冷冻干燥机 日本Hitachi公司;Spectral Max M2多功能酶标仪 美国 Molecular Devices公司;Millicell ERS-2电阻仪 美国Millipore公司。
1.3 方法
1.3.1 粗肽的提取
参考Escudero等[12]的方法。将火腿剔除脂肪和可见筋膜后分割成小块,用绞肉机绞碎后称取肉末25 g,置于500 mL离心瓶中,加入100 mL磷酸盐缓冲液(phosphate buffered saline,PBS)(0.02 mol/L,pH 7.0),用匀浆机进行匀浆处理(18000 r/min、12 s,间歇时间15 s),直至匀浆液呈现均匀、黏稠的状态。然后将离心瓶置于4 ℃静置2 h,4 ℃、12000×g离心20 min后取上清液,使用滤纸过滤掉其中的脂肪滴、肉糜等杂质,随后向上清液中加入3 倍体积70%乙醇溶液,再将混合液放置在4 ℃静置8 h,最后4 ℃、12000×g离心20 min得到多肽上清液。上清液经过旋转蒸发和冷冻干燥后得到多肽粗提粉末样品,置于-20 ℃冰箱中保存备用。
1.3.2 肽含量测定
参照Church等[13]的方法。在避光条件下配制邻苯二甲醛混合液:首先将80 mg邻苯二甲醛溶解于1 mL甲醇中,随后加入50 mL 100 mmol/L硼砂溶液混合均匀,再依次加入5 mL 20 g/100 mL SDS和200 μL β-巯基乙醇,最后用去离子水定容至100 mL并振荡混匀,现用现配。配制质量浓度为1 mg/mL的多肽粗提物溶液,取200 μL与2 mL邻苯二甲醛混合液混合,避光环境下常温孵育2 min,340 nm波长处测定混合溶液的吸光度。以胰酪蛋白胨为标准品绘制标准曲线,根据拟合方程计算火腿多肽含量。
1.3.3 体外消化
参考Zhu Chaozhi等[14]的方法并作修改。将多肽溶解于PBS缓冲液,配制10 mg/mL溶液,然后通过添加1 mol/L盐酸将pH值调节至2.0。随后将溶液在37 ℃水浴10 min,同时添加胃蛋白酶(添加量为肽含量的4%)水解2 h,结束后将混合物煮沸10 min,使胃蛋白酶灭活,4 ℃、5000×g离心15 min。添加1 mol/L NaOH溶液将离心后的溶液pH值调至7.5,加入胰蛋白酶(添加量为肽含量的4%)进行2 h的37 ℃温水孵育消化。结束后煮沸10 min,4 ℃、5000×g离心15 min,收集上清液并标记为DXP。冷冻干燥后,将未消化的火腿肽(XP)溶液和DXP同时进行体外抗炎活性实验。
1.3.4 Caco-2肠道细胞跨膜转运实验
Caco-2细胞接种在培养基(DMEM+10%胎牛血 清+1%青霉素-链霉素)中,并置于37 ℃、5% CO2的培养箱中培养。Caco-2细胞以2×105 cells/mL接种于Transwell孔板(孔径0.4 μm,直径12 mm,表面积1.12 m2)。在上室和下室分别加入0.5 mL细胞悬液和1.5 mL细胞培养基,培养24 h后更换培养液,前7 d隔天更换细胞培养液,7 d之后每天更换培养液直至培养21 d。用电阻仪测定细胞单层跨膜电阻(trans epithelial electrical resistance,TEER),Caco-2细胞单层的TEER随着培养时间的延长逐渐变大,TEER越大,则细胞单层致密性越好。当TEER达到800 Ω·cm2以上符合实验要求[15]。 配制1 mg/mL的多肽溶液(溶解于Hank’s平衡盐溶液(Hank’s balanced salt solution,HBSS)),在上室加入0.5 mL多肽样品溶液,下室加入1.5 mL HBSS,放入细胞培养箱120 min,最后将下室的培养基全部取出,冷冻干燥后质谱检测多肽成分。
1.3.5 抗炎活性测定参考Eslim等[16]的方法。RAW264.7细胞接种于12 孔板,接种密度为1×105 cells/cm2,将细胞板置于37 ℃、5% CO2的培养箱中培养24 h。火腿多肽溶解于DMEM培养基中,配制成1 mg/mL的多肽溶液,0.22 μm滤膜过滤待用。在RAW264.7细胞长至密集度约80%时抽离原培养基,用PBS冲洗细胞后加入500 μL多肽溶液,预处理1 h后加入50 μL LPS(10 μg/mL,溶解于DMEM培养基)以诱导炎症反应,共孵育12 h后收集细胞上清液,取50 μL立即测定NO含量,取100 μL测定细胞炎症因子含量。其中,对照(negative control,NC)组细胞无多肽处理且无LPS诱导,炎症阳性对照(positive control,PC) 组使用LPS诱导产生炎症,DXP和XP处理组为多肽与LPS共孵育12 h。
1.3.6 细胞上清液中NO、TNF-α和IL-6含量测定
按照NO、TNF-α和IL-6检测试剂盒的方法操作。
1.3.7 液相色谱-串联质谱鉴定多肽序列及合成
首先将火腿多肽进行前处理,使用MonoSpin C18脱盐柱进行脱盐。液相洗脱液由体积分数0.1%甲酸(缓冲液A)和乙腈(缓冲液B)组成,洗脱梯度如下:0~2 min,2%缓冲液B;2~19 min,2%~30%缓冲液B; 19~20 min,30%~95%缓冲液B;20~25.5 min,95%缓冲液B;25.5~26 min,95%~2%缓冲液B;26~30 min,2%缓冲液B。多肽上样后进行梯度洗脱,然后采用一级质谱、二级质谱扫描,质谱全扫描范围为m/z 100~1200。所得结果用Mass Lyna 4.1软件分析。质谱数据通过PeaksStudio数据库和de novo模型进行多肽组成分析。已知序列的多肽经苏州强耀生物科技有限公司进行化学合成,合成肽的纯度均为95%以上。
1.3.8 跨膜转运后火腿多肽的抗炎活性测定将合成肽配制为1 mg/mL的多肽溶液,按照1.3.5节的步骤操作,检测巨噬细胞的NO和TNF-α分泌量。
1.4 数据处理
数据统计分析采用SAS 8.0软件,方差分析过程选用One-Way ANOVA,实验结果用平均值±标准差表示,实验重复次数为6,每次平行测定次数为3,多重比较采用Duncan’s Multiple Range Test,柱形图采用GraphPad Prism 5 软件绘制,显著性水平设为P<0.05。
2 结果与分析
2.1 火腿中生物活性肽的含量
在肉制品加工过程中,肌肉中的蛋白质在内源酶的作用下发生水解生成大量肽类化合物和氨基酸。内源肽酶(如组织蛋白酶和钙蛋白酶)可以将蛋白质降解为肽段,随后肽段被肽酶进一步降解产生氨基酸、二肽或三肽等[17]。本研究中,100 g宣威火腿可提取9.8 g多肽粗提物,其中肽含量为86.85%,多肽提取率为8.49%。在前期的研究中,成熟24 个月金华火腿的多肽含量为8.95%[8],与本研究结果相似。在发酵牛肉香肠的研究中,发酵21 d的香肠肽粗提物中的多肽含量为28.49%,不同发酵方式对多肽提取量有较大影响[18]。诺邓火腿粗提物中的多肽含量随着加工时间的延长呈现先上升后下降的趋势,加工2 年诺邓火腿粗肽的多肽含量最高[19]。宣威火腿和金华火腿加工8 个月后的肌肉中多肽提取率分别为2.34%[20]和1.16%[21]。原料来源、腌制成熟条件(温度、湿度、加盐腌制时间)及成熟时间均会影响干腌火腿的多肽含量。
2.2 胃肠道模拟消化对火腿多肽抗炎活性的影响
NO是一种具有极强生物活性的效应分子,在炎症反应中NO水平升高是造成局部组织损伤的因素之一[22]。 由图1可知,与对照组相比,PC组的NO含量显著升高,未消化与消化后多肽均可以降低巨噬细胞中NO的含量。其中,消化后多肽处理组的NO含量为8.01 μmol/L,显著低于未消化多肽组(12.6 μmol/L,P<0.05)。由图2可知,在调控细胞因子分泌方面,火腿多肽可以显著降低巨噬细胞中TNF-α和IL-6的释放量。其中,TNF-α含量由1523.08 pg/mL降低至620.23 pg/mL (P<0.05),DXP组显著低于XP组(P<0.05)。IL-6含量由PC组的156.79 pg/mL降低至DXP组的 52.34 pg/mL,DXP组与XP组没有显著差异。通过NO和TNF-α含量的变化可知,DXP对细胞促炎因子释放的抑制作用更强,由此说明胃肠模拟消化提升了火腿多肽的抗炎功能。
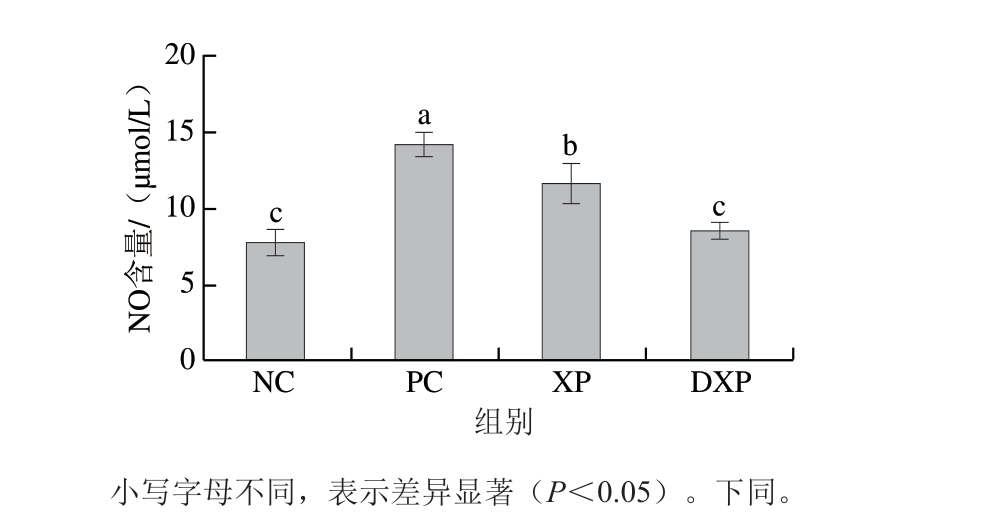
图1 胃肠道模拟消化后火腿多肽对RAW264.7细胞分泌NO的影响(n=6)
Fig. 1 Effect of peptides subjected from Xuanwei ham to enzymatic digestion on the secretion of NO in RAW264.7 cells (n = 6)
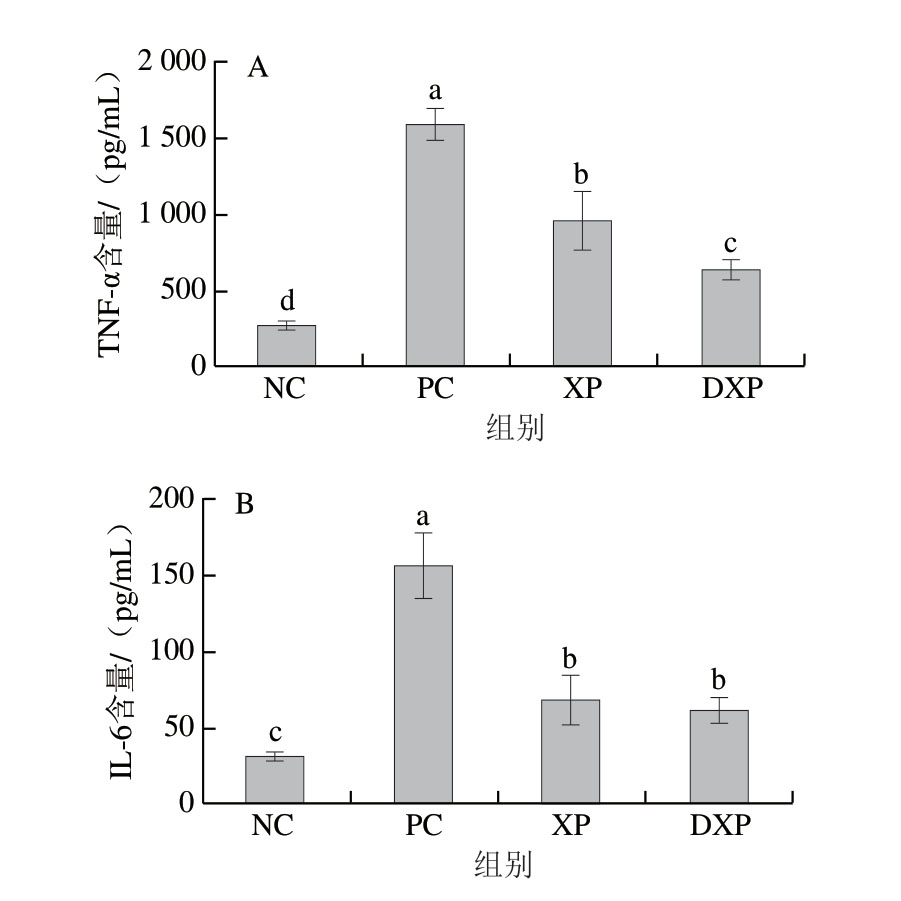
图2 胃肠道模拟消化后火腿多肽对RAW264.7细胞分泌TNF-α(A)和 IL-6(B)的影响(n=6)
Fig. 2 Effect of peptides from Xuanwei ham subjected to enzymatic digestion on the secretion of TNF-α (A) and IL-6 (B) in RAW264.7 cells (n = 6)
2.3 胃肠道模拟消化对火腿多肽序列的影响
由表1可知,胃肠道模拟消化处理后火腿多肽的肽段数量从545 条增加到817 条,多肽的分子质量分布发生较大变化。未消化多肽中分子质量小于1000 Da的多肽占40.18%,分子质量小于500 Da的多肽占4.00%;而消化后分子质量小于1000 Da的多肽显著增加至57.40%,分子质量小于500 Da的多肽占7.90%。由此说明,火腿多肽经胃肠道模拟消化后可释放更多的小分子肽。与长链肽段相比,小分子肽的生物吸收性更强,进而有助于其生理功能的发挥。从鸡蛋、大豆、牛乳中分离得到的抗炎功能肽有IRW、IQW[5]、VPY[6]、IPP及VPP[7],其分子质量均小于500 Da。研究显示,IRW可以缓解内皮细胞黏附因子ICAM-1表达,降低细胞炎症水平[5]。大豆来源的生物活性肽VPY可以降低肠道Caco-2细胞和THP-1细胞中TNF-α、IL-6、IL-1β、干扰素γ等促炎细胞因子的释放,进而发挥缓解炎症的功能[6]。综合本研究结果可知,胃肠道模拟消化使火腿肽进一步降解产生更多小分子肽,从而提升了火腿肽对NO和TNF-α的抑制作用。
表1 胃肠道模拟消化及跨膜转运前后火腿中多肽的组成变化
Table 1 Change in the composition of peptides from Xuanwei ham after simulated digestion and transmembrane transport
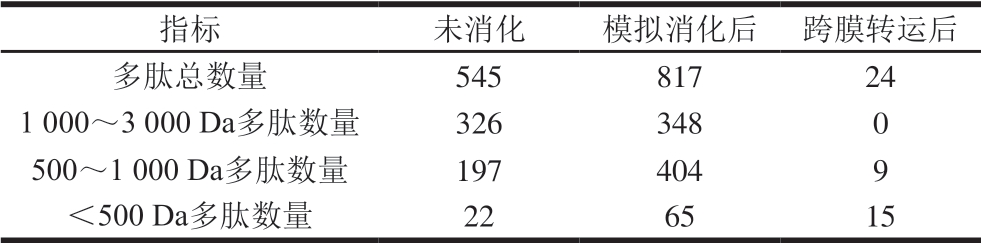
指标 未消化 模拟消化后 跨膜转运后多肽总数量 545817241000~3000 Da多肽数量 3263480500~1000 Da多肽数量 1974049<500 Da多肽数量 226515
2.4 Caco-2细胞跨膜转运对火腿多肽序列及抗炎活性的影响
在生物活性肽的消化吸收过程中,肠道屏障是影响多肽跨膜转运的最大障碍。经肠道消化后,90%以上的长链多肽将被消化酶降解,产生短链小肽和游离氨基酸,然后经肠道上皮细胞吸收[23]。除胃肠道的消化酶以外,小肠上皮刷状缘细胞表面的氨肽酶、羧肽酶也可以将多肽特异性酶解,从而使多肽在跨膜转运前后的分子序列发生变化[24]。因此,能否以肽链的完整结构跨越肠道细胞是决定生物活性肽在体内代谢吸收的必要前提。
由表2可知,共有24 条多肽可以在跨膜转运后抵达孔板的下室(BL侧)。其中,部分多肽序列,如SPSA、VGLF、LVGF、PSVY等可以在消化后的多肽序列中找到其对应的来源,说明长肽链的序列在跨膜转运过程中发生断裂,进而穿越Caco-2细胞单层膜。如TINGVQYPLSPSA在C端发生断裂产生SPSA,LGEKLDE断裂产生LGEKL。多肽的跨膜转运方式包括主动转运、细胞旁路途径转运及内吞作用[18]。二肽、三肽等小分子肽主要是通过小肠上皮细胞上刷状缘的寡肽转运蛋白PepT1主动转运而吸收,而分子质量较大的多肽则主要以旁路转运途径跨越细胞膜[25]。Dodco等[26]研究发现,刷状缘膜上的肽酶可以将寡肽水解成氨基酸、二肽或三肽,四肽及四肽以上多肽在刷状缘的水解率高达90%,三肽的水解率为10%~60%,二肽的水解率只有10%。因此,分子质量较大的多肽更容易在穿越细胞膜的过程中发生水解,因而到达BL侧的浓度更小。
表2 Caco-2细胞跨膜转运后火腿多肽序列的鉴定
Table 2 Sequence identification of peptides from Xuanwei ham transported across Caco-2 cells
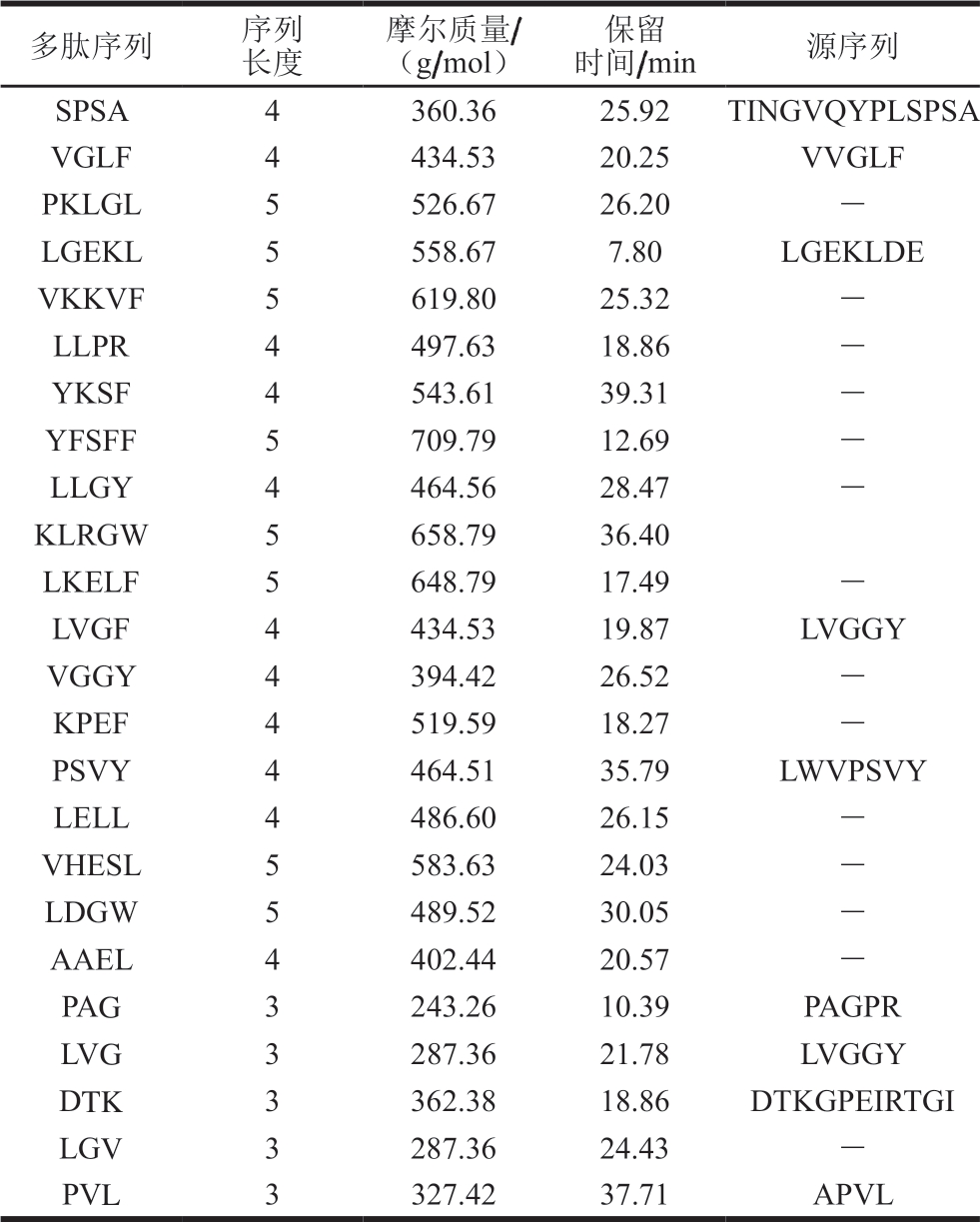
注:-. 没有对应源序列。
多肽序列 序列长度摩尔质量/(g/mol)保留时间/min 源序列SPSA 4360.3625.92 TINGVQYPLSPSA VGLF 4434.5320.25 VVGLF PKLGL 5526.6726.20 -LGEKL 5558.677.80 LGEKLDE VKKVF 5619.8025.32 -LLPR 4497.6318.86 -YKSF 4543.6139.31 -YFSFF 5709.7912.69 -LLGY 4464.5628.47 -KLRGW 5658.7936.40 LKELF 5648.7917.49 -LVGF 4434.5319.87 LVGGY VGGY 4394.4226.52 -KPEF 4519.5918.27 -PSVY 4464.5135.79 LWVPSVY LELL 4486.6026.15 -VHESL 5583.6324.03 -LDGW 5489.5230.05 -AAEL 4402.4420.57 -PAG 3243.2610.39 PAGPR LVG 3287.3621.78 LVGGY DTK 3362.3818.86 DTKGPEIRTGI LGV 3287.3624.43 -PVL 3327.4237.71 APVL
SwissADME数据库(http://www.swissadme.ch/index)可以预测生物活性肽的理化性质、脂溶性、水溶性、药代动力学性质、溶解性及生物相容性等,从而为研究生物活性肽的跨膜吸收特性提供前提[27]。通过SwissADME数据库对鉴定得到的生物活性肽进行预测分析,由表3可知,在理化特性方面,所有多肽的氢键受体数量大于5,VHESL的受体数量最多(11),多肽的氢键供体数量均大于4,其中KLRGW供体数量最多(11)。极易溶解的多肽有15 条,不可溶的多肽(YFSFF)有1 条。在生物利用度方面,利用度为0.55的多肽有8 条,其余多肽的利用度均小于或等于0.17。在肠道吸收特性方面,PAG、LVG、LGV、PVL 4 条多肽的吸收度较高,其余多肽的肠道吸收性较差。P-糖蛋白是生物大分子吸收转运中的跨膜蛋白,主要通过消耗ATP将药物泵送出细胞[28],如果生物活性肽是P-糖蛋白底物,则可能降低其生物利用度。本研究中有13 条肽可以作为 P-糖蛋白的底物,另有11 条肽不是P-糖蛋白的底物。细胞色素P4503A4酶是肝脏代谢的重要降解酶,细胞色素P4503A4酶的抑制剂可导致药物积蓄中毒[29]。从本研究预测结果可知,火腿肽跨膜转运后产生的小肽均不是细胞色素P4503A4酶的抑制剂,说明这些小肽没有引起肝脏中毒的风险。根据生物利用度和肠道吸收性可知,PAG、LVG、LGV、PVL在机体内发挥生理调节功能的可能性更高。
表3 跨膜转运后火腿多肽的生理生化特性预测分析
Table 3 Predicted physiological and biochemical properties of peptides from Xuanwei ham after transmembrane transport
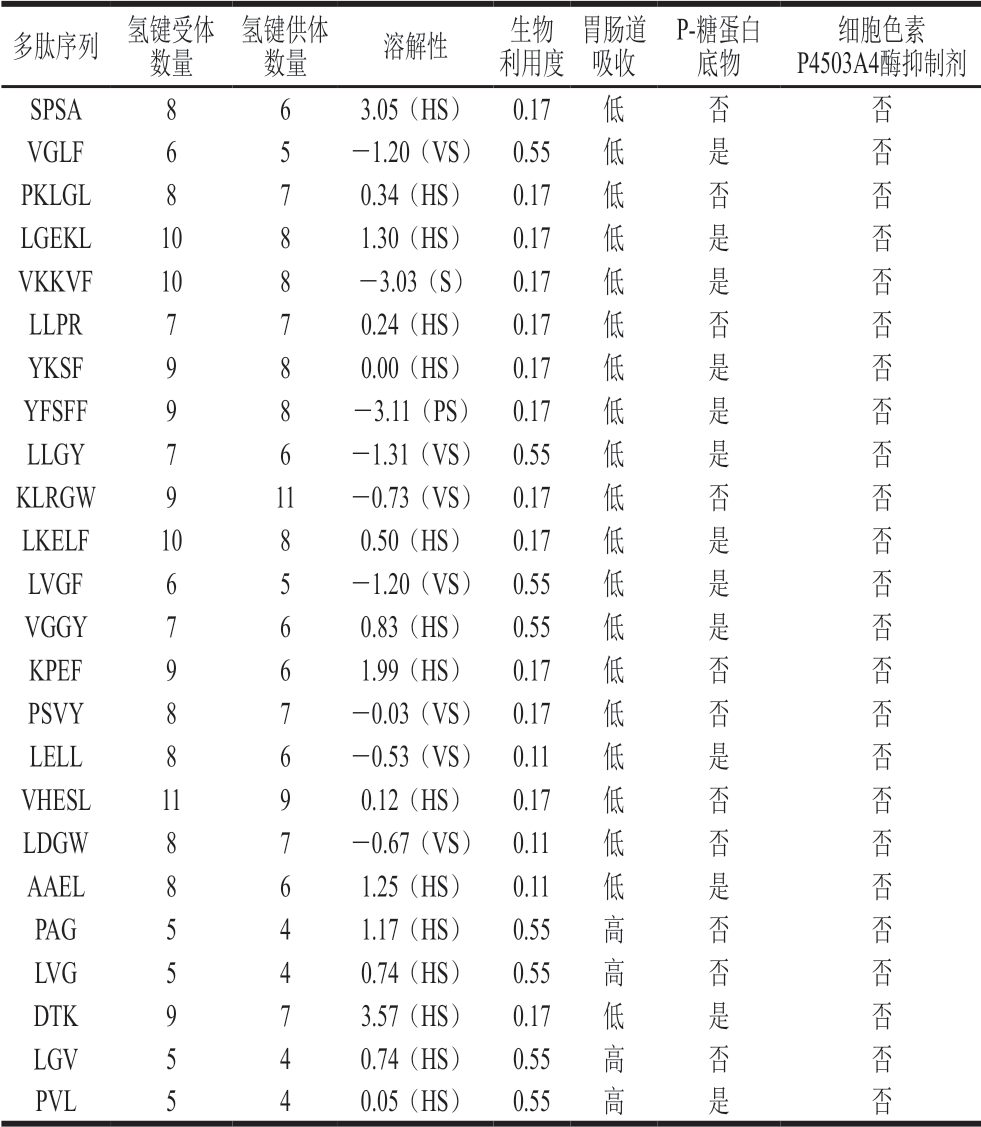
注:HS. 极易溶;VS. 易溶;S. 可溶;PS. 不可溶。
多肽序列 氢键受体数量氢键供体数量 溶解性 生物利用度胃肠道吸收P-糖蛋白底物细胞色素P4503A4酶抑制剂SPSA 863.05(HS) 0.17 低 否 否VGLF 65 -1.20(VS) 0.55 低 是 否PKLGL 870.34(HS) 0.17 低 否 否LGEKL 1081.30(HS) 0.17 低 是 否VKKVF 108 -3.03(S) 0.17 低 是 否LLPR 770.24(HS) 0.17 低 否 否YKSF 980.00(HS) 0.17 低 是 否YFSFF 98 -3.11(PS) 0.17 低 是 否LLGY 76 -1.31(VS) 0.55 低 是 否KLRGW 911 -0.73(VS) 0.17 低 否 否LKELF 1080.50(HS) 0.17 低 是 否LVGF 65 -1.20(VS) 0.55 低 是 否VGGY 760.83(HS) 0.55 低 是 否KPEF 961.99(HS) 0.17 低 否 否PSVY 87 -0.03(VS) 0.17 低 否 否LELL 86 -0.53(VS) 0.11 低 是 否VHESL 1190.12(HS) 0.17 低 否 否LDGW 87 -0.67(VS) 0.11 低 否 否AAEL 861.25(HS) 0.11 低 是 否PAG 541.17(HS) 0.55 高 否 否LVG 540.74(HS) 0.55 高 否 否DTK 973.57(HS) 0.17 低 是 否LGV 540.74(HS) 0.55 高 否 否PVL 540.05(HS) 0.55 高 是 否
2.5 跨膜转运后火腿多肽的抗炎活性
为进一步验证跨膜转运后多肽的抗炎活性,采用化学合成的方法制备PAG、LVG、LGV、PVL 4 条多肽,并测定合成肽对炎症因子分泌的调节作用。由图3可知,合成肽对LPS诱导的RAW264.7细胞中NO分泌有显著抑制作用(P<0.05),4 组多肽处理组的NO含量均低于PC组。其中PC组NO含量为14.82 μmol/L,LVG处理后NO含量最低,为7.89 μmol/L(P<0.05),且LVG组的NO含量显著低于PAG和LGV组,由此可见LVG对NO的抑制能力最强。
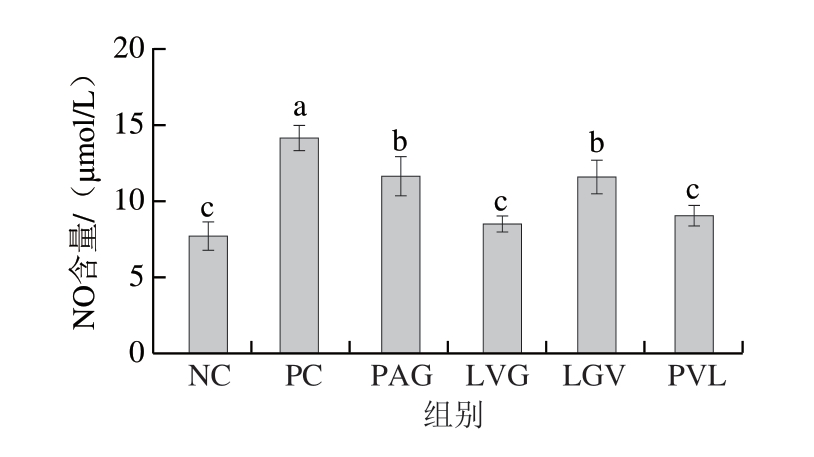
图3 合成肽对LPS诱导的RAW264.7细胞分泌NO的调节作用(n=6)
Fig. 3 Regulatory effect of synthetic peptides on the secretion of NO in LPS-induced RAW264.7 cells (n = 6)
由图4可知,PAG、LVG、LGV、PVL 4 条多肽可以抑制TNF-α的分泌。与PC组(1589.70 pg/mL)相比,LVG处理后TNF-α含量显著降低至626.32 pg/mL,PAG、LGV组的TNF-α含量差异不显著,但小于PC组。多肽的氨基酸组成、分子质量和疏水性与其生物活性密切相关。从大豆中分离得到的小分子抗炎活性肽VPY可以降低Caco-2和THP-1细胞中TNF-α、IL-6、IL-8等促炎因子的分泌,在吸收过程中,VPY介导PepT1蛋白的作用进行跨膜转运[6]。大豆FLV肽可以缓解脂肪细胞中TNF-α、IL-6、单核细胞趋化蛋白1等促炎因子的分泌,同时通过降低胰岛素抵抗来介导脂肪细胞的糖代谢过程;FLV调节PepT2蛋白进而被跨膜转运,说明FLV以完整结构进入脂肪细胞,进而发挥缓解炎症作用[30]。本研究中鉴定得到的小分子肽LVG与大豆抗炎活性肽FLV具有类似的氨基酸组成,其抗炎活性在巨噬细胞中已得到初步证实,由此说明,火腿肽在经肠道消化和跨膜转运后可以发挥缓解细胞炎症功能。
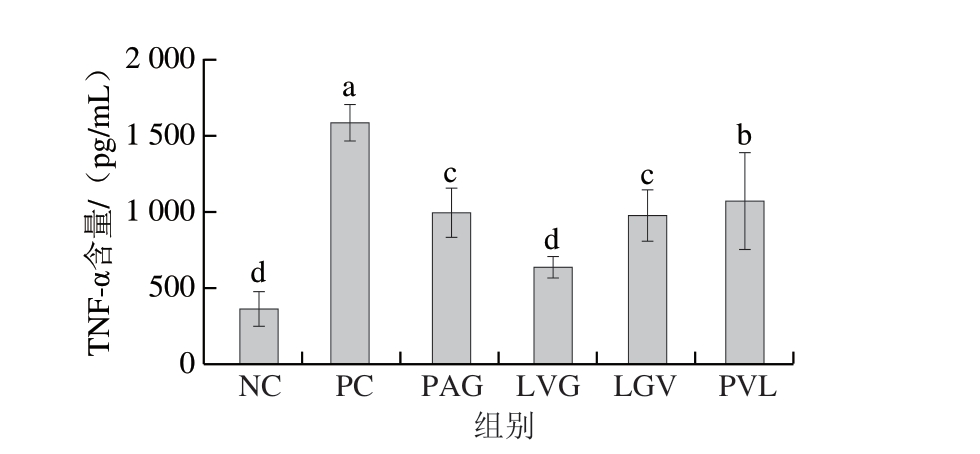
图4 合成肽对LPS诱导的RAW264.7细胞分泌TNF-α的调节作用(n=6)
Fig. 4 Regulatory effect of synthetic peptides on the secretion of TNF-α in LPS-induced RAW264.7 cells (n = 6)
3 结论
本研究重点探究火腿肽在胃肠道模拟消化及跨膜转运前后对细胞炎症因子分泌的调节作用。在LPS诱导的RAW264.7细胞炎症中,消化后火腿肽可显著抑制巨噬细胞中NO、TNF-α和IL-6的分泌。经跨膜转运吸收后可检测到24 条多肽,合成的小分子肽PAG、LVG、LGV、PVL均可抑制巨噬细胞中NO和TNF-α的分泌。综上可知,胃肠道模拟消化可以改变多肽的分子质量分布,进而提升火腿肽的抗炎功能;跨膜转运后的小分子肽生物利用度相对较高,且可以发挥缓解炎症因子释放的功能。
[1] WANG Zhigao, YING Xiaoguo, GAO Peng, et al. Anti-inflammatory activity of a peptide from skipjack (Katsuwonus pelamis)[J]. Marine Drugs, 2019, 17(10): 582-596. DOI:10.3390/md17100582.
[2] MORONG J J, GONZÁLEZ F. Obesity, dysmetabolic and proinflammatory milieu of polycystic ovary syndrome[M]. Berlin: Springer Group, 2022: 155-190. DOI:10.1007/978-3-030-92589-5-9.
[3] 龚建萍, 李倩, 赵述芳, 等. 免疫因素在溃疡性结肠炎发病机制中的研究进展[J]. 现代消化及介入诊疗, 2020, 25(12): 1676-1679. DOI:10.3969/j.issn.1672-2159.2020.12.029.
[4] PEIGHAMBARDOUST, S H, KARAMI, Z, PATERIO, M, et al. A review on health-promoting, biological, and functional aspects of bioactive peptides in food applications[J]. Biomolecules, 2021, 11(5): 631-639. DOI:10.3390/biom11050631.
[5] MAJUMDER K, CHAKRABARTI S, DAVIDGE S T, et al. Structure and activity study of egg protein ovotransferrin derived peptides (IRW and IQW) on endothelial inflammatory response and oxidative stress[J]. Journal of Agricultural and Food Chemistry, 2013, 61(9): 2120-2129. DOI:10.1021/jf3046076.
[6] KOVACS-NOLAN J, ZHANG H, IBUKI M, et al. The PepT1-transportable soy tripeptide VPY reduces intestinal inflammation[J]. Biochimica et Biophysica Acta, 2012, 1820(11): 1753-1763. DOI:10.1016/j.bbagen.2012.07.007.
[7] CHAKRABARTI S, WU J P, KANZAKI M. Milk-derived tripeptides IPP (Ile-Pro-Pro) and VPP (Val-Pro-Pro) promote adipocyte differentiation and inhibit inflammation in 3T3-F442A cells[J]. PLoS ONE, 2015, 10(2): e117492. DOI:10.1371/journal.pone.0117492.
[8] XING Lujuan, LIU Rui, GAO Xiaoge, et al. The proteomics homology of antioxidant peptides extracted from dry-cured Xuanwei and Jinhua ham[J]. Food Chemistry, 2018, 266: 420-426. DOI:10.1016/j.foodchem.2018.06.034.
[9] 李平, 杨婷, 周辉, 等. 干腌火腿中生物活性肽功能特性研究进展[J]. 食品科学, 2021, 42(11): 278-283. DOI:10.7506/spkx1002-6630-20200418-238.
[10] FU Lijuan, XING Lujuan, HAO Yuejing, et al. The anti-inflammatory effects of dry-cured ham derived peptides in RAW264.7 macrophage cells[J]. Journal of Functional Foods, 2021, 87: 104827. DOI:10.1016/j.jff.2021.104827.
[11] 邢路娟, 曹松敏, 郑锦晓, 等. 宣威火腿中抗菌肽的分离、纯化及鉴定[J]. 食品科学技术学报, 2019, 37(6): 46-52. DOI:10.3969/j.issn.2095-6002.2019.06.007.
[12] ESCUDERO E, ARISTOY M, ISHIMURAN H, et al. Antihypertensive effect and antioxidant activity of peptide fractions extracted from Spanish dry-cured ham[J]. Meat Science, 2012, 91(3): 306-311. DOI:10.1016/j.meatsci.2012.02.008.
[13] CHURCH F C, SWAISGOOD H E, PORTER D H, et al. Spectrophotometric assay using o-phthaldialdehyde for determination of proteolysis in milk and isolated milk proteins[J]. Journal of Dairy Science, 1983, 66(6): 1219-1227. DOI:10.3168/jds.S0022-0302(83)81926-2.
[14] ZHU Chaozhi, ZHANG Wangang, KANG Zhuang, et al. Stability of an antioxidant peptide extracted from Jinhua ham[J]. Meat Science, 2014, 96(2): 783-789. DOI:10.1016/j.meatsci.2013.09.004.
[15] DING Long, ZHANG Yan, JIANG Yiqun, et al. Transport of egg white ACE-inhibitory peptide, Gln-Ile-Gly-Leu-Phe, in human intestinal Caco-2 cell monolayers with cytoprotective effect[J]. Journal of Agricultural and Food Chemistry, 2014, 62(14): 3177-3182. DOI:10.1021/jf405639w.
[16] ESLIM S S, ALVARO M R, MARILENA A R, et al. Assessment of anti-inflammatory and antioxidant compounds in gastrointestinal digests from germinated amaranth protein concentrate[J]. Current Developments in Nutrition, 2022, 6(Suppl 1): 532-541. DOI:10.1093/cdn/nzac077.035.
[17] 张亚军, 陈有亮. 传统干腌火腿成熟机理的研究[J]. 肉类工业, 2002(11): 16-20. DOI:10.3969/j.issn.1008-5467.2002.11.007.
[18] 王秀丽, 陆晨红, 霍俊辉, 等. 接种发酵对发酵牛肉香肠品质及多肽抗氧化活性的影响[J]. 肉类研究, 2022, 36(1): 7-13. DOI:10.7506/rlyj1001-8123-20210817-202.
[19] 罗雨婷, 吴宝森, 谷大海, 等. 不同加工年份诺邓火腿粗肽的特征与抗氧化活性[J]. 肉类研究, 2017, 31(9): 32-37. DOI:10.7506/rlyj1001-8123-201709006.
[20] XING Lujuan, HU Yaya, HU Hongyan, et al. Purification and identification of antioxidative peptides from dry-cured Xuanwei ham[J]. Food Chemistry, 2016, 194(5): 951-958.
[21] ZHU Chaozhi, ZHANG Wangang, ZHOU Guanghong, et al. Isolation and identification of antioxidant peptides from Jinhua ham[J]. Journal of Agricultural and Food Chemistry, 2013, 61(6): 1265-1271. DOI:10.1021/jf3044764.
[22] GODÍNEZ-RUBÍ M, ORTUÑO-SAHAGÚN D. Nitric oxide donors in brain inflammation[M]//SEABRA A B. Nitric oxide donors. Salt Lake City: Academic Press, 2017: 263-292. DOI:10.1016/B978-0-12-809275-0.00011-9.
[23] MINER-WILLIAMS W, STEVENS B R, MOUGHAN P J. Are intact peptides absorbed from the healthy gut in the adult human[J]. Nutrition Research Reviews, 2014, 27(2): 308-329. DOI:10.1017/S0954422414000225.
[24] SHEN W L, MATSUI T. Current knowledge of intestinal absorption of bioactive peptides[J]. Food and Function, 2017, 8(12): 4306-4314. DOI:10.1039/C7FO01185G.
[25] LANDOWSKI C P, ANDERLE P, SUN D, et al. Transporter and ion channel gene expression after Caco-2 cell differentiation using 2 different microarray technologies[J]. AAPS Journal, 2004, 6(3): 35-44. DOI:10.1208/aapsj060321.
[26] DODCO A N O, LAWRENCE M J. The effect of experimental variables on uptake studies with intestinal brush border membrane vesicles[J]. European Journal of Pharmaceutical Sciences, 1996, 4(97): S69. DOI:10.1016/S0928-0987(97)86230-6.
[27] UDECHUKWU M C, DANG C, UDENIGWE C C. Identification of Zinc-binding peptides in adam17-inhibiting whey protein hydrolysates using imac-Zn2+ coupled with shotgun peptidomics[J]. Food Production Processing and Nutrition, 2021, 3(1): 5. DOI:10.1186/s43014-020-00048-4.
[28] 杨晓波, 刘克辛. P-糖蛋白分子结构及转运机制[J]. 药物评价研究, 2018, 41(1): 1-4. DOI:10.7501/j.issn.1674-6376.2018.01.001.
[29] 宋复兴, 王蓉, 原永芳. 药物代谢细胞色素p450酶学与研究方法应用进展[J]. 医学综述, 2017, 23(4): 665-669.
[30] KWAK S, KIM C, CHOI M, et al. The soy peptide Phe-Leu-Val reduces TNF-α induced inflammatory response and insulin resistance in adipocytes[J]. Journal of Medicinal Food, 2016, 19(7): 678-685. DOI:10.1089/jmf.2016.3685.