发酵香肠是指将肉连同脂肪绞碎,加入配料、发酵剂一起灌入肠衣,经微生物发酵后制成的肉制品[1]。发酵香肠含有丰富的蛋白质和脂肪,风味独特、安全性高,是发酵肉制品的典型代表[2]。我国作为肉制品消费大国,牛肉消费占比巨大,加之少数民族和西方餐饮习惯的影响也让牛肉的需求空间更大,因此牛肉发酵香肠具有极大的发展潜力。
在发酵香肠加工过程中,脂肪降解在风味形成上有重要贡献。然而在实际生产和流通中,脂肪和蛋白质过度氧化酸败,使得发酵香肠失去原有风味,降低食用价值和营养价值,严重时会对人体产生不利影响[3-4]。目前,针对发酵香肠抗氧化稳定性的提高,国内外研究人员在加工工艺、原辅料、抗氧化剂及包装等方面成果较为显著[3],但仍有不足之处,且很难多方面满足发酵香肠的风味、品质、营养、安全等的需求。
发酵剂是指能在发酵基质中发挥理想代谢活性的活的或休眠状态的微生物制剂[5]。常见的肉品发酵剂微生物主要是乳酸菌、酵母菌、霉菌及葡萄球菌的一些菌株[2,6],它们在原料肉中的代谢活动对发酵香肠独特品质的形成具有重要意义[2]。同时,一些菌株可以产生有机酸或细菌素[7],抑制有害微生物的生长,提升产品的安全性和稳定性[8-9]。并且一些发酵剂已被证明有助于形成具有抗氧化、抗高血压和降胆固醇功能的低分子质量化合物,如肽。近年来的研究发现,动植物蛋白源肽显示出良好的抗氧化活性。但是,天然抗氧化肽本身的提取步骤相当繁琐,在发酵香肠中的应用还停留在实验研究阶段。因此,研究发酵剂对于香肠内源性抗氧化肽的影响具有重要意义。曹辰辰等[4]研究复配发酵剂对猪肉发酵香肠品质的影响,但未研究该复配发酵剂对于牛肉发酵香肠品质及多肽抗氧化性的影响。因此,本研究将植物乳杆菌CD101(Lactobacillus plantarum CD101)和模仿葡萄球菌NJ201(Staphylococcus simulans NJ201)作为发酵剂接种到牛肉发酵香肠中,以自然发酵香肠作为对照组,探究发酵剂对牛肉发酵香肠品质及多肽抗氧化活性影响,为提升牛肉发酵香肠的产品品质、营养性、安全性及抗氧化性等提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜牛肉、猪背膘、猪肠衣、调味料 江苏南京苏果超市。
植物乳杆菌CD101(NCBI编号为MG798695)、模仿葡萄球菌NJ201(NCBI编号为MG798688),由南京农业大学国家肉品质量安全控制工程技术研究中心实验室保存。
MRS培养基、MSA培养基、TSA培养基 青岛海博生物科技有限公司;磷酸盐缓冲液(phosphate buffered saline,PBS)、谷胱甘肽(glutathione,GSH)、氯化钠、氯化亚铁 国药集团化学试剂有限公司;食品中亚硝酸盐含量检测试剂盒、羟自由基清除能力检测试剂盒南京辉亚生物科技有限公司;BCA蛋白浓度测定试剂盒南京格雷福斯生物科技有限公司;总抗氧化能力测试试剂盒 南京迈博昊成生物科技有限公司;试剂均为分析纯。
1.2 仪器与设备
TC 12E绞肉机 意大利Sirman公司;VF608灌肠机德国Handtmann公司;FE20 pH计 美国Mettler Toledo公司;TA-XT2质构仪 英国Stable Micro Systems公司;CR-400色差仪 日本Konica Minota公司;PowerPac Basic电泳仪、Universal Hook凝胶成像仪美国Bio-Rad公司;Spectral Max M2e多功能酶标仪美国MD公司。
1.3 方法
1.3.1 发酵剂的活化与制备
根据Yu Di等[10]的方法稍作修改。挑取MRS平板上的植物乳杆菌CD101于MRS液体培养基,37 ℃培养18 h;挑取TSA平板上的模仿葡萄球菌NJ201于TSA液体培养基,30 ℃培养18 h;分别活化3 次后,菌液12 000×g、4 ℃离心(5 min),弃上清液,用无菌水洗涤沉淀3 次,备用。
1.3.2 牛肉发酵香肠的制作
参考冯美琴等[11]的方法进行制作。新鲜牛肉与猪背膘质量比为8∶2,以肉质量为基础添加:食盐2%、蔗糖1%、葡萄糖1%、亚硝酸钠0.015%、异抗坏血酸钠0.05%、姜粉0.1%、白胡椒粉0.1%、五香粉0.1%。设置2 个处理组:以自然发酵处理组为对照组,以添加接种量为107 CFU/g且菌株配比为植物乳杆菌CD101∶模仿葡萄球菌NJ201=1∶1的复配发酵剂处理组作为实验组。
工艺流程:原料肉→漂洗→绞肉→搅拌(分批加入发酵剂和其他辅料)→灌肠→恒温发酵→干燥成熟。
工艺条件:30 ℃、相对湿度80%条件下发酵24 h,15 ℃、相对湿度75%条件下缓慢发酵3 d,最后以12 ℃、相对湿度72%进行干燥,在第21天时得到发酵香肠成品。
1.3.3 牛肉发酵香肠pH值测定
按照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》[12],使用pH计进行测定。
1.3.4 牛肉发酵香肠色差测定
根据Cao Chenchen等[13]的方法并稍作修改。剥去香肠样品肠衣,绞碎,按压成厚约1 cm、半径1 cm的薄片,选6 个不同位置,使用色差仪测定样品的亮度值(L*)、红度值(a*)和黄度值(b*)。
使用前用标准版Y=94.0、X=0.315 6、y=0.332 1校正。引用E*评价香肠的色泽以减少误差,E*按式(1)计算。
1.3.5 牛肉发酵香肠质构测定
根据Cao Chenchen等[13]的方法并稍作修改。香肠剥去肠衣,切成高25 mm、半径约10 mm大小,使用P/50A探头,参数设定为:50 kg load cell,测前速率2 mm/s,测试速率5 mm/s,测后速率5 mm/s,压缩率50%。取硬度、弹性、黏聚性、咀嚼性4 个指标作为测定结果。
1.3.6 牛肉发酵香肠亚硝酸盐含量测定
采用亚硝酸盐含量检测试剂盒测定。
1.3.7 牛肉发酵香肠中粗肽的提取
参照冯美琴等[11]的方法并稍作修改。选择未接菌和接菌发酵香肠各3 根,每根称取25 g,去除肥丁、肠衣和筋膜后绞肉机切碎斩匀的香肠碎末,加入100 mL 0.1 mol/L、pH 7.2 PBS后,冰浴匀浆4 次(15 000 r/min,每次15 s),4 ℃静置2 h后,离心(4 ℃、12 000×g、22 min),用8 层纱布过滤取上清液,加3 倍体积40%乙醇,静置12 h,再次离心(4 ℃、12 000×g、22 min),抽滤取上清液,旋蒸(50 r/min、40 ℃)所有样品后得到浓缩的肽液,使用冻干机冷冻干燥60 h得到粗肽粉,置于-20 ℃备用。
1.3.8 牛肉发酵香肠粗肽粉多肽含量测定
根据Yu Di等[10]的方法并稍作修改,用邻苯二甲醛(ortho-phthalaldehyde,OPA)法测定。OPA混合试剂的配制:80 mg OPA溶于2 mL甲醇,依次加入50 mL 0.1 mol/L四硼酸钠溶液、5 mL 20 g/100 mL十二烷基硫酸钠(sodium dodecyl sulfate,SDS)和200 μL β-巯基乙醇,用去离子水定容至100 mL。取100 μL去离子水配制的1 mg/mL粗肽溶液,加入2.0 mL OPA混合试剂,剧烈混匀,室温孵育2 min,测定反应液在340 nm波长处吸光度。胰酪蛋白胨作为标准蛋白,配制一系列质量浓度(0.0、0.2、0.4、0.6、0.8、1.0 mg/mL)溶液,在340 nm波长处测定吸光度,以蛋白质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得出反应液中多肽质量浓度,粗肽粉中多肽含量按式(2)计算。
1.3.9 牛肉发酵香肠蛋白十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)
根据Yu Di等[10]的方法并稍作修改。取4 g去肥绞碎香肠加入16 mL全蛋白提取液(2 g/100 mL SDS溶于0.01 mol/L、pH 7.0 PBS);9 500 r/min冰浴匀浆2×30 s后,4 ℃、4 000×g离心20 min,用BCA蛋白浓度测定试剂盒测定上清液的蛋白质量浓度。用超纯水调节上清液蛋白质量浓度至1 mg/mL,与5×上样缓冲液充分混合(4∶1,V/V),沸水浴5 min,快速冷却至室温。用10%的预制胶,样品上样量10 μL,标准蛋白上样量5 μL进行电泳,80 V运行30 min后,调节电压为120 V电泳1 h。电泳结束后,染色1 h、脱色18 h,于成像系统观察。
1.3.10 牛肉发酵香肠多肽1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力测定
根据Yu Di等[10]的方法并稍作修改。DPPH自由基溶液(0.2 mmol/L,溶于95%乙醇)与0.5 mL肽液混合作为样品组;DPPH自由基溶液与0.5 mL 95%乙醇混合作为空白组;95%乙醇与0.5 mL肽液混合作为对照组。3 组混合溶液室温避光反应30 min后,5 000 r/min离心5 min,在517 nm波长处测定上清液吸光度,以1 mg/mL GSH作为阳性对照。DPPH自由基清除率按式(3)计算。
式中:A样品为样品组的吸光度;A空白为空白组的吸光度;A对照为对照组的吸光度。
1.3.11 牛肉发酵香肠多肽羟自由基清除能力测定
采用羟自由基清除能力检测试剂盒测定。
1.3.12 牛肉发酵香肠多肽2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除能力测定
采用总抗氧化能力测试试剂盒(ABTS法)测定。ABTS阳离子自由基清除能力用Trolox当量表示,单位为μmol/g。
1.4 数据处理
所有数据采用SAS 9.1软件中的Duncan’s Multiple-Range Test进行显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著,采用Factorial ANOVA进行方差分析,使用Origin 7.0绘图软件作图。
2 结果与分析
2.1 牛肉发酵香肠pH值测定结果
表 1 牛肉发酵香肠pH值测定结果
Table 1 pH of fermented beef sausages
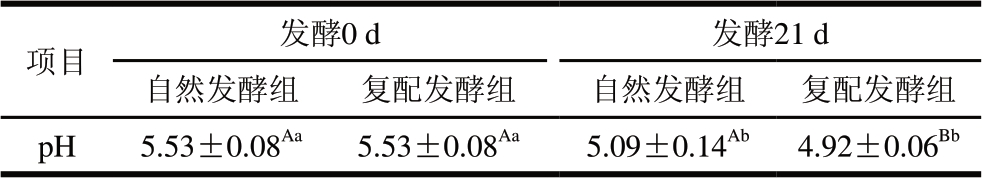
注:同行大写字母不同,表示发酵相同时间的不同处理组间差异显著(P<0.05);同行小写字母不同,表示相同处理组、不同发酵时间差异显著(P<0.05)。表2同。
项目 发酵0 d 发酵21 d自然发酵组 复配发酵组 自然发酵组 复配发酵组pH 5.53±0.08Aa 5.53±0.08Aa 5.09±0.14Ab 4.92±0.06Bb
由表1可知,发酵0 d的香肠pH值在5.53左右,自然发酵组与复配发酵组无显著差异,发酵21 d的香肠pH值均显著低于0 d(P<0.05),且复配发酵组显著低于自然发酵组(P<0.05)。此结果与Yu Di等[10]的研究一致,说明复配发酵组的乳酸菌具有较强产酸能力。Zhao Lihua等[14]研究认为发酵过程中合适的温度和湿度有利于乳酸菌的生长,促进其积累有机酸,尤其是乳酸。低pH值可抑制有害微生物生长,保证产品的食用安全性[9]。此外,Kanno等[15]研究表明,低pH值能降低肉中蛋白质的持水能力,缩短香肠的发酵周期。
2.2 牛肉发酵香肠色差测定结果
表 2 牛肉发酵香肠色差测定结果
Table 2 Color parameters of fermented beef sausages
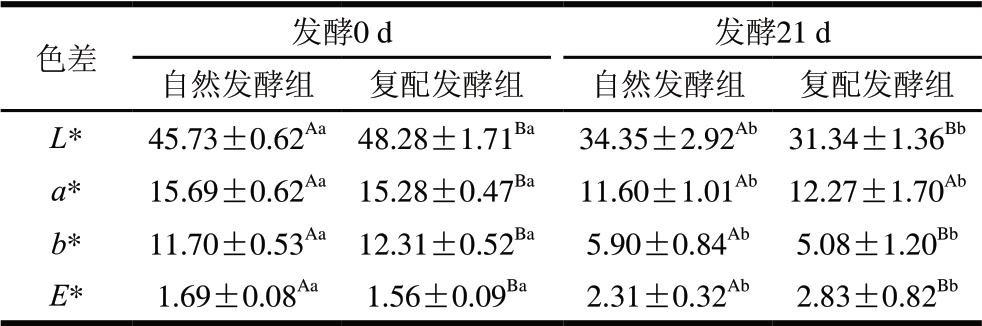
色差 发酵0 d 发酵21 d自然发酵组 复配发酵组 自然发酵组 复配发酵组L* 45.73±0.62Aa 48.28±1.71Ba 34.35±2.92Ab 31.34±1.36Bb a* 15.69±0.62Aa 15.28±0.47Ba 11.60±1.01Ab 12.27±1.70Ab b* 11.70±0.53Aa 12.31±0.52Ba 5.90±0.84Ab 5.08±1.20Bb E* 1.69±0.08Aa 1.56±0.09Ba 2.31±0.32Ab 2.83±0.82Bb
由表2可知:L*、E*受发酵时间、不同发酵处理作用影响显著(P<0.05);发酵21 d香肠的L*降低,E*升高。dos Santos Cruxen等[16]通过实验证实添加木糖葡萄球菌LQ3的香肠颜色比不添加的香肠颜色更红,具有更好的感官品质。Cao Chenchen等[13]的研究表明,复配发酵香肠pH值较低,促进了亚硝酸盐分解为NO,进而生成亚硝基肌红蛋白,从而改善了产品的色泽[17]。
2.3 牛肉发酵香肠质构测定结果
表 3 牛肉发酵香肠质构测定结果
Table 3 Texture properties of fermented beef sausages

注:同列大写字母不同,表示不同处理组间差异显著(P<0.05)。
组别 硬度/g 弹性 黏聚性 咀嚼性/g自然发酵组 13 319.80±3 617.10A 0.14±0.02A 0.47±0.03A 3 421.09±1 450.71A复配发酵组 22 661.87±3 607.16B 0.16±0.03B 0.47±0.03A 6 682.28±1 882.33B
质构特性是发酵香肠品质的重要特征,优良的香肠应当硬度适中、肠体坚实有弹性、质地紧密。由表3可知,复配发酵组香肠的硬度、弹性显著高于自然发酵组(P<0.05),表明接种发酵剂能显著提升产品的硬度和弹性,这与Essid等[18]的研究结果一致,该研究表明,使用植物乳杆菌和模仿葡萄球菌复合发酵显著提升了发酵香肠的硬度和弹性,提升产品品质。此外,复配发酵组香肠的咀嚼性显著高于自然发酵组,这表明接种发酵剂也可以改善香肠的咀嚼性,但2 组的黏聚性差异不显著,这与曹辰辰[19]的研究结果相一致。
2.4 牛肉发酵香肠亚硝酸盐含量测定结果
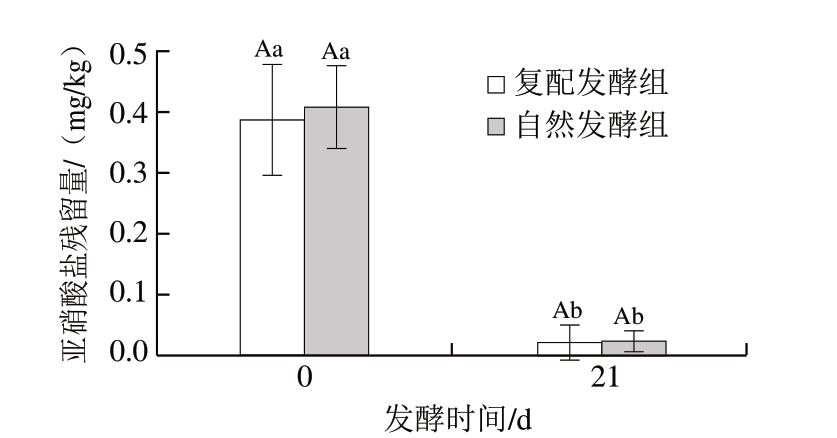
图 1 牛肉发酵香肠亚硝酸盐残留量测定结果
Fig. 1 Nitrite residue in fermented beef sausages
大写字母不同,表示发酵相同时间的不同处理组间差异显著(P<0.05);小写字母不同,表示相同处理组、不同发酵时间差异显著(P<0.05)。
由图1可知,亚硝酸盐残留量受发酵时间的影响极显著(P<0.01),而其受不同发酵处理的影响不显著。2 组发酵香肠发酵21 d时亚硝酸盐残留量都较0 d显著降低,发酵21 d时复配发酵组和自然发酵组的牛肉香肠中亚硝酸盐含量分别为0.95、1.00 mg/kg。此结果与曹辰辰等[4]的研究一致,发酵21 d时的发酵香肠中亚硝酸盐含量极低,并且远低于熟肉制品最大允许量30 mg/kg的国家标准[20]。
2.5 牛肉发酵香肠粗肽粉多肽含量测定结果
表 4 牛肉发酵香肠发酵21 d粗肽粉的肽含量测定结果
Table 4 Crude peptide content in sausages fermented for 21 days
注:同行大写字母不同,表示不同处理组间差异显著(P<0.05)。表5同。
指标 自然发酵组 复配发酵组粗肽粉肽含量/% 26.31±0.01A 28.49±0.04A
由表4可知,接种发酵剂后,粗肽粉肽含量从26.31%提高至28.49%,此结果与SDS-PAGE结果中15 kDa的条带增强相吻合,与Yu Di等[10]的结论相同,该研究认为在加工过程中,大分子质量多肽含量降低,小分子质量多肽含量增加;接种发酵剂能促进多肽含量增加,尤其是分子质量较小的多肽含量。依据樊康[21]的研究,在发酵香肠成熟前期,主要是香肠内源蛋白酶起作用,而在成熟后期,主要是微生物酶降解小肽。由于复配发酵组的微生物酶降解肽成小分子肽的能力较自然发酵组中微生物酶的能力更强,所以复配发酵组的肽含量要高于自然发酵组。
活性肽具有清除自由基、螯合金属离子的作用,可广泛抑制由金属离子、酶、单线态氧所诱发的氧化反应[3]。因此,肽含量的变化将直接影响自然发酵组和复配发酵组牛肉发酵香肠的其他抗氧化能力,如DPPH自由基清除能力、ABTS阳离子自由基清除能力、羟自由基清除能力等。
2.6 SDS-PAGE结果
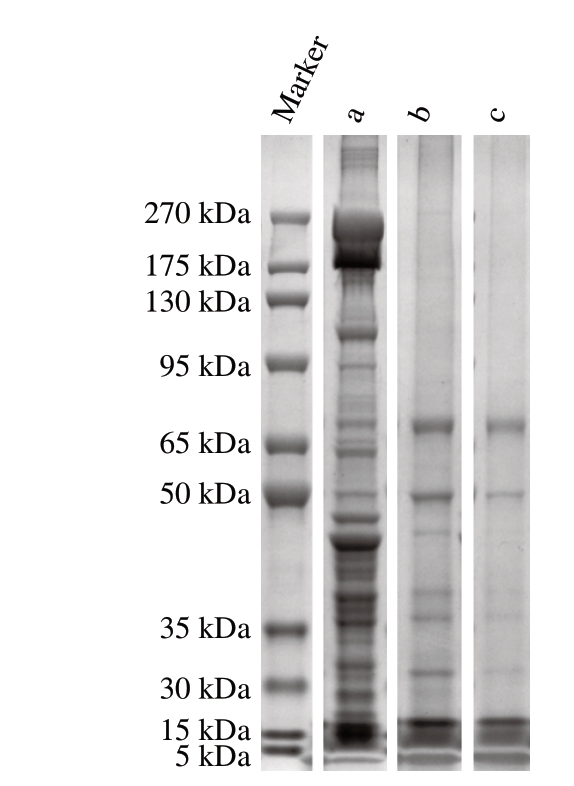
图 2 牛肉发酵香肠蛋白降解的SDS-PAGE结果
Fig. 2 SDS-PAGE results of protein degradation in beef fermented sausage
a.发酵0 d;b. 21 d自然发酵组;c. 21 d复配发酵组。
蛋白质降解是发酵香肠成熟过程中最重要的生化反应之一,参与这一过程的蛋白酶主要为内源蛋白酶及微生物蛋白酶。220、45、40、37 kDa分别对应肌球蛋白重链、肌动蛋白、原肌球蛋白和肌钙蛋白[11]。由图2可知,发酵0 d香肠蛋白中高分子质量的条带较多且颜色较深。与发酵0 d相比,发酵21 d复配发酵组与自然发酵组均几乎无95~270 kDa高分子质量条带,表明肌球蛋白重链强烈降解,这是肌肉内源酶作用的结果。
陈倩等[22]指出,在发酵初期,肌肉内源酶会将蛋白质降解成多肽,继而内源性氨肽酶可以将多肽进一步降解成小肽及游离氨基酸。此外,复配发酵组与自然发酵组相比,30~50 kDa条带几乎消失,这表明发酵剂加强了肌动蛋白、原肌球蛋白和肌钙蛋白的降解,接种微生物促进了内源蛋白酶的活性,从而促进了蛋白降解[11];同时,接种微生物也引入了较多的微生物蛋白酶,这2 种因素共同作用,导致蛋白降解程度的加深。15 kDa以下的条带颜色变深,可能是小分子肽和游离氨基酸的产生引发的累积,复配发酵剂对发酵香肠中蛋白质降解和小分子肽积累具有有效性,增加了多肽尤其是小分子多肽的含量。以上结果均与冯美琴等[11]的研究结果相似。
2.7 牛肉发酵香肠多肽DPPH自由基清除能力测定结果
当DPPH自由基与抗氧化剂相遇时,可以接受抗氧化剂的氢原子,导致其在517 nm波长处的吸光度下降,其变化程度与抗氧化剂的含量呈剂量关系[23]。因此多肽DPPH自由基清除能力可以作为抗氧化指标,反映香肠的抗氧化能力。
实验中1 mg/mL GSH的DPPH自由基清除率为95.64%,与Yu Di等[10]的结果相似。GSH组的DPPH自由基清除率均高于自然发酵组和复配发酵组,可验证自然发酵组和复配发酵组具有DPPH自由基清除能力。复配发酵组的DPPH自由基清除能力约为GSH组的1/3,自然发酵组的DPPH自由基清除能力约为GSH组的1/5。
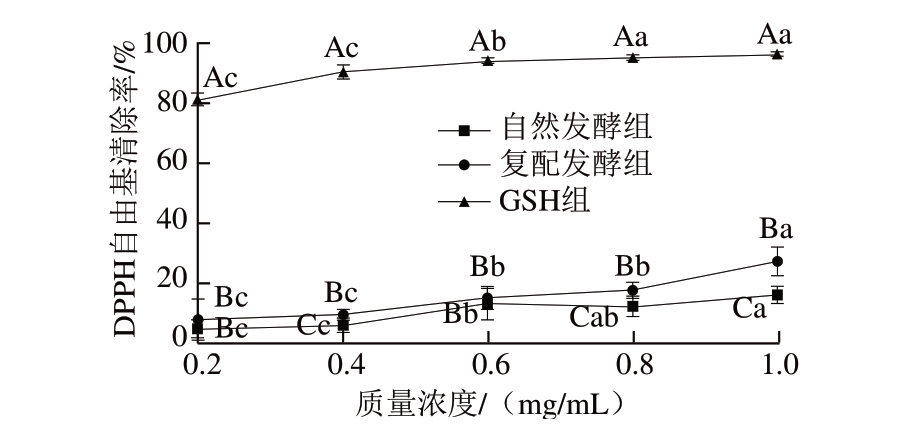
图 3 牛肉发酵香肠多肽DPPH自由基清除能力测定结果
Fig. 3 DPPH radical scavenging ability of polypeptides in fermented beef sausages
大写字母不同,表示相同质量浓度、不同处理组间差异显著(P<0.05);小写字母不同,表示相同处理组、不同质量浓度间差异显著(P<0.05)。图4同。
由图3可知,2 组牛肉发酵香肠多肽DPPH自由基清除率受质量浓度和发酵处理因素的影响均显著(P<0.05),复配发酵组DPPH自由基清除率显著高于自然发酵组(P<0.05),且2 组DPPH自由基清除率呈上升趋势。这表明接种发酵剂能显著增强小分子多肽清除DPPH自由基的能力。与Yu Di等[10]的研究结果相同。
Mejri等[24]发现,接种戊糖乳杆菌等菌种制作发酵香肠,能够促进香肠中产生抗氧化肽,从而使香肠具有良好的DPPH自由基清除能力。多肽的抗氧化活性与多肽的氨基酸组成、空间结构和疏水性有关,一些独特的氨基酸序列可能具有较强的抑制或阻断氧化链式反应的能力[25]。例如,Liu Dongmei等[26]指出,位于N端的疏水性氨基酸有利于提高多肽的抗氧化活性。由于DPPH自由基是一种稳定的亲脂性自由基,所以复配发酵组香肠中多肽DPPH自由基清除活性高说明复配发酵剂中微生物蛋白酶水解蛋白时暴露出更多疏水性氨基酸,使其更容易与DPPH自由基结合而发挥作用[10]。
2.8 牛肉发酵香肠多肽羟自由基清除能力测定结果
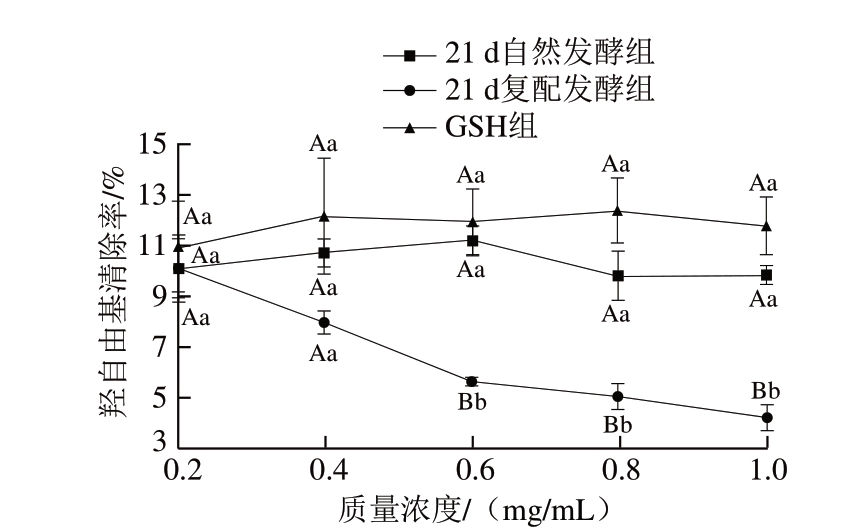
图 4 牛肉发酵香肠多肽羟自由基清除能力测定结果
Fig. 4 Hydroxyl radical scavenging ability of polypeptides in fermented beef sausages
羟自由基是目前已知对生物体危害最大的一种自由基,可对糖类、蛋白质、核酸和脂类等生物大分子造成氧化损伤[27]。由图4可知,在0.2、0.4 mg/mL质量浓度条件下,3 组羟自由基清除率无显著差异,但质量浓度大于0.4 mg/mL时,复配发酵组香肠与其他2 组相比开始出现显著差异(P<0.05)。GSH组、自然发酵组的羟自由基清除率随着质量浓度的增加并未表现出明显差异,而复配发酵组的羟自由基清除率却在大于0.4 mg/mL时呈现出显著下降(P<0.05)。
结果表明,复配发酵组香肠粗肽的羟自由基清除能力在质量浓度较高时显著低于自然发酵组,且随着质量浓度的增加,清除能力显著下降,与Yu Di等[10]的研究结果不符,该研究表明,发酵香肠中对羟自由基清除能力较好的为分子质量较大的多肽,小分子多肽的羟自由基清除能力显著下降。Zhu Chaozhi等[28]在金华火腿粗肽液分离过程中也发现,分子质量最小的组分羟自由基清除率最低,这可能是由于这些组分通常含有大量的氨基酸并且一些寡肽的抗氧化能力较弱。根据Chen Huiping等[29]报道,当多肽被水解为游离氨基酸时,其抗氧化能力可能会降低或完全消失。根据SDS-PAGE结果,复配发酵组蛋白质降解程度较重,小分子肽含量增加,这可能是导致羟自由基清除能力下降的原因。
2.9 牛肉发酵香肠多肽ABTS阳离子自由基清除能力测定结果
表 5 发酵香肠多肽ABTS阳离子自由基清除能力测定结果
Table 5 ABTS cation radical scavenging ability of polypeptides in fermented beef sausages
指标 自然发酵组 复配发酵组 GSH组ABTS阳离子自由基清除能力/(μmol/g) 171.50±15.08A209.91±10.18B771.00±1.67C
ABTS在适当的氧化剂作用下氧化成绿色的ABTS阳离子自由基,在抗氧化物存在时ABTS阳离子自由基的产生受到抑制,在734 nm波长处吸光度会下降[2]。由表5可知,复配发酵组香肠的ABTS阳离子自由基清除能力显著高于自然发酵组(P<0.05),同时GSH组的ABTS阳离子自由基清除能力为771.00 μmol/g,与自然发酵组和复配发酵组均有显著差异(P<0.05)。以上结果说明,复配发酵剂在加工过程中能显著增强多肽的ABTS阳离子自由基清除能力,提高发酵香肠中抗氧化肽的抗氧化活性。这与Yu Di等[10]的结论相似,其结果表明,接种复配发酵剂能在加工过程中显著增强小分子多肽的ABTS阳离子自由基清除能力。同时,Luan Xiaoxu等[30]表明,接种发酵组中低分子质量、高疏水氨基酸比例的短链肽含量更高,因而抗氧化活性更强。该指标的测定结果也与肽含量测定结果相符,进一步证明了复配发酵剂通过提高具有抗氧化功能的小分子多肽含量增强牛肉发酵香肠的ABTS阳离子自由基清除能力。
3 结 论
本研究探究发酵剂对牛肉发酵香肠品质及多肽抗氧化活性的影响。结果表明:接种发酵剂能显著提高香肠的硬度、弹性和咀嚼性等,改善产品色泽,提升产品品质;发酵21 d时亚硝酸盐含量明显下降,且含量在国标允许范围内,保证了香肠的安全性;肽含量测定及SDS-PAGE结果表明,复配发酵剂有效促进蛋白降解成分子质量较小的多肽;复配发酵组香肠多肽DPPH自由基清除率、ABTS阳离子自由基清除能力显著高于自然发酵组(P<0.05),但复配发酵组香肠多肽的羟自由基清除能力在质量浓度较高时显著低于自然发酵组,结合电泳结果,复配发酵组蛋白质降解程度强于自然发酵组,小分子质量肽含量增加,从而导致羟自由基清除能力显著下降。综上,本研究使用的复配发酵剂可以促进香肠产生内源性抗氧化肽,从而抑制牛肉发酵香肠氧化,为制作品质更高、货架期更长的牛肉发酵香肠提供了新思路。
[1] 山丽杰, 田洪涛, 贾英民, 等. 浓缩型乳酸菌发酵剂制备中几个技术关键问题的探讨[J]. 中国乳品工业, 2002(5): 66-69. DOI:10.3969/j.issn.1001-2230.2002.05.020.
[2] 龙强, 聂乾忠, 刘成国. 发酵香肠研究进展及展望[J]. 食品科学,2017, 38(13): 291-298. DOI:10.7506/spkx1002-6630-201713047.
[3] 秦春君, 李想, 邓锋, 等. 发酵肉制品抗氧化研究进展[J]. 食品与发酵工业, 2010, 36(7): 122-126. DOI:10.13995/j.cnki.11-1802/ts.2010.07.021.
[4] 曹辰辰, 冯美琴, 孙健, 等. 功能性发酵剂对发酵香肠氧化稳定性及挥发性风味物质的影响[J]. 食品科学, 2019, 40(20): 106-113.DOI:10.7506/spkx1002-6630-20190513-129.
[5] HAMMES W P, HERTEL C. New developments in meat starter cultures[J]. Meat Science, 1998, 49(Suppl 1): S125-S138.DOI:10.1016/S0309-1740(98)90043-2.
[6] 陈亚杰, 张香美, 卢涵, 等. 有益葡萄球菌对发酵肉制品品质影响[J]. 肉类工业, 2019(2): 40-43. DOI:10.3969/j.issn.1008-5467.2019.02.010.
[7] GIELLO M, LA STORIA A, DE FILIPPIS F, et al. Impact of Lactobacillus curvatus 54M16 on microbiota composition and growth of Listeria monocytogenes in fermented sausages[J]. Food Microbiology, 2018, 72: 1-15. DOI:10.1016/j.fm.2017.11.003.
[8] TODOROV S D, STOJANOVSKI S, ILIEV I, et al. Technology and safety assessment for lactic acid bacteria isolated from traditional Bulgarian fermented meat product “lukanka”[J]. Brazilian Journal of Microbiology, 2017, 48(3): 576-586. DOI:10.1016/j.bjm.2017.02.005.
[9] RZEPKOWSKA A, ZIELIŃSKA D, OŁDAK A, et al. Organic whey as a source of Lactobacillus strains with selected technological and antimicrobial properties[J]. International Journal of Food Science and Technology, 2017, 52(9): 1983-1994. DOI:10.1111/ijfs.13471.
[10] YU Di, FENG Meiqin, SUN Jian, et al. Protein degradation and peptide formation with antioxidant activity in pork protein extracts inoculated with Lactobacillus plantarum and Staphylococcus simulans[J]. Meat Science, 2020, 160: 107958. DOI:10.1016/j.meatsci.2019.107958.
[11] 冯美琴, 余頔, 孙健. 发酵剂对发酵香肠蛋白质降解及多肽抗氧化能力的影响[J]. 食品科学, 2020, 41(20): 97-104. DOI:10.7506/spkx1002-6630-20200521-251.
[12] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准食品pH值的测定: GB 5009.237—2016[S]. 北京: 中国标准出版社,2016: 1-4.
[13] CAO Chenchen, FENG Meiqin, SUN Jian, et al. Screening of lactic acid bacteria with high protease activity from fermented sausages and antioxidant activity assessment of its fermented sausages[J]. CyTAJournal of Food, 2019, 17(1): 347-354. DOI:10.1080/19476337.2019.1 583687.
[14] ZHAO Lihua, YE Jin, MA Changwei, et al. Physico-chemical characteristics and free fatty acid composition of dry fermented mutton sausages as affected by the use of various combinations of starter cultures and spices[J]. Meat Science, 2011, 88(4): 761-766.DOI:10.1016/j.meatsci.2011.03.010.
[15] KANNO T, KUDA T, AN C, et al. Radical scavenging capacities of saba-narezushi, Japanese fermented chub mackerel, and its lactic acid bacteria[J]. LWT-Food Science and Technology, 2012, 47(1): 25-30.DOI:10.1016/j.lwt.2012.01.007.
[16] DOS SANTOS CRUXEN C E, FUNCK G D, DA SILVA DANNENBERG G, et al. Characterization of Staphylococcus xylosus LQ3 and its application in dried cured sausage[J]. LWT-Food Science and Technology, 2017, 86: 538-543. DOI:10.1016/j.lwt.2017.08.045.
[17] LORENZO J M, GÓMEZ M, FONSECA S. Effect of commercial starter cultures on physicochemical characteristics, microbial counts and free fatty acid composition of dry cured foal sausage[J]. Food Control, 2014, 46: 382-389. DOI:10.1016/j.foodcont.2014.05.025.
[18] ESSID I, HASSOUNA M. Effect of inoculation of selected Staphylococcus xylosus and Lactobacillus plantarum strains on biochemical, microbiological and textural characteristics of a Tunisian dry fermented sausage[J]. Food Control, 2013, 32(2): 707-714.DOI:10.1016/j. foodcont.2013.02.003.
[19] 曹辰辰. 传统中式香肠中优良菌种的筛选及其对发酵香肠抗氧化和品质的影响[D]. 南京: 南京农业大学, 2019: 103-104.DOI:10.27244/d.cnki.gnjnu.2019.000910.
[20] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准 食品中亚硝酸盐与硝酸盐的测定:GB 5009.33—2016[S]. 北京: 中国标准出版社, 2016: 1-4.
[21] 樊康. 接种发酵对中式香肠品质的影响及其发酵剂的研制[D].南京: 南京农业大学, 2012: 47-48. DOI:10.7666/d.Y2361620.
[22] 陈倩, 韩齐, 孔保华, 等. 乳酸菌对发酵肉制品中肌肉蛋白降解作用的研究进展[J]. 食品科学, 2014, 35(9): 279-284. DOI:10.7506/spkx1002-6630-201409055.
[23] SHARMA O P, BHAT T K. DPPH antioxidant assay revisited[J].Food Chemistry, 2009, 113(4): 1202-1205. DOI:10.1016/j.foodchem.2008.08.008.
[24] MEJRI L, VÁSQUEZ-VILLANUEVA R, HASSOUNA M, et al.Identification of peptides with antioxidant and antihypertensive capacities by RP-HPLC-Q-TOF-MS in dry fermented camel sausages inoculated with different starter cultures and ripening times[J].Food Research International, 2017, 100: 708-716. DOI:10.1016/j.foodres.2017.07.072.
[25] LAFARGA T, ÁLVAREZ C, HAYES M. Bioactive peptides derived from bovine and porcine co-products: a review[J]. Journal of Food Biochemistry, 2017, 41(6): e12418. DOI:10.1111/jfbc.12418.
[26] LIU Dongmei, CHEN Xing, HUANG Jichao, et al. Generation of bioactive peptides from duck meat during post-mortem aging[J]. Food Chemistry, 2017, 237: 408-415. DOI:10.1016/j.foodchem.2017.05.094.
[27] CACCIUTTOLO M A, TRINH L, LUMPKIN J A, et al. Hyperoxia induces DNA damage in mammalian cells[J]. Free Radical Biology and Medicine, 1993, 14(3): 267-276. DOI:10.1016/0891-5849(93)90023-n.
[28] ZHU Chaozhi, ZHANG Wangang, ZHOU Guanghong, et al. Isolation and identification of antioxidant peptides from Jinhua ham[J].Journal of Agricultural and Food Chemistry, 2013, 61(6): 1265-1271.DOI:10.1021/jf3044764.
[29] CHEN Huiping, ZHAO Mouming, LIN Lianzhu, et al. Identification of antioxidative peptides from defatted walnut meal hydrolysate with potential for improving learning and memory[J]. Food Research International, 2015, 78: 216-223. DOI:10.1016/j.foodres.2015.10.008.
[30] LUAN Xiaoxu, FENG Meiqin, SUN Jian. Effect of Lactobacillus plantarum on antioxidant activity in fermented sausage[J].Food Research International, 2021, 144: 110351. DOI:10.1016/j.foodres.2021.110351.