噻嗪类利尿剂是一类促进体液从组织中排出的西药,主要有氯噻嗪、氢氯噻嗪、环戊噻嗪、环噻嗪、苄氟噻嗪、氯噻酮等,在临床上作为口服利尿药和降压药广泛使用。滥用此类利尿剂可影响肾脏代谢,引起低血钾和缺钾、脂肪代谢紊乱、糖代谢改变、肌肉血流改变甚至肌肉坏死。在体育运动中,个别运动员会在参赛体质量检查前服用利尿剂,通过快速排尿来快速减轻体质量;或在兴奋剂检查前服用利尿剂,用以增加尿液和禁用药物代谢速度,使药物随尿液排出体外,从而逃避药物检测。因此,国家体育总局在《2021年兴奋剂目录》中将利尿剂及其他具有相似化学结构和相似生物作用的物质归属为禁用物质。由于运动员在日常饮食中需摄入肉类以提供足够的能量,若摄入的肉类中存在利尿剂残留,可能会导致尿检阳性,从而导致误检误判。因此,检测运动员膳食肌肉组织中利尿剂的残留量至关重要。
目前国内外对噻嗪类利尿剂的检测研究主要集中在人尿液[1-3]、血液[4]、饲料[5]及减肥类保健食品[6-9]等方面,检测方法主要为高效液相色谱法[10-11]、气相色谱-质谱法[12]、液相色谱-质谱联用法[13-16]和高分辨质谱筛查方法[17-18],对于肌肉中噻嗪类利尿剂的测定报道还很少[19],因此研究运动员膳食肌肉组织中噻嗪类利尿剂的检测技术十分必要。由于利尿剂类药物经动物吸收、代谢后含量很低,肌肉组织中残留量通常在万分之一甚至百万分之一范围,这不仅要求样品提取和净化方法要具有普适性和高效性,还要求检测方法具有良好的选择性和高灵敏度。
鉴于此,本研究利用高效液相色谱-串联质谱技术建立猪、鸡和牛肌肉组织中氯噻嗪、氢氯噻嗪、环戊噻嗪、环噻嗪、苄氟噻嗪、氯噻酮共6 种噻嗪类利尿剂的检测方法,对检测方法的线性范围、检出限、回收率、精密度进行评价并应用于实际样品检测。
1 材料与方法
1.1 材料与试剂
30 个样品(10 个猪肉样品、8 个牛肉样品和12 个鸡肉样品)随机购自广州各市场。
乙腈、甲醇(均为色谱纯) 德国Merck公司;甲酸(色谱纯) 上海安谱实验科技股份有限公司;实验用水为经Milli-Q净化系统制备的超纯水;其他试剂均为分析纯,购于广州化学试剂厂。
标准品:氯噻嗪(纯度>99.0%)、氢氯噻嗪(纯度>98.0%)、环戊噻嗪(纯度>99.0%)、环噻嗪(纯度>99.2%)、苄氟噻嗪(纯度>99.0%)、氯噻酮(纯度>98.5%) 德国Dr. Ehrenstorfer公司。
1.2 仪器与设备
LC-20高效液相色谱仪-Triple Quad 4500三重四极杆质谱仪 美国AB Sciex公司;MS3 basic漩涡混合器 德国IKA公司;TurboVap LV氮吹仪 瑞典Biotage公司;KQ-500D数控超声波清洗器 昆山超声仪器有限公司;3K15离心机 德国Sigma公司;Milli-Q纯水器 美国Millipore公司;KDC 1044低速离心机 中科中佳有限公司;Oasis PRiME HLB固相萃取柱(200 mg,6 mL) 美国Waters公司。
1.3 方法
1.3.1 标准溶液配制
分别准确称取适量6 种噻嗪类利尿剂标准物质(精确至0.1 mg),用乙腈配制成质量浓度为100 mg/L的单标储备液,-18 ℃冰箱保存。准确移取各单标储备液0.20 mL,置于10 mL棕色容量瓶中,用乙腈定容,制得混合标准中间溶液(质量浓度均为2.0 mg/L,现用现配)。分别吸取混合标准中间溶液5、10、25、50、100、250 μL,用乙腈稀释至10 mL,得到6 种噻嗪类利尿剂质量浓度梯度均为1、2、5、10、20、50 µg/L的系列混合标准工作溶液(现用现配)。
1.3.2 样品处理
1.3.2.1 样品制备及贮存
取适量新鲜或解冻的肌肉组织,绞碎并均质,于-20 ℃以下保存。
1.3.2.2 提取
准确称取5 g(精确至0.01 g)均质样品于50 mL离心管内,加入10 mL乙腈-水溶液(30∶70,V/V),涡旋1 min,超声提取10 min,4 000 r/min离心3 min,移取上清液至25 mL比色管中,使用10 mL乙腈-水溶液(30∶70,V/V)重复提取1 次;合并2 次上清液并定容至25.0 mL,待净化。
1.3.2.3 净化
准确移取5.0 mL待净化提取液通过Oasis PRiME HLB固相萃取柱,待样液完全流出后,用5 mL 水淋洗,弃去流出液。减压抽干PRiME HLB固相萃取柱,用10 mL乙腈-水溶液(95∶5,V/V)洗脱至15 mL离心管中,将洗脱液于50 ℃下氮吹浓缩至干,再用1.0 mL初始流动相溶解残渣,过0.22 μm滤膜,用高效液相色谱-串联质谱测定。
1.3.3 实验条件
1.3.3.1 色谱条件
色谱柱:Waters Acquity UPLC BEH C18液相色谱柱(100 mm×2.1 mm,1.7 µm);流速0.3 mL/min;柱温30 ℃;进样量5 μL;流动相:乙腈(A)和5 mmol/L乙酸铵溶液(B),梯度洗脱程序:0~3 min,80%流动相B;3~6 min,80%~20%流动相B;6~9 min,20%流动相B;9~9.5 min,20%~80%流动相B;9.5~12.0 min,80%流动相B。
1.3.3.2 质谱条件
质谱条件:电喷雾离子源(electronspray ionization,ESI);扫描方式:负离子扫描;喷雾电压4 500 V;离子源温度450 ℃;雾化气压力276 kPa;辅助气压力414 kPa;气帘气压力276 kPa;检测方式:多反应监测模式;碰撞室出口电压10 V;母离子、子离子、去簇电压、碰撞电压及保留时间见表1。
表1 化合物的质谱检测条件
Table 1 Instrumental conditions for mass spectral analysis of the analytes
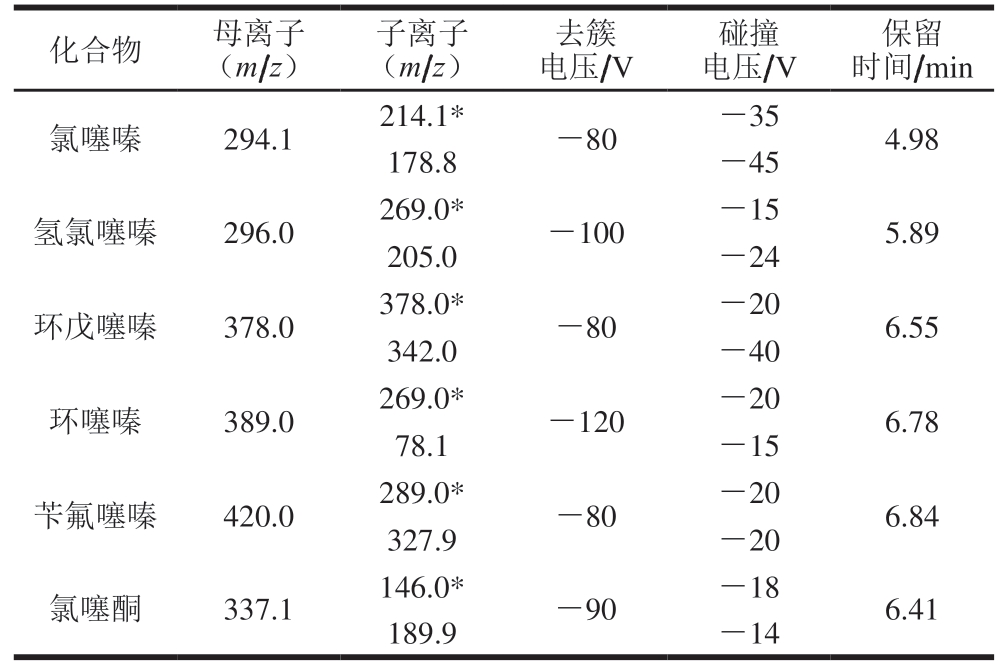
注:*. 定量离子。
?
1.4 数据处理
使用AB Sciex Analyst 1.6.2数据工作站软件进行数据采集、分析及计算,拟合线性回归曲线。
2 结果与分析
2.1 样品的提取和净化条件优化
动物肌肉组织中内源性物质较多,且大多数为脂溶性物质,在使用高效液相色谱-串联质谱检测时,这些干扰物质会产生严重的基质效应,因此需要选择合适的提取溶剂和净化方式。
2.1.1 提取溶剂的选择
由于噻嗪类利尿剂分子中含有苯并噻嗪环状结构,在有机溶剂中溶解度良好,可以使用有机溶剂-水混合溶剂进行提取。比较乙腈、甲醇、水等单一溶剂或二元溶剂对6 种目标物的提取效果。结果表明,采用乙腈或甲醇的单一有机溶剂体系,对6 种目标物的提取回收率均在83%以上,而单一水体系对6 种目标物的提取回收率均在25%以下,效率较低。使用有机溶剂-水二元体系提取时,有机相使用乙腈或甲醇时提取效果差别不大;但不同有机相比例会影响净化过程。有机相比例太低时(<10%),目标物提取效率全部低于60%;而有机相比例太高(>30%),虽然提取回收率满足了实验要求,但提取液同时提取了较多脂溶性杂质干扰物,影响固相萃取净化效果。此外,有机相比例较高的提取液还会导致固相萃取柱净化上样过程中目标物随有机相洗脱损失。综合比较,选取乙腈-水溶液(30∶70,V/V)进行提取,此时6 种目标物提取回收率均达到80%以上。
2.1.2 PRiME固相萃取净化条件的选择
PRiME固相萃取技术利用水可浸润性填料,无需常规固相萃取小柱的活化步骤,直接对提取液进行净化,可以有效去除杂质,减少基质干扰,近年来在食品中兽药残留[20-23]、农药残留[24-25]、真菌毒素[26-27]及污染物[28-30]等化合物的检测方法开发方面得到广泛应用。本研究利用PRiME HLB固相萃取小柱对上述提取液进行净化,并对洗脱液进行优化。分别使用10 mL体积分数95%、80%、50%、20%的乙腈-水溶液洗脱待测物,结果显示,采用20%、50%乙腈-水溶液作为洗脱液时,部分目标物仍未被洗脱,6 种目标物的回收率仅50%左右;当乙腈体积分数增加至80%以上时,6 种目标物洗脱回收率可达80%以上,满足检测要求。考虑到水在氮吹过程较难除去,因此,选择10 mL 95%乙腈-水溶液进行洗脱。
2.2 色谱条件优化
噻嗪类利尿剂分子中含有苯并噻嗪环状结构,其在C18、苯基、PFP色谱柱上会保留,综合考虑色谱柱经济性,首先考察实验室常用的C18色谱柱。选取Waters Acquity UPLC BEH C18(100 mm×2.1 mm,1.7 µm)、CNW Athena C18-WP(100 mm×2.1 mm,3 μm)和Shim-pack XR ODS(100 mm×2.0 mm,2.2 µm)色谱柱对6 种分析物进行分离。结果发现,3 种C18色谱柱均可以实现6 种噻嗪利尿剂的分离,且峰形良好。
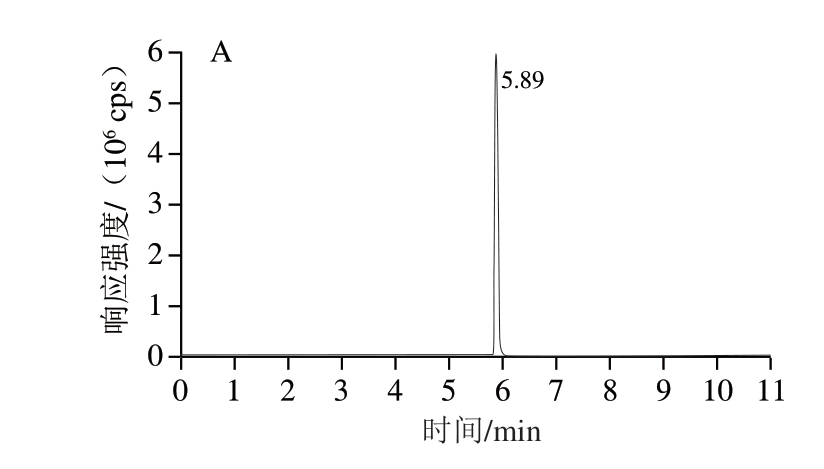
使用Waters Acquity UPLCBEHC1 8色谱柱(100 mm×2.1 mm,1.7 µm)进行分离,6 种分析物的提取离子色谱图如图1所示。
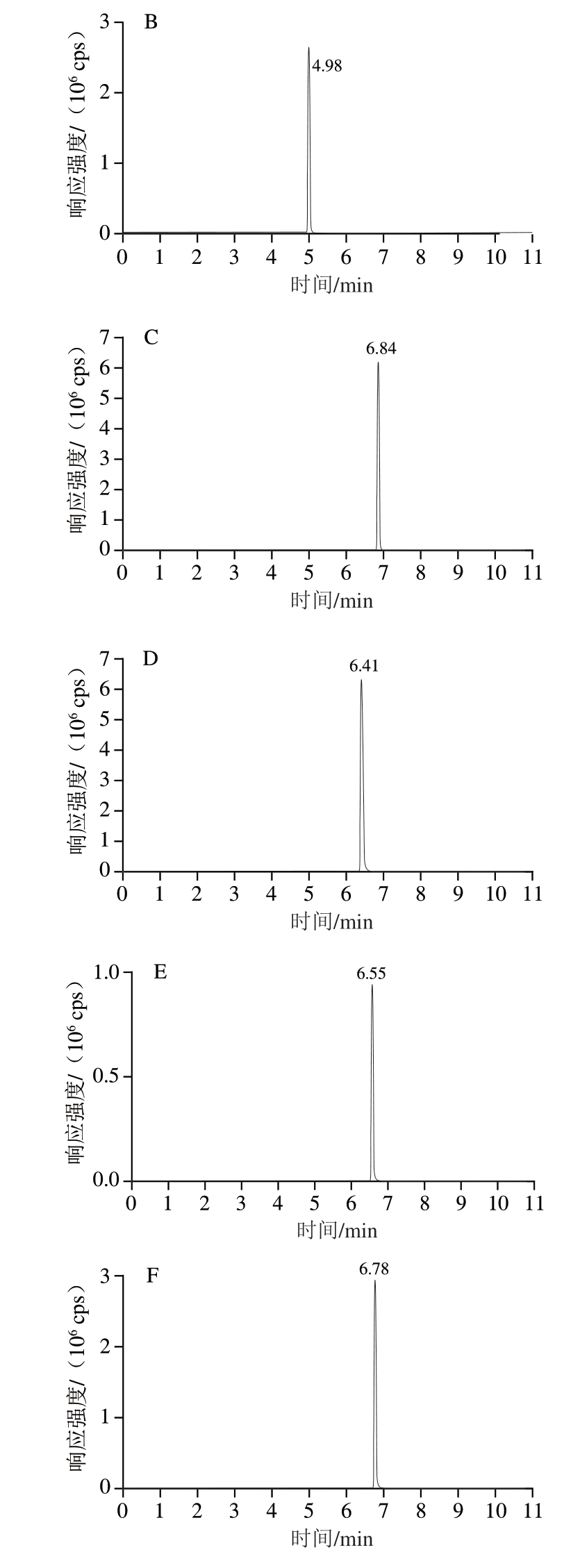
图1 6 种分析物标准溶液的提取离子色谱图
Fig. 1 Extracted ion chromatograms of standard solutions of six analytes
A. 氢氯噻嗪;B. 氯噻嗪;C. 苄氟噻嗪;D. 氯噻酮;E. 环戊噻嗪;F. 环噻嗪。
2.3 质谱条件优化
在多反应监测模式下,对6 种噻嗪类利尿剂的质谱条件进行优化。将6 种目标物的单标溶液(1.0 mg/L)在ESI+和ESI- 2 种模式下进行扫描。结果发现,目标物易在ESI-模式下得到[M-H]-准分子离子峰,质谱信号响应较强。选择该特征准分子离子峰为母离子进行二级质谱分析,以响应值最大的碎片离子为定量离子,次级响应的碎片离子为定性离子,优化质谱参数。
2.4 线性方程和定量限
在优化的实验条件下,分别对系列混合标准工作溶液进行测定,质量浓度为1~50 µg/L。以各化合物的定量离子对色谱峰面积(y)和其质量浓度(x,µg/L)进行线性回归拟合,得到6 种噻嗪类利尿剂在1~50 µg/L质量浓度范围内的线性方程。
以阴性牛肉样品进行添加回收实验,定量添加混合标准工作溶液,以信噪比(RS/N)=10确定方法定量限(limit of quantitation,LOQ)。
由表2可知,6 种目标物在1~50 µg/L质量浓度范围内线性关系良好,R2大于0.997,说明6 种化合物在其限定的质量浓度范围内的响应是线性的。6 种目标物的LOQ均为1.0 µg/kg,表明本方法灵敏,适用于6 种噻嗪类利尿剂化合物的定量分析。
表2 6 种分析物的线性范围、线性方程、相关系数及LOQ
Table 2 Linear ranges, linear regression equations, correlation coefficients and LOQs of six analytes

?
2.5 回收率、精密度实验
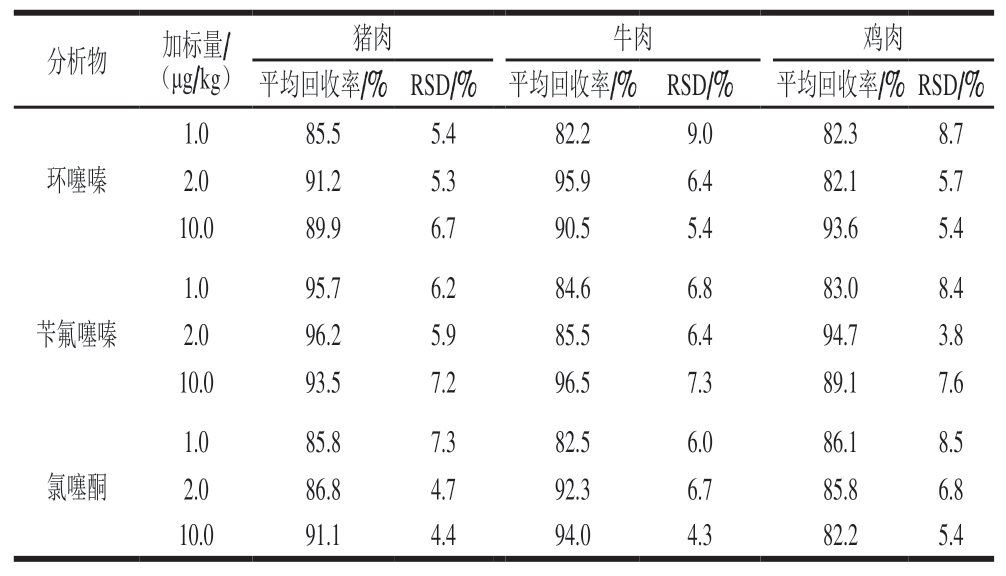
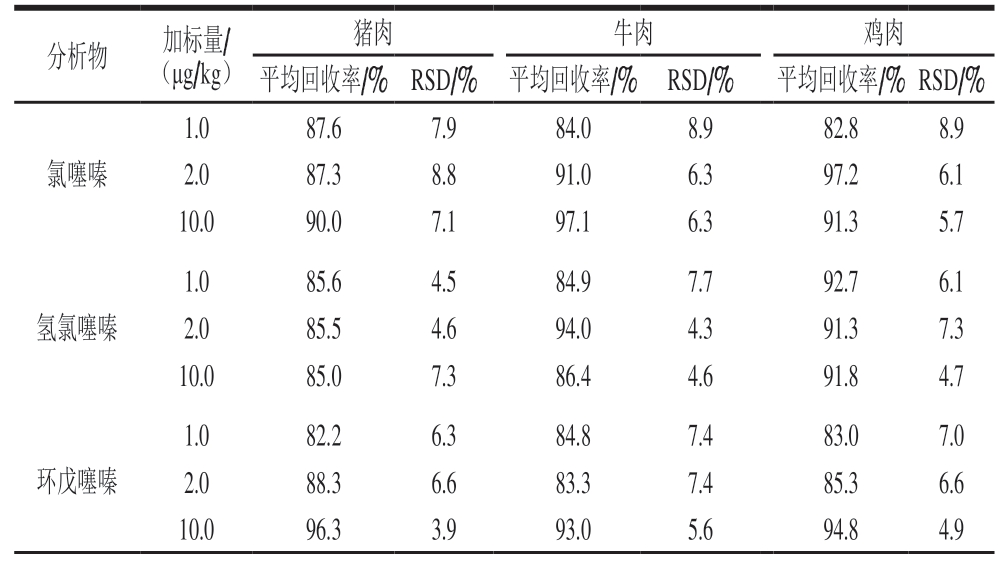
在最优实验条件下,选取猪肉、牛肉和鸡肉阴性样品,分别添加不同质量浓度的混合标准工作液,使目标物加标量分别为1.0、2.0、10.0 µg/kg,每个加标水平平行测定6 次,计算方法回收率和相对标准偏差(relative standard deviation,RSD)。
续表3
?
由表3可知,6 种噻嗪类利尿剂在3 个加标水平下,平均回收率为82.1%~97.2%,RSD为3.8%~9.0%,表明方法具有良好的回收率和精密度,能够满足肌肉组织中6 种噻嗪类利尿剂化合物的检测要求。
表3 肌肉中6 种噻嗪类利尿剂的加标回收率和精密度测定结果(n= 6)Table 3 Results of spiked recovery and precision for six analytes in real samples (n=6)
?
2.6 实际样品测定
对从本地市场随机购买的30 个肌肉样品(包括10 个猪肉样品、8 个牛肉样品和12 个鸡肉样品)应用本研究建立的方法进行检测,所有样品均未发现有上述6 种噻嗪类利尿剂检出。
3 结 论
利用高效液相色谱-串联质谱和PRiME固相萃取技术建立肌肉组织中氯噻嗪、氢氯噻嗪、环戊噻嗪、环噻嗪、苄氟噻嗪、氯噻酮6 种噻嗪类利尿剂的检测方法。该方法具有简便、快速、灵敏度高及重复性好等特点,其方法LOQ、回收率及精密度等指标能够满足肌肉中噻嗪类利尿剂检测的有关要求,该方法适用于肌肉组织中噻嗪类利尿剂检测的定性与定量。
[1] 朱永林, 贡玉清, 邵德佳, 等. 高效液相色谱-串联质谱法测定动物尿液中8 种利尿剂残留量[J]. 中国兽药杂志, 2008(9): 6-12.DOI:10.3969/j.issn.1002-1280.2008.09.002.
[2] 秦旸, 徐友宣, 吴侔天. 液相色谱-质谱法快速筛选人尿中26 种利尿剂[J]. 质谱学报, 2007(4): 229-232.
[3] 赵君, 董颖, 张丽娟, 等. 人尿中6 种利尿剂的液相色谱-串联质谱联用检测方法研究[J]. 中国运动医学杂志, 2016, 35(10): 947-951.DOI:10.16038/j.1000-6710.2016.10.008.
[4] 梁杨, 王小玲, 郭礼强. 基于QuEChERS提取的HPLC-MS/MS法检测人血浆中6 种常用利尿剂[J]. 药物分析杂志, 2019, 39(9): 1590-1596. DOI:10.16155/j.0254-1793.2019.09.07.
[5] 杨旺火. 高效液相色谱串联质谱法测定饲料中8 种利尿剂药物[J].粮食与饲料工业, 2 0 1 9(4): 5 7-6 1. D O I:1 0.7 6 3 3/j.issn.1003-6202.2019.04.015.
[6] 许立. 高效液相色谱-串联质谱法同时测定减肥类保健食品中29 种非法添加化学药品[D]. 杭州: 浙江工业大学, 2017: 15-60.
[7] 张栋, 宋志强, 陈荟婧, 等. 高效液相色谱-光电二极管阵列检测-串联四级杆质谱法测定人尿及保健品中的5 种利尿剂成分[J]. 科学技术与工程, 2016, 16(15): 124-128; 148.
[8] 马长路, 付丽, 马丽卿, 等. 减肥保健食品中4 种利尿剂液质色谱法的分析方法研究[J]. 食品工业, 2010, 31(5): 88-91.
[9] 田素润, 蒋俊树, 丁磊. 液相色谱-串联质谱法测定生鲜乳中氯噻嗪残留量[J]. 化学分析计量, 2013, 22(3): 17-19. DOI:10.3969/j.issn.1008-6145.2013.03.004.
[10] 王媛, 张文韬, 李斯特, 等. 固相萃取-高效液相色谱法同时测定减肥功能食品中五种违禁药物[J]. 四川大学学报(医学版), 2010, 41(5):873-876; 895. DOI:10.13464/j.scuxbyxb.2010.05.003.
[11] LIU Meng, LÜ Bingqiang, JIANG Hailong, et al. Determination of diuretics in human urine using HPLC coupled with magnetic solidphase extraction based on a metal-organic framework[J]. Biomedical Chromatography, 2020, 34(9): e4876. DOI:10.1002/bmc.4876.
[12] 赵海香, 郭振福, 汪丽萍, 等. 气相色谱-质谱法测定茶饮料中6 种利尿剂[J]. 理化检验(化学分册), 2010, 46(7): 820-824; 828.
[13] 马艳华, 闫宽, 董颖, 等. 液相色谱-动态串联质谱技术同时检测人尿中120 种刺激剂和利尿剂等禁用物质[J]. 中国运动医学杂志, 2016,35(5): 461-467; 472. DOI:10.16038/j.1000-6710.2016.05.009.
[14] 李卓, 陈玉龙, 孙晓, 等. 超高效液相色谱-串联质谱法同时测定减肥类保健食品中10 种非法添加利尿类及泻下类药物[J].食品工业科技, 2020, 41(22): 214-220. DOI:10.13386/j.issn1002-0306.2020010024.
[15] 刘子雄, 黄景辉, 谭贵良, 等. 超高效液相色谱-串联质谱法测定保健食品中78 种非法添加化学药物[J]. 现代食品科技, 2020, 36(12):283-292. DOI:10.13982/j.mfst.1673-9078.2020.12.0551.
[16] 颜伟华, 郭浩炜, 王笑笑, 等. 超高效液相色谱-质谱联用法同时测定减肥类保健食品中20 种化学药物的研究[J]. 现代食品, 2020(8):210-214. DOI:10.16736/j.cnki.cn41-1434/ts.2020.08.072.
[17] 芦丽, 宫旭, 冯有龙. UPLC-IT/TOF MS快速筛查确证保健食品中36 种非法添加的减肥、降血脂、通便类药物[J]. 中南药学, 2019,17(10): 1667-1676.
[18] 谭会洁, 郭常川, 邢晟, 等. Orbitrap高分辨质谱用于保健食品中15种非法添加减肥类药物的筛查鉴定[J]. 色谱, 2019, 37(9): 969-976.DOI:10.3724/SP.J.1123.2019.02009.
[19] 薛颖, 花锦, 高浩, 等. 超高效液相色谱-串联质谱法测定鸡肉和猪肉中利尿剂残留量[J]. 食品工业科技, 2021, 42(3): 230-235.DOI:10.13386/j.issn1002-0306.2020050206.
[20] 王梦颖, 陈烨超, 涂凤琴, 等. 超高效液相色谱-四极杆-飞行时间高分辨质谱用于乳液类化妆品中9 种抗过敏违禁药物的筛查和定量分析[J]. 色谱, 2020, 38(12): 1423-1430. DOI:10.3724/SP.J.1123.2020.06017.
[21] 程志, 宿书芳, 魏莉莉, 等. 通过式固相萃取净化-液相色谱-串联质谱法测定豆芽中10 种喹诺酮类抗生素[J]. 分析实验室, 2020, 39(2):131-136. DOI:10.13595/j.cnki.issn1000-0720.2019.050601.
[22] 宿书芳, 孙立臻, 薛霞, 等. 通过式固相萃取-超高效液相色谱-串联质谱法测定水产品中地西泮[J]. 色谱, 2020, 38(7): 791-797.DOI:10.3724/SP.J.1123.2019.11028.
[23] 章豪, 吴银良, 张宜文, 等. PRIME HLB固相萃取-超高效液相色谱-串联质谱法测定蜂产品中10 种头孢类药物的残留量[J]. 食品科学,2020, 41(22): 330-336. DOI:10.7506/spkx1002-6630-20190717-224.
[24] 朱富强, 吴树栋, 韩岩君, 等. 通过式固相萃取净化/超高效液相色谱-串联质谱法测定畜禽肉中19 种除草剂残留[J]. 环境化学, 2020,39(3): 835-839.
[25] 张婧雯, 张海超, 王敬, 等. 通过型固相萃取-液相色谱-高分辨质谱法快速测定粮谷中17 种酰胺类农药残留量[J]. 分析实验室, 2020,39(2): 154-160. DOI:10.13595/j.cnki.issn1000-0720.2019.061108.
[26] 易珊珊, 杜鑫. PRIME-HLB固相萃取/超高效液相色谱-串联质谱法同时快速检测粮食中4 种真菌毒素的含量[J]. 云南师范大学学报(自然科学版), 2020, 40(5): 47-52.
[27] XU Xiaoying, ZHU Bingqi, LIU Zhu, et al. Simultaneous determination of eight microcystins in fish by PRiME pass-through cleanup and online solid phase extraction coupled to ultra high performance liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography B, 2019, 1125: 121709. DOI:10.1016/j.jchromb.2019.06.036.
[28] 黄永桥, 马凯, 吴新文, 等. UHPLC-MS/MS法测定猪肉和牛肉中的高氯酸盐[J]. 食品工业, 2019, 40(12): 298-300.
[29] 牛宇敏, 王彬, 杨润晖, 等. 超高效液相色谱-串联质谱法同时测定尿液与血清中23 种双酚类化合物[J]. 分析测试学报, 2020, 39(6):715-721. DOI:10.3969/j.issn.1004-4957.2020.06.003.
[30] 张璐, 付晓燕, 孔祥虹, 等. 超高效液相色谱-四极杆/静电场轨道阱高分辨质谱快速测定羊乳中11 种磷酸二酯酶-5抑制剂[J].分析实验室, 2020, 39(2): 225-230. DOI:10.13595/j.cnki.issn1000-0720.2019.060601.