牛肉的食用品质是消费者购买牛肉时最重要的决定因素,包括嫩度、肉色、风味和多汁性等[1-2]。食用品质受宰后多种因素的影响[3],肌肉部位是影响牛肉品质的重要因素。许多研究报道了不同肌肉部位对食用品质的影响[4-6],结果表明,腰大肌较嫩且具有更好的肉色,半膜肌和半腱肌的保水性较差[6-8]。宰后成熟对牛肉的嫩度有明显的改善效果,成熟过程中肌间线蛋白、肌钙蛋白-T、肌联蛋白、伴肌动蛋白和其他骨架蛋白发生降解[2],其中肌间线蛋白和肌钙蛋白-T的降解是导致不同类型肌肉在成熟时期嫩度变化的最重要因素之一[9-10]。
许多研究表明,不同部位肌肉的嫩度和肉色稳定性不同[11-12]。然而,目前关于我国主要牛品种鲁西黄杂交牛和安秦杂交牛在宰后成熟过程中不同部位肌肉的食用品质变化和蛋白质水解程度的研究仍有限。因此,为了解这2 个品种肉牛宰后成熟期间不同部位肉成熟进程的差异,本研究分析安秦杂交牛和鲁西黄杂交牛3 个不同部位肌肉(背最长肌、腰大肌和半膜肌)成熟期间的品质变化以及肌间线蛋白和肌钙蛋白-T的降解情况对其食用品质的影响,以期为鲁西黄杂交牛和安秦杂交牛不同部位肌肉精准成熟方法的优化提供数据和理论支持。
1 材料与方法
1.1 材料与试剂
鲁西黄牛杂交牛(山东某肉牛屠宰场,24~30 月龄)和安秦杂交牛(陕西某肉牛屠宰场,24~30 月龄)各10 头,经标准流程屠宰,冷却成熟48 h后进行分割。选取正常pH值(5.4~5.8)范围的背最长肌、腰大肌和半膜肌3 个部位肉在0~4 ℃条件下运回实验室,分割为厚度为2.54 cm牛排进行真空包装(此时成熟时间为5 d),在(2±2)℃条件下继续成熟至7、14 d和21 d,分别在各时间点取样测定各项指标。
乙二胺四乙酸、溴酚蓝、BCA蛋白检测试剂盒、甘氨酸、十二烷基硫酸钠、β-巯基乙醇、Tris 北京索莱宝科技有限公司;抗肌间线蛋白小鼠单克隆抗体、抗肌钙蛋白-T小鼠单克隆抗体 美国Sigma-Aldrich公司;羊抗小鼠二抗 北京爱必信生物技术有限公司;磷酸氢二钠、磷酸二氢钠 国药集团化学试剂有限公司。
1.2 仪器与设备
VORTEX1漩涡振荡器、T18高速分散机 德国IKA公司;SenvenGo pH计 瑞士Mettler Toledo公司;SP62便携式积分球分光光度仪 美国X-Rite公司;TA-XT2i质构仪 英国Stable Micro System公司;BX41 Olympus光学显微镜 日本奥林巴斯公司;ChemiDoc MP凝胶成像仪 美国Bio-Rad公司;C200真空包装机 德国M u l t i Va c公司;T G L-1 6 M S台式高速冷冻离心机上海卢湘仪离心机仪器有限公司;HH-4数显恒温水浴锅常州国华电器有限公司。
1.3 方法
1.3.1 pH值的测定
使用校正率为95%以上的pH计测定牛排的pH值,每块牛排测定3 个点,取其平均值。
1.3.2 蒸煮损失的测定
参考张一敏等[13]的方法,取各成熟时间点的背最长肌、腰大肌和半膜肌肉样,称质量(m1,g)。将肉样放置于真空包装袋中,在肉样中心插入温度计,80 ℃水浴加热至中心温度70 ℃后取出。冷却后放入0~4 ℃环境中过夜,用滤纸吸干肉样表面汁液,再次称质量(m2,g)。每组3 个平行,结果取平均值。
1.3.3 肉色的测定
将牛排包装袋打开,取出牛排发色30 min后,使用色差计测定牛排表面亮度值(L*)、红度值(a*)和黄度值(b*)。测定肉样表面6 个点,结果取平均值。
1.3.4 剪切力的测定
参考Hou Xu等[14]的方法,取1.3.2节中冷却过夜后的肉样,用直径1.27 cm的取样器沿肌纤维方向取肉柱,用质构仪测定肉样剪切力,每块牛排至少取6 个肉柱,结果取其平均值。
1.3.5 肌节长度的测定
参考Li Ke等[15]的方法并做相应修改。取2 g肉样,加入18 mL提前预冷的蔗糖溶液(0.25 mol/L,4 ℃),6 000 r/min匀浆1 min后制作载玻片。使用光学显微镜在放大倍数1 000 倍下观察肌节并拍照,每个样品保留30 份图像。使用Image-Pro Plus Version 6.0(美国)软件测量肌节长度,结果取平均值。
1.3.6 肌原纤维蛋白的提取
参考Liu Rui等[16]的方法并做相应修改。在0.5 g肉样中加入5 mL试剂Ⅰ(100 mmol/L Tris、10 mmol/L乙二胺四乙酸,pH 8.3),匀浆,15 000×g、4 ℃高速离心40 min,弃上清液,在沉淀中加入5 mL试剂Ⅱ(含2%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)的10 mmol/L磷酸盐缓冲液),继续匀浆,1 500×g常温离心15 min后,去上清液。用BCA蛋白检测试剂盒测定上清液蛋白质量浓度,调整蛋白质量浓度至8 mg/mL。加入等体积的试剂Ⅲ(100 mmol/L Tris、4% SDS、20%甘油、5 mmol/L乙二胺四乙酸、1%溴酚蓝和β-巯基乙醇,pH 6.8),混匀,95 ℃水浴5 min后备用。
1.3.7 免疫印迹技术检测肌原纤维降解程度
使用SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)检测肌间线蛋白降解和肌钙蛋白-T的降解程度。肌间线蛋白分离胶10%,肌钙蛋白-T分离胶12.5%,浓缩胶均为5%,电泳缓冲液为25 mmol/L Tris、192 mmol/L甘氨酸和0.1% SDS。分别以宰后45 min腰大肌的肌间线蛋白和宰后5 d背最长肌的肌钙蛋白-T作标准参考。样品在80 V电压下电泳30 min,然后在120 V电压下电泳至结束。电泳结束后,在4 ℃、90 V恒压下将凝胶中的蛋白质通过Mini-Protean II系统转印1.5 h至聚偏氟乙烯膜中。然后用TBST(20 mmol/L Tris、137 mmol/L NaCl、5 mmol/L KCl和0.05%吐温-20)稀释的5%脱脂乳粉在室温下封闭1.5 h。加入一抗(用TBST稀释,肌间线蛋白1∶1 000、肌钙蛋白-T 1∶500),4 ℃孵育过夜。用TBST洗膜25 min(5 min/次)去除多余抗体,然后加入二抗(用TBST稀释,1∶5 000)在室温下孵育1.5 h后,TBST清洗5 次。用ECL显影液处理膜,使用Bio-Rad成像分析仪检测条带灰度,并使用Quantity One软件进行定量分析。
1.4 数据处理
所有数据采用SAS 9.0软件进行方差分析。以肌肉部位、品种和成熟时间和其相互作用为固定效应,以动物为随机效应的混合模型分析方法,P<0.05表示具有显著性差异。
2 结果与分析
2.1 品种、肌肉部位和成熟时间对牛排pH值和蒸煮损失的影响
由表1可知,品种、肌肉部位和成熟时间三因素交互作用对pH值影响不显著(P>0.05),品种和成熟时间两因素交互作用对其影响显著(P<0.05),因此,对于pH值,仅对品种和成熟时间作分析。成熟21 d期间2 个品种牛排的pH值为5.49~5.64,安秦杂交牛各部位肉在不同成熟时间无显著差异,而鲁西黄牛杂交牛各部位肉的pH值随着成熟时间的延长显著升高(P<0.05),这与Mungure等[17]的结果一致。这可能是由于肌肉中蛋白质水解导致游离氨基酸和肌肽增加[18-20]。品种、肌肉部位和成熟时间三因素交互作用对蒸煮损失影响不显著,品种和成熟时间的交互作用对蒸煮损失率影响显著(P<0.05),因此,对于蒸煮损失率,仅对品种和成熟时间作分析。随着成熟时间的延长,2 个品种牛排的蒸煮损失率变化不显著。成熟5~14 d,2 个品种牛排蒸煮损失率无显著差异,但是成熟21 d时鲁西黄杂交牛的蒸煮损失率显著高于安秦杂交牛(P<0.05)。
表1 品种和成熟时间对牛排pH值和蒸煮损失率的影响
Table 1 Effect of breed and postmortem aging time on pH and cooking loss of beef steaks

注:a、b. 同一指标相同品种、不同成熟时间差异显著(P<0.05);x、y.同一指标相同成熟时间、不同品种差异显著(P<0.05) 。表2同。
?
2.2 品种、肌肉部位和成熟时间对牛排肉色的影响
肉色是影响消费者购买决策的重要因素,也是用于判断牛肉是否新鲜的重要指标[21]。肉色受多种因素的影响,其中,品种、部位和成熟时间均是影响肉色的重要因素[22]。由表2可知,品种、成熟时间和肌肉部位三因素交互作用对L*影响不显著,品种和成熟时间的交互作用对L*影响显著(P<0.05),因此,对于L*,仅对品种和成熟时间作分析。随着成熟时间的延长,安秦杂交牛的L*显著降低,而成熟时间对鲁西黄杂交牛的L*影响不显著。
表2 品种和成熟时间对牛排L*的影响
Table 2 Effect of breed and postmortem aging time on L* of beef steaks

?
由表3可知,品种、成熟时间和肌肉部位三因素交互作用对牛排a*影响显著(P<0.05)。2 个品种牛排背最长肌不同成熟时间的a*均低于腰大肌和半膜肌,Sujiwo等[21]研究也发现牛背最长肌的a*低于腰大肌(P<0.05)。另一项研究[8]发现,牛腰大肌的肌红蛋白含量高于背最长肌和半膜肌,导致腰大肌a*更大。成熟21 d期间,鲁西黄杂交牛各部位肉的a*均无显著变化,2 个品种牛排腰大肌的a*也无显著差异,而安秦杂交牛半膜肌在成熟14、21 d时a*较成熟7 d时显著降低(P<0.05)。品种、成熟时间和肌肉部位三因素交互作用对b*影响显著(P<0.05)。2 个品种牛排背最长肌不同成熟时间的b*均低于腰大肌和半膜肌。成熟期间鲁西黄牛杂交牛各部位肉和安秦杂交牛背最长肌和腰大肌b*无显著变化。b*总体变化规律与a*一致。
表3 品种、肌肉部位和成熟时间对牛排a*和b*的影响
Table 3 Effect of breed, muscle type and postmortem aging time on a*and b* of beef steaks
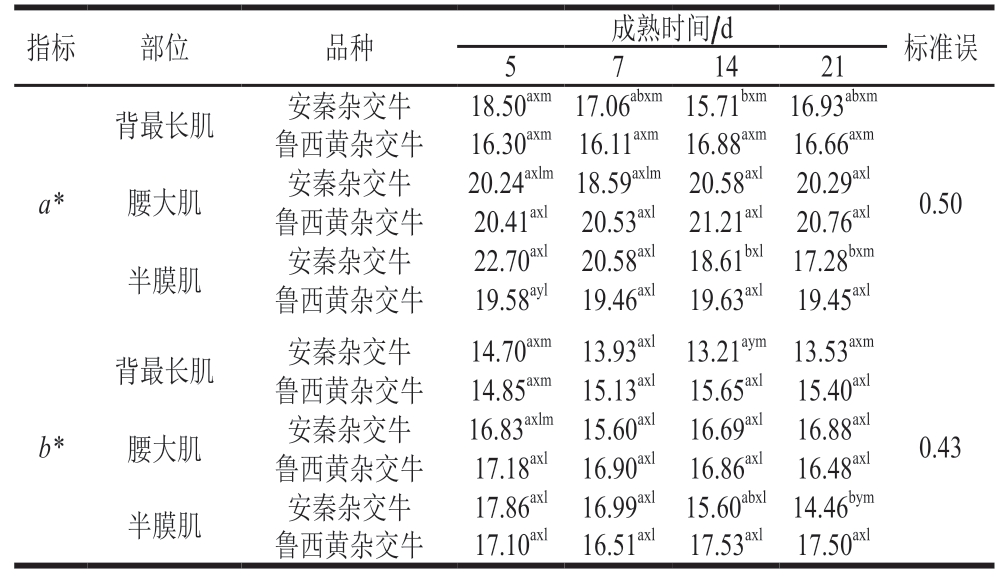
注:l、m. 同一指标相同成熟时间和品种,不同部位肌肉差异显著(P<0.05)。表4同。
?
2.3 品种、肌肉部位和成熟时间对牛排剪切力和肌节长度的影响
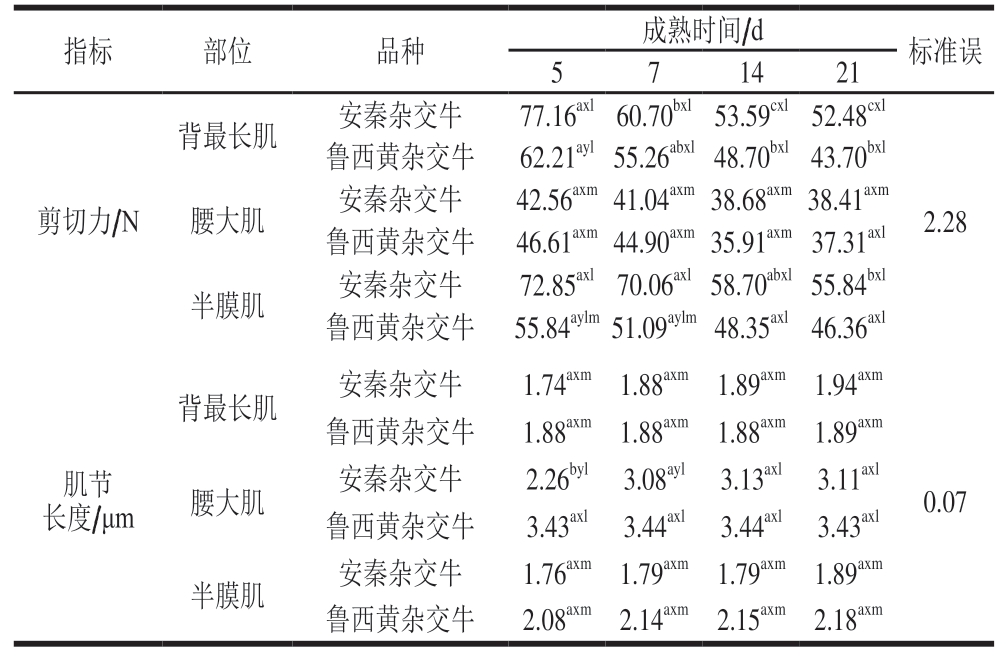
一般,剪切力与嫩度成正比,肌节长度与嫩度成反比。由表4可知,品种、肌肉部位和成熟时间对牛排剪切力影响显著(P<0.05)。安秦杂交牛和鲁西黄杂交牛背最长肌以及安秦杂交牛半膜肌的剪切力在成熟过程中均显著下降(P<0.05),说明延长成熟时间可以改善这2 个部位肉的嫩度[23];而腰大肌剪切力随成熟时间的延长无显著降低。整个成熟过程中,安秦杂交牛背最长肌和半膜肌的剪切力相似,且显著高于腰大肌(P<0.05)。而鲁西黄杂交牛成熟7 d时背最长肌剪切力显著高于腰大肌和半膜肌(P<0.05),成熟14、21 d时背最长肌和半膜肌的剪切力相近,腰大肌在不同成熟时间的剪切力无显著差异。这表明随着成熟时间的延长,背最长肌的嫩度有所改善,且腰大肌嫩度好于另外2 个部位。Saudo等[24]研究发现,不同品种牛的剪切力存在显著差异,但在成熟14 d时嫩度接近,说明较长的成熟时间有利于肉的嫩化。随着成熟时间的延长剪切力下降,可能是由于肌原纤维蛋白通过内源蛋白水解酶降解导致[23,25-26]。品种、肌肉部位和成熟时间对肌节长度影响显著(P<0.05)。安秦杂交牛腰大肌肌节长度在成熟期间呈现显著上升趋势(P<0.05),而安秦杂交牛其他部位肉和鲁西黄杂交牛3 个部位肌肉肌节长度均无显著变化。2 个品种牛腰大肌肌节长度均显著高于背最长肌和半膜肌(P<0.05),而背最长肌和半膜肌无显著性差异。该结果与Veiseth-Kent等[10]的研究结果一致,即腰大肌的肌节长度较其他部位的肌节长度长。
表4 品种、肌肉部位和成熟时间对牛排剪切力和肌节长度的影响Table 4 Effect of breed, muscle type and postmortem aging time on shear force and sarcomere length of beef steaks
?
2.4 品种、肌肉部位和成熟时间对牛排肌间线蛋白降解程度的影响
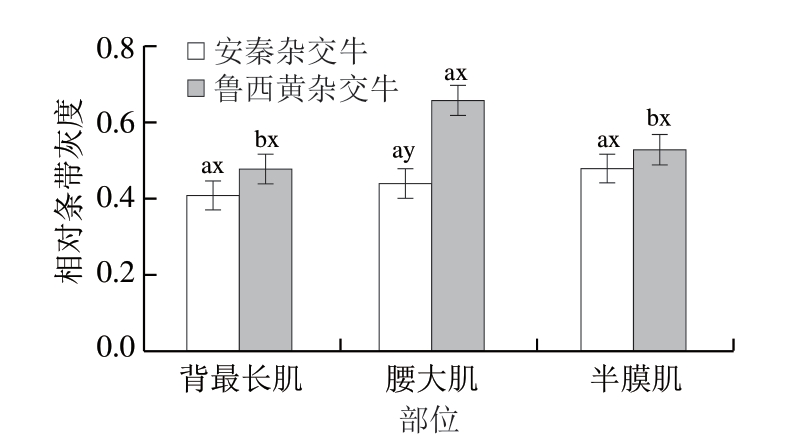
图2 不同品种、部位对牛排肌间线蛋白相对条带灰度的影响
Fig. 2 Effect of breeds and muscle types on relative grey of desmin in beef steaks
a、b. 同一品种、不同部位差异显著(P<0.05);x、y.
同一部位肌肉、不同品种差异显著(P<0.05)。图5同。
对鲁西黄杂交牛和安秦杂交牛3 个部位肌肉样品进行免疫印迹分析,肌间线蛋白的降解情况如图1所示。显著性分析结果表明,品种、成熟时间和肌肉部位三因素交互作用对肌间线蛋白降解影响不显著(P>0.05),品种和肌肉部位两因素交互作用及成熟时间对其影响显著(P<0.05)。由图1~3可知,安秦杂交牛3 个肌肉部位的肌间线蛋白降解程度差异不显著,鲁西黄杂交牛腰大肌的肌间线蛋白相对条带灰度显著高于背最长肌和半膜肌(P<0.05),这说明鲁西黄杂交牛腰大肌的肌间线蛋白降解程度显著低于其余2 个部位肌肉,这可能与pH值下降、钙蛋白酶自溶以及蛋白酶水解活性丧失有关,最终导致肌原纤维蛋白降解减少[27]。鲁西黄杂交牛腰大肌肌间线蛋白相对条带灰度显著高于安秦杂交牛(P<0.05),说明鲁西黄杂交牛的腰大肌肌间线蛋白降解程度低于安秦杂交牛腰大肌,而2 个品种牛背最长肌和半膜肌的肌间线蛋白降解程度差异不显著。随着成熟时间的延长,肌间线蛋白条带灰度显著下降(P<0.05),说明肌间线蛋白降解显著增加。通常认为由钙蛋白酶系统调控的肌间线蛋白水解程度与牛肉嫩度有关[28]。肌间线蛋白由中间纤维网络组成,维持着肌原纤维的结构完整性和肌细胞的功能[29-31]。
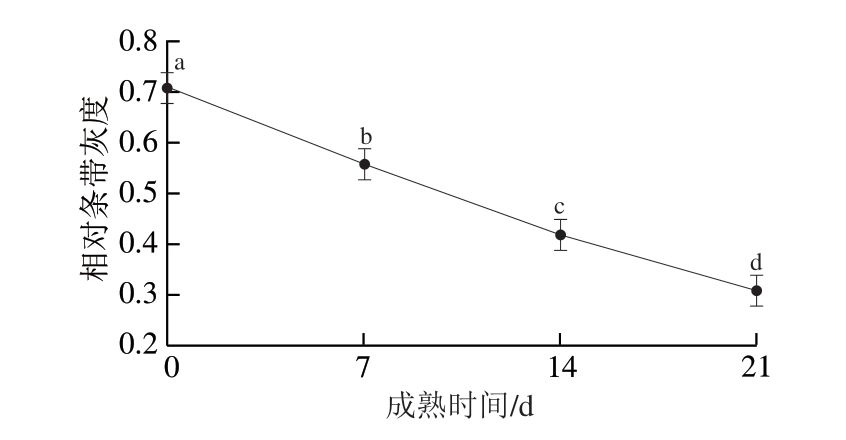
小写字母不同,表示差异显著(P<0.05)。
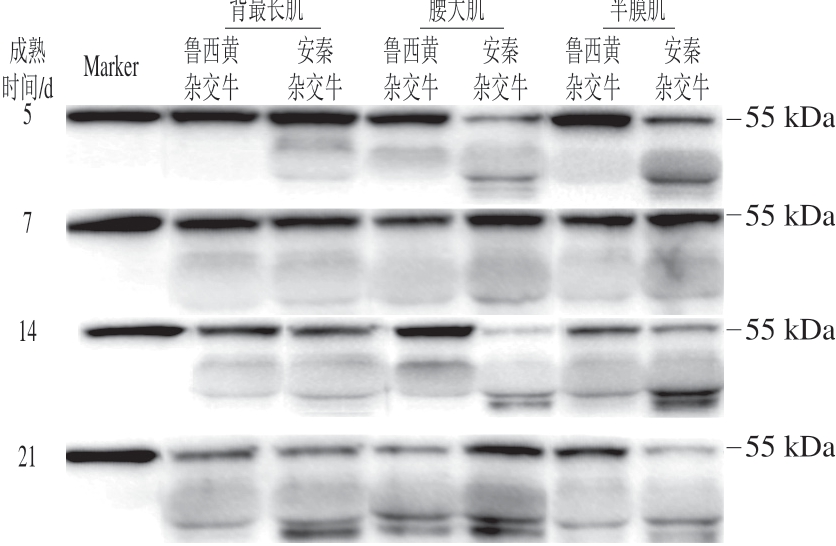
图1 不同品种、部位牛排成熟期间肌间线蛋白的Western blotting分析Fig. 1 Western blotting patterns of desmin in different muscles from different breeds during maturation
2.5 品种、肌肉部位和成熟时间对牛排肌钙蛋白-T降解程度的影响
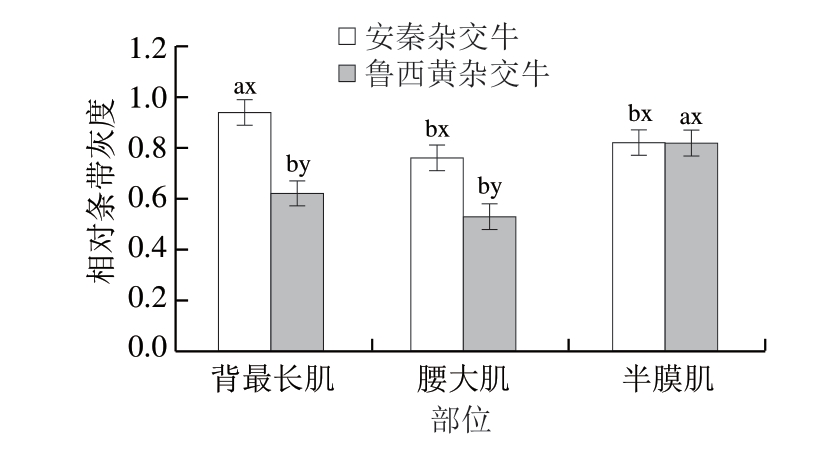
图5 不同品种、部位对牛排肌钙蛋白-T 30 kDa降解条带相对灰度的影响
Fig. 5 Effect of breeds and muscle types on relative grey of 30 kDa degradation products from troponin-T in beef steaks
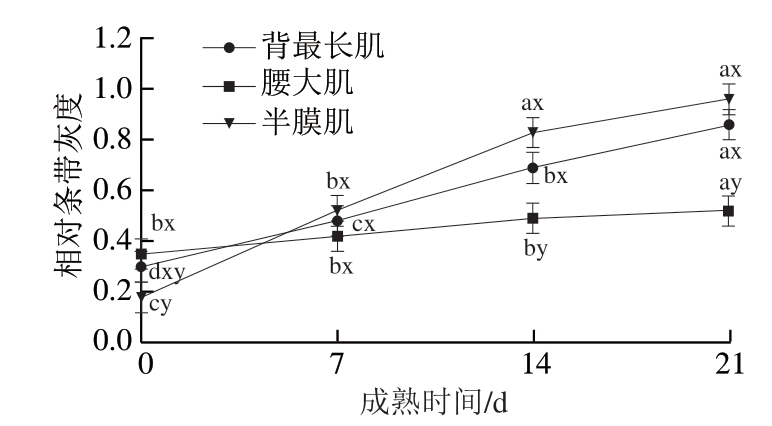
图6 成熟时间和肌肉部位对肌钙蛋白-T 30 kDa降解条带相对灰度的影响
Fig. 6 Effect of postmortem aging time and muscle types on relative grey of 30 kDa degradation products from troponin-T in beef steaks
a~d. 同一部位、不同成熟时间差异显著(P<0.05);x、y. 同一成熟时间、不同部位差异显著(P<0.05)。
由图4~6可知,品种、成熟时间和肌肉部位三因素交互作用对肌钙蛋白-T降解影响不显著(P>0.05),品种和肌肉部位两因素交互作用与肌肉部位与成熟时间两因素交互作用对其影响显著(P<0.05)。有研究表明,肌钙蛋白-T 30 kDa降解产物的出现是牛肉嫩化的标志[28,32],同时也是钙蛋白酶激活的标志。钙蛋白酶会破坏肌肉细胞的整体结构,最终改善肉的嫩度[28,33]。2 个品种牛半膜肌的肌钙蛋白-T 30 kDa降解产物的相对条带灰度在成熟14 d和21 d显著高于其他部位(P<0.05),成熟7 d无显著性差异。鲁西黄杂交牛背最长肌和腰大肌的肌钙蛋白-T降解速率低于安秦杂交牛(P<0.05),对于半膜肌,2 种牛之间肌钙蛋白-T水解程度差异不显著。以上结果证明成熟时间和品种对肌钙蛋白-T降解产生影响。3 个部位肌肉肌钙蛋白-T 30 kDa降解产物的相对条带灰度在成熟过程中均逐渐升高,表明肌钙蛋白-T降解增加。在品种和肌肉部位两因素交互作用分析中,鲁西黄杂交牛腰大肌的肌钙蛋白-T 30 kDa降解产物的相对条带灰度低于半膜肌(P<0.05),然而,在肌肉部位与成熟时间两因素交互作用分析中,成熟7 d时这3 个部位之间没有差异(P>0.05)。因此,综合分析以上结果可知,在成熟过程中,背最长肌和半膜肌肌钙蛋白-T的降解速率要快于腰大肌,这可能是背最长肌和半膜肌的剪切力随成熟时间的延长而降低,而腰大肌剪切力未出现显著降低的原因。
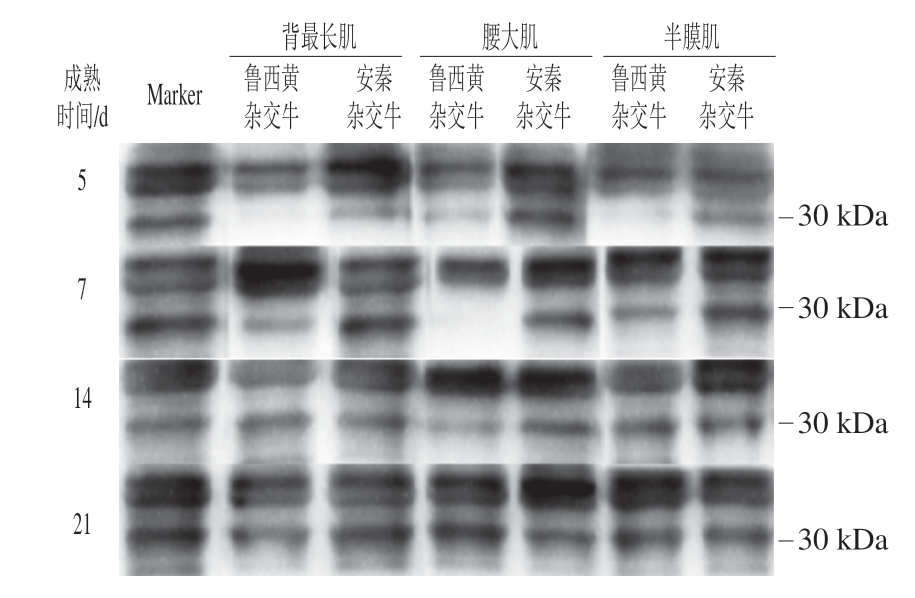
图4 不同品种、部位牛排成熟期间肌钙蛋白-T 30 kDa降解产物的Western blotting分析
Fig. 4 Western blotting patterns of 30 kDa degradation products from troponin-T in different muscles from different breeds during maturation
3 结 论
鲁西黄杂交牛和安秦杂交牛不同部位肌肉间食用品质差异显著,腰大肌具有更好的嫩度、肉色和保水性。延长宰后成熟时间能有效降低牛肉的剪切力,有利于提高不同部位牛肉的嫩度,成熟14 d能够改善不同部位肌肉的嫩度,其中宰后成熟时间对背最长肌和半膜肌嫩度改善更明显,对腰大肌嫩度改善有限。在宰后成熟过程中,所有样品的肌间线蛋白和肌钙蛋白-T均发生降解,鲁西黄杂交牛和安秦杂交牛背最长肌和半膜肌的肌间线蛋白和肌钙蛋白-T降解程度高于腰大肌。同时,与鲁西黄杂交牛相比,安秦杂交牛腰大肌的肌间线蛋白和肌钙蛋白-T降解程度更高。因此,不同品种间不同部位肉的成熟规律不同,有必要针对不同部位开发相应的成熟方案,以优化肉类行业的成熟技术,提高食用质量和价值。
[1] SMITH G C, TATUM J D, BELK K E. International perspective:characterisation of United States Department of Agriculture and Meat Standards Australia systems for assessing beef quality[J]. Australian Journal of Experimental Agriculture, 2008, 48(11): 1465-1480.DOI:10.1071/EA08198.
[2] STARKEY C P, GEESINK G H, COLLINS D, et al. Do sarcomere length, collagen content, pH, intramuscular fat and desmin degradation explain variation in the tenderness of three ovine muscles?[J]. Meat Science, 2016, 113(3): 51-58. DOI:10.1016/j.meatsci.2015.11.013.
[3] GAGAOUA M, TERLOUWAB E M C, MICOL D, et al. Sensory quality of meat from eight different types of cattle in relation with their biochemical characteristics[J]. Journal of Integrative Agriculture,2016, 15(7): 1550-1563. DOI:10.1016/S2095-3119(16)61340-0.
[4] RHEE M S, WHEELER T L, SHACKELFORD S D, et al. Variation in palatability and biochemical traits within and among eleven beef muscles[J]. Journal of Animal Science, 2004, 82(2): 534-550.DOI:10.1046/j.1439-0388.2003.00440.x.
[5] VIEIRA C, CERDEÑO A, SERRANO E, et al. Breed and ageing extent on carcass and meat quality of beef from adult steers(oxen)[J]. Livestock Science, 2007, 107(1): 62-69. DOI:10.1016/j.livsci.2006.09.004
[6] MAHESH N N, ANNA C V C S C, GREGG R, et al. Musclespecific effect of aging on beef tenderness[J]. LWT-Food Science and Technology, 2019, 100: 250-252. DOI:10.1016/j.lwt.2018.10.038.
[7] KIM G D, YANG H S, JEONG J Y. Comparison of characteristics of myosin heavy chain-based fiber and meat quality among four bovine skeletal muscles[J]. Korean Journal for Food Science of Animal Resources, 2016, 36(6): 819-828. DOI:10.5851/kosfa.2016.36.6.819.
[8] JOO S H, LEE K W, HWANG Y H, et al. Histochemical characteristics in relation to meat quality traits of eight major muscles from Hanwoo steers[J]. Korean Journal for Food Science of Animal Resources, 2017,37(5): 716-725. DOI:10.5851/kosfa.2017.37.5.716.
[9] STARKEY C P, GEESINK G H, ODDY V H, et al. Explaining the variation in lamb Longissimus shear force across and within ageing periods using protein degradation, sarcomere length and collagen characteristics[J]. Meat Science, 2015, 105(6): 32-37. DOI:10.1016/j.meatsci.2015.02.011.
[10] VEISETH-KENT E, PEDERSEN M E, RNNING S B, et al.Can postmortem proteolysis explain tenderness differences in various bovine muscles?[J]. Meat Science, 2017, 137(3): 114-122.DOI:10.1016/j.meatsci.2017.11.011.
[11] KIM Y H, KEETON J T, SMITH S B, et al. Role of lactate dehydrogenase in metmyoglobin reduction and color stability of different bovine muscles[J]. Meat Science, 2009, 83(3): 376-382.DOI:10.1016/j.meatsci.2009.06.009.
[12] KING D A, SHACKELFORD S D, WHEELER T L. Relative contributions of animal and muscle effects to variation in beef lean color stability[J]. Journal of Animal Science, 2011, 89(5): 1434 DOI:10.2527/jas.2010-3595.
[13] 张一敏, 朱立贤, 曹丽, 等. 肉牛宰后初期一磷酸腺苷活化蛋白激酶活性在不同部位肉中的差异表达及与牛肉品质关系[J]. 食品与发酵工业, 2016, 42(6): 73-79. DOI:10.13995/j.cnki.11-1802/ts.201606013.
[14] HOU Xu, LIANG Rongrong, MAO Yanwei, et al. Effect of suspension method and aging time on meat quality of Chinese fattened cattle M. Longissimus dorsi[J]. Meat Science, 2014, 96(1): 640-645.DOI:10.1016/j.meatsci.2013.08.026.
[15] LI Ke, ZHANG Yimin, MAO Yanwei, et al. Effect of very fast chilling and aging time on ultra-structure and meat quality characteristics of Chinese Yellow cattle M. Longissimus lumborum[J]. Meat Science,2012, 92(4): 795-804. DOI:10.1016/j.meatsci.2012.07.003.
[16] LIU Rui, LI Yupin, WANG Mengqin, et al. Effect of protein S-nitrosylation on autolysis and catalytic ability of μ-calpain[J]. Food Chemistry, 2016, 213: 470-477. DOI:10.1016/j.foodchem.2016.06.104.
[17] MUNGURE T E, BEKHIT E D, STEWART I, et al. Effect of rigor temperature, ageing and display time on the meat lipid oxidative stability of hot boned beef Semimembranosus muscle[C]// 9th CIGR Section VI International Technical Symposium, 17 November,Auckland, New Zealand, 2015.
[18] BRAGGINS T J, FROST D A, AGNEW M P, et al. Changes in pH and free amino acids in sheepmeat during extended chilled storage[C]//Congress Proceedings 45th CoMST. Yokohama, Japan, 1999.
[19] FAROUK M M, WIELICZKO K J. Optimum time for using chilled beef in gelled products[J]. Journal of Food Science, 2010, 68(1): 164-167. DOI:10.1111/j.1365-2621.2003.tb14134.x.
[20] BRAGGINS T J, AGNEW M P, FROST D A, et al. The effects of extended chilled storage on the odor and flavor of sheepmeat[J].Advances in Experimental Medicine and Biology, 2004, 542: 51.DOI:10.1007/978-1-4419-9090-7_4.
[21] SUJIWO J, KIM H J, SONG S O, et al. Relationship between quality and freshness traits and torrymeter value of beef loin during cold storage[J]. Meat Science, 2019, 149: 120-125. DOI:10.1016/j.meatsci.2018.11.017
[22] MUCHENJE V, DZAMA K, CHIMONYO M, et al. Some biochemical aspects pertaining to beef eating quality and consumer health: a review[J]. Food Chemistry, 2009, 112(2): 279-289. DOI:10.1016/j.foodchem.2008.05.103.
[23] BHAT Z F, MORTON J D, MASON S L, et al. Role of calpain system in meat tenderness: a review[J]. Food Science and Human Wellness,2018, 7: 196-204. DOI:10.1016/j.fshw.2018.08.002.
[24] SAUDO C, MACIE E S, OLLETA J L, et al. The effects of slaughter weight, breed type and ageing time on beef meat quality using two different texture devices[J]. Meat Science, 2004, 66(4): 925-932.DOI:10.1016/j.meatsci.2003.08.005.
[25] MOHAMMAD, KOOHMARAIE. Biochemical factors regulating the toughening and tenderization processes of meat[J]. Meat Science,1996, 43(1): 193-201. DOI:10.1016/0309-1740(96)00065-4.
[26] LEPETIT J. Collagen contribution to meat toughness: theoretical aspects[J]. Meat Science, 2008, 80(4): 960-967. DOI:10.1016/j.meatsci.2008.06.016.
[27] MELODY J L, LONERGAN S M, ROWE L J, et al. Early postmortem biochemical factors influence tenderness and water-holding capacity of three porcine muscles[J]. Journal of Animal Science, 2004, 82(4):1195-1205. DOI:10.2527/2004.8241195x.
[28] LONERGAN S M, HUFF-LONERGAN E, WIEGAND B R, et al.Postmortem proteolysis and tenderization of top loin steaks from brangus cattle[J]. Journal of Muscle Foods, 2007, 12(2): 121-136.DOI:10.1111/j.1745-4573.2001.tb00304.x.
[29] LAZARIDES E, HUBBARD B D. Immunological characterization of the subunit of the 100 filaments from muscle cells[J]. Proceedings of the National Academy of Sciences, 1977, 73(12): 4344-4348.DOI:10.1073/pnas.73.12.4344.
[30] BALOGH J, LI Z, PAULIN D, et al. Desmin filaments influence myofilament spacing and lateral compliance of slow skeletal muscle fibers[J]. Biophysical Journal, 2005, 88(2): 1156-1165. DOI:10.1529/biophysj.104.042630.
[31] FU Q Q, GE Q F, LIU R, et al. Influence of modified atmosphere packaging on protein oxidation, calpain activation and desmin degradation of beef muscles[J]. Journal of the Science of Food and Agriculture, 2017, 97: 4508-4514. DOI:10.1002/jsfa.8316
[32] HO C Y, STROMER M H, ROBSON R M. Identification of the 30 kDa polypeptide in post mortem skeletal muscle as a degradation product of troponin-T[J]. Biochimie, 1994, 76(5): 369-375.DOI:10.1016/0300-9084(94)90110-4.
[33] OLSON D G, PARRISH F C, DAYTON W R, et al. Effect of postmortem storage and calcium activated factor on the myofibrillar proteins of bovine skeletal muscle[J]. Journal of Food Science, 1977,42(1): 117-124. DOI:10.1111/j.1365-2621.1977.tb01233.x.