我国是淡水鱼养殖大国,鲢鱼(Hypophthalmichthys molitrix)是四大淡水鱼之一,2019年鲢鱼年产量已达到381 万t[1],在水产品加工领域占有重要地位,鲢鱼以原料价格低和产量大的优势近年来受到广泛关注,已成为鱼糜制品的潜在原料[2]。2019年我国鱼糜制品产量已达到139.4 万t[1]。鲢鱼肌原纤维蛋白是鱼肉的重要组成部分,也是鱼肉中最主要的蛋白,在肉类的加工贮存中起到非常重要的作用[3]。抑制或减少鱼糜肌原纤维蛋白在贮藏和加工过程中的变性可以改善鱼糜制品的功能特性,生产高品质产品。
常用物理、化学、酶和基因工程等方法修饰蛋白质。化学法主要包括酰化、磷酸化、脱氨基、糖基化改性等,其中糖基化改性以操作条件温和、加工安全性高及赋予蛋白质新功能等优势受到重视[4]。研究发现,酶解褐藻酸钠寡糖(enzymolysis alginate oligosaccharide,EAO)可提高肌原纤维蛋白在低NaCl浓度溶液中的溶解度[5]和保水性能[6];山梨糖醇、山梨糖醇与海藻糖/蔗糖复合,可抑制肌原纤维蛋白的聚集[7];经葡萄糖糖基化改性后具有高溶解度的肌原纤维蛋白热稳定性显著提高[8];右旋糖酐[9]和葡萄糖[10]可提高肌原纤维蛋白的乳化性。
褐藻酸钠的分子式为(C6H7O6Na)n,相对分子质量为32 000~200 000,其结构单元相对分子质量理论值为198.11[11-13],在pH>12时呈胶体状态,在pH<3时形成不溶性凝胶,由β-D-甘露糖醛酸(M)和α-L-古罗糖醛酸(G)通过1→4糖苷键以3 种方式(MM、GG和GM)连接成直链线性高聚合物[14]。褐藻寡糖具有良好的溶解度、生物利用度和多重生物活性[15],如促进植物生长[16]、保护神经元[17]、抗氧化[18]、免疫调节[19]、抗炎、抗肿瘤[20-21]等。褐藻寡糖是低分子低聚物,通常用酸水解、氧化和生物酶水解的方法降解褐藻酸钠获得。酸水解法可分别使用草酸、盐酸、硫酸或甲酸等降解获得聚甘露糖醛酸(MM)和聚古罗糖醛酸(GG)[22], 进一步降解获得酸解甘露糖醛酸寡糖(acidolyzed mannose oligosaccharide,AMO)、酸解古罗糖醛酸寡糖(acidolyzed guluronic oligosaccharide,AGO),但酸法降解的反应耗时长,一般需4~12 h,反应条件不易控制,能耗高,产物回收率低,且“三废”污染严重,产品外观色泽差[22]。酶解法条件温和、可控性强,生产的EAO特异性高[23]。
冷冻鱼糜是鱼糜制品加工行业主要的流通料[24],淡水鱼糜在冷冻贮藏和加工过程中需要更好地保存品质,褐藻寡糖可作为冷冻海产品原料的抗冻剂。本研究系统考察不同来源褐藻寡糖(酸解法分别获得AMO和AGO,酶解法获得EAO)对冷冻鲢鱼鱼糜的稳定作用及对肌原纤维蛋白分子结构的影响,为进一步研究冷冻、解冻等加工过程和消化过程中蛋白质变化提供参考。
1 材料与方法
1.1 材料与试剂
冷冻鲢鱼糜,2019年6月12日购于洪湖市井力水产食品股份有限公司。
AMO、AGO 实验室自制;EAO 中科荣信生物科技有限公司;溴化钾(光谱纯) 天津市大茂化学试剂厂;氯化钠(分析纯) 辽宁泉瑞试剂有限公司;氢氧化钠(分析纯) 天津市东丽区天大化学试剂厂;乙醇(分析纯) 天津市北联精细化学品开发有限公司;尿素(分析纯) 国药集团化学试剂有限公司;β-巯基乙醇(分析纯) 上海雅吉生物科技有限公司;三羟甲基氨基甲烷(Tris)(分析纯) 青岛捷世康生物科技有限公司;食盐 潍坊千源盐化有限公司。
1.2 仪器与设备
DS-1高速组织捣碎机 上海标本模型厂;HR/T20MM 立式高速冷冻离心机 湖南赫西仪器装备有限公司;SynergyH1/H1M酶标仪 美国伯腾仪器有限公司;Q20差示扫描量热(differential scanning calorimetry,DSC)仪 美国TA仪器公司;F-2700荧光分光光度计 日本Hitachi公司;NEXUS670傅里叶变换红外光谱(Fourier-transform infrared spectroscopy,FTIR)仪 美国PerkinElmer公司;UV-9000双光束紫外-可见分光光度计 上海元析仪器有限公司。
1.3 方法
1.3.1 酸解法制备AMO、AGO
参考赵丹等[25]的方法略作修改,采用酸水解法制备AMO、AGO。取2 g褐藻酸钠,加入100 mL蒸馏水浸泡24 h,加入80 mL 0.3 mol/L盐酸,沸水回流水解10 h,冷却后5 000×g离心15 min,取沉淀溶于60 mL 0.8 g/100 mL Na2CO3溶液,用0.5 mol/L盐酸调节pH值至2.85,5 000×g离心15 min得上清液与沉淀2,在上清液中加入2 倍体积乙醇(体积分数95%),5 000×g离心15 min后得沉淀1,沉淀1和沉淀2分别用体积分数75%乙醇和体积分数95%乙醇反复洗涤,再将2 种沉淀冷冻干燥,分别得到AMO和AGO。
1.3.2 鱼糜-褐藻寡糖复合物的制备
参考杨姣等[26]的方法略作修改。将冷冻鲢鱼鱼糜于4 ℃层析柜中解冻过夜,取20 g鱼糜,加入1.5%食盐,擂溃5 min,添加10 mL 0.5 g/100 mL或1.0 g/100 mL的AMO、AGO、EAO溶液,将鱼糜水分含量调整为76%,以添加10 mL蒸馏水的样品为空白,继续擂溃2 min使水分与鱼糜充分混匀,得到添加不同质量浓度3 种褐藻寡糖的鱼糜-褐藻寡糖复合物。
1.3.3 DSC法测定复合物稳定性
参考黄海[27]的方法。称取13~15 mg鱼糜-褐藻寡糖复合物,放入氧化铝坩埚底部密封,使用标准品对DSC仪进行校准后进行样品测定,以密封的空坩埚为对照。实验采用的测定程序为:初始温度与结束温度设定为15 ℃,先以10 ℃/min降温到-50 ℃并保持10 min,再以5 ℃/min升温到15 ℃保持1 min,以5 ℃/min升温到100 ℃后以50 ℃/min降温到15 ℃。
在升温曲线上,冰点理论上为结晶刚刚熔解完成的温度,但由于试样熔化完后,基线受升温速率和样品量的影响,出现不同程度的滞后现象,因此把相变峰的峰值温度确定为鱼肉的冰点[28]。
水分形态分析[29]:假设鱼糜样品中水分的总焓变与纯水相同,可冻结水(包括自由水和不易流动水)含量可通过样品在0 ℃附近的焓变计算得到,按式(1)计算。
式中:ΔH2为由鱼糜凝胶在0 ℃测得DSC吸热峰面积计算得到的单位质量焓变/(J/g);ΔH0为纯水的单位质量焓变(334 J/g)。
非冻结水含量按式(2)计算。
在40~80 ℃分析复合物的热稳定性[30]。使用TA Universal Analysis软件进行数据记录并分析各处理组样品DSC图谱各峰的峰值温度(Tp)和总变性焓(ΔH3)。
1.3.4 分子间作用力测定
根据Li Fengtang等[31]方法稍作修改。取2 g鱼糜-褐藻寡糖复合物,分别与10 mL 0.05 mol/L NaCl(SA)、0.6 mol/L NaCl(SB)、0.6 mol/L NaCl+1.5 mol/L尿素(SC)、0.6 mol/L NaCl+8 mol/L尿素(SD)、0.6 mol/L NaCl+8 mol/L尿素+1.5 mol/L β-巯基乙醇(SE)混合,4 000 r/min均质3~5 min后,于4 ℃静置1 h,8 000 r/min离心10 min,使用考马斯亮蓝法测定上清液中蛋白质含量。离子键、氢键、疏水相互作用力、二硫键含量分别按式(3)~(6)计算,每个样品重复测定3 次。
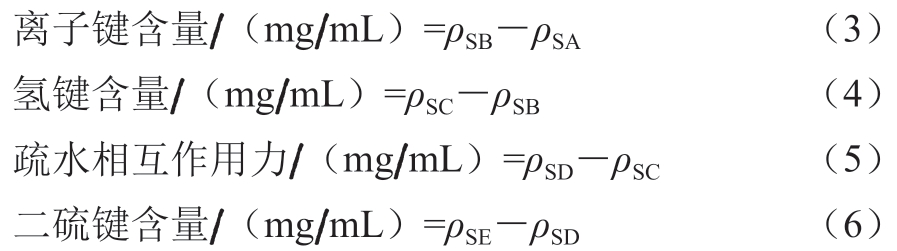
式中:ρSA为溶解于SA溶液中的蛋白质质量 浓度/(mg/mL);ρSB为溶解于SB溶液中的蛋白质质量浓度/(mg/mL);ρSC为溶解于SC溶液中的蛋白质质量 浓度/(mg/mL);ρSD为溶解于SD溶液中的蛋白质质量浓度/(mg/mL);ρSE为溶解于SE溶液中的蛋白质质量 浓度/(mg/mL)。
1.3.5 肌原纤维蛋白的提取
参考仪淑敏等[32]的方法。分别取上述鱼糜-褐藻寡糖复合物5 g,加入25 mL 10 mmol/L、pH 7.2 Tris-HCl缓冲液,4 000 r/min均质2 min后,于4 ℃、5 000 r/min离心15 min,取沉淀加入20 mL 10 mmol/L Tris-HCl缓冲液(含0.6 mol/L NaCl,pH 7.2),于4 000 r/min均质30 s,4 ℃、4 500 r/min离心20 min后取上清,上清液即为肌原纤维蛋白溶液,用双缩脲试剂测定上清液中肌原纤维蛋白含量。用10 mmol/L Tris-HCl缓冲液(含0.6 mol/L NaCl,pH 7.2)将肌原纤维蛋白配制成质量浓度 1.0 mg/mL的溶液。
1.3.6 FTIR测定肌原纤维蛋白中蛋白质二级结构含量
根据Xu Yujuan等[33]方法稍作修改。将提取的各肌原纤维蛋白溶液进行冷冻干燥,取2 mg冷冻干燥后的肌原纤维蛋白粉末,与100 mg干燥的无水溴化钾充分混合,在约18 N的压力下加压2 min,制成溴化钾压片。用FTIR仪对其进行测定和分析,分辨率4 cm-1,光谱扫描范围400~4 000 cm-1。Peak Fit软件用于酰胺Ⅰ谱带的原始光谱曲线拟合。1 600~1 639 cm-1被认为是β-折叠结构波段,1 640~1 650 cm-1被认为是无规则卷曲结构波段,1 651~1 660 cm-1被认为是α-螺旋结构波段,1 661~1 700 cm-1被认为是β-转角结构波段[34]。利用Peak Fit软件,根据积分面积占比计算各二级结构的相对含量。
1.3.7 肌原纤维蛋白内源荧光光谱测定
取各组肌原纤维蛋白溶液,采用荧光分光光度计进行荧光光谱扫描,激发波长为280 nm,扫描范围300~450 nm,测定荧光强度[35]。猝灭常数(Ksv)用Stern-Volmer方程计算[36],如式(7)所示。
式中:F0和F分别为空白组与添加褐藻寡糖组的荧光强度最大值;[Q]为褐藻寡糖质量浓度/(mg/mL)。
1.3.8 肌原纤维蛋白紫外吸收光谱测定
取各组肌原纤维蛋白溶液,以10 mmol/L Tris-HCl缓冲液(含0.6 mol/L NaCl,pH 7.2)作为对照。将样品置于石英比色皿中,用紫外-可见分光光度计在波长230~350 nm获得紫外吸收光谱。使用OriginPro 2017软件从紫外吸收光谱获得二阶导数光谱[37]。
1.4 数据处理
采用SPSS软件对实验中所得数据进行显著性分析(P<0.05),使用OriginPro 2017软件制表、绘图。
2 结果与分析
2.1 复合物DSC测定结果及分析
DSC技术可以定量测定样品的物理转变及化学反应,水分状态的改变对食品的贮藏性、加工性和商品的利用价值都有极大影响。DSC技术可用来测定蛋白的结晶点、冰点等[38]。
由图1可知,DSC曲线显示了明显的熔融温度(Tp1),其中放热峰为水分结晶峰。解冻鲢鱼鱼糜经褐藻寡糖修饰后其熔融温度改变,表明加热过程中晶态结构被破坏[39]。
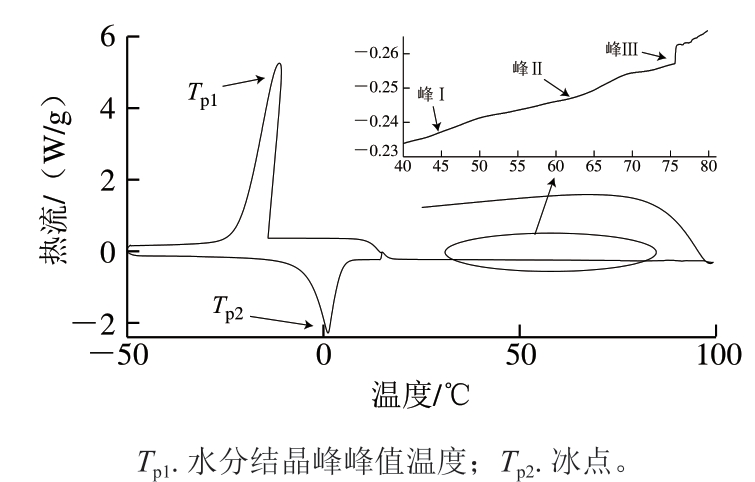
图1 空白鱼糜样品DSC图谱
Fig. 1 DSC profiles of blank surimi sample
由表1可知:除了1.0 g/100 mL AGO组,褐藻寡糖导致解冻鲢鱼鱼糜的水分结晶峰Tp1升高,且低质量浓度组更高;AMO组、EAO组水分结晶峰ΔH1升高,且高质量浓度组升高幅度较大,而AGO组ΔH1降低,且AGO高质量浓度组降低幅度较大,水分结晶峰的出现可能是由于本研究设置的程序中水分结晶峰值在-50~15 ℃升温速率较大。
寡糖修饰后加快水分的相变,导致鱼糜水分分布的改变,由于寡糖的亲水性使复合物的亲水性增强,从而提高了样品的可冻结水含量[40]。高质量浓度褐藻寡糖对鱼糜水分分布(可冻结水含量和非冻结水含量比例)的影响较大。1.0 g/100 mL AMO、1.0 g/100 mL AGO提高了冰点峰Tp2,而0.5 g/100 mL AMO、AGO、EAO则降低了冰点峰Tp2。1.0 g/100 mL AMO、AGO、EAO组ΔH2升高,可冻结水含量升高,而0.5 g/100 mL AMO、AGO组ΔH2降低,可冻结水含量降低,这是因为在空间允许的情况下,水分子有形成更多氢键的趋势,以形成类似“笼形”的聚集体结构,水分子与寡糖之间也会形成部分氢键,以利于上述结构的形成,使更多水分子禁锢在寡糖-蛋白复合网络结构中,可冻结水的流动性减弱,导致冰点降低,吸热峰的峰值向低温区移动[41]。高质量浓度褐藻寡糖组冰点峰值温度升高,可能与EAO由M、G 2 种单体聚合而成有关,其较MM、GG聚合体较复杂。总的来说,AMO与AGO在抗冻性方面性能更优越,且低质量浓度(0.5 g/100 mL)褐藻寡糖更容易降低冰点、可冻结水含量更低,能更好地抵抗低温,便于贮藏[42]。
DSC可以表征肌原纤维蛋白的结构变化,进而推断热稳定性[43]。图1中40~80 ℃有3 个峰,其中峰Ⅰ代表肌球蛋白头部引起的热流变化,峰Ⅱ代表肌球蛋白尾部和肌浆蛋白引起的热流变化,峰Ⅲ代表肌动蛋白引起的热流变化,各峰的峰值温度(表1中TpⅠ、TpⅡ、TpⅢ)为蛋白变性温度,该温度越高,蛋白质稳定性越高,峰Ⅰ、峰Ⅱ、峰Ⅲ峰面积的积分和为总变性焓(ΔH3)[44]。由表1可知,褐藻寡糖修饰后TpⅠ均升高,其中1.0 g/100 mL EAO、0.5 g/100 mL AMO、0.5 g/100 mL AGO组升高程度较大,表明褐藻寡糖修饰后,鱼糜肌原纤维蛋白的热稳定性增强[45]。寡糖能够通过非共价相互作用和物理缠结改变鱼糜肌原纤维蛋白的构象,使分子结构中的羟基与肌原纤维蛋白分子中的一些基团发生反应,同时也能增强肌原纤维蛋白的疏水相互作用[46],影响多肽链空间结构的重排[47],从而避免蛋白质变性。除1.0 g/100 mL AMO与0.5 g/100 mL EAO组Tp Ⅱ升高,其他组Tp Ⅱ均降低;除0.5 g/100 mL AMO组Tp Ⅲ降低,其他组Tp Ⅲ均升高,且经高质量浓度褐藻寡糖修饰后更高。AMO、AGO组ΔH3均升高,且高质量浓度AMO组升高程度更大。总的来说,AMO、AGO组热稳定性都有所改善[47],且经高质量浓度褐藻寡糖修饰后样品的热稳定性较强。
表1 褐藻寡糖对鱼糜相转变温度、焓变、水分含量、变性温度的影响
Table 1 Influence of alginate oligosaccharides on phase transition temperature, enthalpy, moisture content and denaturation temperature of surimi
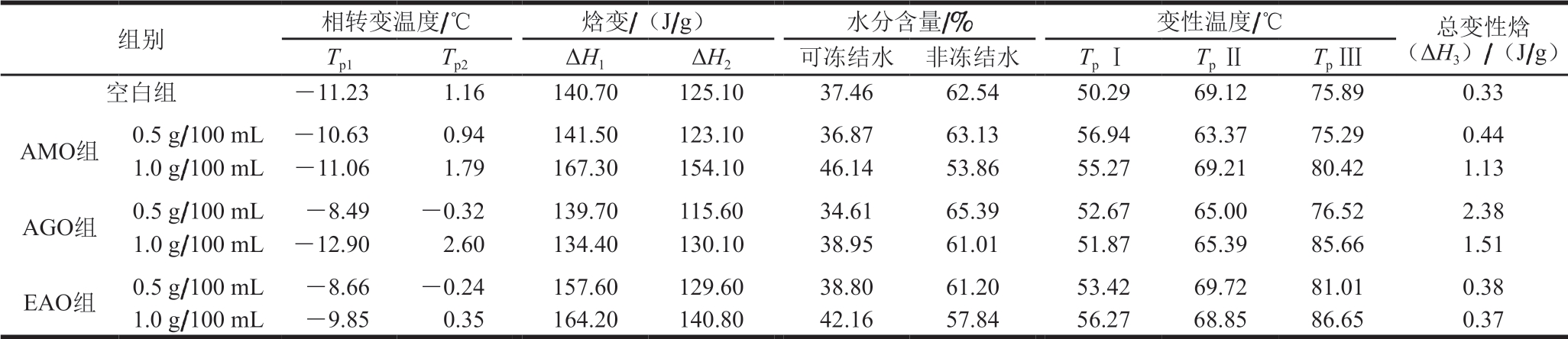
组别 相转变温度/℃ 焓变/(J/g) 水分含量/% 变性温度/℃ 总变性焓(ΔH3)/(J/g)Tp1 Tp2 ΔH1 ΔH2 可冻结水 非冻结水 Tp Ⅰ Tp Ⅱ Tp Ⅲ空白组 -11.23 1.16 140.70 125.10 37.46 62.54 50.29 69.12 75.89 0.33 AMO组 0.5 g/100 mL -10.63 0.94 141.50 123.10 36.87 63.13 56.94 63.37 75.29 0.44 1.0 g/100 mL -11.06 1.79 167.30 154.10 46.14 53.86 55.27 69.21 80.42 1.13 AGO组 0.5 g/100 mL -8.49 -0.32 139.70 115.60 34.61 65.39 52.67 65.00 76.52 2.38 1.0 g/100 mL -12.90 2.60 134.40 130.10 38.95 61.01 51.87 65.39 85.66 1.51 EAO组 0.5 g/100 mL -8.66 -0.24 157.60 129.60 38.80 61.20 53.42 69.72 81.01 0.38 1.0 g/100 mL -9.85 0.35 164.20 140.80 42.16 57.84 56.27 68.85 86.65 0.37
2.2 复合物分子间作用力测定结果及分析
鱼糜凝胶系统中的网络结构主要是通过蛋白质分子间与分子内的相互作用来维持,如离子键、氢键、疏水相互作用和二硫键[48]。离子键和氢键是相对于疏水相互作用和二硫键较弱的键合力[49]。
由表2可知,鲢鱼鱼糜中存在大量离子键和氢键,与空白组相比较,1 g/100 mL AMO和1 g/100 mL EAO组离子键含量显著降低(P<0.05),而1 g/100 mL AGO组离子键含量显著升高(P<0.05),经低质量浓度组褐藻寡糖修饰后,离子键含量均升高,离子键可以维持肌原纤维蛋白三级结构,离子键被破坏意味着蛋白发生了聚集。与空白组相比较,除1 g/100 mL EAO组外,其他组氢键含量均降低,这种现象可能是由于寡糖在蛋白展开时与蛋白质竞争与水结合。EAO组疏水相互作用力下降,而0.5 g/100 mL AMO组疏水相互作用力显著增加(P<0.05),且AGO组疏水相互作用力均上升,表明褐藻寡糖修饰对维持肌原纤维蛋白构象的稳定起着重要作用[50]。褐藻寡糖修饰后,高质量浓度褐藻寡糖组鱼糜二硫键含量均上升,其中1 g/100 mL AMO组二硫键含量较高,巯基氧化,形成二硫键,导致蛋白质交联增加,从而改善鱼糜凝胶的性质[24]。
表2 褐藻寡糖对鱼糜分子间作用力的影响
Table 2 Effect of alginate oligosaccharides on intermolecular forces in surimi mg/mL
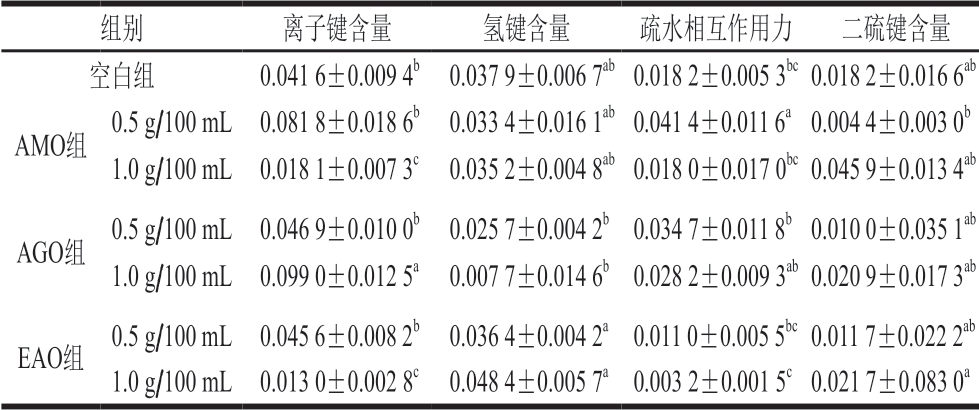
注:同列小写字母不同,表示差异显著(P<0.05)。
组别 离子键含量 氢键含量 疏水相互作用力 二硫键含量空白组 0.041 6±0.009 4b 0.037 9±0.006 7ab0.018 2±0.005 3bc0.018 2±0.016 6ab AMO组 0.5 g/100 mL 0.081 8±0.018 6b 0.033 4±0.016 1ab0.041 4±0.011 6a0.004 4±0.003 0b 1.0 g/100 mL 0.018 1±0.007 3c 0.035 2±0.004 8ab0.018 0±0.017 0bc0.045 9±0.013 4ab AGO组 0.5 g/100 mL 0.046 9±0.010 0b 0.025 7±0.004 2b0.034 7±0.011 8b0.010 0±0.035 1ab 1.0 g/100 mL 0.099 0±0.012 5a 0.007 7±0.014 6b0.028 2±0.009 3ab0.020 9±0.017 3ab EAO组 0.5 g/100 mL 0.045 6±0.008 2b 0.036 4±0.004 2a0.011 0±0.005 5bc0.011 7±0.022 2ab 1.0 g/100 mL 0.013 0±0.002 8c 0.048 4±0.005 7a0.003 2±0.001 5c0.021 7±0.083 0a
2.3 鱼糜肌原纤维蛋白FTIR测定结果及分析
由图2可知,鱼糜肌原纤维蛋白在FTIR图谱上有多个吸收波段,其中1 629 cm-1处的特征吸收峰为酰胺Ⅰ带C=O的伸缩振动;1 555 cm-1处的特征吸收峰为酰胺Ⅱ带C-N的伸缩与N-H的弯曲振动[51];1 180~953 cm-1有一系列重叠峰,为C-O和C-C伸缩振动和C-H的弯曲模式。褐藻寡糖修饰后,肌原纤维蛋白酰胺Ⅱ带的特征吸收峰波数略有降低,可能是褐藻寡糖与蛋白发生静电相互作用的原因[34];1 180~953 cm-1区域的透光率变大,可能是肌原纤维蛋白与寡糖之间形成了共价键,导致体系中羟基和碳氧键增多,使得该波段吸收增强[10]。加入褐藻寡糖后,3 192 cm-1处的吸收增强,这种变化可能是由N-H的减少引起的,这也证明了褐藻寡糖与肌原纤维蛋白之间可能通过共价键结合[34]。
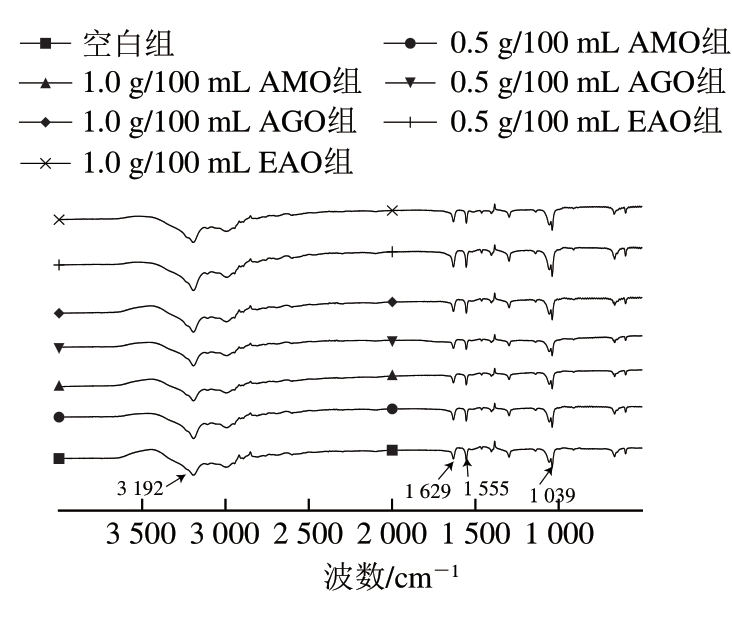
图2 鱼糜肌原纤维蛋白FTIR谱图
Fig. 2 FTIR spectra of myofibrillar protein in surimi
酰胺Ⅰ带是被公认的二级结构特征吸收峰,蛋白质的二级结构主要通过非共价作用力维持,当环境发生变化时,蛋白质分子将重新排列,以达到最低能量,维持相对稳定的状态[47]。
由表3可知,鱼糜肌原纤维蛋白二级结构中相对含量较高的主要是β-折叠,其次是无规则卷曲、β-转角及α-螺旋。褐藻寡糖修饰后,α-螺旋相对含量均降低,高质量浓度褐藻寡糖修饰后α-螺旋相对含量低于低质量浓度组,α-螺旋相对含量降低表明褐藻寡糖通过与蛋白质分子相互作用抑制水溶性蛋白质和疏水残留物的暴露[52]。褐藻寡糖修饰后,β-转角相对含量均降低,其中高、低质量浓度EAO组β-转角相对含量降低差距不大。除AGO组外,其他组β-折叠相对含量都有所升高,高、低质量浓度EAO组β-折叠相对含量增加较均衡。无规则卷曲结构相对含量均升高,尤其是AGO组,且AGO组与EAO低质量浓度组升高幅度较大,无规则卷曲相对含量的升高表明褐藻寡糖修饰使蛋白结构更加无序。可能是褐藻寡糖的修饰使β-转角、α-螺旋向无规则卷曲转变,肌原纤维蛋白具有更随机的结构[53]。
表3 褐藻寡糖对鱼糜肌原纤维蛋白二级结构相对含量的影响
Table 3 Effect of alginate oligosaccharides on secondary structure relative contents of myofibrillar proteins in surimi %
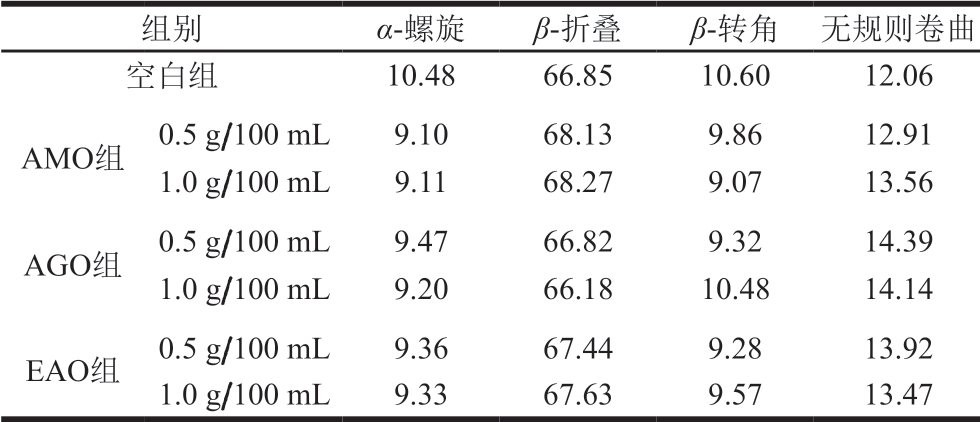
组别 α-螺旋 β-折叠 β-转角 无规则卷曲空白组 10.48 66.85 10.60 12.06 AMO组 0.5 g/100 mL 9.10 68.13 9.86 12.91 1.0 g/100 mL 9.11 68.27 9.07 13.56 AGO组 0.5 g/100 mL 9.47 66.82 9.32 14.39 1.0 g/100 mL 9.20 66.18 10.48 14.14 EAO组 0.5 g/100 mL 9.36 67.44 9.28 13.92 1.0 g/100 mL 9.33 67.63 9.57 13.47
2.4 鱼糜肌原纤维蛋白内源荧光光谱测定结果及分析
蛋白质内源性色氨酸(Trp)荧光对于其周边微环境的极性非常敏感,因此常用于监测蛋白质三级结构的变化[54]。由图3可知,空白组荧光最大发射波长为331 nm,褐藻寡糖修饰后,鱼糜肌原纤维蛋白的最大发射波长并没有变化,但是荧光强度均有所增强,酸解样品高质量浓度条件下荧光强度较高,酶解样品低质量浓度条件下荧光强度较高。可能是由于褐藻寡糖修饰后,与蛋白之间发生聚合反应,蛋白反应性荧光强度升高[53],酸解AMO与AGO可能更容易与蛋白反应,且高质量浓度褐藻寡糖为蛋白提供了更多的结合位点[53]。一般来说,生色团与猝灭剂相互作用会降低荧光量子产率。本研究结果与其相悖,可能归因于褐藻寡糖与肌原纤维蛋白发生静电相互作用,增加了疏水性Trp发色团微环境的极性,使Trp残基更多地埋藏在肌原纤维蛋白分子中,从而导致与猝灭剂的相互作用程度较低[55]。
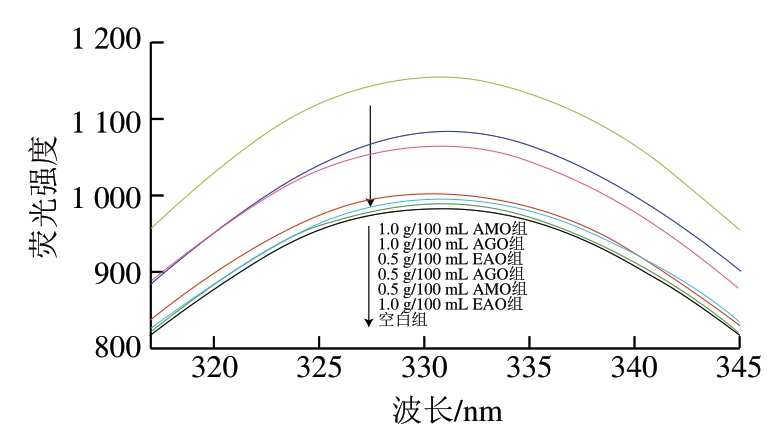
图3 鱼糜肌原纤维蛋白内源荧光光谱
Fig. 3 Endogenous fluorescence spectra of myofibrillar proteins in surimi
由表4可知,所有褐藻寡糖修饰后样品Ksv皆为负值,也说明褐藻寡糖修饰后使肌原纤维蛋白溶液的极性改变。
表4 鱼糜肌原纤维蛋白荧光猝灭常数(Ksv)
Table 4 Fluorescence quenching constant (Ksv) of myofibrillar proteins in surimi
指标 AMO组 AGO组 EAO组0.5 g/100 mL1.0 g/100 mL 0.5 g/100 mL1.0 g/100 mL 0.5 g/100 mL1.0 g/100 mL Ksv -0.002 4 -0.014 9 -0.003 9 -0.009 3 -0.015 2 -0.000 6
2.5 鱼糜肌原纤维蛋白紫外吸收光谱测定结果及分析
色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)的R基团含有苯环共轭双键,分别在280、275、257 nm波长处有吸收峰。肌原纤维蛋白的最大吸收波长在275 nm附近,可能是由于Tyr未包埋在蛋白质内部。
由图4可知,在275、280 nm波长处,各样品的最大吸收峰并未发生移动,表明肌原纤维蛋白中Tyr微环境变化不明显。高质量浓度褐藻寡糖组肌原纤维蛋白紫外吸收峰强度增强,且3 种褐藻寡糖中AMO组增加幅度较大,说明褐藻寡糖与肌原纤维蛋白之间发生分子内或分子间的相互作用[56]。
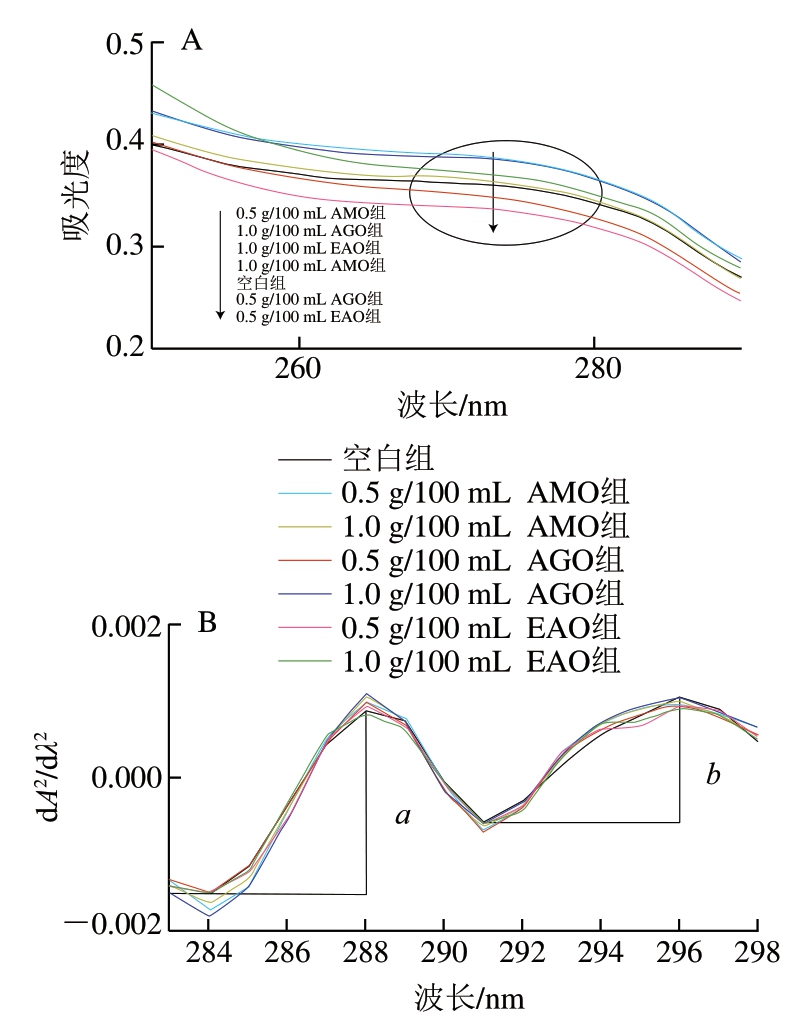
图4 鱼糜肌原纤维蛋白紫外吸收光谱(A)与二阶导数图谱(B)
Fig. 4 UV spectra (A) and second derivative spectra (B) of myofibrillar proteins in surimi
紫外二阶光谱可以进一步研究肌原纤维蛋白构象的细微差异,在288 nm(Trp、Tyr共同作用)和296 nm(Trp作用)波长处有2 个正吸收峰,在284、291 nm波长处有2 个负吸收峰[57],因此需采用紫外二阶导数生成r值(r=a/b,a、b分别为第1次和第2次正吸收峰与负吸收峰的差值),来分析Tyr残基微环境。且褐藻寡糖修饰后,二阶导数光谱峰的位置几乎未发生变化。
Tyr在极性溶剂中的暴露增加会导致r值增加。由表5可知,与空白组相比,褐藻寡糖修饰后r值增大,1.0 g/100 mL AGO组增加幅度较大,3 种褐藻寡糖修饰后r值均升高,可能是由于褐藻寡糖通过大量羟基与Tyr形成氢键,从而使Tyr暴露于分子表面[57],也表明1.0 g/100 mL AGO修饰后的蛋白质聚集程度较高[58]。
表5 鱼糜肌原纤维蛋白二阶导数光谱2 个主峰的r值
Table 5 r value of two main peaks in second derivative spectra of myofibrillar proteins in surimi
指标 空白组 AMO组 AGO组 EAO组0.5 g/100 mL 1.0 g/100 mL 0.5 g/100 mL1.0 g/100 mL 0.5 g/100 mL1.0 g/100 mL r值 1.473 8 1.648 5 1.641 3 1.492 5 1.769 7 1.580 6 1.540 9
3 结 论
褐藻寡糖(0.5、1.0 g/100 mL)的修饰对鲢鱼鱼糜的稳定性有一定的改善,1 g/100 mL组的热稳定性更强,0.5 g/100 mL组鱼糜冷冻稳定性显示出较好的优势。褐藻寡糖的修饰对蛋白质离子键具有保护作用,且1 g/100 mL AGO组最优;褐藻寡糖通过静电相互作用与蛋白结合,且改变了肌原纤维蛋白的二级结构,使β-转角、α-螺旋向无规则卷曲转变,蛋白结构更加无序;褐藻寡糖修饰后,改变了蛋白周围的极性环境,色氨酸被埋藏于分子内,而酪氨酸更容易暴露,使蛋白结构更加聚集。
本研究讨论了不同来源的褐藻寡糖作为抗冻剂或热稳定剂在冷冻鱼糜行业的应用,研究结果有宏观尺度的对鲢鱼鱼糜品质的影响,也有分子尺度的对肌原纤维蛋白结构的修饰,仍需对微观结构进行表征,以进一步明确褐藻寡糖对蛋白质的修饰机制。本研究为系统理解复杂食品组分结构变化提供了依据,为开发新产品和应用提供了参考。
[1] 农业农村部渔业渔政管理局. 2020中国渔业统计年鉴[EB/OL]. (2020-06) [2021-06-15]. https://data.cnki.net/trade/Yearbook/Single/N2021020168?z=Z009.
[2] ABDOLLAHI M, REZAEI M, JAFARPOUR A, et al. Sequential extraction of gel-forming proteins, collagen and collagen hydrolysate from gutted silver carp (Hypophthalmichthys molitrix), a biorefinery approach[J]. Food Chemistry, 2018, 242: 568-578. DOI:10.1016/j.foodchem.2017.09.045.
[3] 于传, 王嵬, 乔翠平, 等. 金线鱼-白鲢鱼混合鱼糜凝胶蛋白质构象和作用力的研究[J]. 食品安全质量检测学报, 2020, 11(22): 60-69.
[4] 荣婧, 仇超颖, 胡晓, 等. 鸢乌贼肌原纤维蛋白糖基化产物功能特性研究[J]. 南方水产科学, 2018, 14(1): 70-78. DOI:10.3969/j.issn.2095-0780.2018.01.009.
[5] SATO R, KATAYAMA S, SAWABE T, et al. Stability and emulsionforming ability of water-soluble fish myofibrillar protein prepared by conjugation with alginate oligosaccharide[J]. Journal of Agricultural and Food Chemistry, 2003, 51(15): 4376-4381. DOI:10.1021/jf021023v.
[6] 黄菊, 丁晨, 谢超, 等. 海藻胶低聚寡糖对秘鲁鱿鱼(Peru squid)鱼糜品质特性的影响研究[J]. 海洋与湖沼, 2015, 46(3): 659-664. DOI:10.11693/hyhz20150300073.
[7] URESTI R M, VELAZQUEZ G, VAZQUEZ M, et al. Effect of sugars and polyols on the functional and mechanical properties of pressure-treated arrowtooth flounder (Atheresthes stomias) proteins[J]. Food Hydrocolloids, 2005, 19(6): 964-973. DOI:10.1016/j.foodhyd.2004.12.006.
[8] LI Shibo, HE Zhifei, LI Mingqi, et al. A study of the physicochemical properties of rabbit glycated myofibrillary protein with high solubility in low ionic strength medium[J]. International Journal of Biological Macromolecules, 2020, 147: 241-249. DOI:10.1016/j.ijbiomac.2020.01.069.
[9] FUJIWARA K, OOSAWA T, SAEKI H. Improved thermal stability and emulsifying properties of carp myofibrillar proteins by conjugation with dextran[J]. Journal of Agricultural and Food Chemistry, 1998, 46(4): 1257-1261. DOI:10.1021/jf9708148.
[10] 杨宇鸿, 董士远, 靳卫亚, 等. 草鱼肌原纤维蛋白-葡萄糖糖基化产物的理化特性及乳化特性研究[J]. 食品工业科技, 2018, 39(18): 77-82; 142. DOI:10.13386/j.issn1002-0306.2018.18.015.
[11] MAHMOOD S J, SIDDIQUE A. Ionic studies of sodium alginate isolated from Sargassum terrarium (brown algea) karachi coast with 2,1-electrolyte[J]. Journal of Saudi Chemical Society, 2010, 14(1): 117-123. DOI:10.1016/j.jscs.2009.12.018.
[12] BEMILLER J N. Carbohydrate chemistry for food scientists[M]. 3th. Woodhead Publishing and AACC International Press, 2019: 293-301. DOI:10.1016/B978-0-12-812069-9.00014-5.
[13] OSOJNIK G, NATASHA P U. Biopolymer nanostructures for food encapsulation purposes[M]. Salt Lake City: Academic Press, 2019: 1; 335-338. DOI:10.1016/B978-0-12-815663-6.00013-6.
[14] 周绪霞, 徐鋆, 丁玉庭. 酶解制备褐藻胶寡糖及其产物的抗氧化活性分析[J]. 食品与发酵工业, 2014, 8(2): 116-120. DOI:10.13995/j.cnki.11-1802/ts.2014.02.008.
[15] 王雪妹, 王晶, 张全斌. 褐藻多糖硫酸酯对脂多糖诱导大鼠肾小球系膜细胞NO产生量的影响[J]. 海洋科学, 2014, 38(10): 1-5. DOI:10.11759/hykx20131218002.
[16] LUAN L, NAGASAWA N, HA V, et al. Enhancement of plant growth stimulation activity of irradiated alginate by fractionation[J]. Radiation Physics and Chemistry, 2009, 78(9): 796-799. DOI:10.1016/j.radphyschem.2009.05.001.
[17] 董晓莉, 耿美玉, 管华诗, 等. 褐藻酸性寡糖对帕金森病大鼠纹状体、杏仁核多巴胺释放的影响[J]. 中国海洋药物, 2003, 22(5): 9-12.
[18] 吴燕燕, 张婉, 李来好, 等. 海藻中抗氧化、保湿功能活性物质的研究进展[J]. 海洋科学, 2015, 39(9): 138-142. DOI:10.11759hykx20140729002.
[19] IWAMOTO M, KURACHI M, NAKASHIMA T, et al. Structureactivity relationship of alginate oligosaccharides in the induction of cytokine production from RAW264.7 cells[J]. FEBS Letters, 2005, 579(20): 4423-4429. DOI:10.1016/j.febslet.2005.07.007.
[20] IWAMOTO Y, XU X, TAMURA T, et al. Enzymatically depolymerized alginate oligomers that cause cytotoxic cytokine production in human mononuclear cells[J]. Bioscience, Biotechnology, and Biochemistry, 2003, 67(2): 258-263. DOI:10.1271/bbb.67.258.
[21] YANG J H, BANG M A, JANG C H, et al. Alginate oligosaccharide enhances LDL uptake via regulation of LDLR and PCSK 9 expression[J]. Journal of Nutritional Biochemistry, 2015, 26(11): 1393-1400. DOI:10.1016/j.jnutbio.2015.07.009.
[22] 胡博旸, 聂莹, 孙路, 等. 酸降解法制备褐藻寡糖抗氧化性的研究[J]. 食品工业科技, 2016, 37(10): 136-140. DOI:10.13386/j.issn1002-0306.2016.10.018.
[23] LI Shangyong, WANG Zhipeng, WANG Linna, et al. Combined enzymatic hydrolysis and selective fermentation for green production of alginate oligosaccharides from Laminaria japonica[J]. Bioresource Technology, 2019, 281: 84-89. DOI:10.1016/j.biortech.2019.02.056.
[24] MI Hongbo, LI Yi, WANG Cong, et al. The interaction of starch-gums and their eあect on gel properties and protein conformation of silver carp surimi[J]. Food Hydrocolloids, 2020, 112: 106290. DOI:10.1016/j.foodhyd.2020.106290.
[25] 赵丹, 汪秋宽, 张慧怡, 等. 海带粗提物及褐藻酸钠寡糖的保湿与抗氧化作用研究[J]. 水产科学, 2012, 31(6): 358-362. DOI:10.3969/j.issn.1003-1111.2012.06.010.
[26] 杨姣, 安玥琦, 陈雨欣, 等. 鱼糜制品加热过程中过熟味的特征风味成分解析[J]. 现代食品科技, 2020, 36(8): 265-280. DOI:10.13982/j.mfst.1673-9078.2020.8.0169.
[27] 黄海. DSC在食品中的运用[J]. 食品与机械, 2002(2): 6-9. DOI:10.3969/j.issn.1003-5788.2002.02.002.
[28] 杨协力, 朱文学, 刘丽莉. DSC在食品加工与贮藏中的应用及发展趋势[J]. 保鲜与加工, 2008, 8(4): 1-4. DOI:10.3969/j.issn.1009-6221.2008.04.002.
[29] 胡佳慧, 熊光权, 乔宇, 等. 微冻贮藏过程中能量代谢酶活性和蛋白质氧化降解对鲈鱼质构特性的影响[J]. 食品科学, 2018, 39(23): 236-243. DOI:10.7506/spkx1002-6630-201823034.
[30] CHENG Jingrong, ZHU Mingjun, LIU Xueming. Insight into the conformational and functional properties of myofibrillar protein modified by mulberry polyphenols[J]. Food Chemistry, 2020, 308: 125592. DOI:10.1016/j.foodchem.2019.125592.
[31] LI Fengtang, ZHAO Jianxin, HUANG Jie, et al. Improvement of the quality of surimi products with over-drying potato starches[J]. Journal of Food Quality, 2017, 2017: 1-5. DOI:10.1155/2017/1417856.
[32] 仪淑敏, 李睿智, 陈杨, 等. 白鲢鱼肌原纤维蛋白双向电泳分析体系的建立[J]. 食品科学, 2017, 38(1): 41-46. DOI:10.7506/spkx1002-6630-201701007.
[33] XU Yujuan, ZHAO Xue, BIAN Guangliang, et al. Structural and solubility properties of pale, soft and exudative (PSE)-like chicken breast myofibrillar protein: effect of glycosylation[J]. Food Science and Technology, 2018, 95: 209-215. DOI:10.1016/j.lwt.2018.04.051.
[34] XU Yujuan, DONG Ming, TANG Changbo, et al. Glycation-induced structural modification of myofibrillar protein and its relation to emulsifying properties[J]. Food Science and Technology, 2020, 117: 108664. DOI:10.1016/j.lwt.2019.108664.
[35] ESTEVEZ M, KYLLI P, PUOLANNE E, et al. Fluorescence spectroscopy as a novel approach for the assessment of myofibrillar protein oxidation in oil-in-water emulsions[J]. Meat Science, 2008, 80(4): 1290-1296. DOI:10.1016/j.meatsci.2008.06.004.
[36] JIANG Jiang, ZHANG Zhipeng, ZHAO Jing, et al. The effect of non-covalent interaction of chlorogenic acid with whey protein and casein on physicochemical and radical-scavenging activity of in vitro protein digests[J]. Food Chemistry, 2018, 268: 334-341. DOI:10.1016/j.foodchem.2018.06.015.
[37] WANG Guan, LIU Manman, CAO Liwei, et al. Effects of different NaCl concentrations on self-assembly of silver carp myosin[J]. Food Bioscience, 2018, 24: 1-8. DOI:10.1016/j.fbio.2018.05.002.
[38] 艾文婷, 张敏, 黄汝国, 等. 热分析技术在食品热物性研究中的应用[J]. 食品工业科技, 2016, 37(19): 377-380. DOI:10.13386/j.issn1002-0306.2016.19.065.
[39] 于源, 张敏, 邵弘. 差示扫描量热法在大豆蛋白产品品质检测中的应用[J]. 大豆科技, 2008(1): 26-28; 36. DOI:10.3969/j.issn.1674-3547.2008.01.013.
[40] 邵颖, 王小红, 吴文锦, 等. 食盐添加量对预制鲈鱼冷藏保鲜及热加工特性的影响[J]. 农业工程学报, 2016, 32(12): 280-286. DOI:10.11975/j.issn.1002-6819.2016.12.040.
[41] 周绪霞, 姜珊, 顾赛麒, 等. 油茶籽油对鱼糜凝胶特性及凝胶结构的影响[J]. 食品科学, 2017, 38(9): 27-33. DOI:10.7506/spkx1002-6630-201709005.
[42] 杨嘉琪, 宋春丽. 糖基化及酶解对大豆蛋白功能性质的影响[J]. 食品与发酵工业, 2020, 46(1): 125-129. DOI:10.13995/j.cnki.11-1802/ts.022122.
[43] LIANG Feng, LIN Lin, HE Tianhai, et al. Eあect of transglutaminase on gel properties of surimi and precocious Chinese mitten crab (Eriocheir sinensis) meat[J]. Food Hydrocolloids, 2020, 98: 105261. DOI:10.1016/j.foodhyd.2019.105261.
[44] 李侠, 孙圳, 杨方威, 等. 适宜冻结温度保持牛肉蛋白稳定性抑制水分态变[J]. 农业工程学报, 2015, 31(23): 238-245. DOI:10.11975/j.issn.1002-6819.2015.23.032.
[45] 陈雨桐, 梁宏闪, 李斌. 单宁酸对小麦醇溶蛋白结构及功能性质的影响[J]. 食品工业科技, 2020, 41(6): 39-46; 52. DOI:10.13386/j. issn1002-0306.2020.06.007.
[46] 刘宏影, 马莹莹, 李秀霞, 等. 解冻方式对金线鱼肌原纤维蛋白热稳定性和组织结构的影响[J]. 华中农业大学学报, 2019, 38(6): 25-32. DOI:10.13300/j.cnki.hnlkxb.2019.06.004.
[47] 郭金英, 贺亿杰, 韩四海, 等. 魔芋葡甘聚糖对冷冻小麦面团面筋蛋白结构和功能特性的影响[J]. 食品科学, 2019, 40(24): 33-39. DOI:10.7506/spkx1002-6630-20181225-294.
[48] NUNEZ-FLORES R, CANDO D, BORDERÍAS A J, et al. Importance of salt and temperature in myosin polymerization during surimi gelation[J]. Food Chemistry, 2018, 239(15): 1226-1234. DOI:10.1016/j.foodchem.2017.07.028.
[49] ZHANG Jinchuang, LIU Li, JIANG Yuanyong. High-moisture extrusion of peanut protein-/carrageenan/sodium alginate/ wheat starch mixtures: Eあect of diあerent exogenous polysaccharides on the process forming a fibrous structure[J]. Food Hydrocolloids, 2020, 99: 105311. DOI:10.1016/j.foodhyd.2019.105311.
[50] 汪之和, 朱孔辉, 施文正, 等. 鳊鱼鱼糜蛋白质结构与凝胶特性的关系[J]. 水产学报, 2010, 34(5): 814-819. DOI:10.3724/SP.J.1231.2010.06715.
[51] MUYONGA J H, COLE G B, DUODU K G. Fourier transform infrared (FTIR) spectroscopic study of acid soluble collagen and gelatin from skins and bones of young and adult Nile perch (Lates niloticus)[J]. Food Chemistry, 2004, 86(3): 325-332. DOI:10.1016/j.foodchem.2003.09.038.
[52] WALAYAT N, XIONG Zhouyi, XIONG Hanguo, et al. The effectiveness of egg white protein and β-cyclodextrin during frozen storage: functional, rheological and structural changes in the myofibrillar proteins of Culter alburnus[J]. Food Hydrocolloids, 2020, 105: 105842. DOI:10.1016/j.foodhyd.2020.105842.
[53] XU Zhenzhen, HUANG Guoqing, XU Tongcheng, et al. Comparative study on the Maillard reaction of chitosan oligosaccharide and glucose with soybean protein isolate[J]. International Journal of Biological Macromolecules, 2019, 131: 601-607. DOI:10.1016/j.ijbiomac.2019.03.101.
[54] 汪兰, 吴文锦, 乔宇, 等. 冻藏条件下魔芋葡甘聚糖降解产物对肌原纤维蛋白结构的影响[J]. 食品科学, 2015, 36(22): 244-249. DOI:10.7506/spkx1002-6630-201522046.
[55] 周向军, 杨雪纯, 刘海玉, 等. 木糖醇和甘露醇对花生蛋白结构和功能特性的影响[J]. 食品与机械, 2018, 34(7): 17-22. DOI:10.13652/j.issn.1003-5788.2018.07.004.
[56] XU Yujuan, ZHAO Yuqi, WEI Zhixin, et al. Modification of myofibrillar protein via glycation: physicochemical characterization, rheological behavior and solubility property[J]. Food Hydrocolloids, 2020, 105: 105852. DOI:10.1016/j.foodhyd.2020.105852.
[57] 孙亚天, 程志先, 李果, 等. 大豆分离蛋白与壳聚糖相互作用的光谱法研究[J]. 核农学报, 2018, 32(4): 723-731. DOI:10.11869/j.issn.100-8551.2018.04.0723.
[58] PENG Zeyu, ZHU Mingming, ZHANG Juan, et al. Physicochemical and structural changes in myofibrillar proteins from porcine Longissimus dorsi subjected to microwave combined with air convection thawing treatment[J]. Food Chemistry, 2021, 343: 128412. DOI:10.1016/j.foodchem.2020.128412.