我国水域辽阔,水产资源丰富,水产品总产量常年居于世界首位。2020年我国水产品总产量为6 545.02 万t,其中淡水产品总产量为3 234.64 万t,同比增长约1.15%[1]。乌鳢(Channa argus)是我国主要淡水鱼养殖品种,其肉质鲜美、营养价值高。在我国,多有术后患者和孕妇食用乌鳢的习惯,食用乌鳢可生肌活血、促进伤口收敛、加速表面伤口愈合[2]。乌鳢还具有增强记忆力和抗疲劳功效,体弱者食用乌鳢可快速恢复体力[3]。此外,乌鳢体表会分泌一种特殊黏液,不仅可以快速修复损伤表皮,还具有一定的抑菌活性。当前,乌鳢生产加工产品主要是冻鱼片和生鱼肉,在乌鳢加工过程中,鱼皮、鱼骨等加工副产物通常利用价值低,其中富含的生物活性成分未能得到有效的开发与利用。因此,提高加工副产物的利用率和利用价值,也是水产加工行业提高经济利益的途径之一。
胶原蛋白肽产量丰富,广泛应用于食品、化妆品和医药等行业,不仅具有抗氧化、抗皱延衰、增强免疫力、降血压血脂、美白肌肤和保湿锁水等多种功效,且低温条件下具有良好的生物活性。当前,已有关于胶原蛋白与温度关系的研究。如许蓉等[4]研究不同温度对鸡胸软骨Ⅱ型胶原蛋白溶液的影响,研究发现,胶原蛋白的黏度和结构与温度呈现负相关关系,随着温度升高,胶原蛋白黏度减小,螺旋分解增加。Aukkanit等[5]研究不同提取温度对银线鱼胶原蛋白自组装纤维的影响,结果表明,10 ℃条件下提取的胶原蛋白不仅具有较高的自组装率,而且自组装纤维直径更大。Zhu Shichen等[6]研究不同温度条件下(20~37 ℃)草鱼胶原蛋白的微流变学特性发现,升温对胶原纤维网络的形成具有促进作用,且纤维紧密性增强。当前有关温度与乌鳢胶原蛋白肽自组装关系的研究较少。因此,本研究采用乌鳢副产物鱼皮制备胶原蛋白肽,探究不同温度对胶原蛋白肽自组装聚集体的结构稳定性及理化性质的影响,为胶原蛋白肽自组装改性方面的进一步研究提供理论参考。
1 材料与方法
1.1 材料与试剂
乌鳢活鱼(质量约500 g),购于广州华润万家超市。
磷酸二氢钠、磷酸氢二钠(均为分析纯) 福晨化学试剂有限公司;戊二醛、氢氧化钠(均为分析纯)天津市大茂化学试剂厂;乙酸(分析纯) 江苏强盛功能化学股份有限公司;无水乙醇(分析纯) 上海凌峰化学试剂有限公司;正丁醇(分析纯) 天津市富宇精细化工有限公司;胃蛋白酶 上海源叶生物科技有限公司。
1.2 仪器与设备
JascoJ-815圆二色谱仪 日本分光公司;UV-1800紫外分光光度计 日本岛津公司;S-3400N扫描电子显微镜 日本日立公司;WJL-628激光粒度分析仪 上海仪电物理光学仪器公司;ST85B3-1真空冷冻干燥机 美国Milirock公司;DSC200F3差示扫描量热(differential scanning calorimetry,DSC)仪 德国Netzsch公司;AR-1500 EX流变仪 美国TA公司;LRH-250F生化培养箱 上海一恒科学仪器有限公司;VERTEX33傅里叶变换红外光谱仪 德国Bruker公司;TA-XT.Plus物性分析仪 英国Stable Micro Systems公司。
1.3 方法
1.3.1 乌鳢鱼皮胶原蛋白肽的制备
参考文献[7-9]的方法,首先将乌鳢鱼皮洗净切碎,以料液比1∶10(m/V)将鱼皮加入0.1 mol/L NaOH中,反应24 h去除胶原蛋白中的色素和杂蛋白,鱼皮取出后用超纯水冲洗至中性并沥干;以料液比1∶10添加体积分数10%正丁醇溶液,与鱼皮混合反应24 h进行脱脂处理,取出鱼皮,用超纯水冲洗至中性后沥干;再以0.5 mol/L乙酸作为溶剂,以料液比1∶10添加至沥干后的鱼皮中,提取胶原蛋白48 h,随后将溶液10 000 r/min、4 ℃离心20 min获得上清液;向上清液中加入NaCl盐析至出现沉淀,4 ℃、8 000 r/min离心10 min后取沉淀,以料液比1∶10用0.5 mol/L乙酸复溶,随后采用去离子水(1∶50,V/V)透析24 h,将透析液冻干,获得胶原蛋白。
将胶原蛋白复溶于0.1 mol/L乙酸后采用胃蛋白酶(酶比活力1∶3 000),10 ℃酶解2 h,获得胶原蛋白肽溶液。
1.3.2 圆二光谱测定
将1.3.1节酶解所得质量浓度0.5 mg/mL胶原蛋白肽溶液在pH 4、不同温度(20、25、30、37、42、52 ℃)条件下自组装10 min后,分别移取300 μL胶原蛋白肽溶液于光程为1 mm的比色皿中,在波长190~260 nm、持续通入氮气的条件下进行圆二光谱扫描,实验重复2 次[10]。
1.3.3 浊度测定
参考贾俊强[11]、Leo[12]等方法并略作修改,使用紫外分光光度计测定不同温度(4、20、25、28、30、37、42、52 ℃)条件下,pH 7、1 mg/mL胶原蛋白肽自组装过程中吸光度。波长设为313 nm,将样品放置于恒温环境中,每隔1 min采集吸光度数据。
1.3.4 扫描电子显微镜观察
采用扫描电子显微镜观察不同温度(20、25、30、37、42、52 ℃)条件下,pH 7、质量浓度10 mg/mL、自组装10 min胶原蛋白肽凝胶的形貌与微观结构。上机样品参照Chen等[13]方法进行制备。
1.3.5 凝胶强度测定
参考宋晓敏等[14]的方法并略作修改,采用物性分析仪对不同温度条件下,pH 7、质量浓度10 mg/mL、自组装10 min胶原蛋白肽凝胶的凝胶强度进行测定,选用P/0.5圆柱探头做穿刺实验,参数设定为:触发力5 g,测试前、测试中和测试后速率均为1.0 mm/s,应变50%。
1.3.6 粒径测定
取等量的不同温度条件下胶原蛋白肽溶液自组装10 min后样品,置于超纯水中配制成质量浓度2 g/100 mL分散溶液,采用激光粒度分析仪测定胶原蛋白肽自组装颗粒粒径分布。
1.3.7 黏度测定
采用流变仪测定不同温度条件下处理胶原蛋白肽凝胶的黏度(剪切应力)曲线。将3 mL pH 7、10 mg/mL胶原蛋白肽溶液置于测试平台上,测定条件设置为平板直径40 mm,测试前温度20、25、30、37、42、52 ℃,测试前平衡时间(自组装时间)5 min,平衡后将温度设为常温25 ℃,在剪切速率为0.01~0.1 s-1变化范围内测定黏度变化[15]。
1.3.8 傅里叶变换红外光谱测定
将不同温度条件下自组装胶原蛋白肽样品冻干后分别与KBr混合,样品(1~2 mg)与KBr质量比1∶100,在4 000~400 cm-1范围内测定样品傅里叶变换红外光谱[10]。
1.3.9 热变性温度测定
参考Jolanta等[16]方法,将乌鳢鱼皮胶原蛋白肽溶液在不同pH值(pH 4、6、7、8、9、10)、温度30 ℃条件下自组装1 h处理样品冷冻干燥后,以空的铝制坩埚作为对照。DSC测定方法:准确称取10 mg胶原蛋白肽冻干样品,用20 μL超纯水充分溶胀24 h(4 ℃),温度扫描范围为20~60 ℃,升温速率2 ℃/min,样品室氮气流速20 mL/min。
1.4 数据处理
采用SPSS v26.0软件进行数据处理和结果分析,结果表示为平均值±标准差;红外光谱图使用PeakFit 4.12软件进行数据处理;圆二色谱数据采用Prodata软件处理;所有数据图均采用Origin 9.0软件绘制。
2 结果与分析
2.1 温度对乌鳢鱼皮胶原蛋白肽圆二色谱的影响
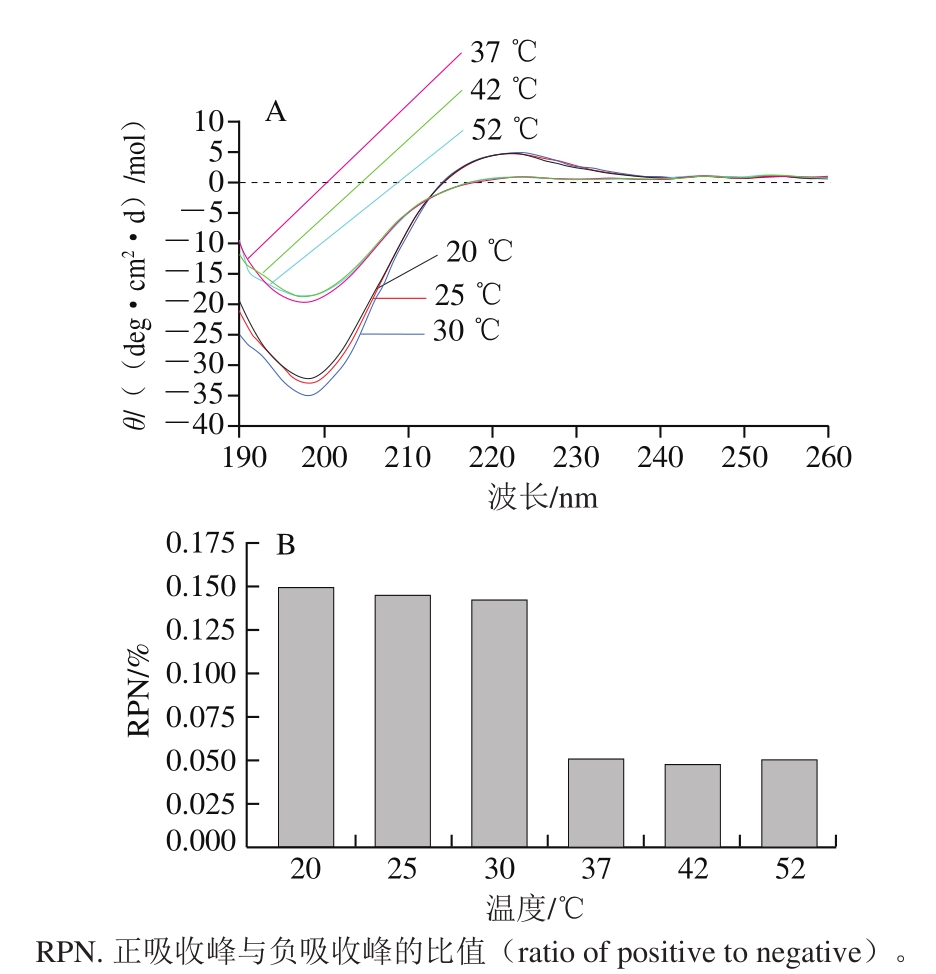
图 1 不同温度下乌鳢鱼皮胶原蛋白肽的圆二色谱(A)和正峰椭圆率值(B)
Fig. 1 Circular dichroism spectra (A) and positive peak ellipticity (B)of collagen peptide from snakehead fish skin at different temperature
圆二色谱通过测定生物大分子物质的手性结构产生的左右旋光差异吸收来分析生物分子结构,可用于分析胶原蛋白肽链三螺旋结构[17]。由图1可知,胶原蛋白肽存在2 个极为明显的吸收峰,其中195~205 nm有一个负吸收峰,215~225 nm存在一个正吸收峰,这是胶原蛋白肽三螺旋结构在圆二光谱图中的吸收性质[18]。其中,RPN与胶原蛋白的螺旋程度呈现正相关[11],反映了胶原蛋白肽分子中的螺旋区域与非螺旋区域的相对含量[19]。不同温度条件对峰值具有一定的影响,胶原蛋白肽在20、25、30 ℃条件下的圆二色谱图与RPN变化并不明显,说明在此温度下胶原蛋白肽链仍保持良好的三螺旋结构,但随着温度的升高,其负吸收峰逐渐增大,说明在达到变性温度前,升温可促进胶原蛋白肽自组装,在保持原有结构的条件下,自组装有利于胶原蛋白结构的稳定。当温度处于37 ℃时,其负吸收峰峰值明显增加,正吸收峰消失,RPN骤然下降,说明在该温度下,胶原蛋白肽三螺旋结构已经完全打开,此时胶原蛋白肽链为松散的3 条亚基链[20]。原因可能是由于温度达到了胶原蛋白肽的变性温度,胶原蛋白肽三螺旋结构因温度的升高而分解,变得松散,相比于37 ℃圆二光谱吸收曲线,42 ℃及52 ℃处理时变化并不明显,可能是胶原蛋白肽处于某一温度范围,某部分结构受到温度影响较为明显,但其结构的进一步崩解需要更高的温度。这说明高温长时间处理会引起胶原蛋白肽解螺旋,出现三螺旋向单体的转变,最终可能引起乌鳢皮胶原蛋白肽的自组装方式发生变化。
2.2 温度对乌鳢鱼皮胶原蛋白肽自组装速率的影响
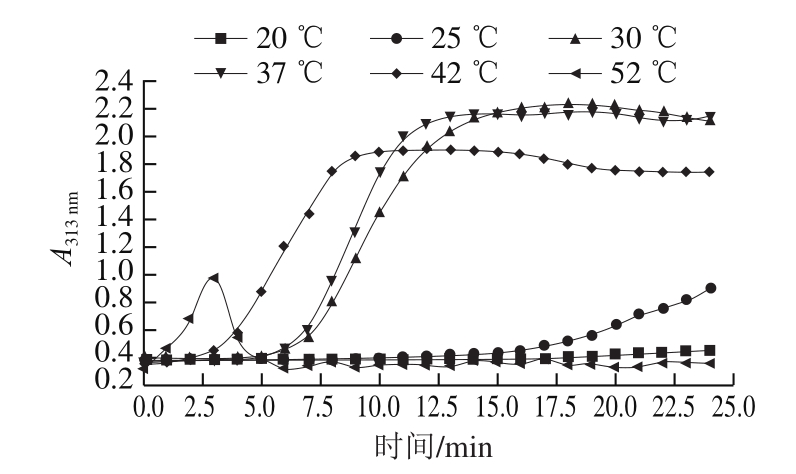
图 2 不同温度下乌鳢鱼皮胶原蛋白肽自组装动力学曲线图
Fig. 2 Self-assembly kinetic curves of collagen peptide from snakehead fish skin at different temperatures
不少研究者[21-22]认为,胶原蛋白肽自组装过程可在波长313 nm条件下进行检测,通过313 nm波长处的吸光度变化来反映不同外界条件下胶原蛋白肽自组装过程所需时间长短。由图2可知,乌鳢鱼皮胶原蛋白肽自组装过程吸光度变化曲线为S型,其自组装过程分为成核期(吸光度增加缓慢)、生长期(吸光度快速增加)和平衡期(吸光度不变)3 个阶段[12,23]。20 ℃条件下胶原蛋白肽成核时间(18.5 min)明显长于其他温度条件下的成核时间,且随着温度的升高(20~52 ℃),自组装所需成核时间逐渐缩短,生长期斜率增大,组装效率增加;这是由于胶原蛋白肽是一种两亲性分子,在氢键作用下分子表面形成水合层,当温度较低时,分子间运动迟缓,水分子无法突破氢键的作用,水合层阻隔了胶原蛋白肽分子间的聚集,从而抑制自组装的进行[24],而升温可提升分子运动能力,增大分子碰撞几率,导致水层破坏,使得更多活性基团暴露,从而促进胶原蛋白肽分子间的自组装[25]。但当温度超过胶原蛋白肽变性温度(32 ℃)时[26],平衡期吸光度出现降低,42 ℃处理的胶原蛋白肽最大吸光度为1.912,明显低于非变性温度下的吸光度,且其吸光度持续下降,而52 ℃处理的胶原蛋白肽最大吸光度为0.977,在超过变性温度条件下仍存在吸光度升高的现象,这可能是在升温(5~52 ℃)过程中,胶原蛋白肽分子发生变性需要一定的时间,故样品仍出现短时间的自组装聚集现象。可见,乌鳢鱼皮胶原蛋白肽拥有较低的变性温度,当超过变性温度时,吸光度虽然仍在增加,但纤维生长的同时带来纤维的崩解,当纤维崩解速率大于纤维生长速率时,吸光度降低。
2.3 温度对乌鳢鱼皮胶原蛋白肽聚集体微观结构的影响
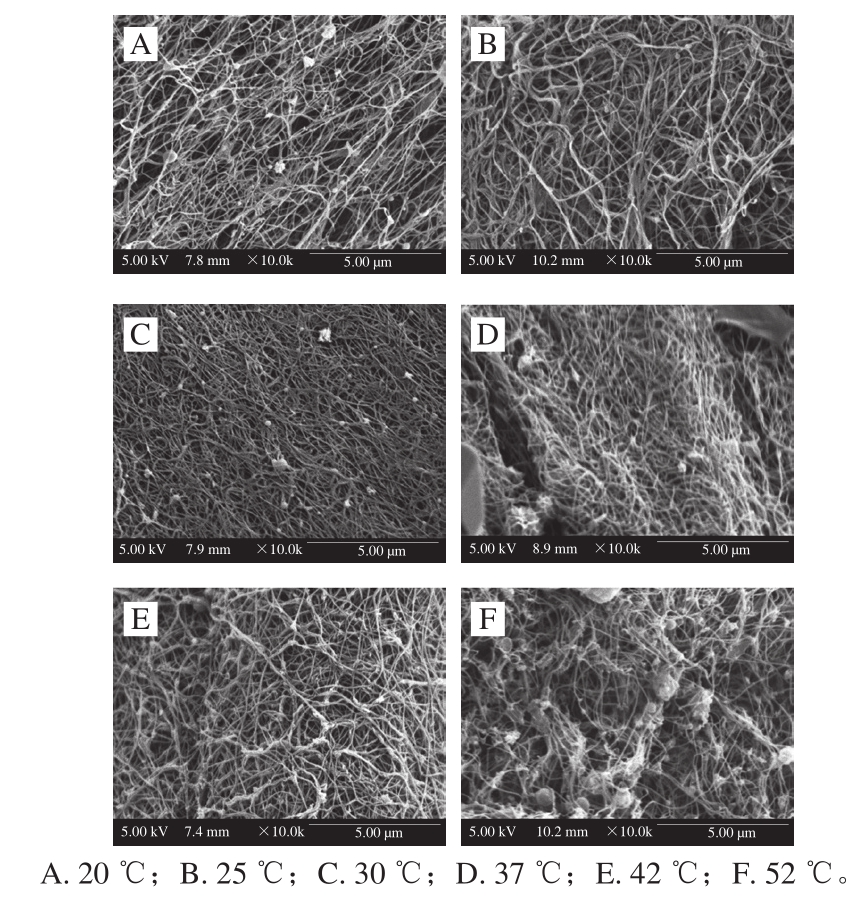
图 3 不同温度下乌鳢鱼皮胶原蛋白肽聚集体微观结构
Fig. 3 Microstructure of collagen peptide aggregates from snakehead fish skin at different temperatures
由图3可知,不同温度条件对乌鳢鱼皮胶原蛋白肽三维网络的结构形貌影响不同。当温度为20 ℃时,胶原蛋白肽自组装缓慢,形成凝胶程度不高,凝胶纤维直径及密度较后期组装的凝胶纤维相对较小,这是由于温度过低,胶原蛋白肽分子运动速率较低,自组装动力不足导致。随着温度的升高(20~30 ℃),胶原蛋白肽三维网络结构得到明显的改善,其表面变得平滑、均匀,孔隙变小,三维网络结构变得更为有序和致密。但随着温度的继续升高(30~37 ℃),有序纤维结构向无序转变,这是由于乌鳢鱼皮胶原蛋白肽到达变性温度所导致,而Liu Wentao等[26]测得乌鳢鱼皮胶原蛋白溶液的变性温度为32 ℃,说明胶原纤维聚集,逐渐靠拢,以抵抗高温带来的蛋白变性。当温度继续升高至42 ℃,纤维结构孔隙增大,表层纤维由于高温发生溶解,纤维直径变细,未溶解纤维靠拢,无序结构增多;当温度达到52 ℃,纤维结构逐步崩溃,大部分纤维溶解及形成絮状结构,该现象与高昕等[27]关于刺参胶原纤维在变性温度条件下出现的现象基本一致,这是由于高温部分破坏了胶原纤维的三螺旋结构,纤维间的共价键遭到破坏,纤维变性收缩发生聚集,胶原蛋白肽凝胶网络被破坏。该结构变化与吸光度变化规律相符,蛋白质纤维的形成有其最适温度,如乳清蛋白纤维形成的最适温度为178 ℃[28],胶原蛋白肽自组装最适温度应为30 ℃,适宜的温度条件下可以增强胶原蛋白肽分子的运动能力,使其突破水合层,有助于纤维间氢键、二硫键等次级结构的进一步形成,提高组装效率的同时,还能提高结构的紧密性,而过低温度会抑制胶原蛋白肽纤维的形成,过高的温度则会导致蛋白质的变性。
2.4 温度对乌鳢鱼皮胶原蛋白肽凝胶强度的影响
凝胶强度是用于表征蛋白质凝胶特性的重要指标,凝胶强度的大小可反映蛋白凝胶网络结构的质量,与蛋白聚集程度及蛋白聚集体大小紧密相关[29]。由于乌鳢胶原蛋白肽自组装形成的凝胶具有一定的弹韧性,可以承受一定的外部压力,可根据凝胶所能承受的极限压力测定其凝胶强度大小[30]。
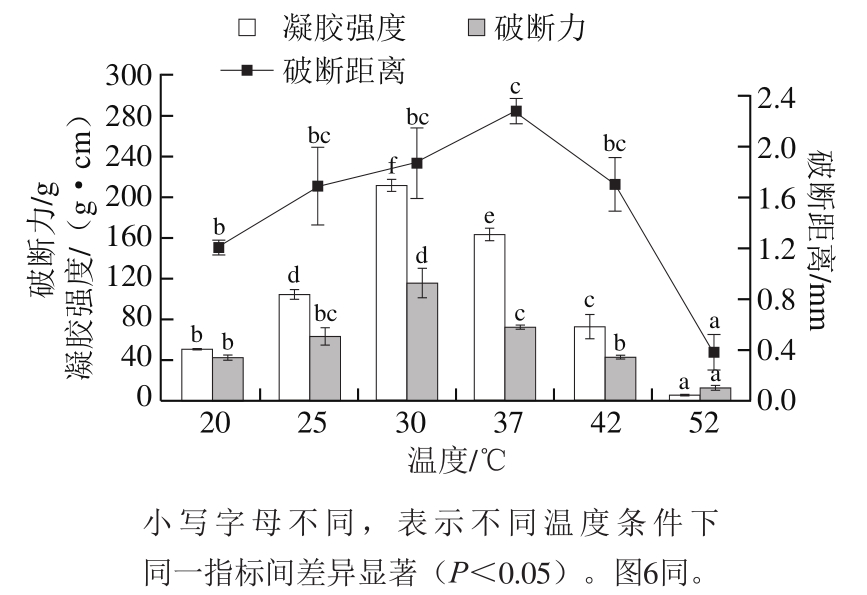
图 4 不同温度下乌鳢鱼皮胶原蛋白肽聚集体的凝胶强度
Fig. 4 Gel strength of collagen peptide aggregates from snakehead fish skin at different temperatures
由图4可知,乌鳢鱼皮胶原蛋白肽凝胶破断力、破断距离及凝胶强度随着温度的持续升高均呈现先升高后降低的趋势,随着温度的升高(20~30 ℃),聚集体凝胶强度从50.23 g/cm2显著升高至212.55 g/cm2(P<0.05),由于温度的升高有助于胶原蛋白肽分子间的运动,增加了胶原蛋白肽分子的碰撞几率,促进了胶原蛋白肽分子间的二硫键、氢键等次级结构的形成,从而促进胶原蛋白肽的自组装,未聚集的胶原蛋白肽分子聚集率增加,凝胶化程度增加。随着温度的继续升高(30~52 ℃),胶原蛋白肽凝胶强度从212.55 g/cm2显著降至4.52 g/cm2(P<0.05),而胶原蛋白肽聚集体的破断力也出现相同的变化趋势,这也说明胶原蛋白肽凝胶网络结构在超过变性温度32 ℃[26]情况下,内部出现了部分坍塌[31-32]。胶原蛋白肽在30 ℃条件下凝胶强度最高,该条件更有助于胶原蛋白肽的自组装。处理温度决定了胶原蛋白肽的变性程度和热聚集体含量,影响参与凝胶网络结构的胶原蛋白肽分子的数量,从而影响胶原蛋白肽聚集体的凝胶强度[33]。
2.5 温度对乌鳢鱼皮胶原蛋白肽黏度的影响
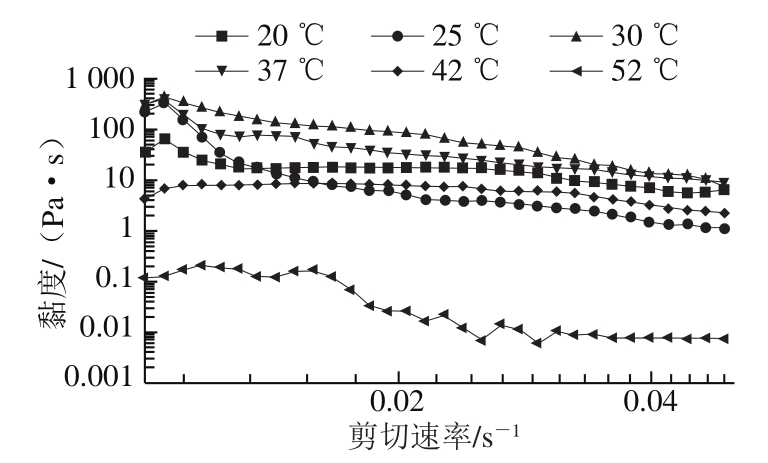
图 5 不同温度下乌鳢鱼皮胶原蛋白肽聚集体的黏度
Fig. 5 Viscosity versus shear rate curves of collagen peptide aggregates from snakehead fish skin at different temperatures
由图5可知,不同温度处理条件下乌鳢鱼皮胶原蛋白肽均呈现出剪切变稀现象,表现为典型非牛顿流体的假塑性流动行为,与前人研究[34-35]结果一致。低剪切速率下,胶原蛋白肽聚集体的剪切黏度均出现了短暂升高,这是由于胶原蛋白肽自组装形成纤维空间网络结构在受力形变前产生的阻力作用,从而导致黏度出现短暂增加[36]。当剪切力达到一定程度时,纤维网络结构逐步溃散,黏度降低,从而表现为剪切稀释。
不同温度下自组装胶原蛋白肽聚集体的黏度存在一定差异。随着温度的升高,聚集体的初始黏度与最大黏度均呈现出先升后降的趋势,导致其黏度增大的原因是温度升高促进分子间运动,分子间碰撞加剧,水化层的破坏使得更多的疏水基团结合,胶原蛋白肽分子相互缠结,形成更为稳定的聚集体[37],而胶原蛋白肽微观纤维网络紧密性和稳定性的改变决定了宏观黏度的变化[38],30 ℃条件下的胶原蛋白肽黏度较大,说明其聚集程度较高,与微观结构及凝胶强度的测定结果相互印证,由于胶原蛋白肽自组装有其最适温度,故在30 ℃左右的条件下,胶原蛋白肽聚集体纤维紧密性最高,在剪切力作用下,其产生的黏度更高。而继续升温黏度降低是由于高温导致胶原蛋白肽变性,从微观结构可以看出,纤维结构发生解聚或溶解,三维网络结构的紧密性降低,使得胶原蛋白肽的剪切阻力下降,最终导致黏度降低。
2.6 温度对乌鳢鱼皮胶原蛋白肽粒径的影响
颗粒的粒径大小反映了胶原蛋白肽的聚集程度。由图6可知,温度对胶原蛋白肽自组装聚合物粒径大小具有一定的影响,随着温度的升高(20~52 ℃),胶原蛋白肽自组装颗粒粒径呈先增加(由112.56 μm增加至184.52 μm)后降低(由184.52 μm降低至99.34 μm)的趋势,在30 ℃时,胶原蛋白肽聚集体的平均粒径达到最大值184.52 μm,说明胶原蛋白肽在该温度条件下形成的聚集体结构最为稳定,该变化趋势与王艳[39]对不同温度草鱼皮胶原蛋白粒径变化的研究相符,但其测得最适温度为35 ℃,这可能是由于胶原蛋白的种类不同导致。在30~52 ℃温度范围内,胶原蛋白肽聚集体的粒径逐渐减小,这是由于胶原蛋白肽变性温度条件下,形成自组装聚集体结构的共价键及非共价键因高温遭到破坏,胶原蛋白肽纤维结构发生解聚,维持胶原蛋白肽三螺旋结构的非共价键也遭到破坏,聚集结构溶解,胶原蛋白肽聚集体粒径随之降低[40-41]。因此,适宜的处理温度有利于形成更为稳定且凝胶强度更好的聚集体。胶原蛋白肽自组装有其较为适宜的温度,过低的温度会影响胶原蛋白肽自组装速率或导致组装停滞,而过高温度可使胶原蛋白肽变性,从而导致胶原蛋白肽聚集程度降低,颗粒粒径下降。
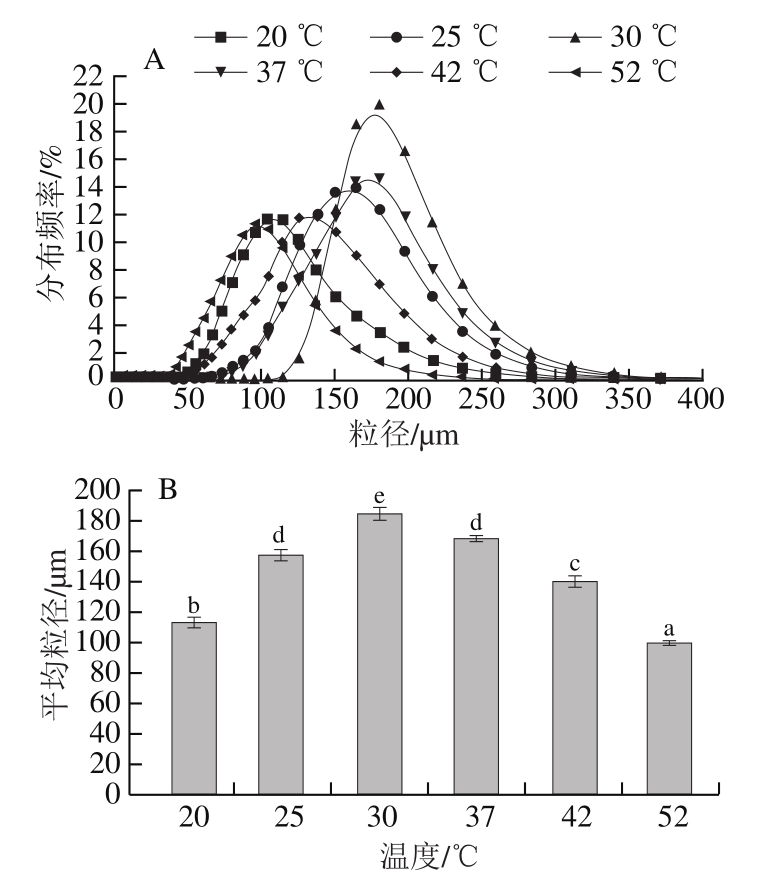
图 6 不同温度下乌鳢鱼皮胶原蛋白肽聚集体粒径分布(A)和平均粒径(B)
Fig. 6 Particle size distribution (A) and average particle size (B) of collagen peptide aggregates from snakehead fish skin treated at different temperatures
2.7 温度对乌鳢鱼皮胶原蛋白肽聚集体二级结构的影响
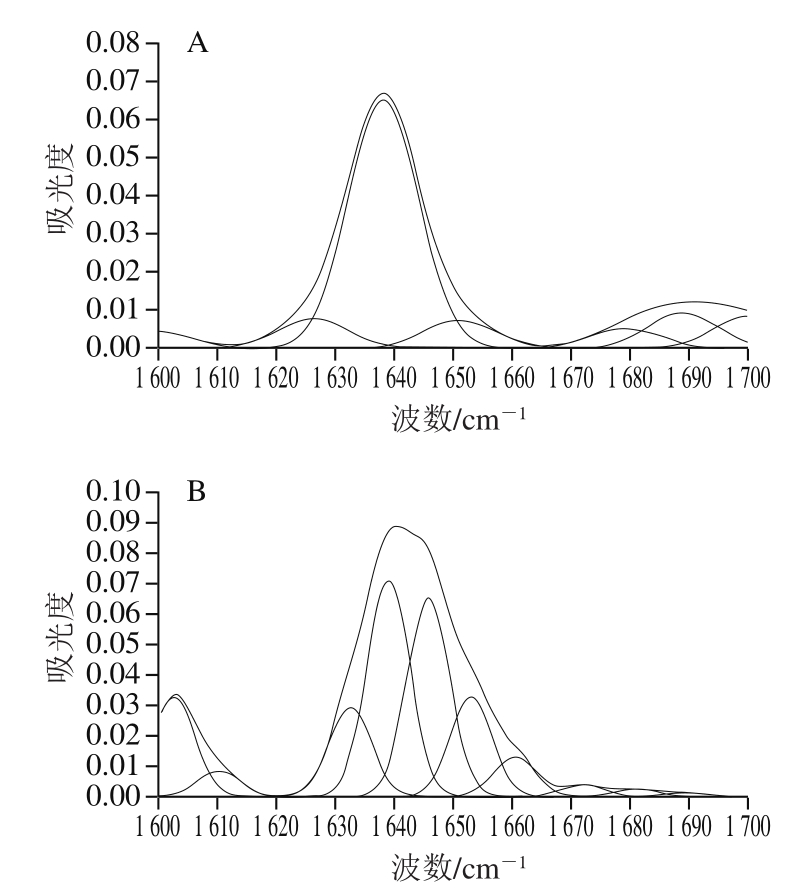
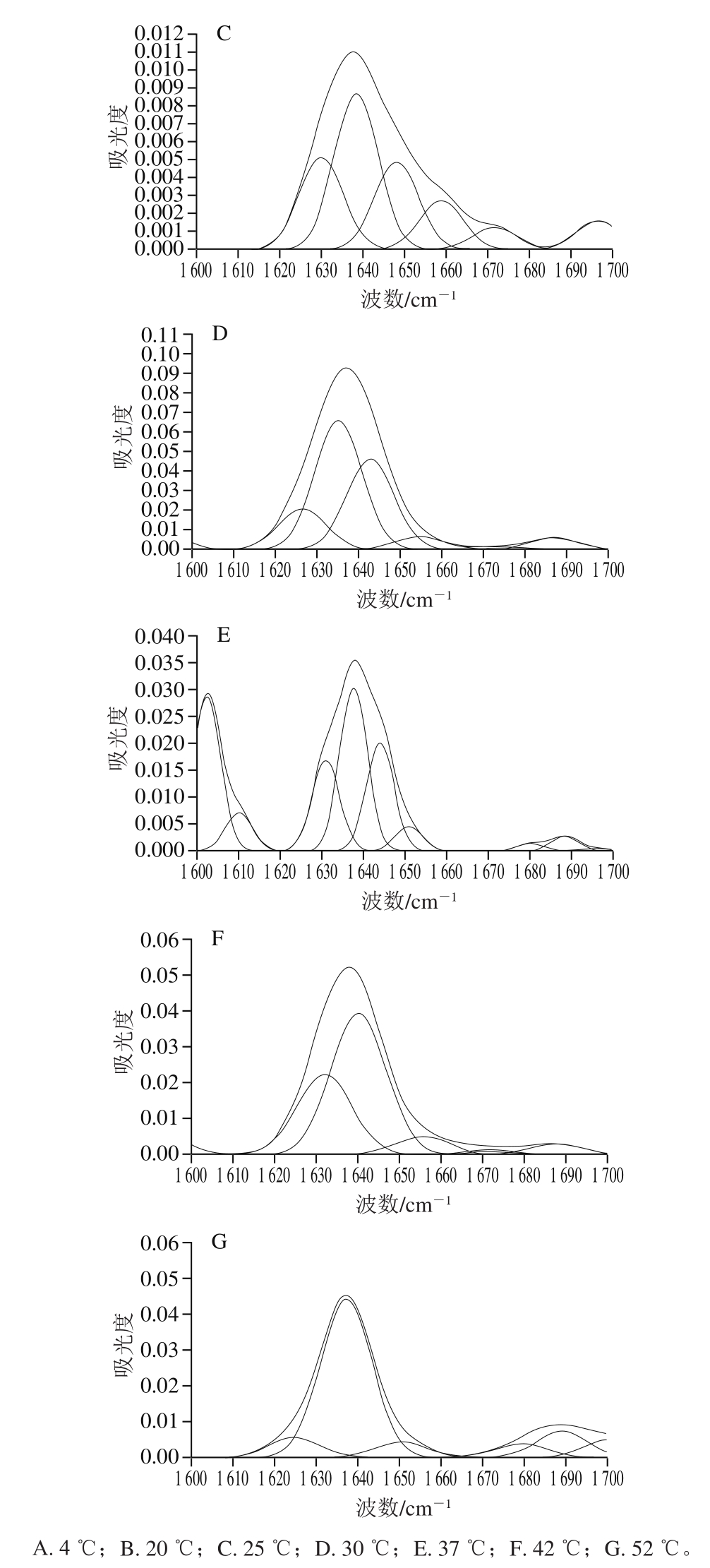
图 7 不同温度下乌鳢鱼皮胶原蛋白肽聚集体酰胺Ⅰ带红外光谱图
Fig. 7 Infrared spectra of collagen peptide aggregates amide I band from snakehead fish skin at different temperatures
图7为不同温度条件下乌鳢胶原蛋白肽自组装聚集体的红外图谱。蛋白质中的C=O、N-H和C-N的振动方式与其二级结构有关,多个红外波段可用于反映键振动方式,其中,酰胺Ⅰ带(1 600~1 700 cm-1)可反映C=O的伸缩振动[42]。因此,本研究对不同温度条件下乌鳢鱼皮胶原蛋白肽自组装聚集体的酰胺Ⅰ带进行分析,研究温度对乌鳢鱼皮胶原蛋白肽自组装聚集体二级结构的影响。其中,β-折叠所处波段为1 615~1 637 cm-1和1 682~1 700 cm-1,无规则卷曲为1 637~1 645 cm-1,α-螺旋为1 646~1 664 cm-1,β-转角为1 664~1 681 cm-1[43]。
表 1 不同温度下乌鳢鱼皮胶原蛋白肽聚集体二级结构相对含量
Table 1 Secondary structure relative contents of collagen peptide aggregates from snakehead fish skin at different temperatures %
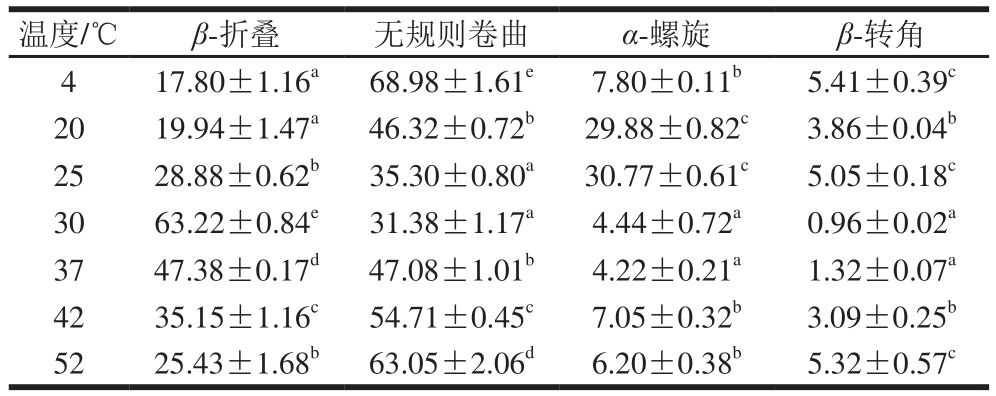
注:同列小写字母不同,表示差异显著(P<0.05)。
温度/℃ β-折叠 无规则卷曲 α-螺旋 β-转角4 17.80±1.16a 68.98±1.61e 7.80±0.11b 5.41±0.39c 20 19.94±1.47a 46.32±0.72b 29.88±0.82c 3.86±0.04b 25 28.88±0.62b 35.30±0.80a 30.77±0.61c 5.05±0.18c 30 63.22±0.84e 31.38±1.17a 4.44±0.72a 0.96±0.02a 37 47.38±0.17d 47.08±1.01b 4.22±0.21a 1.32±0.07a 42 35.15±1.16c 54.71±0.45c 7.05±0.32b 3.09±0.25b 52 25.43±1.68b 63.05±2.06d 6.20±0.38b 5.32±0.57c
由表1可知,自组装对乌鳢鱼皮胶原蛋白肽二级结构相对含量影响显著(P<0.05),从Fan Daidi等[44]研究可知,胶原蛋白最低自组装温度约为22 ℃,达到该温度时,胶原蛋白才会发生自组装,因此,4 ℃条件下的乌鳢鱼皮胶原蛋白肽并未发生自组装反应,但由于上述研究采用的胶原蛋白为类人胶原蛋白,与本研究不同,所以最低自组装温度可能存在差异。相较于4 ℃条件下的乌鳢鱼皮胶原蛋白肽,20 ℃自组装乌鳢鱼皮胶原蛋白肽β-折叠相对含量无显著变化,但无规则卷曲相对含量显著降低22.66%(P<0.05),α-螺旋相对含量显著增加22.08%(P<0.05),表明胶原蛋白肽在该温度条件下可能已发生自组装反应。研究[45-47]表明,蛋白质自组装可促使二级结构由无序状态向有序状态转变,其中大量无规则卷曲形成β-折叠,凝胶纤维网络逐步形成。β-折叠是多肽自组装纳米纤维的重要组成部分,其相对含量的升高表明更多纳米纤维的形成。随着温度的持续升高,β-折叠相对含量先增加后降低,这是由于非变性温度条件下,升温有助于更稳定的纤维结构的形成;当温度到达37 ℃时,β-折叠相对含量出现降低,且随着温度的继续升高,β-折叠相对含量持续降低,表明胶原蛋白肽自组装纤维结构难以抵抗变性温度的作用,其有序的β-折叠结构逐步向无规则卷曲转变。
2.8 乌鳢鱼皮胶原蛋白肽聚集体热变性温度分析
由图8可知,不同pH值条件下乌鳢鱼皮胶原蛋白肽自组装后的DSC图谱中存在一个明显吸热峰,这主要是胶原蛋白肽链螺旋结构分解的吸热行为,该峰值温度为乌鳢鱼皮胶原蛋白肽的热变性温度(Td)[48]。pH值为4的条件下,乌鳢鱼皮胶原蛋白肽Td为33.8 ℃,稍高于Liu Wentao等[26]采用乌鳢鱼皮胶原溶液测得的32 ℃,导致该情况的原因是由于本研究采用超纯水溶胀不同pH值条件下自组装的胶原蛋白肽24 h,使得胶原蛋白肽分子之间更为接近,胶原蛋白肽的热稳定性增强。自组装程度较高的胶原蛋白肽(pH 6~10)的热稳定性高于自组装程度较低的胶原蛋白肽(pH 4),这是因为pH 4条件下的胶原蛋白肽多以单分子的形式存在,化学键及次级结构之间的结合较少,而自组装程度较高的胶原蛋白肽形成了有序的三维网络纤维结构,提高了胶原蛋白肽分子间及分子内的交联程度,对高温带来的变性起到一定的抵抗作用,因此pH 6~10条件下胶原蛋白肽热稳定性更高[49]。此外,不同pH条件下胶原蛋白肽自组装结构的变性温度随着pH值的增加呈现先升后降的趋势,pH 8条件下达到最大值,变性温度为54.1 ℃,高于其他温度条件下自组装的胶原蛋白肽,这是由胶原蛋白肽自组装程度所决定,当胶原蛋白肽pH值逐渐接近8时,胶原蛋白肽更接近于等电点,电荷趋向于零,阻碍胶原蛋白肽自组装的阻力减小,自组装程度更高,因而胶原蛋白肽自组装形成的聚集体结构更为稳定。
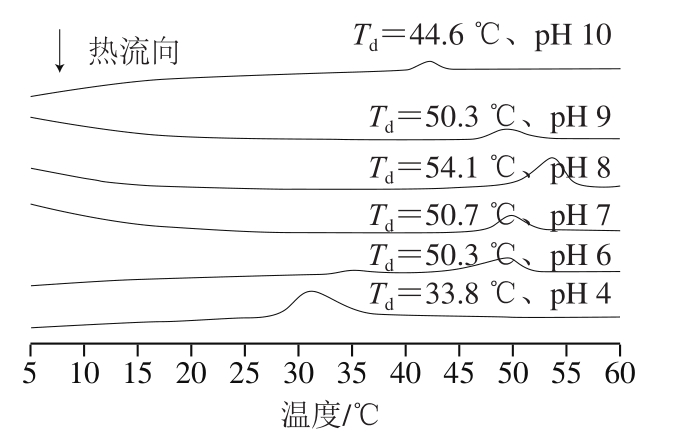
图 8 不同pH值条件下乌鳢鱼皮胶原蛋白肽聚集体的DSC曲线
Fig. 8 DSC curves of collagen peptide aggregates from snakehead fish skin at different pH values
3 结 论
在20~52 ℃时,乌鳢鱼皮胶原蛋白肽自组装速率和温度呈正相关,可通过改变温度影响自组装速率。然而,胶原蛋白肽聚集体三维纤维网络紧密性随温度的升高先增大后降低,与其凝胶强度、粒径、黏度和二级结构中β-折叠相对含量随温度的变化规律相一致,其中30 ℃条件下胶原蛋白肽自组装聚集体各项指标达到最大值,表明该温度条件下乌鳢胶原蛋白肽自组装聚集体结构稳定性最强。胶原蛋白肽聚集体结构相比未组装的胶原蛋白肽热稳定性更强,当温度高于胶原蛋白肽变性温度时,其三螺旋结构发生解旋,纤维网络结构溃散。因此,可以通过改变温度的方式提高自组装效率,得到聚集程度更为紧密、结构稳定性更强的胶原蛋白肽聚集体。由于胶原蛋白肽具有良好的生物相容性和低致敏性,使其在药物缓释方面具有一定的研究前景,可在药物载体的应用方面开展进一步探索。
[1]中华人民共和国国家统计局. 中国统计年鉴[EB/OL]. [2021-06-21].https://data.stats.gov.cn/easyquery.htm?cn=C01.
[2]童敏, 陈勇, 张桂英. 乌鳢乌鸡本草汤对实验小鼠伤口愈合的影响[J].湖南中医杂志, 2018, 34(10): 168-170. DOI:10.16808/j.cnki.issn1003-7705.2018.10.073.
[3]袁淑云, 霍金平, 蔡宗友. 乌鳢与月鳢对小鼠抗疲劳及生肌作用的实验研究[J]. 右江医学, 2005, 33(2): 109-111. DOI:10.3969/j.issn.1003-1383.2005.02.003.
[4]许蓉, 郑淋, 赵谋明. 温度和pH值对鸡胸软骨II型胶原蛋白的结构、黏度和热稳定性的影响[J]. 食品科学, 2020, 41(14): 66-71.DOI:10.7506/spkx1002-6630-20190624-294.
[5]AUKKANIT N, GARNJANAGOONCHORN W. Temperature effects on type I pepsin-solubilised collagen extraction from silver-line grunt skin and its in vitro fibril self-assembly[J]. Journal of the Science of Food and Agriculture, 2010, 90(15): 2627-2632. DOI:10.1002/jsfa.4131.
[6]ZHU Shichen, YU Xiaoyue, YOU Juan, et al. Study of the thermodynamics and conformational changes of collagen molecules upon self-assembly[J]. Food Hydrocolloids, 2020, 114(12): 106576.DOI:10.1016/j.foodhyd.2020.106576.
[7]TANG Lanlan, CHEN Shulin, SU Wenjin, et al. Physicochemical properties and film-forming ability of fish skin collagen extracted from different freshwater species[J]. Process Biochemistry, 2015, 50(1):148-155. DOI:10.1016/j.procbio.2014.10.015.
[8]HONG H, CHAPLOT S, CHALAMAIAH M, et al. Removing crosslinked telopeptides enhances the production of low-molecular-weight collagen peptides from spent hens[J]. Journal of Agricultural and Food Chemistry, 2017, 65(34): 7491-7499. DOI:10.1021/acs.jafc.7b02319.
[9]刘炜熹, 孙卫东, 张业辉, 等. 离子强度对乌鳢胶原蛋白短肽聚集结构及理化特性的作用[J]. 现代食品科技, 2020, 36(8): 65-72.DOI:10.13982/j.mfst.1673-9078.2020.8.0117.
[10]雷选, 王旭苹, 程镜蓉, 等. 芦丁和阿魏酸与酪蛋白的相互作用研究[J]. 食品科学技术学报, 2020, 38(2): 73-80. DOI:10.3969/j.issn.2095-6002.2020.02.010.
[11]贾俊强, 孙晟源, 周晓瑞, 等. 超声处理对鲫鱼皮胶原蛋白的自组装行为和理化性质影响[J]. 食品科学, 2020, 41(19): 98-104.DOI:10.7506/spkx1002-6630-20190826-275.
[12]LEO L, BRIDELLI M G, POLVERINI E. Insight on collagen selfassembly mechanisms by coupling molecular dynamics and UV spectroscopy techniques[J]. Biophysical Chemistry, 2019, 253:106224. DOI:10.1016/j.bpc.2019.106224.
[13]CHEN S, HIROTA N, OKUDA M, et al. Microstructures and rheological properties of tilapia fish-scale collagen hydrogels with aligned fibrils fabricated under magnetic fields[J]. Acta Biomaterialia,2011, 7(2): 644-652. DOI:10.1016/j.actbio.2010.09.014.
[14]宋晓敏, 刘建福. 蚕豆淀粉凝胶强度与质构的影响因素[J]. 食品科技, 2013, 38(6): 180-184.
[15]李思佳, 孙卫东, 张业辉, 等. 微射流-酶处理对罗非鱼皮胶原蛋白结构和理化特性的影响[J]. 现代食品科技, 2019, 35(7): 24-29.DOI:10.13982/j.mfst.1673-9078.2019.7.005.
[16]JOLANTA T G, PIOTR K. A DSC study on the effect of marination on the stability of skin collagen from chicken wings[J]. Acta Scientiarum Polonorum Technologia Alimentaria, 2010, 9(4): 18-21.DOI:10.1080/13697130310001651490.
[17]张之宝, 王静洁, 陈晖娟, 等. 圆二色谱研究胶原模拟多肽三螺旋结构及其热稳定性[J]. 光谱学与光谱分析, 2014, 34(4): 1050-1055.DOI:10.3964/j.issn.1000-0593(2014)04-1050-06.
[18]BHARATHY H, FATHIMA N N. Exploiting oleuropein for inhibiting collagen fibril formation[J]. International Journal of Biological Macromolecules, 2017, 101: 179-186. DOI:10.1016/j.ijbiomac.2017.03.050.
[19]USHA R, SREERAM K J, MANDAL A B. Organization of collagen in the presence of diphenyl phosphoryl azide (DPPA): an in vitro study[J]. Colloids and Surfaces B: Biointerfaces, 2013, 109: 121-128.DOI:10.1016/j.colsurfb.2013.03.034.
[20]段蕊, 叶超, 邢芳芳, 等. 采用圆二色谱法研究冬夏鲢鱼鳞胶原蛋白的稳定性[J]. 食品与发酵工业, 2010, 36(1): 73-76.
[21]YAN Mingyan, LI Bafang, ZHAO Xue, et al. Effect of concentration,pH and ionic strength on the kinetic self-assembly of acidsoluble collagen from walleye pollock (Theragra chalcogramma)skin[J]. Food Hydrocolloids, 2012, 29(1): 199-204. DOI:10.1016/j.foodhyd.2012.02.014.
[22]LIN Yungkai, LIU Dengcheng. Effects of pepsin digestion at different temperatures and times on properties of telopeptide-poor collagen from bird feet[J]. Food Chemistry, 2006, 94(4): 621-625. DOI:10.1016/j.foodchem.2004.12.007.
[23]FATEMEH E, MARYAM M E, FATEMEH N A. Thermodynamic parameters and influence of kinetic factors on the self-assembly of acid-soluble collagen nanofibrils[J]. Food Biophysics, 2017, 12(3):365-373. DOI:10.1007/s11483-017-9492-5.
[24]闫婷婷. 胶原自组装行为的研究[D]. 郑州: 郑州大学, 2017: 40-50.
[25]王小庆, 任健. 不同预热处理温度对黑豆分离蛋白乳液凝胶性质的影响[J]. 中国油脂, 2016, 41(8): 28-30. DOI:10.3969/j.issn.1003-7969.2016.08.007.
[26]LIU Wentao, TIAN Zhenhua, LI Conghu, et al. Thermal denaturation of fish collagen in solution: a calorimetric and kinetic analysis[J]. Thermochimica Acta, 2014, 581: 32-40. DOI:10.1016/j.tca.2014.02.012.
[27]高昕, 刘莲凤, 刘倩, 等. 不同加热温度下刺参肌肉组织与胶原纤维结构的变化[J]. 水产学报, 2012, 36(9): 1465-1472. DOI:10.3724/SP.J.1231.2012.27937.
[28]刘春红, 冯金凤, 冯志彪, 等. 乳清蛋白自组装纤维形成的临界聚集质量浓度研究[J]. 中国食品学报, 2016, 16(1): 69-76. DOI:10.16429/j.1009-7848.2016.01.010.
[29]潘腾, 陈星, 沈清武, 等. 不同Ca2+浓度下猪肉肌球蛋白的热聚集体机制研究[J]. 农业机械学报, 2020, 51(9): 329-336. DOI:10.6041/j.issn.1000-1298.2020.09.037.
[30]伍胜. 对卡拉胶及其魔芋复配凝胶强度的测量[J]. 食品科学, 1999,20(8): 38-41.
[31]HUANG Xingjian, LI Chen, YANG Fang, et al. Interactions and gel strength of mixed myofibrillar with soy protein, 7S globulin and enzyme-hydrolyzed soy proteins[J]. European Food Research and Technology, 2010, 231(5): 751-762. DOI:10.1007/s00217-010-1329-0.
[32]FURUKAWA T, OHTA S, YAMAMOTO A. Texture-structure relationships in heat-induced soy protein gels[J]. Journal of Texture Studies, 2010, 10(4): 333-346. DOI:10.1111/j.1745-4603.1980.tb00864.x.
[33]HATAMI M, NEJATIAN M, MOHAMMADIFAR M A, et al.Milk protein-gum tragacanth mixed gels: effect of heat-treatment sequence[J]. Carbohydrate Polymers, 2014, 101: 1068-1073.DOI:10.1016/j.carbpol.2013.10.004.
[34]李剑瑛. 赤魟鱼鱼皮胶原及其衍生物的制备、理化性质及功能特性研究[D]. 厦门: 集美大学, 2019: 20-30.
[35]RASHEEDA K, NISHAD F N. Trigonelline hydrochloride: a promising inhibitor for type I collagen fibrillation[J]. Colloids Surf B Biointerfaces, 2018, 170: 273-279. DOI:10.1016/j.colsurfb.2018.06.030.
[36]朱亮, 闻荻江. 壳聚糖/胶原蛋白共混溶液的流变性能研究[J]. 中国皮革, 2009, 38(3): 16-18; 30.
[37]马明思, 张宇昊, 马良, 等. 兔皮胶原蛋白的微观结构及不同因素对其聚集特性的影响[J]. 食品与机械, 2017, 33(2): 11-16.DOI:10.13652/j.issn.1003-5788.2017.02.003.
[38]VEEN S, VERSLUIS P, KUIJK A, et al. Microstructure and rheology of microfibril-polymer networks[J]. Soft Matter, 2015, 11(46): 8907-8912. DOI:10.1039/C5SM02086G.
[39]王艳. 草鱼皮胶原蛋白的提取、性质研究及膜性能表征[D]. 天津:天津科技大学, 2013: 40-50.
[40]琚海燕, 刘萌, 但卫华, 等. 胶原纤维溶胀液的流变特性研究[J].功能材料, 2014, 45(11): 11110-11114. DOI:10.3969/j.issn.1001-9731.2014.11.023.
[41]LI Yang, LI Yanwen, DU Zongliang, et al. Comparison of dynamic denaturation temperature of collagen with its static denaturation temperature and the configuration characteristics in collagen denaturation processes[J]. Thermochimica Acta, 2008, 469: 71-76.DOI:10.1016/j.tca.2008.01.006.
[42]管弋铦, 何苗, 熊双丽. 超高压处理对大米蛋白功能特性及结构的影响[J]. 食品工业科技, 2016, 37(20): 104-109. DOI:10.13386/j.issn1002-0306.2016.20.012.
[43]孙圳, 杨方威, 李侠, 等. ATR-FTIR分析冻结-解冻后的牛肉蛋白二级结构变化[J]. 光谱学与光谱分析, 2016, 36(11): 3542-3546.DOI:10.3964/j.issn.1000-0593(2016)11-3542-05.
[44]FAN Daidi, XING Jianyu, XUE Wenjiao, et al. Effect of temperature on self-interaction of human-like collagen[J]. Chinese Journal of Chemistry, 2011, 29(9): 1811-1816. DOI:10.1002/cjoc.201180318.
[45]陈启航, 孙丽颖, 董维兵. β-折叠肽自组装在生物医学方面的应用[J]. 中国生化药物杂志, 2017, 37(8): 443-445. DOI:10.3969/j.issn.1005-1678.2017.08.188.
[46]周希蕊. pH/离子双响应性两亲多肽水凝胶的制备及性质研究[D].北京: 北京化工大学, 2013: 30-40. DOI:10.7666/d.Y2393173.
[47]TAN H L, SHAMSUDEEN H, SO’AIB M S. Effects of electric filed on β-sheet propensity self-assembled amphiphile peptides[J].Materials Today: Proceedings, 2018, 5(2): S143-S148. DOI:10.1016/j.matpr.2018.08.056.
[48]赵燕, 鲁亮, 杨玲, 等. 草鱼皮胶原的体外自组装动力学研究[J].食品科学, 2014, 35(11): 21-26. DOI:10.7506/spkx1002-6630-201411005.
[49]吕辉华. 胶原蛋白的体外纤维重组及其产物性能研究[D]. 武汉: 武汉轻工大学, 2016: 5-15.