长期以来,食源性疾病的爆发在世界范围内引起了广泛关注。在过去的几十年中,为了抑制微生物生物膜污染对食品品质特性和货架期的影响,仍然广泛使用传统的热处理杀菌方式,如高温热处理[1]和巴氏杀菌[2]等。然而,这些方法存在一定程度的加工缺陷,例如,过高温度会导致肉中蛋白质的聚集及降解,不利于蛋白质消化,并会造成营养流失,其次对产品的色泽、滋味和口感等也会造成不良影响,并且热处理会消耗大量能量,导致成本上升[3]。除了热杀菌,化学杀菌剂的使用在食品行业中也比较常见,如氯处理[4]和有机酸[5]等。但是,大多数常规的化学杀菌剂在使用过程中常常会产生交叉抗性,对环境胁迫不敏感,除此之外,在食品加工过程中使用还会产生一定的健康风险。
生物膜是一种由微生物所构成的有结构的细胞群落,被包围在由细胞外聚合物质(extracellular polymeric substances,EPS)自身所构成的基质中,通常它们之间会彼此黏附或者附着于不同的界面或表面上。生物膜是许多微生物生存的一种模式,并且在适当的条件下很容易形成,因此,生物膜实质上会对微生物起到一定的“屏障”作用,从而使存在于其内部的微生物对外部化学和物理作用产生一定程度的耐受。能够产生生物膜的微生物在遭受到化学杀菌剂等处理的过程中,其所产生的抵抗力和耐受性都高于以浮游状态存在的微生物,这是由于生物膜的存在使化学杀菌剂难以渗透和扩散到其内部,失去了使微生物失活的必要条件。García-Sánchez等[6]证明一些能够产生生物膜的空肠弯曲杆菌菌株可以在恶劣环境下存活,并且对常用抑菌剂均有较高的耐药性。在肉制品及其他食品生产过程中,生物膜也会导致冲洗和擦拭等方法无法有效去除设备表面附着的微生物。
由于传统的物理或化学杀菌方法存在杀菌不彻底和食用安全性等方面的问题,因此,有必要探索新型杀菌技术,以期能在一定程度保持品质的前提下达到有效杀菌的目的。目前,主要的新型杀菌技术包括冷等离子体[7]、超临界二氧化碳处理[8]和超声技术[9]等,其中超声技术作为一种食品非热加工技术,在食品中的应用受到了广泛关注。近年来,通过超声空化作用所产生的机械效应破坏生物膜结构,进而抑制微生物活性已成为食品杀菌技术领域的研究热点,但是关于超声在肉及肉制品加工行业中的应用报道并不多见。本文综述微生物生物膜的形成和代谢过程;对超声技术的分类、原理和技术特点进行简单介绍;同时对超声技术抑制生物膜污染的具体诱导机制进行了详细阐述,并对现有的国内外研究进行总结,以期为超声技术在肉及肉制品等食品杀菌领域中的应用提供借鉴。
1 微生物生物膜的形成机制、代谢过程及影响因素
生物膜是指由EPS所包围的有结构的微生物细胞群落,这些细胞群落在界面或表面上相互附着从而形成生物膜[10]。EPS是一种微生物来源的有机聚合物,在生物膜系统中起到聚合和黏附作用,并且在一定程度上决定了生物膜的结构、强度和性能,其主要成分包括多糖、蛋白质、核酸及脂质等[11]。导致人类食源性疾病爆发的常见微生物通常以生物膜形式存在,与浮游生物通过运动并定居于新的表面不同,生物膜细菌具有更加活跃的繁殖代谢能力以及较强的致病性。由于其生长并包埋在高度水合的阴离子基质中,并且基质聚合物和生物膜中最远端细胞上的大量带电结合位点为内部细胞提供保护,使其对抗菌剂有更强的抵抗力[12]。Alonso-Calleja等[13]研究证明,大肠杆菌ATCC12806生物膜不仅表现出对亚硝酸钠和次氯酸钠的单独耐受性,还观察到对其产生的交叉抗性,同时得出结论,能够抑制浮游态微生物污染的食品级抗菌剂浓度已经无法抑制大肠杆菌ATCC12806生物膜污染过程,并且为了避免其暴露于亚致死浓度抗菌剂后产生交叉耐受,需要提高抗菌剂浓度,但这会造成一定的健康风险。
生物膜的形成主要包括5 个阶段,第1阶段为浮游微生物细胞的可逆附着,在初始阶段,浮游微生物通过弱相互作用(如范德华力、疏水力和静电力等)或鞭毛、菌毛和凝集素黏附等机制在非生物或生物表面可逆附着和生长繁殖,并且不断地从液体环境中吸收营养物质。根据浮游生物的特征和活动状态以及附近流体相的扩散和剪切力作用,附着类型可分为主动附着和被动附着[14]。附着能力很大程度上取决于微生物的种类、浓度、体积、接触时间和表面的物理化学性质(表面电荷、pH值和温度)等。在此阶段中,只产生少量的EPS,大多数微生物仍然具备独立运动的能力,甚至可以从表面分离并恢复浮游状态。第2阶段为产生EPS的不可逆附着阶段,此阶段微生物不断增殖,EPS持续累积,从而逐渐转变成不可逆附着状态。通常,EPS的构成与生物体类别和环境变化有关,一般由多糖、蛋白质、糖蛋白、糖脂以及胞外DNA、金属离子、二价阳离子和其他表面活性成分组成[15]。当微生物分泌物达到一个临界浓度时,利用其自身的多糖、鞭毛和菌毛等附着结构相互结合成细菌聚集物并且在表面形成EPS,从而保护内部细胞免受抗生素、消毒剂和环境胁迫影响,还可以促进生物或非生物表面细胞的黏附、加速三维结构和微菌落的形成以及诱导生物膜的成熟。第3阶段为微菌落的形成阶段。当一定数量的固着微生物与同种或异种细胞相邻并处于稳定状态时,会随即形成具有三维结构的单物种或混合物种微菌落[16]。微菌落是微生物生态系统中的重要组成部分,存在于其中的水分通道为营养物质的进入和代谢废物的排出提供了一种有效途径,并且可以通过自发消除受损个体的机制来维持群落的稳定。在这个过程中,EPS有助于加强不同微菌落之间以及微菌落和基质之间的黏附,并且在环境发生变化时起到稳定菌落的作用。第4阶段是生物膜的成熟阶段。生物膜成熟后,内部形成了能够有效分配营养物质及传播膜内信号的开放水通道。由于不同微生物所依赖的营养物质不同,最终形成被EPS包围的扁平状、蘑菇状或郁金香状的不同组织结构[17]。同时,微生物之间通过释放一些特殊的信号分子来相互沟通和协调以进行基因调控,这个过程被称作群体感应(quorum sensing,QS)[18],在抑制微生物聚集效应和生物膜的定植成熟等方面起到十分重要的作用。QS中的自诱导物主要包括4 种,首先是由革兰氏阴性菌产生N-酰基高丝氨酸内酯中的自诱导物-1(autoinducer-1,AI-1)和AI-3,其次是在革兰氏阳性菌中存在的一种用于物种内部交流的物质,被称为自诱导肽,最后一种是应用于不同物种群落之间通信的AI-2 QS分子呋喃氧基-硼酸二酯[19]。第5阶段为扩散阶段。此阶段细胞会从成熟的生物膜中分离,随后扩散到其他区域,并且恢复到浮游形态,重新进入新的生物膜形成周期。能够形成生物膜的微生物的细胞会由于各种原因而发生扩散,如群体效应的影响、营养状态的改变、表面特性的转化、细菌的繁殖代谢和外部环境的影响等。主要的扩散过程包括侵蚀、磨损和脱落[20]。首先,流体剪切力作用所导致的细胞侵蚀和分子颗粒之间碰撞所导致的表面磨损是一种小细胞群体或单个细胞的连续分离过程,只改变微生物生物膜表面的结构,而脱落会导致大部分甚至全部的生物膜结构损失,但是扩散的发生往往是局部的[21-22]。
2 超声技术的原理及抑制微生物生物膜污染的机制
早在20世纪20年代就已经证实超声可以作为一种环境友好的抑制微生物生物膜污染技术[23]。而近些年来,将超声技术应用于抑制微生物生物膜污染方面的研究越来越广泛。目前已经有多项研究表明超声处理可以有效破坏生物膜结构,从而达到抑制污染的目的,在一定程度保持产品原有品质的同时提高了其安全性[24-26]。
2.1 超声技术的类型及技术特点
声波主要分为3 个部分,包括次声(频率<20 Hz)、带声(20 Hz<频率<20 kHz)和超声(频率>20 kHz),其中,超声波由一系列高频率声波组成,起始频率为20 kHz,接近人类听觉范围的上限[27]。超声波按频率不同可分为功率超声(20~100 kHz)、高频超声(100 kHz~1 MHz)和诊断超声(1~10 MHz)[28]。超声波的2 个重要参数是功率密度(每毫升溶液所消耗的功率量,W/mL)和功率强度(每平方厘米发射器面积所消耗的功率量,W/cm2)[29]。在食品加工中,超声波主要分为2 类:低强度高频超声波(功率强度<1 W/cm2、频率100 kHz~1 MHz)和高强度低频超声波(功率强度>10 W/cm2、频率20~100 kHz)[30],其中,低强度高频超声波通常用于表征食品成分、评估食品结构和保证食品质量,因为它几乎不会导致被处理材料发生物理化学变化,而高强度低频超声波具有破坏性,可以使介质内部产生快速移动的微气泡流,经过一系列变化最终气泡剧烈破裂,进而达到改性物料的目的,因此常用于食品加工领域[31]。
2.2 超声技术抑制微生物生物膜污染的诱导机制
2.2.1 空化效应
超声技术抑制生物膜污染的主要作用机理与空化效应有关。如图1所示,最初,溶解的气体和蒸汽通过扩散产生气泡;达到压缩半周期时,气泡开始收缩,但是由于压缩过程中气泡表面积的减少,使其排出的内容物小于膨胀阶段所吸收内容物,从而导致气泡向共振尺寸方向生长,这个过程被称为矫正扩散或整流扩散;在临界尺寸范围内,当超声波应用频率与气泡壁振动频率相同时,相位耦合从而发生共振现象,导致气泡在1 个压缩周期内发生破裂[32]。空化效应主要分为稳定空化(非惯性空化)和瞬态空化(惯性空化)[33]。稳定空化主要导致介质微搅动,液体中微小气泡形成后经过多次超声波振荡来增大其体积,一般不发生气泡破裂;而瞬态空化中的气泡寿命很短,它以极大的振幅不断振动,快速增长然后迅速崩溃,约在1 个超声周期内就发生剧烈的气泡坍塌,破碎成体积更小的气泡后再次进入气泡增长周期,循环往复[34]。空化气泡的坍塌或内爆瞬间产生极高的压力(可达到50 MPa),产生向外传播的冲击波,从而产生能够破坏细胞的强机械力和剪切力,同时引起微观湍流,也称为空化区湍流现象,坍塌过程也会产生高温(气泡内部达到5 500 ℃),使液体介质发生热分解从而产生自由基,此过程是超声抑制生物膜污染的一个主要机制[35]。
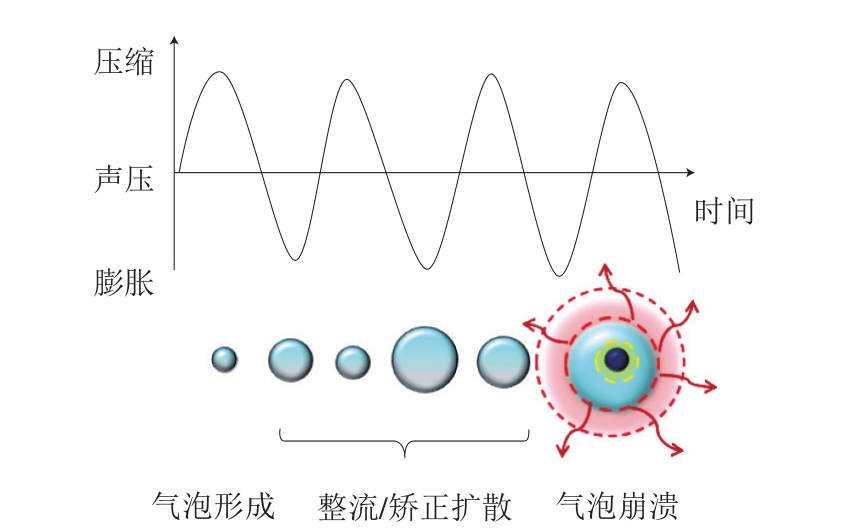
图1 空化作用下气泡的形成、生长和剧烈崩塌
Fig.1 Formation, growth and collapse of violent bubbles under cavitation
空化效应会破坏微生物细胞壁结构和功能、使细胞膜变薄、在一定程度上使细胞壁和细胞膜分离、释放细胞内容物并且使酶失活,由介质产生的高温、高压、自由基以及气泡爆炸所产生的高剪切力、机械力和微观湍流等效应会使微生物生物膜结构遭到破坏,并产生大小不一的孔洞,此过程被称为声穿孔现象。这种穿孔效应可以增加细胞膜的通透性,允许抗菌物质通过孔洞转移到细胞内,破坏蛋白质、酶和DNA,还会导致细胞内功能物质泄漏,最终导致细胞凋亡,从而达到抑制微生物生物膜污染的目的。
2.2.2 驻波效应和微观湍流
驻波效应是指超声设备向介质发射超声波的同时,声波又从固体表面或气-液界面反射回液体介质中的过程,可导致强烈的空化作用。气泡在膨胀、压缩和坍塌周期中的表现为:在声压随时间从最大值到最小值波动的驻波压力波腹处,所聚集的气泡尺寸都小于共振尺寸;相反,在声压接近于零的压力节点处,所聚集的气泡尺寸都大于共振尺寸[36-37]。气泡从压力节点处向波腹处移动的过程中,空化气泡以比流体的平均速度快1 个数量级的速度在带状结构中行进,从而加速流体的传递速率,当它们碰撞时气泡之间会发生相互聚集,最终在接近微生物表面时发生坍塌,从而破坏微生物生物膜结构,这种气泡转移的流动过程被称为微观湍流[38]。
2.2.3 微射流
当气泡靠近微生物生物膜时,流体运动的幅度和方向迅速发生改变,在其表面引起一定程度的剪切力和阻力,从而发生由空化效应诱导的气泡坍塌,但这种坍塌通常是不对称的,这个过程被称为不对称空化。而不对称的空化效应最终会导致速率超过100 m/s的微射流的形成[39]。微射流会轰击微生物细胞,导致微生物细胞膜变薄并在表面发生点蚀和侵蚀,从而达到抑制微生物生物膜污染效果,除此之外,微射流效应还可以用来去除附着在表面上的颗粒达到清洁作用,或者用于加速聚集体分解成颗粒的过程[40]。
2.2.4 产生自由基
空化作用导致介质发生热分解,生成活性氧(reactive oxygen species,ROS)、羟自由基(•OH)和过氧化氢(H2O2),它们被证明为有效的抗菌物质[41]。相关反应方程为(1)~(6)。
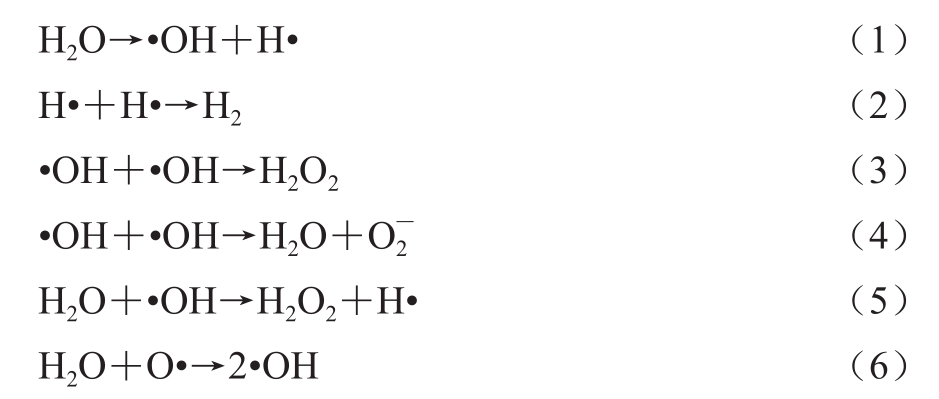
空化过程中所产生的H2O2、ROS和•OH可以通过攻击微生物细胞壁和细胞膜来削弱其对细胞的保护作用,使内部蛋白质、脂质、多糖和核酸等物质发生氧化。例如,•OH会攻击某些氨基酸侧链和双键位置,使相应蛋白质发生氧化,并且使其特异性功能受到抑制;•OH还会与多不饱和脂肪酸发生反应导致脂质氧化,破坏细胞膜的结构完整性、流动性和通透性,加速自由基到达细胞内部的进程;H2O2、•OH和ROS可以攻击多糖和生物聚合物,影响细胞正常代谢;ROS引发的氧化应激和•OH都可通过DNA双螺旋断裂等方式破坏核酸结构[42];同时还会使细胞内压力升高,与细胞内聚合物发生反应,干扰细胞正常的生长代谢活动,导致一系列后果,包括蛋白质变性、酶失活、DNA双螺旋结构破坏甚至死亡。另外,在此过程中形成的NO2降低了溶液的pH值,这也会使微生物失活[43]。一般来说,生成的自由基数量与超声频率有关。低频率超声(20~100 kHz)产生的气泡较大,崩溃更加剧烈,释放的能量更多,但生成的气泡数量较少,单位时间内崩溃的次数也较少,这阻碍了•OH的生成和扩散。而高频率超声(100 kHz~1 MHz)产生的气泡较小,释放的能量也较少,但气泡数量较多,单位时间内崩溃坍塌次数较多,这有利于•OH的生成和扩散[44-45],因此,声化学效应在中、高频超声抑制污染过程中起到主导作用。
3 超声技术抑制微生物生物膜污染的影响因素
最近的许多研究表明,尽管超声波技术表现出良好的抑制微生物生物膜污染的能力,然而具体过程受多种因素的影响,包括超声波的功率强度、振幅、温度、外部施加压力、流动特性、表面张力、固体颗粒浓度、微生物的类型、形状或体积等[46]。
3.1 超声功率强度和振幅
低强度超声(功率强度<1 W/cm2)可能会在一定程度上促进微生物细胞及其产生的生物膜生长[47],因为其产生的稳定空化对微生物生物膜所造成的损伤是可逆的,同时改变了微生物细胞的生存状态,从而促进其增殖代谢过程。而高强度超声(功率强度>10 W/cm2)所产生的瞬间空化对微生物生物膜造成不可修复的损伤。一般来说,超声功率强度增加会使空化气泡数量增多和空化区域面积增大,从而使空化效应更加剧烈,但是这个过程存在一个临界点,超过该临界功率水平时,功率强度仍持续增加,通常会导致空化效率降低[48]。造成这种现象的原因主要有3 个:首先,高功率强度会导致气泡的体积膨胀到非常大,以至于气泡没有足够的时间崩溃,从而使空化气泡崩溃的频率降低;其次,还会形成气泡团簇,它可以使功率强度逐层衰减,从而保护内部气泡防止其崩溃坍塌;最后,功率强度过高还会导致在发射器表面形成微气泡聚集,从而使探头表面积增大,而功率强度与探头半径或面积成反比,所以最终使超声波功率强度衰减和空化效率降低。超声的振动幅度是指超声波探头尖端将声波发送到介质中时所经过的最大位移,Merouani等[49]研究证明,气泡的周围半径范围随超声振幅的增大而增大,因而振幅的增大就意味着空化效应的增强。
3.2 温度和压力
温度改变会导致空化气泡在液体中的扩散速率、分散性、蒸汽压和介质黏度的变化,而这些因素都可以直接影响空化作用的强度,进而影响超声抑制微生物生物膜污染的效果和速率。温度的升高通常伴随着气体扩散速率、分散性和蒸汽压的增大,这将降低空化阈值[50],提高空化气泡形成速率,但是会减弱气泡坍塌的剧烈程度。当温度进一步提高至沸点时,会形成数量巨大的气泡群,进而导致超声能量显著递减。此外,由于黏性液体无法产生空化效应,所以必须将液体黏度最小化,而大多数液体的黏度都会随着温度的升高而降低[51]。在超声应用过程中,由于介质粒子的振动、气泡活动及空化效应所引起的瞬间区域高温会导致样品温度持续上升,所以在实际应用中,为了使空化效率最大化,合适的温度是十分必要的。压力增加会使空化阈值增大,导致在相同强度超声下所产生的空化气泡减少,但会导致更加迅速和剧烈的空化气泡坍塌。
3.3 流动特性、表面张力和固体颗粒浓度
当超声波作用于静态液体介质时,会导致稳定的声波反射,因此驻波效应在静态流体中的效果比较明显,而在流动液体介质中时,空化效应所施加的机械力可以使从膜上脱离的颗粒自由流动而远离生物膜污染区域,所以空化效应在流动状态条件下效果更加显著[52]。通常液体中的表面张力增加会在一定程度上导致空化效应的加强,但是在高表面张力液体介质中,空化气泡的形成会受到抑制[53]。固体颗粒浓度升高会导致液体介质浓度增大,从而增加了声波在介质中传递的阻力,使其强度衰减,衰减程度与介质类型、实验要求和外部条件等因素有关[54]。
3.4 微生物的类型、形状或体积
除了超声本身的参数及介质的特性外,微生物生物膜的类型、形状或体积等同样也可以影响超声抑制微生物生物膜污染的效果。例如,在超声处理过程中,相对于革兰氏阴性菌,革兰氏阳性菌更加稳定,这是由于革兰氏阳性菌的细胞壁更厚,导致其形成的生物膜结构更加稳定,并且内部肽聚糖(厚度20~80 nm)的黏附层结合更加紧密,使声波传递过程中的强度大幅衰减,从而起到保护生物膜结构的作用[55]。当细菌以球状存在,通常会导致超声发生有规律的逐层衰减,所以球状细菌比其他形状的细菌具有更高的稳定性;与聚集体积较小的生物膜相比,体积较大的生物膜结构拥有更大的表面积,导致其对超声作用更加敏感[56]。
4 超声技术在肉及肉制品中的应用及问题
4.1 超声技术在肉及肉制品中的应用
肉及肉制品中富含水分、蛋白质和脂质等营养成分,有利于食源性微生物的生长繁殖,极易在生产、流通、销售和贮藏等过程中发生腐败变质,并导致食品安全问题。目前,国内外许多研究表明,超声可有效抑制肉及肉制品的微生物污染。表1列举了一些有关于超声抑菌技术在肉及肉制品中应用的典型文献,并列出了处理过程中的具体参数(超声频率、强度、时间)以及具体的抑菌效果。
许多研究已经指出,超声技术对生鲜肉的抑菌作用明显。Caraveo等[57]将超声处理牛半腱肌于4 ℃下贮藏14 d以观察微生物的生长情况,结果证明,超声可有效抑制牛半腱肌贮藏过程中大肠菌群和嗜冷菌等微生物的生物膜污染,在最大程度保持牛肉品质特性的同时,显著抑制了菌群数量的增加,并没有出现明显的腐败现象。同样,Carrillo-Lopez等[58]证明超声可有效抑制牛背长肌中嗜温、嗜冷和大肠菌群污染。Piñon等[59]对鸡胸肉进行不同时间的超声处理,并指出由于金黄色葡萄球菌(属革兰氏阳性球菌)对超声处理较不敏感,30 min处理不足以减少其数量,而当进行50 min的超声处理时,显著降低了金黄色葡萄球菌和沙门氏菌含量,证明在应用过程中超声时间以及微生物种类和形态等对杀菌效果有显著影响。Bonah等[60]证明超声可有效抑制猪肉表面病原菌污染,同时抑制贮藏过程病原菌生长速率。对于鱼类生鲜制品同样也有类似的研究报道[61]。这说明超声技术对不同来源生鲜肉的抑菌作用具有广泛的适用性。
表1 超声技术在肉及肉制品中的抑菌作用
Table 1 Bacteriostasis of ultrasound technology in meat and meat products
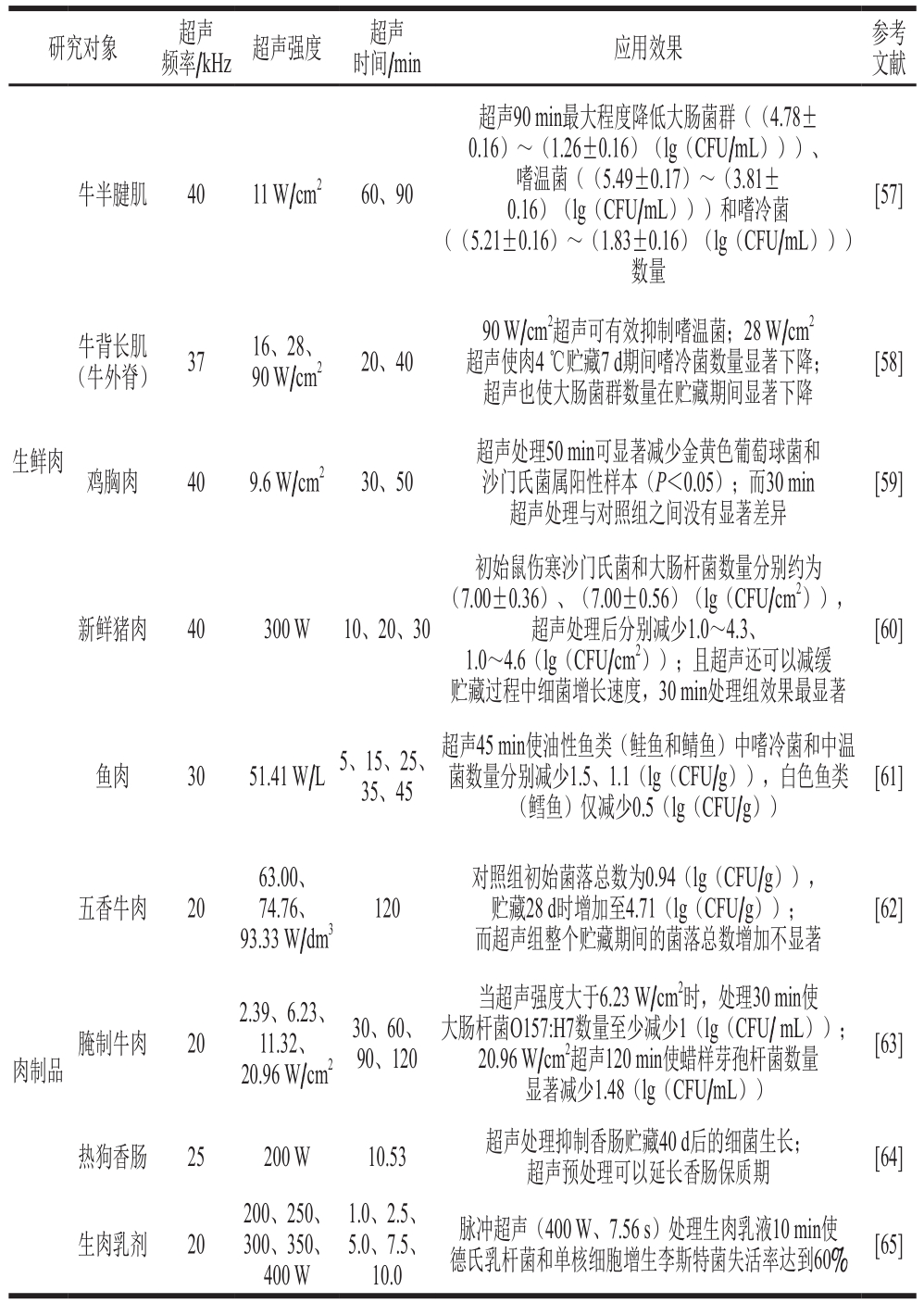
研究对象 超声频率/kHz 超声强度 超声时间/min 应用效果 参考文献生鲜肉牛半腱肌 40 11 W/cm2 60、90超声90 min最大程度降低大肠菌群((4.78±0.16)~(1.26±0.16)(lg(CFU/mL)))、嗜温菌((5.49±0.17)~(3.81±0.16)(lg(CFU/mL)))和嗜冷菌((5.21±0.16)~(1.83±0.16)(lg(CFU/mL)))数量[57]牛背长肌(牛外脊) 37 16、28、90 W/cm2 20、40 90 W/cm2超声可有效抑制嗜温菌;28 W/cm2超声使肉4 ℃贮藏7 d期间嗜冷菌数量显著下降;超声也使大肠菌群数量在贮藏期间显著下降[58]鸡胸肉 40 9.6 W/cm2 30、50超声处理50 min可显著减少金黄色葡萄球菌和沙门氏菌属阳性样本(P<0.05);而30 min超声处理与对照组之间没有显著差异[59]新鲜猪肉 40 300 W 10、20、30初始鼠伤寒沙门氏菌和大肠杆菌数量分别约为(7.00±0.36)、(7.00±0.56)(lg(CFU/cm2)),超声处理后分别减少1.0~4.3、1.0~4.6(lg(CFU/cm2));且超声还可以减缓贮藏过程中细菌增长速度,30 min处理组效果最显著[60]鱼肉 30 51.41 W/L5、15、25、35、45超声45 min使油性鱼类(鲑鱼和鲭鱼)中嗜冷菌和中温菌数量分别减少1.5、1.1(lg(CFU/g)),白色鱼类(鳕鱼)仅减少0.5(lg(CFU/g))[61]肉制品五香牛肉 20 63.00、74.76、93.33 W/dm3 120对照组初始菌落总数为0.94(lg(CFU/g)),贮藏28 d时增加至4.71(lg(CFU/g));而超声组整个贮藏期间的菌落总数增加不显著[62]腌制牛肉 20 2.39、6.23、11.32、20.96 W/cm2 30、60、90、120当超声强度大于6.23 W/cm2时,处理30 min使大肠杆菌O157:H7数量至少减少1(lg(CFU/ mL));20.96 W/cm2超声120 min使蜡样芽孢杆菌数量显著减少1.48(lg(CFU/mL))[63]热狗香肠 25 200 W 10.53 超声处理抑制香肠贮藏40 d后的细菌生长;超声预处理可以延长香肠保质期 [64]生肉乳剂 20 200、250、300、350、400 W 1.0、2.5、5.0、7.5、10.0脉冲超声(400 W、7.56 s)处理生肉乳液10 min使德氏乳杆菌和单核细胞增生李斯特菌失活率达到60% [65]
除了生鲜肉类外,超声技术在抑制熟肉制品生产加工过程中/后期的微生物污染中的应用也得到了广泛的研究。Zhang Jian等[62]通过研究超声波辅助烹饪五香牛肉的冷藏品质得出,超声波可抑制微生物污染并减缓风味的恶化,减少贮藏过程中的脂肪氧化和蛋白质降解。超声技术还可以在牛肉的腌制过程中使盐水中的大肠杆菌O157:H7和蜡样芽孢杆菌失活[63],研究发现,空化产生的大量H2O2证实超声自由基反应可辅助微生物灭活,此外,超声处理可通过破坏微生物膜完整性达到抑制生物膜污染及抑菌效果。超声处理热狗香肠可延长保质期[64]。Aguilar等[65]证明,脉冲超声可显著抑制生肉乳剂(蛋白质、脂肪质量比0.5∶1.0)中天然微生物菌群的生物膜污染,由于微生物种类的不同其作用效果也存在差异,但是需要严格控制处理时间以避免在实际应用中造成肉及其制品质地和感官方面的劣变。
超声技术还可以作为一种辅助手段和其他杀菌方法(热处理、非热处理及化学杀菌剂)联用,在此基础上进一步提高杀菌强度和效率。例如,Li Jiao等[66]的研究表明,单独超声处理10 min会使金黄色葡萄球菌数量减少0.36(lg(CFU/mL)),弱酸性电解水(slightly acidic electrolyzed water,SAEW)处理10 min减少3.06(lg(CFU/mL)),而联合处理可减少3.68(lg(CFU/mL)),证明超声和SAEW对抑制金黄色葡萄球菌生物膜污染具有协同性。Guo Mingming等[67]证明百里香纳米乳液(0.375 mg/mL)联合超声技术(20 kHz、255 W/cm2、9 min)使大肠杆菌O157:H7数量减少(7.42±0.27)(lg(CFU/mL)),联合处理可显著增强细胞膜的通透性,改变细胞的形态和微观结构,导致更多内容物泄露,从而达到协同抑制生物膜的效果。Guo Liping等[68]研究表明,应用超声波(25 kHz、10 W/cm3)和30 mg/L次氯酸钠进行联合处理,在抑制大肠杆菌生物膜污染方面显示出协同增效作用。Evelyn等[69]先将牛肉泥进行热处理(95、100、105 ℃)后再进行超声(162 W),会加速产气荚膜梭状芽孢杆菌的失活。单独超声处理在抑制酶活性的同时导致生物膜结构被破坏,从而产生致死效应;而单独热处理一般会使能够产生生物膜的微生物处于亚致死损伤状态,不仅不能达到抑制生物膜污染的目的,还对食品品质有所影响[70]。而热-超声联合处理存在协同效应,首先,超声降低了微生物的耐热性,其次,在高于50 ℃的条件下微生物生物膜对超声更加敏感,通过减少亚致死细胞的数量,达到抑制微生物生物膜污染的目的[71]。超声技术与其他方法联用在肉及肉制品中的一些应用如表2所示。
超声技术除了直接应用于肉及肉制品本身外,在肉制品加工工厂中,对于去除加工设备或工具表面的生物膜以及废水处理也有着重要意义。Du Cezhi等[79]发现,超声浴(100 kHz、0.22 J/mm2)清洗抛光后的不锈钢316 L样品(长度10 mm、宽度10 mm、厚度2 mm)后,附着其上的金黄色葡萄球菌生物膜结构产生了一定程度的破坏,从而显著降低了其表面附着力。Brasil等[80]证明超声波可对屠宰牛的刀具进行有效清洁和消毒。此外,超声处理废水可以有效抑制潜在的生物膜形成[81],从而改善系统的使用寿命。除了用于抑制生物膜污染外,超声技术还广泛应用于肉及肉制品的嫩化[82]、乳化[83]、凝胶化[84],以及肉的冷冻[85]、解冻[86]和腌制[87]等加工过程中,改善肉及肉制品的品质。
表2 超声技术与其他方法联用在肉及肉制品中的抑菌作用
Table 2 Application of ultrasound technology in combination with other methods in sterilization of meat and meat products

研究对象 处理方法 相关参数 应用效果 参考文献猪肉 热处理+多频超声热处理温度80~90 ℃;热+单频超声(20 kHz、300 W、70 ℃);热+多频超声(20/40/60 kHz、300 W、70 ℃);时间5~25 min热+多频超声是灭活猪肉中蜡样芽孢杆菌效率最高的方法,与其他处理方法相比,5 min内使其显著减少4.16(lg(CFU/mL))[72]肉鸡胴体化学处理+真空+水共振超声化学处理(1 mg/mL氯化十六烷吡啶/0.1 mg/mL次氯酸钠、30 min);真空(-0.02 MPa、10 min);水共振超声(130 kHz、1 200 W、15 min)与单独浸入化学药品相比,真空、水共振超声结合1 mg/mL氯化十六烷吡啶或0.1 mg/mL次氯酸钠更有效显著降低了弯曲杆菌数量(1.0~1.6(lg(CFU/g)))[73]黄羽肉鸡 低温短时加热+超声低温短时加热温度55 ℃;超声(40 kHz、0.2 W/cm2);时间15 min初始菌落总数为2.39(lg(CFU/g)),低温短时加热+超声处理未检测到菌落总数,表明低温短时加热+超声可灭活细菌并显著延长货架期[74]鸡胸肉 SAEW+超声SAEW(500 mL/min、10 ℃);超声(25/130 kHz、230 W、28 W/L、10 min)与传统工艺相比,SAEW+超声具有更高的微生物灭活率,且不会加速鸡胸肉的脂质和蛋白质氧化[75]干腌火腿 超临界流体+超声25 MPa、46 ℃、10 min、8.5 mg/mL NaCl联合处理后大肠杆菌的失活程度最显著((3.62±0.20)(lg(CFU/g))),因此可用于延长干腌火腿的货架期,同时对产品质量影响较小[76]鲑鱼紫外线+酸性电解水+超声紫外线(254 nm、(10.3±0.3)W/cm2、5 min);酸性电解水(pH(2.6±0.2)),氯质量浓度(65±15) mg/L、1 min;超声(45 kHz、200 W、1 min)联合处理后,单核细胞增生李斯特菌数量显著减少;菌落总数降低0.64(lg(CFU/g)),同时对鱼肉质地没有显著影响[77]蟹肉压力+热+超声压力100 kPa;热处理35~95 ℃;超声(20 kHz、90 μm)压力+热+超声处理能够灭活形成孢子的细菌,并且具有协同效应 [78]
4.2 超声技术在肉及肉制品应用中的问题
尽管超声技术在肉及肉制品中已经有大量的应用和潜在的用途,但目前仍然存在一些问题。首先,目前对于超声设备的研究、选择、作用方式以及针对不同微生物生物膜和不同食品超声波的频率、功率强度、振幅和作用时间等关键参数的设定还未形成一个成熟体系,这些因素决定了微生物灭活的效率,后续需要做更多的工作和更深入的研究,使其效率升高同时拓宽其应用范围。其次,在某些条件下超声过程中产生的ROS和H2O2等活性物质会与不饱和脂肪酸发生反应,使脂肪部分氧化,所以在超声处理脂肪含量较高的肉类及其制品时有可能产生不良风味。例如,Kang Dacheng等[88]利用超声处理牛肉时,显著增强了牛肉中脂质和蛋白质的氧化,从而引起异味而导致质量下降。Gómez-Salazar等[89]利用超声(40 kHz、110 W)处理腌制兔肉诱发自由基等活性物质产生,加速了脂质或蛋白质的氧化。Alves等[90]利用超声(25 kHz、500 W、9 min)处理意大利腊肠后发现,超声加速脂质(过氧化值和硫代巴比妥酸反应物值)和蛋白质(巯基)的氧化,对意大利腊肠的品质产生不良影响。综上所述,虽然超声技术在应用于抑制微生物生物膜污染方面已经进行了大量的研究,且已经证明其有效性及商业应用的可能性,但要将此技术广泛应用于实际生产中时,仍存在许多需要解决的问题。
5 结 语
随着人民生活水平的不断提高和经济的改善以及科学技术的飞速发展,消费者对肉及肉制品的安全性提出了更高的要求。但目前,广泛使用的热杀菌和化学杀菌方法存在许多问题,主要表现在其会导致一定程度的营养流失、对产品质量和感官特性等会产生不良影响、易产生交叉抗性和健康风险等。许多研究指出,与传统的杀菌手段相比,超声技术具有操作简便、节约能源和安全清洁等优势,可以有效抑制微生物生物膜污染,同时在一定程度上改善传统杀菌方式对食品感官品质的不良影响,在食品行业中具有良好的应用前景。近年来,国内外有诸多研究报道了超声技术可以有效抑制肉及肉制品加工过程中的微生物膜污染。然而,就目前的研究现状而言,超声技术在肉制品杀菌中的应用仍面临着一些挑战。例如:目前仍未形成系统的超声抑菌体系,无法实现大规模的产业化应用;此外,由超声引发的促氧化因子(如ROS和H2O2)会催化自由基链式反应,这在肉及肉制品中会诱导一定程度的脂质氧化,同时还会产生一些不良风味,不利于产品品质。因此,在今后的研究中,需要对超声技术的工艺条件及各种参数进行优化,拓宽其应用范围,更加深入研究超声技术与其他杀菌工艺联用的作用效果,另外还应针对不同的工业需求设计和开发专用型超声波杀菌设备,以实现快速、高效、环境友好的工业化肉及肉制品等食品杀菌。
[1]CAMPANELLA O H.Heat treatment: principles and techniques[M].Salt Lake City: Academic Press, 2016: 316-327.DOI:10.1016/B978-0-12-384947-2.00371-8.
[2]AZOFEIFA G, QUESADA S, PEREZ A M, et al.Pasteurization of blackberry juice preserves polyphenol-dependent inhibition for lipid peroxidation and intracellular radicals[J].Journal of Food Composition and Analysis, 2015, 42: 56-62.DOI:10.1016/j.jfca.2015.01.015.
[3]ALEGBELEYE O O, GUIMARAES J T, CRUZ A G, et al.Hazards of a ‘healthy’ trend? An appraisal of the risks of raw milk consumption and the potential of novel treatment technologies to serve as alternatives to pasteurization[J].Trends in Food Science and Technology, 2018, 82: 148-166.DOI:10.1016/j.tifs.2018.10.007.
[4]HAUTE S V, LUO Yaguang, BOLTEN S, et al.Survival of Salmonella enterica and shifts in the culturable mesophilic aerobic bacterial community as impacted by tomato wash water particulate size and chlorine treatment[J].Food Microbiology, 2020, 90: 103470.DOI:10.1016/j.fm.2020.103470.
[5]SAGONG H G, LEE S Y, CHANG P S, et al.Combined effect of ultrasound and organic acids to reduce Escherichia coli O157:H7,Salmonella typhimurium, and Listeria monocytogenes on organic fresh lettuce[J].International Journal of Food Microbiology, 2011, 145(1):287-292.DOI:10.1016/j.ijfoodmicro.2011.01.010.
[6]GARCÍA-SÁNCHEZ L, MELERO B, JAIME I, et al.Biofilm formation, virulence and antimicrobial resistance of different Campylobacter jejuni isolates from a poultry slaughterhouse[J].Food Microbiology, 2019, 83: 193-199.DOI:10.1016/j.fm.2019.05.016.
[7]SHIRANI K, SHAHIDI F, MORTAZAVI S A.Investigation of decontamination effect of argon cold plasma on physicochemical and sensory properties of almond slices[J].International Journal of Food Microbiology, 2020, 335: 108892.DOI:10.1016/j.ijfoodmicro.2020.108892.
[8]MOHD OMAR A K, TENGKU NORSALWANI T L, ASMAH M S,et al.Implementation of the supercritical carbon dioxide technology in oil palm fresh fruits bunch sterilization: a review[J].Journal of CO2 Utilization, 2018, 25: 205-215.DOI:10.1016/j.jcou.2018.03.021.
[9]HUANG Kang, WRENN S, TIKEKAR R, et al.Efficacy of decontamination and a reduced risk of cross-contamination during ultrasound-assisted washing of fresh produce[J].Journal of Food Engineering, 2018, 224(5): 95-104.DOI:10.1016/j.jfoodeng.2017.11.043.
[10]COSTERTON J W.Microbial biofilms[J].Annual Review of Microbiology, 1995, 49(3): 711-745.DOI:10.5772/intechopen.90790.
[11]COSTERTON J W, IRVIN R T, CHENG K J.The bacterial glycocalyx in nature and disease[J].Annual Review of Microbiology,1981, 35(1): 299.DOI:10.1146/annurev.mi.35.100181.001503.
[12]HALL-STOODLEY L, COSTERTON J W, STOODLEY P.Bacterial biofilms: from the natural environment to infectious diseases[J].Nature Reviews Microbiology, 2004, 2(2): 95-108.DOI:10.1038/nrmicro821.
[13]ALONSO-CALLEJA C, GUERRERO-RAMOS E, ALONSOHERNANDO A, et al.Adaptation and cross-adaptation of Escherichia coli ATCC 12806 to several food-grade biocides[J].Food Control,2015, 56: 86-94.DOI:10.1016/j.foodcont.2015.03.01.
[14]CHEN B, ABDALLAH M, CAMPISTRON P, et al.Detection of biofilm formation by ultrasonic coda wave interferometry[J].Journal of Food Engineering, 2020, 290: 110219.DOI:10.1016/j.jfoodeng.2020.110219.
[15]ABEE T, KOVACS A T, KUIPERS O P, et al.Biofilm formation and dispersal in gram-positive bacteria[J].Current Opinion in Biotechnology,2010, 22(2): 172-179.DOI:10.1016/j.copbio.2010.10.016.
[16]WAGNER E M, PRACSER N, THALGUTER S, et al.Identification of biofilm hotspots in a meat processing environment: detection of spoilage bacteria in multi-species biofilms[J].International Journal of Food Microbiology, 2020, 328: 108668.DOI:10.1016/j.ijfoodmicro.2020.108668.
[17]SREY S, JAHID L K, HA S D.Biofilm formation in food industries:a food safety concern[J].Food Control, 2013, 31(2): 572-585.DOI:10.1016/j.foodcont.2012.12.001.
[18]YI Li, Dong Xiao, GRENIER D, et al.Research progress of bacterial quorum sensing receptors: classification, structure, function and characteristics[J].Science of The Total Environment, 2020, 763:143031.DOI:10.1016/j.scitotenv.2020.143031.
[19]STEPHENS K, BENTLEY W E.Synthetic biology for manipulating quorum sensing in microbial consortia[J].Trends in Microbiology,2020, 28(8): 633-643.DOI:10.1016/j.tim.2020.03.009.
[20]STOODLEY P, SAUER K, DAVIES D G, et al.Biofilms as complex differentiated communities[J].Annual Review of Microbiology, 2002,13: 228-233.DOI:10.1146/annurev.micro.56.012302.160705.
[21]ERHABOR C R, ERHABOR J O, MCGAW L J.The potential of South African medicinal plants against microbial biofilm and quorum sensing of foodborne pathogens: a review[J].South African Journal of Botany, 2019, 126: 214-231.DOI:10.1016/j.sajb.2019.07.024.
[22]SADEKUZZAMAN M, YANG S, MIZAN M F R, et al.Current and recent advanced strategies for combating biofilms[J].Comprehensive Reviews in Food Science and Food Safety, 2015, 14(4): 491-509.DOI:10.1111/1541-4337.12144.
[23]WOOD R W, LOOMIS A L.The physical and biological effects of high-frequency sound-waves of great intensity[J].The London,Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 1928, 4(22): 417-436.DOI:10.1080/14786440908564348.
[24]CAO Xiaohuang, ZHANG Min, MUJUMDAR A S, et al.Effects of ultrasonic pretreatments on quality, energy consumption and sterilization of barley grass in freeze drying[J].Ultrasonics Sonochemistry,2018, 40: 333-340.DOI:10.1016/j.ultsonch.2017.06.014.
[25]PARK J S, HA J W.Ultrasound treatment combined with fumaric acid for inactivating food-borne pathogens in apple juice and its mechanisms[J].Food Microbiology, 2019, 84: 103277.DOI:10.1016/j.fm.2019.103277.
[26]WANG Jingyi, LIU Qiudou, XIE Bijun, et al.Effect of ultrasound combined with ultraviolet treatment on microbial inactivation and quality properties of mango juice[J].Ultrasonics Sonochemistry, 2020,64: 1350-4177.DOI:10.1016/j.ultsonch.2020.105000.
[27]CAECEL J A, GARCIA-PEREZ J V, BENEDITO J, et al.Food process innovation through new technologies: use of ultrasound[J].Journal of Food Engineering, 2012, 110(2): 200-207.DOI:10.1016/j.jfoodeng.2011.05.038.
[28]HERCEG Z, MARKOV K, SALAMON B S, et al.Effect of high intensity ultrasound treatment on the growth of food spoilage bacteria[J].Food Technology and Biotechnology, 2013, 51(3):352-359.DOI:10.1016/j.biortech.2013.04.021.
[29]KENTISH S, ASHOKKUMAR M.The physical and chemical effects of ultrasound[M].New York: Springer, 2001: 233-240.DOI:10.1007/978-1-4419-7472-3_1.
[30]BHARGAVA N, MOR R S, KUMAR K, et al.Advances in application of ultrasound in food processing: a review[J].Ultrasonics Sonochemistry, 2020, 70: 105293.DOI:10.1016/j.ultsonch.2020.105293.
[31]FU Xizhe, BELWAL T, CRAVOTTO G, et al.Sono-physical and sono-chemical effects of ultrasound: primary applications in extraction and freezing operations and influence on food components[J].Ultrasonics Sonochemistry, 2019, 60: 104726.DOI:10.1016/j.ultsonch.2019.104726.
[32]ZUPANC M, PANDUR Z, PERDIH T S, et al.Effects of cavitation on different microorganisms: the current understanding of the mechanisms taking place behind the phenomenon.A review and proposals for further research[J].Ultrasonics Sonochemistry, 2019, 57:147-165.DOI:10.1016/j.ultsonch.2019.05.009.
[33]BARBA F J, KOUBAA M, PRADO-SILVA L D, et al.Mild processing applied to the inactivation of the main foodborne bacterial pathogens: a review[J].Trends in Food Science and Technology, 2017,66: 20-35.DOI:10.1016/j.tifs.2017.05.011.
[34]GIELEN B, JORDENS J, JANSSEN J, et al.Characterization of stable and transient cavitation bubbles in a milliflow reactor using a multibubble sonoluminescence quenching technique[J].Ultrasonics Sonochemistry, 2015, 25(1): 31-39.DOI:10.1016/j.ultsonch.2014.08.013.
[35]CRUM L A.Acoustic cavitation series: part five rectified diffusion[J].Ultrasonics, 1984, 22: 215-223.DOI:10.1016/0041-624X(84)90016-7.
[36]SUSLICK K S, FLANNIGAN D J.Inside a collapsing bubble:sonoluminescence and the conditions during cavitation[J].Annual Review of Physical Chemistry, 2008, 59(1): 659-683.DOI:10.1146/annurev.physchem.59.032607.093739.
[37]YE Linzheng, ZHU Xijing, LIU Yao.Numerical study on dualfrequency ultrasonic enhancing cavitation effect based on bubble dynamic evolution[J].Ultrasonics Sonochemistry, 2019, 59: 104744.DOI:10.1016/j.ultsonch.2019.104744.
[38]LUTHER S, METTIN R, KOCH P, et al.Observation of acoustic cavitation bubbles at 2 250 frames per second[J].Ultrasonics Sonochemistry, 2001, 8(3): 159-162.DOI:10.1016/S1350-4177(01)00073-6.
[39]SAOJOSE J F B D, ANDRADE N J D, RAMOS A M, et al.Decontamination by ultrasound application in fresh fruits and vegetables[J].Food Control, 2014, 45: 36-50.DOI:10.1016/j.foodcont.2014.04.015.
[40]MUTHUKUMARAN S, KENTISH S E, STEVENS G W, et al.Application of ultrasound in membrane separation processes: a review[J].Reviews in Chemical Engineering, 2006, 22(3): 155-194.DOI:10.1515/REVCE.2006.22.3.155.
[41]ASHOKKUMAR M.The characterization of acoustic cavitation bubbles:an overview[J].Ultrasonics Sonochemistry, 2011, 18(4): 864-872.DOI:10.1016/j.ultsonch.2010.11.016.
[42]MCDONNEL G, RUSSELL A D.Antiseptics and disinfectants:activity, action, and resistance[J].Clinical Microbiology Reviews,1999, 12(1): 147-179.DOI:10.1128/CMR.12.1.147.
[43]GAGOL M, PRZYJAZNY A, BOCZKAJ G.Wastewater treatment by means of advanced oxidation processes based on cavitation:a review[J].Chemical Engineering Journal, 2018, 338: 599-627.DOI:10.1016/j.cej.2018.01.049.
[44]YUSOF N S M, BABGI B, ALAHAMDI Y, et al.Physical and chemical effects of acoustic cavitation in selected ultrasonic cleaning applications[J].Ultrasonics Sonochemistry, 2015, 29: 568-576.DOI:10.1016/j.ultsonch.2015.06.013.
[45]DAI Jinming, BAI Mei, LI Changzhu, et al.Advances in the mechanism of different antibacterial strategies based on ultrasound technique for controlling bacterial contamination in food industry[J].Trends in Food science and Technology, 2020, 105: 211-222.DOI:10.1016/j.tifs.2020.09.016.
[46]PFLIEGER R, NIKITENKO S, CAIROS C, et al.Characterization of cavitation bubbles and sonoluminescence[M].New York: Springer Nature, 2019.DOI:10.1007/978-3-030-11717-7.
[47]HUANG Guoping, CHEN Suwan, DAI Cunhua, et al.Effects of ultrasound on microbial growth and enzyme activity[J].Ultrasonics Sonochemistry, 2016, 37: 144-149.DOI:10.1016/j.ultsonch.2016.12.018.
[48]JAMBRAK A R, ŠIMUNEK M, EVACIC S, et al.Influence of high power ultrasound on selected moulds, yeasts and Alicyclobacillus acidoterrestris in apple, cranberry and blueberry juice and nectar[J].Ultrasonics, 2018, 83: 3-17.DOI:10.1016/j.ultras.2017.02.011.
[49]MEROUANI S, HAMDAOUI O, REZGUI Y, et al.Effects of ultrasound frequency and acoustic amplitude on the size of sonochemically active bubbles: theoretical study[J].Ultrasonics Sonochemistry, 2013, 20(3): 815-819.DOI:10.1016/j.ultsonch.2012.10.015.
[50]WOOD R J, LEE J, BUSSEMAKER M J.A parametric review of sonochemistry: control and augmentation of sonochemical activity in aqueous solutions[J].Ultrasonics Sonochemistry, 2017, 38: 351-370.DOI:10.1016/j.ultsonch.2017.03.030.
[51]MANMI K, WANG Qianxi.Acoustic microbubble dynamics with viscous effects[J].Ultrasonics Sonochemistry, 2017, 36: 427-436.DOI:10.1016/j.ultsonch.2016.11.032.
[52]MUTHUKUMARAN S, KENTISH S, ASHOKKUMAR M, et al.Potential uses of ultrasound in the dairy ultrafiltration processes[J].The Journal of the Acoustical Society of America, 2008, 123(5): 3046.DOI:10.1121/1.2932742.
[53]ZEVNIK J, DULAR M.Cavitation bubble interaction with a rigid spherical particle on a microscale[J].Ultrasonics Sonochemistry, 2020,69: 105252.DOI:10.1016/j.ultsonch.2020.105252.
[54]SU Kunpeng, WU Jianhua, XIA Dingkang.Classification of regimes determining ultrasonic cavitation erosion in solid particle suspensions[J].Ultrasonics Sonochemistry, 2020, 68: 105214.DOI:10.1016/j.ultsonch.2020.105214.
[55]OJHA K S, HARRISON S M, BRUNTON N P, et al.Statistical approaches to access the effect of Lactobacillus sakei culture and ultrasound frequency on fatty acid profile of beef jerky[J].Journal of Food Composition and Analysis, 2017, 57: 1-7.DOI:10.1016/j.jfca.2016.12.007.
[56]CHEMAT F, HUMA Z E, KHAN M K.Applications of ultrasound in food technology: processing, preservation and extraction[J].Ultrasonics Sonochemistry, 2010, 18(4): 813-835.DOI:10.1016/j.ultsonch.2010.11.023.
[57]CARAVEO O, ALARCON-ROJO A D, RENTERIA A, et al.Physicochemical and microbiological characteristics of beef treated with high-intensity ultrasound and stored at 4 ℃[J].Journal of the Science of Food and Agriculture, 2015, 95(12): 2487-2493.DOI:10.1002/jsfa.6979.
[58]CARRILLO-LOPEZ L M, HUERTA-JIMENEZ M, GARCIAGALICIA L A, et al.Bacterial control and structural and physicochemical modification of bovine Longissimus dorsi by ultrasound[J].Ultrasonics Sonochemistry, 2019, 58: 104608.DOI:10.1016/j.ultsonch.2019.05.025.
[59]PINON M L, ALARCON-ROJO A D, RENTERIA A L, et al.Microbiological properties of poultry breast meat treated with highintensity ultrasound[J].Ultrasonics, 2020, 102: 105680.DOI:10.1016/j.ultras.2018.01.001.
[60]BONAH E, HUANG Xingyi, YANG Hongying, et al.Nondestructive monitoring, kinetics and antimicrobial properties of ultrasound technology applied for surface decontamination of bacterial foodborne pathogen in pork[J].Ultrasonics Sonochemistry, 2021, 70: 105344.DOI:10.1016/j.ultsonch.2020.105344.
[61]PEDROS-GARRIDO S, CODON-ABANTO S, BELTRAN J A, et al.Assessment of high intensity ultrasound for surface decontamination of salmon (S.salar), mackerel (S.scombrus), cod (G.morhua)and hake (M.merluccius) fillets, and its impact on fish quality[J].Innovative Food Science and Emerging Technologies, 2017, 41: 64-70.DOI:10.1016/j.ifset.2017.02.006.
[62]ZHANG Jian, ZHANG Yuqin, ZOU Yunhe, et al.Effects of ultrasound-assisted cooking on quality characteristics of spiced beef during cold storage[J].LWT-Food Science and Technology, 2021,136: 110359.DOI:10.1016/j.lwt.2020.110359.
[63]KANG Dacheng, JIANG Yuhe, XING Lujuan, et al.Inactivation of Escherichia coli O157:H7 and Bacillus cereus by power ultrasound during the curing processing in brining liquid and beef[J].Food Research International, 2017, 102: 717-727.DOI:10.1016/j.foodres.2017.09.062.
[64]CICHOSKI A J, RAMPELOTTO C, SILVA M S, et al.Ultrasoundassisted post-packaging pasteurization of sausages[J].Innovative Food Science and Emerging Technologies, 2015, 30: 132-137.DOI:10.1016/j.ifset.2015.04.011.
[65]AGUILAR C, SERNA-JIMENEZ J, BENITEZ E, et al.Influence of high power ultrasound on natural microflora, pathogen and lactic acid bacteria in a raw meat emulsion[J].Ultrasonics Sonochemistry, 2021,72: 105415.DOI:10.1016/j.ultsonch.2020.105415.
[66]LI Jiao, DING Tian, LIAO Xinyu, et al.Synergetic effects of ultrasound and slightly acidic electrolyzed water against Staphylococcus aureus evaluated by flow cytometry and electron microscopy[J].Ultrasonics Sonochemistry, 2016, 38: 711-719.DOI:10.1016/j.ultsonch.2016.08.029.
[67]GUO Mingming, ZHANG Lianjiao, HE Qiao, et al.Synergistic antibacterial effects of ultrasound and thyme essential oils nanoemulsion against Escherichia coli O157:H7[J].Ultrasonics Sonochemistry, 2020, 66: 104988.DOI:10.1016/j.ultsonch.2020.104988.
[68]GUO Liping, SUN Yongcai, ZHU Yinglian, The antibacterial mechanism of ultrasound in combination with sodium hypochlorite in the control of Escherichia coli[J].Food Research International, 2020,129: 108887.DOI:10.1016/j.foodres.2019.108887.
[69]EVELYN, SILVA F V M.Use of power ultrasound to enhance the thermal inactivation of Clostridium perfringens spores in beef slurry[J].International Journal of Food Microbiology, 2015, 206: 17-23.DOI:10.1016/j.ijfoodmicro.2015.04.013.
[70]LI Jiao, SUO Yuanjie, LIAO Xinyu, et al.Analysis of Staphylococcus aureus cell viability, sublethal injury and death induced by synergistic combination of ultrasound and mild heat[J].Ultrasonics Sonochemistry, 2017, 39: 101-110.DOI:10.1016/j.ultsonch.2017.04.019.
[71]HEN Fengying, ZHANG Min, YANG Chaohui.Application of ultrasound technology in processing of ready-to-eat fresh food:a review[J].Ultrasonics Sonochemistry, 2020, 63: 104953.DOI:10.1016/j.ultsonch.2019.104953.
[72]OWUSU-ANSAH P, YU Xiaojie, OSAE R, et al.Inactivation of Bacillus cereus from pork by thermal, non-thermal and singlefrequency/multi-frequency thermosonication: modelling and effects on physicochemical properties[J].LWT-Food Science and Technology,2020, 133: 109939.DOI:10.1016/j.lwt.2020.109939.
[73]VETCHAPITAK T, SHINKI T, SASAKI S, et al.Evaluation of chemical treatment combined with vacuum and ultrasonication with a water resonance system for reducing Campylobacter on naturally contaminated chicken carcasses[J].Food Control, 2020, 112: 107087.DOI:10.1016/j.foodcont.2020.107087.
[74]LI Pengpeng, SUN Liangge, WANG Jiankang, et al.Effects of combined ultrasound and low-temperature short-time heating pretreatment on proteases inactivation and textural quality of meat of yellow-feathered chickens[J].Food Chemistry, 2021, 355: 129645.DOI:10.1016/j.foodchem.2021.129645.
[75]CICHOSKI A J, FLORES D R M, MENEZES C R D, et al.Ultrasound and slightly acid electrolyzed water application: an efficient combination to reduce the bacterial counts of chicken breast during pre-chilling[J].International Journal of Food Microbiology,2019, 301: 27-33.DOI:10.1016/j.ijfoodmicro.2019.05.004.
[76]CASTILLO-ZAMUDIO R I, PANIAGUA-MARTINEZ I, ORTUNOCASES C, et al.Use of high-power ultrasound combined with supercritical fluids for microbial inactivation in dry-cured ham[J].Innovative Food Science and Emerging Technologies, 2021, 67:102557.DOI:10.1016/j.ifset.2020.102557.
[77]MIKS-KRAJNIK M, FENG L X J, BANG W S, et al.Inactivation of Listeria monocytogenes and natural microbiota on raw salmon fillets using acidic electrolyzed water, ultraviolet light or/and ultrasounds[J].Food Control, 2017, 74: 54-60.DOI:10.1016/j.foodcont.2016.11.033.
[78]CONDON-ABANTO S, ARROYO C, ALVAREZ I, et al.Application of ultrasound in combination with heat and pressure for the inactivation of spore forming bacteria isolated from edible crab (Cancer pagurus)[J].International Journal of Food Microbiology, 2016, 223:9-16.DOI:10.1016/j.ijfoodmicro.2016.02.001.
[79]DU Cezhi, WANG Chengyong, SUI Jiaobo, et al.Enhancing Staphylococcus aureus sterilization of stainless steel by the synergistic effect of surface structure and physical washing[J].Colloids and Surfaces B: Biointerfaces, 2021, 197: 111393.DOI:10.1016/j.colsurfb.2020.111393.
[80]BRASIL C C B, BARIN B J S, JACOB-LOPES E, et al.Single step non-thermal cleaning/sanitation of knives used in meat industry with ultrasound[J].Food Research International, 2017, 91: 133-139.DOI:10.1016/j.foodres.2016.11.030.
[81]RODRIGUEZ-CALVO A, GONZALEZ-LOPEZ J, RUIZ L M, et al.Effect of ultrasonic frequency on the bacterial community structure during biofouling formation in microfiltration membrane bioreactors for wastewater treatment[J].International Biodeterioration and Biodegradation, 2020, 155: 105102.DOI:10.1016/j.ibiod.2020.105102.
[82]SHI Haibo, ZHANG Xinxiao, CHEN Xiao, et al.How ultrasound combined with potassium alginate marination tenderizes old chicken breast meat: possible mechanisms from tissue to protein[J].Food Chemistry, 2020, 328: 127144.DOI:10.1016/j.foodchem.2020.127144.
[83]CHEN Jiahui, ZHANG Xing, XUE Siwen, et al.Effects of ultrasound frequency mode on myofibrillar protein structure and emulsifying properties[J].International Journal of Biological Macromolecules,2020, 163: 1768-1779.DOI:10.1016/j.ijbiomac.2020.09.114.
[84]ZHANG Chao, LIU Haotian, XIA Xiufang, et al.Effect of ultrasoundassisted immersion thawing on emulsifying and gelling properties of chicken myofibrillar protein[J].LWT-Food Science and Technology,2020, 142: 111016.DOI:10.1016/j.lwt.2021.111016.
[85]ZHENG Liyun, SUN Dawen.Innovative applications of power ultrasound during food freezing processes: a review[J].Trends in Food Science and Technology, 2006, 17(1): 16-23.DOI:10.1016/j.tifs.2005.08.010.
[86]SUN Qinxiu, KONG Baohua, LIU Shucheng, et al.Ultrasoundassisted thawing accelerates the thawing of common carp (Cyprinus carpio) and improves its muscle quality[J].LWT-Food Science and Technology, 2021, 141: 111080.DOI:10.1016/j.lwt.2021.111080.
[87]CONTRERAS M, BENEDITO J, GARCIA-PEREZ J V.Ultrasonic characterization of salt, moisture and texture modifications in drycured ham during post-salting[J].Meat Science, 2021, 172: 108356.DOI:10.1016/j.meatsci.2020.108356.
[88]KANG Dacheng, ZOU Yunhe, CHENG Yuping, et al.Effects of power ultrasound on oxidation and structure of beef proteins during curing processing[J].Ultrasonics Sonochemistry, 2016, 33: 47-53.DOI:10.1016/j.ultsonch.2016.04.024.
[89]GOMEZ-SALAZAR J A, OCHOA-MONTES D A, CERON-GARCIA A, et al.Effect of acid marination assisted by power ultrasound on the quality of rabbit meat[J].Journal of Food Quality, 2018, 2018: 1-6.DOI:10.1155/2018/5754930.
[90]ALVES L D L, SILVA M S D, FLORES D R M, et al.Effect of ultrasound on the physicochemical and microbiological characteristics of Italian salami[J].Food Research International, 2018, 106: 363-373.DOI:10.1016/j.foodres.2017.12.074.