大河乌猪因其肉质好、营养丰富、风味独特而闻名[1-2]。大河乌猪火腿是采用新鲜后腿为原料,经预冷排酸、上盐腌制、脱水平衡、挂晒发酵等工序,在自然条件下加工而成;另外,其产地云南省富源县气候湿润、相对湿度较大、雨热同季,与其他产地存在较大差异,因此风味特征与其他产地的火腿相比存在特殊性。
糖酵解、内源酶作用、脂肪氧化、硫胺素降解、蛋白质水解、美拉德反应及微生物作用等是火腿产生挥发性风味物质的主要途径[3]。研究表明,各产地的火腿风味品质受猪品种、产地气候条件、加工工艺、贮藏方式等因素的影响[4-7]。为了解火腿的风味品质,有学者采用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术进行研究[8];目前食品领域比较常见的多元统计方法,如主成分分析(principal component analysis,PCA)、偏最小二乘-判别分析(partial least squares-discriminant analysis,PLS-DA),广泛应用于代谢组学[9-11]和风味组学[12]的研究中。童红甘等[13]采用GC-MS结合多元统计分析方法探究不同地区板鸭风味差异。
目前,对云南富源大河乌猪火腿的加工工艺及风味的研究报道较少。为此,本研究以6 个不同发酵时间的大河乌猪火腿为研究对象,采用固相微萃取(solid phase microextraction,SPME)-GC-MS对挥发性风味物质进行鉴定。结合PCA、PLS-DA多元统计分析方法分析不同发酵时间大河乌猪火腿挥发性风味的差异,旨在研究并区分大河乌猪火腿发酵过程中挥发性风味物质的变化。
1 材料与方法
1.1 材料与试剂
大河乌猪火腿(质量(10±1) kg)由云南东恒经贸集团有限公司提供。
甲醇(色谱纯) 美国Sigma公司。
1.2 仪器与设备
7890A-5975C GC-MS仪 美国Agilent公司;SPME萃取头(50/30 μm DVB/CAR/PDMS) 美国Supelco公司。
1.3 方法
1.3.1 大河乌猪干腌火腿的生产
大河乌猪新鲜后腿((10±1) kg)→预冷排酸((3±1) ℃、相对湿度85%~90%,室内冷凉18 h以上)→修割整形→低温上盐腌制(采用上盐堆码干腌腌制,按每只鲜腿质量的5.5%称取食盐,再按食盐总质量50%、30%、20%的比例,分别在第1、3、15天搓揉上盐并翻堆后堆码腌制,(3±1) ℃、相对湿度85%,腌制时间18 d)→中温脱水平衡((6±1) ℃、相对湿度75%~80%,60 d)→高温发酵产香(晾挂于室内,自然发酵)→质检→成品
1.3.2 火腿采样
在172 只大河乌猪火腿的6 个发酵阶段(90、150、210、270、450、630 d)随机从每个发酵阶段抽取4 只火腿样品,共计24 只(样品编号记为1~24),取半膜肌和股二头肌,混合,真空包装并保存在-20 ℃。
1.3.3 SPME-GC-MS条件
SPME条件:参照Huan Yanjun等[14]的方法,称取已搅碎的肉样5.00 g于20 mL顶空瓶中,将老化后的萃取头插入顶空瓶上部,50 ℃吸附40 min,210 ℃解吸5 min。
GC条件:参照高韶婷等[15]的方法,略做修改。色谱柱:DB-5 MS毛细管色谱柱(30 m×0.25 mm,0.25 µm);升温程序:40 ℃保持5 min,以5 ℃/min升至90 ℃,再以12 ℃/min升至250 ℃并保持7 min;载气He(纯度≥99.999%);流速1.0 mL/min;进样口温度250 ℃;进样量0.5 µL;分流比1∶30。
MS条件:传输线温度280 ℃,电子轰击离子源,离子源温度230 ℃,四极杆温度150 ℃,电子能量70 eV,数据采集模式为全扫描(Scan),质量扫描范围50~450 u。
1.3.4 挥发性风味物质的鉴定及定量
挥发性物质的定性:挥发性化合物利用NIST08.L谱库的标准质谱图对得到的谱图数据进行串联检索和人工解析,获得未知化合物与质谱库中已知化合物的匹配度,匹配度大于80%即初步确定未知物为该物质。
挥发性物质的定量:采用峰面积归一化法[16]。
1.4 数据处理
采用Excel 2019软件进行数据处理,SIMCA 14.1软件绘图。结果用平均值±标准差表示。
2 结果与分析
2.1 大河乌猪火腿发酵过程中挥发性风味物质测定结果
表1 大河乌猪火腿发酵过程中挥发性风味物质组成
Table 1 Volatile flavor compounds identified during the fermentation of Dahe black pig ham
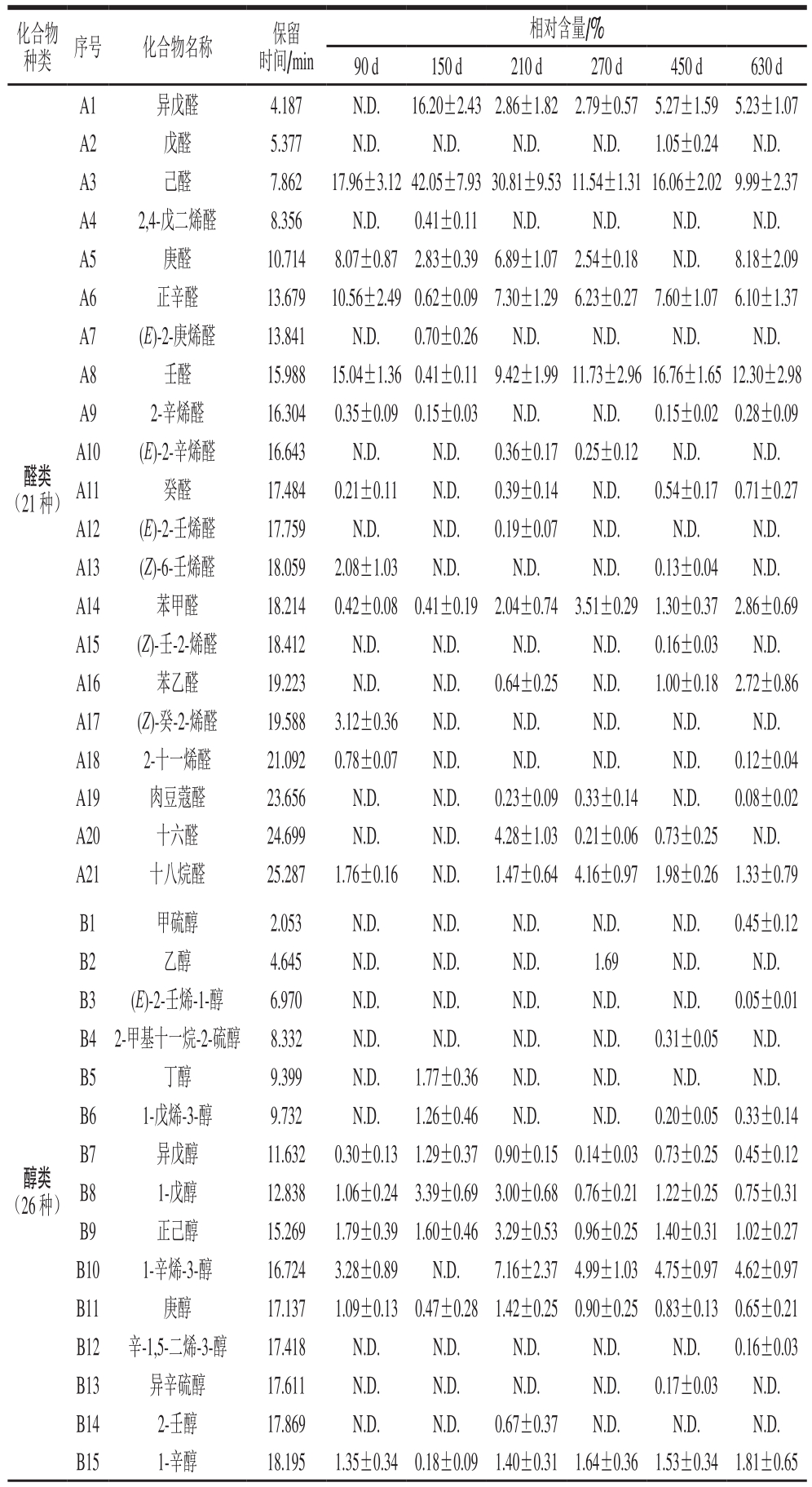
化合物种类 序号 化合物名称 保留时间/min相对含量/%90 d 150 d 210 d 270 d 450 d 630 d醛类(21 种)A1 异戊醛 4.187 N.D.16.20±2.432.86±1.82 2.79±0.57 5.27±1.59 5.23±1.07 A2 戊醛 5.377 N.D.N.D.N.D.N.D.1.05±0.24 N.D.A3 己醛 7.862 17.96±3.1242.05±7.9330.81±9.5311.54±1.3116.06±2.029.99±2.37 A4 2,4-戊二烯醛 8.356 N.D.0.41±0.11 N.D.N.D.N.D.N.D.A5 庚醛 10.714 8.07±0.87 2.83±0.39 6.89±1.07 2.54±0.18 N.D.8.18±2.09 A6 正辛醛 13.679 10.56±2.490.62±0.097.30±1.296.23±0.277.60±1.076.10±1.37 A7 (E)-2-庚烯醛 13.841 N.D.0.70±0.26 N.D.N.D.N.D.N.D.A8 壬醛 15.988 15.04±1.360.41±0.11 9.42±1.9911.73±2.9616.76±1.6512.30±2.98 A9 2-辛烯醛 16.304 0.35±0.09 0.15±0.03 N.D.N.D.0.15±0.02 0.28±0.09 A10 (E)-2-辛烯醛 16.643 N.D.N.D.0.36±0.170.25±0.12 N.D.N.D.A11 癸醛 17.484 0.21±0.11 N.D.0.39±0.14 N.D.0.54±0.17 0.71±0.27 A12 (E)-2-壬烯醛 17.759 N.D.N.D.0.19±0.07 N.D.N.D.N.D.A13 (Z)-6-壬烯醛 18.059 2.08±1.03 N.D.N.D.N.D.0.13±0.04 N.D.A14 苯甲醛 18.214 0.42±0.080.41±0.192.04±0.743.51±0.291.30±0.372.86±0.69 A15 (Z)-壬-2-烯醛 18.412 N.D.N.D.N.D.N.D.0.16±0.03 N.D.A16 苯乙醛 19.223 N.D.N.D.0.64±0.25 N.D.1.00±0.18 2.72±0.86 A17 (Z)-癸-2-烯醛 19.588 3.12±0.36 N.D.N.D.N.D.N.D.N.D.A18 2-十一烯醛 21.092 0.78±0.07 N.D.N.D.N.D.N.D.0.12±0.04 A19 肉豆蔻醛 23.656 N.D.N.D.0.23±0.09 0.33±0.14 N.D.0.08±0.02 A20 十六醛 24.699 N.D.N.D.4.28±1.03 0.21±0.06 0.73±0.25 N.D.A21 十八烷醛 25.287 1.76±0.16 N.D.1.47±0.644.16±0.971.98±0.261.33±0.79醇类(26 种)B1 甲硫醇 2.053 N.D.N.D.N.D.N.D.N.D.0.45±0.12 B2 乙醇 4.645 N.D.N.D.N.D.1.69 N.D.N.D.B3 (E)-2-壬烯-1-醇 6.970 N.D.N.D.N.D.N.D.N.D.0.05±0.01 B4 2-甲基十一烷-2-硫醇 8.332 N.D.N.D.N.D.N.D.0.31±0.05 N.D.B5 丁醇 9.399 N.D.1.77±0.36 N.D.N.D.N.D.N.D.B6 1-戊烯-3-醇 9.732 N.D.1.26±0.46 N.D.N.D.0.20±0.05 0.33±0.14 B7 异戊醇 11.632 0.30±0.13 1.29±0.37 0.90±0.15 0.14±0.03 0.73±0.25 0.45±0.12 B8 1-戊醇 12.838 1.06±0.24 3.39±0.69 3.00±0.68 0.76±0.21 1.22±0.25 0.75±0.31 B9 正己醇 15.269 1.79±0.39 1.60±0.46 3.29±0.53 0.96±0.25 1.40±0.31 1.02±0.27 B10 1-辛烯-3-醇 16.724 3.28±0.89 N.D.7.16±2.37 4.99±1.03 4.75±0.97 4.62±0.97 B11 庚醇 17.137 1.09±0.13 0.47±0.28 1.42±0.25 0.90±0.25 0.83±0.13 0.65±0.21 B12 辛-1,5-二烯-3-醇 17.418 N.D.N.D.N.D.N.D.N.D.0.16±0.03 B13 异辛硫醇 17.611 N.D.N.D.N.D.N.D.0.17±0.03 N.D.B14 2-壬醇 17.869 N.D.N.D.0.67±0.37 N.D.N.D.N.D.B15 1-辛醇 18.195 1.35±0.34 0.18±0.09 1.40±0.31 1.64±0.36 1.53±0.34 1.81±0.65
续表1
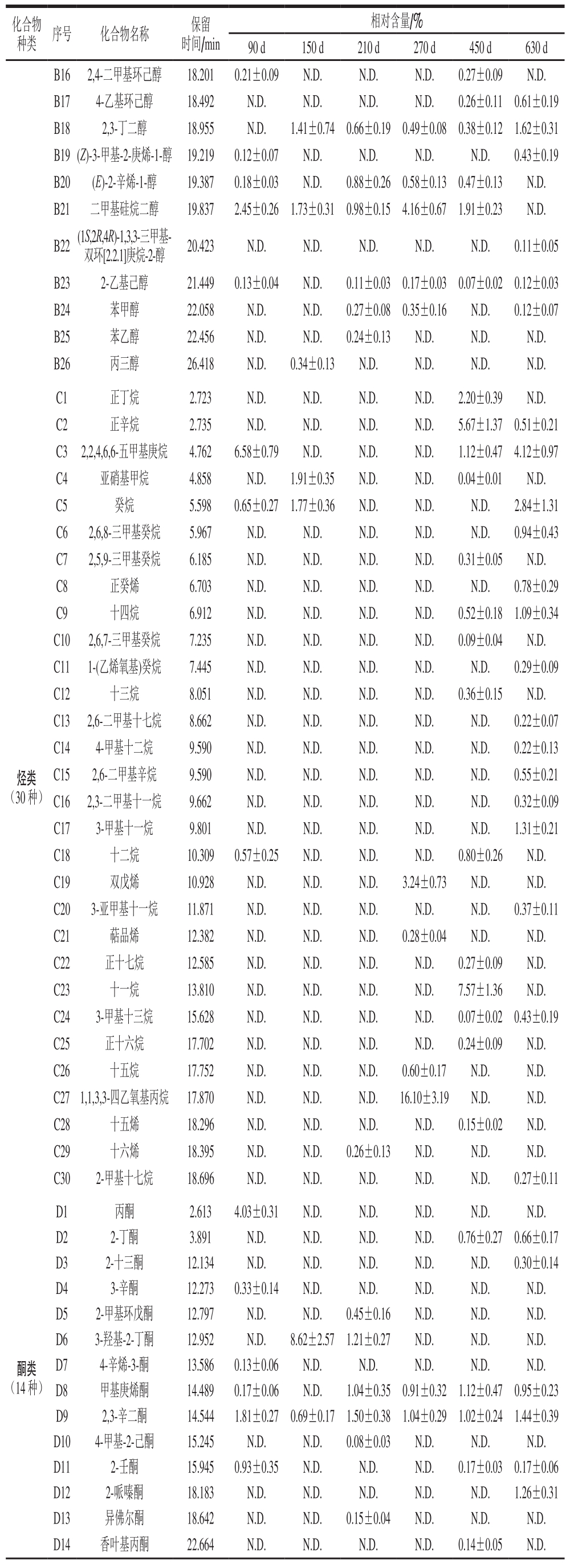
化合物种类 序号 化合物名称 保留时间/min相对含量/%90 d 150 d 210 d 270 d 450 d 630 d B16 2,4-二甲基环己醇 18.201 0.21±0.09 N.D.N.D.N.D.0.27±0.09 N.D.B17 4-乙基环己醇 18.492 N.D.N.D.N.D.N.D.0.26±0.11 0.61±0.19 B18 2,3-丁二醇 18.955 N.D.1.41±0.74 0.66±0.19 0.49±0.08 0.38±0.12 1.62±0.31 B19(Z)-3-甲基-2-庚烯-1-醇 19.219 0.12±0.07 N.D.N.D.N.D.N.D.0.43±0.19 B20 (E)-2-辛烯-1-醇 19.387 0.18±0.03 N.D.0.88±0.26 0.58±0.13 0.47±0.13 N.D.B21 二甲基硅烷二醇 19.837 2.45±0.26 1.73±0.31 0.98±0.15 4.16±0.67 1.91±0.23 N.D.B22(1S,2R,4R)-1,3,3-三甲基-双环[2.2.1]庚烷-2-醇 20.423 N.D.N.D.N.D.N.D.N.D.0.11±0.05 B23 2-乙基己醇 21.449 0.13±0.04 N.D.0.11±0.03 0.17±0.03 0.07±0.02 0.12±0.03 B24 苯甲醇 22.058 N.D.N.D.0.27±0.080.35±0.16 N.D.0.12±0.07 B25 苯乙醇 22.456 N.D.N.D.0.24±0.13 N.D.N.D.N.D.B26 丙三醇 26.418 N.D.0.34±0.13 N.D.N.D.N.D.N.D.烃类(30 种)C1 正丁烷 2.723 N.D.N.D.N.D.N.D.2.20±0.39 N.D.C2 正辛烷 2.735 N.D.N.D.N.D.N.D.5.67±1.37 0.51±0.21 C3 2,2,4,6,6-五甲基庚烷 4.762 6.58±0.79 N.D.N.D.N.D.1.12±0.47 4.12±0.97 C4 亚硝基甲烷 4.858 N.D.1.91±0.35 N.D.N.D.0.04±0.01 N.D.C5 癸烷 5.598 0.65±0.27 1.77±0.36 N.D.N.D.N.D.2.84±1.31 C6 2,6,8-三甲基癸烷 5.967 N.D.N.D.N.D.N.D.N.D.0.94±0.43 C7 2,5,9-三甲基癸烷 6.185 N.D.N.D.N.D.N.D.0.31±0.05 N.D.C8 正癸烯 6.703 N.D.N.D.N.D.N.D.N.D.0.78±0.29 C9 十四烷 6.912 N.D.N.D.N.D.N.D.0.52±0.18 1.09±0.34 C10 2,6,7-三甲基癸烷 7.235 N.D.N.D.N.D.N.D.0.09±0.04 N.D.C11 1-(乙烯氧基)癸烷 7.445 N.D.N.D.N.D.N.D.N.D.0.29±0.09 C12 十三烷 8.051 N.D.N.D.N.D.N.D.0.36±0.15 N.D.C13 2,6-二甲基十七烷 8.662 N.D.N.D.N.D.N.D.N.D.0.22±0.07 C14 4-甲基十二烷 9.590 N.D.N.D.N.D.N.D.N.D.0.22±0.13 C15 2,6-二甲基辛烷 9.590 N.D.N.D.N.D.N.D.N.D.0.55±0.21 C16 2,3-二甲基十一烷 9.662 N.D.N.D.N.D.N.D.N.D.0.32±0.09 C17 3-甲基十一烷 9.801 N.D.N.D.N.D.N.D.N.D.1.31±0.21 C18 十二烷 10.309 0.57±0.25 N.D.N.D.N.D.0.80±0.26 N.D.C19 双戊烯 10.928 N.D.N.D.N.D.3.24±0.73 N.D.N.D.C20 3-亚甲基十一烷 11.871 N.D.N.D.N.D.N.D.N.D.0.37±0.11 C21 萜品烯 12.382 N.D.N.D.N.D.0.28±0.04 N.D.N.D.C22 正十七烷 12.585 N.D.N.D.N.D.N.D.0.27±0.09 N.D.C23 十一烷 13.810 N.D.N.D.N.D.N.D.7.57±1.36 N.D.C24 3-甲基十三烷 15.628 N.D.N.D.N.D.N.D.0.07±0.02 0.43±0.19 C25 正十六烷 17.702 N.D.N.D.N.D.N.D.0.24±0.09 N.D.C26 十五烷 17.752 N.D.N.D.N.D.0.60±0.17 N.D.N.D.C271,1,3,3-四乙氧基丙烷 17.870 N.D.N.D.N.D.16.10±3.19 N.D.N.D.C28 十五烯 18.296 N.D.N.D.N.D.N.D.0.15±0.02 N.D.C29 十六烯 18.395 N.D.N.D.0.26±0.13 N.D.N.D.N.D.C30 2-甲基十七烷 18.696 N.D.N.D.N.D.N.D.N.D.0.27±0.11酮类(14 种)D1 丙酮 2.613 4.03±0.31 N.D.N.D.N.D.N.D.N.D.D2 2-丁酮 3.891 N.D.N.D.N.D.N.D.0.76±0.27 0.66±0.17 D3 2-十三酮 12.134 N.D.N.D.N.D.N.D.N.D.0.30±0.14 D4 3-辛酮 12.273 0.33±0.14 N.D.N.D.N.D.N.D.N.D.D5 2-甲基环戊酮 12.797 N.D.N.D.0.45±0.16 N.D.N.D.N.D.D6 3-羟基-2-丁酮 12.952 N.D.8.62±2.57 1.21±0.27 N.D.N.D.N.D.D7 4-辛烯-3-酮 13.586 0.13±0.06 N.D.N.D.N.D.N.D.N.D.D8 甲基庚烯酮 14.489 0.17±0.06 N.D.1.04±0.35 0.91±0.32 1.12±0.47 0.95±0.23 D9 2,3-辛二酮 14.544 1.81±0.27 0.69±0.17 1.50±0.38 1.04±0.29 1.02±0.24 1.44±0.39 D10 4-甲基-2-己酮 15.245 N.D.N.D.0.08±0.03 N.D.N.D.N.D.D11 2-壬酮 15.945 0.93±0.35 N.D.N.D.N.D.0.17±0.030.17±0.06 D12 2-哌嗪酮 18.183 N.D.N.D.N.D.N.D.N.D.1.26±0.31 D13 异佛尔酮 18.642 N.D.N.D.0.15±0.04 N.D.N.D.N.D.D14 香叶基丙酮 22.664 N.D.N.D.N.D.N.D.0.14±0.05 N.D.
续表1

注:N.D.未检出。
化合物种类 序号 化合物名称 保留时间/min相对含量/%90 d 150 d 210 d 270 d 450 d 630 d酯类(8 种)E1 乳酸乙酯 4.635 N.D.N.D.N.D.N.D.0.28±0.06 2.18±0.86 E2 丙烯酸-2-乙基己酯 17.580 N.D.N.D.N.D.0.39±0.15 N.D.N.D.E3 乙酰胺基丙二酸二乙酯 17.727 N.D.N.D.N.D.N.D.N.D.3.44±1.03 E4 1,3-二硬脂酸甘油酯 27.489 N.D.N.D.N.D.0.17±0.03 N.D.N.D.E5 硬脂酸甲酯 27.623 0.15 N.D.N.D.N.D.N.D.N.D.E6 油酸甲酯 27.850 N.D.N.D.0.46±0.16 N.D.N.D.N.D.E7 二十酸甲酯 30.023 N.D.1.54±0.49 N.D.N.D.N.D.N.D.E8 二十二烷酸甲酯 33.725 8.60±2.53 N.D.N.D.N.D.N.D.N.D.酸类(11 种)F1 冰醋酸 16.453 N.D.N.D.1.07±0.28 N.D.3.54±0.98 N.D.F2 异丁酸 18.833 N.D.0.58±0.160.14±0.05 0.34±0.170.11±0.03 N.D.F3 丁酸 19.652 0.14±0.06 3.54±0.59 0.58±0.19 0.69±0.25 N.D.0.35±0.07 F4 异戊酸 20.208 N.D.1.56±0.310.98±0.151.15±0.370.27±0.090.72±0.24 F5 缬草酸 20.509 N.D.0.28±0.07 N.D.N.D.N.D.0.96±0.37 F6 己酸 22.287 0.59±0.17 N.D.0.88±0.261.36±0.462.44±0.690.44±0.19 F7 庚酸 22.905 N.D.0.12±0.03 N.D.N.D.N.D.N.D.F8 辛酸 24.545 0.09±0.03 0.42±0.16 0.19±0.05 0.53±0.17 N.D.0.27±0.11 F9 正癸酸 26.565 N.D.0.17±0.03 N.D.0.57±0.09 N.D.N.D.F10 油酸 27.492 N.D.N.D.N.D.0.17±0.06 N.D.N.D.F11 肉豆蔻酸 31.688 N.D.N.D.N.D.0.31±0.12 N.D.N.D.芳香族化合物(7 种)G1 甲苯 6.773 N.D.N.D.N.D.5.67±1.27 N.D.1.31±0.21 G2 乙苯 8.624 N.D.N.D.N.D.N.D.N.D.0.10±0.02 G3 苯乙烯 12.761 N.D.0.12±0.03 N.D.0.61±0.09 N.D.0.75±0.31 G4 叔丁基苯 13.121 N.D.N.D.N.D.2.11±0.28 N.D.0.79±0.18 G5 间异丙基甲苯 13.241 N.D.N.D.N.D.0.16±0.05 N.D.N.D.G6 愈创木酚 21.869 N.D.N.D.0.26±0.08 N.D.N.D.N.D.G7 4-甲基苯酚 24.775 0.11±0.03 N.D.0.15±0.04 0.32±0.13 0.11±0.03 0.17±0.06 H1 4-氨基-6-氟-2-甲基喹啉 4.976 N.D.N.D.N.D.N.D.N.D.1.77±0.29其他(18 种)H2 二甲基二硫醚 7.042 N.D.0.81±0.39 N.D.N.D.0.12±0.09 N.D.H3 O-癸基羟胺 9.251 N.D.N.D.N.D.N.D.0.14±0.050.14±0.06 H4 2-戊基呋喃 12.053 0.38±0.17 N.D.0.19±0.03 0.21±0.09 0.30±0.11 0.21±0.08 H5 己腈 13.653 N.D.N.D.N.D.N.D.N.D.0.19±0.07 H6 十二甲基环六硅氧烷 14.280 0.09±0.01 N.D.0.25±0.09 0.47±0.12 N.D.N.D.H7 2,3-二甲基吡嗪 14.324 N.D.N.D.0.25±0.13 N.D.N.D.0.41±0.19 H8 2,6-二甲基吡嗪 14.720 N.D.N.D.0.48±0.21 0.40±0.19 0.43±0.15 1.47±0.29 H9 2,3,5-三甲基吡嗪 16.270 N.D.N.D.0.77±0.27 0.34±0.07 0.71±0.23 1.42±0.53 H10 川芎嗪 16.861 N.D.N.D.0.23±0.09 N.D.0.14±0.05 0.45±0.12 H11 十六烷基环八硅氧烷 19.270 N.D.N.D.N.D.0.09±0.04 N.D.N.D.H121,1,1,3,5,7,7,7-八甲基-3,5-双(三甲基硅氧基) 19.286 0.03±0.01 N.D.N.D.N.D.N.D.N.D.H13 奥苷菊环 20.881 0.31±0.19 N.D.N.D.N.D.N.D.N.D.H14 六甲基环三硅氧烷 21.602 N.D.N.D.0.18±0.060.58±0.130.12±0.06 N.D.H15 八甲基环四硅氧烷 22.200 N.D.N.D.N.D.0.34±0.07 N.D.N.D.H162-甲氧基-4-甲基苯酚 22.907 N.D.N.D.0.11±0.03 N.D.N.D.N.D.H17 环五聚二甲基硅氧烷 22.928 N.D.N.D.0.21±0.09 0.47±0.12 N.D.0.22±0.04 H18 1,1,3,3,5,5,7,7,9,9,11,11,13,13,15,15-十六甲基八硅氧烷24.893 N.D.N.D.N.D.0.25±0.12 N.D.N.D.
由表1~2可知:不同发酵时间的大河乌猪火腿,其挥发性风味物质相对含量和种类均发生变化;发酵过程中共鉴定出135 种挥发性风味物质,包括醛类21 种、醇类26 种、烃类30 种、酮类14 种、酯类8 种、酸类11 种、芳香族化合物7 种、其他18 种;且发酵90、150、210、270、450、630 d的挥发性风味物质的种类分别为42、35、51、53、62、71 种,故随着发酵时间的延长,大河乌猪火腿的风味物质种类总体呈现增多的趋势。
表2 大河乌猪火腿发酵过程中各类挥发性风味物质的种类及相对含量
Table 2 Types and relative contents of volatile flavor substances identified during the fermentation of Dahe black pig ham
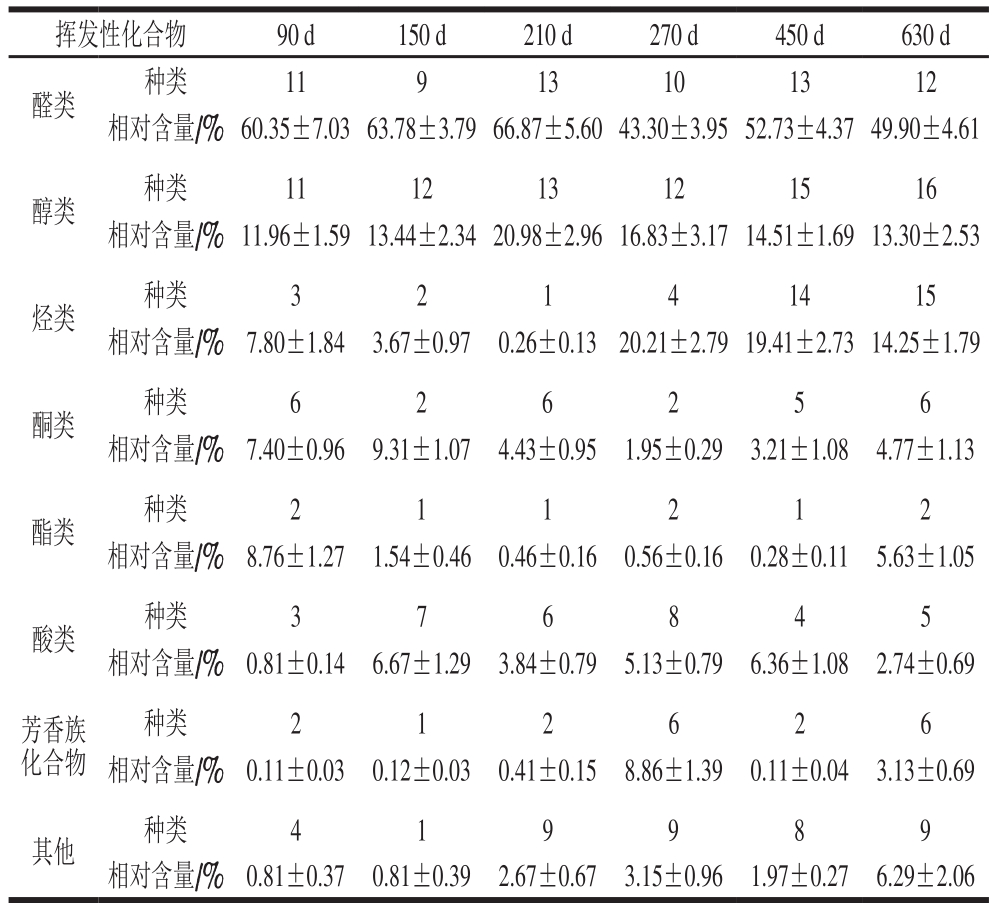
挥发性化合物 90 d 150 d 210 d 270 d 450 d 630 d醛类 种类 11 9 13 10 13 12相对含量/%60.35±7.0363.78±3.7966.87±5.6043.30±3.9552.73±4.3749.90±4.61醇类 种类 11 12 13 12 15 16相对含量/%11.96±1.5913.44±2.3420.98±2.9616.83±3.1714.51±1.6913.30±2.53烃类 种类 3 2 1 4 14 15相对含量/% 7.80±1.84 3.67±0.97 0.26±0.13 20.21±2.7919.41±2.7314.25±1.79酮类 种类 6 2 6 2 5 6相对含量/% 7.40±0.96 9.31±1.07 4.43±0.95 1.95±0.29 3.21±1.08 4.77±1.13酯类 种类 2 1 1 2 1 2相对含量/% 8.76±1.27 1.54±0.46 0.46±0.16 0.56±0.16 0.28±0.11 5.63±1.05酸类 种类 3 7 6 8 4 5相对含量/% 0.81±0.14 6.67±1.29 3.84±0.79 5.13±0.79 6.36±1.08 2.74±0.69芳香族化合物种类 2 1 2 6 2 6相对含量/% 0.11±0.03 0.12±0.03 0.41±0.15 8.86±1.39 0.11±0.04 3.13±0.69其他 种类 4 1 9 9 8 9相对含量/% 0.81±0.37 0.81±0.39 2.67±0.67 3.15±0.96 1.97±0.27 6.29±2.06
相对含量最多的挥发性物质是醛类,这与Sabio等[17]研究巴约纳、伊比利亚火腿时得出的结果一致。鉴定出的醛类包括直链醛、烯醛、二醛、支链醛和芳香醛5 种类型,这些醛类在国内外绝大多数类型的火腿中都存在[18]。己醛、壬醛、正辛醛、异戊醛是大河乌猪火腿中含量最丰富的醛类物质,它们也是伊斯特拉火腿的特征风味物质[19]。己醛是由n-6脂肪酸氧化得到的,具有青草香气,但过量会导致腐败臭味[20];壬醛是油酸的氧化产物,有助于增加甜味和果味香气[21-22];异戊醛与坚果味有关,在成熟伊比利亚火腿中含量较为丰富[18]。此外,醛类的相对含量随着发酵期的延长而呈现先上升后下降的趋势,而国内外著名火腿的相关报道中醛类物质均随发酵时间的延长而增多[23-24]。这一差异可能是由于大河乌猪火腿的生产地云南富源独特的气候,当地湿度较大或是加工方法不同之故。
醇类物质形成与脂质氧化、微生物繁殖和甲基酮还原密切相关[25]。在大河乌猪火腿中,醇类物质的相对含量仅次于醛类且含量最丰富的为1-辛烯-3-醇,与Radovčić等[26]的报道一致,且在6 个发酵阶段均有检出。1-辛烯-3-醇是由花生四烯酸氧化形成的,阈值较低,呈典型的蘑菇味,已被鉴定为金华火腿和如皋火腿的气味活性成分[27]。
烃类化合物主要由脂质分解产生,其阈值较高,通常不作为干腌火腿的主要风味物质。本研究中,大河乌猪火腿所含的烃类物质种类最多,与赵改名等[18]研究金华火腿中挥发性风味物质变化规律一致,在发酵时间为150、210 d时,其相对含量仅为3.67%、0.26%,其相对含量较低的原因可能是在一定的发酵时间内烃类化合物作为生成杂环化合物的重要中间体[28]。
酮类化合物源于氨基酸的降解、脂质氧化和微生物代谢[29],其性质稳定、香气持久。2,3-辛二酮贯穿于6 个发酵期且相对含量变化幅度小,表明其香气持久稳定。大河乌猪火腿中含量较高的酮为甲基酮,如3-羟基-2-丁酮、丙酮,可能与火腿肌肉表面生长大量的霉菌有关[18]。大河乌猪火腿中酮类物质含量在发酵150 d后减少,其可能转化为一些羧酸和其他风味物质,表明酮类物质可能对大河乌猪火腿的整体风味起着前体作用[30]。
酸类化合物源于中性脂肪和磷酸的降解、氨基酸脱氨反应或微生物的生长繁殖。发酵90 d时,己酸含量很高,说明在发酵初期,微生物作用较强,其原因是大量的霉菌在火腿表面生长。发酵时间为90~150 d,酸类物质含量增加,这是由于蛋白质降解可以形成氨基酸,氨基酸进一步反应可以产生使火腿呈弱酸味的酸类物质,这一结果与耿翠竹[31]研究结果一致。
酯类化合物是酯化反应的重要产物,赋予干腌火腿果味和甜味[32]。本研究中,酯类化合物总体含量不高。随发酵时间的延长,酯类化合物的相对含量总体呈先降低后增加的趋势,推测原因可能是在发酵90、150、210、270、450 d时,生成的酯类含量小于酯类氧化消耗量,而发酵630 d时,酯类氧化速率减慢,所消耗的量减少。苯类物质同烷烃类一样具有较高的阈值,对火腿风味贡献较小。
其他类风味物质主要有呋喃(2-戊基呋喃)、吡嗪类(2,3-二甲基吡嗪、2,6-二甲基吡嗪、2,3,5-三甲基吡嗪、川芎嗪)、硅氧烷类(十二甲基环六硅氧烷、十六烷基环八硅氧烷、六甲基环三硅氧烷等)等。2-戊基呋喃常见于肉制品中,主要是通过亚油酸的氧化产生,对金华、宣威、如皋火腿的风味品质具有一定的贡献[33]。杂环类化合物由于通过硫胺素降解、氨基酸热解形成,多数具有肉香。此外,吡嗪类化合物广泛存在于发酵火腿中,通常赋予肉品坚果及烘烤香味[34]。在大河乌猪火腿中检测到的杂环类物质有4-氨基-6-氟-2-甲基喹啉;吡嗪类物质有2,6-二甲基吡嗪、2,3,5-三甲基吡嗪等。
2.2 不同发酵时间大河乌猪火腿中挥发性化合物的多元统计分析
2.2.1 基于PCA区分不同发酵时间大河乌猪火腿
PCA是目前应用最为广泛的一种无监督的多元统计学分析方法[35]。利用火腿挥发性风味组分的峰面积通过SIMCA软件进行PCA,结合图1A可知,拟合后模型的可解释变量Rx2=0.529>0.5,表明模型拟合准确性较好,但由于模型的可预测度Q2=0.201<0.5,表明模型预测能力较差。由图1B可知,所有火腿样品均处于95% Hotelling T2置信区间内,没有发现“离群样本点”,表明分析样品中没有异常值。PCA属于无监督分析模型,因此,并不能直接区分不同发酵时间的大河乌猪火腿,之后将采用有监督的方法进一步研究。
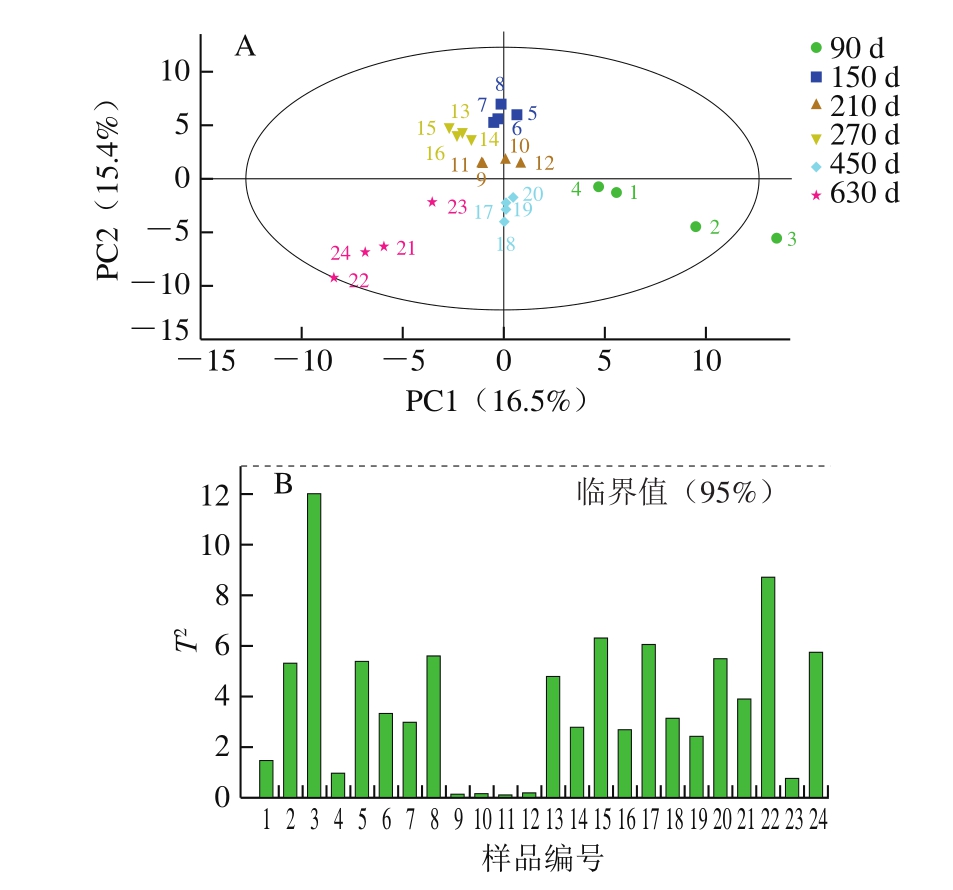
图1 PCA得分图(A)和Hotelling T2分布图(B)
Fig.1 PCA score plot (A) and Hotelling T2 distribution plot (B)
2.2.2 基于PLS-DA区分不同发酵时间大河乌猪火腿
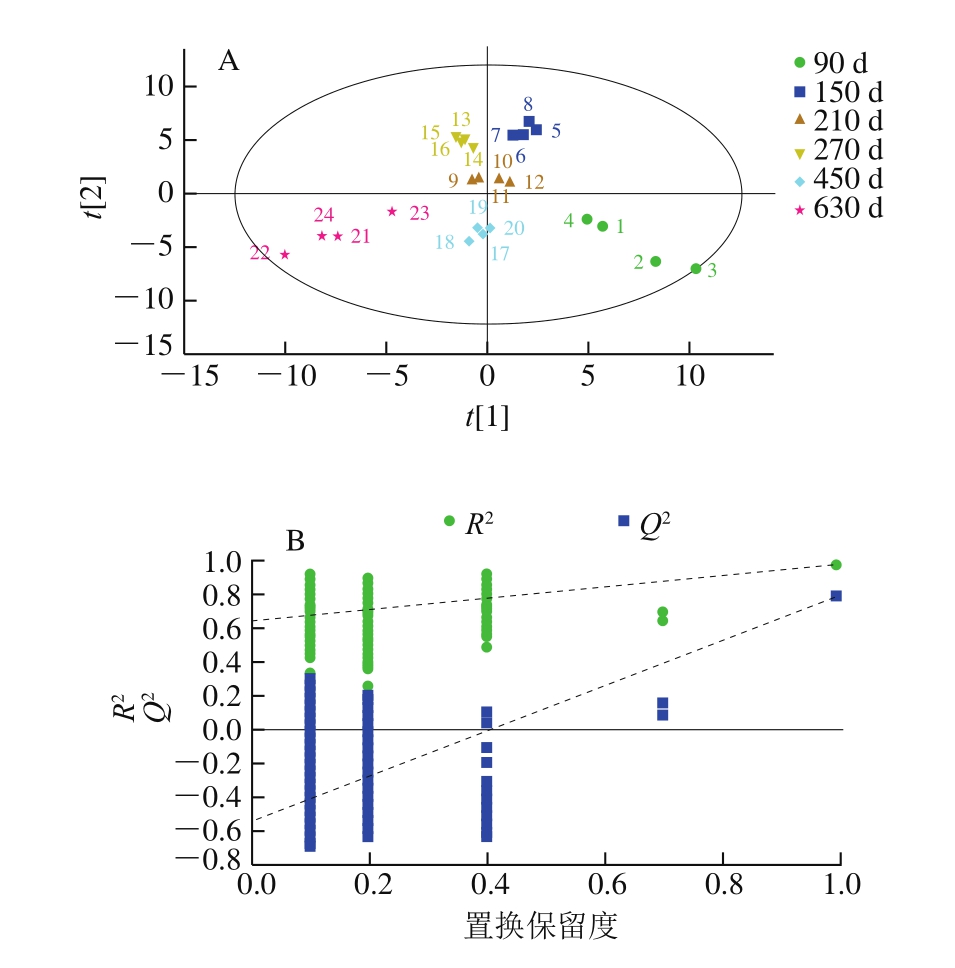
图2 不同发酵时间大河乌猪火腿PLS-DA(A)和置换检验图(B)
Fig.2 PLS-DA plot (A) and permutation test plot (B) for discriminant analysis of Dahe black pig ham at different fermentation times
PLS-DA为有监督的分析,可以预设分类,弥补了PCA方法的不足,强化组间差异,同时可以量化特征化合物造成组分差异的程度[35]。由拟合后的模型及图2A可知,该建模方法能较好地区分不同发酵时间大河乌猪火腿,且拟合模型预测成分的累计统计量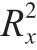 为0.626、模型解释率参数
为0.626、模型解释率参数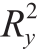 为0.962、预测能力参数Q2为0.853,均高于0.5,说明该模型对不同发酵时间的大河乌猪火腿具有较好的预测能力,相比于PCA,PLS-DA对6 个不同发酵期的大河乌猪火腿样品区分明显。
为0.962、预测能力参数Q2为0.853,均高于0.5,说明该模型对不同发酵时间的大河乌猪火腿具有较好的预测能力,相比于PCA,PLS-DA对6 个不同发酵期的大河乌猪火腿样品区分明显。
采用置换检验(重复次数200)对PLS-DA模型进行验证,由图2B可知,右侧的R2和Q2均高于左侧的R2和Q2,与纵轴相交时R2=0.650,Q2=-0.542,Q2与纵轴相交为负值表明该PLS-DA模型可靠,不存在过拟合现象,且有较好预测能力[32],可以用于解释不同发酵时间大河乌猪火腿风味的差异。
2.2.3 关键挥发性风味物质分析
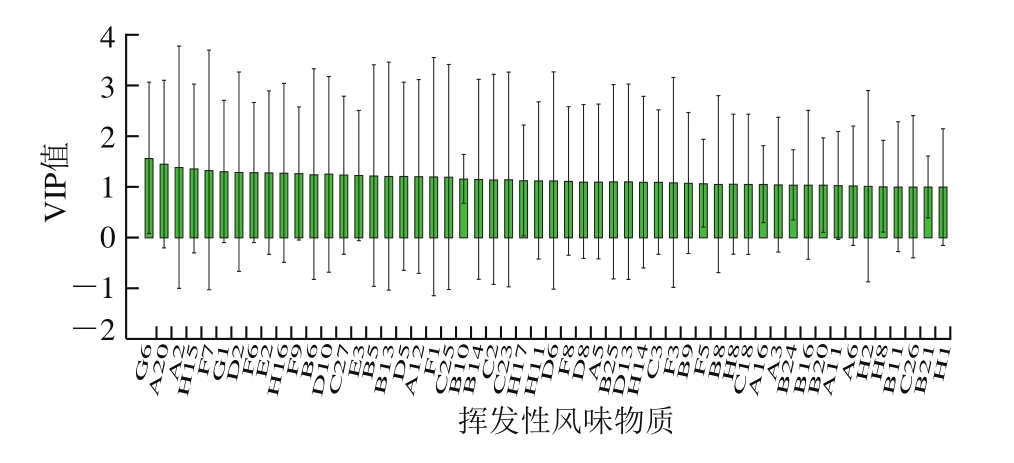
图3 挥发性风味成分的VIP值图
Fig.3 VIP values of volatile flavor compounds
变量重要性投影(variable importance project,VIP)值可进一步直观反映变量对模型分类的整体贡献度。由图3可知,为获得PLS-DA模型下区分不同发酵时间大河乌猪火腿的关键差异挥发性化合物,根据VIP>1时即为重要差异化合物[35],本研究共获得54 种差异挥发性化合物,其中VIP>1.5的物质有愈创木酚(G6),对于区分6 个不同发酵时间的大河乌猪火腿尤为重要。
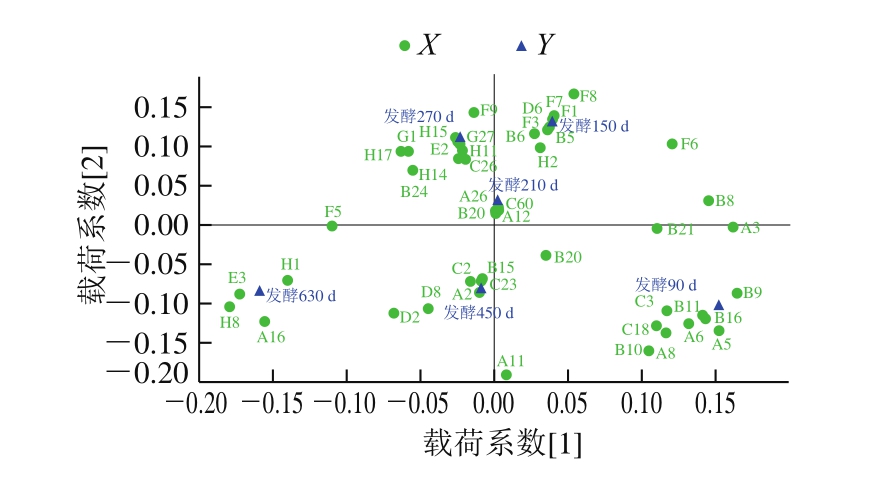
图4 PLS-DA载荷散点图
Fig.4 PLS-DA loading scatter plot
因子载荷图反映每个变量在得分图上的贡献[35],每一类别(Y)附近的变量(X)均在该类别的样品中相对含量较大[36]。由图4可知:庚醇(B11)、2,4-二甲基环己醇(B16)、正己醇(B9)、庚醛(A5)是发酵90 d大河乌猪火腿的特征物质;冰醋酸(F1)、丁醇(B5)、丁酸(F3)、3-羟基-2-丁酮(D6)是发酵150 d大河乌猪火腿的特征物质;愈创木酚(G6)、2-甲氧基-4-甲基苯酚(H16)、4-甲基-2-己酮(D10)、2-甲基环戊酮(D5)是发酵210 d大河乌猪火腿的特征物质;丙烯酸-2-乙基己酯(E2)、八甲基环四硅氧烷(H15)、1,1,3,3-四乙氧基丙烷(C27)、十六烷基环八硅氧烷(H11)是发酵270 d大河乌猪火腿的特征物质;戊醛(A2)、异辛硫醇(B13)、正十六烷(C25)是发酵450 d大河乌猪火腿的特征物质;乙酰胺基丙二酸二乙酯(E3)、2,6-二甲基吡嗪(H8)、4-氨基-6-氟-2-甲基喹啉(H1)、苯乙醛(A16)是发酵630 d大河乌猪火腿的特征物质。
3 结 论
发酵时间影响大河乌猪火腿挥发性风味物质的形成,在6 个发酵时间大河乌猪火腿中,共鉴定出135 种挥发性化合物,以醛类、醇类、烃类为主;根据VIP>1筛选出54 种对不同发酵时间的大河乌猪火腿进行有效区分的标志物;结合PLS-DA载荷散点图得出,发酵90 d大河乌猪火腿的特征物质为庚醇(B11)、2,4-二甲基环己醇(B16)等,发酵150 d大河乌猪火腿的特征物质为冰醋酸(F1)、丁醇(B5)等,发酵210 d大河乌猪火腿的特征物质为愈创木酚(G6)、2-甲氧基-4-甲基苯酚(H16)等,发酵270 d大河乌猪火腿的特征物质为丙烯酸-2-乙基己酯(E2)、八甲基环四硅氧烷(H15)等,发酵450 d大河乌猪火腿的特征物质为戊醛(A2)、异辛硫醇(B13)等,发酵630 d大河乌猪火腿的特征物质为乙酰胺基丙二酸二乙酯(E3)、2,6-二甲基吡嗪(H8)等。本研究为大河乌猪火腿加工品质控制提供了理论支撑。
[1]朱砺, 李学伟, 帅素容, 等.大河猪与大河乌猪的肌肉营养成分分析[J].中国畜牧杂志, 2008, 44(7): 6-9.
[2]司徒乐愉, 吴安立, 皮晓波, 等.大河乌猪肉质特性研究[J].养猪,2004(5): 48-50.
[3]郭新, 卢士玲, 王斌, 等.中国传统火腿风味分析研究进展[J].粮食与油脂, 2019, 32(3): 18-21.
[4]CASABURI A, FILIPPIS F D, VILLANI F, et al.Activities of strains of Brochothrix thermosphacta in vitro and in meat[J].Food Research International, 2014, 62(8): 366-374.DOI:10.1016/j.foodres.2014.03.019.
[5]GIOVANELLI G, BURATTI S, LAUREATI M, et al.Evolution of physicochemical, morphological and aromatic characteristics of Italian PDO dry-cured hams during processing[J].European Food Research and Technology, 2016, 242(7): 1117-1127.DOI:10.1007/s00217-015-2616-6.
[6]LORENZO J M.Changes on physico-chemical, textural, lipolysis and volatile compounds during the manufacture of dry-cured foal“cecina”[J].Meat Science, 2014, 96(1): 256-263.DOI:10.1016/j.meatsci.2013.06.026.
[7]KHAN M I, JO C, TARIQ M R.Meat flavor precursors and factors influencing flavor precursors: a systematic review[J].Meat Science,2015, 110: 278-284.DOI:10.1016/j.meatsci.2015.08.002.
[8]ZHANG Jian, PAN Daodong, ZHOU Guanghong, et al.The changes of the volatile compounds derived from lipid oxidation of boneless drycured hams during processing[J].European Journal of Lipid Science and Technology, 2019, 121(10): 135-146.DOI:10.1002/ejlt.201900135.
[9]HU Yichen, KONG Weijun, YANG Xihui, et al.GC-MS combined with chemometric techniques for the quality control and original discrimination of Curcumae longae rhizome: analysis of essential oils[J].Journal of Separation Science, 2014, 37(4): 404-411.DOI:10.1002/jssc.201301102.
[10]MELUCCI D, BENDINI A, TESINI F, et al.Rapid direct analysis to discriminate geographic origin of extra virgin olive oils by flash gas chromatography electronic nose and chemometrics[J].Food Chemistry,2016, 204: 263-273.DOI:10.1016/j.foodchem.2016.02.131.
[11]富天昕, 冯玉超, 张丽媛, 等.基于GC-MS技术对不同产地稻米的代谢组学分析[J].食品科学, 2019, 40(12): 176-181.DOI:10.7506/spkx1002-6630-20180621-412.
[12]毛世红.基于风味组学的功夫红茶品质分析与控制研究[D].重庆:西南大学, 2018: 5-11.
[13]童红甘, 王武, 张华锋, 等.HPLC、GC-MS结合多元统计分析方法探究不同地区板鸭风味差异[J].现代食品科技, 2018, 34(12): 228-238.
[14]HUAN Yanjun, ZHOU Guanghong, ZHAO Gaiming, et al.Changes in flavor compounds of dry-cured Chinese Jinhua ham during processing[J].Meat Science, 2005, 71(2): 291-299.DOI:10.1016/j.meatsci.2005.03.025.
[15]高韶婷, 宋雪, 陈乐, 等.基于固相萃取整体捕集剂-气相色谱-质谱金华火腿挥发性风味物质分析[J].食品科学, 2015, 36(22): 113-116.DOI:10.7506/spkx1002-6630-201522020.
[16]THÉRON L, TOURNAYRE P, KONDJOYAN N, et al.Analysis of the volatile profile and identification of odour-active compounds in Bayonne ham[J].Meat Science, 2010, 85(3): 453-460.DOI:10.1016/j.meatsci.2010.02.015.
[17]SABIO E, VIDAL-ARAGON M C, BERNALTE M J.Volatile compounds present in six types of dry-cured ham from south European countries[J].Food Chemistry, 1998, 61(4): 493-504.DOI:10.1016/S0308-8146(97)00079-4.
[18]赵改名, 柳艳霞, 田玮, 等.金华火腿中挥发性风味物质形成过程及变化规律研究[J].食品与发酵工业, 2007(5): 120-125.
[19]LORENZO J M, CARBALLO J, FRANCO D.Effect of the inclusion of chestnut in the finishing diet on volatile compounds of dry-cured ham from Celta pig breed[J].Journal of Integrative Agriculture, 2013,12(11): 2002-2012.DOI:10.1016/S2095-3119(13)60638-3.
[20]MARUSIC N, VIDACEK S, JANCI T, et al.Determination of volatile compounds and quality parameters of traditional Istrian dry cured ham[J].Meat Science, 2014, 96(4): 1409-1416.DOI:10.1016/j.meatsci.2013.12.003.
[21]乔发东, 马长伟.宣威火腿加工过程中挥发性风味化合物分析[J].食品研究与开发, 2006, 27(3): 24-29.DOI:10.3969/j.issn.1005-6521.2006.03.009.
[22]殷朝敏, 范秀芝, 史德芳, 等.HS-SPME-GC-MS结合HPLC分析5 种食用菌鲜品中的风味成分[J].食品工业科技, 2019, 40(3): 254-260.DOI:10.13386/j.issn1002-0306.2019.03.040.
[23]RUIZ J, VENTANAS J, CAVA R, et al.Volatile compounds of dry-cured Iberian ham as affected by the length of the curing process[J].Meat Science, 1999, 52(1): 19-27.DOI:10.1016/s0309-1740(98)00144-2.
[24]李诚, 张静, 付刚.跷碛火腿发酵过程中挥发性风味成分的变化[J].食品科学, 2010, 31(24): 405-409.
[25]郑璞, 苏伟, 母雨, 等.盘县火腿自然发酵过程中理化和风味特征[J].肉类研究, 2020, 34(9): 59-67.DOI:10.7506/rlyj1001-8123-20200615-152.
[26]RADOVČIĆ N, VIDAČEK S, JANČI T, et al.Characterization of volatile compounds, physico-chemical and sensory characteristics of smoked dry-cured ham[J].Journal of Food Science and Technology,2016, 53(11): 4093-4105.DOI:10.1007/s13197-016-2418-2.
[27]刘登勇.气味指纹技术的建立及其在腌腊肉制品中的应用[D].南京: 南京农业大学, 2008: 27-33.
[28]崔方超, 李婷婷, 杨兵, 等.电子鼻结合GC-MS分析草鱼脱腥前后风味变化[J].食品科学, 2014, 35(20): 126-130.DOI:10.7506/spkx1102-6630-201420025.
[29]SANCHEZ-PENA C M, LUNA G, GARCIA-GONZALEZ D L, et al.Characterization of French and Spanish dry-cured hams: influence of the volatiles from the muscles and the subcutaneous fat quantified by SPME-GC[J].Meat Science, 2005, 69(4): 635-645.DOI:10.1016/j.meat sci.2004.10.015.
[30]王勇勤, 郭新, 黄笠原, 等.基于电子鼻和气相色谱-质谱联用技术分析不同贮藏时间羊肉火腿香气成分[J].食品科学, 2019, 40(2):215-221.DOI:10.7506/spkx1002-6630-20180612-193.
[31]耿翠竹.宣恩火腿加工过程中蛋白质降解规律及其对火腿风味的影响[D].武汉: 武汉轻工大学, 2017.
[32]陆宽, 王雪雅, 孙小静, 等.电子鼻结合顶空SPME-GC-MS联用技术分析贵州不同品种辣椒发酵后挥发性成分[J].食品科学, 2018,39(4): 199-205.DOI:10.7506/spkx1002-6630-201804030.
[33]谭椰子, 周光宏, 徐幸莲, 等.3 个品牌干腌火腿皮下脂肪挥发性风味比较分析[J].食品科学, 2019, 40(16): 185-192.DOI:10.7506/spkx1002-6630-20180725-304.
[34]MARTIN A, CORDOBA J J, ARANDA E, et al.Contribution of a selected fungal population to the volatile compounds on dry-cured ham[J].International Journal of Food Microbiology, 2006, 110(1): 8-18.DOI:10.1016/j.ijfoodmicro.2006.01.031.
[35]尹洪旭, 杨艳芹, 姚月凤, 等.基于气相色谱-质谱技术与多元统计分析对不同栗香特征绿茶判别分析[J].食品科学, 2019, 40(4):192-198.DOI:10.7506/spkx1002-6630-20180120-276.
[36]田甜, 韦锦坚, 文金华, 等.不同季节凌云白毫绿茶的香气成分差异分析[J].食品科学, 2020, 41(22): 252-259.DOI:10.7506/spkx1002-6630-20191020-206.