肉类富含优质蛋白质及人体必需的微量元素,是人们膳食结构中重要的组成部分。目前市售的生鲜肉按照所处温度状况可分为热鲜肉、冷冻肉和冷却肉[1]。近年来,随着消费者对食品安全和质量的重视,我国肉类消费呈现出从冷冻肉、热鲜肉到冷却肉的发展趋势,冷却肉市场发展潜力十分巨大[2]。冷却肉是指对严格执行检疫制度屠宰后的畜胴体迅速进行冷却处理,使胴体温度在24 h内降到0~4 ℃,并在后续加工、流通和零售过程中环境温度始终保持在0~4 ℃范围内的鲜肉。冷却肉克服了热鲜肉、冷冻肉在品质上存在的不足和缺陷,因始终处于冷链控制下,微生物的生长受到抑制,因此冷却肉的安全性较高;此外,冷却肉经历了充分的解僵成熟过程,肉质细嫩,滋味鲜美,营养价值高[3]。
尽管冷藏可以有效延长肉的保质期,但是一些嗜冷细菌如单核细胞增生李斯特菌(Listeria monocytogenes,Lm)仍能在冷藏条件下生长并引起冷却肉腐败变质[4]。Lm是一种重要的食源性致病菌,能引起人畜共患传染病李斯特菌病[5-7]。Lm对环境的耐受能力很强,可在低温、高盐等多种不利条件下生存[8-12],还可以在食品及食品加工接触面上形成生物膜,严重威胁食品安全[13-16]。
防腐保鲜剂的添加可以有效抑制细菌生长,延长冷却肉的货架期。常见的保鲜剂可以分为化学保鲜剂和生物保鲜剂,其中生物保鲜剂具有无毒、无害、无污染等优点,是现代保鲜技术的发展方向[17]。研究表明,微生物在发酵过程中产生的次级代谢产物具有良好的抑菌活性,在食品防腐保鲜方面具有潜在的应用价值[18-22]。
本实验室从泡菜中分离出一株绿色魏斯氏菌(Weissella viridescens),考察绿色魏斯氏菌发酵液对Lm的抑菌效果以及对Lm生物膜形成的影响,通过测定冷藏过程中冷却猪肉的菌落总数、Lm总数、感官和理化指标,评估该发酵液对冷却猪肉产品特性的影响,从而为冷却肉生物保鲜剂的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
冷却猪后腿瘦肉购于新乡市某超市。
Lm 10403S菌株为本实验室保存;绿色魏斯氏菌WV20-15分离自泡菜。
培养基 广东环凯微生物技术有限公司;草酸铵北京化工厂有限责任公司;结晶紫 天津市大茂化学试剂厂;无水乙醇(分析纯) 天津市富宇精细化工有限公司。
1.2 仪器与设备
CT15RE型离心机 日本日立公司;LGJ-25C冷冻干燥机 四环福瑞科仪科技发展(北京)有限公司;Bioscreen Cpro全自动生长曲线分析仪 芬兰Oy Growth Curves Ab有限公司;DMi1倒置显微镜 德国Leica公司;拍击式均质器 上海本昂科学仪器有限公司;PHS-3B型pH计 上海雷磁电子仪器有限公司;Multiskan Spectrum酶标仪 美国Thermo Scientific公司。
1.3 方法
1.3.1 绿色魏斯氏菌发酵液的制备
将绿色魏斯氏菌WV20-15接种至MRS液体培养基中,37 ℃培养48 h。将发酵液在4 ℃、8 000 r/min下离心10 min,收集的发酵上清液再经0.22 μm无菌滤膜过滤除菌,滤液即为发酵原液。发酵原液经真空冷冻干燥后称质量,并置于-20 ℃保存,使用时重新溶解于无菌水中配制成所需质量浓度。
1.3.2 绿色魏斯氏菌发酵液对Lm的最小抑菌质量浓度(minimum inhibitory concentration,MIC)测定
采用微量肉汤稀释法测定绿色魏斯氏菌发酵液对Lm的MIC。将发酵液冷冻干燥物重新溶解于无菌水中,配制成240、120、60、30、15 mg/mL的溶液。在96 孔板中依次加入不同质量浓度的发酵液,然后加入稀释后的Lm菌悬液,密封后置于37 ℃培养24 h。设置仅脑心浸液(brain heart infusion,BHI)培养基的阴性对照以及仅Lm菌悬液的阳性对照,实验组和对照组均设置6 个复孔。以孔内完全抑制Lm生长的最低质量浓度为MIC。
1.3.3 Lm生长曲线测定
利用微生物全自动生长曲线分析仪测定Lm在绿色魏斯氏菌发酵液作用下的生长曲线[23]。挑取5 个单克隆菌落接种至BHI液体培养基中,37 ℃、150 r/min培养过夜。过夜培养物按体积比1∶100分别接种至新鲜(对照组)和含有1/2 MIC发酵液的BHI培养基中,然后再转移至100 孔蜂窝板中,37 ℃培养30 h,每隔15 min测定菌液的OD600 nm值,以培养时间为横坐标,OD600 nm为纵坐标绘制生长曲线。
1.3.4 绿色魏斯氏菌发酵液对Lm生物膜形成的影响
参照Djordjevic等[24]的方法,将Lm菌株培养至对数期早期(OD600 nm值约为0.4),分别使用含有1/2 MIC、1/4 MIC、1/8 MIC发酵液的BHI培养基稀释Lm菌液至105 CFU/mL;以不含发酵液BHI培养基稀释Lm菌液作为对照组。取200 μL稀释菌液加至96 孔板中,37 ℃培养48 h后,小心弃去孔中的培养基,经草酸铵结晶紫溶液染色、体积分数95%乙醇溶液脱色后,用酶标仪于595 nm波长处检测其OD595 nm,同时置于倒置显微镜下观察拍照。
1.3.5 绿色魏斯氏菌发酵液在冷却猪肉保鲜中的应用
1.3.5.1 原料肉的处理
用体积分数75%的乙醇溶液充分擦拭刀具、案板等器具并紫外线照射15 min。在无菌条件下将新鲜猪肉腿肉切分成25 g左右的小块。将肉块随机分成6 组,每组6 个平行,每个平行重复3 次。各组处理方法见表1。将处理好的样品在4 ℃下冷藏,分别在冷藏0、3、6、9、12、15 d测定各项指标。
表1 实验分组方案
Table 1 Grouping scheme

组别 处理方式未接种组 在无菌生理盐水中浸渍30 s,取出沥干2×MIC未接种组 在质量浓度2×MIC的绿色魏斯氏菌发酵液中浸渍30 s,取出沥干4×MIC未接种组 在质量浓度4×MIC的绿色魏斯氏菌发酵液中浸渍30 s,取出沥干接种组 接种1.0×105 CFU/mL Lm菌悬液后在无菌生理盐水中浸渍30 s,取出沥干2×MIC接种组 接种1.0×105 CFU/mL Lm菌悬液后在质量浓度2×MIC的绿色魏斯氏菌发酵液中浸渍30 s,取出沥干4×MIC接种组 接种1.0×105 CFU/mL Lm菌悬液后在质量浓度4×MIC的绿色魏斯氏菌发酵液中浸渍30 s,取出沥干
1.3.5.2 冷却猪肉微生物指标测定
参照GB 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》对未接种组、2×MIC未接种组、4×MIC未接种组样品中的细菌总数进行测定。取接种组、2×MIC接种组、4×MIC接种组样品,在不同贮藏时期用BHI培养基进行Lm计数。
1.3.5.3 冷却猪肉感官质量评定
由10 人组成感官评价小组,参照NY/T 632—2002《冷却猪肉》对色泽、组织状态、气味和煮沸后肉汤4 项指标进行感官评价,具体评分标准见表2。同时采用9 点评分法进行评分:9 分=极好,8 分=很好,7 分=好,6 分=次好,5 分=一般,4 分=一般以下,3 分=差,2 分=很差,1 分=极差。
表2 冷却猪肉感官指标
Table 2 Criteria for sensory evaluation of chilled pork

指标 评价标准色泽 肌肉呈红色、有光泽,脂肪呈乳白色组织状态 肌纤维致密、坚实、有弹性,指压后凹陷立即恢复,外表微干或微湿润、不黏手气味 具有鲜猪肉正常气味,无异味煮沸后肉汤 澄清透明,脂肪团聚于表面,具有猪肉香味
1.3.5.4 冷却猪肉理化指标测定
pH值:将25 g样品研磨后加入225 mL蒸馏水,过滤,取滤液用pH计测定pH值,每个样品测3 次,取平均值。挥发性盐基氮(total volatile basic-nitrogen,TVB-N)含量:采用紫外分光光度计法测定,冷却肉TVB-N含量超过20 mg/100 g即为变质肉[19]。
1.4 数据处理
每组实验重复测定3 次,结果表示为平均值±标准差,利用SPSS 19.0软件采用双尾t检验对实验数据进行显著性差异分析,P<0.05被认为具有显著性差异。
2 结果与分析
2.1 绿色魏斯氏菌发酵液对Lm的MIC
经检测发现,Lm 10403S在含有15 mg/mL绿色魏斯氏菌发酵液的培养基中可以生长;当绿色魏斯氏菌发酵液质量浓度为30 mg/mL时,Lm 10403S的生长完全受到抑制。这表明绿色魏斯氏菌发酵液对Lm 10403S的生长具有抑制作用,其对Lm 10403S的MIC为30 mg/mL。
2.2 Lm菌株生长曲线测定结果
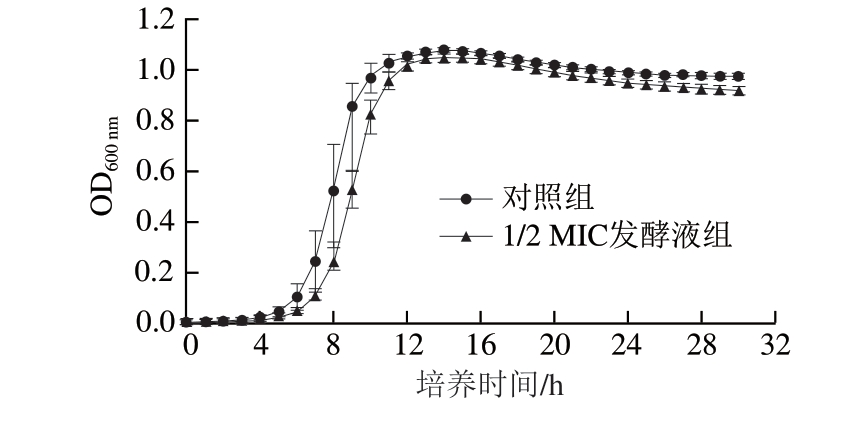
图1 Lm10403S在绿色魏斯氏菌发酵液作用下的生长曲线
Fig.1 Growth curves of Lm 10403S in the presence of Weissella viridescens fermentation broth
绿色魏斯氏菌发酵液质量浓度过高时会抑制Lm 10403S菌株的生长,从而降低菌株生物被膜的形成量。为排除后续研究中细菌数量变化对生物被膜形成的干扰作用,本研究首先考察菌株Lm 10403S在亚抑菌浓度发酵液作用下的生长情况。由图1可知,与对照组相比,加入1/2 MIC发酵液后菌株Lm 10403S的生长几乎没有受到影响。因此,该质量浓度以及小于该质量浓度的绿色魏斯氏菌发酵液可用于后续生物被膜的检测实验。
2.3 Lm菌株生物被膜检测结果
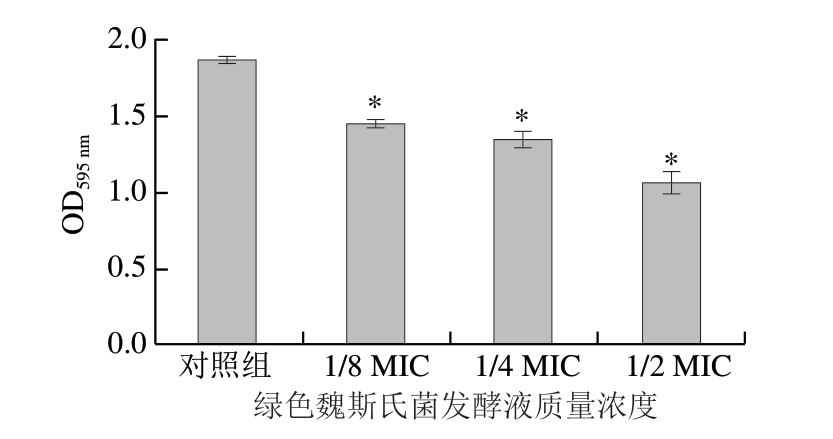
图2 Lm10403S在绿色魏斯氏菌发酵液作用下的生物被膜形成量
Fig.2 Biofilm biomass of Listeria monocytogenes 10403S in the presence of Weissella viridescens fermentation broth
*.与对照组相比,差异显著(P<0.05)。
根据生长曲线的测定结果,本实验进一步研究在质量浓度1/2 MIC、1/4 MIC和1/8 MIC绿色魏斯氏菌发酵液作用下菌株Lm 10403S的生物被膜形成能力。由图2可知,与对照组相比,加入绿色魏斯氏菌发酵液后Lm 10403S的生物被膜形成量显著降低(P<0.05),当绿色魏斯氏菌发酵液质量浓度分别为1/8 MIC、1/4 MIC和1/2 MIC时,Lm 10403S的生物被膜形成量分别下降了22.3%、28.1%和43.3%。

图3 倒置显微镜观察Lm 10403S生物被膜结构
Fig.3 Inverted microscopic observation of Listeria monocytogenes 10403S biofilm structure
A.对照组;B.1/8 MIC绿色魏斯氏菌发酵液;C.1/4 MIC绿色魏斯氏菌发酵液;D.1/2 MIC绿色魏斯氏菌发酵液。
由图3可知,未经绿色魏斯氏菌发酵液处理的Lm 10403S细胞形成的网链状生物被膜结构致密、孔隙小;而在绿色魏斯氏菌发酵液作用下Lm 10403S细胞形成的生物被膜结构疏松、空隙较大,且随着发酵液质量浓度的增加这种变化趋势更明显。
Lm在一定条件下可形成生物被膜,与浮游状态相比,处于生物被膜中的Lm对消毒剂等杀菌物质具有更强的抵抗能力,导致食品工业中常用的消毒程序很难将Lm生物被膜清除[25-26]。因此,有效控制Lm生物被膜的形成对保障食品安全具有重要意义。研究表明,某些细菌代谢产生的有机酸、过氧化氢、细菌素等对Lm生物被膜的形成具有抑制作用[27-29]。Shao Xinhao等[29]报道一株肠膜明串珠菌的无细胞培养上清液对2 株Lm生物被膜的形成具有明显抑制效果。宋杏等[30]发现植物乳杆菌Y42的无细胞培养上清液可抑制Lm生物被膜的形成及运动性。
绿色魏斯氏菌为革兰氏阳性菌,属于异型发酵乳酸菌,广泛分布于发酵食品中,如泡菜、腊肠、豆豉等。绿色魏斯氏菌不仅参与食品发酵过程中风味物质的形成,还具有潜在的抑菌特性。李文等[31]发现绿色魏斯氏菌ZY-6的发酵上清液能抑制大肠杆菌、沙门氏菌等常见食源性致病菌的生长。刘梅等[32]研究发现,在共培养条件下产细菌素绿色魏斯氏菌C1对Lm生长、毒力基因表达以及细胞黏附性均具有抑制作用。这些研究表明绿色魏斯氏菌及其代谢产物在食品腐败菌和致病菌的防控方面具有应用潜力。本研究中绿色魏斯氏菌WV20-15的发酵液不仅能够抑制Lm的生长,对Lm生物被膜的形成也具有明显抑制作用,然而发酵液中具体何种物质在发挥作用尚不清楚,仍需进一步研究。
2.4 绿色魏斯氏菌发酵液对冷却猪肉保鲜效果评价
2.4.1 绿色魏斯氏菌发酵液对冷却猪肉中细菌生长的影响
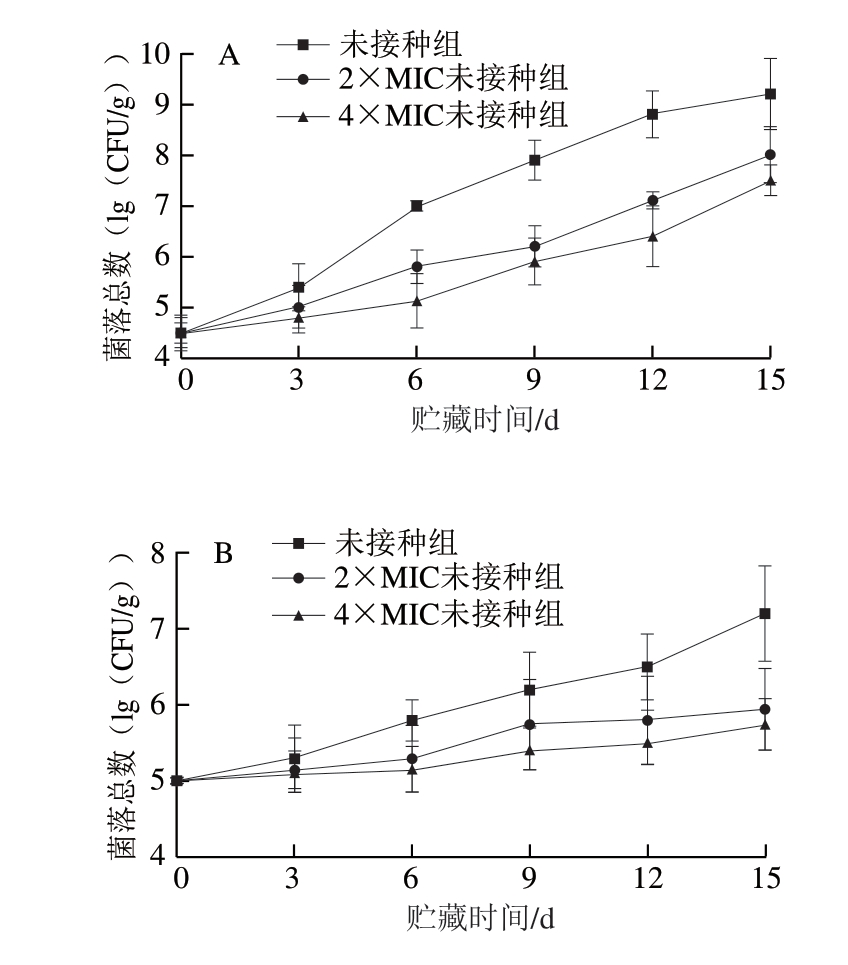
图4 绿色魏斯氏菌发酵液对冷却猪肉贮藏过程中细菌总数(A)和Lm总数(B)的影响
Fig.4 Effect of Weissella viridescens fermentation broth on the numbers of total bacteria (A) and Listeria monocytogenes (B) in chilled pork during storage
冷却肉的腐败主要是由于细菌的大量繁殖导致蛋白质分解,因此冷却肉中细菌的生长情况是判断其新鲜度的依据之一[19]。由图4A可知,随着贮藏时间的延长,未接种组和绿色魏斯氏菌发酵液处理组(2×MIC未接种组和4×MIC未接种组)中冷却猪肉样品的细菌总数均呈现逐渐升高的趋势,但是绿色魏斯氏菌发酵液处理组的细菌总数增长速率均低于未接种组。冷藏6 d时,未接种组细菌总数已达107 CFU/g,2×MIC未接种组的细菌总数接近106 CFU/g,而4×MIC未接种组的细菌总数约为105 CFU/g,较未接种组低2 个数量级;冷藏12 d时,2×MIC未接种组细菌总数超过107 CFU/g;冷藏15 d时,4×MIC未接种组的细菌总数超过107 CFU/g。由此可见,绿色魏斯氏菌发酵液能够抑制冷却猪肉中细菌的生长,延长冷却猪肉的保质期。
Lm在冷藏温度下仍能生长繁殖,是引起冷却肉腐败变质的主要菌种[18]。由图4B可知,接种组和绿色魏斯氏菌发酵液处理组(2×MIC接种组和4×MIC接种组)中Lm总数均随贮藏时间的延长而逐渐上升。相同贮藏时间内,绿色魏斯氏菌发酵液处理组Lm总数均低于接种组,表明绿色魏斯氏菌发酵液能够抑制冷却猪肉中Lm的生长。
2.4.2 绿色魏斯氏菌发酵液对冷却猪肉感官品质的影响
表3 冷却猪肉总体感官评分结果
Table 3 Results of sensory evaluation of chilled pork
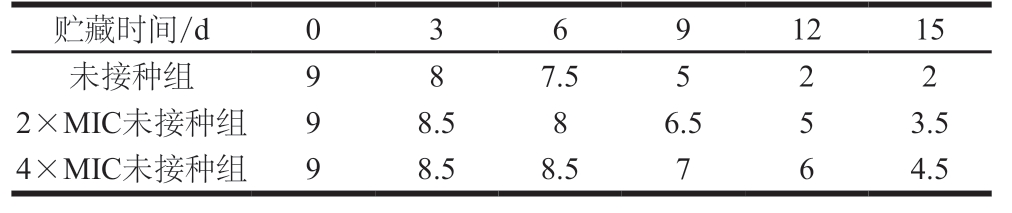
贮藏时间/d 0 3 6 9 12 15未接种组 9 8 7.5 5 2 2 2×MIC未接种组 9 8.5 8 6.5 5 3.5 4×MIC未接种组 9 8.5 8.5 7 6 4.5
由表3可知,贮藏期间绿色魏斯氏菌发酵液处理组(2×MIC未接种组和4×MIC未接种组)的总体感官评分始终高于未接种组。本实验以感官评分6 分作为冷却肉货架期终点,未接种组的货架期不超过9 d,2×MIC未接种组的货架期达9 d以上,而4×MIC未接种组的货架期可达12 d,表明绿色魏斯氏菌发酵液能够延长冷却猪肉的货架期。
2.4.3 绿色魏斯氏菌发酵液对冷却猪肉理化性质的影响
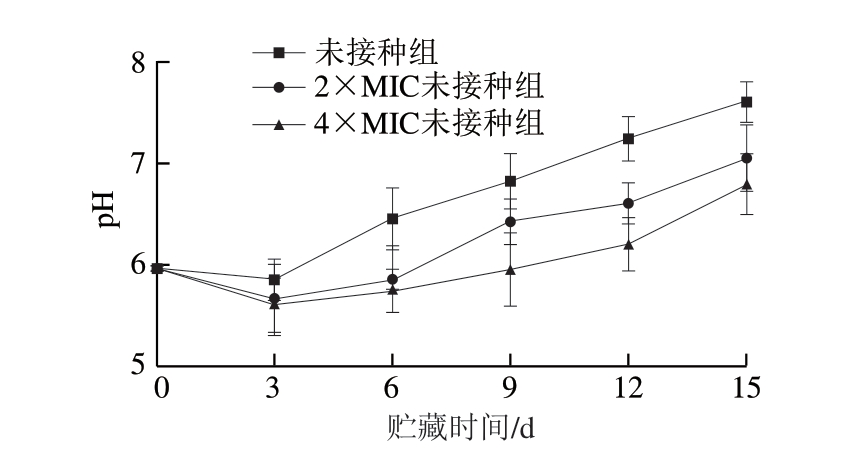
图5 绿色魏斯氏菌发酵液对冷却猪肉贮藏过程中pH值的影响
Fig.5 Effect of Weissella viridescens fermentation broth on pH of chilled pork during storage
pH值可以反映肉的新鲜程度,一般认为一级鲜肉的pH值为5.8~6.2,二级鲜肉的pH值为6.3~6.6,pH值大于6.7即为变质肉[19]。由图5可知,3 组冷却猪肉的pH值变化均为先下降后上升。在贮藏初期(0~3 d),3 组冷却猪肉的pH值均下降,这主要是由于肉样组织细胞的呼吸作用使得肌肉中的肌糖原酵解和ATP分解产生乳酸、磷酸等酸性物质所致[33]。随着贮藏时间的延长,微生物开始大量繁殖,在肉中内源蛋白酶和微生物分泌的蛋白水解酶作用下肌肉蛋白质被分解为氨基酸、生物胺和氨等碱性物质,从而使pH值上升[33]。未接种组在贮藏6 d时变质,2×MIC未接种组贮藏12 d时为变质肉,4×MIC未接种组贮藏15 d时为变质肉。表明绿色魏斯氏菌发酵液能够延缓pH值的升高,保持肉的新鲜度,适当延长冷却猪肉的货架期。
TVB-N是指肉中的蛋白质在酶和细菌的作用下分解产生的氨及胺类等碱性含氮物质,其含量是反映肉鲜度的主要指标。由图6可知,随着贮藏时间的延长,3 组冷却肉的TVB-N含量均逐渐增加。其中,未接种组上升较快,而4×MIC未接种组上升最慢。未接种组在贮藏6 d时开始变质,2×MIC未接种组在贮藏9 d时达到变质肉TVB-N含量,而4×MIC未接种组在贮藏12 d时变质。
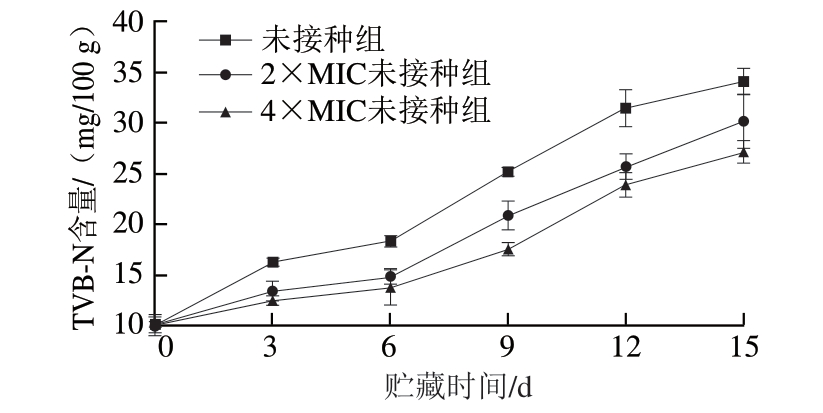
图6 绿色魏斯氏菌发酵液对冷却猪肉贮藏过程中TVB-N含量的影响
Fig.6 Effect of Weissella viridescens fermentation on TVB-N content of chilled pork during storage
3 结 论
本实验主要研究了绿色魏斯氏菌发酵液对Lm生长和生物被膜形成的影响,以及对冷却猪肉冷藏期间品质指标变化的影响。结果表明,绿色魏斯氏菌发酵液可抑制Lm的生长,亚抑菌浓度的发酵液能有效抑制Lm生物被膜的形成,且这种抑制作用呈现浓度依赖性。绿色魏斯氏菌发酵液能够抑制冷藏期间冷却猪肉中细菌和Lm的生长,延缓冷却猪肉因腐败导致的感官品质下降,同时对贮藏过程中冷却猪肉pH值和TVB-N含量的增加也产生抑制作用,使冷却猪肉的货架期明显延长。因此,绿色魏斯氏菌发酵液在冷却猪肉防腐保鲜方面具有潜在的应用价值,有望开发成为新型生物保鲜剂。目前关于绿色魏斯氏菌发酵液的应用仍有许多问题亟待解决,如绿色魏斯氏菌发酵液中有效成分的分离、纯化和鉴定,以及有效成分的作用机制等。
[1] 姜绍通, 吴洁方, 刘国庆, 等.茶多酚和大蒜素在冷却肉涂膜保鲜中的应用[J].食品科学, 2010, 31(10): 313-316.DOI:10.7506/spkx1002-6630-201010069.
[2] 张德权, 惠腾, 王振宇.我国肉品加工科技现状及趋势[J].肉类研究,2020, 34(1): 1-8.DOI:10.7506/rlyj1001-8123-20191029-256.
[3] 张德权, 侯成立.热鲜肉与冷却肉品质差异之管见[J].肉类研究,2020, 34(5): 83-90.DOI:10.7506/rlyj1001-8123-20200220-041.
[4] CHAN Y C, WIEDMANN M.Physiology and genetics of Listeria monocytogenes survival and growth at cold temperatures[J].Critical Reviews in Food Science and Nutrition, 2009, 49(3): 237-253.DOI:10.1080/10408390701856272.
[5] FARBER J M, PETERKIN P I.Listeria monocytogenes, a foodborne pathogen[J].Microbiological Reviews, 1991, 55(3): 476-511.DOI:10.1016/0196-4399(87)90051-1.
[6] KATHARIOU S.Listeria monocytogenes virulence and pathogenicity,a food safety perspective[J].Journal of Food Protection, 2002, 65(11):1811-1829.DOI:10.4315/0362-028x-65.11.1811.
[7] HAMON M, BIERNE H, COSSART P.Listeria monocytogenes: a multifaceted model[J].Nature Reviews Microbiology, 2006, 4: 423-434.DOI:10.1038/nrmicro1413.
[8] HINGSTON P, CHEN J, DHILLON B K, et al.Genotypes associated with Listeria monocytogenes isolates displaying impaired or enhanced tolerances to cold, salt, acid, or desiccation stress[J].Frontiers in Microbiology, 2017, 8: 369.DOI:10.3389/fmicb.2017.00369.
[9] KOMORA N, BRUSCHI C, MAGALHĀES R, et al.Survival of Listeria monocytogenes with different antibiotic resistance patterns to food-associated stresses[J].International Journal of Food Microbiology, 2017, 245: 79-87.DOI:10.1016/j.ijfoodmicro.2017.01.013.
[10] SHAMLOO E, HOSSEINI H, MOGHADAM Z A.Importance of Listeria monocytogenes in food safety: a review of its prevalence,detection, and antibiotic resistance[J].Journal of Veterinary Research,2019, 20(4): 241-254.
[11] SHAH M K, BERGHOLZ T M.Variation in growth and evaluation of cross-protection in Listeria monocytogenes under salt and bile stress[J].Journal of Applied Microbiology, 2020, 129: 367-377.DOI:10.1111/jam.14607.
[12] QUESILLE-VILLALOBOS A M, PARRA A, MAZA F, et al.The combined effect of cold and copper stresses on the proliferation and transcriptional response of Listeria monocytogenes[J].Frontiers in Microbiology, 2019, 10: 612.DOI:10.3389/fmicb.2019.00612.
[13] PIERCEY M J, HINGSTON P A, HANSEN L T.Genes involved in Listeria monocytogenes biofilm formation at a simulated food processing plant temperature of 15 ℃[J].International Journal of Food Microbiology, 2016, 223: 63-74.DOI:10.1016/j.ijfoodmicro.2016.02.009.
[14] LI Rui, DU Wenfang, YANG Jun, et al.Control of Listeria monocytogenes biofilm by paenibacterin, a natural antimicrobial lipopeptide[J].Food Control, 2018, 84: 529-535.DOI:10.1016/j.foodcont.2017.08.031.
[15] RIPOLLEES-AVILA C, HASCOËT A S, GUERRERO-NAVARRO A E, et al.Establishment of incubation conditions to optimize the in vitro formation of mature Listeria monocytogenes biofilms on foodcontact surfaces[J].Food Control, 2018, 92: 240-248.DOI:10.1016/j.foodcont.2018.04.054.
[16] SKOWRON K, HULISZ K, GRYŃ G, et al.Comparison of selected disinfectants efficiency against Listeria monocytogenes biofilm formed on various surfaces[J].International Microbiology, 2018, 21: 23-33.DOI:10.1007/s10123-018-0002-5.
[17] 王筱梦, 江芸, 孙芝兰, 等.生物防腐剂的保鲜机理及应用[J].食品工业科技, 2017, 38(19): 304-308.DOI:10.13386/j.issn1002-0306.2017.19.056
[18] 周辉, 叶科元, 胡逸敏, 等.屎肠球菌HY07发酵液对冷却猪肉中单增李斯特菌的抑制作用研究[J].食品科技, 2015, 40(2): 145-149.DOI:10.13684/j.cnki.spkej.2015.02.031.
[19] 时威, 谢为天, 张岩, 等.解淀粉芽孢杆菌发酵液保鲜冷却猪肉的效果研究[J].中国酿造, 2011, 10(2): 51-55.DOI:10.3969/j.issn.0254-5071.2011.10.014.
[20] 张晨曦, 贺稚非, 李洪军.乳酸菌细菌素研究进展及其在肉制品防腐保鲜领域的应用[J].食品与发酵工业, 2017, 43(7): 271-276.DOI:10.13995/j.cnki.11-1802/ts.013971.
[21] 张开屏, 马牧然, 曹凯慧, 等.肉源乳酸菌抑菌特性分析[J].食品工业科技, 2020, 41(23): 71-77.DOI:10.13652/j.issn.1003-5788.2019.03.023.
[22] WANG Huhu, YE Keping, ZHANG Qiuqin, et al.Biofilm formation of meat-borne Salmonella enterica and inhibition by the cell-free supernatant from Pseudomonas aeruginosa[J].Food Control, 2013,32(2): 650-658.DOI:10.1016/j.foodcont.2013.01.047.
[23] PÖNTINEN A, MARKKULA A, LINDSTRÖM M, et al.Twocomponent-system histidine kinases involved in growth of Listeria monocytogenes EGD-e at low temperatures[J].Applied and Environmental Microbiology, 2015, 81(12): 3994-4004.DOI:10.1128/AEM.00626-15.
[24] DJORDJEVIC D, WIEDMANN M, MCLANDSBOROUGH L A.Microtiter plate assay for assessment of Listeria monocytogenes biofilm formation[J].Applied and Environmental Microbiology, 2002,68(6): 2950-2958.DOI:10.1128/AEM.68.6.2950-2958.2002.
[25] KOCOT A M, OLSZEWSKA M A.Biofilm formation and microscopic analysis of biofilms formed by Listeria monocytogenes in a food processing context[J].LWT-Food Science & Technology, 2017, 84:47-57.DOI:10.1016/j.lwt.2017.05.042.
[26] WANG Wenkai, ZHOU Xiujuan, SUO Yujuan, et al.Prevalence,serotype diversity, biofilm-forming ability and eradication of Listeria monocytogenes isolated from diverse foods in Shanghai,China[J].Food Control, 2017, 73: 1068-1073.DOI:10.1016/j.ijfoodmicro.2018.10.020.
[27] MELIAN C, SEGLI F, GONZALEZ R, et al.Lactocin AL705 as quorum sensing inhibitor to control Listeria monocytogenes biofilm formation[J].Journal of Applied Microbiology, 2019, 127: 911-920.DOI:10.1111/jam.14348.
[28] PÉREZ-IBARRECHE M, CASTELLANO P, LECLERCQ A, et al.Control of Listeria monocytogenes biofilms on industrial surfaces by the bacteriocin-producing Lactobacillus sakei CRL1862[J].FEMS Microbiology Letters, 2017, 363: 12.DOI:10.1093/femsle/fnw118.
[29] SHAO Xinhao, FANG Kuili, MEDINA D, et al.The probiotic, Leuconostoc mesenteroides, inhibits Listeria monocytogenes biofilm formation[J].Journal of Food Safety, 2020, 40: e12750.DOI:10.1111/jfs.12750.
[30] 宋杏, 尤宏, 李福赞, 等.植物乳杆菌Y42无细胞培养上清抑制单增李斯特菌生物膜形成研究[J].食品科学技术学报, 2018, 36(2): 35-41.DOI:10.3969/j.issn.2095-6002.2018.02.005.
[31] 李文, 陈银元, 陈立明, 等.两株魏斯氏菌的益生特性比较[J].食品与发酵工业, 2019, 45(15): 37-43.DOI:10.13995/j.cnki.11-1802/ts.020151.
[32] 刘梅, 黄艳, 刘佳, 等.绿色魏斯氏菌对单增李斯特菌毒力特性的影响[J].南京农业大学学报, 2018, 41(4): 736-741.DOI:10.7685/jnau.201708007.
[33] 李鹏, 王红提, 孙玉凤, 等.高压静电场对不同包装冷鲜鸡肉贮藏过程中产品特性的影响[J].肉类研究, 2018, 32(11): 36-40.DOI:10.7506/rlyj1001-8123-201811006.