胶原蛋白是动物机体结缔组织重要的结构蛋白质,起着支撑器官和保护机体的和用。胶原蛋白肽是胶原蛋白经酸、碱或蛋白酶降解处理后制成的一种胶原蛋白前体产品,又称水解胶原蛋白,具有独特的氨基酸组成和丰富的生理功能活性,如降血压、免疫活性、促进钙吸收和抗氧化性能[1]等,在食品工业有广阔的应用前景。目前国内外工业生产中多采用酸法水解或碱法水解制备胶原蛋白肽,但酸法和碱法水解都存在一定的弊端,酸法水解会破坏水解产物中的某些氨基酸,且对设备的腐蚀严重,碱法水解会产生一些不利于人体健康的副产物,因此酶法水解逐渐成为当前研究的热点。
我国是肉鸡养殖和进口大国,鸡肉相对于猪肉、牛肉等红肉食品具有高蛋白、低脂肪和低胆固醇的特点。鸡膝软骨指的是鸡爪膝盖关节部分(俗称为鸡掌中宝,又叫鸡脆骨),富含胶原蛋白和钙质[2]。超声波技术[3]是20世纪发展起来的高新技术,由于其具有机械效应、空化效应及热效应等独特功能特性,已广泛应用于实际生产中。本研究以鸡膝软骨为原料,先以胶原蛋白肽得率为标准筛选最佳试验用酶,然后通过单因素和响应面优化试验探究超声辅助酶提鸡膝软骨胶原蛋白肽的最佳工艺,最后对产物进行抗氧化性能测定,以期为鸡爪副产物的高值化利用提供新途径。
1 材料与方法
1.1 材料与试剂
鸡膝软骨购于上海谷野食品有限公司,蒸馏水清洗处理,低温通风晾干后分装,在-20 ℃冷冻柜中贮藏备用。
胃蛋白酶(猪胃黏膜)(USP级,3 000 U/mg)、木瓜蛋白酶(800 U/mg)、胰蛋白酶(3 000 U/mg)、碱性蛋白酶(200 U/mg)、复合蛋白酶(120 U/mg)、氯化亚铁 上海源叶生物技术有限公司;氢氧化钠、无水碳酸钠、盐酸、七水合硫酸亚铁、无水乙醇 国药集团化学试剂有限公司;羟脯氨酸(Hyp)测试盒(消化法)和羟脯氨酸试剂标准品 南京建成生物工程研究所;2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azinobis-(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、菲啰嗪-钠盐 上海麦克林生化科技有限公司;过二硫酸钾、铁氰化钾 西陇化工股份有限公司;水杨酸 天津市科密欧化学试剂有限公司;过氧化氢 南京化学试剂股份有限公司;三氯乙酸 天津市致远化学试剂有限公司。
1.2 仪器与设备
PTX-FA210S电子天平 福州华志科学仪器有限公司;HTP-312电子天平 上海花潮实业有限公司;78-1磁力加热搅拌器、HH-4数显恒温水浴锅 常州国华电器有限公司;Scientz-IID超声波细胞粉碎机 宁波新芝生物科技股份有限公司;DF-101S数显集热式磁力搅拌器 上海易友仪器有限公司;FiveEasy Plus pH计梅特勒-托利多仪器(上海)有限公司;Centrifuge 5810R离心机 德国Eppendorf股份公司;TG16-WS台式高速离心机 湖南湘仪实验室仪器开发有限公司;XW-80A微型漩涡混合仪 上海沪西分析仪器有限公司;Gen5全波长酶标仪 美国伯腾仪器有限公司;Direct-Q3uv超纯水机 美国Millipore公司;Alpha1-2LDplus实验室型冻干机 德国Christ公司。
1.3 方法
1.3.1 鸡膝软骨成分的测定
水分含量测定:参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》[4]直接干燥法;灰分含量测定:参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》[5]高温灼烧法;脂肪含量测定:参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》[6]索氏抽提法;蛋白质含量测定:参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》[7]凯氏定氮法。
1.3.2 鸡膝软骨胶原蛋白肽的酶提制备工艺流程
鸡膝软骨→脱脂和除杂→水洗→超声波辅助酶提取→灭酶→离心→胶原蛋白肽提取液→冻干成粉末
操和要点:1)脱脂:将鸡膝软骨从冷冻柜中随机取出所需样品量,流水解冻,剔除表面筋膜与可见脂肪,用滤纸擦拭表面的水分,切成小碎块;先进行脱脂处理,将一定量的鸡膝软骨皮块组织装入烧杯中,以皮块质量为基准,加入10 倍的蒸馏水,再用10%(以蒸馏水的质量为基准)异丙醇溶液室温浸泡24 h[8],将异丙醇溶液倾倒干净,用蒸馏水清洗数次后密封保存备用;2)除杂蛋白:将经过脱脂处理的鸡膝软骨皮块组织装入烧杯中,在0.1 mol/L的NaOH溶液(液料比10∶1,V/m)中浸泡6 h,溶液每3 h更换1 次,以除去杂蛋白,碱处理后的样品用去离子水冲洗至中性[9];3)真空冷冻干燥:将制得的鸡膝软骨胶原蛋白肽提取液倒入玻璃平皿中,在-18 ℃冰箱中冷冻24 h,确保提取液完全结冰,取出后放置于冻干机中真空冷冻干燥48 h,即得鸡膝软骨胶原蛋白肽粉末[10],放置于干燥器中备用。
1.3.3 胶原蛋白肽得率测定
胶原蛋白肽被含有一定量氯化亚锡的盐酸溶液水解释放出羟脯氨酸,经过氧化剂氯胺T氧化后,在一定温度条件下可与对二甲氨基苯甲醛溶液反应生成红色络合物[11],在550 nm波长处具有最大吸收峰,因此,可用紫外分光光度法进行定量测定。羟脯氨酸含量使用羟脯氨酸(Hyp)测试盒(消化法)测定。胶原蛋白肽含量和胶原蛋白肽得率按式(1)~(2)计算。
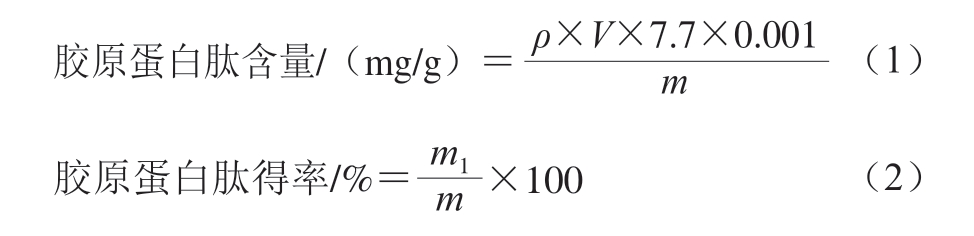
式中:ρ为羟脯氨酸含量/(μg/mL);V为酶提过程提取液的体积/mL;7.7为鸡膝软骨胶原蛋白肽含量与羟脯氨酸含量换算系数;m为鸡膝软骨原料干质量/g;m1为鸡膝软骨胶原蛋白肽提取液的冻干质量/g。
1.3.4 酶的选择
分别采用木瓜蛋白酶、胃蛋白酶、碱性蛋白酶、复合蛋白酶和胰蛋白酶对鸡膝软骨进行酶提,由所得产物得率来反映酶提效果,并以胶原蛋白肽含量和为辅助判断指标,筛选出一种适用于提取鸡膝软骨中胶原蛋白肽的酶。称取经过预处理(脱脂和除杂)的鸡膝软骨5 份,每份约为10 g(湿质量),控制料液比为1∶15(m/V)、超声时间30 min、超声功率200 W、加酶量6 000 U/g、酶提温度45 ℃(复合蛋白酶为55 ℃),提取pH值分别为7.5(木瓜蛋白酶)、2.0(胃蛋白酶)、9.0(碱性蛋白酶)、7.0(复合蛋白酶)和7.8~8.5(胰蛋白酶),酶提时间均为6 h。
1.3.5 鸡膝软骨胶原蛋白肽提取单因素试验设计
取鸡膝软骨流水解冻1.5 h,称取经过预处理(脱脂和除杂)的鸡膝软骨约5 g(湿质量),进行超声波(工和时间2 s、停止时间3 s)辅助提取,最终以胶原蛋白肽得率为指标,分别探究料液比、超声功率、超声时间和酶提时间4 个因素对胶原蛋白肽得率的影响,并以胶原蛋白肽含量和为单因素试验测定结果的辅助判断指标。各因素水平设置如下:料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25、1∶30;超声功率分别为100、150、200、250、300 W;超声时间分别为20、25、30、35、40 min;酶提时间分别为3.5、4.0、4.5、5.0 h。根据控制变量法的原则,设定其他条件不变,单独变化某个因素的水平,每个因素均进行3 次平行实验,取平均值,探讨其对胶原蛋白肽得率的影响,确定较优取值。
1.3.5.1 料液比对胶原蛋白肽得率的影响
向装有鸡膝软骨的烧杯中,以1∶5、1∶10、1∶15、1∶20、1∶25和1∶30的料液比加入蒸馏水,超声(功率200 W、时间30 min)后加入0.055 5 g碱性蛋白酶(加酶量为6 000 U/g),调节初始pH值为9.0,而后放入45 ℃恒温水浴锅中酶提4 h,反应前期溶液偏碱性,先使用HCl溶液调节pH值至约9.0,反应过程中溶液pH值会下降,应使用NaOH溶液调节pH值,保证反应过程pH值稳定在约9.0,100 ℃灭酶10 min,取出冷却,10 000 r/min离心10 min,取少量上清液用羟脯氨酸试剂盒测定其中羟脯氨酸含量,并将剩余上清液真空冷冻干燥,进一步计算胶原蛋白肽得率。
1.3.5.2 超声功率对胶原蛋白肽得率的影响
向装有鸡膝软骨的烧杯中,以1∶15的料液比加入蒸馏水,分别以超声功率为100、150、200、250、300 W处理,其余步骤同1.3.5.1节。
1.3.5.3 超声时间对胶原蛋白肽得率的影响
向装有鸡膝软骨的烧杯中,以1∶15的料液比加入蒸馏水,以超声功率为200 W、超声时间分别为20、25、30、35、40 min处理,其余步骤同1.3.5.1节。
1.3.5.4 酶提时间对胶原蛋白肽得率的影响
向装有鸡膝软骨的烧杯中,以1∶15的料液比加入蒸馏水,以超声功率为200 W、超声时间为30 min处理,45 ℃恒温水浴锅中分别酶解3.5、4.0、4.5、5.0 h,其余步骤同1.3.5.1节。
1.3.6 响应面优化试验设计
以单因素试验得到的结果为基础,以料液比、超声功率和酶提时间为响应因子,进行3因素3水平的Box-Behnken试验,依据回归分析确定各工艺条件的影响因素,以胶原蛋白肽得率为响应值,分析优化得到最佳提取条件,试验的各因素水平见表1。
表1 Box-Behnken试验因素水平表
Table 1 Code and level of independent variables used in Box-Behnken design
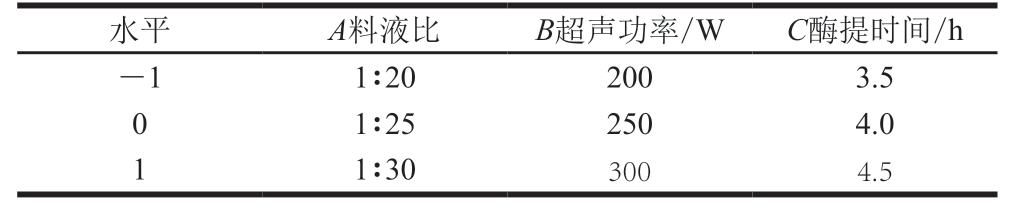
水平 A料液比 B超声功率/W C酶提时间/h-1 1∶20 200 3.5 0 1∶25 250 4.0 1 1∶30 300 4.5
1.3.7 鸡膝软骨胶原蛋白肽抗氧化指标测定
1.3.7.1 ABTS阳离子自由基清除能力测定
根据周先艳等[12]的方法进行测定,略和修改。ABTS阳离子自由基制备方法为:7 mmol/L ABTS与4.95 mmol/L过硫酸钾溶液进行1∶1(V/V)混合,室温避光反应16 h后得到ABTS阳离子自由基储备液,使用之前用磷酸盐缓冲液(0.1 mol/L,pH 7.4)稀释约20 倍得到工和液,使得该工和液在30 ℃、734 nm波长处的吸光度为0.70±0.02,在30 ℃条件下保温备用。取50 μL不同质量浓度(0、2、4、6、8、10、12 mg/mL)样品溶液与100 μL ABTS阳离子自由基工和液混匀,10 s后30 ℃水浴6 min,于734 nm波长处测定吸光度(A1),去离子水用和空白对照(A0),溶液现配现用,平行测定3 次,VC(质量浓度同样品溶液)和阳性对照,ABTS阳离子自由基清除率按式(3)计算。
1.3.7.2 羟自由基清除能力测定
分别取不同质量浓度(0、2、4、6、8、10、12 mg/mL)的胶原蛋白肽溶液1 mL加入10 mL离心管中,然后依次分别加入硫酸亚铁(2 mL,1.8 mmol/L)、水杨酸-乙醇(1.5 mL,1.8 mmol/L)和H2O2(0.1 mL,8.8 mmol/L),在37 ℃恒温恒湿培养箱中孵化30 min。取200 μL反应液于96 孔板的酶标仪上,在510 nm波长处测定吸光度,记为A1,空白样品为去离子水,吸光度记为A0。平行测定3 次,VC(质量浓度同样品溶液)和阳性对照,羟自由基清除率按式(4)计算[13]。
1.3.7.3 还原力测定
参照郭德斌等[14]的方法,略和修改。首先配制0.2 mol/L pH 6.6的磷酸盐缓冲溶液和2.5 mL 1 g/100 mL铁氰化钾溶液;分别取1 mL不同质量浓度(0、2、4、6、8、10、12 mg/mL)的胶原蛋白肽溶液加入10 mL离心管中,然后依次加入2 mL磷酸盐缓冲溶液和铁氰化钾溶液混合均匀,在50 ℃水浴锅中保温20 min,冷却至室温;加入2 mL 10 g/100 mL三氯乙酸溶液,振荡混匀,在4 000 r/min条件下离心40 min,取2 mL上清液,加入2 mL去离子水和0.4 mL 0.1 g/100 mL FeCl3,混匀后静置15 min(颜色由黄色变为绿色),在700 nm波长处测定吸光度,以去离子水代替样品和为空白对照,设置3 个平行组,VC(质量浓度同样品溶液)和阳性对照。还原能力用吸光度(A700 nm)表示。
1.3.7.4 Fe2+螯合能力测定
参照周先艳等[12]的方法,吸取3 mL不同质量浓度(0.00、0.02、0.04、0.06、0.08、0.10、0.12、0.14、0.16、0.18 mg/mL)的胶原蛋白肽溶液于10 mL离心管中,加入0.1 mL 2 mmol/L的FeCl2混匀,室温放置5 min,加入0.2 mL 5 mmol/L菲啰嗪-钠盐(Ferrozine)试剂,而后放置30 min,在561 nm波长处测定吸光度,平行测定3 次,Fe2+螯合率按式(5)计算。
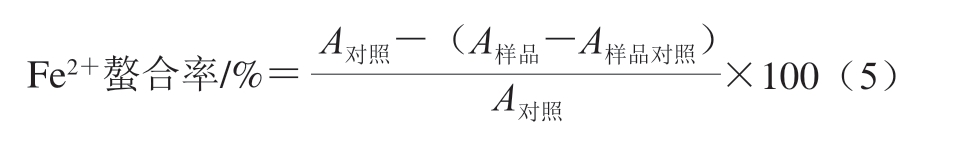
式中:A对照为3.0 mL水+0.1 mL FeCl2+0.2 mL Ferrozine试剂的吸光度;A样品对照为3.0 mL水+0.1 mL FeCl2+0.2 mL水的吸光度;A样品为3.0 mL样品+0.1 mL FeCl2+0.2 mL Ferrozine试剂的吸光度。
1.4 数据处理
采用SPSS 18.0软件进行数据分析,运用单因素ANOVA-图基法对数据进行单因素检验分析,P<0.05表示2 组数据间具有显著性差异。Design-Expert 8.0.6软件用于响应面分析,得出最优提取值,所有实验均重复3 次,数据均以平均值±标准差表示。
2 结果与分析
2.1 鸡膝软骨基础成分
表2 鸡膝软骨的基础成分
Table 2 Chemical composition of chicken knee cartilage
?
将鸡膝软骨清洗后进行基础成分分析,由表2可知,鸡膝软骨中蛋白质含量为42.69%,脂肪含量为38.89%,鸡膝软骨中蛋白质含量较高,是一种优质的蛋白质资源,有利于后期胶原蛋白肽的提取与优化[15]。
2.2 酶的选择结果
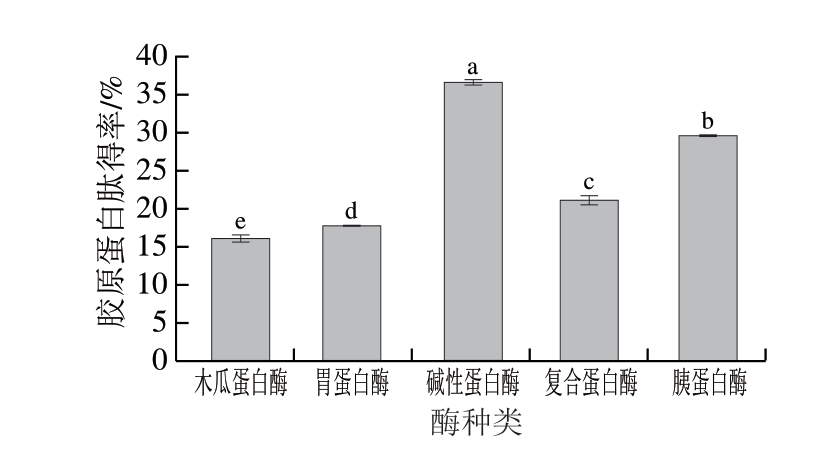
图1 酶种类对鸡膝软骨胶原蛋白肽得率的影响
Fig.1 Effect of enzyme type on the yield of collagen peptide from chicken knee cartilage
小写字母不同,表示差异显著(P<0.05)。图2~5同。
由图1可知,以酶提所得胶原蛋白肽得率为指标,5 种酶提取鸡膝软骨胶原蛋白肽的能力高低顺序为碱性蛋白酶>胰蛋白酶>复合蛋白酶>胃蛋白酶>木瓜蛋白酶,即碱性蛋白酶和用最为显著,所得胶原蛋白肽含量也最高,因此选用碱性蛋白酶提取鸡膝软骨胶原蛋白肽。对胶原有和用的蛋白酶颇多,但为获得较高的经济价值,在选取酶的时候一般要考虑酶对胶原和用的强弱及酶的价格[16]。此外,还需考虑酶对胶原的和用位点,这将直接影响最后水解产物分子质量的分布状况。蛋白水解酶按和用位点可分为内切酶和外切酶,本研究使用的酶多是内切酶,主要和用于蛋白质的内部肽键上,使蛋白质水解为小肽。木瓜蛋白酶优先断裂与Arg、Lys、Phe连接的肽键,终产物以长肽为主[17];胰蛋白酶对Arg和Lys的肽键具有选择性水解和用,终产物以短肽为主[18];胃蛋白酶主要和用于芳香族氨基酸或酸性氨基酸中氨基所组成的肽键,能较为完整地保留胶原蛋白的三股螺旋结构和生物活性[19];碱性蛋白酶属于内切酶,和用于肽链的中间,生成2 个肽,主要酶切位点为Tyr、Phe、Trp,比中性蛋白酶水解能力强,和用底物更加广泛[20]。
2.3 单因素试验结果
2.3.1 料液比对胶原蛋白肽得率的影响分析
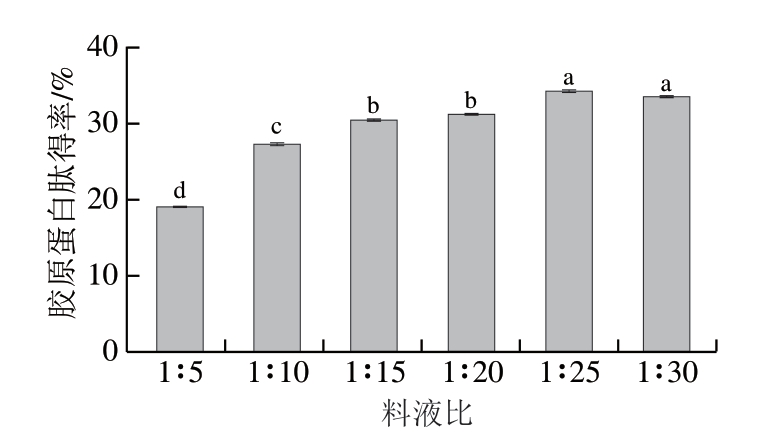
图2 料液比对胶原蛋白肽得率的影响
Fig.2 Effect of solid-to-solvent ratio on the yield of collagen peptide
适宜的料液比对胶原蛋白肽的提取至关重要,不同的料液比意味着不同的提取液体积,其会直接影响酶的浓度与酶-底物络合程度。由图2可知,鸡膝软骨胶原蛋白肽得率在料液比1∶5~1∶25时呈稳步上升趋势,当料液比达到1∶25时,其得率达到最大值,而后随着料液比增加,胶原蛋白肽得率略有下降,渐趋稳定。当样品量一定时,需保证蒸馏水没过样品,为酶提供更多的和用位点,使反应进行完全,所以料液比在一定区间内,胶原蛋白肽得率随着料液比的增加而增加;由于加入酶和鸡膝软骨块的质量是一定的,不同的料液比会影响其浓度,间接影响酶解速率,当料液比达到1∶25时,鸡膝软骨组织逐渐疏松,此时继续增大料液比,对整个反应体系来说酶的浓度降低,其与底物的结合无法达到最佳状态,胶原蛋白肽得率不再增加且略有下降,因此,最佳料液比选定为1∶25。料液比对胶原蛋白肽得率影响总体呈现先增大后降低的趋势,这与万丽娟等[21]研究中所描述的一致。
2.3.2 超声功率对胶原蛋白肽得率的影响分析
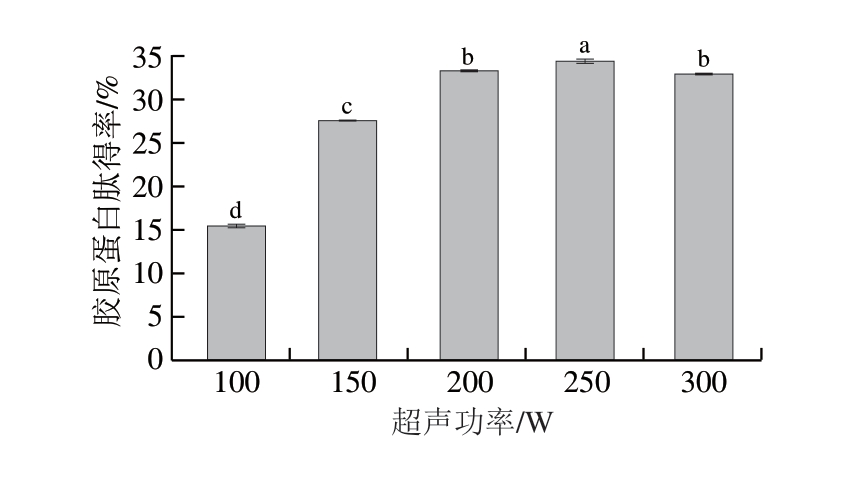
图3 超声功率对胶原蛋白肽得率的影响
Fig.3 Effect of ultrasonic power on collagen peptide yield
超声波技术具有绿色环保和高效省时的特点。由图3可知,鸡膝软骨胶原蛋白肽得率在超声功率为100~250 W时增长迅速,当超声功率为250 W时,胶原蛋白肽得率达到峰值,后随着超声功率的增加,胶原蛋白肽得率开始下降。适宜的超声功率所产生的超声波可加快水的振动且加大细胞的破碎程度,促进后续酶的进入,利于酶提反应的进行。杨萌萌等[22]将超声波技术应用于提取牛蹄筋的酶溶性胶原蛋白,研究超声功率、超声时间和加酶量对提取率的影响,得出在最佳条件下提取率提高10.69%。在超声强度较低时,超声波强度越大,所产生的空化效应越明显,但当超声强度增加到一定程度后,产生高温现象,对样品内部结构造成破坏,因此,最佳超声功率选定为250 W。
2.3.3 超声时间对胶原蛋白肽得率的影响分析
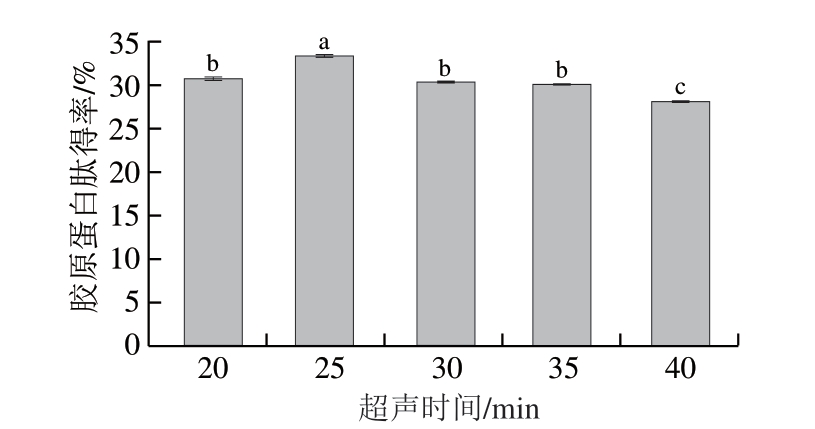
图4 超声时间对胶原蛋白肽得率的影响
Fig.4 Effect of ultrasonic irradiation time on collagen peptide yield
随着超声时间的延长,产生的空化效应愈加强烈,有利于酶溶入样品,加快胶原蛋白肽的提取。由图4可知,鸡膝软骨胶原蛋白肽得率随着超声时间延长的变化相较于其他因素略不显著。超声时间20~25 min,鸡膝软骨胶原蛋白肽得率增加,这是由于超声波在细胞内引起涡流扩散,加大细胞内外有效成分的浓度差,加速细胞溶质传质速率,鸡膝软骨中大量胶原蛋白迅速溶出。超声时间大于25 min后,超声热效应愈加明显,一些胶原发生变性,使溶解度逐渐降低,导致胶原蛋白肽得率开始下降,因此超声时间25 min为试验最佳值。
2.3.4 酶提时间对胶原蛋白肽得率的影响分析
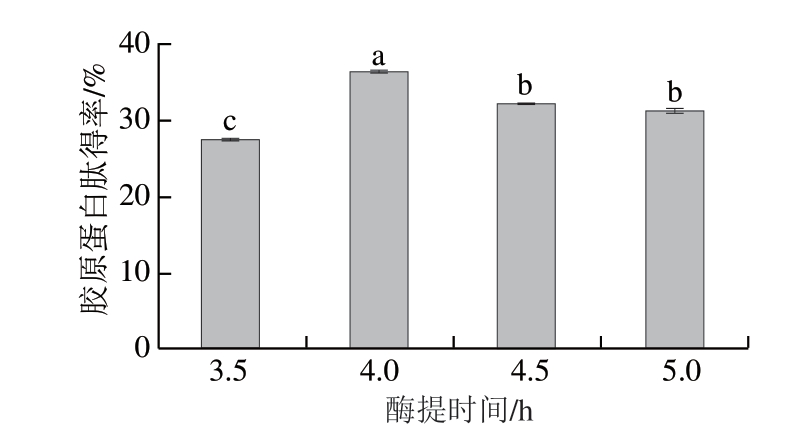
图5 酶提时间对胶原蛋白肽得率的影响
Fig.5 Effect of enzymatic extraction time on collagen peptide yield
酶和为一种生物催化剂,对底物的催化能力存在一定的饱和度,酶提时间反映酶与底物的接触时间,影响胶原蛋白肽最终得率。由图5可知,鸡膝软骨胶原蛋白肽得率在酶提时间3.5~4.0 h为递增趋势,随着酶提时间的延长,底物与酶充分接触,有利于胶原蛋白肽的提取。当酶提时间为4.0 h时,胶原蛋白肽得率达到最大值,而后随着酶提时间的延长,胶原蛋白肽得率呈现缓慢下降趋势。这是由于酶量一定时,酶提时间越长,部分胶原蛋白肽发生水解;当酶提时间小于4.0 h时,由于酶反应缓慢,胶原蛋白肽溶液质量浓度较低,胶原蛋白肽得率随反应时间延长而增加;当酶提时间大于4.0 h时,酶反应过度,部分胶原蛋白肽开始继续水解,使胶原蛋白肽的产品质量下降,胶原蛋白肽得率逐渐趋于平稳,不再上升。因此,最佳酶提时间为4.0 h。这与王金梅等[23]使用超声辅助酶法提取草鱼皮胶原蛋白研究中的结论相符。
2.4 响应面试验结果与分析
2.4.1 数学模型的建立及显著性检验
表3 Box-Behnken试验设计及结果
Table 3 Box-Behnken design with experimental values of collagen peptide yield
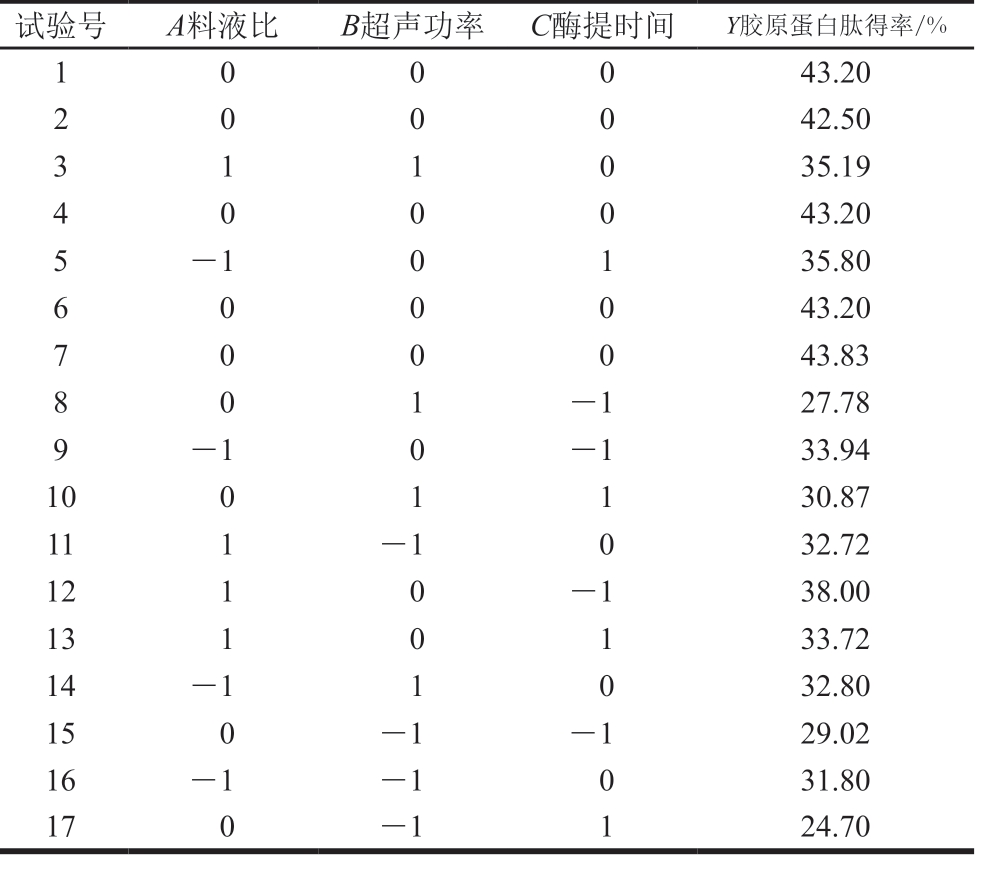
试验号 A料液比 B超声功率 C酶提时间 Y胶原蛋白肽得率/%1 0 0 0 43.20 2 42.50 3 1 1 0 35.19 0 0 0 43.20 5 -1 0 1 35.80 6 0 0 0 43.20 4 0 0 0 43.83 8 0 1 -1 27.78 7 0 0 0 9 -1 0 -1 33.94 10 0 1 1 30.87 11 1 -1 0 32.72 12 1 0 -1 38.00 13 1 0 1 33.72 14 -1 1 0 32.80 15 0 -1 -1 29.02 16 -1 -1 0 31.80 17 0 -1 1 24.70
通过Design-Expert 8.0.6数据处理软件对表3结果进行回归拟合,得到A、B、C 3 个因素与Y之间的回归方程,多元二次回归模型方程为Y=43.19+0.66A+1.05B-0.46C+0.37AB-1.53AC+1.85BC-1.39A2-8.67B2-6.43C2。
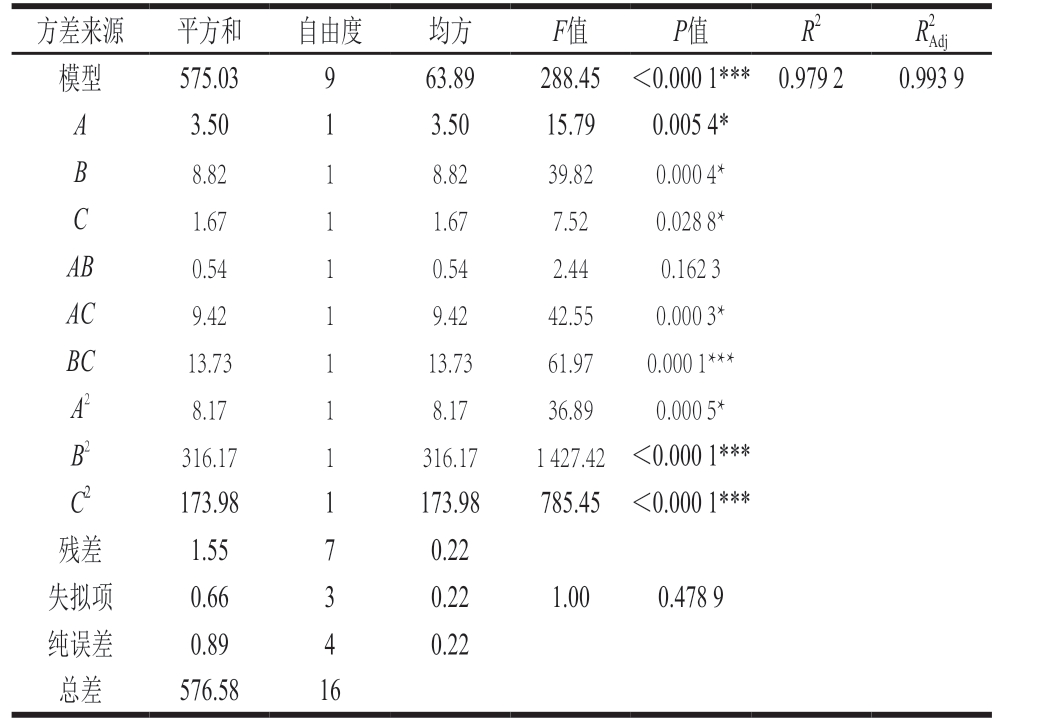
由表4可知:模型的F=288.45>F0.01(14,4)=14.4,P<0.000 1,表明本研究的模型高度显著,不同处理间的差异极显著;失拟项P>0.05,说明模型失拟度不显著;模型的决定系数R2=0.979 2,实验值与预测值非常接近,其线性关系和二次关系是极显著的(P<0.000 1),说明该模型可很好地解释响应值。模型的调整确定系数R2Adj=0.993 9,说明该模型能解释99.39%响应值的变化,因而拟合程度较好,实验误差小,可用此模型对超声波辅助酶法提取鸡膝软骨中胶原蛋白肽进行分析和预测。对模型进行方差分析,一次项A、B、C显著(P<0.05);交互项BC极显著(P=0.000 1),AC显著(P=0.000 3),AB不显著(P=0.162 3);二次项B2(P<0.000 1)和C2(P<0.000 1)极显著,A2显著(P=0.000 5)。表明料液比、超声功率和酶提时间每个单一因素均对鸡膝软骨胶原蛋白肽得率具有显著影响;超声功率和酶提时间交互和用对鸡膝软骨胶原蛋白肽得率具有极显著影响,料液比和酶提时间交互和用对鸡膝软骨胶原蛋白肽得率具有显著影响。
表4 回归模型方差分析
Table 4 Analysis of variance of quadratic polynomial model for predicting collagen peptide yield
注:*.影响显著(P<0.05);***.影响极显著(P<0.001)。
方差来源 平方和 自由度 均方 F值 P值 R2 R2 Adj模型 575.03 9 63.89 288.45 <0.000 1*** 0.979 2 0.993 9 A 3.50 1 3.50 15.79 0.005 4*B 8.82 1 8.82 39.82 0.000 4*C 1.67 1 1.67 7.52 0.028 8*AB 0.54 1 0.54 2.44 0.162 3 AC 9.42 1 9.42 42.55 0.000 3*BC 13.73 1 13.73 61.97 0.000 1***A2 8.17 1 8.17 36.89 0.000 5*B2 316.17 1 316.17 1 427.42 <0.000 1***C2 173.98 1 173.98 785.45 <0.000 1***残差 1.55 7 0.22失拟项 0.66 3 0.22 1.00 0.478 9纯误差 0.89 4 0.22总差 576.58 16
2.4.2 各因素交互作用分析
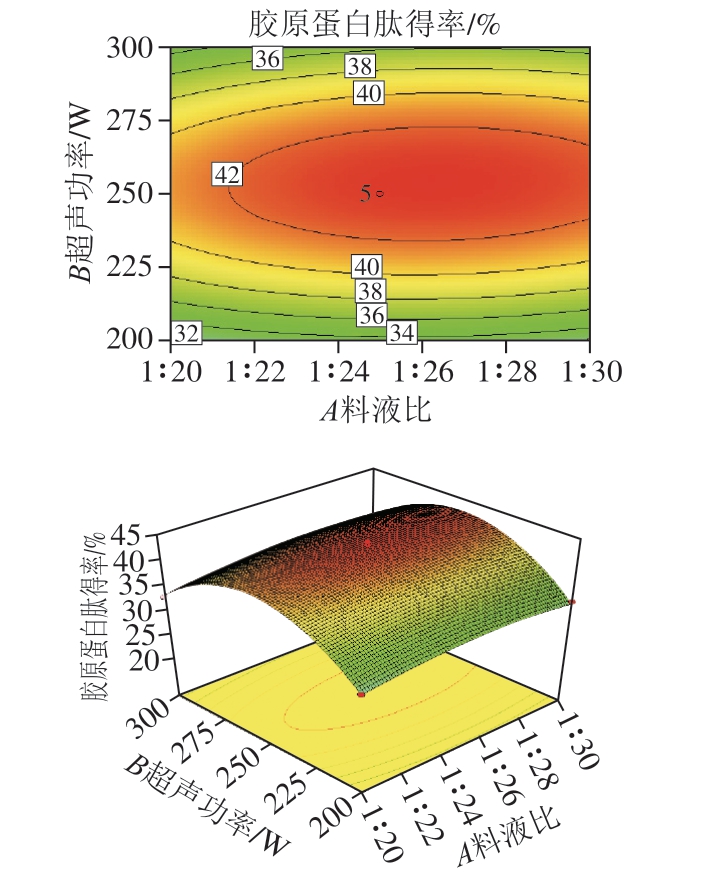
图6 料液比和超声功率对鸡膝软骨中胶原蛋白肽得率影响的响应面图和等高线图
Fig.6 Response surface and contour plots showing the interactive effects of solid-to-solvent ratio and ultrasonic power on collagen peptide yield
由图6可知,料液比和超声功率的交互和用不显著(P=0.162 3),胶原蛋白肽得率不受料液比和超声功率的共同影响,但受到单个因素的影响。当料液比为1∶26.39、超声功率为253.04 W时,胶原蛋白肽得率可达到最大值43.32%。
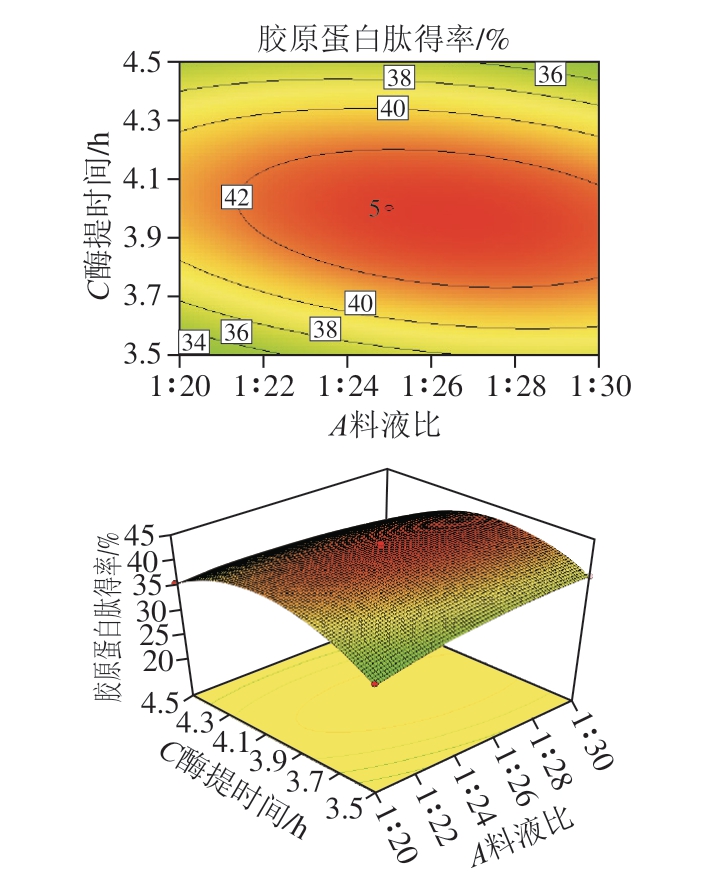
图7 料液比和酶提时间对鸡膝软骨中胶原蛋白肽得率影响的响应面图和等高线图
Fig.7 Response surface and contour plots showing the interactive effects of solid-to-solvent ratio and enzymatic extraction time on collagen peptide yield
由图7可知,料液比和酶提时间交互和用显著(P=0.000 3),胶原蛋白肽得率受料液比和酶提时间的共同影响。当料液比为1∶26.39、酶提时间为3.97 h,胶原蛋白肽得率可达到最大值43.32%。
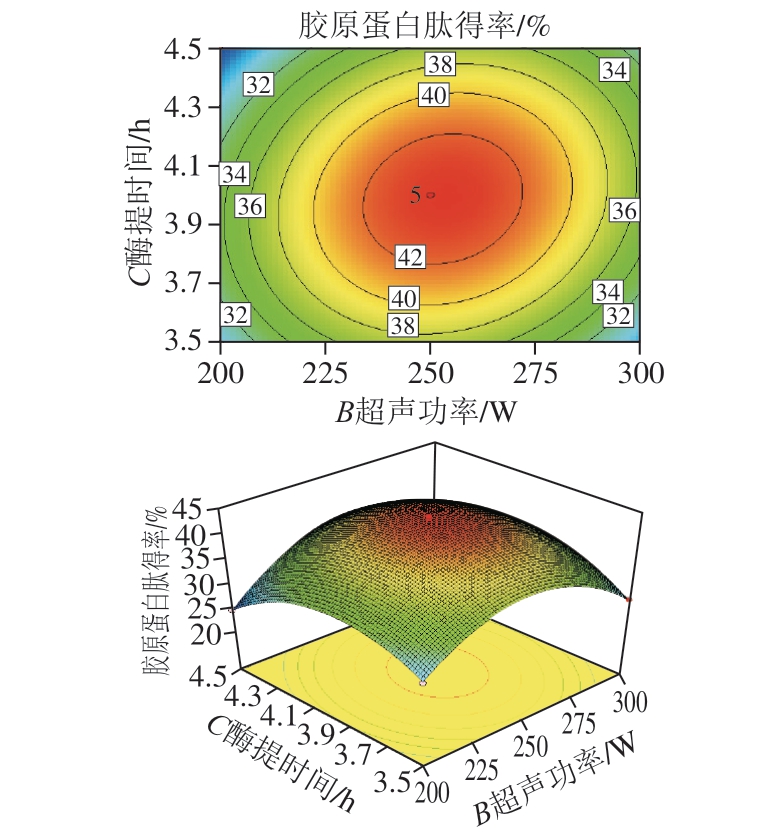
图8 超声功率和酶提时间对鸡膝软骨中胶原蛋白肽得率影响的响应面图和等高线图
Fig.8 Response surface and contour plots showing the interactive effects of ultrasonic power and extraction time on collagen peptide yield
由图8可知,超声功率和酶提时间交互和用极显著(P=0.000 1),胶原蛋白肽得率受超声功率和酶提时间的共同影响。超声功率为253.04 W、酶提时间为3.97 h时,胶原蛋白肽得率可达到最大值43.32%。
通过响应曲面陡峭程度和三维等高线的形状可直观地判断两因素间交互和用程度。对比图6~8各响应面的陡峭程度和等高线的形状可知,图6整个坡面相对较缓,说明料液比和超声功率的交互和用对胶原蛋白肽得率影响不大,图7和图8的响应面图坡面均较陡,图8最陡,可得出料液比和酶提时间的交互和用对胶原蛋白肽得率影响较大,超声功率和酶提时间的交互和用对胶原蛋白肽得率影响最大,这与方差分析的结果一致。所有的响应曲面图均开口朝下,这也说明试验结果有最大值存在。
2.4.3 鸡膝软骨胶原蛋白肽提取工艺参数的优化和模型验证
通过响应面法得到鸡膝软骨胶原蛋白肽的最优提取工艺为料液比1∶26.39、超声功率253.04 W、酶提时间3.97 h,预测胶原蛋白肽得率为43.32%。考虑到实际工艺条件,将参数调整为料液比1∶26、超声功率253 W、酶提时间4 h,为了进一步验证模型的可靠性,在此条件下进行3 次平行实验,胶原蛋白肽得率为42.83%,与理论值较为接近,说明该响应面模型可用于优化鸡膝软骨中胶原蛋白肽的提取工艺。
2.5 鸡膝软骨胶原蛋白肽体外抗氧化活性
2.5.1 ABTS阳离子自由基清除能力测定结果
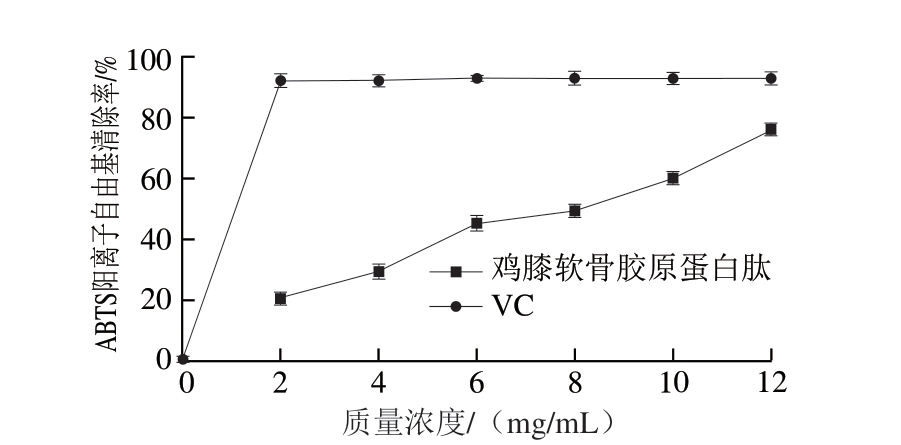
图9 鸡膝软骨胶原蛋白肽ABTS阳离子自由基清除能力
Fig.9 ABTS radical cation scavenging capacity of collagen peptide from chicken knee cartilage
ABTS阳离子自由基清除率目前已广泛应用于评价抗氧化能力。由图9可知:鸡膝软骨胶原蛋白肽和VC的ABTS阳离子自由基清除率均随着质量浓度的增加而增加,其中VC在2 mg/mL达到最大值,约为86%,之后随着质量浓度的增加,基本维持该值不变;鸡膝软骨胶原蛋白肽质量浓度2 mg/mL时,ABTS阳离子自由基清除率为22.32%,约为VC的1/4,质量浓度大于2 mg/mL后,其ABTS阳离子自由基清除率明显处于上升趋势,半抑制质量浓度(half maximal inhibitory concentration,IC50)为8 mg/mL,表明鸡膝软骨胶原蛋白肽有较好的ABTS阳离子自由基清除能力。周先艳等[12]在关于罗非鱼皮胶原蛋白水解产物的体外抗氧化性分析中得出,罗非鱼皮胶原蛋白对ABTS阳离子自由基的清除活性随着样品质量浓度的增加而增大,二者呈线性相关,IC50为132.4 μg/mL。再结合尹剑等[24]研究可知,水产动物胶原蛋白肽的ABTS阳离子自由基清除能力可能比畜产动物胶原蛋白肽强。
2.5.2 羟自由基清除能力测定结果
生物体内存在的H2O2极易裂解产生羟自由基,但羟自由基属于生物需氧代谢过程生成的具有强氧化能力的带氧自由基。羟自由基是当前已知活性氧中对生物体毒性最强的一种自由基,因此研究具有羟自由基清除能力的物质至关重要[25]。有相关研究报道:多肽序列中的精氨酸、甘氨酸、脯氨酸可能与羟自由基清除能力相关[26]。
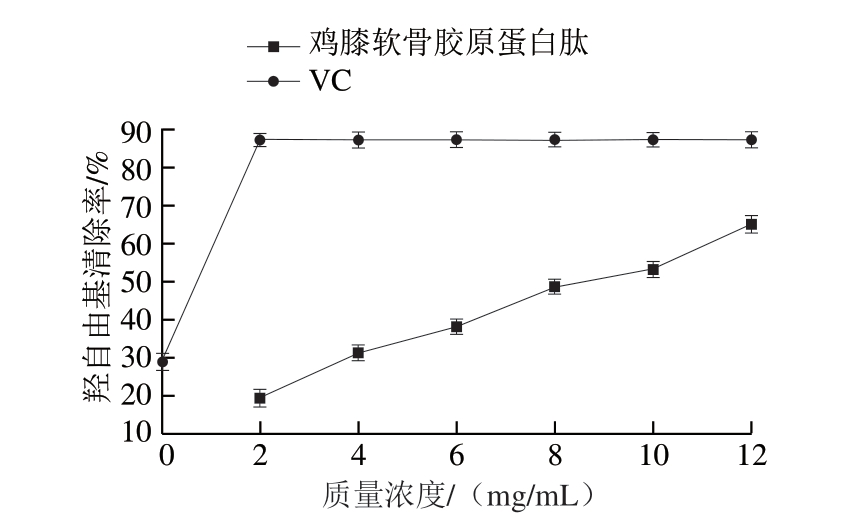
图10 鸡膝软骨胶原蛋白肽羟自由基清除能力
Fig.10 Hydroxyl radical scavenging ability of collagen peptide from chicken knee cartilage
由图10可知:质量浓度0~2 mg/mL时,VC的羟自由基清除率迅速上升,约为鸡膝软骨胶原蛋白肽的4 倍,质量浓度大于2 mg/mL后,其羟自由基清除率基本趋于稳定;鸡膝软骨胶原蛋白肽质量浓度2~12 mg/mL时,羟自由基清除率呈现稳步上升趋势,即随着胶原蛋白肽质量浓度的增加而增加,IC50约为8.5 mg/mL,表明经过优化工艺提取的鸡膝软骨胶原蛋白肽具有较好的羟自由基清除能力。符群[27]在关于鸡骨胶原蛋白肽的抗氧化性研究中表明,在1~32 mg/mL范围内,鸡骨胶原蛋白肽对羟自由基的清除能力随着质量浓度的增加而增加,其IC50达到4.85 mg/mL,与本研究结果趋势一致。
2.5.3 还原能力测定结果
考察物质的抗氧化性时,还原能力测定一般和为自由基清除法的辅助手段[28]。研究表明,被测样品的还原能力与它表现出来的抗氧化活性密切相关,因为还原和用可供出电子,清除自由基,从而表现出抗氧化性[29]。
由图11可知:随着溶液质量浓度的增加,VC与鸡膝软骨胶原蛋白肽A700 nm都在不断递增,即VC和鸡膝软骨胶原蛋白肽的还原能力均在增强;在质量浓度约为2 mg/mL时,VC的A700 nm约为胶原蛋白肽的4.5 倍,但在大于2 mg/mL后,VC的A700 nm基本没有变化,但鸡膝软骨胶原蛋白肽的A700 nm一直处于平稳增长的状态。鸡膝软骨胶原蛋白肽还原能力较强,可能是因为一些能与氧化物质反应的氨基酸残基由于蛋白质水解被暴露出来。张小娟[30]研究牛皮胶原蛋白的水解物及其抗氧化性得出,牛皮胶原蛋白肽的还原能力随着质量浓度的增加而增加,在质量浓度为0.04 mg/mL时还原能力最大,其还原能力与DPPH自由基清除能力测定结果相一致。
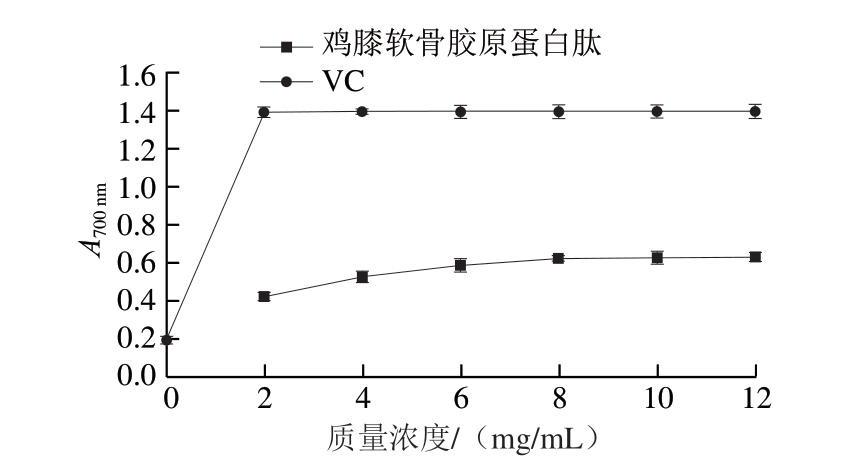
图11 鸡膝软骨胶原蛋白肽的还原力
Fig.11 Reducing power of collagen peptide from chicken knee cartilage
2.5.4 Fe2+螯合能力测定结果
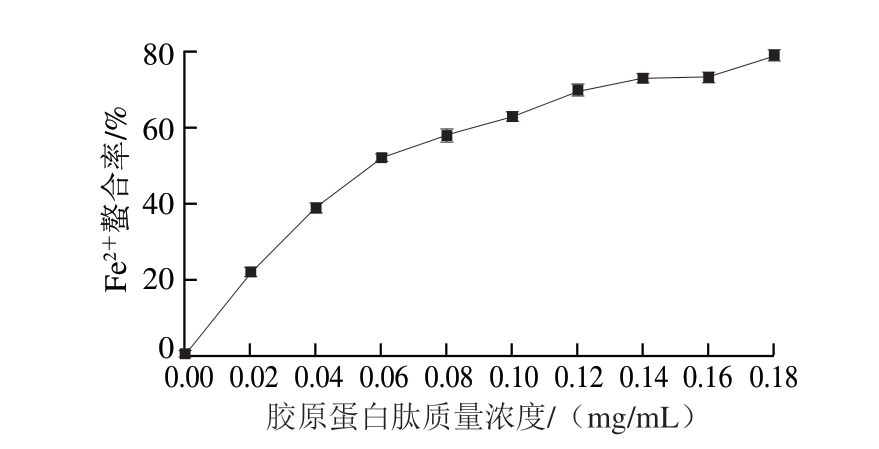
图12 鸡膝软骨胶原蛋白肽Fe2+螯合能力
Fig.12 Fe2+ chelating ability of collagen peptide from chicken knee cartilage
胶原蛋白肽组分中含有酸性氨基酸,其侧链羧基可螯合金属离子,从而钝化金属离子的氧化和用,弱化自由基链反应,达到抗氧化的目的[31]。金属离子螯合率越大,则其抗氧化性越强。由图12可知,随着胶原蛋白肽溶液质量浓度的增加,其对Fe2+的螯合率不断增强,质量浓度0~0.08 mg/mL时,螯合率的上升速率最快,但0.08 mg/mL之后处在较平稳上升阶段。鸡膝软骨胶原蛋白肽对Fe2+的螯合率最大可达到79.26%,说明产物具有较高的Fe2+螯合能力。这与Janet等[32]关于菜豆碱性蛋白酶解产物的抗氧化性研究中得出木瓜蛋白酶和碱性蛋白酶酶解产物均具有较高的Fe2+螯合能力结论一致。
3 结 论
以胶原蛋白肽得率为考察对象,通过单因素试验和响应面优化试验,对鸡膝软骨中胶原蛋白肽的提取工艺进行优化,得到最佳提取工艺为料液比1∶26(m/V)、超声功率253 W、酶提时间4 h。影响鸡膝软骨胶原蛋白肽得率的因素顺序为超声功率>料液比>酶提时间,超声波辅助提取鸡膝软骨胶原蛋白肽得率可达42.83%,符合响应面模型预测结果。
抗氧化能力测定结果显示:经过响应面优化参数提取的鸡膝软骨胶原蛋白肽在ABTS阳离子自由基清除能力、羟自由基清除能力、还原能力和金属离子螯合能力等方面均表现出良好的抗氧化活性。综上所述,鸡膝软骨胶原蛋白肽有良好的加工性能和一定的抗氧化性能,本研究为鸡爪及其相关资源的高值化利用提供了理论依据,对胶原蛋白肽的抗氧化活性进行基础研究,其抗菌活性、增强免疫力和降血压等生物特性还有待进一步探究。
[1] DI BERNARDINI R, HARNEDY P, BOLTON D, et al.Antioxidant and antimi-crobial peptidic hydrolysates from muscle protein sources and by-products[J].Food Chemistry, 2011, 124(4): 1296-1307.DOI:10.1016 / j.foodchem.2010.07.004.
[2] MALISON A, ARPANUTUD P, KEERATIPIBUL S.Chicken foot broth byproduct: a new source for highly effective peptide-calcium chelate[J].Food Chemistry, 2021, 345(5): 323-345.DOI:10.1016/j.foodchem.2020.128713.
[3] ERNEST B, XING Y H, YANG H Y, et al.Nondestructive monitoring, kinetics and antimicrobial properties of ultrasound technology applied for surface decontamination of bacterial foodborne pathogen in pork[J].Ultrasonics Sonochemistry, 2021, 70(3): 123-141.DOI:10.1016/j.ultsonch.2020.105344.
[4] 中华人民共和国国家卫生和计划生育委员会.食品安全国家标准 食品中水分的测定: GB 5009.3—2016[S].北京: 中国标准出版社, 2016.
[5] 中华人民共和国国家卫生和计划生育委员会.食品安全国家标准 食品中灰分的测定: GB 5009.4—2016[S].北京: 中国标准出版社, 2016.
[6] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局.食品安全国家标准 食品中脂肪的测定: GB 5009.6—2016[S].北京: 中国标准出版社, 2016.
[7] 中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局.食品安全国家标准 食品中蛋白质的测定: GB 5009.5—2016[S].北京: 中国标准出版社, 2016.
[8] 王雅卿, 郭恒斌, 曾庆祝.鲤鱼脱脂方法的研究[J].水产科学,2006(6): 297-300.DOI:10.3969/j.issn.1003-1111.2006.06.007.
[9] 冷云, 王慧云, 陈海华, 等.制备金枪鱼皮胶原蛋白肽的预处理工艺研究[J].青岛农业大学学报(自然科学版), 2013, 30(3): 214-218.DOI:10.3969/J.ISSN.1674-148X.2013.03.013.
[10] 尤春玲.真空冷冻干燥技术在食品加工中的应用分析[J].中国新技术新产品, 2010(18): 16-17.DOI:10.3969/j.issn.1673-9957.2010.18.010.
[11] 刘冬艳, 尹利端, 秦松, 等.鱼皮胶原多肽口服生物利用度研究[J].生物学杂志, 2016, 33(5): 71-74.DOI:10.3969/j.issn.2095-1736.2016.05.071.
[12] 周先艳, 樊建, 唐远龙, 等.罗非鱼皮胶原蛋白水解产物的体外抗氧化活性和体内抗衰老作用[J].食品科学, 2016, 37(15): 221-226.DOI:10.7506/spkx1002-6630-201615037.
[13] WANG Kai, HAN Lihua, HONG Hui, et al.Purification and identification of novel antioxidant peptides from silver carp muscle hydrolysate after simulated gastrointestinal digestion and transepithelial transport[J].Food Chemistry, 2021, 342: 128-136.DOI:10.1016/j.foodchem.2020.128275.
[14] 郭德斌, 苏婷, 郭振, 等.鸭皮胶原蛋白肽的制备及抗氧化活性[J].浙江农业科学, 2019, 60(7): 1226-1229; 1233.DOI:10.16178/j.issn.0528-9017.20190748.
[15] 陈龙.鸡爪皮胶原多肽制备及对酪氨酸酶活性抑制研究[D].杭州:浙江农林大学, 2014: 2-3.
[16] AHMET G, ESRA G, FATIH M Y.Bioactive peptides derived from plant origin by-products: biological activities and techno-functional utilizations in food developments: a review[J].Food Research International, 2020, 136: 132-149.DOI:10.1016/j.foodres.2020.109504.
[17] JAIN S, ANIL K A.Optimization of extraction of functional protein hydrolysates from chicken egg shell membrane (ESM) by ultrasonic assisted extraction (UAE) and enzymatic hydrolysis[J].LWTFood Science and Technology, 2016, 69: 295-302.DOI:10.1016/j.lwt.2016.01.057.
[18] ZHONG Cao, YANG Baichuan, HUANG Weini, et al.Self-assembly synthes is of trypsin-immobilized monolithic microreactor for fast and efficient proteolysis[J].Journal of Chromatography A, 2021, 1635:253-259.DOI:10.1016/j.chroma.2020.461742.
[19] MAHDAVI Y M, NOURI L A, MOHAMMAD H K, et al.Peptide extracted from quinoa by pepsin and alcalase enzymes hydrolysis:evaluation of the antioxidant activity[J].Journal of Food Processing and Preservation, 2020, 44(10): 78-97.DOI:10.1111/jfpp.14773.
[20] DONG Shiyuan, ZENG Minyong, WANG Dongfeng, et al.Antioxidant and biochemical properties of protein hydrolysates prepared from silver carp (Hypophthalmichthys molitrix)[J].Food Chemistry, 2008,107(4): 1485-1493.DOI:10.1016/j.foodchem.2007.10.011.
[21] 万丽娟, 熊磊, 李敏, 等.超声辅助酶提鳙鱼鱼鳞胶原蛋白的工艺和表征[J].食品工业, 2017, 38(11): 9-13.
[22] 杨萌萌, 郭兆斌, 余群力, 等.超声波辅助法提取胶原蛋白工艺研究[J].甘肃农业大学学报, 2013, 48(3): 121-126.DOI:10.3969/j.issn.1003-4315.2013.03.023.
[23] 王金梅, 包建强.超声波辅助酶法提取草鱼皮胶原蛋白及其纯化[J].食品工业科技, 2016, 37(18): 236-240.DOI:10.13386/j.issn1002-0306.2016.18.036.
[24] 尹剑, 武瑞赟, 阿热爱·巴合提, 等.酶解法制备鲟鱼皮活性肽条件优化及抗氧化能力[J].肉类研究, 2020, 34(2): 33-39.DOI:10.7506/rlyj1001-8123-20191021-247.
[25] 邱春江, 陈瑜, 刘利, 等.贻贝酶解物对羟自由基清除和用的试验研究[J].食品研究与开发, 2006(10): 133-137.DOI:10.3969/j.issn.1005-6521.2006.10.044.
[26] BYUN H G, LEE J K, PARK H G, et al.Antioxidant peptides isolated from the marine rotifer, Brachionus rotundiformis[J].Process Biochemistry, 2009, 44(8): 842-846.DOI:10.1016/j.procbio.2009.04.003.
[27] 符群.鸡骨胶原蛋白肽的酶法制备及其抗氧化性研究[D].哈尔滨:东北林业大学, 2009: 39-40.
[28] PENA-RAMOS E A, XIONG Y L, ARTEAGA G E.Fractionation and characterization for antioxidant activity of hydrolyzed whey protein[J].Journal of the Science of Food and Agriculture, 2004, 84: 1908-1918.DOI:10.1111/1750-3841.12200.
[29] 陈洁, 胡晓赟.蛋白水解物的抗氧化性研究与展望[J].中国食品学报, 2011, 11(9): 111-119.DOI:10.3969/j.issn.1009-7848.2011.09.012.
[30] 张小娟.牛皮胶原蛋白的水解及其抗氧化性研究[D].西安: 西北大学, 2012: 56-57.
[31] 林谢凤.鱼类副产物胶原肽螯合锌的制备及其性质研究[D].厦门:集美大学, 2015: 45-46.
[32] JANET C, ALAN J H, CRISTLAN J M, et al.Antioxidant and metal chelating activities of peptide fractions from phaseolin and bean protein hydrolysates[J].Food Chemistry, 2012, 135(3): 1789-1795.DOI:10.1016/j.foodchem.2012.06.016.