羊肉风味浓郁、肉质细嫩、味道鲜美,具有高蛋白质、低脂肪、低胆固醇等特点,且富含人体所必需的氨基酸和微量元素,营养价值高,深受消费者喜爱[1-2]。食用品质是评价羊肉品质优劣的关键指标之一,会直接影响消费者的购买决定和产业经济效益,其主要包括嫩度、色泽、风味和多汁性[3]。因此,羊肉品质的精准保持和快速鉴别是肉类产业需求的重点和肉品科学的研究热点。
采用新型包装技术是保证羊肉品质的重要手段,也是改善羊肉品质的重要突破[4],其中托盘包装、真空包装和气调包装是目前产业中常用的主要包装方式[5]。目前羊肉的鉴别方法有近红外光谱、高光谱、拉曼光谱等技术,这些技术具有能够实现快速检测、无损耗、样品无需前处理等优点,但其检测精度较低、稳定性差,易受环境因素的影响[6]。
近年来,随着分子生物学理论和组学技术的迅速发展,利用组学技术挖掘表征肉品质生物标志物成为肉品领域的研究热点,这为鉴别、评价和预测肉品质开辟了新思路[7-8]。热休克蛋白(heat shock protein,Hsp)是动物中广泛存在的一类高度保守蛋白,通常按分子质量大小可分为Hsp100、Hsp90、Hsp70、Hsp60及小分子蛋白(Hsp20、Hsp27、αB-晶体蛋白)[9]。Hsp具有分子伴侣、抑制应激诱导的细胞凋亡和维持肌原纤维结构稳定的生物学功能,对肉品质具有重要影响。Hwang等[10]研究发现,Hsp27表达量与猪肉的韧性呈正相关。Kim等[11]研究发现,Hsp27表达量与牛肉的韧性呈正相关,与亮度值(L*)和红度值(a*)呈负相关。Carvalho等[12]研究印度诺尔牛发现,Hsp70表达量增加,牛肉剪切力增大。Zhang Muhan等[13]研究鹅肉发现,Hsp70在低滴水损失组有较高的表达,并被认为是肉中持水力的潜在预测因子。Luca等[14]研究表明,随着Hsp70表达量的升高,猪肉滴水损失降低。但目前有关Hsp27、Hsp70在羊肉中的研究报道还很少,Hsp27、Hsp70能否作为表征羊肉品质的潜在生物标志物有待进一步研究,不同包装方式是否会影响宰后羊肉冷藏过程中Hsp27、Hsp70表达量变化尚不清楚。
本研究以羊背最长肌为研究对象,探究不同包装方式下羊肉冷藏过程中Hsp27、Hsp70相对表达量的变化及其与肉品质间的关系,明确包装方式对Hsp27、Hsp70的影响规律,为羊肉品质评价和鉴别提供参考依据。
1 材料与方法
1.1 材料与试剂
羊肉采集于内蒙古美洋洋食品有限公司。选取20 只6~8 月龄、饲养环境一致的小尾寒羊公羊。Hsp27小鼠单克隆抗体G3.1(ab2790)、Hsp70小鼠单克隆抗体3A3(ab5439)、辣根过氧化物酶标记山羊抗小鼠免疫球蛋白G(immunoglobulin G,IgG)(ab205719)英国Abcam公司;GAPDH鼠单克隆抗体(AB-M-M001)杭州贤至生物科技有限公司。
1.2 仪器与设备
电泳设备、转膜设备、ChemiDocTM MP凝胶成像仪美国Bio-Rad公司;CM-600D色差计 日本柯尼卡-美能达(中国)有限公司;数显式肌肉嫩度仪 东北农业大学工程学院;Testo 205便携式pH计 德国德图公司;RDW550P卧式气调包装机(全自动) 成都市罗斯波尔机械有限公司;HH-4数显恒温水浴锅 江苏省荣华仪器制造有限公司。
1.3 方法
1.3.1 样品处理及实验设计
采用完全随机法将20 只小尾寒羊公羊分成4 组,每组5 只,分别用于托盘包装、真空包装、高氧气调包装(O2、CO2体积比75∶25)和低氧气调包装(O2、CO2体积比50∶50)。托盘包装采用聚丙烯托盘,真空包装袋厚度150 μm,透氧性4 cm3/(m2·d),透湿性4.5 g/(m2·d),气调包装膜厚度100 μm,透氧性<2 cm3/(m2·d),透湿性<5 g/(m2·d)。小尾寒羊屠宰后30 min内取双侧背最长肌,置于4 ℃冷库15 min内剔除表面筋膜及结缔组织,每组样品分成大小相等的6 份,在宰后1 h对样品进行包装,随后将包装的样品置于4 ℃冰箱中冷藏,分别在冷藏1、6、12、24、72、144 h时测定pH值、肉色、蒸煮损失率、剪切力并留样。留样样品于冻存管中液氮速冻后置于干冰中带回实验室,用于Hsp27和Hsp70相对表达量测定。
1.3.2 pH值的测定
参考Szerman等[15]方法,使用便携式pH计测定各时间点肉样的pH值,将探头插入羊肉中,深度约2 cm,选取3 个不同位置连续测定3 次,结果取平均值。
1.3.3 肉色的测定
参考李蒙[16]方法,用CM-600D色差计测定L*、a*、黄度值(b*),色差计在使用前用标准白瓷板和标准黑板在室温下进行校正,每个样品表面选取4 个位点进行测定,结果取平均值。
1.3.4 剪切力的测定
参考李桂霞等[17]的方法,稍作修改。将肉样置于蒸煮袋内,抽去袋内空气,使肉块表面紧贴蒸煮袋,密封袋口,放入71 ℃水浴锅中30 min后将肉块取出,冷却至室温并放入4 ℃冰箱过夜。将肉样沿着肌纤维方向切成1.0 cm×1.0 cm×1.5 cm的小块。采用数显式肌肉嫩度仪对样品进行测定,每个样品重复测定7 次,结果取平均值。
1.3.5 蒸煮损失率的测定
参考肖雄等[18]的方法,稍作修改。称取肉样,质量记为m1(g),随后将肉样放置于蒸煮袋内并抽去袋内空气,使肉块表面紧贴蒸煮袋,密封袋口,放入71 ℃水浴锅中30 min后将肉块取出,冷却至室温用定性滤纸擦去表面水分后称质量,记为m2(g)。蒸煮损失率按照下式计算。
1.3.6 Hsp免疫印迹分析
肌浆蛋白的提取:参考Huang Honggang[19]、Oh[20]等的方法并稍作修改,称取1 g冷冻的肉样,加入6 mL预冷的缓冲液(0.01 mol/L Tris、0.01 mol/L二硫苏糖醇(dithiothreitol,DTT)、pH 8.3、蛋白酶抑制剂1 片(配制50 mL))冰浴匀浆,然后在4 ℃条件下10 000×g离心30 min,上清液即为肌浆蛋白溶液。肌浆蛋白溶液用超纯水稀释20 倍后,用BCA试剂盒测定蛋白质质量浓度,将肌浆蛋白质量浓度调至8 mg/mL,保存于-80 ℃备用。
免疫印迹:参考Shi[21]、Xing[22]、Xing Tong[23]等的方法并稍作修改。提取的肌浆蛋白样品调整质量浓度为8 mg/mL,按体积比1∶1加入十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)蛋白上样缓冲液(10 g/100 mL SDS、10 mL甘油、0.5 mol/L Tris-HCl(pH 6.8)、1 mol/L DTT、1 mol/L溴酚蓝),沸水浴中加热10 min,蛋白上样量为10 μL。SDS-PAGE电泳中Hsp27和Hsp70采用12%的分离胶和4%的浓缩胶,电泳初始电压为70 V,待蛋白进入分离胶后将电压调整为110 V,待蛋白到达凝胶底部时停止电泳。电泳结束后采用湿法将凝胶上的蛋白条带转移至硝酸纤维素(nitrocellulose,NC)膜上,转膜结束后用TBST缓冲液(137 mmol/L NaCl、20 mmol/L Tris、体积分数0.1%吐温-20、pH 7.6)清洗NC膜3 次,每次10 min。清洗后将条带置于含5 g/100 mL脱脂乳粉的TBST溶液中室温封闭1 h,加入一抗(Hsp27小鼠单克隆抗体(稀释比1∶200)、Hsp70小鼠单克隆抗体(稀释比1∶1 000)和GAPDH鼠单克隆抗体(稀释比1∶500)),4 ℃缓慢摇动孵育过夜,随后用TBST溶液漂洗NC膜3 次,每次10 min。漂洗后加入二抗(稀释比1∶2 000),室温缓慢摇动孵育2 h;孵育结束后用TBST溶液漂洗NC膜3 次,加入电化学发光显色液浸泡5 min,凝胶成像仪拍照。采用Quantity One软件分析条带灰度值。
1.4 数据处理
采用Microsoft Office Excel 2010软件进行数据分析与作图。利用IBM SPSS Statistics 25.0软件进行差异显著性分析,采用邓肯多重比较法,P<0.05即为差异显著,所得结果以平均值±标准差的形式表示。
2 结果与分析
2.1 不同包装方式处理羊肉冷藏过程中Hsp27的相对表达量变化
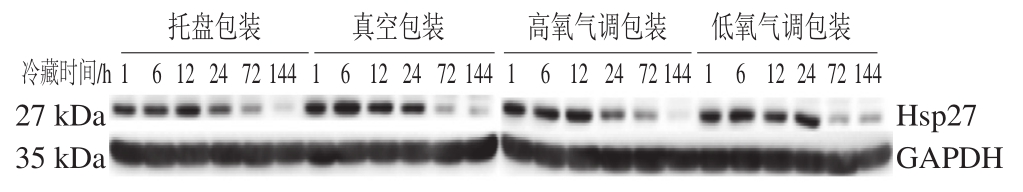
图 1 不同包装方式处理羊肉冷藏过程中Hsp27免疫印迹图
Fig. 1 Western blotting showing the relative expression of Hsp27 in lamb meat packaged under different conditions during refrigeration storage
由图1可知,随着冷藏时间的延长,不同包装方式处理下Hsp27条带灰度值减小,表明Hsp27发生降解,尤其是在冷藏72、144 h,Hsp27的降解程度明显高于宰后初期。
由图2可知,随着宰后冷藏时间延长,不同包装方式羊肉冷藏过程中Hsp27相对表达量呈先增加后降低趋势,其中真空包装和低氧气调包装羊肉Hsp27相对表达量在冷藏6 h达到峰值,托盘包装和高氧气调包装在冷藏12 h达到峰值。宰后初期羊刚被屠宰放血,处于缺氧状态,外界氧气和营养供应的终止导致细胞产生不可避免的凋亡,Hsp27作为一种应激蛋白立即对细胞凋亡产生应激反应,以维持细胞的平衡。李婕等[24]的研究结果表明,Hsp27表达量总体呈降低趋势,这与本研究结果一致。宰后冷藏后期Hsp27相对表达量下降,原因可能是Hsp27作为分子伴侣,结合受损的蛋白质以及错误折叠的蛋白质保护细胞内蛋白,防止不可逆的损伤[25],最终导致机体Hsp27相对表达量降低。
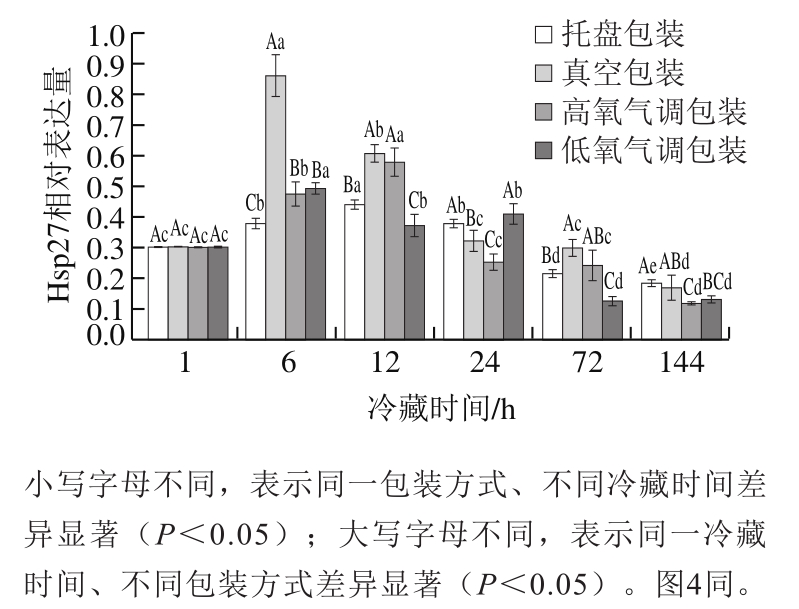
图 2 不同包装方式处理羊肉冷藏过程中Hsp27相对表达量
Fig. 2 Relative expression of Hsp27 in lamb meat packaged under different conditions during refrigeration storage
2.2 不同包装方式处理羊肉冷藏过程中Hsp70的相对表达量变化
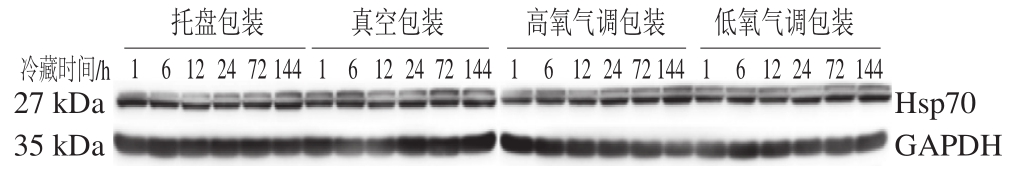
图 3 不同包装方式处理羊肉冷藏过程中Hsp70免疫印迹图
Fig. 3 Western blotting showing the relative expression of Hsp70 in lamb meat packaged under different conditions during refrigeration storage
由图3可知,随冷藏时间的延长,不同包装方式羊肉Hsp70条带灰度值逐渐增加,尤其是在冷藏144 h,Hsp70的条带明显深于冷藏初期。
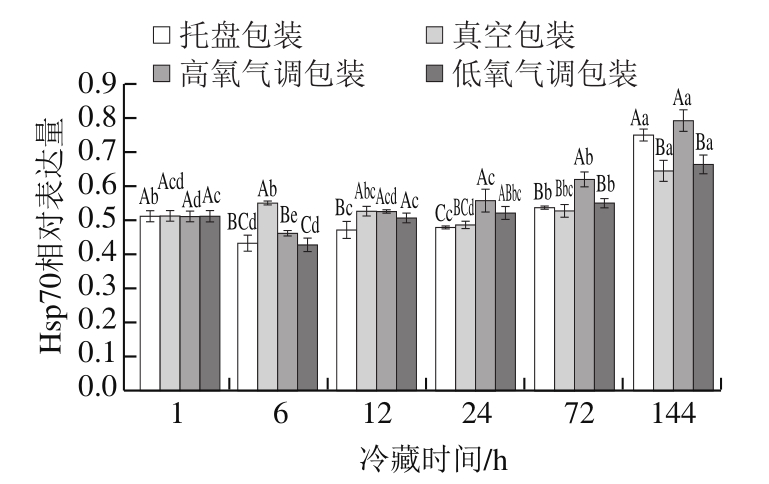
图 4 不同包装方式处理羊肉冷藏过程中Hsp70相对表达量
Fig. 4 Relative expression of Hsp70 in lamb meat packaged under different conditions during refrigeration storage
由图4可知,不同包装方式羊肉冷藏过程中Hsp70相对表达量呈逐渐上升趋势,在144 h达到峰值。在冷藏后期的24、72、144 h,高氧气调包装组Hsp70相对表达量明显高于托盘包装、真空包装和低氧气调包装组。4 种包装方式羊肉冷藏过程中Hsp70相对表达量逐渐上升,可能是由于Hsp70可以抑制细胞凋亡进程,保护组织免受氧化应激损伤[26-27]。冷藏24~144 h,高氧气调包装组Hsp70相对表达量明显高于其他3 个处理组,出现这种现象的原因可能是高氧环境可能会引起肉品发生氧化应激反应,从而促使Hsp70表达量上调,来保护机体免受氧化应激损伤。杨啸吟等[28]研究结果表明,高氧环境可能会促使抗氧化蛋白2、Hsp及DJ-1蛋白的表达量上调,以抵御肉品的氧化应激反应,这与本研究结果一致。
2.3 不同包装方式处理羊肉冷藏过程中品质的变化
表 1 不同包装方式羊肉冷藏过程中pH值、肉色、剪切力及蒸煮损失率的变化
Table 1 Changes in pH value, meat color, shear force and cooking loss of lamb packaged under different conditions during refrigeration

注:小写字母不同,表示同一包装方式、不同冷藏时间差异显著(P<0.05);大写字母不同,表示同一冷藏时间、不同包装方式差异显著(P<0.05)。
指标 包装方式 冷藏时间/h 1 6 12 24 72 144 pH托盘包装 6.86±0.16a 6.47±0.20b 6.33±0.27b 6.04±0.10Ac 5.79±0.02d 5.83±0.06cd真空包装 6.86±0.16a 6.51±0.18b 6.30±0.08c 5.94±0.06ABd 5.85±0.05d 5.83±0.03d高氧气调包装 6.86±0.16a 6.62±0.17b 6.46±0.20b 6.01±0.08Ac 5.84±0.05cd 5.78±0.08d低氧气调包装 6.86±0.16a 6.58±0.06b 6.40±0.23c 5.90±0.05Bd 5.81±0.06d 5.80±0.09d L*托盘包装 35.15±1.29c 34.95±1.37c37.23±2.96bc40.33±3.56a39.79±1.65ab41.21±1.05ABa真空包装 35.15±1.29c 35.19±0.84c 35.20±1.34c 40.81±2.91b 41.18±1.35b43.37±1.27Aa高氧气调包装 35.15±1.29b 35.52±1.71b 35.28±3.24b 41.13±2.18a 40.85±2.59a41.41±2.74ABa低氧气调包装 35.15±1.29b 33.67±1.53b 35.25±1.57b 40.38±2.63a 40.64±2.17a40.30±0.81Ba a*托盘包装 12.72±0.94b 11.91±1.16b11.97±1.07ABb11.39±0.58b 12.09±0.85b 14.55±2.13a真空包装 12.72±0.94bc11.43±0.95c12.97±0.78Ab12.49±0.72bc11.44±0.79c 15.19±1.47a高氧气调包装 12.72±0.94ab12.28±1.01ab10.16±0.60Bc12.56±1.53ab11.26±1.51bc13.53±1.52a低氧气调包装 12.72±0.94ab11.64±1.19b10.90±1.24BCb12.55±0.61ab11.50±1.46b 14.00±2.22a b*托盘包装 8.91±0.81de 8.51±0.63e 10.07±1.49cd10.70±1.43bc11.64±0.55b 13.79±1.13a真空包装 8.91±0.81cd 8.19±0.83d 9.70±0.56c 10.89±1.06b 11.10±0.44b 14.35±1.16a高氧气调包装 8.91±0.81c 8.93±0.97c 8.72±1.59c 11.14±1.64b 11.03±1.67b 13.51±1.63a低氧气调包装 8.91±0.81c 8.06±0.60c 9.04±1.12c 10.74±1.35b 10.50±0.80b 12.76±1.58a剪切力/N托盘包装 74.17±2.67c79.30±2.50Ab77.23±0.90Bb92.94±2.28Aa78.81±2.66Bb65.64±0.92Bd真空包装 74.17±2.67a76.40±2.62Ba76.67±1.09Ba70.16±2.72Cb66.23±0.69Cc37.05±1.39Dd高氧气调包装 74.17±2.67c74.15±1.89Bc52.62±1.39Ce95.36±0.39Ab98.29±1.47Aa67.60±0.76Ad低氧气调包装 74.17±2.67b81.41±0.81Aa81.87±1.76Aa74.58±0.84Bb67.94±0.69Cc55.67±0.96Cd蒸煮损失率/%托盘包装 12.04±1.21b 7.81±0.96c 8.29±2.58c 12.15±1.67b 17.10±4.32a 13.74±1.18b真空包装 12.04±1.21b 7.04±1.55c 7.67±1.48c 8.58±2.52c 17.48±3.56a14.84±3.82ab高氧气调包装 12.04±1.21bc 8.75±1.91cd 7.26±3.23d 10.99±3.84bcd19.12±3.58a 13.58±2.47b低氧气调包装 12.04±1.21b 8.03±1.52c 9.84±2.31bc 12.51±2.76b 20.94±4.55a 13.15±1.61b
由表1可知,随着冷藏时间的延长,4 种不同包装方式羊肉pH值逐渐下降,从冷藏1 h的6.86显著下降到冷藏72 h的5.8左右(P<0.05),72 h后趋于稳定。a*和L*是衡量肉类新鲜度最重要的颜色参数,真空包装处理组冷藏至144 h的L*和a*明显高于托盘包装和气调包装处理组,说明真空包装处理组羊肉的L*和a*最好,在冷藏至144 h仍能保持较好的色泽,本研究结果与董玉影[29]、Maqsood[30]等研究结果一致。随着冷藏时间的延长,不同包装方式处理组b*呈上升趋势,但是在不同包装之间无显著差异。
随着冷藏时间的延长,不同包装方式羊肉剪切力呈先升高后降低的趋势。冷藏后期24~144 h,高氧气调包装组剪切力显著高于托盘包装、低氧气调包装和真空包装组(P<0.05),说明真空包装处理组嫩度最好,原因可能是Hsp27表达量的下调增加了肌动蛋白的降解,肌肉中肌原纤维完整性衰减和内部Z线和I带连接处被破坏,从而导致肌原纤维超微结构发生变化,肉嫩度提高[31]。在冷藏后期72~144 h,真空包装处理组剪切力明显低于其他3 个处理组(P<0.05),在此期间Hsp70相对表达量也明显低于其他3 个处理组,推测真空包装处理组肉嫩度降低可能与Hsp70表达量有关。
持水能力是肉类加工的重要性能,羊肉蒸煮损失率是衡量肌肉持水能力的重要指标。随着冷藏时间的延长,除冷藏1 h外不同包装方式羊肉蒸煮损失率总体呈先增加后降低的趋势,表明不同包装方式羊肉的持水能力随着时间的延长而降低;冷藏6 h和12 h,真空包装处理组蒸煮损失率低于托盘包装、高氧气调包装和低氧气调包装,说明真空包装处理组羊肉持水能力较好。但是蒸煮损失率在不同包装之间差异不显著,证实了不同包装对蒸煮损失率没有显著影响,本研究结果与朱学伸等[32]研究一致。在冷藏6 h,真空包装处理组蒸煮损失率明显低于托盘包装和气调包装处理组(P<0.05),此时真空包装处理组Hsp27、Hsp70相对表达量显著高于其他3 个处理组,原因可能是Hsp27、Hsp70表达量上调抑制了肌肉细胞凋亡,减少膜破裂和细胞内水分流失,使肉的保水能力增强。
2.4 不同包装方式下羊肉Hsp27、Hsp70表达量与pH值、肉色、剪切力和蒸煮损失率相关性分析
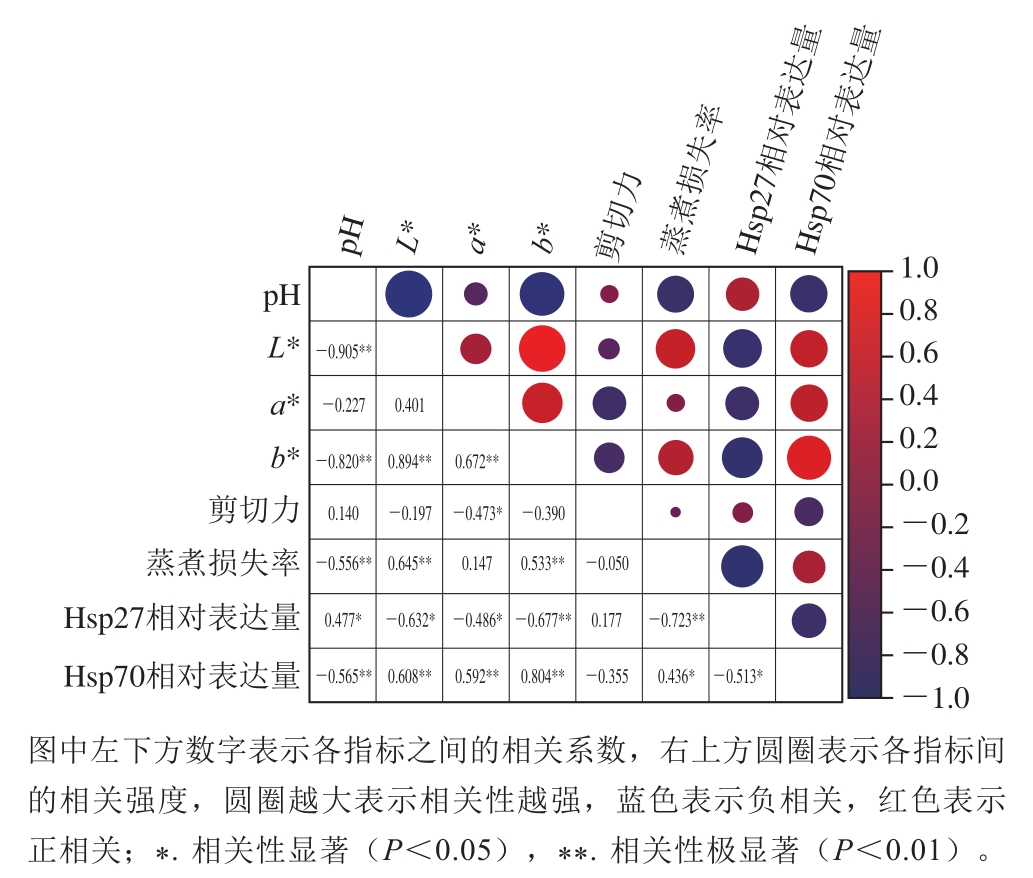
图 5 Hsp27、Hsp70相对表达量与肉品质的相关性分析
Fig. 5 Correlation analysis between the relative expression of Hsp27 and Hsp70 and meat quality
对不同包装方式羊肉冷藏1~144 h Hsp27和Hsp70相对表达量及品质进行相关性分析,可进一步明确这2 种潜在标志物与各品质的相关程度。由图5可知:Hsp27相对表达量与pH值呈显著正相关(P<0.05),相关系数为0.477,与剪切力呈正相关,与L*、b*和蒸煮损失率呈极显著负相关(P<0.01),相关系数分别为-0.632、-0.677和-0.723,与a*呈显著负相关(P<0.05),相关系数为-0.486;Hsp70相对表达量与pH值呈极显著负相关(P<0.01),相关系数为-0.565,与剪切力呈负相关,与L*、a*、b*呈极显著正相关(P<0.01),相关系数分别为0.608、0.592和0.804;与蒸煮损失率呈显著正相关(P<0.05),相关系数为0.436。
本研究中Hsp27相对表达量与pH值呈显著正相关与其他研究基本一致[24,33],与肉色(L*、b*)呈极显著负相关,与a*呈显著负相关与Kim[11]、张淼[34]等的研究结果一致。蛋白质组学的研究结果中关于Hsp27与嫩度的关系并不一致,其中Ding Zhenjiang等[35]研究发现,Hsp27表达量与牛肉的韧性呈负相关,Huang Honggang等[19]研究发现,猪肉中Hsp27表达量与韧性呈正相关,本研究结果与其研究结果一致。本研究中Hsp70相对表达量与pH值呈极显著负相关,与L*、a*、b*呈极显著正相关,这与Gagaoua等[7]研究结果一致。Hsp70相对表达量与剪切力呈负相关,Guillemin等[27]研究表明,Hsp70相对表达量与牛肉嫩度呈负相关,这与本研究结果一致。
3 结 论
随着冷藏时间的延长,不同包装方式羊肉的pH值逐渐降低;在冷藏后期(144 h),真空包装处理组的L*和a*明显高于托盘包装和气调包装,剪切力显著低于托盘包装和气调包装。随着冷藏时间的延长,不同包装方式羊肉冷藏过程中Hsp27相对表达量呈先增加后降低趋势,Hsp70相对表达量呈逐渐上升趋势。Hsp27和Hsp70与羊肉品质的相关关系如下:Hsp27相对表达量与pH值、剪切力呈正相关,与L*、a*、b*和蒸煮损失率呈负相关;Hsp70相对表达量与pH值、剪切力呈负相关,与L*、a*、b*和蒸煮损失率呈正相关。本研究表明,Hsp27相对表达量下调、Hsp70相对表达量上调可提高羊肉的色泽和嫩度,且真空包装处理组羊肉保鲜效果最好。
[1]柴婷, 许艳丽, 赛迪古丽, 等. 改善羊肉嫩度方法的研究进展[J].中国草食动物科学, 2020, 40(6): 60-62. DOI:10.3969/j.issn.2095-3887.2020.06.014.
[2]刘瑞生, 王珂, 徐建峰, 等. 中草药添加剂改善羊肉品质的研究进展[J].中国畜牧杂志, 2020, 56(7): 42-45. DOI:10.19556/j.0258-7033.20200113-04.
[3]周招洪, 陈健, 郑玉强, 等. 性别和屠宰体重对猪肉品质的影响研究进展[J]. 当代畜牧, 2015(3): 60-64.
[4]TRNGREN M A, DARRÉ M, GUNVIG A, et al. Case studies of packaging and processing solutions to improve meat quality and safety[J]. Meat Science, 2018, 144: 149-158. DOI:10.1016/j.meatsci.2018.06.018.
[5]扶庆权, 刘瑞, 张万刚, 等. 不同包装方式下蛋白质氧化对鲜肉品质的影响研究进展[J]. 肉类研究, 2019, 33(4): 49-54. DOI:10.7506/rlyj1001-8123-20190318-061.
[6]胡争艳, 王军淋, 吴平谷, 等. 蛋白质组学技术在肉类鉴别及肉质分析中的应用进展[J]. 生物技术进展, 2018, 8(3): 206-213.
[7]GAGAOUA M, COUVREUR S, GUILLAIN L B, et al. Associations among protein biomarkers and pH and color traits in Longissimus thoracis and Rectus abdominis muscles in protected designation of origin maine-Anjou cull cows[J]. Journal of Agricultural and Food Chemistry, 2017, 65(17): 3569-3580. DOI:10.1021/acs.jafc.7b00434.
[8]GAGAOUA M, TERLOUW E M, MICOL D, et al. Understanding early post-mortem biochemical processes underlying meat color and pH decline in the Longissimus thoracis muscle of young blond d’Aquitaine bulls using protein biomarkers[J]. Journal of Agricultural and Food Chemistry, 2015, 63(30): 6799-6809. DOI:10.1021/acs.jafc.5b02615.
[9]张牧焓, 王道营, 刘芳, 等. 热休克蛋白与肌内磷脂的关系[J].江苏农业学报, 2012, 28(3): 673-676. DOI:10.3969/j.issn.1000-4440.2012.03.041.
[10]HWANG I H, PARK B Y, KIM J H, et al. Assessment of postmortem proteolysis by gel-based proteome analysis and its relationship to meat quality traits in pig Longissimus[J]. Meat Science, 2005, 69(1): 79-91.DOI:10.1016/j.meatsci.2004.06.019.
[11]KIM N K, CHO S, LEE S H, et al. Proteins in Longissimus muscle of Korean native cattle and their relationship to meat quality[J]. Meat Science, 2008, 80(4): 1068-1073. DOI:10.1016/j.meatsci.2008.04.027.
[12]CARVALHO M E, GASPARIN G, POLETI M D, et al. Heat shock and structural proteins associated with meat tenderness in Nellore beef cattle, a Bos indicus breed[J]. Meat Science, 2014, 96(3): 1318-1324.DOI:10.1016/j.meatsci.2013.11.014.
[13]ZHANG Muhan, WANG Daoying, XU Xinglian, et al. Comparative proteomic analysis of proteins associated with water holding capacity in goose muscles[J]. Food Research International, 2018, 116: 354-361.DOI:10.1016/j.foodres.2018.08.048.
[14]LUCA A D, MULLEN A M, ELIA G, et al. Centrifugal drip is an accessible source for protein indicators of pork ageing and waterholding capacity[J]. Meat Science, 2011, 88(2): 261-270. DOI:10.1016/j.meatsci.2010.12.033.
[15]SZERMAN N, RAO W L, LI X, et al. Effects of the application of dense phase carbon dioxide treatments on technological parameters,physicochemical and textural properties and microbiological quality of lamb sausages[J]. Food Engineering Reviews, 2015, 7(2): 241-249.DOI:10.1007/s12393-014-9092-9.
[16]李蒙. 蛋白质磷酸化调控肉色稳定性的作用机制[D]. 北京: 中国农业科学院, 2017.
[17]李桂霞, 李欣, 李铮, 等. 宰后僵直及成熟过程中羊背最长肌理化性质的变化[J]. 食品科学, 2017, 38(21): 112-118. DOI:10.7506/spkx1002-6630-201721018.
[18]肖雄, 侯成立, 李欣, 等. 宰后贮藏过程中羔羊肉食用品质的变化[J]. 肉类研究, 2019, 33(9): 53-58. DOI:10.7506/rlyj1001-8123-20190625-145.
[19]HUANG Honggang, LARSEN M R, KARLSSON A H, et al.Gel-based phosphoproteomics analysis of sarcoplasmic proteins in postmortem porcine muscle with pH decline rate and time differences[J]. Proteomics, 2011, 11(20): 4063-4076. DOI:10.1002/pmic.201100173.
[20]OH E, LEE B, CHOI Y M. Associations of heat-shock protein expression with meat quality and sensory quality characteristics in highly marbled Longissimus thoracis muscle from hanwoo steers categorized by Warner-Bratzler shear force value[J]. Foods, 2019,8(12): 638. DOI:10.3390/foods8120638.
[21]SHI C H, LEMEE A U, DENG J T, et al. Characterization of heat shock protein 27 in extracellular vesicles: a potential anti-inflammatory therapy[J].The FASEB Journal, 2019, 33(2): 1-14. DOI:10.1096/fj.201800987R.
[22]XING T, WANG P, ZHAO L, et al. A comparative study of heat shock protein 70 in normal and PSE (pale, soft, exudative)-like muscle from broiler chickens[J]. Poultry Science, 2016, 95(10): 2391-2396.DOI:10.3382/ps/pew181.
[23]XING Tong, XU Xinglian, ZHOU Guanghong, et al. The effect of transportation of broilers during summer on the expression of heat shock protein 70, postmortem metabolism and meat quality[J]. Journal of Animal Science, 2015, 93(1): 62-70. DOI:10.2527/jas.2014-7831.
[24]李婕, 罗天林, 师希雄, 等. 牦牛肉宰后成熟过程中热休克蛋白27表达量与食用品质的相关性分析[J]. 食品科学, 2016, 37(9): 18-22.DOI:10.7506/spkx1002-6630-201609004.
[25]SUN Y, MACRAE T H. The small heat shock proteins and their role in human disease[J]. The FEBS Journal, 2005, 272(11): 2613-2627.DOI:10.1111/j.1742-4658.2005.04708.x.
[26]BJARNADOTTIR S G, HOLLUNG K, HOY M, et al. Changes in protein abundance between tender and tough meat from bovine Longissimus thoracis muscle assesed by iTRAQ and 2-DE analysis[J].Journal of Animal Science, 2012, 90: 1-9. DOI:10.2527/jas.2011-4721.
[27]GUILLEMIN N, BONNET M, JURIE C, et al. Functional analysis of beef tenderness[J]. Journal of Proteomics, 2011, 75(2): 352-365.DOI:10.1016/j.jprot.2011.07.026.
[28]杨啸吟, 张一敏, 朱立贤, 等. 高氧气调包装贮藏牛排肉色稳定性的蛋白质组学[J]. 食品科学, 2019, 40(3): 231-237. DOI:10.7506/spkx1002-6630-20171112-126.
[29]董玉影, 刘笑笑, 李官浩, 等. 不同包装方式对贮藏牛肉食用品质的影响[J]. 食品工业科技, 2015, 36(6): 317-321. DOI:10.13386/j.issn1002-0306.2015.06.061.
[30]MAQSOOD S, HADDAD N A A, MUDGIL P. Vacuum packaging as an effective strategy to retard off-odour development, microbial spoilage, protein degradation and retain sensory quality of camel meat[J]. LWT-Food Science and Technology, 2016, 72: 55-62.DOI:10.1016/j.lwt.2016.04.022.
[31]LOMIWES D, HURST S M, DOBBIE P, et al. The protection of bovine skeletal myofibrils from proteolytic damage post mortem by small heat shock proteins[J]. Meat Science, 2014, 97(4): 548-557.DOI:10.1016/j.meatsci.2014.03.016.
[32]朱学伸, 王苑, 周光宏, 等. 不同包装方式对猪背最长肌冷却成熟期间品质变化的影响[J]. 食品与发酵工业, 2007, 33(4): 15-18.DOI:10.3321/j.issn:0253-990X.2007.04.004.
[33]LOMIWES D, FAROUK M M, FROST D A, et al. Small heat shock proteins and toughness in intermediate pHu beef[J]. Meat Science,2013, 95(3): 472-479. DOI:10.1016/j.meatsci.2013.05.022.
[34]张淼. 应激过程中组织和细胞内HSPs表达与应激性损伤机理研究[D].南京: 南京农业大学, 2011. DOI:10.7666/d.Y2038402.
[35]DING Zhenjiang, WEI Qichao, ZHANG Chunjiang, et al. Influence of oxidation on heat shock protein 27 translocation, caspase-3 and calpain activities and myofibrils degradation in postmortem beef muscles[J]. Food Chemistry, 2021, 340: 127914. DOI:10.1016/j.foodchem.2020.127914.