肉制品是我国居民食品消费的重要组成部分,主要以猪肉、鸡肉、牛肉、羊肉和鸭肉为主。一些不法商贩为获得高额利润,使用低价优质肉冒充高价优质肉,如根据鸭肉的纹理色泽和牛羊肉更为接近,采用牛羊肉精、肉粉或香精等对鸭肉进行浸泡,以此掩盖其掺假行为,用鸭肉冒充牛羊肉进行销售[1-3]。以廉价的鸭肉冒充牛肉、羊肉进行生产经营欺骗消费者的做法,不仅损害了消费者的经济利益,同时也存在诸多的安全隐患,如过敏体质的人群因食用掺假的食品而造成过敏损伤等问题。因此,对于食品监管部门,建立快速、有效的鸭源性成分检测方法对肉制品行业的监督和管理有重要意义。
目前国内外主要采用聚合酶链式反应(polymerase chain reaction,PCR)和荧光PCR方法对肉制品中动物源性成分进行定性检测[4-6]。基于线粒体和核基因组特异性靶基因建立的系列PCR检测技术,已经实现了标准化并广泛应用于肉制品中猪、牛、羊、马等动物源性成分的检测[7-8]。实时荧光PCR技术具有特异性强、灵敏度高、操作简便、快速高效等特点[9-10],使用实时荧光PCR技术进行掺假肉成分的定量分析时,需要建立标准曲线,根据样本循环阈(circulation threshold,Ct)值粗略计算DNA含量,是一种相对定量的方法,而无法满足绝对定量的要求[11-14]。微滴式数字PCR(droplet digital PCR,ddPCR)通过对样品进行微滴化处理,经PCR扩增后逐个对每个微滴进行检测,有荧光信号的微滴判读为1,没有荧光信号的微滴判读为0,根据泊松分布原理及阳性微滴的个数与比例即可得出靶分子的起始拷贝数或浓度。ddPCR能够实现对靶序列核酸的绝对定量,在精确性、准确性和灵敏度方面效果优于普通PCR和实时荧光PCR[15]。同时ddPCR技术不依赖标准曲线,不受PCR抑制物及PCR扩增效率的影响,通过单分子计数方式实现外源基因拷贝数绝对定量分析,更适合食品等基质复杂样本中掺假成分的准确定量检测[11]。
生长激素(growth hormone,GH)基因是一种重要的功能基因,对生长激素的合成和分泌有调节和控制作用,对动物的生长发育有重要意义,其次,GH基因为单拷贝基因,有利于ddPCR反应核酸的准确定量,故本研究以鸭GH基因为靶基因,建立鸭源性成分ddPCR检测方法,实现肉制品中鸭源性成分的定量检测。
鸭、鸡、鹅、鹌鹑、鸽子、鸵鸟、袋鼠、绵羊、山羊、牛、牦牛、猪、马、驴、猫、狗、兔、狐狸和貉子肉粉由本实验室保存;羊肉卷(片)、烤羊肉串、肥牛卷、牛肉松、牛柳、猪肉、猪肉馅、香肠等88 份肉制品为本实验保存的客户送检样品。
食品基因组DNA提取试剂盒 美国Promega公司;ddPCR预混液(不含dUTP)、微滴反应板、微滴发生盖、ddPCR机油 美国Bio-Rad公司。
PCR仪(T100TM Thermal cycler)、QX200 ddPCR微滴生成仪、微滴生成卡、QX200TM Droplet Reader、热封仪 美国Bio-Rad公司;NanoDrop2000C超微量分光光度计 美国Thermo Fisher公司;三孔电热恒温水槽上海一恒生物有限公司;MM400混合型球磨仪 德国莱驰公司;SL202电子天平 德国赛多利斯公司;1-14台式离心机 德国Sigma公司;SQ2119N料理机 慈溪市西贝乐电器有限公司。
1.3.1 引物和探针设计
根据GenBank上收录的鸭物种的基因序列,以鸭GH基因(JN408702.2、EF521443.1)保守区设计特异性引物和TaqMan探针,序列见表1。引物探针由上海捷瑞生物工程有限公司合成。
表 1 鸭物种GH基因特异性引物探针序列
Table 1 Specific primer and probe sequences for duck GH gene
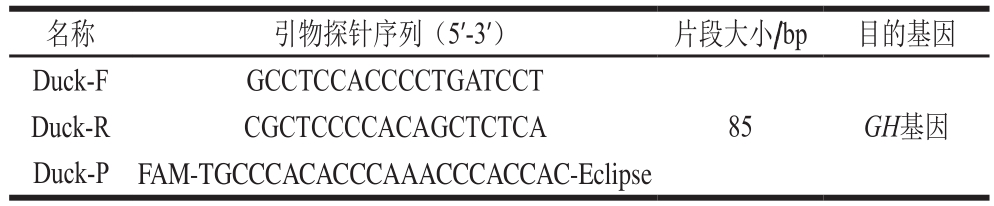
Duck-R CGCTCCCCACAGCTCTCA Duck-P FAM-TGCCCACACCCAAACCCACCAC-Eclipse名称 引物探针序列(5’-3’) 片段大小/bp 目的基因Duck-F GCCTCCACCCCTGATCCT 85 GH基因
1.3.2 肉粉的制备与基因组DNA的提取
称取500 g肉制品,放入料理机搅拌打碎成肉泥。收集肉泥,于65 ℃烘干箱烘干16 h,将烘干的肉粉放入混合型球磨仪中充分研磨,收集肉粉。密封,置于4 ℃保存备用。
使用食品基因组DNA提取试剂盒,按照说明书进行不同肉样的基因组DNA提取,使用超微量分光光度计测定提取DNA质量浓度,将其稀释至100 ng/μL,放置于-20 ℃贮存备用。
1.3.3 鸭源性成分ddPCR方法的建立
以提取鸭肉基因组DNA为模板,采用设计的引物和探针建立ddPCR方法。反应体系为20 μL:ddPCR反应预混液10 μL,Duck-F、Duck-R各0.8 μL,Duck-P 0.4 μL,模板DNA 2 μL,补水至20 μL。
将上述反应体系利用微滴生成器进行微滴化,并转移至96 孔板中,封膜进行PCR扩增。PCR扩增条件:95 ℃预变性5 min;94 ℃变性15 s,60 ℃退火及延伸60 s,49 个循环;98 ℃加热10 min,10 ℃保存。扩增过程中,升降温速率为1 ℃/s。PCR扩增结束后,将96 孔板取出,置于微滴读取仪中进行微滴荧光读取。采用FAM/HEX通道收集微滴信号,读取阳性微滴数和阴性微滴数。
1.3.4 鸭源性成分ddPCR方法的特异性和灵敏性测定
取30 mg鸭、鸡、鹅、鹌鹑、鸽子、鸵鸟、袋鼠、绵羊、山羊、牛、牦牛、猪、马、驴、猫、狗、兔、狐狸和貉子肉粉样品,提取基因组DNA,最终以100 μL无菌水溶解DNA,采用超微量分光光度计测定其质量浓度,并将其稀释至10~100 ng/μL,进行ddPCR扩增,根据1.3.3节的扩增体系和扩增程序进行鸭GH基因检测,同时以ddH2O为空白对照,验证引物探针的特异性。
将提取的鸭基因组DNA稀释至质量浓度为100、50、25、12.5、6.25、3.125、1.562 5、0.625 0、0.212 5、0.012 5 ng/μL,根据建立的ddPCR方法进行扩增,计算各质量浓度样本中鸭GH基因的拷贝数,确定所建立方法的灵敏性。
1.3.5 鸭肉粉质量与鸭GH基因拷贝数浓度线性关系的建立
以3.0、5.0、10.0、20.0、30.0、40.0、50.0 mg鸭肉粉质量(x1,mg)为横坐标,提取的DNA质量浓度平均值(y1,ng/μL)为纵坐标,建立鸭肉粉质量-DNA质量浓度的线性关系式:y1=ax1+b(a、b为方程常数);以100、50、25、12.5、6.25、3.125、1.562 5、0.625 0 ng/μL的鸭肉粉DNA质量浓度(x2,ng/μL)为横坐标,反应体系中鸭GH基因拷贝数浓度的平均值为纵坐标(y2,copies/μL),建立DNA质量浓度-鸭GH基因拷贝数浓度的线性关系式:y2=cx2+d(c、d为方程常数),每个反应进行3 次重复。
由于ddPCR反应体系中模板中目的基因含量需≤105 copies,而在实际样品检测过程中,提取的部分样品核酸质量浓度过高,需要将样本DNA稀释至合适质量浓度再进行ddPCR检测。设样品质量浓度的稀释倍数为n,则y1=n×x2;由以上关系式可以推出鸭肉粉质量(x1,mg)、鸭GH基因拷贝数浓度(y2,copies/μL)和样品稀释倍数(n)之间的关系,即:![]()
1.3.6 源性成分ddPCR方法的检测限分析
将鸭肉粉质量分数分别为1%、5%、10%、20%、50%、60%、80%、99%、100%的混合肉粉(含鸭肉粉、牛肉粉、羊肉粉)进行DNA提取,并以之作为模板,进行鸭源性成分GH基因ddPCR检测,每个样品做3 个重复,计算相对标准偏差(relative standard deviation,RSD)。以ddPCR检测所得GH基因拷贝数浓度,根据1.3.5节鸭肉粉质量、GH基因拷贝数浓度和样品稀释倍数之间的关系式,计算鸭肉粉质量分数,并计算回收率。参照国际食品法典委员会标准CAC/GL 74—2010《检测、鉴定和量化食品中特定基因序列和蛋白质的执行标准和方法确认准则》[16],以回收率和RSD评价本方法的准确度和精密度,以回收率为80%~120%和RSD≤25%作为质量分数有效定量数据的判断依据。
1.3.7 市售商业化肉制品中鸭源性成分的定量检测
将本实验室保存的羊肉卷(片)、烤羊肉串、猪肉馅、肥牛卷、牛肉松、香肠等88 份肉制品,按照1.3.2节进行样品处理。用建立的鸭源性成分ddPCR方法,对肉制品中鸭源性成分进行定量分析。同时采用行业标准SN/T 3731.5—2013《食品及饲料中常见畜类品种的鉴定方法 第5部分:马成分检测 实时荧光PCR法》中的PCR方法对88 份肉制品进行鸭源性成分检测,对检测结果进行分析,进一步验证所建立方法的准确性和实际应用效果。
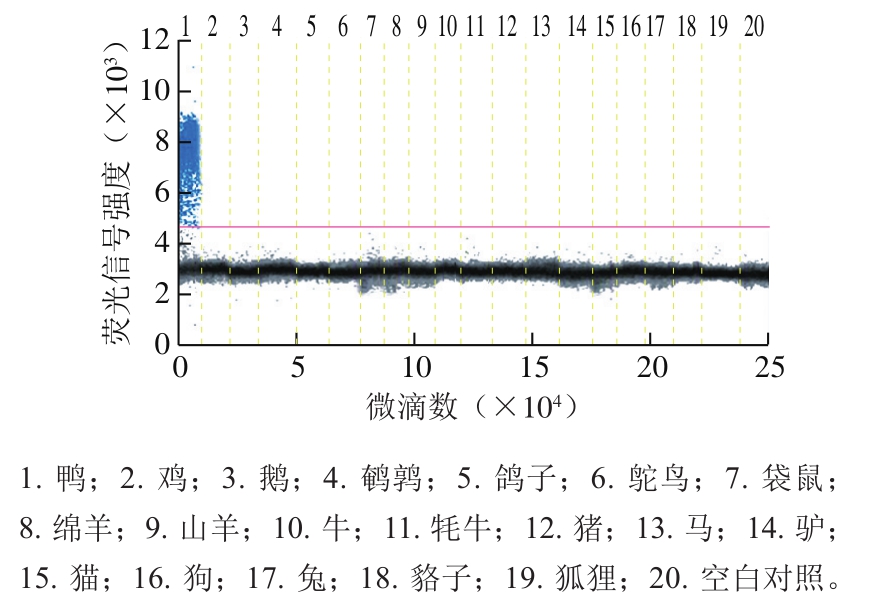
图 1 鸭源性成分ddPCR检测方法的特异性
Fig. 1 Specificity of ddPCR for duck-derived ingredients
以鸭、鸡、鹅、猪、牛、羊、貉子、兔和鸽子等基因组DNA为模板,以ddH2O为空白对照,进行ddPCR检测。由图1可知,空白对照未出现扩增,说明反应体系未受污染,且每个样品产生的总微滴数大于12 000 个,符合泊松分布的统计要求。仅鸭基因组DNA有特异性微滴扩增,猪、鸡、牛、羊、兔等其他异源基因组DNA无任何扩增,表明所建立的ddPCR具有良好的特异性。
将鸭基因组DNA质量浓度分别稀释为100、50、25、12.5、6.25、3.125、1.562 5、0.625 0、0.212 5、0.012 5 ng/μL,进行ddPCR扩增检测。由图2可知,当模板质量浓度稀释至0.625 0 ng/μL时,检测到的GH基因拷贝浓度为11.1 copies/μL(仪器自动读取),表明所建立的ddPCR方法检测鸭GH基因具有良好的灵敏性。
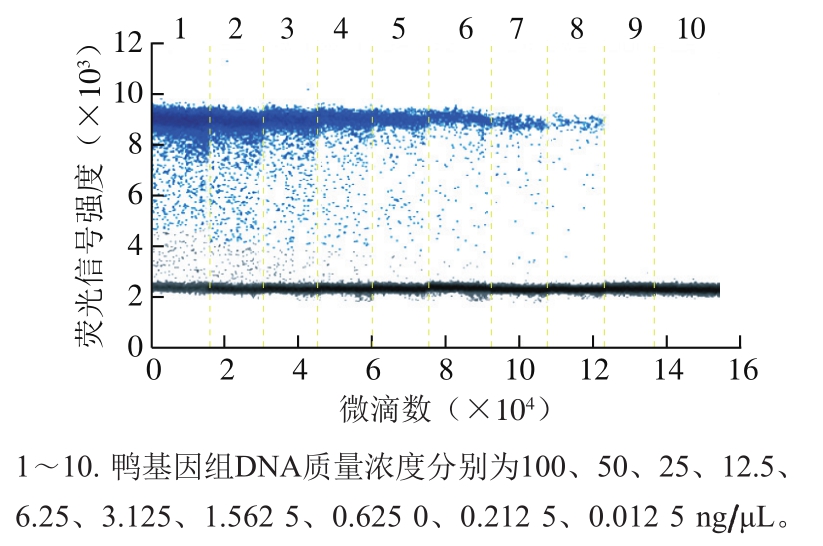
图 2 鸭源性成分ddPCR检测方法的灵敏性
Fig. 2 Sensitivity of ddPCR for duck-derived ingredients
以鸭肉粉质量为横坐标(x1,mg),DNA质量浓度为纵坐标(y1,ng/μL),得到二者的线性关系式为y1=40.873x1-6.273(R2=0.989 2);以DNA质量浓度为横坐标(x2,ng/μL),鸭GH基因拷贝数浓度为纵坐标(y2,copies/μL),得到二者的线性关系式为y2=17.739x2+0.550 5(R2=0.999 9)。
由此可以推出鸭肉粉质量(x1,mg)、鸭GH基因拷贝数浓度(y2,copies/μL)和检测前样品稀释倍数(n)之间的关系式为![]()
表 2 ddPCR检测限结果分析
Table 2 Evaluation of the detection limit of ddPCR
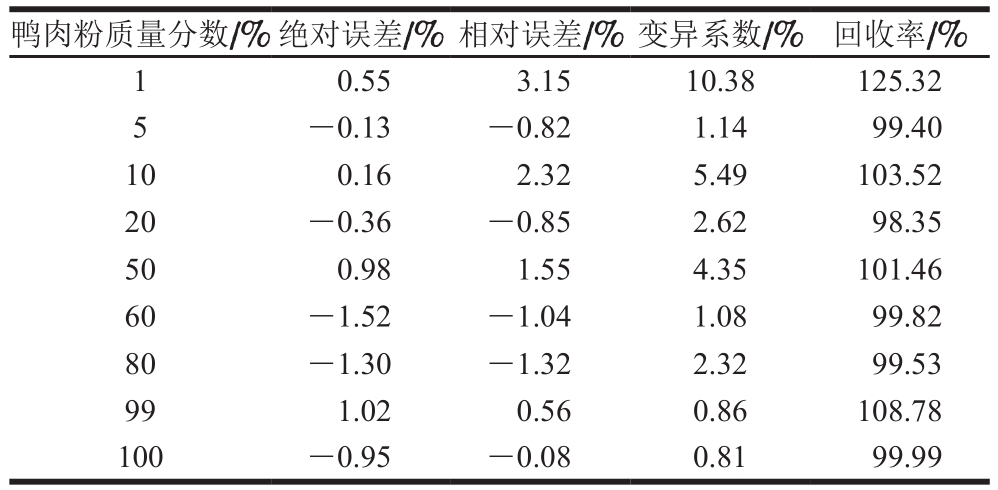
鸭肉粉质量分数/%绝对误差/% 相对误差/% 变异系数/% 回收率/%1 0.55 3.15 10.38 125.32 5-0.13 -0.82 1.14 99.40 10 0.16 2.32 5.49 103.52 20 -0.36 -0.85 2.62 98.35 50 0.98 1.55 4.35 101.46 60 -1.52 -1.04 1.08 99.82 80 -1.30 -1.32 2.32 99.53 99 1.02 0.56 0.86 108.78 100 -0.95 -0.08 0.81 99.99
由表2可知,当模拟混合样品中鸭肉粉质量分数为5%~100%时,计算不同鸭肉粉质量分数样品3 次重复测定的绝对误差均小于±1.52%,相对误差均小于±3.15%,变异系数均小于10.38%,回收率为98.35%~125.32%,测量值接近实际值。所建立ddPCR方法检测肉制品中鸭肉成分的最低检测限为5%,最高检测限为100%。
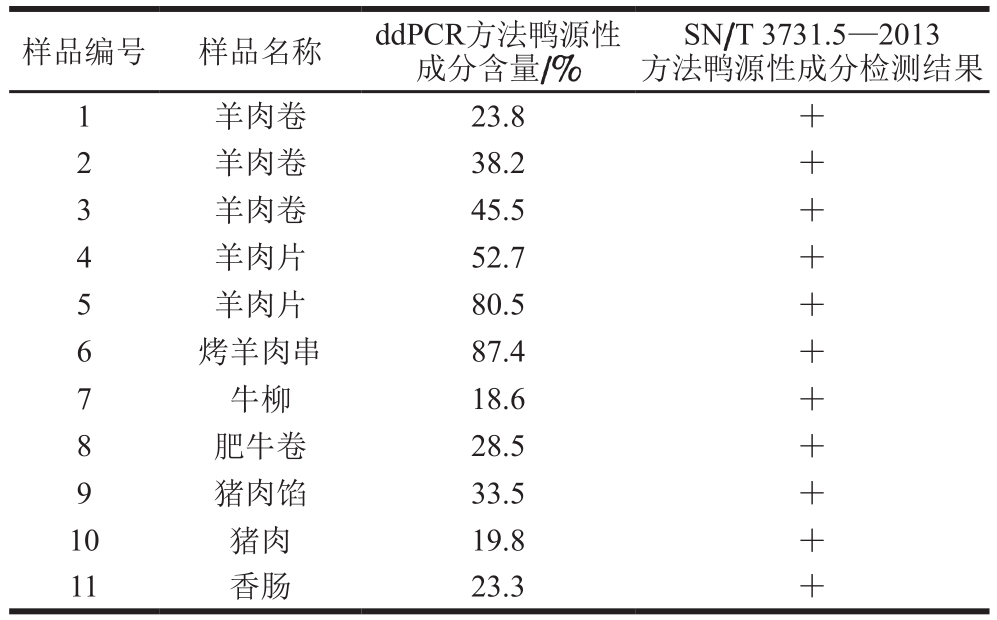
由表3可知,采用ddPCR方法在11 份肉制品中检出鸭源性成分,检出率为12.5%,鸭源性成分含量为18.6%~87.4%。采用SN/T 3731.5—2013方法在11 份肉制品中检出鸭源性成分,结果与ddPCR方法一致。上述结果表明,所建立的ddPCR方法能够对肉制品中鸭源性成分进行良好的定量检测。
表 3 实际样品鸭源性成分检测结果
Table 3 Detection of duck-derived ingredients in actual samples
注:+. 阳性。
SN/T 3731.5—2013方法鸭源性成分检测结果1 羊肉卷 23.8 +2 羊肉卷 38.2 +3 羊肉卷 45.5 +4 羊肉片 52.7 +5 羊肉片 80.5 +6 烤羊肉串 87.4 +7 牛柳 18.6 +8 肥牛卷 28.5 +9 猪肉馅 33.5 +10 猪肉 19.8 +11 香肠 23.3 +样品编号 样品名称 ddPCR方法鸭源性成分含量/%
肉类掺假问题越来越受到公众的关注,建立有效的动物源性成分定量检测方法是检验检测机构研究的热点问题[17-19]。建立有效的检测手段是执法监管部门的技术支撑和保障。ddPCR技术通过微滴数进行判读,实现对起始样品的绝对定量,已经应用到生命科学的各个领域,在动物源性成分定量检测方面发挥了重要作用[20-23],在动物源性成分定量检测中已经得到了广泛应用[24-28]。苗丽等[29]建立肉制品中牛源和猪源成分的ddPCR检测方法,通过对肉制品中猪源和牛源性成分的定量检测甄别肉制品是“无意沾染”还是“故意掺假”;王强等[30]根据单拷贝基因建立鹅源性成分的ddPCR检测方法,并应用于市售商品的检测;任君安等[31]根据复制蛋白A1基因建立羊源和猪源性成分的ddPCR方法,通过二者基因拷贝数固定比值对14 份羊肉制品进行定量检测,具有很好的定量准确性;史艳宇等[32]以鸭线粒体基因建立鸭源性成分ddPCR检测方法,灵敏性高于荧光PCR方法,该研究以多拷贝基因为靶基因,在定量检测的灵敏性方面低于以单拷贝基因为靶基因建立的方法。
本研究以鸭单拷贝GH基因作为靶基因,建立鸭源性成分ddPCR检测方法,通过构建鸭肉粉质量(mg)与DNA质量浓度(ng/μL)、DNA质量浓度(ng/μL)与GH基因拷贝数浓度(copies/μL)之间的线性关系,确定了鸭肉粉质量(mg)与鸭GH基因拷贝数浓度(copies/μL)之间的关系式,能够对鸭肉质量进行准确定量检测,ddPCR方法检测肉制品中鸭肉成分的最低检测限为5%,最高检测限为100%。定量结果同模拟样品真实值基本一致,表明所建立的ddPCR具有较好的准确性和较强的抗干扰能力。对88 份商业化肉制品的鸭源性成分进行定量检测结果表明,11 份肉制品中鸭源性成分含量为18.6%~87.4%,说明该方法能够用于肉制品中鸭源性成分的有效检测和精准定量检测。同时,所建立的ddPCR方法也存在一定的不足。在鸭源性成分定量检测中,只能选取红肉部分进行样品前处理,不能选取皮肤、脂肪或内脏等部分进行检测。在今后的研究中将对此不足之处进行进一步的研究和探索。
本研究基于鸭单拷贝GH基因建立了鸭源性成分ddPCR检测方法,通过分析鸭肉粉质量(mg)和鸭GH基因拷贝数浓度(copies/μL)之间的线性关系,实现了肉制品中鸭源性成分的定量检测,可以有效区分“无意沾染”和“蓄意掺假”,为有效打击非法肉制品制假售假、规范市场秩序和保障食品安全提供了技术保障。
本研究以鸭GH基因为靶基因,建立鸭源性成分定量检测的ddPCR方法,该方法特异性强,灵敏性可达11.1 copies/μL,并通过鸭肉粉质量(mg)与DNA质量浓度(ng/μL)、DNA质量浓度(ng/μL)与鸭GH基因拷贝数浓度(copies/μL)之间的线性关系,建立鸭肉粉质量(x)与鸭GH基因拷贝数浓度(y)之间的关系式为![]() 建立ddPCR方法检测肉制品中鸭肉成分的最低检测限为5%,最高检测限为100%。本研究所建立的鸭源性成分ddPCR方法有较好的准确性和较强的适用性,能够应用于肉制品中鸭源性成分的定量检测。
建立ddPCR方法检测肉制品中鸭肉成分的最低检测限为5%,最高检测限为100%。本研究所建立的鸭源性成分ddPCR方法有较好的准确性和较强的适用性,能够应用于肉制品中鸭源性成分的定量检测。
[1]ALI M E, RAZZZK M A, HAMID S B A, et al. Multiplex PCR assay for the detection of five meat species forbidden in Islamic foods[J]. Food Chemistry, 2015, 177: 214-224. DOI:10.1016/j.foodchem.2014.12.098.
[2]INES L, JUTTA Z, HERMANN B. Quantitative determination of commercially relevant species in foods by real-time PCR[J].International Journal of Food Science and Technology, 2007, 42:336-341. DOI:10.1111/j.1365-2621.2006.01249.x.
[3]任君安, 黄文胜, 葛毅强, 等. 肉制品真伪鉴别技术研究进展[J].食品科学, 2016, 37(1): 247-257. DOI:10.7506/spkx1002-6630-201601043.
[4]LIU L, CHEN F C, DORSEY J L, et al. Sensitive monoclonal antibody-based sandwich ELISA for the detection of porcine skeletal muscle in meat and feed products[J]. Journal of Food Science, 2006,71(1): M1-M6. DOI:10.1111/j.1365-2621.2006.tb12393.x.
[5]MONTOWSKA M, POSPIECH E. Species-specific expression of various proteins in meat tissue: proteomic analysis of raw and cooked meat and meat products made from beef, pork and selected poultry species[J]. Food Chemistry, 2013, 136(3): 1461-1469. DOI:10.1016/j.foodchem.2012.09.072.
[6]CHOU C C, LIN S P, LEE K M, et al. Fast differentiation of meats from fifteen animal species by liquid chromatography with electrochemical detection using copper nanoparticle plated electrodes[J]. Journal of Chromatography B, 2007, 846(1): 230-239.DOI:10.1016/j.jchromb.2006.09.006.
[7]中华人民共和国质量监督检验检疫总局, 中国国家标准化管理委员会. 明胶中牛、羊、猪源性成分的定性检测方法 实时荧光PCR法: GB/T 25165—2010[S]. 北京: 中国标准出版社, 2010.
[8]中华人民共和国质量监督检验检疫总局. 食品及饲料中常见畜类品种的鉴定方法 第5部分: 马成分检测 实时荧光PCR法:SN/T 3730.5—2013[S]. 北京: 中国标准出版社, 2013.
[9]史艳宇, 刘金华, 吴月丹, 等. 荧光定量PCR方法检测畜肉食品中鸭源性成分[J]. 食品安全质量检报, 2013, 4(6): 1859-1864.DOI:10.19812/j.cnki.jfsq11-5956/ts.2013.06.041.
[10]许如苏, 周广彪, 魏霜, 等. 锁核酸探针技术快速检测鸭源性成分的试验[J]. 中国兽医杂志, 2015, 51(9): 91-93. DOI:10.3969/j.issn.0529-6005.2015.09.034.
[11]FLOREN C, WIEDEMANN I, BRENIG B, et al. Species identification and quantification in meat and meat products using droplet digital PCR(ddPCR)[J]. Food Chemistry, 2015, 173: 1054-1058. DOI:10.1016/j.foodchem.2014.10.138.
[12]DEMAROUOY J. Meat adulteration: the use of PCR[J]. Meat Science,2013, 94(2): 164. DOI:10.1016/j.meatsci.2013.01.019.
[13]KARABASANAVAR N S, SINGH S P, KUMAR D, et al. Detection of pork adulteration by highly-specific PCR assay of mitochondrial D-loop[J]. Food Chemistry, 2014, 14(5): 530-534. DOI:10.1016/j.foodchem.2013.08.084.
[14]KOPPEL R, DANIELS M, BRUNEN-NIEWELER C. Multiplex realtime PCR for the detection and quantification of DNA from duck,goose, chicken, turkey and pork[J]. European Food Research and Technology, 2013, 236(2): 1093-1098. DOI:10.1007/s00217-013-1973-2.
[15]FU Wei, ZHU Pengyu, WANG Chenguang, et al. A highly sensitive and specific method for the screening detection of genetically modified organisms based on digital PCR without pretreatment[J]. Scientific Reports, 2015, 5(1): 395-402. DOI:10.1038/srep12715.
[16]联合国粮食及农业组织, 世界卫生组织. 检测、鉴定和量化食品中特定基因序列和蛋白质的执行标准和方法确认准则:CAC/GL 74—2010[S].
[17]李家鹏, 乔晓玲, 田寒友, 等. 食品和饲料中动物源性成分检测技术研究进展[J]. 食品科学, 2011, 32(9): 340-347.
[18]何伟玲, 黄明, 张弛. 食品中肉类成分种属鉴别技术研究进展[J]. 食品科学, 2012, 33(3): 304-307.
[19]牛会敏, 王静怡, 姚晓洁, 等. 微滴式数字聚合酶链式反应在食品安全检测领域的应用[J]. 食品安全质量检测学报, 2020, 11(24): 9295-9300. DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.24.040.
[20]杨硕, 江丰, 刘艳, 等. 多重数字PCR定量检测市售核桃乳中核桃大豆源性成分的方法[J]. 食品科学, 2017, 38(16): 280-286.DOI:10.7506/spkx1002-6630-201716045.
[21]刘二龙, 卢丽, 凌莉, 等. 红薯源性成分微滴式数字PCR的检测与定量分析[J]. 现代食品科技, 2019, 35(7): 273-277. DOI:10.13982/j.mfst.1673-9078.2019.7.038.
[22]MASSANELLA M, SINGHANIA A, BELLAKOVA B N, et al.Differential gene expression in HIV-infected following ART[J].Antiviral Research, 2013, 100(2): 420-428. DOI:10.1016/j.antiviral.2013.07.017.
[23]BALLIN N Z. Authentication of meat and meat products[J]. Meat Science, 2010, 86(3): 577-587. DOI:10.1016/j.meatsci.2010.06.001.
[24]刘立兵, 石蕊寒, 项佳林, 等. 应用微滴式数字聚合酶链式反应定量检测牛肉制品中的猪源性成分[J]. 肉类研究, 2018, 32(9): 39-44.DOI:10.7506/rlyj1001-8123-201809006.
[25]REN Junan, DENG Tingting, HUANG Wensheng, et al. A digital PCR method for identifying and quantifying adulteration of meat species in raw and processed food[J]. PLoS One, 2017, 12(3): e0173567.DOI:10.1371/journal.pone.0173567.
[26]CAI Yicun, LI Xiang, LÜ Rong, et al. Quantitative analysis of pork and chicken products by droplet digital PCR[J]. BioMed Research International, 2014, 376: 810209. DOI:10.1155/2014/810209.
[27]苗丽, 张秀平, 陈静, 等. 肉制品中羊源性成分微滴数字PCR法定量检测方法的研究[J]. 食品工业科技, 2016, 37(4): 73-76.DOI:10.13386/j.issn1002-0306.2016.04.005.
[28]王强, 蔡一村, 张扬, 等. 食品和饲料中鹅源性成分微滴式数字PCR检测与定量分析[J]. 现代食品科技, 2018, 34(10): 258-263.DOI:10.13982/j.mfst.1673-9078.2018.10.035.
[29]苗丽, 张秀平, 陈静, 等. 微滴数字PCR法对肉制品中牛源和猪源成分的定量分析[J]. 食品科学, 2016, 37(8): 187-191. DOI:10.7506/spkx1002-6630-201608033.
[30]王强, 蔡一村, 张扬, 等. 食品和饲料中鹅源性成分微滴式数字PCR检测与定量分析[J]. 现代食品科技, 2018, 34(10): 258-263; 178.DOI:10.13982/j.mfst.1673-9078.2018.10.035.
[31]任君安, 邓婷婷, 黄文胜, 等. 微滴式数字聚合酶链式反应精准定量检测羊肉中掺杂猪肉[J]. 食品科学, 2017, 38(2): 311-316.DOI:10.7506/spkx1002-6630-201702049.
[32]史艳宇, 王莹, 石虹, 等. 微滴数字PCR方法检测畜肉食品中鸭源性成分[J]. 食品安全质量检测学报, 2018, 9(3): 583-588. DOI:10.3969/j.issn.2095-0381.2018.03.021.
Quantitative Detection of Duck-Derived Ingredients in Meat Products by Droplet Digital Polymerase Chain Reaction
刘立兵, 员丽娟, 陈敏娜, 等. 基于微滴式数字聚合酶链式反应技术的肉制品中鸭源性成分的定量检测[J]. 肉类研究,2021, 35(3): 30-34. DOI:10.7506/rlyj1001-8123-20210119-013. http://www.rlyj.net.cn
LIU Libing, YUAN Lijuan, CHEN Minna, et al. Quantitative detection of duck-derived ingredients in meat products by droplet digital polymerase chain reaction[J]. Meat Research, 2021, 35(3): 30-34. DOI:10.7506/rlyj1001-8123-20210119-013.http://www.rlyj.net.cn