风味是消费者评价肉制品品质的重要因素,川味腊肉由于其独特的烟熏风味深受消费者喜爱。这是由于川味腊肉加工过程中经过烟熏处理,不但使成品腊肉拥有独特风味,还具有杀菌、抗氧化、去腥、延长贮藏期等作用。烟熏特征风味主要由一些酚类物质构成,如烷基酚类、愈创木基型酚类、紫丁香基型酚类[1]。肉中的蛋白质在特定的空间构象和结构下会对不同风味化合物产生不同的吸附作用,从而改变食品顶空风味物质浓度,进而影响到消费者对特征风味物质的感知和食品品质。蛋白质与小分子物质的结合主要依靠非共价键,如氢键、疏水作用力、静电相互作用和范德华力,其次也有共价结合作用[2]。汪娟[3]发现不饱和脂肪醛如反-2-壬烯醛会与大豆蛋白发生共价结合。许多学者已对肉中肌原纤维蛋白对小分子风味物质的吸附做过研究。例如,胡可等[4]提取腊肉各关键加工环节的肌原纤维蛋白,探究其对4-乙基愈创木酚的吸附能力 ;周昌瑜等[5]探究肌原纤维蛋白质量浓度对于17 种典型风味物质吸附能力的影响,结果表明,相同质量浓度肌原纤维蛋白对不同风味物质吸附表现为:醛类>酯类>酮类>醇类;徐永霞等[6]探究4 种特征醛类腥味物质与草鱼肌原纤维蛋白间的相互作用;Cao Jinxuan等[7]研究氧化对G-肌动蛋白结构及其对风味物质吸附的影响;Pérez-Juan等[8-10]研究肌原纤维蛋白质量浓度、结构及离子强度对风味物质吸附的影响;Luo Ji等[11]研究介质阻挡放电冷等离子体处理对干腌腊肉中肌原纤维蛋白结构及其对风味物质吸附的影响;Lü Tong等[12]研究胰蛋白酶处理对肌动蛋白结构及其对挥发性物质吸附的影响。腊肉加工中不可避免需要加入食盐,楼宵玮等[13]探究不同氯化钠浓度下肌原纤维蛋白与17 种典型风味物质的吸附关系,结果表明随着氯化钠浓度的增加,肌原纤维蛋白对醇类、醛类和酮类物质的吸附性总体降低。
腊肉食用前需经过加热,但加热温度不一,包括80~90 ℃低温加热、100 ℃蒸煮及120 ℃以上的高温处理,加热温度的差异会改变腊肉中蛋白质的结构及性质,影响酚类物质的吸附进而影响腊肉品质。虽然已有学者用实验手段研究了加热过程中肌原纤维蛋白对小分子风味物质的吸附[14-15],但鲜有加热对肉中蛋白结构及其对风味物质吸附影响的微观解析。分子动力学模拟是一种具有足够小的时间和空间尺度的强大模拟技术,通过此技术能够获取蛋白质分子以及原子水平上的结构信息[16],其已成为从分子水平分析蛋白的另一种有效手段。目前,借助分子动力学模拟技术研究蛋白质结构变化所使用的模拟时间通常不超过50 ns,所获取的蛋白质结构变化信息较为有限[17-20]。蛋白与酚类物质结合的分子模拟报道较多[21-24],但蛋白与其他小分子风味物质间作用的分子模拟研究较少。Stapornkul等[25]研究肌红蛋白与绿茶中酚类物质的结合,薛斐[26]研究香草醛与牛血清白蛋白、牛血红蛋白、人免疫球蛋白G以及胶原蛋白4 种蛋白的相互作用。一般分子模拟研究均是在常温下进行,但腊肉在熟化过程中不可避免会受到高温作用,使蛋白结构发生变化。因此,从分子模拟的角度深入研究与验证蛋白结构变化是否会影响其对小分子酚类物质的吸附,以及加热处理如何影响蛋白与酚类物质的结合规律十分必要。
本研究以肌原纤维蛋白的重要组成蛋白肌动蛋白为研究对象,采用分子动力学模拟和分子对接技术研究在4 种温度(25、80、100、120 ℃)下肌动蛋白在0.5 mol/L NaCl溶液中的结构变化及热处理温度对酚类物质吸附规律的影响。
1 材料与方法
1.1 分子动力学模拟
采用Gromacs(2019.6)软件,从PDB数据库(http://www.rcsb.org/)下载肌动蛋白结构(PDB ID:2zwh),下载后手动除去结晶水、杂离子,并补全缺失的原子。模拟过程中选用GROMOS54a7力场,将蛋白放入立方体水盒子中,采用SPC水模型,使蛋白离盒子边缘最短距离为1 nm,添加0.5 mol/L NaCl(模拟腊肉中食盐浓度)并使体系达到电中性,使用最速下降法对体系进行能量最小化,然后分别进行400 ps的NVT和NPT平衡,平衡后温度为298.15 K,压力为100 kPa。
在规定的温度下进行150 ns的分子动力学模拟。使用LINCS算法约束所有与氢相连的键,使用PME法计算静电相互作用,使用截断半径为1 nm计算范德华力,压浴方式和控压方式分别为Parrinello-Rahman法和Isotropic法;使用V-rescale控温方式,以20 ℃/ns的速率升至353.15、373.15、393.15 K(即80、100、120 ℃),达到目标温度后系统保持在此温度进行剩余模拟。模拟步长为2 fs,每10 ps储存1 次数据。所得数据结果用Origin软件进行绘图。
1.2 风味物质吸附
选取腊肉中常见的6种酚类物质,即愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚、4-乙烯基愈创木酚、4-丙烯基愈创木酚和4-烯丙基愈创木酚,并用1-辛烯-3-醇、1-辛烯-3-酮和2-辛烯醛作对照。小分子物质用ChemDraw Professional 17.1和Chem3D 17.1软件准备,通过AutoDock工具分别生成肌动蛋白和小分子物质的pdbqt文件。采用盲对接,grid box设定为40×40×40 Å,中心坐标为默认值,设置间隔为1 Å。对接过程中采用AutoDock Vina程序搜索前20 个得分最高的对接构象,Energy_Range设置为5,Exhaustiveness设置为20。每个温度条件下重复对接3 次,即分别提取模拟130、140 ns和150 ns的蛋白结构进行对接。计算每次对接后得分排名前20 个构象结合的平均自由能。
2 结果与分析
2.1 热处理对肌动蛋白构象均方根误差(root mean square deviation,RMSD)的影响
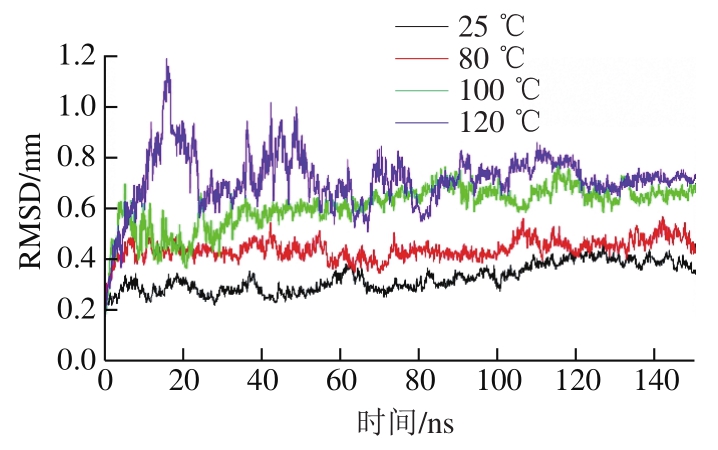
图 1 不同温度下肌动蛋白构象RMSD的变化
Fig. 1 Changes in RMSD at different temperatures
RMSD是衡量分子模拟过程中蛋白构象与原始构象的平均偏差,是评价模拟中蛋白是否稳定的重要指标。由图1可知,在温度为25 ℃时肌动蛋白构象RMSD变化程度很小,在0.3 nm左右。当温度为80 ℃时RMSD升高,并保持在0.4 nm左右。当温度达到100 ℃时,RMSD变化分为3 个阶段:在0~30 ns时RMSD曲线波动较为明显,在30~80 ns时曲线整体呈略微上升的趋势,90 ns后趋于平稳,RMSD维持在0.6 nm左右。当温度达到120 ℃时,RMSD在0~20 ns内曲折上升,在20~30 ns时下降,在30~90 ns之间剧烈波动,在100 ns后趋于平稳,保持在0.7 nm左右。整体来看,在4 种温度下肌动蛋白构象RSMD在前40 ns内变化较为剧烈,之后波动逐渐减小,趋于平稳;随着温度的升高,RMSD逐渐增大,RMSD曲线波动程度增大,这与刘祥雨等[27]研究乳球蛋白时得到的结论一致。
2.2 热处理对肌动蛋白回旋半径(radius of gyration,Rg)的影响
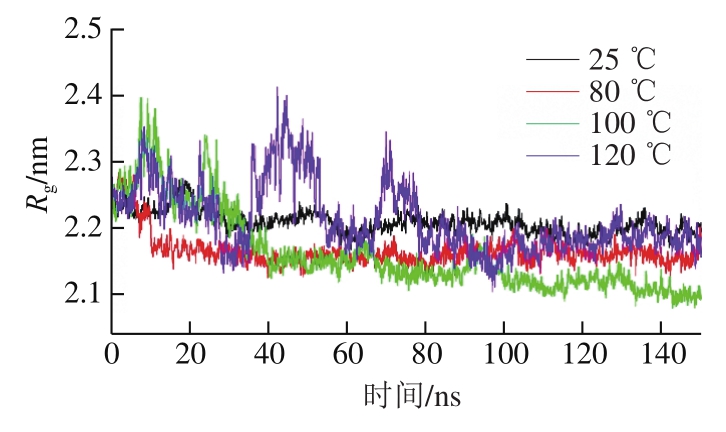
图 2 不同温度下肌动蛋白Rg的变化
Fig. 2 Variation in Rg at different temperatures
Rg为描述蛋白结构致密性的重要参数,其越小表明蛋白结构越致密。由图2可知,整体来看,不同温度下肌动蛋白Rg均随模拟时间的延长缓慢下降。当温度为25 ℃时,Rg曲线较为平稳,略有降低的趋势,稳定在2.2 nm左右。当温度为80 ℃时,Rg曲线在0~10 ns时呈直线下降,在10 ns之后趋于平稳,维持在2.1 nm左右。当温度上升至100 ℃时,Rg在0~10 ns之间经过短暂的上升后,在10~20 ns时快速下降,在0~30 ns之间波动较为剧烈,在30 ns之后整体呈下降的趋势,最终下降至2.1 nm左右。在120 ℃时,Rg曲线在0~80 ns之间波动较为剧烈,且在0~30 ns之间Rg曲线变化趋势与100 ℃时较为重合,80 ns之后波动减小逐渐趋于稳定,维持在2.15~2.2 nm。由此可见,温度越高Rg在模拟过程中的波动越大,需要更长的时间才能达到平衡,不同温度下达到平衡后的肌动蛋白Rg介于2.1~2.2 nm之间,100 ℃时Rg稍小,25、80、120 ℃下Rg较为接近。
2.3 热处理对肌动蛋白构象均方根波动(root mean square fluctuation,RMSF)值的影响
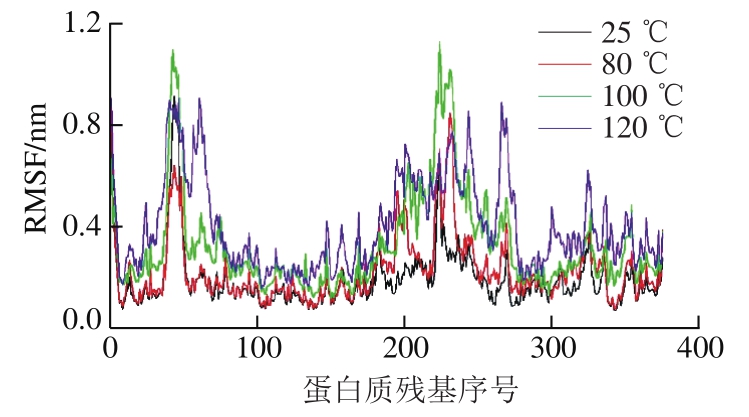
图 3 不同温度下肌动蛋白构象RMSF值的变化
Fig. 3 Changes in RMSF value at different temperatures
RMSF是相比于平均构象,蛋白中每一个氨基酸残基的位置变化。可根据蛋白质残基的波动情况获取蛋白质在不同温度下的变性程度。由图3可知,随着温度的上升,肌动蛋白构象RMSF值波动程度明显增大,说明在高温作用下蛋白质内部分子间部分作用力丢失,天然构象失去稳定性,这与刘祥雨等[27]的研究结论一致。
2.4 热处理对肌动蛋白氢键的影响
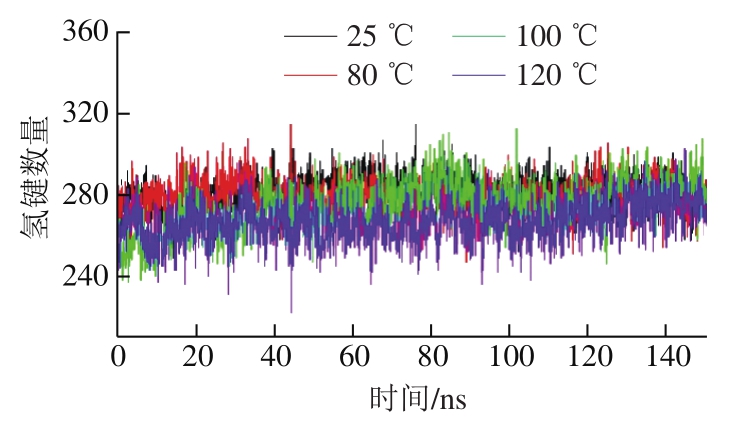
图 4 不同温度下肌动蛋白氢键数量变化
Fig. 4 Changes in number of hydrogen bonds in actin at different temperatures
氢键是一种重要的非共价结构力,影响蛋白质结构的稳定性[27]。不同温度对肌动蛋白结构以及氢键的数量和存在方式产生影响。由图4可知:模拟150 ns过程中,热作用下肌动蛋白分子内一直伴随氢键的断裂和新的氢键的形成,导致氢键数量不断变化;在25、80、100 ℃ 3 个温度下肌动蛋白氢键数量相差较小,当温度在100 ℃以下时,氢键数量较为稳定,约为280,当温度升高至120 ℃时,在前110 ns氢键数量下降至约260,110~150 ns期间略有上升;表明氢键在100 ℃及以下时稳定性较好,当温度上升至120 ℃肌动蛋白结构改变,氢键数量减少,致使蛋白结构稳定性降低[28]。刘祥雨等[27]的分子模拟研究结果表明,100 ℃及以下温度的热处理对β-乳球蛋白的氢键影响较小,而120 ℃热处理会使蛋白氢键数量显著减少,这与本研究结果一致。
2.5 热处理对肌动蛋白溶剂可及表面积的影响
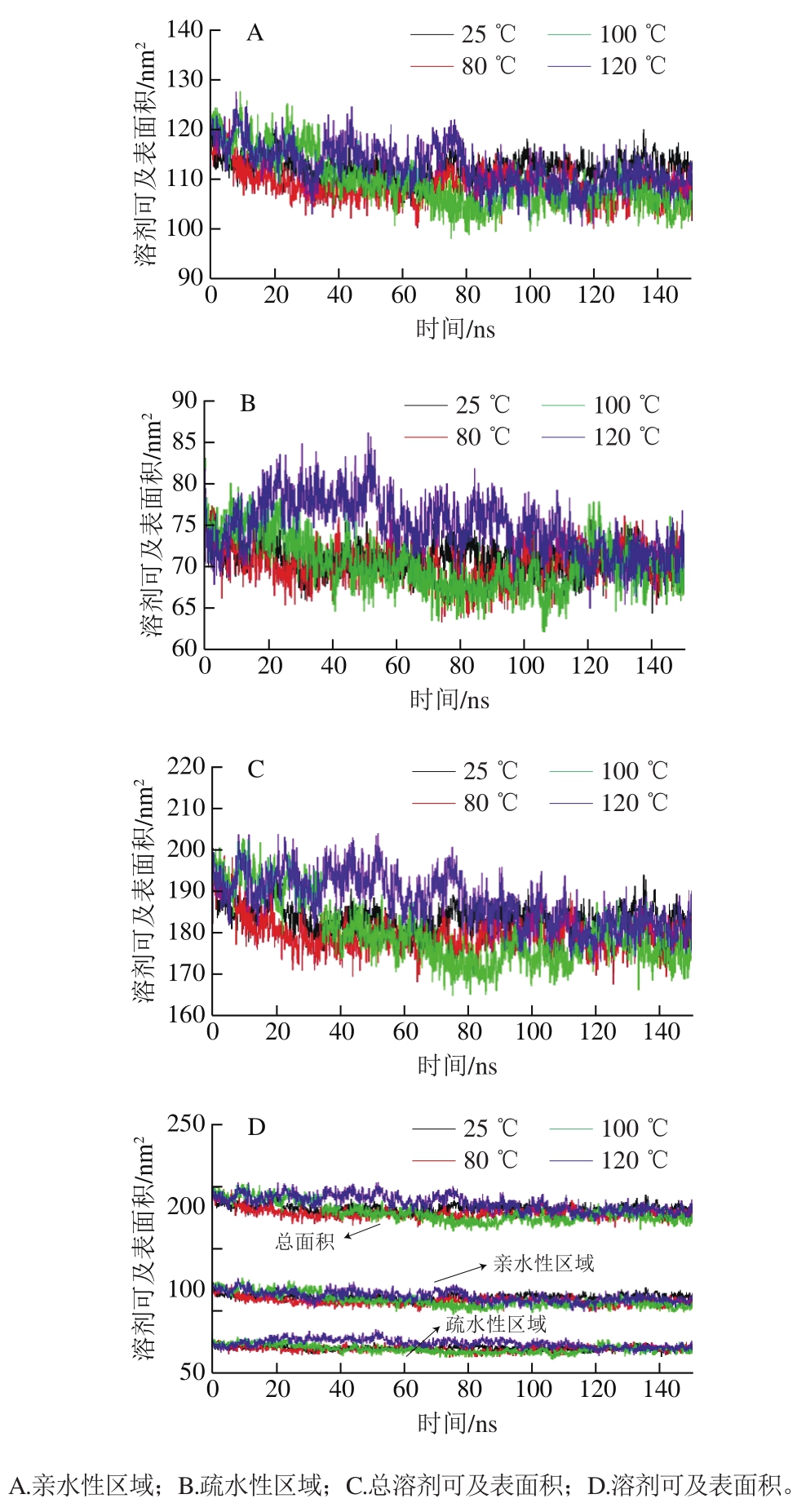
图 5 不同温度下肌动蛋白溶剂可及表面积变化
Fig. 5 Changes in solvent accessible surface area of actin at different temperatures
不同温度下肌动蛋白亲水性区域和疏水性区域的溶剂可及表面积随模拟时间的变化如图5所示。在温度从25 ℃上升至120 ℃过程中,亲水性区域的溶剂可及表面积变化较小,基本稳定在110 nm2(图5A)。疏水性区域的溶剂可及表面积在温度低于100 ℃时变化也较小,当温度升高至120 ℃时,在0~120 ns之间明显上升,在120 ns之后逐渐下降,并与其余3 个温度接近(图5B)。整体而言,不同温度热作用下肌动蛋白疏水性区域的溶剂可及表面积增大,由原来的70 nm2增加到75 nm2,这是由于在热作用下蛋白结构发生变化,位于分子内部的疏水基团暴露在表面,使疏水溶剂的可及表面积增加[27]。随着温度的升高,总溶剂可及表面积增大,说明热作用使肌动蛋白结构伸展,疏水基团与水接触表面积增加(图5C),并且亲水性区域的溶剂可及表面积始终大于疏水性区域(图5D),肌动蛋白在此过程中表现出亲水性大于疏水性,因此肌动蛋白在整个模拟过程中为水溶性,表明温度上升并没有改变肌动蛋白的溶解性。
2.6 热处理对肌动蛋白二级结构的影响
肌动蛋白的二级结构变化可表明其整体结构的稳定性,以及模拟过程中所发生的分子动力学变化。由图6可知,随着温度的升高,肌动蛋白总二级结构含量逐渐降低,120 ℃时降低程度较大,无规则卷曲结构含量增加,且在100 ℃和120 ℃下变化幅度较大;随着温度的上升,α-螺旋含量逐渐降低,β-折叠含量在100 ℃时降低程度最大。无规则卷曲结构含量越高,α-螺旋和β-折叠结构含量越低,表明蛋白结构破坏越大。因此,80 ℃的热作用能显著破坏肌动蛋白结构,且随着温度的上升破坏越显著。
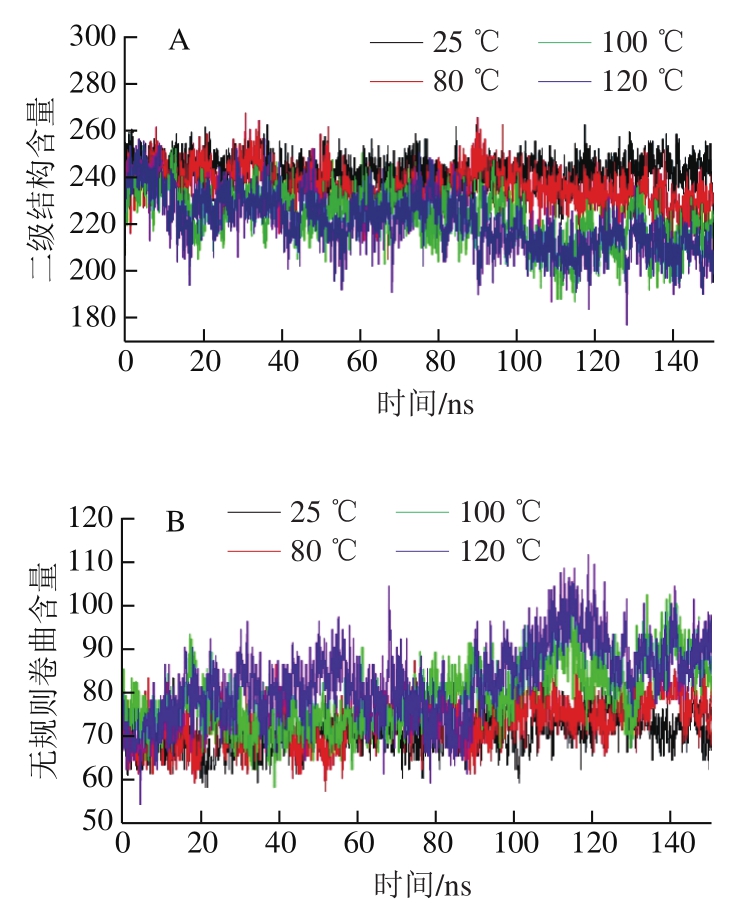
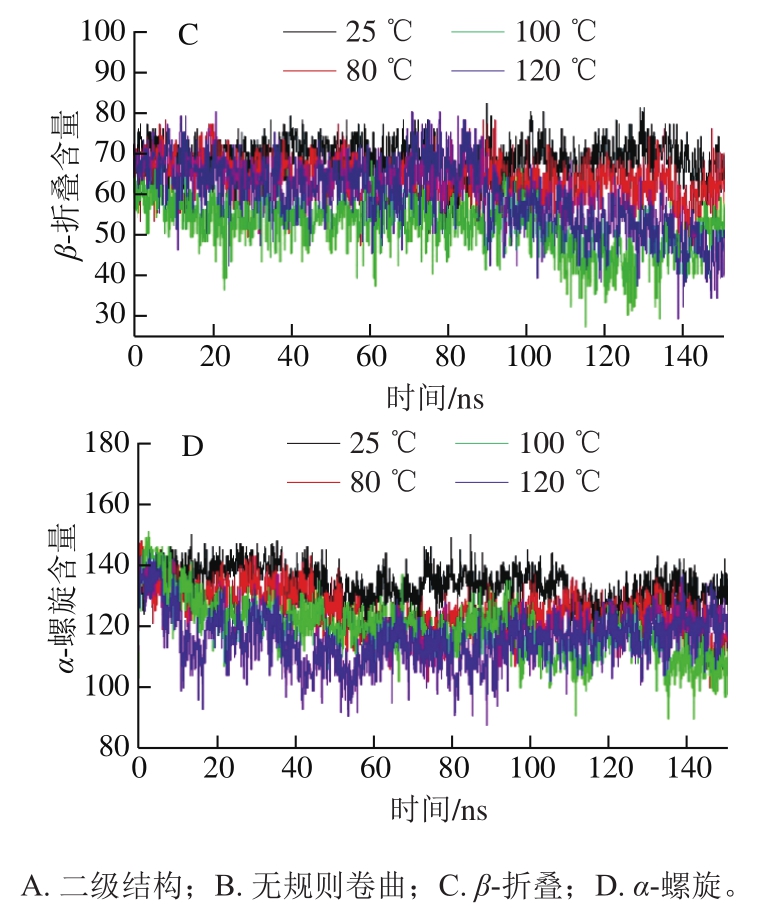
图 6 不同温度下肌动蛋白的二级结构变化
Fig. 6 Changes in actin secondary structure at different temperatures
2.7 热处理下肌动蛋白对酚类物质吸附的影响
表 1 不同温度下前20 个对接构象中肌动蛋白对风味物质的结合自由能
Table 1 Free energy for binding of actin to flavor substances in the first 20 docking conformations at different temperatures kcal/mol
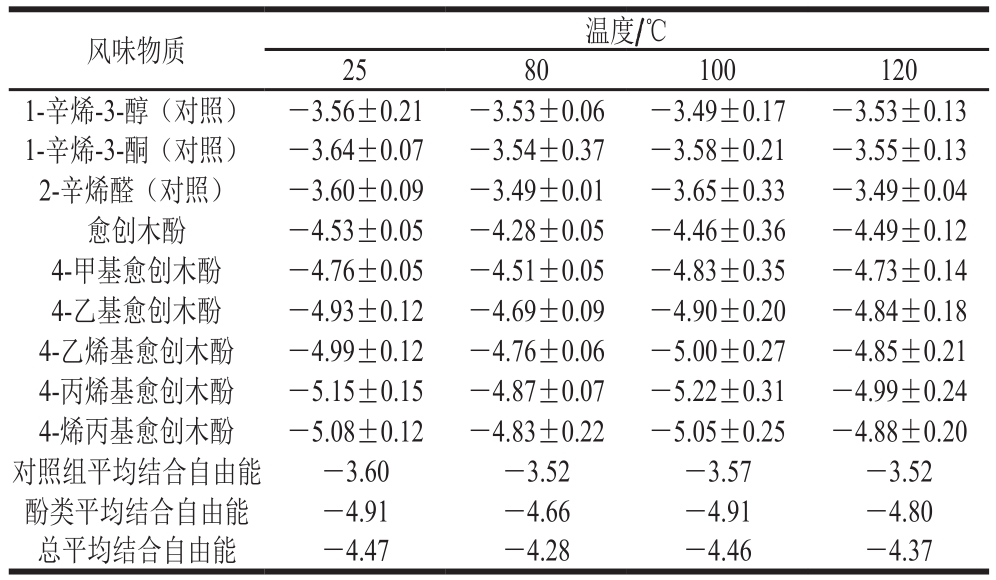
风味物质 温度/℃25 80 100 120 1-辛烯-3-醇(对照) -3.56±0.21 -3.53±0.06 -3.49±0.17 -3.53±0.13 1-辛烯-3-酮(对照) -3.64±0.07 -3.54±0.37 -3.58±0.21 -3.55±0.13 2-辛烯醛(对照) -3.60±0.09 -3.49±0.01 -3.65±0.33 -3.49±0.04愈创木酚 -4.53±0.05 -4.28±0.05 -4.46±0.36 -4.49±0.12 4-甲基愈创木酚 -4.76±0.05 -4.51±0.05 -4.83±0.35 -4.73±0.14 4-乙基愈创木酚 -4.93±0.12 -4.69±0.09 -4.90±0.20 -4.84±0.18 4-乙烯基愈创木酚 -4.99±0.12 -4.76±0.06 -5.00±0.27 -4.85±0.21 4-丙烯基愈创木酚 -5.15±0.15 -4.87±0.07 -5.22±0.31 -4.99±0.24 4-烯丙基愈创木酚 -5.08±0.12 -4.83±0.22 -5.05±0.25 -4.88±0.20对照组平均结合自由能 -3.60 -3.52 -3.57 -3.52酚类平均结合自由能 -4.91 -4.66 -4.91 -4.80总平均结合自由能 -4.47 -4.28 -4.46 -4.37
由于蛋白上存在多个小分子物质结合位点,并且具有一定的随机性,为减少误差,本研究选取得分排名前20 个对接构象计算平均结合自由能,并选取碳原子数均为8的1-辛烯-3-醇、1-辛烯-3-酮、2-辛烯醛作为对照。由表1可知,3 种对照物质在不同温度下与肌动蛋白的结合自由能均较为接近,有报道[29]显示肌原纤维蛋白对风味物质的吸附作用表现为由醇类>酮类>醛类依次递增的规律,这与本研究结果有所不同,可能是由于其结果为实际实验测得,影响因素较本实验所用分子模拟方法多,这种差异的具体机制有待于进一步研究。从6 种酚类物质来看,随碳链的延长,吸附作用逐渐增强;对比4-乙基愈创木酚与4-乙烯基愈创木酚,随着不饱和键的增加,吸附作用略有增强;对比2 种同分异构体4-丙烯基愈创木酚和4-烯丙基愈创木酚,前者的吸附作用大于后者;这些差异可能与小分子的结构差异有关。研究表明小分子物质与蛋白的结合主要通过疏水相互作用和氢键[14],碳链越长疏水相互作用越强;另外,空间位阻也会影响小分子物质与蛋白的结合,如Gremli等[30]研究发现,大豆蛋白对酮类的吸附随碳链的延长呈先增强后减弱变化,表现为对2-癸酮的吸附能力最强,这主要是由于碳链过长导致空间位阻增大,本研究中2 种同分异构体吸附能不同可能也与空间位阻不同有关。
对比不同温度发现,1-辛烯-3-醇、1-辛烯-3-酮、2-辛烯醛在不同温度下与肌动蛋白的结合自由能几乎无变化,而6 种酚类物质与肌动蛋白的结合自由能均在80 ℃时最低,可能是此时肌动蛋白未完全变性,暴露的可吸附区域减小;当温度升高至100 ℃时,结合自由能增加,并与25 ℃时接近,此时蛋白变性程度增加,结构变化导致一些疏水性结合位点的增加;而120 ℃又有所降低,可能是蛋白完全变性后导致风味物质吸附位点减少。
综上,温度影响肌动蛋白对风味物质吸附的可能机制是:加热时蛋白变性,疏水性区域和亲水性区域会发生一定程度的重排,导致蛋白与小分子物质的结合位点、结合方式和结合自由能均发生变化。因此,根据分子动力学模拟分析结果可知,100 ℃的加热更有利于蛋白结合更多的小分子酚类物质。另外,肌动蛋白对酚类物质的吸附作用远大于分子质量相近的醛、酮、醇类,而醛、酮、醇类物质也是腊肉中重要的风味物质,因此在腊肉生产时应避免过度烟熏,否则会导致吸附在蛋白中的醛、酮、醇类等小分子物质减少,影响腊肉的风味品质。
3 结 论
本实验采用分子动力模拟方法研究在室温(25 ℃)及3 种腊肉热处理常用温度(80、100、120 ℃)下肌动蛋白的结构变化,结果表明,随着温度的升高,肌动蛋白结构不稳定性增大,RMSD和RMSF值随着温度的升高明显增加,特别是100 ℃和120 ℃时;Rg随温度的升高波动增强并在平衡后呈下降趋势。疏水性区域及总溶剂可及表面积均随温度的升高而增大,蛋白内部氢键数量随着温度的升高而减少,120 ℃时降低最为明显。蛋白二级结构随温度的升高发生显著变化,主要是α-螺旋和β-折叠含量减少而无规则卷曲结构含量明显增加。温度的升高并不会显著改变肌动蛋白对1-辛烯-3-醇、1-辛烯-3-酮、2-辛烯醛的吸附,但80 ℃和120 ℃的加热会明显降低肌动蛋白对愈创木酚类物质的吸附。肌动蛋白对愈创木酚的吸附作用远大于分子质量相近的醇、酮和醛类物质,因此生产中应避免对腊肉过度烟熏,否则可能减少醛、酮、醇类等挥发性风味物质在腊肉蛋白中的保留,进而影响腊肉的风味品质。
[1]王洪伟, 索化夷, 张玉, 等. 感官评价和GC-MS结合偏最小二乘回归法分析酚类化合物对腊肉烟熏风味的贡献[J]. 食品与发酵工业,2019, 45(21): 244-249. DOI:10.13995/j.cnki.11-1802/ts.021083.
[2]WANG K, ARNTFIELD S D. Probing the molecular forces involved in binding of selected volatile flavour compounds to salt-extracted pea proteins[J]. Food Chemistry, 2016, 211: 235-242. DOI:10.1016/j.foodchem.2016.05.062.
[3]汪娟. 大豆分离蛋白与特定风味化合物相互作用机制的研究[D].广州: 华南理工大学, 2018: 15-22.
[4]胡可, 常瑞, 朱秋劲, 等. 西式火腿关键加工环节对肌原纤维蛋白结构及风味吸附能力的影响[J]. 食品与发酵工业, 2020, 46(6): 163-169. DOI:10.13995/j.cnki.11-1802/ts.022756.
[5]周昌瑜, 蒋亚婷, 曹锦轩, 等. 肌原纤维蛋白浓度对风味物质吸附能力的影响[J]. 核农学报, 2016, 30(5): 904-911. DOI:10.11869/j.issn.100-8551.2016.05.0904.
[6]徐永霞, 王瑞, 赵佳美, 等. 草鱼肌原纤维蛋白与特征腥味物质的结合作用[J]. 中国食品学报, 2020, 20(8): 76-83. DOI:10.16429/j.1009-7848.2020.08.009.
[7]CAO Jinxuan, ZHOU Changyu, WANG Yang, et al. The effect of oxidation on the structure of G-actin and its binding ability with aroma compounds in carp grass skeletal muscle[J]. Food Chemistry, 2018,240: 346-353. DOI:10.1016/j.foodchem.2017.07.068.
[8]PÉREZ-JUAN M, FLORES M, TOLDRA F. Binding of aroma compounds by isolated myofibrillar proteins: effect of protein concentration and conformation[J]. Food Chemistry, 2007, 105(3):932-939. DOI:10.1016/j.foodchem.2007.04.051.
[9]PÉREZ-JUAN M, FLORES M, TOLDRA F. Effect of pork meat proteins on the binding of volatile compounds[J]. Food Chemistry,2008, 108(4): 1226-1233. DOI:10.1016/j.foodchem.2007.04.037.
[10]PÉREZ-JUAN M, FLORES M, TOLDRA F. Effect of ionic strength of different salts on the binding of volatile compounds to porcine soluble protein extracts in model systems[J]. Food Research International,2007, 40(6): 687-693. DOI:10.1016/j.foodres.2006.11.013.
[11]LUO Ji, NASIRU M M, YAN W, et al. Effects of dielectric barrier discharge cold plasma treatment on the structure and binding capacity of aroma compounds of myofibrillar proteins from dry-cured bacon[J].LWT-Food Science and Technology, 2020, 117: 108606. DOI:10.1016/j.lwt.2019.108606.
[12]LÜ Tong, WANG Ying, PAN Daodong, et al. Effect of trypsin treatments on the structure and binding capacity of volatile compounds of myosin[J]. Food Chemistry, 2016, 214: 710-716. DOI:10.1016/j.foodchem.2016.07.115.
[13]楼宵玮, 蒋娅婷, 潘道东, 等. 氯化钠对肌原纤维蛋白与风味物质相互作用的影响[J]. 食品科学, 2017, 38(5): 74-79. DOI:10.7506/spkx1002-6630-201705012.
[14]吕彤, 林俊杰, 周昌瑜, 等. 热处理强度对猪肉肌球蛋白结构及风味成分吸附特性的影响[J]. 农业工程学报, 2016, 32(8): 285-291.DOI:10.11975/j.issn.1002-6819.2016.08.040.
[15]周昌瑜, 蒋娅婷, 曹锦轩, 等. 热处理时间对鸭肉肌原纤维蛋白凝胶的风味吸附能力影响[J]. 现代食品科技, 2016, 32(3): 218-224.DOI:10.13982/j.mfst.1673-9078.2016.3.035.
[16]刘晓霞, 邢光耀, 张利绒, 等. 黄粉虫抗冻蛋白分子与冰水界面相互作用的分子动力学模拟[J]. 内蒙古大学学报(自然科学版), 2020,51(6): 615-622. DOI:10.13484/j.nmgdxxbzk.20200609.
[17]魏贝贝. 基于分子动力学分析的Mn-SOD的热稳定性研究[D]. 曲阜:曲阜师范大学, 2018: 12-13.
[18]吕建平, 魏冬青, 王永华, 等. 基于分子动力学的脂肪酶Lipase5的热稳定性研究[J]. 原子与分子物理学报, 2016, 33(1): 128-134.DOI:10.3969/j.issn.1000-0364.2016.02.022.
[19]钱辉, 陆兆新, 张充, 等. 鱼腥藻脂肪氧合酶热稳定性提高的分子动力学模拟[J]. 食品科学, 2016, 37(2): 1-6. DOI:10.7506/spkx1002-6630-201702001.
[20]张晨虹. 絮凝蛋白Flo1突变对增强寡糖结合的分子动力[D]. 大连:大连理工大学, 2020: 18-22.
[21]王婧. 多酚类化合物与牛血清蛋白相互作用的研究[D]. 杭州: 浙江工业大学, 2013: 7-9.
[22]SAHIHI Y, GHAYEB Y. An investigation of molecular dynamics simulation and molecular docking: interaction of citrus flavonoids and bovine β-lactoglobulin in focus[J]. Computers in Biology and Medicine, 2014, 51: 44-50. DOI:10.1016/j.compbiomed.2014.04.022.
[23]ZHU Junxiang, LI Kangjing, WU Hao, et al. Multi-spectroscopic,conformational, and computational atomic-level insights into the interaction of β-lactoglobulin with apigenin at different pH levels[J]. Food Hydrocolloids, 2020, 105: 105810. DOI:10.1016/j.foodhyd.2020.105810.
[24]MOHAMMADI F, SAHIHI M, BORDBAR A K. Multispectroscopic and molecular modeling studies on the interaction of two curcuminoids with β-lactoglobulin[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2015, 140: 274-282. DOI:10.1016/j.saa.2014.12.032.
[25]STAPORNKUL N, PRYTKOVA T, WERE L. Effect of green tea on interaction of lipid oxidation products with sarcoplasmic and myofibrillar protein homogenates extracted from bovine top round muscle[J]. Food Research International, 2016, 89: 1038-1045.DOI:10.1016/j.foodres.2016.01.016.
[26]薛斐. 香草醛与蛋白质的相互作用研究[D]. 上海: 上海师范大学,2016: 1-69.
[27]刘祥雨, 覃小丽, 钟金锋. 采用分子动力学模拟研究温度对乳球蛋白稳定性的影响[J]. 食品与发酵工业, 2020, 46(7): 89-96.DOI:10.13995/j.cnki.11-1802/ts.022638.
[28]陈志国, 傅毅, 须文波. 分子动力学模拟研究CGTase酶活性区域的热稳定性[J]. 计算机与应用化学, 2013, 30(9): 967-972.DOI:10.3969/j.issn.1001-4160.2013.09.003.
[29]SHEN H, HUANG M, ZHAO M, et al. Interactions of selected ketone flavours with porcine myofibrillar proteins: the role of molecular structure of flavour compounds[J]. Food Chemistry, 2019, 298:125060. DOI:10.1016/j.foodchem.2019.125060.
[30]GREMLI H A. Interaction of flavor compounds with soy protein[J].Journal of the American Oil Chemists’ Society, 1974, 51(1): 95A-97A.DOI:10.1007/BF02542100.