牛磺酸,化学名为2-氨基乙磺酸,俗称牛胆碱,是一种存在于动物体内的含硫非蛋白氨基酸[1-2]。牛磺酸曾经被认为是含硫氨基酸的无功能代谢产物[3],直到1975年Hayes等[4]报道,采用以酪蛋白为主要蛋白来源的饲料饲喂猫,因其缺乏牛磺酸,可引起猫的视网膜变性,若长期缺乏,可导致猫失明,从而引起了人们对牛磺酸营养作用的高度重视。
研究表明,牛磺酸对生长发育有一定影响,是人体条件性必需氨基酸[5],具有促进脂肪和脂溶性物质吸收、提高机体免疫力、促进生长及保护细胞、改善心肌缺血损伤及促进蛋白质、氨基酸、糖代谢等生理学功能[6-8],适量的牛磺酸能促进机体的激素分泌,增强和改善机体的各种功能,是调节机体正常活动的活性物质,而缺乏牛磺酸会导致多种疾病的发生[9]。基于牛磺酸的重要生理功能,准确检测各类食品中牛磺酸的含量对指导营养的均衡摄入具有重要意义。
天然食品中,海洋动物的牛磺酸含量较高,猪肉、牛肉、鸡肉等畜禽肉中牛磺酸含量较丰富,鸡胚中牛磺酸含量约为哺乳动物的100 倍[10]。食品中牛磺酸的检测方法主要包括液相色谱法[11-16]、氨基酸分析仪法[17-18]、离子色谱法[19]、分光光度法[20]和液相色谱-串联质谱法[21-24]等;而对于药物[25-26]、大鼠血液及组织[27-29]等不同基质中牛磺酸的检测方法研究,国内外也有相关报道。在众多检测方法中,最常用的方法为高效液相色谱法,但因牛磺酸的紫外吸收较弱,常采用衍生化方法提高检测灵敏度,而衍生化反应操作较繁琐,要求较高,影响因素较多。本研究旨在利用高效液相色谱-串联质谱仪建立一种操作简便、检出限低、灵敏度高、定性及定量准确的牛磺酸含量检测方法,以满足猪肉和猪肉制品中牛磺酸含量的准确定性及定量。
1 材料与方法
1.1 材料与试剂
猪肉、猪肉圆火腿为市售。
牛磺酸标准物质(100 mg,纯度≥99.6%) 中国标准物质中心;乙腈(质谱纯)、乙酸铵(质谱纯)美国Fisher公司;亚铁氰化钾、乙酸锌、正己烷 天津市科密欧化学试剂有限公司。
1.2 仪器与设备
Xevo TQ MS高效液相色谱-串联质谱仪、BEH-C18色谱柱(2.1 mm×50 mm,1.7 μm)、BEH-HILIC色谱柱(2.1 mm×50 mm,1.7 μm) 美国Waters公司;BSA224S电子天平 瑞士Mettler Toledo公司;5200DE数控超声波清洗器 昆山市超声仪器有限公司;VX-III多管平行振荡器 北京Targin公司;JW-3021HR离心机安徽嘉文仪器装备有限公司;MS 3 basic涡旋振荡器、高速分散机 德国IKA公司;0.22 μm微孔滤膜(有机相)天津市津腾实验设备有限公司。
1.3 方法
1.3.1 标准溶液的配制
牛磺酸标准储备液(1.0 mg/mL):准确称取10 mg(精确至0.1 mg)牛磺酸标准物质于10 mL容量瓶中,用超纯水定容至刻度,摇匀。
牛磺酸标准中间溶液(10 μg/mL):准确吸取1.0 mg/mL牛磺酸标准储备液1 mL于100 mL容量瓶中,用超纯水定容至刻度,摇匀。
牛磺酸标准工作溶液:准确吸取一定量的10 μg/mL牛磺酸标准中间溶液,用体积分数75%乙腈水溶液稀释成质量浓度分别为1、5、10、20、50、100、200、500、1 000 ng/mL的标准工作溶液,现配现用。
1.3.2 高效液相色谱条件
BEH-HILIC色谱柱(2.1 mm×50 mm,1.7 μm),柱温40 ℃,流动相A为超纯水,流动相B为乙腈,流速0.40 mL/min,进样量2 μL,流动相及梯度洗脱条件见表1。
1.3.3 质谱条件
表 1 流动相及梯度洗脱条件
Table 1 Mobile phase composition and gradient elution conditions

时间/min 流动相A体积分数/% 流动相B体积分数/% 曲线0.0 8 92 1.0 8 92 线性变化3.0 50 50 线性变化4.0 8 92 线性变化6.0 8 92 即时变化
电离模式:电喷雾离子源(electrospray ionization,ESI)负离子模式(ESI-);检测模式:多反应监测(multiple response monitoring,MRM)模式;毛细管电压2.8 kV;离子源温度150 ℃;干燥气流量950 L/h;干燥气温度450 ℃;锥孔反吹气流量40 L/h,MRM监测条件如表2所示。
表 2 MRM条件
Table 2 MRM mass spectrometric conditions

碰撞能量/eV牛磺酸 123.855>79.834 123.855>79.834 161 33 15 123.855>106.823 12名称 定性离子对(m/z)定量离子对(m/z)采集时间/ms碎裂电压/V
1.3.4 样品处理
1.3.4.1 样品提取
准确称取经绞肉机搅碎处理均匀的样品2 g(精确至0.001 g)于50 mL离心管中,加入20 mL约40 ℃的温水[13],采用高速分散机处理约0.5 min,使其完全分散,涡旋振荡提取10 min,将离心管中的样品转移至100 mL容量瓶中,用约50 mL 40 ℃左右的温水分2~3 次洗涤离心管,洗涤液合并转入100 mL容量瓶中,超声提取10 min,待样液冷却至室温后用水定容至100 mL,移取10 mL定容液于另一50 mL离心管中,加入10 mL水饱和正己烷,涡旋振荡混合5 min,于4 ℃、7 000 r/min离心5 min。
1.3.4.2 样品净化
准确吸取1 mL离心后下层清液于15 mL离心管中,加入3 mL乙腈用以沉淀蛋白质,涡旋振荡混匀1 min,7 000 r/min离心5 min,吸取1 mL上清液过0.22 μm有机滤膜,滤液供高效液相色谱-串联质谱仪测定。
1.4 数据处理
采用与高效液相色谱-串联质谱仪配套使用的数据采集和处理一体化软件MassLynx V4.1(美国Waters公司)进行实验数据的采集和实验结果的自动处理,经软件自动处理得到试样溶液中牛磺酸的质量浓度,按式(1)计算试样中牛磺酸含量。
式中:X为试样中牛磺酸含量/(mg/100 g);ρ为从标准工作曲线得到的试样溶液中牛磺酸的质量浓度/(ng/mL);V为样液最终定容体积/mL;m为试样质量/g。
2 结果与分析
2.1 质谱条件优化
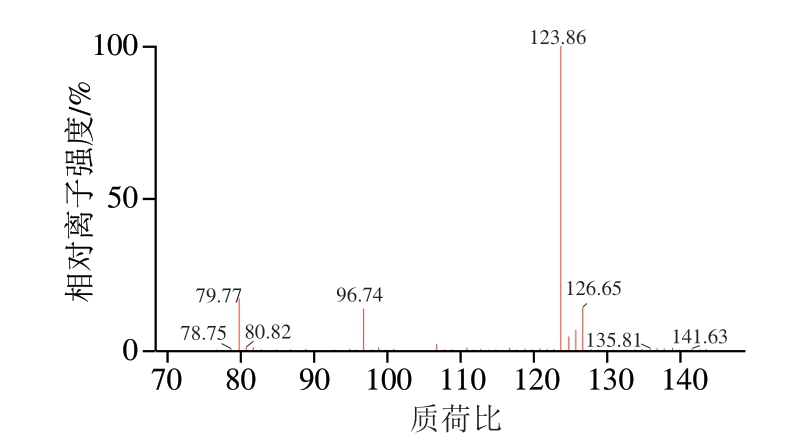
图 1 牛磺酸的母离子扫描图
Fig. 1 Parental ion scan mass spectrum of taurine
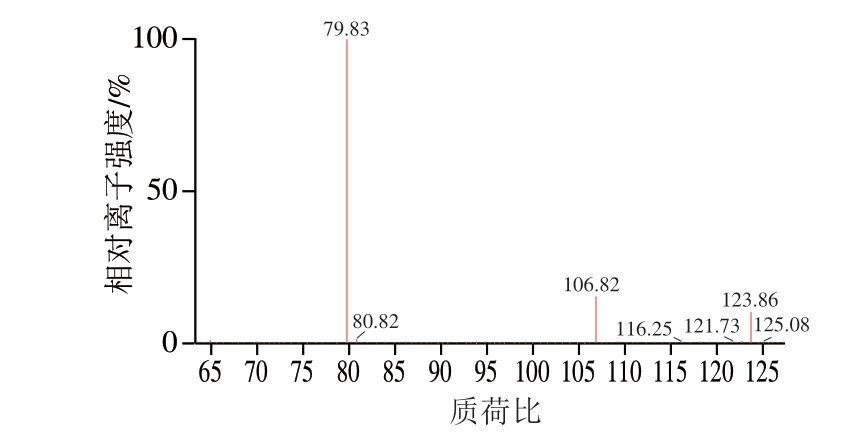
图 2 牛磺酸的特征碎片离子扫描图
Fig. 2 Fragment ions scan mass spectrum of taurine
采用10 μg/mL牛磺酸标准溶液通过蠕动泵注射至离子源,分别在ESI+模式和ESI-模式下进行全扫描,结果表明,牛磺酸在ESI-模式下的响应值明显高于ESI+模式,且因牛磺酸含有磺基结构,在ESI-模式下,较易失去H形成较为稳定的[M—H]-分子离子,因此选择ESI-模式。确定离子模式后,分别选择全扫描和子离子扫描模式,获得牛磺酸的母离子扫描图谱(图1)和特征碎片离子扫描图谱(图2),选择离子丰度最强的碎片离子对为定量离子对,离子丰度相对较强的离子对为定性离子对,同时对其毛细管电压、碎裂电压和碰撞能量等条件进行优化,优化后的质谱条件如1.3.2节所示。
2.2 高效液相色谱条件优化
采用优化后的质谱条件(1.3.2节),对比BEH-C18色谱柱(2.1 mm×50 mm,1.7 μm)与BEH-HILIC色谱柱(2.1 mm×50 mm,1.7 μm)对10 ng/mL牛磺酸标准溶液的分离效果。
当使用BEH-C18柱进行分离时,牛磺酸的保留效果不好,出峰过快(约0.3 min),且峰型严重不对称,这可能是牛磺酸极性较强所致,更换不同流动相,添加甲酸铵、乙酸铵等峰型改善剂,同时调整不同流动相的洗脱梯度,牛磺酸仍无法得到较好保留和相对较优的峰型。
当使用BEH-HILIC柱进行分离时,因HILIC柱装填了中性的酰胺键合基团,提高了其对强极性、水溶性碱性有机物的保留能力,其对脂肪类物质基本不保留,从而可有效去除基质效应的影响,当采用乙腈、超纯水作为流动相时,其对牛磺酸有较好的保留,且色谱峰峰型对称、美观,灵敏度高。
采用优化后的高效液相色谱条件(1.3.1节)和质谱条件(1.3.2节)测定10 ng/mL和1 ng/mL牛磺酸标准溶液,色谱图分别如图3和图4所示。
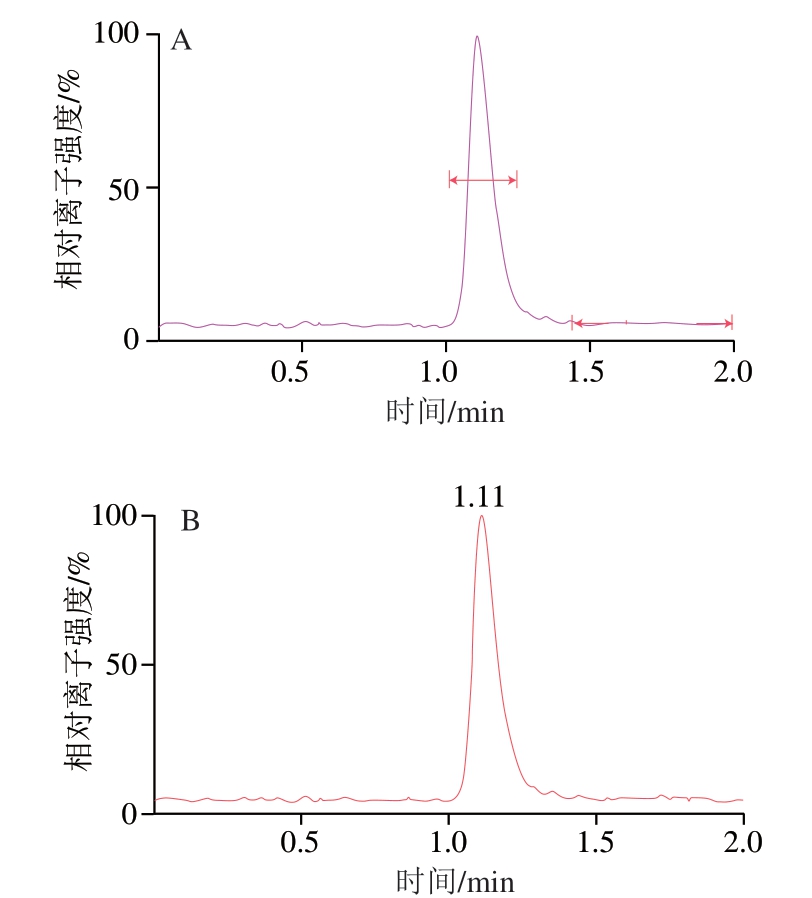
图 3 10 ng/mL牛磺酸标准溶液的色谱图
Fig. 3 Chromatogram of 10 ng/mL standard solution of taurine
A. 定量离子色谱图;B. 总离子流图。图4同。
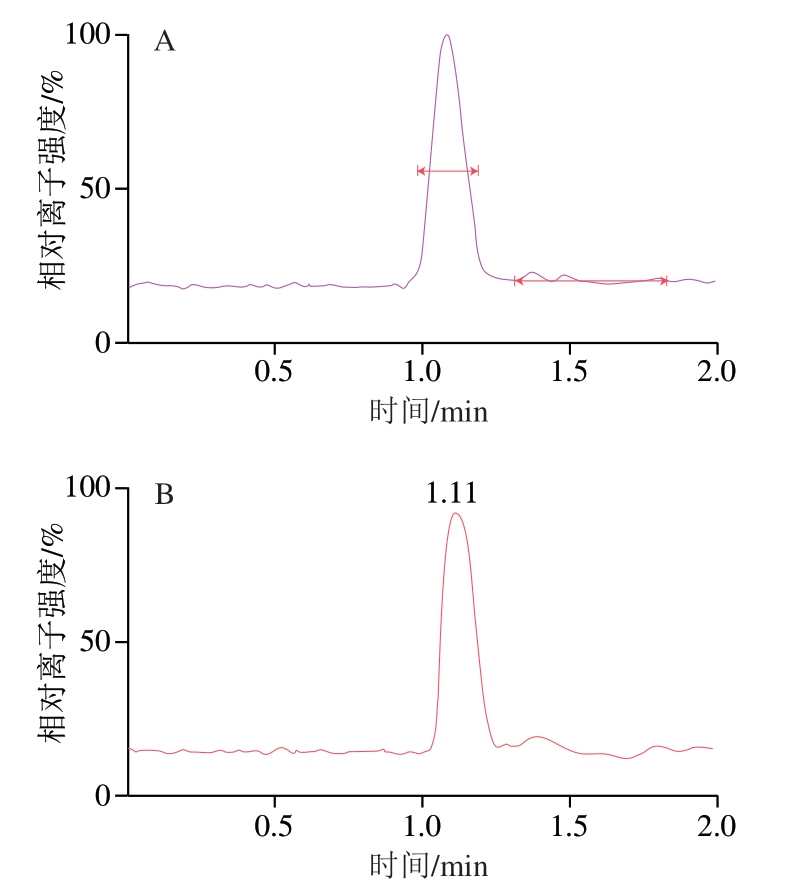
图 4 1 ng/mL牛磺酸标准溶液的色谱图
Fig. 4 Chromatogram of 1 ng/mL standard solution of taurine
2.3 样品前处理条件优化
猪肉及猪肉制品中含有大量的蛋白质和脂肪,若不去除,会给牛磺酸的检测造成一定的基质干扰。去除蛋白质的主要方法有固相萃取法[30-31]和蛋白沉淀法[32-34],固相萃取法成本较高,净化步骤较为繁琐,而蛋白沉淀法操作简便、快捷,因此本研究使用蛋白沉淀法对样品进行净化处理。去除肉及肉制品中脂肪一般采用正己烷除脂肪法,本研究采用此法得到了很好的除脂肪效果。
分别选用亚铁氰化钾、乙酸锌混合溶液(92 g/L亚铁氰化钾、183 g/L乙酸锌体积比1∶1混合)和乙腈作为沉淀剂。当采用亚铁氰化钾和乙酸锌混合溶液作为沉淀剂时,利用亚铁氰化钾和乙酸锌反应生成的氰亚铁酸锌沉淀挟走或吸附干扰物质,与蛋白质共沉淀而达到净化目的,净化效果较好,基本可消除基质干扰,测定猪肉及猪肉制品中牛磺酸含量时,加标回收率可达80%以上,但本研究选用的色谱柱为BEH-HILIC柱,采用纯水相作为上机定容液时,对色谱柱的填料有一定破坏作用,且因溶剂效应,导致色谱峰的对称性变差,峰型变宽。而采用乙腈作为沉淀剂时,乙腈可降低水的介电常数,导致具有表面水层的生物大分子脱水聚集后沉淀析出,对蛋白质具有很好的沉淀效果,其净化效果好,可消除基质干扰,测定猪肉及猪肉制品中牛磺酸含量时,加标回收率可达90%以上,且采用体积分数75%乙腈-水溶液作为上机定容液时,对BEH-HILIC色谱柱的填料无破坏作用,无溶剂效应,峰型窄而尖锐对称。因此选择乙腈作为蛋白沉淀剂。
2.4 线性方程和定量限
按优化后的仪器条件及样品前处理方法对牛磺酸标准工作溶液进行测定。以定量离子峰面积(y)对牛磺酸质量浓度(x,ng/mL)绘制标准曲线,其回归方程为y=3 746.9x+354.2(R2=0.998 9)。以定量离子对3 倍信噪比为检出限,得到该方法的仪器检出限为0.3 ng/mL(实际3 倍信噪比为3.52),10 倍信噪比为定量限,得到该方法的仪器定量限为1 ng/mL(实际10 倍信噪比为11.59)。因受样品基质影响,又未找到牛磺酸阴性猪肉和猪肉制品样品,从而无法获得在检出限或接近检出限的样品数据,故采用校准方程的适用范围评估方法检出限[35]。本研究采用式(2)计算XLOD。
式中:S为牛磺酸阳性基质样品重复测定12 次的校准标准误差(仪器响应的标准偏差)/(ng/mL);b为回归方程的斜率。
通过实验得到S=6 298.3 ng/mL,因此XLOD=5 ng/mL。将XLOD=5 ng/mL代入公式(1),XLOD即为公式(1)中的ρ,计算得到对应的方法检出限为0.1 mg/100 g,以3~10 倍检出限作为方法定量限[35],最终确定本方法的定量限为0.5 mg/100 g。
2.5 加标回收率和精密度
2.5.1 猪肉样品的加标回收率和精密度
取经绞肉机搅碎处理均匀的同一猪肉样品,按表3设计实验。因未找到牛磺酸阴性猪肉样品,为减小样品中较高的牛磺酸含量对加标回收率的影响,故未选择定量限做加标回收实验,而选择与样品中牛磺酸含量相当的加标量和减半的加标量进行加标实验(下同)。本研究所用猪肉样品为同一猪肉样品,表3中测得的加标回收率结果均为扣除猪肉样品中牛磺酸含量所得结果。
表 3 猪肉样品中牛磺酸的加标回收率和精密度测定结果(n=8)
Table 3 Recovery and precision of taurine spiked in fresh pork (n= 8)
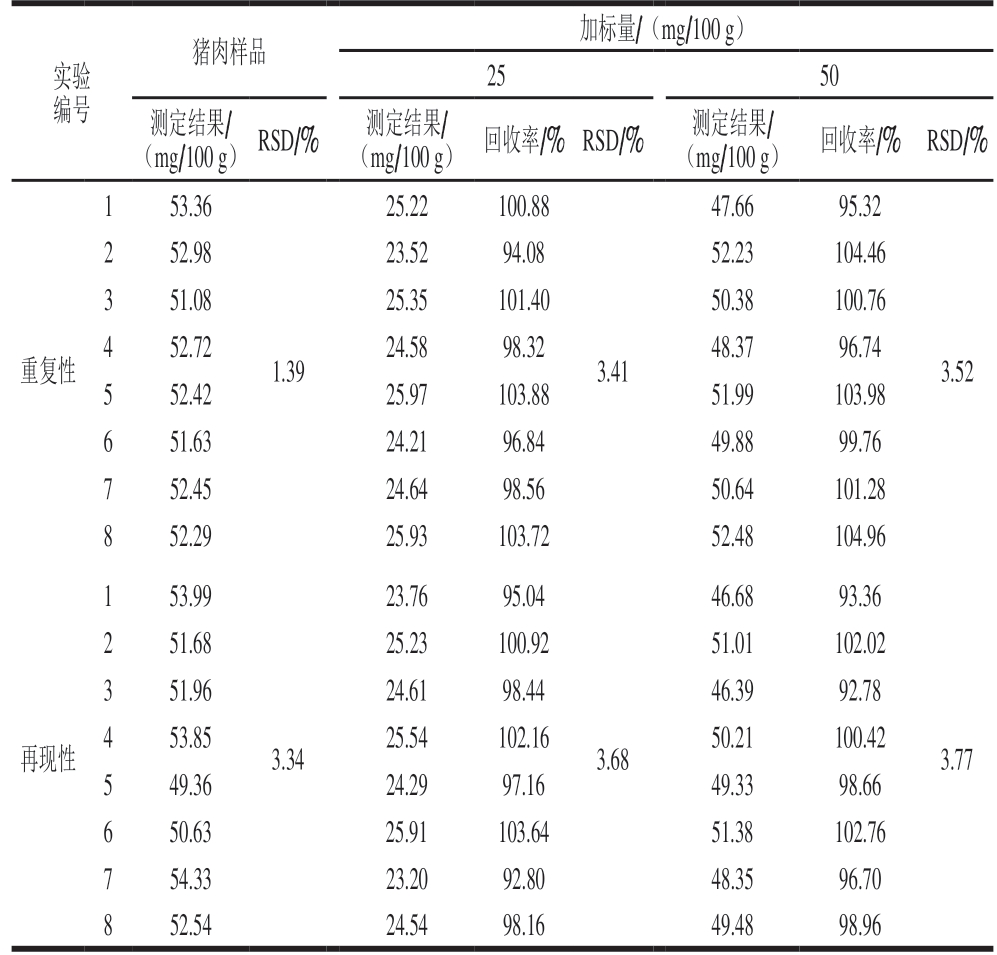
实验编号猪肉样品 加标量/(mg/100 g)25 50测定结果/(mg/100 g) RSD/% 测定结果/(mg/100 g) 回收率/% RSD/% 测定结果/(mg/100 g) 回收率/% RSD/%1 53.36 25.22 100.88 47.66 95.32重复性2 52.98 23.52 94.08 52.23 104.46 3 51.08 25.35 101.40 50.38 100.76 4 52.72 24.58 98.32 48.37 96.74 5 52.42 25.97 103.88 51.99 103.98 6 51.63 24.21 96.84 49.88 99.76 7 52.45 24.64 98.56 50.64 101.28 8 52.29 25.93 103.72 52.48 104.96 1.39 3.41 3.52 1 53.99 23.76 95.04 46.68 93.36再现性2 51.68 25.23 100.92 51.01 102.02 3 51.96 24.61 98.44 46.39 92.78 4 53.85 25.54 102.16 50.21 100.42 5 49.36 24.29 97.16 49.33 98.66 6 50.63 25.91 103.64 51.38 102.76 7 54.33 23.20 92.80 48.35 96.70 8 52.54 24.54 98.16 49.48 98.96 3.34 3.68 3.77
由表3可知,猪肉样品中牛磺酸含量为52.3 mg/100 g,其加标回收率为92.78%~104.96%,相对标准偏差(relative standard deviation,RSD)为1.39%~3.77%。
2.5.2 猪肉制品样品的加标回收率和精密度
取经绞肉机搅碎处理均匀的同一猪肉圆火腿样品,按表4设计实验,测得的加标回收率结果均为扣除猪肉圆火腿样品中牛磺酸含量所得结果。
表 4 猪肉制品中牛磺酸的加标回收率和精密度测定结果(n=8)Table 4 Recovery and precision of taurine spiked in pork sausage (n= 8)
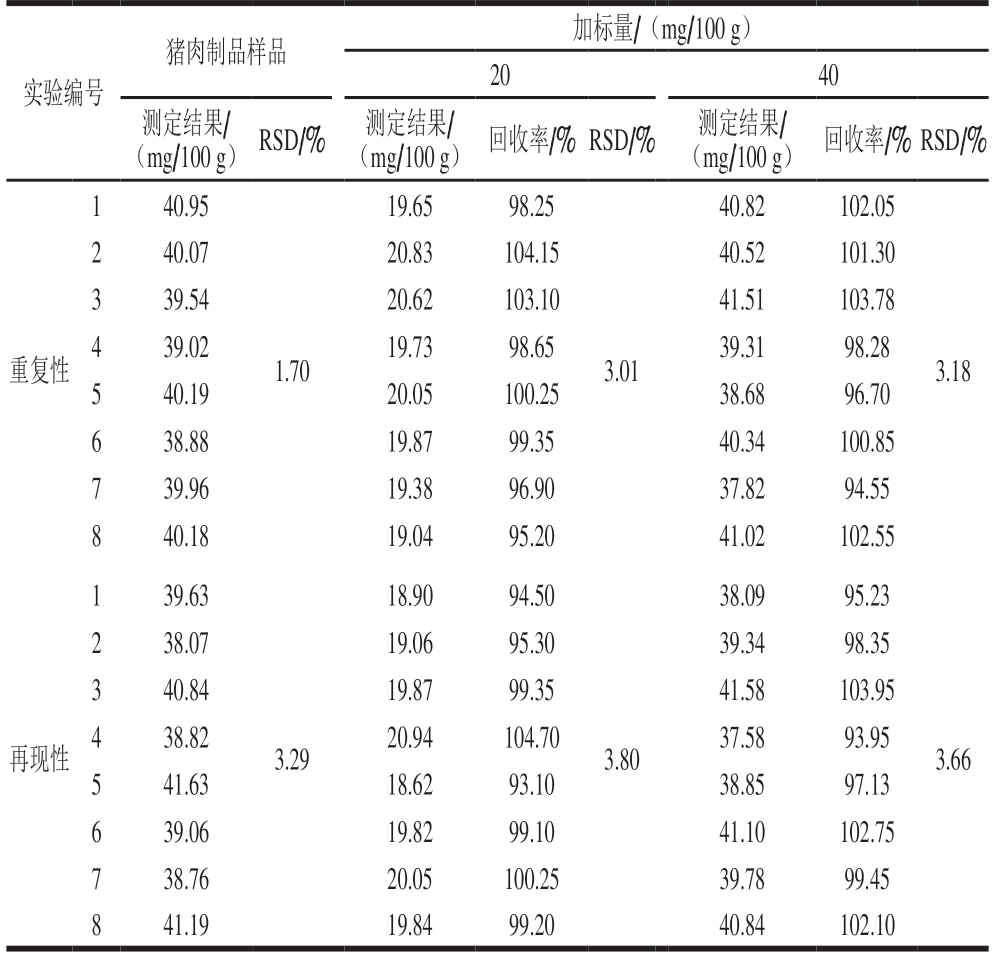
实验编号猪肉制品样品 加标量/(mg/100 g)20 40测定结果/(mg/100 g) RSD/% 测定结果/(mg/100 g) 回收率/% RSD/% 测定结果/(mg/100 g) 回收率/% RSD/%1 40.95 19.65 98.25 40.82 102.05重复性2 40.07 20.83 104.15 40.52 101.30 3 39.54 20.62 103.10 41.51 103.78 4 39.02 19.73 98.65 39.31 98.28 5 40.19 20.05 100.25 38.68 96.70 6 38.88 19.87 99.35 40.34 100.85 7 39.96 19.38 96.90 37.82 94.55 8 40.18 19.04 95.20 41.02 102.55 1.70 3.01 3.18 1 39.63 18.90 94.50 38.09 95.23再现性2 38.07 19.06 95.30 39.34 98.35 3 40.84 19.87 99.35 41.58 103.95 4 38.82 20.94 104.70 37.58 93.95 5 41.63 18.62 93.10 38.85 97.13 6 39.06 19.82 99.10 41.10 102.75 7 38.76 20.05 100.25 39.78 99.45 8 41.19 19.84 99.20 40.84 102.10 3.29 3.80 3.66
由表4可知,猪肉制品(猪肉圆火腿)中牛磺酸含量为39.8 mg/100 g,其加标回收率为93.10%~104.70%,RSD为1.70%~3.80%。
3 讨 论
对比了ESI+和ESI-模式下牛磺酸的响应值,结合牛磺酸的结构特点,选择在ESI-模式下进行质谱方法的优化,通过全扫描和子离子扫描,确定了牛磺酸的母离子和子离子,同时优化了毛细管电压、干燥气流量、碰撞能等质谱参数;通过对比BEH-C18和BEH-HILIC色谱柱对牛磺酸的保留和分离效果,选择对牛磺酸保留效果好、色谱峰峰型对称、灵敏度高且基质效应低的BEH-HILIC色谱柱,同时优化了流动相及洗脱梯度,达到了很好的保留和分离效果。
Mario[22]、Massimo[23]、Chen Zhi[25]、潘军[26]等采用质谱法对能量饮料和药片中牛磺酸含量进行检测,但能量饮料和药片相对于猪肉及猪肉制品,没有蛋白质、脂肪等大分子杂质的干扰,处理过程相对较简便,甚至可以直接测定,而猪肉及猪肉制品中的蛋白质、脂肪等会对牛磺酸的检测造成一定的基质干扰,需采取合适的方法去除。因牛磺酸可溶于水,不溶于乙醚、正己烷等有机溶剂,结合GB 5009.169—2016《食品安全国家标准 食品中牛磺酸的测定》[13]中前处理方法,选择用水进行提取,正己烷除脂肪,同时对比了亚铁氰化钾、乙酸锌混合溶液和乙腈的除蛋白效果,结合加标回收率、基质效应和BEH-HILIC色谱柱的特性,最终选择采用乙腈作为蛋白沉淀剂,达到了很好的除杂效果。
采用优化后的方法对猪肉和猪肉制品中的牛磺酸含量进行检测,在质量浓度1~1 000 ng/mL范围内,牛磺酸的回归方程线性良好,在阳性样品中添加水平为20~50 mg/100 g时,牛磺酸的加标回收率为92.78%~104.96%,RSD为1.39%~3.80%,方法检出限为0.1 mg/100 g,定量限为0.5 mg/100 g,与林琳等[24]建立的方法比较,本研究的方法检出限和定量限均更低,能满足猪肉和猪肉制品中牛磺酸的快速定性和定量检测。
本研究使用高效液相色谱-串联质谱法检测猪肉及猪肉制品中牛磺酸的含量,对准确检测各类动物源性食品中牛磺酸的含量、指导营养的均衡摄入具有重要意义。但本研究只针对牛磺酸1 种目标物进行了检测,与对多种目标物同时检测相比,其提取和分离过程均相对简单,为提高方法的实用性和应用价值,需在本方法的基础上,参考Mario[22]、Chen Zhi[25]等建立的方法,继续加强不同基质中牛磺酸与其他多种营养素同时检测的方法研究。
4 结 论
本研究优化了牛磺酸测定的高效液相色谱条件、质谱条件和样品提取及净化步骤,建立了猪肉和猪肉制品中牛磺酸含量的高效液相色谱-串联质谱快速检测方法,具有灵敏度高、检出限低、杂峰干扰小、回收率高、定性定量准确、检测快速等特点,适用于猪肉和猪肉制品中牛磺酸含量的准确定性定量,对准确检测各类动物源性食品中牛磺酸的含量、指导营养的均衡摄入具有重要意义。
[1] 刘成模, 王华朗, 杨曦, 等. 液相色谱法检测乌贼膏中牛磺酸含量[J]. 粮食与饲料工业, 2015(3): 60-62. DOI:10.7633/j.issn.1003-6202.2015.03.016.
[2] 白小琼, 孔德义. 牛磺酸研究进展[J]. 中国食物与营养, 2011, 17(5):78-80. DOI:10.3969/j.issn.1006-9577.2011.05.019.
[3] Taurine-monograph[J]. Alternative Medicine Review, 2001,6(1): 78-82.
[4] HAYES K C, SCHMIDT R C. Retinal degeneration associated with taurine deficiency in the cat[J]. Science, 1975, 188: 949-951.DOI:10.1126/science.1138364.
[5] HUXTABLE R J. Physiological actions of taurine[J]. Physiological Reviews, 1992, 72(1): 101-163. DOI:10.1152/physrev.1992.72.1.101.
[6] GEI K R, JESTER I, FALKE W, et al. The efect of a taurine containing drink on performance in 10-enduranceathletes[J]. Amino Acids, 1994,7(1): 45-46. DOI:10.1007/BF00808445.
[7] 刘晓雪, 张乃文, 任凤云. 牛磺酸保护心肌缺血损伤的研究进展[J].国际老年医学杂志, 2020, 41(5): 339-341. DOI:10.3969/j.issn.1674-7593.2020.05.018.
[8] LI Fang, TENG Huiyun, LIU Jing, et al. Antenatal taurine supplementation increases taurine content in intrauterine growth restricted fetal rat brain tissue[J]. Metabolic Brain Disease, 2014,29(3): 867-871. DOI:10.1126/science.1138364.
[9] MOTOKI M, YASUHISA A. A simple assay of taurine concentrations in food and biological samples using taurine dioxygenase[J]. Analytical Biochemistry, 2012, 427: 121-123. DOI:10.1016/j.ab.2012.04.030.
[10] 何天培, 顾景范, 高兰兴. 牛磺酸对应激大鼠甲状腺激素代谢的影响[J]. 营养学报, 1998(4): 31-33.
[11] 谢昭鹏, 姚昱锟, 刘斌雄, 等. 牛磺酸提取及检测方法的研究进展[J]. 食品工业科技, 2019, 40(24): 323-331. DOI:10.13386/j.issn1002-0306.2019.24.054.
[12] MOHAMMADREZA G S, SIMINOZAR M, MAHBOUB N, et al.A rapid determination of taurine in human plasma by LC[J]. Chromatographia,2009, 69(11): 1427-1430. DOI:10.1365/s10337-009-1055-6.
[13] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准食品中牛磺酸的测定: GB 5009.169—2016[S]. 北京: 中国标准出版社, 2016: 1-10.
[14] 柳小英, 毛丽沙, 鲍敏洁, 等. 高效液相色谱法测定海洋生物中牛磺酸的含量[J]. 安徽农业科学, 2017, 45(31): 1-3. DOI:10.13989/j.cnki.0517-6611.2017.31.001.
[15] 汤鋆, 王天娇, 彭立核, 等. 柱前衍生-高效液相色谱法快速检测人血清中牛磺酸[J]. 中国卫生检验杂志, 2019, 29(21): 2579-2580; 2583.
[16] WANG Xifeng, CHI Defeng, SU Guanmin, et al. Determination of taurine in biological samples by high-performance liquid chromatography using 4-fluoro-7-nitrobenzofurazan as a derivatizing agent[J]. Biomedical and Environmental Sciences, 2011, 24(5):537-542. DOI:10.3967/0895-3988.2011.05.013.
[17] 秦菁, 魏鲜娥, 蔡伟江, 等. 全自动氨基酸分析仪测定支链氨基酸粉中牛磺酸的含量[J]. 食品安全质量检测学报, 2017, 8(5): 1883-1886.DOI:10.19812/j.cnki.jfsq11-5956/ts.2017.05.069.
[18] 刘常凯, 何林飞, 辛丽娜. 氨基酸分析仪检测婴幼儿奶粉中牛磺酸含量[J]. 食品安全质量检测学报, 2019, 10(12): 3957-3961.
[19] 邵文尧, 邱隆辉, 郭静, 等. 天然牛磺酸的离子色谱分析方法研究[J]. 生物加工过程, 2015, 13(3): 64-68. DOI:10.3969/j.issn.1672-3678.2015.03.012.
[20] 李咏梅, 李人宇. 高灵敏分光光度法测定贝类中牛磺酸含量[J].现代化工, 2013, 33(10): 137-140. DOI:10.16606/j.cnki.issn0253-4320.2013.10.024.
[21] PERSON M D, HAZOTTE A, ELFAKIR C, et al. Development and validation of a hydrophilic interaction chromatography-masss pectrometry eassay for taurine and methionine in matrices rich in carbohydrates[J]. Journal of Chromatography A, 2005, 1081: 174-181.DOI:10.1016/j.chroma.2005.05.052.
[22] MARIO A, GERTRUD M. Simultaneous determination of riboflavin, pyridoxine, nicotinamide, caffeine and taurine in energy drinks by planar chromatography-multiple detection with confirmation by electrospray ionization mass spectrometry[J].Journal of Chromatography A, 2006, 1131: 253-260. DOI:10.1016/j.chroma.2006.07.018.
[23] MASSIMO R, GIOVANNI C, MANUELA C, et al. Simultaneous determination of taurine, glucuronolactone and glucuronic acid in energy drinks by ultra high performance liquid chromatography-tandem mass spectrometry (triple quadrupole)[J]. Journal of Chromatography A,2014, 1364: 303-307. DOI:10.1016/j.chroma.2014.08.083.
[24] 林琳, 林毅侃, 庞贝妮, 等. 高效液相色谱-串联质谱法测定特殊医学用途婴儿乳粉中牛磺酸的含量[J]. 乳业科学与技术, 2020, 43(1):5-8. DOI:10.15922/j.cnki.jdst.2020.01.002.
[25] CHEN Zhi, CHEN Bo, YAO Shouzhuo. High-performance liquid chromatogra-phy/electrospray ionization-mass spectrometry for simultaneous determination of taurine and 10 water-soluble vitamins in multivitamin tablets[J]. Analytica Chimica Acta, 2006, 569(1/2):169-175. DOI:10.1016/j.aca.2006.03.099.
[26] 潘军, 王颖臻. 亲水作用色谱-质谱法检测牛磺酸颗粒中的牛磺酸[J].药物分析杂志, 2016, 36(11): 1999-2003. DOI:10.16155/j.0254-1793.2016.11.16.
[27] TANG Daoquan, ZHENG Xiaoxiao, LI Yinjie, et al. Two complementary liquid chromatography-tandem mass spectrometry(LC-MS/MS) methods to study the excretion and metabolic interaction of edaravone and taurine in rats[J]. Journal of Chromatography B,2014, 970: 8-17. DOI:10.1016/j.jchromb.2014.08.025.
[28] 彭灿, 王敏, 吕蒙莹, 等. 大鼠血浆中胆汁酸、胆红素及牛磺酸的LC-MS/MS分析[J]. 中国药科大学学报, 2013, 44(4): 343-347.
[29] LI Yinjie, LI Zheng, ZHENG Xiaoxiao, et al. Evaluation of sample preparation and chromatographic separation for the parallel determination of taurine and edaravone in rat tissues using HILIC-MS/MS[J].Analytical and Bioanalytical Chemistry, 2015, 407(14): 4143-4153.DOI:10.1007/s00216-015-8635-0.
[30] 黄惠雯. 离子色谱法测定生鲜牛奶中硫氰酸钠前处理方法的研究[J].广西农学报, 2019, 34(4): 34-38.
[31] 邵金良, 杨东顺, 王丽, 等. 固相萃取-高效液相色谱法同时测定牛奶中13 种磺胺残留[J]. 分析实验室, 2014, 33(11): 1322-1325.DOI:10.13595/j.cnki.issn1000-0720.2014.0309.
[32] 谢明清, 林树海, 陈永锋. HPLC/MS/MS法检测人全血中的氟胺酮[J].广东公安科技, 2020, 28(3): 68-69.
[33] 张吟, 陈崇宏, 林玲, 等. 蛋白沉淀-高效液相色谱法筛查血浆中61 种常见的中枢神经系统药物[J]. 色谱, 2009, 27(6): 787-793.DOI:10.3321/j.issn:1000-8713.2009.06.010.
[34] 朱慧, 李克, 翟云霞. 血清蛋白质组学研究中乙腈沉淀法去除清蛋白的实验研究[J]. 临床检验杂志, 2011(1): 16-18. DOI:10.13602/j.cnki.jcls.2011.01.007.
[35] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 合格评定 化学分析方法确认和验证指南: GB/T 27417—2017[S]. 北京: 中国标准出版社, 2017: 7-8.