鸡肉肉质鲜美,脂肪含量低,蛋白质含量高,口感细腻,因此一直受到消费者的喜爱[1]。目前,鸡肉的营销以冷鲜鸡肉为主。冷鲜鸡肉指的是在0~4 ℃条件下贮藏和销售的鸡肉。但是,由于处理温度相对较低,且蛋白质含量高,因此鸡肉极易受到一些食源性致病菌和食源性条件致病菌污染,从而导致鸡肉腐败变质[2]。金黄色葡萄球菌作为革兰氏阳性食源性病原菌之一,可引起人和动物受伤部位的感染,引发心血管发炎和肺炎[3-4]。同时,奶酪、牛肉、鸡肉、鱼类等高蛋白食品易受到金黄色葡萄球菌的污染[5-7]。生物膜是细菌污染食品的另外一种方式。一方面,生物膜的胞外会有许多大分子物质聚集,形成一层胞外基质。胞外基质的存在会对细菌起到保护作用,增强细菌对外界环境的抵抗能力,增加灭菌难度[8]。 另一方面,食品、食品加工设备以及一些隐蔽处会增大形成生物膜的的风险,从而导致食品的交叉污染[9-10]。 因此,鉴于金黄色葡萄球菌游离细胞和生物膜细胞的危害,开发高效的杀菌技术抑制金黄色葡萄球菌游离细胞和生物膜细胞的生长就显得尤其重要。
近年来,超声(ultrasound,US)杀菌技术受到广泛关注。然而,当单独使用US杀菌时,并没有显示出对食源性致病菌有较强杀菌作用,且杀菌效率较低[11]。因此,许多研究者将US协同灭菌作为提高灭菌效率的替代方法。Guo Liping等[12]报道US和次氯酸钠联合处理对灭活大肠杆菌具有协同作用。许愈等[13]报道,US联合酸性电解水可以提高对副溶血性弧菌的杀菌效率。热杀菌是一种传统的杀菌技术,在食品工业中得到广泛应用。在72 ℃条件下处理20 min或在82 ℃条件下处理5 min,可有效减少杏仁表面食源性致病菌的数量[14]。然而,较高的温度可能会损害食品的营养成分和感官质量。因此,寻找一种既能灭活食品中的微生物,又能保证食品质量不受损害的方法具有重要意义。Li Jiao等[15]报道,US与加热相结合可以缩短灭菌时间并降低灭菌温度。
本研究确定热处理(heat,HT)、US、US结合HT(UH)对金黄色葡萄球菌游离细胞和生物膜细胞的杀菌效果,研究UH的抗菌和抗生物膜机制。
1 材料与方法
1.1 材料与试剂
金黄色葡萄球菌(Staphylococcus aureus)菌株,由课题组从鸡肉中分离并保存。
BHI脑心浸液肉汤、BHI脑心浸液固体培养基 青岛海博生物科技有限公司;Nunc™ Lab-TekTM 8 孔腔室盖玻片系统、LIVE/DEAD BacLightTM试剂盒 美国赛默飞世尔科技公司;24 孔聚氯乙烯培养板 美国康宁 公司;增强型ATP检测试剂盒 上海碧云天生物技术有限公司;氯化钠 国药集团化学试剂有限公司。
1.2 仪器与设备
KQ-800KD超声清洗机 中国昆山超声仪器有限公司; Centrifuge 5810R离心机、Centrifuge 5424R离心机 德国 Eppendorf公司;Gen5全波长酶标仪 美国伯腾仪器有限公司;Ultra View VOX转盘式激光共聚焦扫描显微镜(confocal laser scanning microscope,CLSM) 美国珀金埃尔默股份有限公司;EVO-LS10扫描电子显微镜(scanning electron microscope,SEM) 德国卡尔蔡司股份公司。
1.3 方法1.3.1 菌株的培养
将从-80 ℃冰箱取出的金黄色葡萄球菌菌液解冻,然后用接种环蘸取菌液,在BHI固体平板上划线,并在37 ℃条件下培养24 h,挑取单菌落放置于5 mL的BHI脑心浸液肉汤试管中,37 ℃条件下,200 r/min培养12 h,进入对数期,浓度约为109 CFU/mL,连续转接2 次后备用[13]。
1.3.2 US、HT、UH处理
HT、US、UH处理金黄色葡萄球菌游离细胞和生物膜细胞。通过恒温水浴锅进行HT处理,温度分别为50、60、70 ℃(HT50、HT60、HT70组),加热时间分别为5、10、20、30、60 min。在超声波清洗机(50 kHz、400 W)进行US和UH处理,处理温度分别为50、60、70 ℃(UH50、UH60、UH70组),处理时间分别为5、10、20、30、60 min。未经任何处理的金黄色葡萄球菌游离细胞和生物膜细胞在室温下放置5、10、20、30、60 min作为空白对照。
1.3.3 金黄色葡萄球菌游离细胞的灭菌处理
将对数期的金黄色葡萄球菌菌液1 mL收集至离心管中,在4 ℃条件下,5 000 r/min离心10 min,去除培养基,并用0.85 g/100 mL生理盐水洗涤菌泥3 次,然后注入5 mL 0.85 g/100 mL生理盐水,制备成菌悬液(约 109 CFU/mL)。将金黄色葡萄球菌菌悬液用US、HT50、HT60、HT70、UH50、UH60、UH70分别处理5、10、20、30、60 min。最后,用0.85 g/100 mL生理盐水连续10 倍梯度稀释菌悬液,选取合适稀释梯度的菌悬液1 mL,加入平板,并加入BHI固体培养基,待培养基凝固后放入37 ℃条件下培养24 h,进行菌落计数[13,16]。
1.3.4 金黄色葡萄球菌生物膜细胞的灭菌处理
将1 mL浓度约为107 CFU/mL金黄色葡萄球菌菌液添加到24 孔聚氯乙烯培养板的每个孔中,并在37 ℃条件下培养72 h,每24 h更换培养基。培养72 h后得到生物膜细胞,吸出培养基,并用0.01 mol/L磷酸盐缓冲液(phosphate buffer saline,PBS)(pH 7.4)清洗生物膜3 次,最后向每个孔中添加1 mL 0.01 mol/L PBS,制备生物膜细胞悬液(约109 CFU/mL)。用US、HT50、HT60、HT70、UH50、UH60、UH70处理生物膜细胞悬液,处理时间分别为5、10、20、30、60 min。经不同处理后,将生物膜溶液收集至装有9 mL 0.01 mol/L PBS的试管中,用已灭菌的棉签刮擦孔壁和底部,并将棉签一起放入试管中。按照1.3.3节方法对生物膜中细胞计数。
1.3.5 SEM和CLSM观察细胞形态
用US、HT70和UH70处理金黄色葡萄球菌游离细胞和生物膜细胞30 min,此外,未经任何处理并置于室温下30 min的金黄色葡萄球菌游离细胞和生物膜细胞用作空白对照。
参考Liu Fang等[16]的方法。游离细胞SEM观察:将处理和未经处理的菌悬液在5 000×g、4 ℃条件下离心10 min,并留下菌泥,然后,将菌泥用体积分数2.5%戊二醛在4 ℃条件下固定12 h,通过SEM观察游离细胞形态;生物膜细胞SEM观察:将浓度约107 CFU/mL的未经处理金黄色葡萄球菌菌液(400 µL)添加到8 孔室载玻片的每个孔中,并根据1.3.4节方法进行生物膜培养,经过不同处理后,将8 孔室载玻片割成小方块,并用体积分数2.5%戊二醛在4 ℃条件下固定12 h,通过SEM观察生物膜细胞形态。
参考Liu Fang等[16]的方法。游离细胞CLSM观察:将处理和未经处理的菌悬液在5 000×g、4 ℃条件下离心10 min,使用LIVE/DEAD BacLightTM试剂盒染色30 min,通过CLSM观察游离细胞形态;生物膜细胞CLSM观察:采用SEM分析中的方法培养生物膜,将经不同处理后的生物膜用LIVE/DEAD BacLightTM试剂盒染色30 min,然后去除隔板,在CLSM下观察生物膜细胞形态。
1.3.6 金黄色葡萄球菌生物膜中胞外多糖含量测定
参考Liu Fang等[16]的方法进行测定。用US、HT70和UH70处理金黄色葡萄球菌生物膜30 min,未经任何处理并置于室温下30 min的金黄色葡萄球菌生物膜细胞用作空白对照。将处理和未经处理的生物膜细胞收集到不同试管中,在5 000×g、4 ℃条件下离心30 min,收集上清液测定可溶性多糖含量,收集沉淀物并重悬在10 mL 0.85 g/100 mL NaCl溶液(含体积分数0.22%甲醛)中,用于测定不溶性多糖含量。采用苯酚-硫酸法测定可溶性和不溶性多糖含量。
1.3.7 胞外ATP、核酸、蛋白质含量测定
参考Liu Fang[16]、Guo Mingming[17]等的方法。用US、HT50、HT60、HT70、UH50、UH60和UH70处理金黄色葡萄球菌游离细胞和生物膜细胞30 min,在3 000×g、4 ℃条件下离心10 min,收集上清液,用紫外-可见分光光度计测定上清液在260 nm和280 nm波长处的光密度(OD260 nm、OD280 nm),分别用于表征核酸、蛋白质含量。
参考Liu Fang等[16]的方法进行胞外ATP含量测定。用US、HT50、HT60、HT70、UH50、UH60和UH70处理金黄色葡萄球菌游离细胞和生物膜细胞30 min,在10 000×g、0 ℃条件下离心1 min,取上清液,按照试剂盒步骤进行操作测定胞外ATP含量。
1.3.8 呼吸链脱氢酶活性测定
通过氯化三苯基四氮唑(triphenyl tetrazolium chloride,TTC)实验测定呼吸链脱氢酶的活性[18-19]。用US、HT50、HT60、HT70、UH50、UH60和UH70处理金黄色葡萄球菌游离细胞和生物膜细胞30 min。然后将菌液与2 mL 0.05 mol/L Tris-HCl缓冲液(pH 8.5)、2 mL 0.1 mol/L葡萄糖溶液和2 mL 1 mg/mL TTC溶液混合,并置于37 ℃反应5 h。最后,将样品与5 mL石油醚混合,并提取有机相。用紫外-可见分光光度计测得有机相在490 nm波长处的光密度(OD490 nm)。呼吸链脱氢酶活性与OD490 nm 呈正相关,以OD490 nm分析呼吸链脱氢酶活性变化。
1.4 数据处理
实验中所有样本为3 份,结果表示为平均值±标准差,使用SPSS 26.0软件中的ANOVA分析对照组与实验组之间的显著性差异(P<0.05)。
2 结果与分析
2.1 US、HT和UH处理对金黄色葡萄球菌游离细胞的杀菌效果
由图1可知,在处理5 min时,US、HT50、HT60和HT70组只能使0.13、0.35、0.75、1.37(1g(CFU/mL)) 的金黄色葡萄球菌游离细胞失活,而处理30 min时可使0.31、0.79、5.74、7.21(1g(CFU/mL))的金黄色葡萄球菌游离细胞失活。这表明随着处理时间的延长,金黄色葡萄球菌游离细胞逐渐减少。此外,温和的热处理比超声处理对细菌的灭活更有效。US处理60 min只能使0.35(1g(CFU/mL))的金黄色葡萄球菌游离细胞失活,然而,HT70处理60 min可使 7.23(1g(CFU/mL))的金黄色葡萄球菌游离细胞失活。此外,UH比US或HT单独处理更有效。UH70处理60 min可使得金黄色葡萄球菌游离细胞数量降低到低于检出限(≤1.4(1g(CFU/mL))),而单独的US或HT在本研究中的任何处理时间也达不到相同的处理效果。
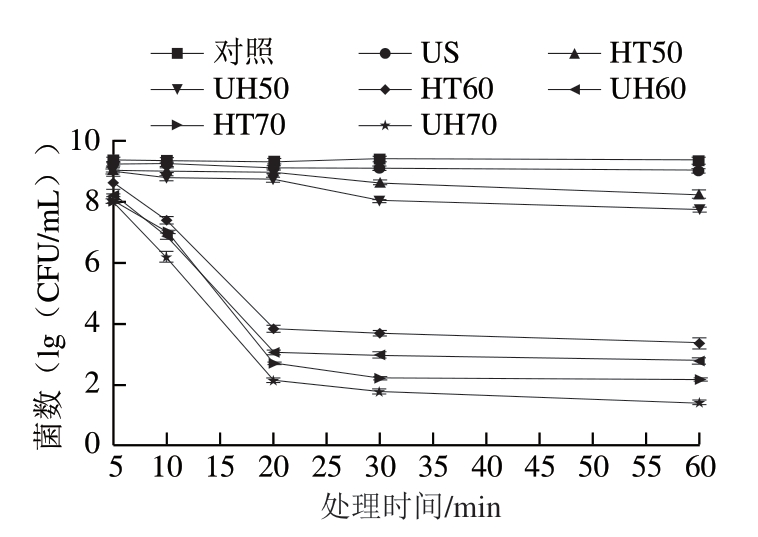
图1 US、HT和UH处理对金黄色葡萄球菌游离细胞的杀菌效果
Fig. 1 Inactivation of Staphylococcus aureus planktonic cells by US, HT and UH
2.2 US、HT和UH处理对金黄色葡萄球菌生物膜细胞的杀菌效果
由图2可知,对照组的金黄色葡萄球菌生物膜细胞数量约为9.40(1g(CFU/mL)),经US、HT50、HT60和HT70处理5 min后,金黄色葡萄球菌生物膜细胞分别减少0.08、0.46、0.87、1.35(1g(CFU/mL)),处理30 min后分别减少0.22、0.65、2.93、5.35(1g(CFU/mL)), 这表明随着处理时间的延长,金黄色葡萄球菌生物膜细胞逐渐减少。此外,金黄色葡萄球菌生物膜细胞经HT70处理60 min后,减少6.10(1g(CFU/mL)),减少量高于US处理60 min,金黄色葡萄球菌生物膜细胞只能减少0.42(1g(CFU/mL))。UH60处理30 min,生物膜细胞数量的减少值大于US和HT60处理30 min的减少值之和。
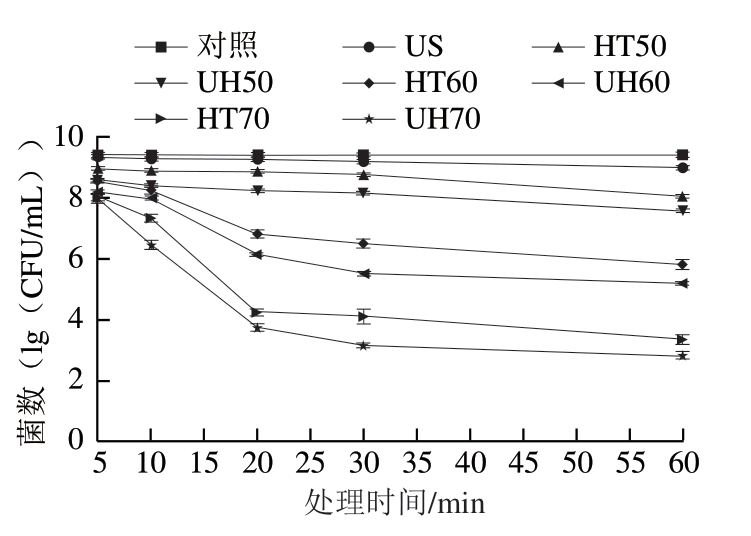
图2 US、HT和UH处理对金黄色葡萄球菌生物膜细胞的杀菌效果
Fig. 2 Inactivation of Staphylococcus aureus biofilm cells by US, HT and UH
2.3 SEM和CLSM观察

用SEM观察金黄色葡萄球菌游离细胞和生物膜细胞,由图3A1~D1、A3~D3可知,对照组的金黄色葡萄球菌游离细胞和生物膜细胞表面完整光滑,无任何孔隙,且生物膜细胞紧密连接在一起,这表明生物膜细胞胞外基质未受到破坏。经US处理30 min后,金黄色葡萄球菌游离细胞和生物膜细胞表面开始出现褶皱,生物膜细胞的胞外基质出现瓦解。而HT70处理30 min后细胞出现萎缩现象,细菌表面开始出现凹陷,生物膜细胞的胞外基质遭到破坏,变得稀疏。UH70处理30 min后,细胞结构受到严重破坏,游离细胞内大分子物质外泄,导致细胞黏连在一起,生物膜细胞基质受到严重破坏,生物膜变得更稀疏。

图3 US、HT70和UH70处理30 min后金黄色葡萄球菌游离细胞和 生物膜细胞的SEM和CLSM图
Fig. 3 SEM and CLSM photographs of Staphylococcus aureus planktonic and biofilm cells after US, HT70 and UH70 treatments for 30 min
A.对照组;B. US组;C. HT70组;D. UH70组;下标1. 游离细胞SEM图;下标2. 游离细胞CLSM图;下标3. 生物膜细胞SEM图;下标4. 生物膜细胞CLSM图。
用CLSM观察金黄色葡萄球菌游离细胞和生物膜细胞,由图3A2~D2、A4~D4可知,对照组金黄色葡萄球菌游离细胞和生物膜细胞发出绿色荧光,这表明所有细菌细胞都是活细胞。经US处理30 min后,少量游离细胞和生物膜细胞被染成红色,这表明US可造成少量细胞的通透性发生改变。经HT70处理30 min后,游离细胞和生物膜细胞被染成红色的比例明显增加,这表明HT70可导致金黄色葡萄球菌游离细胞和生物膜细胞的细胞膜通透性明显增加。UH70处理30 min后,金黄色葡萄球菌游离细胞和生物膜细胞的细胞膜通透性急剧增加,被染成红色的细胞比例明显高于US和HT70处理组。
2.4 金黄色葡萄球菌生物膜胞外多糖含量
由图4可知,对照组金黄色葡萄球菌生物膜胞外可溶性多糖含量与不溶性多糖含量分别为32.93、62.07 μg/mL。 经US、HT70和UH70处理30 min后生物膜胞外可溶性多糖含量变为26.90、18.60、13.61 μg/mL,不溶性多糖含量变为45.90、27.26、21.04 μg/mL。与对照组相比,US、HT70和UH70处理均可导致金黄色葡萄球菌生物膜胞外多糖含量显著减少(P<0.05)。此外,UH处理比单独的US和HT处理能够更有效降低金黄色葡萄球菌生物膜胞外可溶性多糖与不溶性多糖含量。
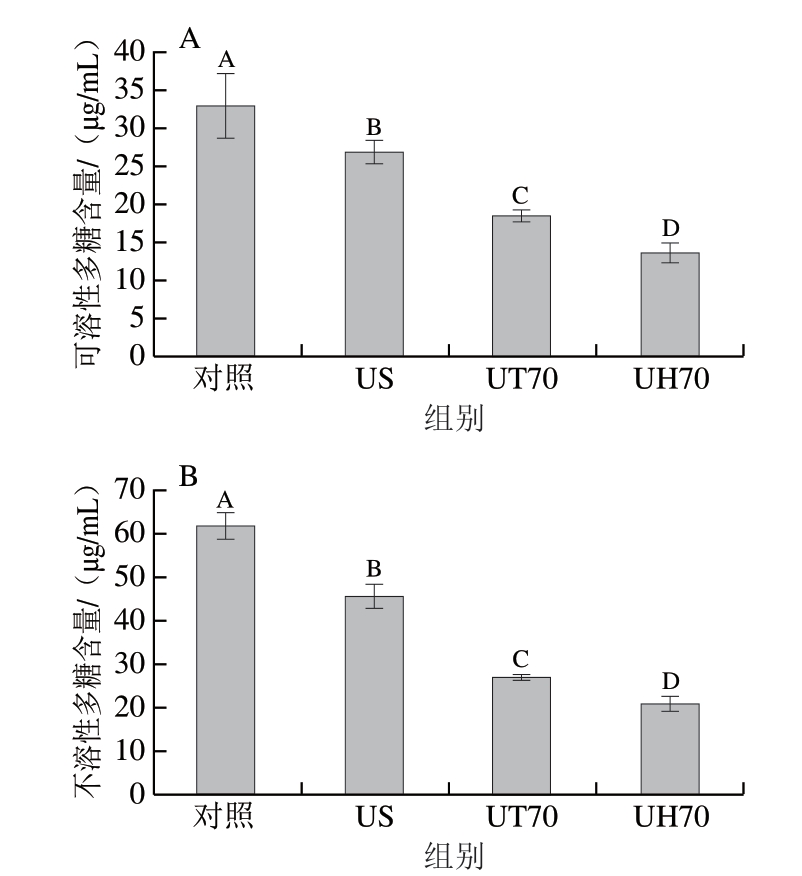
图4 US、HT70和UH70处理30 min后金黄色葡萄球菌生物膜细胞 可溶性多糖(A)与不溶性多糖(B)含量变化
Fig. 4 Changes in contents of soluble (A) and insoluble (B) polysaccharides in Staphylococcus aureus biofilm cells after US, HT70 and UH70 treatments for 30 min
大写字母不同,表示组间差异显著(P<0.05)。图5~6同。
2.5 胞外ATP、核酸、蛋白质含量
由图5A和图5D可知,对照组的金黄色葡萄球菌游离细胞和生物膜细胞的胞外ATP含量分别为6.69、7.26 nmol/mL。经US、HT50、HT60和HT70处理30 min后,游离细胞的胞外ATP含量分别约为44、135、252、284 nmol/mL,生物膜细胞的胞外ATP含量分别约为26、68、91、170 nmol/mL,这表明游离细胞和生物膜细胞的胞外ATP含量随着处理温度的升高而显著增加,且HT比US能更有效地破坏游离细胞和生物膜细胞的细胞膜(P<0.05)。此外,经UH50、UH60和UH70处理30 min后,游离细胞的胞外ATP含量分别约为153、275、377 nmol/mL,生物膜细胞的胞外ATP含量分别约为75、110、201 nmol/mL。这表明与US和HT单独处理相比,UH可以更有效地破坏游离细胞和生物膜细胞的细胞膜,引起胞内ATP泄漏到胞外,从而导致胞外ATP含量显著增加(P<0.05)。
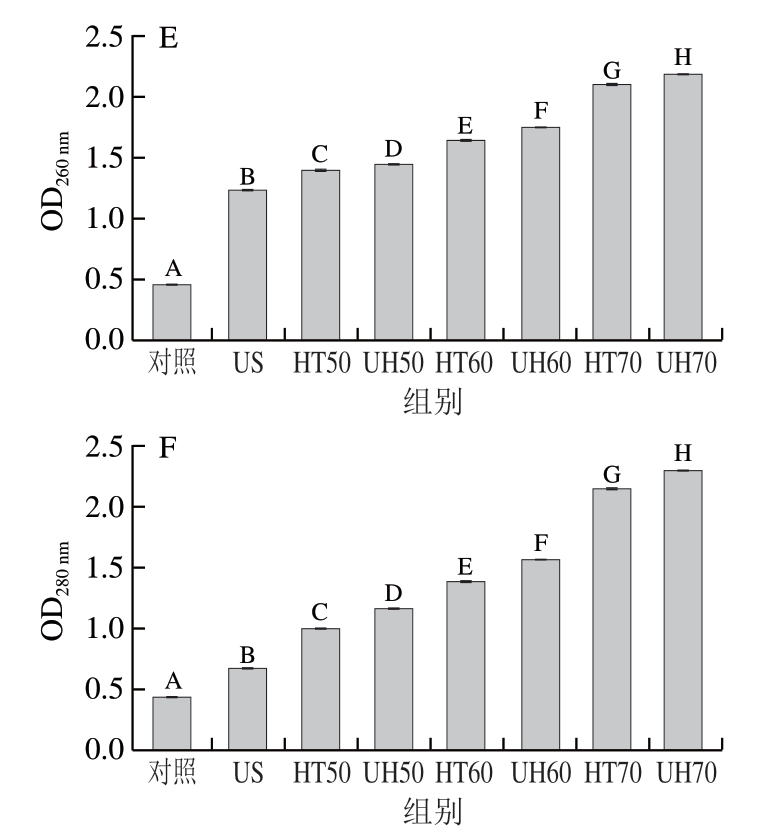
图5 US、HT和UH处理30 min后金黄色葡萄球菌游离细胞和
生物膜细胞的胞外ATP、核酸和蛋白质含量
Fig. 5 Changes in concentrations of extracellular ATP, nucleic acid and protein in Staphylococcus aureus planktonic and biofilm cells after US, HT and UH treatments for 30 min
A~C. 游离细胞;D~F. 生物膜细胞。
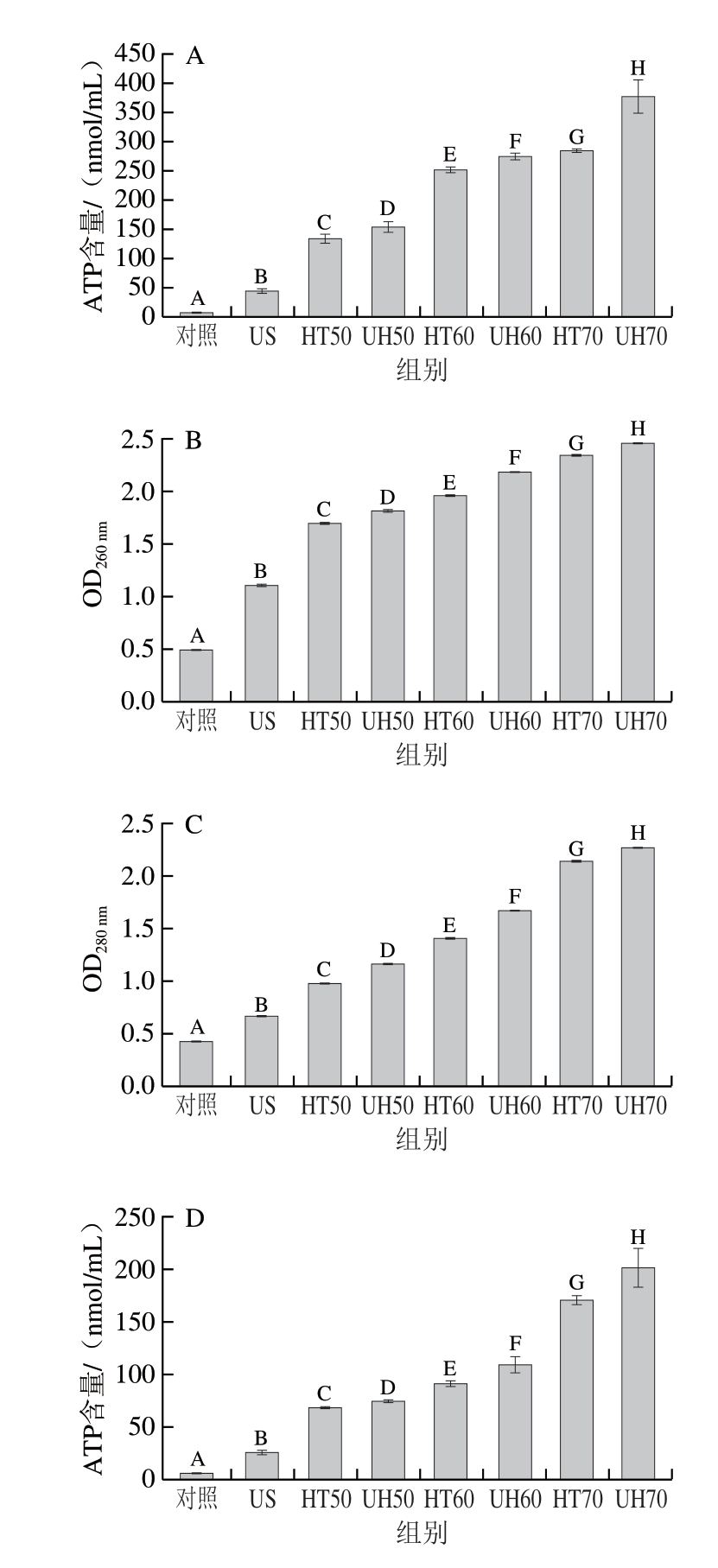
核酸和蛋白质分别在260 nm和280 nm波长处具有最大光密度。与对照组相比,所有处理组均可导致金黄色葡萄球菌游离细胞和生物膜细胞的胞外核酸和蛋白质含量显著增加(P<0.05),但UH处理组的胞外核酸和蛋白质含量显著高于US和HT的单一处理组,这表明UH处理组与US和HT单一处理组相比,可对金黄色葡萄球菌游离细胞和生物膜细胞的细胞膜产生严重损伤。
2.6 金黄色葡萄球菌游离细胞和生物膜细胞呼吸链脱氢酶活性
细菌呼吸链脱氢酶活性降低,意味着细菌的呼吸作用和代谢途径受到抑制。由图6可知,对照组金黄色葡萄球菌游离细胞和生物膜细胞OD490 nm分别为0.463和0.422。经US、HT50、HT60和UH70处理30 min后的游离细胞OD490 nm分别为0.375、0.355、0.274和0.145,生物膜细胞OD490 nm分别为0.371、0.309、0.188和0.128。此外,经UH50、UH60和UH70处理30 min后的游离细胞OD490 nm分别为0.335、0.200和0.099,生物膜细胞OD490 nm分别为0.287、0.158和0.109。这表明,UH处理比US和HT单独处理能够更有效地降低金黄色葡萄球菌游离细胞和生物膜细胞的呼吸链脱氢酶活性。
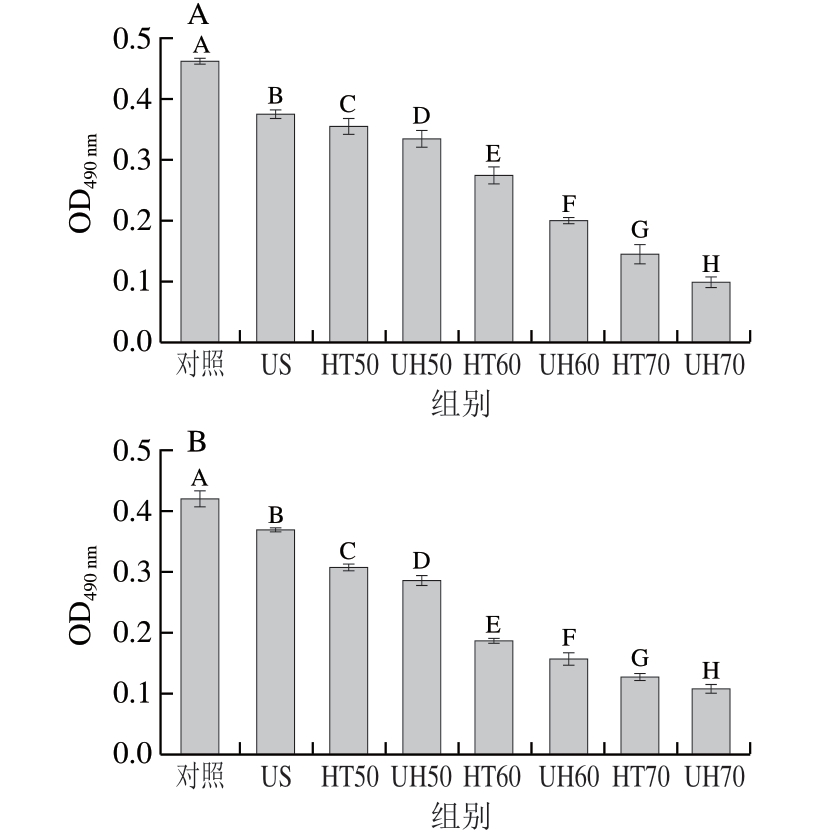
图6 US、HT和UH处理30 min后金黄色葡萄球菌游离细胞(A)和 生物膜细胞(B)的呼吸链脱氢酶活性变化
Fig. 6 Changes in respiratory chain dehydrogenase activity of Staphylococcus aureus planktonic (A) and biofilm cells (B) after US, HT and UH treatments for 30 min
3 讨 论
US和HT联合使用(UH)对金黄色葡萄球菌游离细胞和生物膜细胞具有协同杀菌作用。UH70能灭活金黄色葡萄球菌游离细胞达到无法检测的水平(≤1.4(1g(CFU/mL))), 但单独的US或HT70处理在任何时间都达不到相同的效果。此外,UH70可以在30 min内灭活6.30(1g(CFU/mL)) 金黄色葡萄球菌生物膜细胞,但HT70需要60 min才能达到同样的效果。因此,UH不仅提高了灭菌效率,而且缩短了处理时间。值得注意的是,金黄色葡萄球菌生物膜细胞比游离细胞更难被灭活,这是因为细菌聚集在一起,形成黏附因子,使得菌体细胞聚集在一起,从而增大灭菌的难度[20-21]。Bermúdez-Aguirre等[22]报道,US结合HT处理无害李斯特菌10 min的杀菌效果和单独热处理30 min的杀菌效果一样。Zhu Jinyan等[23]报道,US联合HT对大肠杆菌O157:H7的杀菌效果明显优于单独的US或HT的杀菌效果。Li Jiao等[11]报道,US联合55 ℃ HT具有明显的协同杀菌作用,二者联合处理的杀菌效果显著高于单独US和55 ℃ HT的杀菌效果。US和HT具有协同杀菌作用,这种协同杀菌作用的产生主要归因于二者单独处理都会产生亚致死损伤细胞,当二者联用时,这部分亚致死损伤细胞会被HT迅速灭活,从而产生协同杀菌作用[24]。 近年来,许多研究还报道了US和化学抑菌剂联合使用具有明显的协同杀菌作用。José等[25]报道,US与40 mg/L 过氧乙酸联合使用可以显著灭活樱桃和番茄上的鼠伤寒沙门氏菌,二者具有明显的协同杀菌作用。Huu等[26] 报道,低频率的US和没食子酸丙酯联合处理可以显著提高杀菌效率。He Qiao等[27]报道,US联合百里香精油纳米乳具有明显的协同杀菌作用,二者联合处理可显著提高对金黄色葡萄球菌的杀菌作用。US和化学抑菌剂的结合具有明显的协同杀菌作用,这种协同作用主要归因于US可以破坏菌体细胞的细胞膜,从而促进抑菌剂更好渗入细胞,破坏菌体细胞的结构[28]。
通过SEM图像可以看出,UH可以严重破坏金黄色葡萄球菌菌体细胞完整性。此外,CLSM图像显示,UH处理后菌体细胞的细胞膜通透性急剧增加,从而导致胞外ATP和核酸、蛋白质含量显著增加[29]。许愈等[13]报道,US联合酸性电解水处理可严重破坏副溶血性弧菌的细胞膜完整性,造成细胞内的蛋白质大量流出至胞外。Guo Liping等[12]报道,US与次氯酸钠联合使用可导致大肠杆菌细胞内K+外泄,并损坏大肠杆菌的细胞膜。Guo Mingming等[17]报道,US联合百里香精油纳米乳可以严重破坏大肠杆菌的细胞膜,造成胞内蛋白和核酸外泄。此外,UH显著降低金黄色葡萄球菌生物膜胞外多糖含量,破坏生物膜的胞外基质。生物膜胞外基质一旦受到破坏,生物膜结构会迅速瓦解,加快菌体的死亡。Liu Fang等[16]报道,苯乳酸与微酸电解水的结合比单一处理能够更有效破坏生物膜的胞外基质,降低生物膜胞外多糖含量,导致菌体死亡。上述结果表明,当细胞膜的通透性和完整性受到破坏时,细胞内的ATP、核酸和蛋白质就会释放出来。尽管单一的US处理不足以使细菌细胞失活,但US能够破坏菌体的细胞膜,从而导致化学抑菌剂或热处理能够更好地灭活细胞。
4 结 论
UH处理能有效增强对金黄色葡萄球菌游离细胞和生物膜细胞的杀菌效果,具有明显的协同杀菌作用。此外,SEM图像显示,UH处理严重破坏了金黄色葡萄球菌游离细胞和生物膜细胞膜的完整性。CLSM图像显示,UH处理能够显著提高金黄色葡萄球菌游离细胞和生物膜细胞膜的通透性,从而导致胞内大分子物质外泄,呼吸链脱氢酶活性降低。因此,US与HT的结合主要通过破坏金黄色葡萄球菌游离细胞和生物膜细胞的细胞膜完整性,引起细胞膜通透性改变,造成ATP、核酸、蛋白质外泄,降低细菌呼吸链脱氢酶活性,来达到协同杀菌的目的。
[1] 胡洋健, 邓绍林, 张馨月, 等. 宰后不同成熟时间处理对白切鸡肉食用品质的改善[J]. 现代食品科技, 2020, 36(11): 170-179. DOI:10.13982/j.mfst.1673-9078.2020.11.0505.
[2] 茹志莹, 陈芷雯, 吴少福, 等. 冰温气调保鲜对鸡肉保鲜的影响[J]. 江西农业大学学报, 2020, 42(6): 1213-1221. DOI:10.13836/j.jjau.2020135.
[3] KANG Jiamu, JIN Wenyuan, WANG Jingfan, et al. Antibacterial and anti-biofilm activities of peppermint essential oil against Staphylococcus aureus[J]. LWT-Food Science and Technology, 2019, 101: 639-645. DOI:10.1016/j.lwt.2018.11.093.
[4] COSTA R S, LINS M O, HYARIC M, et al. In vitro antibacterial effects of Zanthoxylum tingoassuiba root bark extracts and two of its alkaloids against multiresistant Staphylococcus aureus[J]. Revista Brasileira de Farmacognosia, 2016, 27(2): 195-198. DOI:10.1016/j.bjp.2016.11.001.
[5] PREZZI L E, LEE S H I, NUNES V M R, et al. Effect of Lactobacillus rhamnosus on growth of Listeria monocytogenes and Staphylococcus aureus in a probiotic Minas Frescal cheese[J]. Food Microbiology, 2020, 92: 103557. DOI:10.1016/j.fm.2020.103557.
[6] TENDERIS B, YALCM H, SIMSEK A, et al. Impact of sodium lactate, encapsulated or unencapsulated polyphosphates and their combinations on Salmonella typhimurium, Escherichia coliO157:H7 and Staphylococcus aureus growth in cooked ground beef[J]. International Journal of Food Microbiology, 2020, 321: 108560. DOI:10.1016/j.ijfoodmicro.2020.108560.
[7] LI Qiuchun, LI Yang, TANG Yuanyue, et al. Prevalence and characterization of Staphylococcus aureus and Staphylococcus argenteus in chicken from retail markets in China[J]. Food Control, 2019, 96: 158-164. DOI:10.1016/j.foodcont.2018.08.030.
[8] CUI Haiying, ZHANG Chenghui, LI Changzhu, et al. Inhibition mechanism of cardamom essential oil on methicillin-resistant Staphylococcus aureus biofilm[J]. LWT-Food Science and Technology, 2020, 122: 109057. DOI:10.1016/j.lwt.2020.109057.
[9] KIM W J, KIM S H, KANG D H. Thermal and non-thermal treatment effects on Staphylococcus aureus biofilms formed at different temperatures and maturation periods[J]. Food Research International, 2020, 137: 109432. DOI:10.1016/j.foodres.2020.109432.
[10] WANG Huawei, WANG Huhu, LIANG Lijiao, et al. Prevalence, genetic characterization and biofilm formation in vitro of Staphylococcus aureus isolated from raw chicken meat at retail level in Nanjing, China[J]. Food Control, 2018, 86: 11-18. DOI:10.1016/j.foodcont.2017.10.028.
[11] LI Jiao, SUO Yuanjie, LIAO Xinyu, et al. Analysis of Staphylococcus aureus cell viability, sublethal injury and death induced by synergistic combination of ultrasound and mild heat[J]. Ultrasonics Sonochemistry, 2017, 39: 101-110. DOI:10.1016/j.ultsonch.2017.04.019.
[12] GUO Liping, SUN Yongcai, ZHU Yinglian, et al. The antibacterial mechanism of ultrasound in combination with sodium hypochlorite in the control of Escherichia coli[J]. Food Research International, 2019, 129: 108887. DOI:10.1016/j.foodres.2019.1088.
[13] 许愈, 张昭寰, 赵莉, 等. 应用酸性电解水联合超声波杀灭副溶血性弧菌[J]. 上海海洋大学学报, 2020, 29(4): 578-584. DOI:10.12024/jsou.20190402604.
[14] ACUFF J C, WU J, MARIK C, et al. Thermal inactivation of Salmonella, Shiga toxin-producing Escherichia coli, Listeria monocytogenes, and a surrogate (Pediococcus acidilactici) on raisins, apricot halves, and macadamia nuts using vacuum-steam pasteurization[J]. International Journal of Food Microbiology, 2020, 333: 108814. DOI:10.1016/j.ijfoodmicro.2020.108814
[15] LI Jiao, CHENG Huan, LIU Donghong, et al. Inactivation of Bacillus subtilis and quality assurance in Chinese bayberry (Myrica rubra) juice with ultrasound and mild heat[J]. LWT-Food Science and Technology, 2019, 108: 113-119. DOI:10.1016/j.lwt.2019.03.061.
[16] LIU Fang, TANG Chun, WANG Debao, et al. The synergistic effects of phenyllactic acid and slightly acid electrolyzed water to effectively inactivate Klebsiella oxytoca planktonic and biofilm cells[J]. Food Control, 2020, 20: 107804. DOI:10.1016/j.foodcont.2020.107804.
[17] GUO Mingming, ZHANG Lianjiao, HE Qiao, et al. Synergistic antibacterial effects of ultrasound and thyme essential oils nanoemulsion against Escherichia coliO157:H7[J]. Ultrasonics Sonochemistry, 2020, 66: 104988. DOI:10.1016/j.ultsonch.2020.104988.
[18] LIU Xue, CAI Jiaxin, CHEN Haimin, et al. Antibacterial activity and mechanism of linalool against Pseudomonas aeruginosa[J]. Microbial Pathogenesis, 2020, 141: 103980. DOI:10.1016/j.micpath.2020.103980.
[19] 林祎. 声热复合处理对液态乳中致病菌的杀菌效果与理化特性影响研究[D]. 杭州: 浙江大学, 2018: 36.
[20] 杨璐环, 邓一秒, 吴希阳, 等. 阪崎肠杆菌生物膜形成条件及超声波对其去除作用[J]. 食品与发酵工业, 2018, 44(7): 55-62. DOI:10.13995/j.cnki.11-1802/ts.016680.
[21] 张悦, 贺银凤, 顾悦, 等. 高产生物膜乳酸菌抗逆性及其抗氧化特性[J]. 农业工程学报, 2021, 37(6): 282-288. DOI:10.11975/j.issn.1002-6819.2021.06.034.
[22] BERMÚDEZ-AGUIRRE D, CORRADINI M G, MAWSON R, et al. Modeling the inactivation of Listeria innocuain raw whole milk treated under thermo-sonication[J]. Innovative Food Science and Emerging Technologies, 2009, 10(2): 172-178. DOI:10.1016/j.ifset.2008.11.005.
[23] ZHU Jinyan, WANG Yuehua, LI Xinghe, et al. Combined effect of ultrasound, heat, and pressure on Escherichia coliO157:H7, polyphenol oxidase activity, and anthocyanins in blueberry (Vaccinium corymbosum) juice[J]. Ultrasonics Sonochemistry, 2017, 37: 251-259. DOI:10.1016/j.ultsonch.2017.01.017.
[24] 迟媛, 弓敏, 马艳秋, 等. 超声协同次氯酸钠杀灭腐败菌效果与动力学研究[J]. 农业机械学报, 2020, 51(7): 372-381. DOI:10.6041 /j.issn.1000-1298.2020.07.042.
[25] JOSÉ J F B S, VANETTI M C D. Effect of ultrasound and commercial sanitizers in removing natural contaminants and Salmonella enterica typhimurium on cherry tomatoes[J]. Food Control, 2012, 24: 95-99. DOI:10.1016/j.foodcont.2011.09.008.
[26] HUU C N, RAI R, YANG Xu, et al. Synergistic inactivation of bacteria based on a combination of low frequency, low-intensity ultrasound and a food grade antioxidant[J]. Ultrasonics Sonochemistry, 2021, 74: 105567. DOI:10.1016/j.ultsonch.2021.105567.
[27] HE Qiao, ZHANG Lianjiao, SONG Luyao, et al. Inactivation of Staphylococcus aureus using ultrasound in combination with thyme essential oil nanoemulsions and its synergistic mechanism[J]. LWTFood Science and Technology, 2021, 147: 111574. DOI:10.1016/j.lwt.2021.111574.
[28] YU Hang, LIU Yang, YANG Fangwei, et al. Synergistic efficacy of high-intensity ultrasound and chlorine dioxide combination for Staphylococcus aureus biofilm control[J]. Food Control, 2021, 122: 107822. DOI:10.1016/j.foodcont.2020.107822.
[29] HE Qiao, LIU Donghong, ASHOKKUMAR M, et al. Antibacterial mechanism of ultrasound against Escherichia coli: alterations in membrane microstructures and properties[J]. Ultrasonics Sonochemistry, 2021, 73(1): 105509. DOI:10.1016/j.ultsonch.2021.105509.