在我国,鸡肉已经成为仅次于猪肉的第二大消费肉类[1]。2020年数据显示,我国鸡肉消费量较2019年同比增长13.2%[2]。肉鸡行业的迅速发展及肉鸡品种生产效率的提升使鸡胸肉产量显著提高,这满足了消费者不断增长的消费需求,但同时也增加了肉鸡饲养过程中胸肌发育异常的风险,其中有一类发育异常的鸡胸肉被称为木质化鸡胸肉。此类鸡胸肉的感官性状主要体现为出现木质化,触感坚硬,表面可见脊状突起,其加工特性亦受到不良影响,降低了消费者的购买欲望,给肉鸡产业造成巨大的经济损失[3-4]。我国肉鸡生产企业中木质化鸡胸肉的发生率高达61.9%[5-6]。
冷冻贮藏可以降低肉中酶的活性并抑制微生物增殖,在延长肉类保质期方面具有关键作用。冷冻肉是目前肉品国际贸易的主要形式,食品工业和家庭个人对其依赖度也在逐渐增加[7]。但在运输、销售和贮存过程中冷链技术不完善容易引起温度波动,使得肉品反复冻融的现象频繁发生,在此过程中冰晶重结晶和聚集会对肉品品质造成更大的损伤,加速冷冻肉的品质劣变[8],出现营养价值下降[9]、色泽劣变[10]、保水性变差[11]等现象。已有研究表明,肉品的电阻抗特征值能够反映冷冻处理对肉品组织结构的破坏作用[12],但目前关于冻融对木质化鸡胸肉电阻抗特性影响的研究鲜有报道。本研究通过测定冻融过程中木质化鸡胸肉的基本品质指标和阻抗指标变化,并对其品质指标和阻抗指标进行主成分分析(principal component analysis,PCA),同时根据Cole-Cole方程拟合得到阻抗等效参数,探讨冻融对木质化鸡胸肉食用品质和电阻抗的影响。
1 材料与方法
1.1 材料
鸡胸肉由江苏益客食品集团股份有限公司提供,是参考标准常规程序屠宰的45 日龄白羽肉鸡的鸡胸肉。屠宰程序为:电击晕、放血、脱毛、掏膛、预冷(屠宰后20 min于0~4 ℃预冷40 min)、分割。将鸡胸肉和冰袋一起放入0~4 ℃保温箱运回实验室。
按照表1所示的分级标准对木质化鸡胸肉进行人工触诊分级,除了正常鸡胸肉之外,将不同木质化程度的鸡胸肉分为轻微、中度和严重3 个等级。其中,中度木质化的鸡胸肉由于发生率较高以及加工改造的可能性较大而成为行业的研究热点[5],因此本研究选择中度等级木质化鸡胸肉。
表1 木质化鸡胸肉分级标准
Table 1 Woody breast grading criteria

等级 描述正常 鸡胸肉表面细腻平滑,触感非常柔软,拎在手中时两端可以呈现自然下垂的状态轻微 鸡胸肉整体比较柔软,在鸡胸肉顶端可以感觉到轻微的硬度触感中度 鸡胸肉整体都能感觉到硬度触感,但硬度主要集中在鸡胸肉顶端,尾端存在一定程度凸起,但拎在手中时仍有一定的下垂感严重 鸡胸肉硬度明显增大,整体触感坚硬,尾端肉眼可见出现明显凸起,拎在手中无下垂感;鸡胸肉表面出现木质化的纹理和黏性分泌物,有些情况下甚至出现渗血
1.2 仪器与设备
TH2829A电学阻抗测试仪 常州同惠电子股份有限公司;ZKSY-600智能恒温水浴锅 南京科尔仪器有限公司;AUY120电子分析天平 日本Shimadzu公司;温度计 德国Testo AG公司;Origin3-Star pH计 美国Thermo Fisher公司;CR-400色差仪 日本柯尼卡-美能达公司;DW-40L92低温保存箱 青岛海尔特种电器有限公司;NMR PQ001低场核磁共振分析仪 上海纽迈电子有限公司;LM3B数显式肌肉嫩度仪 东北农业 大学;SIM-F124制冰机 日本三洋公司。
1.3 方法
1.3.1 反复冻融处理
将工厂运回的鸡胸肉置于国家肉品质量安全控制工程技术研究中心-20 ℃冻库中冷冻,每隔7 d将1 组冷冻鸡胸肉置于4 ℃条件下人为解冻1 次,解冻期间利用插入式热电偶插至样品中心位置,解冻至中心温度为0 ℃,解冻完成后再置于-20 ℃冰箱冻藏。每组鸡胸肉样品的最大冻融次数设置为3 次,每个处理组取20 块鸡胸肉样品测定各项指标。
1.3.2 鸡胸肉肉色测定
参考张剑等[13]的测定方法并稍作修改,测定之前先将样品表面的结缔组织去除,使用色差仪(光源选择D65)在鸡胸肉骨侧选择3 个点进行亮度值(L*)、红度值(a*)和黄度值(b*)测定,每块鸡胸肉样品取3 次测定结果的平均值,每组鸡胸肉样品的肉色为20 块鸡胸肉样品的平均值。
1.3.3 鸡胸肉pH值测定
在鸡胸肉前部靠近翅根的部位选择3 个间隔1~2 cm的测定点,将pH计测量电极插入鸡胸肉中进行测定,插入深度为2 cm左右,每块鸡胸肉的pH值取3 次测定结果的平均值,每组鸡胸肉样品的pH值为20 块鸡胸肉样品的平均值,保持每块鸡胸肉样品测定位置基本一致。
1.3.4 鸡胸肉剪切力测定
将每块测定过蒸煮损失率的鸡胸肉肉块沿肌纤维方向切出2 份1 cm×1 cm×4 cm的肉条。通过肌肉嫩度仪分3 次切断肉条,取3 次剪切力的平均值为每份肉条的剪切力,取2 份肉条剪切力的平均值为所测鸡胸肉的剪切力,每组鸡胸肉的剪切力为20 块鸡胸肉样品的平均值。
1.3.5 鸡胸肉解冻损失率测定
鸡胸肉解冻损失率按照式(1)计算。每组鸡胸肉的解冻损失率为20 块鸡胸肉样品的平均值。
式中:m0为解冻前鸡胸肉质量/g;m1为解冻后鸡胸肉质量/g。
1.3.6 鸡胸肉蒸煮损失率测定
参考陈天浩[14]的方法并稍作修改。每块鸡胸肉取2 份2 cm×2 cm×4 cm的肉块,质量(20±2) g,在蒸煮前称量并记录质量(m2),将温度计插入鸡胸肉的中间部位,放置在75 ℃水浴中直到鸡胸肉中心温度达到70 ℃,取出沥干水分,待样品冷却之后再次称量并记录质量(m3),每块鸡胸肉取样部位相同。蒸煮损失率按照 式(2)计算。每块鸡胸肉的蒸煮损失率为其2 个肉块蒸煮损失率的平均值,每组鸡胸肉样品的蒸煮损失率为20 块鸡胸肉样品的平均值。
式中:m2为蒸煮前鸡胸肉质量/g;m3为蒸煮后鸡胸肉质量/g。
1.3.7 鸡胸肉加压损失率测定
参考Li Chunbao等[15]的方法并稍作修改。用直径2.532 cm的取样器从厚度1 cm左右的肉片切取肉柱,然后用感量0.000 1 g的天平称量并记录加压前质量(m4),将肉柱放置在铺设18 层滤纸的压力平台上,上层同样放置18 层滤纸,加压到35 kg并保持5 min,加压后再次称量并记录加压后质量(m5)。加压损失率按照式(3)计算。每块鸡胸肉样品的加压损失率取2 个肉柱的平均值,每组鸡胸肉样品的加压损失率取20 块鸡胸肉样品的平均值。
式中:m4为加压前鸡胸肉质量/g;m5为加压后鸡胸肉质量/g。
1.3.8 鸡胸肉低场核磁共振分析
参考王鹏等[16]的方法并稍作修改。鸡胸肉去除脂肪和结缔组织,称取约2 g放置于直径15 mm的核磁管内进行核磁共振,测定其弛豫时间。自旋-自旋弛豫时间T2选择CPMG序列进行测定,参数设置如下:共振频率主频22 MHz,测试室温度32 ℃,共扫描3 200 个回波数,回波时间150 μs,重复间隔时间3 000 ms,模拟增益20,每块鸡胸肉样品重复扫描16 次。
1.3.9 鸡胸肉阻抗测定
阻抗特征值包括阻抗幅值和相位角。参考Damez等[17] 的阻抗测定方法并稍作修改。测定电极采用两排六针式电极(原料是紫铜,长度1.5 cm,电极间距1.5 cm),测试电流方向与鸡胸肉的肌纤维方向垂直,测定位置选择鸡胸肉的龙骨突前部外侧,在0.06~200.00 kHz频率范围内从低到高依次选择15 个频点(0.06、0.08、0.10、0.12、0.15、0.20、0.25、0.40、0.80、1.50、5.00、15.00、50.00、100.00、200.00 kHz),测定每块鸡胸肉在15 个频点处的阻抗特征值,每块鸡胸肉测定6 次,取6 次测定的平均值为每块鸡胸肉的阻抗特征值,每组鸡胸肉样品在每个频点处的阻抗特征值为20 块鸡胸肉样品的平均值。测定后,选择1.50~200.00 kHz频率范围内的阻抗进行参数拟合。
1.4 数据处理
用Matlab R2016b软件通过非线性最小二乘法拟合鸡胸肉的等效阻抗参数。通过SPSS 25.0软件中的方差分析对实验数据采用基于Duncan’s多重比较分析进行显著性检验,显著水平选择0.05,数值表示为平均值±标准差。用SIMCA 14.0软件对品质参数变量和阻抗参数进行PCA。用Origin Pro2021软件绘图,绘制阻抗图时,依据阻抗分析惯例,在水平轴上采用以10为底数的对数刻度,对测试频率进行对数转换。
2 结果与分析
2.1 冻融对木质化鸡胸肉基本品质指标的影响
2.1.1 冻融对木质化鸡胸肉肉色的影响
肉色是消费者判断肉质和新鲜度最直观的依据。由表2可知,冷冻处理使正常鸡胸肉和木质化鸡胸肉L*降低,其中正常鸡胸肉L*随冻融次数增加显著减小 (P<0.05),而冻融次数对木质化鸡胸肉L*影响不显著。很多研究发现,冷冻会导致肉色变暗[18-20],这是因为在多次冻融过程中冰晶发生重组后对肌肉细胞的组织结构造成破坏,水分子向细胞外迁移,细胞内溶质含量升高,光吸收率增加,从而导致冻融多次后鸡胸肉L*降低[20-21]。肌红蛋白是宰后肉及肉制品呈现红色的主要原因[22]。正常鸡胸肉鲜肉组和冻融组a*没有显著性差异,表明冷冻和反复冻融并不会对正常鸡胸肉a*产生显著影响;木质化鸡胸肉a*随着冻融次数增加而减小,冻融2 次时木质化鸡胸肉a*显著低于新鲜肉(P<0.05),可能是由于冰晶对肌纤维造成机械损伤,导致解冻时损失了部分肌红蛋白,并使高铁血红蛋白还原酶活性下降[23]。反复冻融过程中正常鸡胸肉b*随冻融次数增加而显著增大(P<0.05),木质化鸡胸肉b*随冻融次数增加先升高后降低,但整体仍然呈现上升趋势,可能是细胞膜中多不饱和脂肪酸在多次冻融处理时被氧化,其氧化产物自由基和蛋白质中的胺类物质反应生成黄色的色素[19,24],因此表现为鸡胸肉b*增大。相同冻融次数下木质化鸡胸肉L*、a*和b*均始显著终高于正常鸡胸肉(P<0.05),这表明虽然整体上冷冻和反复冻融对木质化鸡胸肉的肉色产生显著影响,但并未减小木质化鸡胸肉与正常鸡胸肉肉色的差异。
表2 不同冻融次数鸡胸肉肉色
Table 2 Color parameters of chicken breast meat with different freezethaw cycles
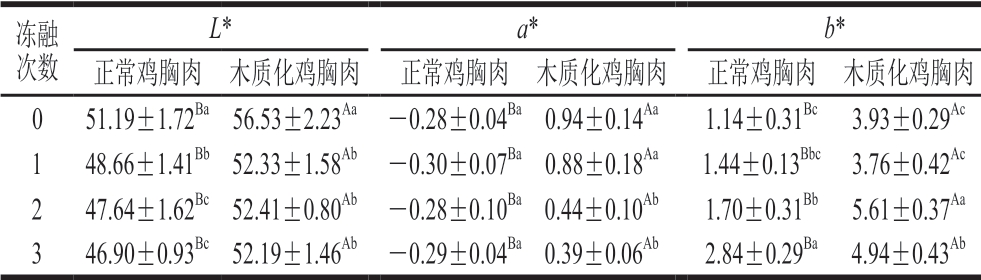
注:同列小写字母不同,表示同组不同冻融次数的鸡胸肉间差异显著(P<0.05);同行大写字母不同,表示冻融次数相同、同一指标组间差异显著(P<0.05)。表3~6同。
冻融次数L* a* b*正常鸡胸肉 木质化鸡胸肉 正常鸡胸肉 木质化鸡胸肉 正常鸡胸肉 木质化鸡胸肉0 51.19±1.72Ba56.53±2.23Aa -0.28±0.04Ba0.94±0.14Aa 1.14±0.31Bc 3.93±0.29Ac 1 48.66±1.41Bb52.33±1.58Ab -0.30±0.07Ba0.88±0.18Aa 1.44±0.13Bbc 3.76±0.42Ac 2 47.64±1.62Bc52.41±0.80Ab -0.28±0.10Ba0.44±0.10Ab 1.70±0.31Bb 5.61±0.37Aa 3 46.90±0.93Bc52.19±1.46Ab -0.29±0.04Ba0.39±0.06Ab 2.84±0.29Ba 4.94±0.43Ab
2.1.2 冻融对木质化鸡胸肉pH值和剪切力的影响
肌肉的pH值对肉的嫩度、持水力和风味等品质指标均有一定影响,可以用来反映肉类品质变化[25]。由表3可知,冷冻和反复冻融过程中正常鸡胸肉的pH值变化没有明显规律性,为5.87~5.95,这表明冷冻对正常鸡胸肉的pH值影响并不显著。和新鲜肉相比,冻融1 次后木质化鸡胸肉的pH值显著增大(P<0.05),而多次冻融后其pH值呈现下降趋势。高亚文等[26]研究反复冻融对大黄鱼品质的影响时发现,多次冻融处理后鱼肉的pH值先增大后减小,和本研究中木质化鸡胸肉的pH值变化趋势相一致。经过1 次冻融处理后木质化鸡胸肉的pH值与新鲜肉相比显著升高(P<0.05),这可能是木质化鸡胸肉肌肉蛋白质或其他含氮化合物分解成胺类等碱性物质所致[27]; 而其pH值在冻融多次后降低,可能是由于冻融次数增加,脂肪氧化程度加重,生成的游离脂肪酸等酸性物质不断积累,最终造成木质化鸡胸肉的pH值下降[28]。
表3 不同冻融次数鸡胸肉pH值和剪切力
Table 3 pH values and shear force of chicken breast meat with different freeze-thaw cycles
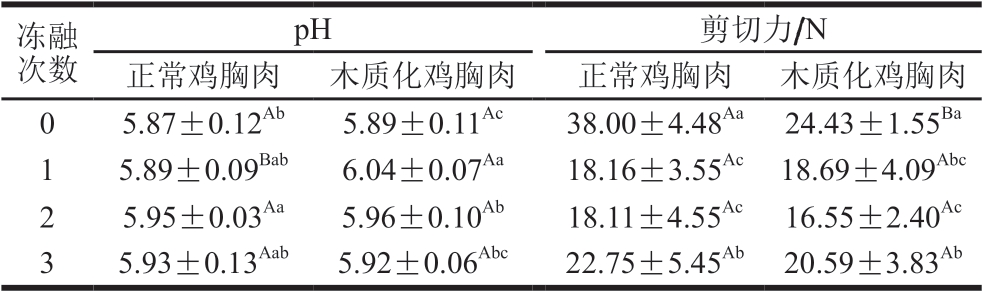
冻融次数pH 剪切力/N正常鸡胸肉 木质化鸡胸肉 正常鸡胸肉 木质化鸡胸肉0 5.87±0.12Ab 5.89±0.11Ac 38.00±4.48Aa 24.43±1.55Ba 1 5.89±0.09Bab 6.04±0.07Aa 18.16±3.55Ac 18.69±4.09Abc 2 5.95±0.03Aa 5.96±0.10Ab 18.11±4.55Ac 16.55±2.40Ac 3 5.93±0.13Aab 5.92±0.06Abc 22.75±5.45Ab 20.59±3.83Ab
剪切力可以直接反映肉品的嫩度,剪切力越小代表肉品的嫩度越高。不同冻融次数木质化鸡胸肉与正常鸡胸肉的剪切力均随冻融次数增加呈现下降趋势,木质化鸡胸肉和正常鸡胸肉在经历1 次冻融后的剪切力均显著低于新鲜肉(P<0.05),反复冻融过程中冰晶的重结晶和聚集会导致部分肌纤维发生断裂,同时,重结晶的冰晶体也对肌肉的细胞膜、细胞器及肉的组织结构造成剪切、撞击等破坏作用,上述因素共同导致反复冻融过程中肌肉的剪切力降低[29];经过3 次冻融处理的木质化鸡胸肉和正常鸡胸肉的剪切力与经过2 次冻融处理时相比显著增大(P<0.05),可能是因为反复冻融过程中重新形成的冰晶体积越来越大,使得肌肉组织在解冻时出现收缩,故而剪切力升高[30]。新鲜正常鸡胸肉的剪切力显著高于木质化鸡胸肉(P<0.05),而在冻融过程中,相同冻融次数下二者无显著性差异,这表明冷冻处理可以减小木质化鸡胸肉和正常鸡胸肉之间的嫩度差异。
2.1.3 冻融对木质化鸡胸肉保水性的影响
肉的保水性会对肉类的口感、滋味、营养及颜色等特性产生直接影响。本研究通过解冻损失率、蒸煮损失率和加压损失率评价冷冻木质化鸡胸肉的保水性。由表4可知,在冷冻和反复冻融过程中,冻融次数越多,木质化鸡胸肉和正常鸡胸肉的解冻损失率越大(P<0.05)。经历1 次冻融后正常鸡胸肉的蒸煮损失率显著高于新鲜肉(P<0.05),但多次冻融后其蒸煮损失率没有发生显著变化;木质化鸡胸肉经历的冻融次数越多,其蒸煮损失率越大,变化显著(P<0.05)。正常鸡胸肉的加压损失率随冻融次数增加而显著增大(P<0.05);冷冻使得木质化鸡胸肉的加压损失率显著上升(P<0.05),而多次冻融后木质化鸡胸肉的加压损失率没有发生显著变化。上述保水性指标变化表明,冷冻和反复冻融使鸡胸肉保水性下降,鸡肉品质显著降低;木质化的发生降低了鸡胸肉的保水性[31],但反复冻融并未减小木质化鸡胸肉和正常鸡胸肉的保水性差异。韩敏义等[32]研究表明,鸡胸肉的解冻损失率和蒸煮损失率均随着冻融次数的增加而显著上升。孙啸[33]测定不同等级木质化鸡胸肉的蒸煮损失率,结果发现,鸡胸肉发生木质化的程度相同时,经过冷冻处理的鸡胸肉保水性更差,与本研究结果一致。
表4 不同冻融次数鸡胸肉的解冻损失率、蒸煮损失率和加压损失率
Table 4 Thawing loss, cooking loss and pressing loss of chicken breast meat with different freeze-thaw cycles
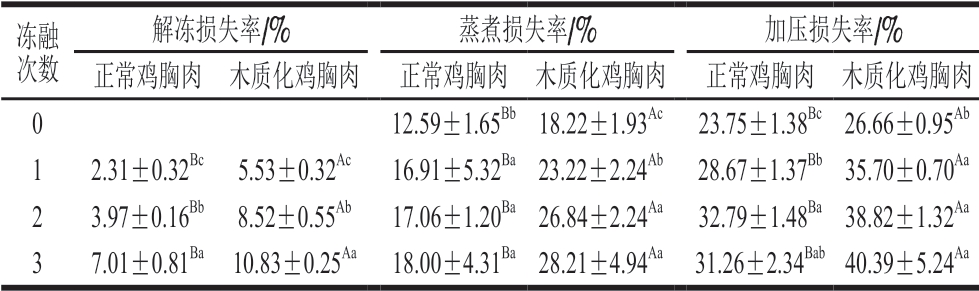
冻融次数解冻损失率/% 蒸煮损失率/% 加压损失率/%正常鸡胸肉 木质化鸡胸肉 正常鸡胸肉 木质化鸡胸肉 正常鸡胸肉 木质化鸡胸肉0 12.59±1.65Bb18.22±1.93Ac 23.75±1.38Bc26.66±0.95Ab 1 2.31±0.32Bc 5.53±0.32Ac 16.91±5.32Ba23.22±2.24Ab 28.67±1.37Bb35.70±0.70Aa 2 3.97±0.16Bb 8.52±0.55Ab 17.06±1.20Ba26.84±2.24Aa 32.79±1.48Ba38.82±1.32Aa 3 7.01±0.81Ba 10.83±0.25Aa 18.00±4.31Ba28.21±4.94Aa 31.26±2.34Bab40.39±5.24Aa
2.2 冻融对木质化鸡胸肉T2弛豫特性的影响
低场核磁共振技术可通过检测氢质子驰豫时间反映鸡胸肉冻融过程中的水分分布和保水性变化。由图1可知,鸡胸肉中存在横向弛豫时间T20(0~1 ms)、T21(1~10 ms)、T22(10~100 ms)和T23(100~1 000 ms)4 个水分群,各自代表强结合水、弱结合水、不易流动水和自由水[34],其中T20和T21表示与大分子结合最紧密且不受外界压力影响的水分群,根据其与大分子结合的牢固程度不同分为2 个峰;T22表示肌纤维和膜之间的水分群;T23表示主要通过毛细管凝结作用存在于细胞外间隙的水分群[35]。正常鸡胸肉和木质化鸡胸肉的T22峰信号强度最大,这表明鸡胸肉中不易流动水的含量最高,且冻融次数越多,总峰面积越小。
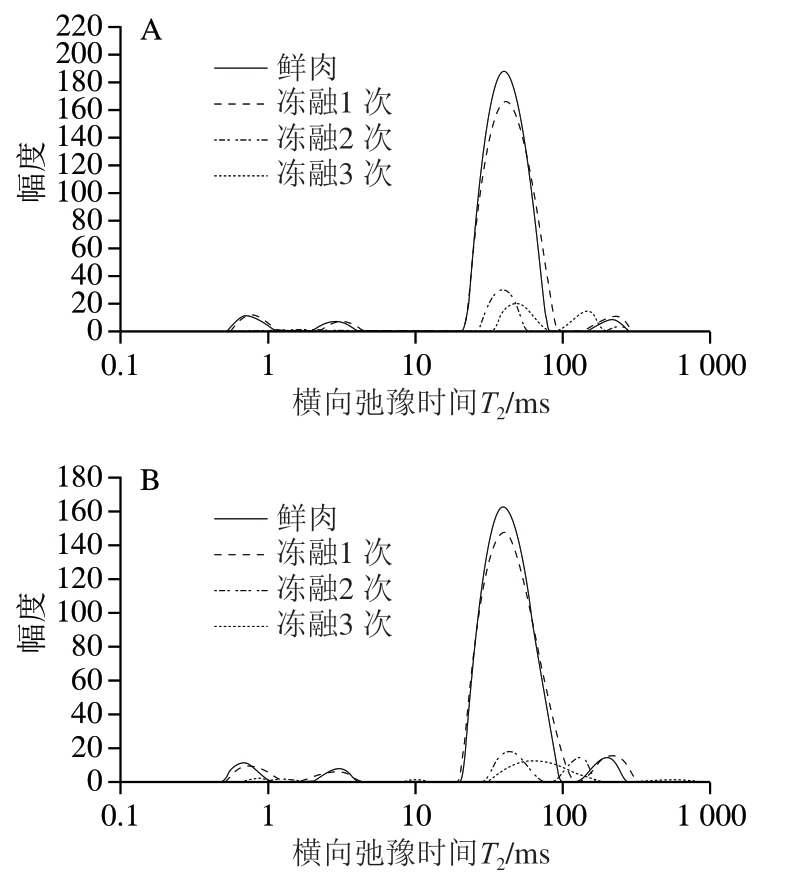
图1 不同冻融次数鸡胸肉横向弛豫时间T2
Fig. 1 Transverse relaxation time (T2) spectra of chicken breast meat with different freeze-thaw cycles
A. 正常鸡胸肉;B. 木质化鸡胸肉。图2~3同。
横向弛豫时间T2对应的峰面积比反映了不同状态水分群的含量比。由表5可知,正常鸡胸肉结合水的峰面积比P20在冻融次数2 次以内未发生显著变化,木质化鸡胸肉结合水的峰面积比P20在冻融次数增加时未发生显著变化,正常鸡胸肉和木质化鸡胸肉不易流动水的峰面积比P22随着冻融次数增加整体呈现降低趋势,正常鸡胸肉和木质化鸡胸肉自由水的峰面积比P23则整体呈现升高趋势,这可能与鸡胸肉冻结时的冰晶生长有关,重结晶过程对三维网状结构和疏水性残基造成破坏,降低了水分结合力,水分自由度上升[36]。
表5 不同冻融次数鸡胸肉T2峰面积比
Table 5 T2 peak area ratio of chicken breast meat with different freezethaw cycles
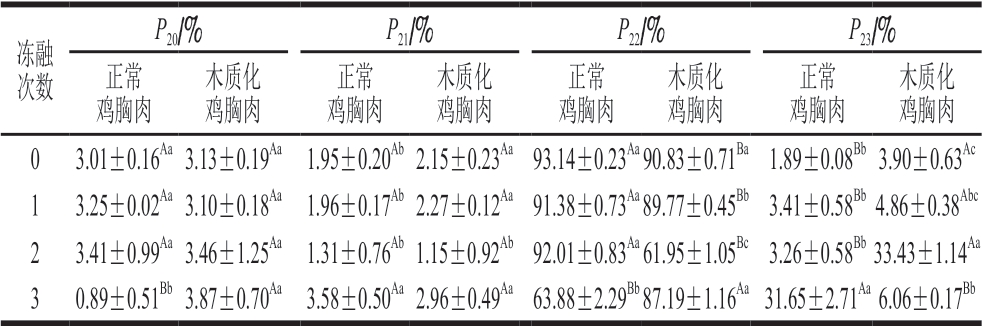
冻融次数P20/% P21/% P22/% P23/%正常鸡胸肉木质化鸡胸肉正常鸡胸肉木质化鸡胸肉正常鸡胸肉木质化鸡胸肉正常鸡胸肉木质化鸡胸肉0 3.01±0.16Aa3.13±0.19Aa 1.95±0.20Ab2.15±0.23Aa93.14±0.23Aa90.83±0.71Ba1.89±0.08Bb3.90±0.63Ac 1 3.25±0.02Aa3.10±0.18Aa 1.96±0.17Ab2.27±0.12Aa91.38±0.73Aa89.77±0.45Bb3.41±0.58Bb4.86±0.38Abc 2 3.41±0.99Aa3.46±1.25Aa 1.31±0.76Ab1.15±0.92Ab92.01±0.83Aa61.95±1.05Bc3.26±0.58Bb33.43±1.14Aa 3 0.89±0.51Bb3.87±0.70Aa 3.58±0.50Aa2.96±0.49Aa63.88±2.29Bb87.19±1.16Aa31.65±2.71Aa6.06±0.17Bb
2.3 冻融对木质化鸡胸肉阻抗特性的影响
2.3.1 冻融对木质化鸡胸肉阻抗幅值的影响
由图2可知,不同冻融次数正常鸡胸肉和木质化鸡胸肉的阻抗幅值均随着检测频率增加呈现逐渐下降的趋势,这一变化趋势体现了生物组织细胞膜的电容特性。新鲜肉的阻抗幅值随着频率升高持续减小,而经过冷冻处理后的正常鸡胸肉和木质化鸡胸肉的阻抗幅值在高于1.50 kHz的频段范围内基本保持恒定状态。这种变化的差异表明,没有经过冷冻处理的鸡胸肉组织细胞膜的电容较高,因此随着电流频率上升,其阻抗幅值持续下降;而冷冻处理后鸡胸肉的组织结构和细胞膜遭到严重破坏,肌肉组织整体的导电性能增加,细胞膜的电阻和电容减小,在较高的频率范围内鸡胸肉组织的容抗趋向恒定。分析不同冻融次数木质化鸡胸肉的阻抗特性发现,在0.06~200.00 kHz整个频段范围内,冻融处理后鸡胸肉的阻抗幅值和新鲜肉相比明显降低,冻融2 次和冻融3 次的处理组之间阻抗幅值并无显著差异,但与冻融1 次的处理组相比明显下降。 李伟明[37]研究发现,未经过冷冻处理的鸡胸肉阻抗幅值在中低频段范围内高于冻融组,其中,低频段范围内经过反复冻融的鸡胸肉阻抗幅值出现显著下降,这和本研究结果相一致。
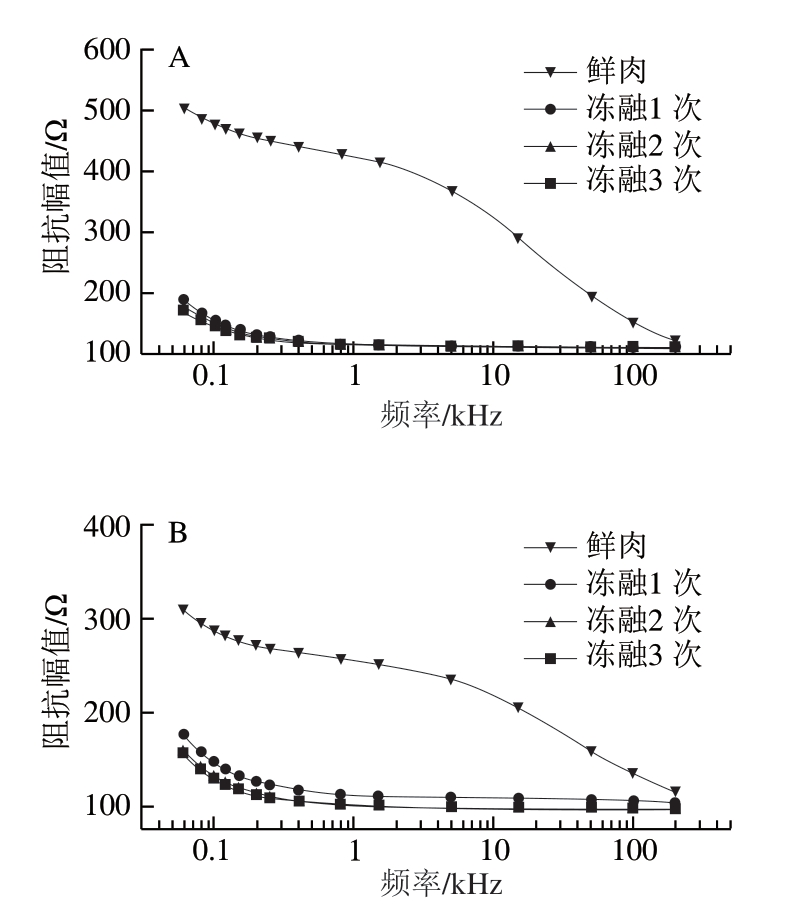
图2 不同冻融次数鸡胸肉阻抗幅值变化
Fig. 2 Changes in impedance amplitude of chicken breast meat with different freeze-thaw cycles
2.3.2 冻融对木质化鸡胸肉相位角的影响
由图3可知,频率较低时冷冻肉的相位角绝对值随着频率的上升出现大幅度降低,频率较高时则趋向于恒定状态;在低频范围内,新鲜肉的相位角绝对值变化趋势与冷冻肉较相似,随着频率上升相位角绝对值逐渐减小,但1.50~200.00 kHz频段出现先增大后减小的波动变化。对正常鸡胸肉而言,在0.06~0.60 kHz低频范围内,新鲜肉的相位角绝对值低于冻融组,在1.50~200.00 kHz频率范围内,新鲜肉的相位角绝对值高于冻融组,冻融1 次和冻融多次组间相位角在0.80~200.00 kHz频率范围内无明显差异。木质化鸡胸肉不同冻融次数处理组间相位角绝对值的变化趋势与正常鸡胸肉基本相同,新鲜木质化鸡胸肉的相位角绝对值在0.06~0.80 kHz的低频范围内低于冻融组,在1.50~200.00 kHz的中高频范围内高于冻融组。在0.06~200.00 kHz整个频段,经过1 次冻融处理与多次冻融处理后,木质化鸡胸肉的相位角并未观察到明显差异,表明反复冻融不会对木质化鸡胸肉的相位角产生明显影响。
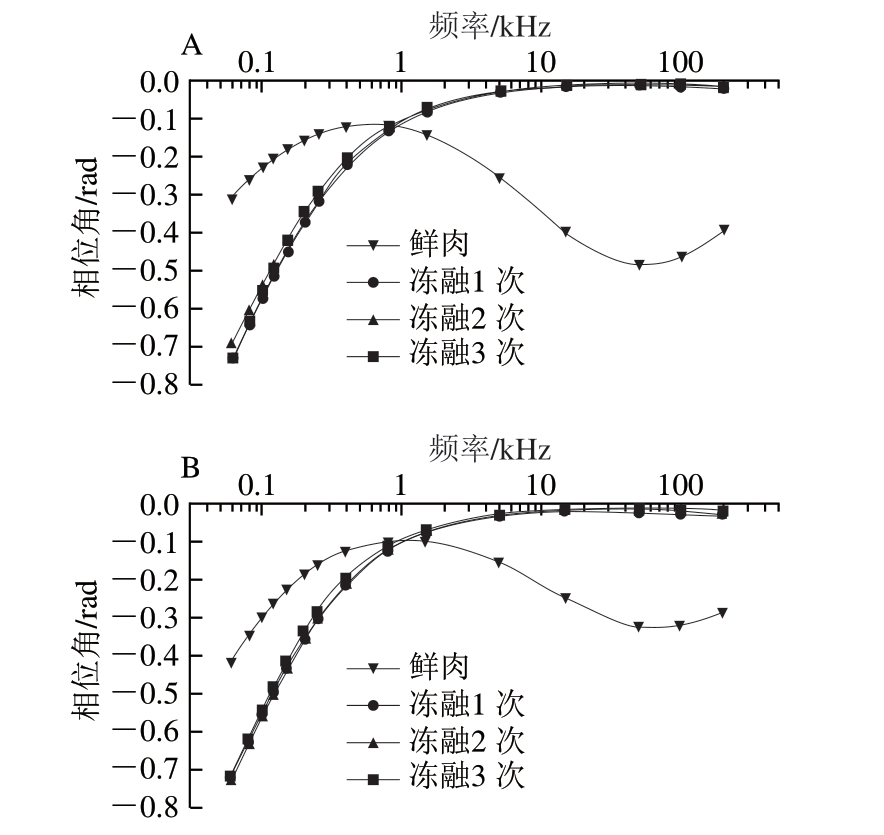
图3 不同冻融次数鸡胸肉的相位角变化
Fig. 3 Changes in phase angle of chicken breast meat with different freeze-thaw cycles
当电场频率较高时,电流可以直接穿透细胞膜,流经整个生物组织,因而可以反映生物组织整体的导电性。没有经过冷冻处理的鸡胸肉组织结构和细胞膜相对比较完整,在较高的频率范围内其容抗比较恒定,所以对其施加的电压与电流之间的相位角始终存在;而经过多次冻融处理的鸡胸肉,尤其是木质化鸡胸肉,一方面反复冻融破坏肌肉的组织结构,另一方面木质化的发生也对细胞膜结构产生不良影响,上述因素共同破坏了细胞膜的电容特性,使鸡胸肉组织整体导电能力上升,由此导致经过冷冻处理的鸡胸肉相位角绝对值在高频段范围内明显低于新鲜肉。
2.3.3 冻融对木质化鸡胸肉阻抗等效参数的影响
由于低频时电极自身可能发生极化现象,产生与细胞结构无关的极化电阻,导致阻抗等效参数的拟合误差相对较大[38],因此本研究选择1.50~200.00 kHz频率范围内的阻抗进行参数拟合。由表6可知,正常鸡胸肉和木质化鸡胸肉的细胞外阻在经过1 次冻融后均显著减小 (P<0.05)。随着冻融次数增加,正常鸡胸肉的细胞膜电容和松弛因子显著减小(P<0.05),特征频率先增大后减小,但整体呈上升趋势。正常鸡胸肉和木质化鸡胸肉未经冷冻处理时的极化系数最大,在经过1 次冻融后均显著减小(P<0.05)。经过冷冻及反复冻融后,正常鸡胸肉和木质化鸡胸肉的细胞内阻以及木质化鸡胸肉的细胞膜电容、松弛因子、特征频率的拟合数据无实际意义,可能是由于冻结过程中机械应力对肌肉组织结构造成严重破坏,生物阻抗的三原件模型不再适用。
表6 不同冻融次数鸡胸肉阻抗等效参数
Table 6 Impedance equivalent parameters calculated for chicken breast meat with different freeze-thaw cycles
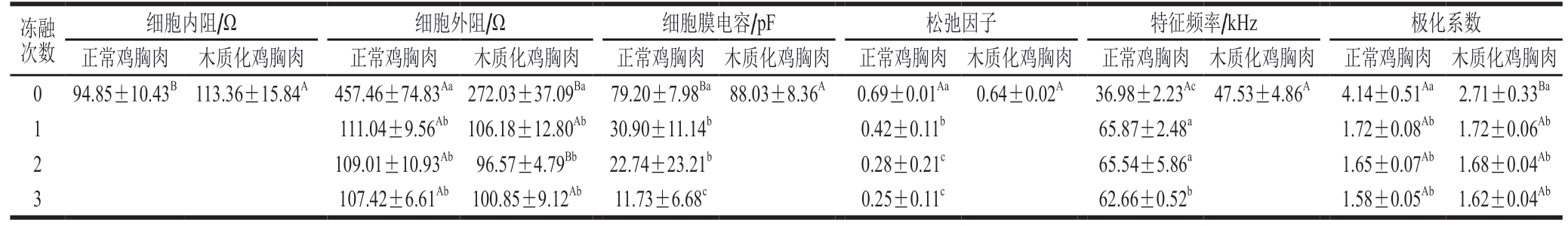
冻融次数细胞内阻/Ω 细胞外阻/Ω 细胞膜电容/pF 松弛因子 特征频率/kHz 极化系数正常鸡胸肉 木质化鸡胸肉 正常鸡胸肉 木质化鸡胸肉 正常鸡胸肉 木质化鸡胸肉 正常鸡胸肉 木质化鸡胸肉 正常鸡胸肉 木质化鸡胸肉 正常鸡胸肉 木质化鸡胸肉0 94.85±10.43B 113.36±15.84A 457.46±74.83Aa272.03±37.09Ba 79.20±7.98Ba88.03±8.36A 0.69±0.01Aa 0.64±0.02A 36.98±2.23Ac47.53±4.86A 4.14±0.51Aa 2.71±0.33Ba 1 111.04±9.56Ab 106.18±12.80Ab 30.90±11.14b 0.42±0.11b 65.87±2.48a 1.72±0.08Ab 1.72±0.06Ab 2 109.01±10.93Ab 96.57±4.79Bb 22.74±23.21b 0.28±0.21c 65.54±5.86a 1.65±0.07Ab 1.68±0.04Ab 3 107.42±6.61Ab 100.85±9.12Ab 11.73±6.68c 0.25±0.11c 62.66±0.52b 1.58±0.05Ab 1.62±0.04Ab
细胞内阻可以反映细胞内液体的导电能力,细胞内离子强度越大,细胞内阻越小,细胞阻抗越小,导电能力越强;细胞外阻可以衡量细胞外液的导电能力大小,细胞外离子强度越大,细胞外阻越小,细胞阻抗越小,导电能力越强[39]。正常鸡胸肉和木质化鸡胸肉的细胞外阻在经过1 次冻融后均显著减小(P<0.05),可能是因为冷冻过程中鸡胸肉肌原纤维被破坏,细胞膜透性增加,细胞内电解质外泄,细胞外导电物质含量增大。细胞膜电容可以表征细胞膜的完整性,细胞膜电容高表示细胞膜完整性好[39]。随着冻融次数增加,正常鸡胸肉的细胞膜电容显著减小(P<0.05),这可能是因为随着冻融次数增加,组织细胞膜破损程度加重,离子通透性加大,其绝缘性减小。松弛因子表征生物组织中大分子的尺寸和构象[40]。随着冻融次数增加,正常鸡胸肉的松弛因子显著减小(P<0.05),这说明冷冻处理使肌肉组织中大分子物质的尺寸和空间构象发生显著变化。特征频率是阻抗虚部达到最大值时对应的频率,每种生物组织都存在特征频率[41]。随着冻融次数增加,正常鸡胸肉的特征频率整体呈上升趋势,表明鸡胸肉阻抗虚部达到最大值时对应的频率点不断向高频处发生移动。极化系数可以反映细胞的生命状态,细胞死亡过程中极化能力减弱,极化系数相应减小,极化系数从最大值减小到单位数值1意味着生物组织的介电结构被完全破坏[41]。正常鸡胸肉和木质化鸡胸肉冻融1 次后极化系数均显著减小 (P<0.05),这表明冻融处理使鸡胸肉肌纤维分解、损伤程度加剧,细胞的生命特征逐渐消失。
2.4 木质化鸡胸肉阻抗指标与品质指标的PCA
对木质化鸡胸肉在0.06~200.00 kHz频率范围内15 个频点处的原始阻抗幅值、相位角、颜色、pH值、剪切力、保水性数据进行PCA多元变量统计分析。 由图4可知,碎石图显示了前2 个主成分PC1和PC2对总体方差的解释情况,PC1和PC2分别解释了总体方差变异的31.43%和1.93%,前2 个主成分能够解释总体方差变异的33.36%,说明原始数据之间存在一定的相关性。
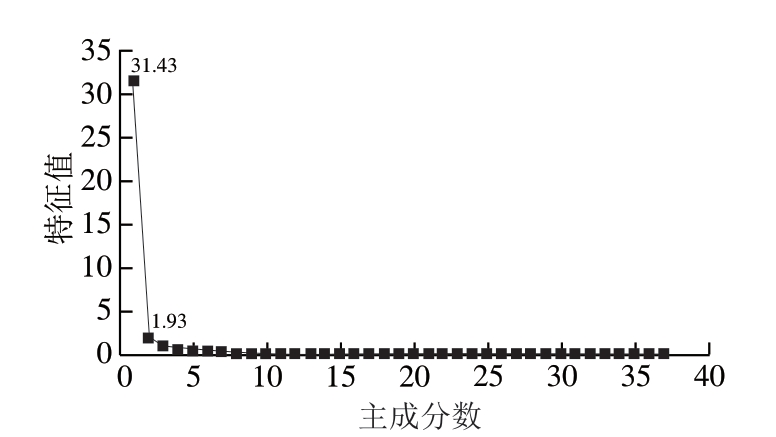
图4 木质化鸡胸肉PCA碎石图
Fig. 4 Scree plot of PCA for woody chicken breast meat
由图5A可知,新鲜肉、冻融1 次和冻融多次木质化鸡胸肉样品区分明显,说明在经过1 次冷冻处理后木质化鸡胸肉的品质和阻抗特性发生明显变化,冻融2 次和冻融3 次样品点比较聚集,说明此阶段变化程度减小。整体上看,随着冻融次数增加,木质化鸡胸肉的阻抗指标和品质指标变化明显。综合载荷图(图5B)分析,随着冻融次数增加,样品点沿PC1方向向左移动是由b*、蒸煮损失率、加压损失率、pH值升高和中高频段相位角变量降低造成的,而新鲜木质化鸡胸肉在PC1方向右方和PC2方向上方主要是因为L*、剪切力、中低频阻抗幅值等指标较高。PC1主要代表中低频段阻抗幅值和相位角、L*及剪切力方面的特性,中低频段阻抗幅值、相位角与L*、剪切力之间具有正相关性,PC2主要代表a*、b*、pH值和蒸煮损失率方面的特性。
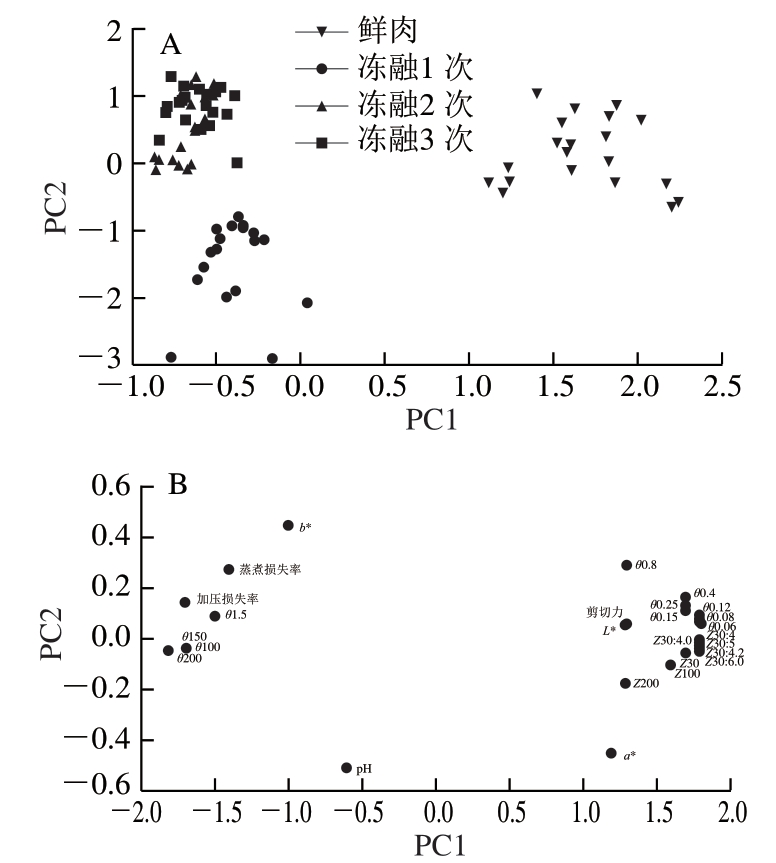
图5 不同冻融次数木质化鸡胸肉各指标的PCA
Fig. 5 PCA score and loading plots for impedance equivalent parameters and quality indicators of woody chicken breast meat with different freeze-thaw cycles
A. PCA得分图;B. 载荷图,Z100代表木质化鸡胸肉在100 kHz处的阻抗幅值,θ1.5代表木质化鸡胸肉在1.5 kHz处的相位角,其他同。
利用PCA对不同冻融次数木质化鸡胸肉原始阻抗数据和品质数据进行降维处理后,可以明显区分新鲜肉、冻融1 次和冻融多次的木质化鸡胸肉,但经过多次冻融的木质化鸡胸肉间存在较大重叠。综合各个变量在主成分载荷图中的分布特点可看出,中低频段的阻抗幅值和相位角与L*和剪切力呈现正相关关系,阻抗参数与不同冻融次数木质化鸡胸肉品质参数有一定的相关性。鸡胸肉木质化的发生和多次冻融处理均会严重影响冷冻肉的品质及阻抗特性。
3 结 论
本研究对冻融过程中木质化鸡胸肉的食用品质和电阻抗特性变化进行研究,结果表明:反复冻融后木质化鸡胸肉a*下降,b*呈上升趋势,保水性变差,整体品质降低;多次冻融处理后木质化鸡胸肉的阻抗幅值明显降低,鸡胸肉的组织结构和细胞膜遭到严重破坏,阻抗等效参数的拟合值无实际意义;阻抗参数与不同冻融次数木质化鸡胸肉品质参数有一定相关性。
[1] 刘九生. 国际禽肉消费市场需求分析[J]. 中国畜牧业, 2020(10): 42-44. DOI:10.3969/j.issn.2095-2473.2020.10.018.
[2] 农业农村部畜牧兽医局, 全国畜牧总站. 2020年肉鸡产业发展形势及2021年展望[J]. 中国畜牧业, 2021(1): 44-47. DOI:10.3969/j.issn.2095-2473.2021.01.021.
[3] HUANG X, AHN D U. The incidence of muscle abnormalities in broiler breast meat: a review[J]. Korean Journal for Food Science of Animal Resources, 2018, 38(5): 835-850. DOI:10.5851/kosfa.2018.e2.
[4] SOGLIA F, MAZZOIN M, PETRACCI M. Spotlight on avian pathology: current growth-related breast meat abnormalities in broilers[J]. Avian Pathology, 2019, 48(1): 1-3. DOI:10.1080/03079457. 2018.1508821.
[5] XING Tong, ZHAO Xue, ZHANG L, et al. Characteristics and incidence of broiler chicken wooden breast meat under commercial conditions in China[J]. Poultry Science, 2020, 99(1): 620-628. DOI:10.3382/ps/pez560.
[6] 韩浩月, VIVEK K. 减少肉鸡产生木质性胸肌和白色条纹肉的日粮手段[J]. 国外畜牧学(猪与禽), 2018, 38(4): 17-20. DOI:10.3969/j.issn.1001-0769.2018.04.007.
[7] 陈清敏. 反复冻融牛肉品质变化评价技术的适用性研究[D]. 无锡: 江南大学, 2020: 1. DOI:10.27169/d.cnki.gwqgu.2020.001044.
[8] JIANG Qingqing, NAKAZAWA N, HU Yaqin, et al. Changes in quality properties and tissue histology of lightly salted tuna meat subjected to multiple freeze-thaw cycles[J]. Food Chemistry, 2019, 293: 178-186. DOI:10.1016/j.foodchem.2019.04.091.
[9] MOHAMMED H H H, HE L, NAWAZ A, et al. Effect of frozen and refrozen storage of beef and chicken meats on inoculated microorganisms and meat quality[J]. Meat Science, 2021, 175: 108453. DOI:10.1016/j.meatsci.2021.108453.
[10] WANG Yao, LIANG Hong, XU Ruying, et al. Effects of temperature fluctuations on the meat quality and muscle microstructure of frozen beef[J]. International Journal of Refrigeration, 2020, 116: 1-8. DOI:10.1016/j.ijrefrig.2019.12.025.
[11] 李婉竹, 梁琪, 张炎, 等. 不同冻融次数下牦牛肉蛋白质氧化与保水性的关系[J]. 食品科学, 2018, 39(2): 14-19. DOI:10.7506/spkx1002-6630-201802003.
[12] EGELANDSDAL B, ABIE S M, BJARNADOTTIR S, et al. Detectability of the degree of freeze damage in meat depends on analytic-tool selection[J]. Meat Science, 2019, 152: 8-19. DOI:10.1016/j.meatsci.2019.02.002.
[13] 张剑, 曹婧, 耿爱莲, 等. 冷藏条件下鸡胸肉新鲜度变化规律及分级研究[J]. 中国家禽, 2020, 42(11): 66-71. DOI:10.16372/j.issn.1004-6364.2020.11.013.
[14] 陈天浩. 冷鲜鸡胸肉与解冻鸡胸肉的阻抗法判别研究[D]. 南京: 南京农业大学, 2016: 24.
[15] LI Chunbao, LIU Dengyong, ZHOU Guanghong, et al. Meat quality and cooking attributes of thawed pork with different low field NMR T21[J]. Meat Science, 2012, 92(2): 79-83. DOI:10.1016/j.meatsci.2011.11.015.
[16] 王鹏, 陈林, 徐幸莲, 等. 喷淋通风宰前静养对肉鸡夏季运输屠宰肉品质的影响(英文)[J]. 农业工程学报, 2018, 34(22): 275-281.
[17] DAMEZ J, CLERJON S, ABOUELKARAM S, et al. Beef meat electrical impedance spectroscopy and anisotropy sensing for non-invasive early assessment of meat ageing[J]. Journal of Food Engineering, 2008, 85(1): 116-122. DOI:10.1016/j.jfoodeng.2007.07.026.
[18] 王芳芳, 张一敏, 罗欣, 等. 冷冻解冻对生鲜肉品质的影响及其新技术研究进展[J]. 食品科学, 2020, 41(11): 295-302. DOI:10.7506/spkx1002-6630-20190515-164.
[19] CHENG Shasha, WANG Xiaohui, LI Ranran, et al. Influence of multiple freeze-thaw cycles on quality characteristics of beef semimembranous muscle: with emphasis on water status and distribution by LF-NMR and MRI[J]. Meat Science, 2019, 147: 44-52. DOI:10.1016/j.meatsci.2018.08.020.
[20] QI Jun, LI Chunbao, CHEN Yinji, et al. Changes in meat quality of ovine Longissimus dorsi muscle in response to repeated freeze and thaw[J]. Meat Science, 2012, 92(4): 619-626. DOI:10.1016/j.meatsci.2012.06.009.
[21] AROEIRA C N, TORRES F R A, FONTES P R, et al. Freezing, thawing and aging effects on beef tenderness from Bos indicus and Bos taurus cattle[J]. Meat Science, 2016, 116: 118-125. DOI:10.1016/j.meatsci.2016.02.006.
[22] 黄卉, 孙申宇, 魏涯, 等. 红色肉贮藏期间肌红蛋白与肉色变化研究进展[J]. 南方水产科学, 2020, 16(3): 119-124. DOI:10.12131/20190170.
[23] COOMBS C E O, HOLMAN B W B, FRIEND M A, et al. Long-term red meat preservation using chilled and frozen storage combinations: a review[J]. Meat Science, 2017, 125: 84-94. DOI:10.1016/j.meatsci.2016.11.025.
[24] QIAN Shuyi, LI Xia, WANG Hang, et al. Effect of sub-freezing storage (-6, -9 and -12 ℃) on quality and shelf life of beef[J]. International Journal of Food Science and Technology, 2018, 53(9): 2129-2140. DOI:10.1111/ijfs.13800.
[25] RAHMAN M H, HOSSAIN M M, RAHMAN S M E, et al. Evaluation of physicochemical deterioration and lipid oxidation of beef muscle affected by freeze-thaw cycles[J]. Korean Journal for Food Science of Animal Resources, 2015, 35(6): 772-782. DOI:10.5851/kosfa.2015.35.6.772.
[26] 高亚文, 汤海青, 欧昌荣, 等. 基于前表面荧光光谱鉴别新鲜与冻融大黄鱼[J]. 农业工程学报, 2016, 32(16): 279-285. DOI:10.11975/j.issn.1002-6819.2016.16.038.
[27] 李锐, 邹茜, 孙玉林, 等. 紫外诱导克氏原螯虾虾头自溶制备蛋白酶解液及其鲜味物质研究[J]. 食品与发酵工业, 2019, 45(3): 153-160. DOI:10.13995/j.cnki.11-1802/ts.018280.
[28] 李贺强, 邹同华, 宋睿琪, 等. 不同真空解冻条件对猪肉品质的影响[J]. 食品与发酵工业, 2021, 47(4): 130-135. DOI:10.13995/j.cnki.11-1802/ts.025317.
[29] 常海军, 李雪, 许晶冰. 不同冻藏时间对重庆‘城口山地鸡’肉品质的影响[J]. 甘肃农业大学学报, 2018, 53(3): 143-149. DOI:10.13432/j. cnki.jgsau.2018.03.021.
[30] 齐聪, 刘佳, 刘梅, 等. 不同冻藏温度对牛肉品质的影响[J]. 食品科技, 2020, 45(7): 112-118. DOI:10.13684/j.cnki.spkj.2020.07.021.
[31] TIJARE V V, YANG F L, KUTTAPPAN V A, et al. Meat quality of broiler breast fillets with white striping and woody breast muscle myopathies[J]. Poultry Science, 2016, 95(9): 2167-2173. DOI:10.3382/ps/pew129.
[32] 韩敏义, 刘志勤, 刘岳, 等. 反复冻融对鸡肉品质的影响[J]. 江苏农业学报, 2013, 29(1): 167-171. DOI:10.3969/j.issn.1000-4440.2013.01.029.
[33] 孙啸. 木质鸡胸肉肉质分析及无损检测方法研究[D]. 南京: 南京农业大学, 2017: 96-97.
[34] 马莹, 杨菊梅, 王松磊, 等. 基于LF-NMR及成像技术分析牛肉贮藏水分含量变化[J]. 食品工业科技, 2018, 39(2): 278-284. DOI:10.13386/j.issn1002-0306.2018.02.052.
[35] BERTRAM H C, DONSTRUP S, KARLSSON A H, et al. Continuous distribution analysis of T2 relaxation in meat: an approach in the determination of water-holding capacity[J]. Meat Science, 2002, 60(3): 279-285. DOI:10.1016/S0309-1740(01)00134-6.
[36] 郑静静. 冷冻加工对小龙虾品质影响的研究[D]. 合肥: 合肥工业大学, 2020: 25-30. DOI:10.27101/d.cnki.ghfgu.2020.001263.
[37] 李伟明. 冻藏时间和冻融次数对鸡胸肉品质及阻抗特性的影响[D]. 南京: 南京农业大学, 2014: 45-47.
[38] 柏雪. 不同贮藏期猪肉电阻抗频谱特性及其与猪肉品质特性关系研究[D]. 长春: 吉林大学, 2018: 25-28.
[39] 王政纲, 赵丽华, 王德宝, 等. 基于模糊数学与电阻抗的冰温贮藏羊肉僵直成熟进程评价[J]. 食品工业科技, 2020, 41(7): 255-260. DOI:10.13386/j.issn1002-0306.2020.07.042.
[40] 王政纲, 赵丽华, 苏琳, 等. 冰温贮藏羊肉电阻抗特性及肉品质相关性分析[J]. 食品科学, 2019, 40(1): 249-255. DOI:10.7506/spkx1002-6630-20171016-150.
[41] 艳茹. 牛宰后肌肉生物电阻抗特性变化的研究[D]. 呼和浩特: 内蒙古农业大学, 2006: 8-9.