禽肉是我国主要食用肉类之一,广受消费者欢迎[1]。 禽肉营养丰富,味道鲜美,富含蛋白质、脂肪、风味物质等,是人们膳食中不可或缺的重要组成部分[2]。鸡肉在炖煮过程中可释放小肽、游离氨基酸、无机盐、核酸代谢物等物质,赋予鸡汤一定的风味,核酸代谢物是炖肉中与鲜味相关的主要化合物,其中5’-肌苷酸(5’-inosine monophosphate,IMP)对鲜味贡献大[3-4]。核苷酸属于一类有机化合物,由嘌呤碱基或嘧啶碱基、核糖或脱氧核糖以及磷酸3 种物质组成,五碳糖通过β-糖苷键连接,与有机碱合成核苷,核苷与磷酸合成核苷酸,核苷和核苷酸是胞内化合物,参与各种调节和代谢功能[5]。动物宰后短时间内,组织中ATP含量变化较小,随着磷酸肌酸的耗尽及糖原酵解停止,ATP合成反应停止,开始迅速分解。糖原酵解产生的乳酸及ATP降解产生的磷酸,使肌肉pH值下降,肌肉达到极限pH值时,大部分ATP降解为 5’-腺苷酸(5’-adenosine monophosphate,AMP),进而分解生成IMP、无机磷酸和氨,IMP进一步降解生成肌苷(inosine,I)、次黄嘌呤(hypoxanthine,Hx)、磷酸和核糖等[6-7],AMP及其降解产物结构如图1所示。
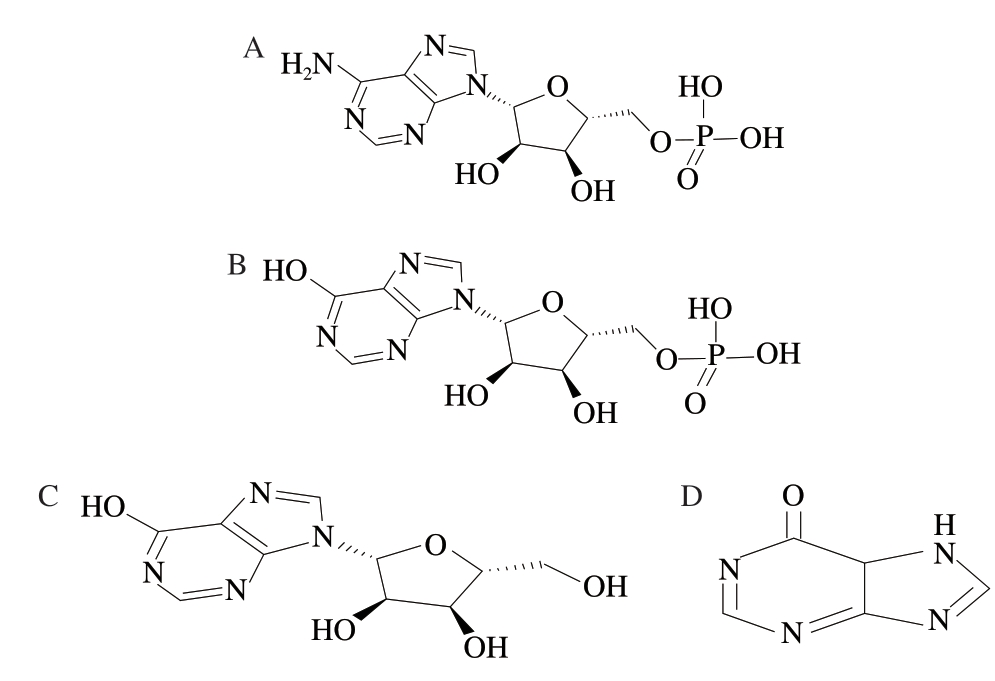
图1 肌苷及其关联物结构式
Fig. 1 Structural formulae of inosine and its related compounds
A. AMP;B. IMP;C. I;D. Hx。
随着生活质量的提高,人们对食品的风味、新鲜程度等指标开始广泛关注。近年来,学者开始关注IMP的鲜味贡献,随着IMP降解产生Hx,赋予苦味“异味”,Hx的检测被用于评估食品工业中鱼类的新鲜度。因此无论是研究风味还是研究新鲜度,AMP的降解产物及其相互关系均为肉质评定的重要指标[8-9]。目前,核苷酸及其关联物的研究多集中在生物性样品(如血液、尿液)[10-14]、 中药[15]、保健品(如人参、鹿茸)[16-17]、食用菌[18-22]、水产品(如中华绒螯蟹[23]、草鱼[24]、对虾[25-26]、梭子蟹[27])等,也有学者研究不同贮藏条件下鸡肉IMP的变化规律[7], 同时测定AMP及其降解产物的研究还鲜有报道。核苷酸及其关联物的研究方法主要有毛细管电泳法[9,12,28]、生物传感器法[8,13]、高效液相色谱法[12,25,27]、高效液相色谱-飞行时间质谱法[15,28]、高效液相色谱-串联质谱法[10-11,14]等,由于鸡肉基质较为复杂,为了同时满足分离度、灵敏度及定量的需求,本研究利用超高效液相色谱-串联质谱开发出一种鸡肉中AMP、IMP、I、Hx的高效、简易的分析方法,为同时测定动物源性食品中多种核苷酸关联物提供思路,为动物源性食品的风味和新鲜度指标研究提供参考。
1 材料与方法
1.1 材料与试剂
鸡肉购自北京市某连锁超市,鸡胸肉及鸡腿肉各200 g,搅碎处理。
IMP(纯度100.0%)、AMP(纯度100.0%)、Hx(纯度99.4%)、乙腈(色谱纯) 上海安谱实验科技股份有限公司;I(纯度98.0%) 上海泰坦科技股份有限公司;甲醇、三氯乙酸、高氯酸(均为优级纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
1290超高效液相色谱-6470串联四极杆质谱仪 美国Agilent公司;S-100涡旋仪、SR-Ⅱw振荡器 日本 Taiyo公司;DT1028H超声波提取仪 德国Bandelin 公司;CR21N离心机 日本Hitachi公司;Milli-Q纯水仪 美国Millipore公司;ABM-2均质机 株式会社日本精机制作所。
1.3 方法
1.3.1 提取
鸡肉经组织研磨仪研磨后,准确称取2 g(精确至0.001 g)于50 mL离心管中,加入10 mL提取溶剂(分别考察体积分数6%高氯酸、体积分数10%甲醇水溶液、3%高氯酸+10%甲醇水溶液和体积分数5%三氯乙酸的提取效果),选用合适的提取方式提取20 min(分别考察匀浆、超声、振荡、添加陶瓷均质子涡旋4 种提取方式的提取效果),以12 000 r/min离心4 min,将上清液转移至另一离心管中,于残渣中再加入10 mL提取溶剂,重复以上步骤,合并2 次提取溶液,用5.0 mol/L及0.5 mol/L NaOH溶液调节pH值(分别考察将pH值调节至4.5、5.0、5.5、6.0时的效果),待净化。
1.3.2 净化
取提取液5 mL至净化柱(分别考察PRIME HLB固相萃取柱、QuEChERS法、MCX柱3 种净化方式的效果),收集净化液于10 mL接收管中,涡旋0.5 min,过0.22 μm滤膜,供超高效液相色谱-质谱测定。
1.3.3 溶液配制
标准储备溶液:分别准确称取固体标准物质AMP、IMP、I、Hx各10 mg,分别置于4 个50 mL烧杯中,Hx先用2 mL 0.5 mol/L硫酸溶液促进溶解,其他物质加适量的一级水溶解,并用一级水转移并定容至100 mL容量瓶中,摇匀,配制成质量浓度为100 µg/mL的单标储备液,4 ℃冰箱中避光保存。
混合标准溶液:分别吸取各单标储备液适量,用一级水配制成各物质质量浓度梯度为50、100、200、500、1 000 ng/mL的混合标准工作溶液。
1.3.4 仪器条件
色谱条件:色谱柱:SB-Aq RRHD柱(3.0 mm× 100 mm,1.8 µm);柱温30 ℃;进样体积2 μL;流动相A:甲酸-水溶液(1∶99,V/V);流动相B:乙腈;流速0.3 mL/min。洗脱梯度见表1。
表1 梯度洗脱程序
Table 1 Gradient elution program
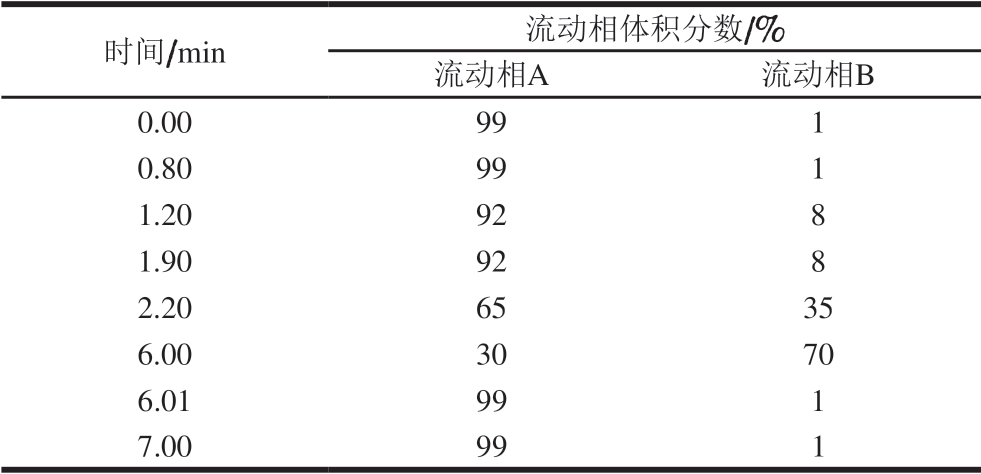
时间/min 流动相体积分数/%流动相A 流动相B 0.00 99 1 0.80 99 1 1.20 92 8 1.90 92 8 2.20 65 35 6.00 30 70 6.01 99 1 7.00 99 1
质谱条件:电喷雾(electrospray ionization,ESI)离子源,正离子模式,毛细管电压2 800 V,干燥气流速11 L/min,喷针气压力241 kPa(35 psi),离子源温度270 ℃,鞘气流速10 L/min,鞘气温度300 ℃,多反应监测模式参数见表2。
表2 4 种化合物质谱多反应监测模式参数
Table 2 Multiple reaction monitoring mode parameters in mass spectroscopy of four compounds
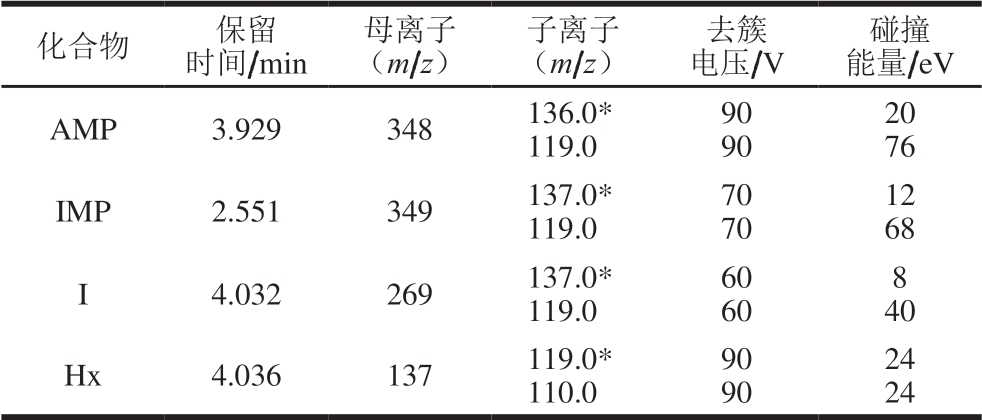
注:*. 定量离子。
化合物 保留时间/min母离子(m/z)子离子(m/z)去簇电压/V碰撞能量/eV AMP 3.929 348 136.0*119.0 90 90 20 76 IMP 2.551 349 137.0*119.0 70 70 12 68 I 4.032 269 137.0*119.0 60 60 8 40 Hx 4.036 137 119.0*110.0 90 90 24 24
1.3.5 结果计算
样品中4 种化合物含量用下式计算。
式中:X为样品中目标化合物含量/(mg/kg);C为由标准工作曲线拟合得到的样品提取液中目标化合物含量/(ng/mL);V为最终定容体积/mL;n为样品处理过程中的稀释倍数;m为样品质量/g。
1.4 数据处理
数据处理采用Microsoft Excel 2017软件;化学结构式采用Chemsketch软件绘制;柱状图采用Originpro 8.5软件绘制。
2 结果与分析
2.1 提取溶剂的选择
作为化合物分析的第1步,选择合适的提取溶剂,将目标物从样品基质中高效、快速地提取出来非常重要[29-30]。 本研究选择体积分数6%高氯酸、体积分数10%甲醇水溶液、3%高氯酸+10%甲醇水溶液和体积分数5%三氯乙酸作为提取溶剂,分别考察4 种溶剂的提取效果。由于样品基质本身含有目标化合物,采用基质曲线,以排除基质中所含目标物对实验结果造成的影响。
对比使用不同提取溶剂、加标量为100 ng/mL时的加标回收率。由图2可知,用10%甲醇水溶液作提取溶剂时,IMP、I和Hx的加标回收率都在90%以上,但AMP没有响应,这可能是由于AMP含有氨基,需要提供更多的H+使其发生电离。另外3 种提取溶剂中,使用3%高氯 酸+10%甲醇水溶液时,4 种目标化合物的加标回收率都在85%左右,最高达到88%。使用6%高氯酸和5%三氯乙酸时,4 种目标化合物的加标回收率均不到80%,因此选用3%高氯酸+10%甲醇水溶液作提取溶剂。
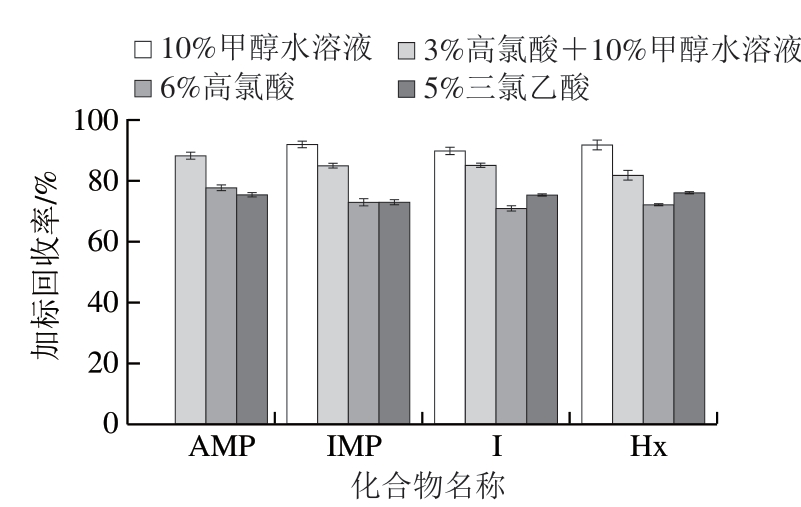
图2 不同提取溶剂对加标回收率的影响(n=3)
Fig. 2 Effect of extraction solvents on spiked recoveries (n = 3)
2.2 提取方式的选择
鸡肉中脂肪和蛋白质的含量都很高,在提取过程中对化合物的提取效率会有一定影响。选择合适的提取方式,减小基质对于化合物的干扰很有必要。本研究考察常见的4 种提取方式:12 000 r/min转速下匀浆5 min、超声波提取仪中超声20 min、振荡器振荡30 min、添加陶瓷均质子涡旋20 min,由于样品基质本身含有目标化合物,采用基质曲线,以排除基质中所含目标物对实验结果造成的影响。
对比不同提取方式、加标量为100 ng/mL时的加标回收率。由图3可知,通过匀浆提取的效果最差,加标回收率为75%左右,且相对标准偏差较大,接近2%。通过振荡提取的加标回收率为80%左右,通过超声提取的加标回收率为85%左右,振荡和超声提取的相对标准偏差均约为1%。添加匀浆均质子涡旋的提取效果最好,加标回收率为90%以上,最高达93%,且相对标准偏差小,约为0.5%,因此提取方法选用添加匀浆均质子涡旋。
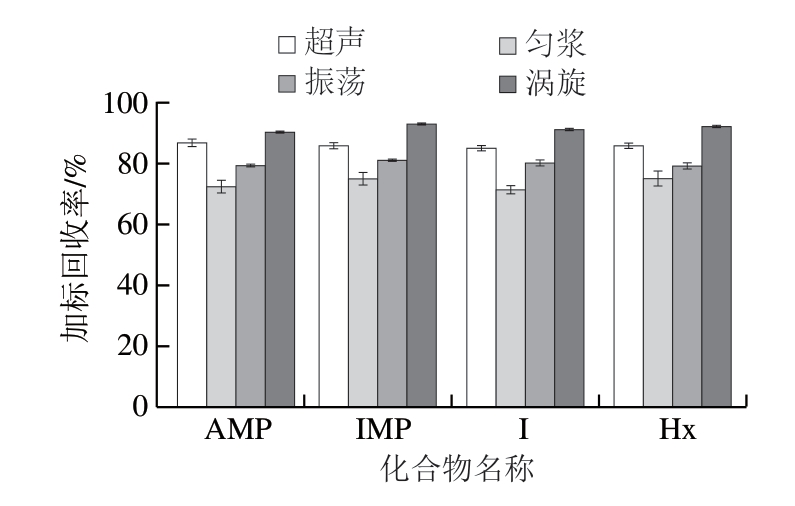
图3 不同提取方式对加标回收率的影响(n=3)
Fig. 3 Effect of extraction methods on spiked recoveries (n = 3)
2.3 提取液最适pH值的选择
pH值对分析物保留时间和分离效果影响很大,比较不同pH值提取液对目标化合物分离的影响。
由图4可知,当提取液pH值为5.5和6.0时,加标回收率均在80%以下,当提取液pH值为4.5时,加标回收率为81%~87%,当提取液pH值为5.0时加标回收率最高,平均值为91.3%。可能是由于pH值影响目标物质在质谱仪中的电离效果,在pH值为5.0时电离最完全,故选取pH 5.0作为提取液的最适pH值。
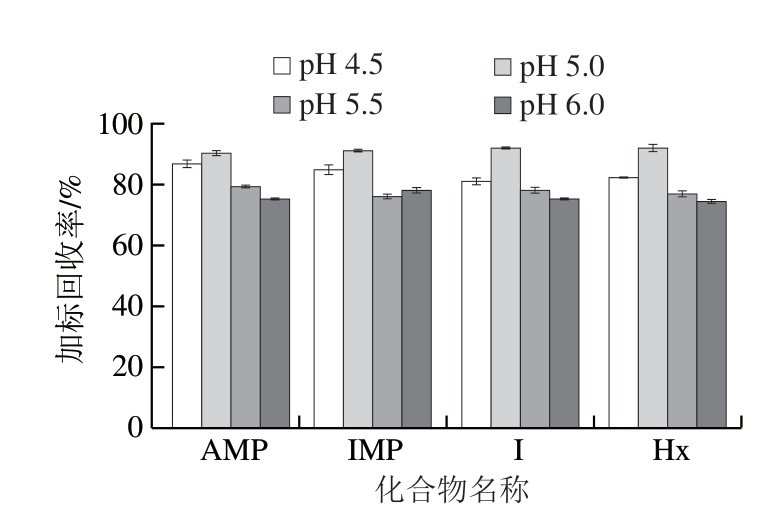
图4 不同提取液pH值对加标回收率的影响(n=3)
Fig. 4 Effect of extraction pH on spiked recoveries (n = 3)
2.4 净化方式的选择
样品经过提取后,上清液中还含有大量油脂,油脂分子质量较大,在流动相中流动缓慢,极易堵塞色谱柱,另外油脂和蛋白质对4 种目标物的检测产生基质干扰,降低方法的灵敏度。为了能有效对鸡肉样品进行净化和富集,除去油脂、蛋白质等基质干扰,选择合适的净化方式也十分有必要。本研究选择PRIME HLB固相萃取柱、QuEChERS法、MCX柱3 种方式对样品进行净化。由于样品基质本身含有目标化合物,采用基质曲线,以排除基质中所含目标物对实验结果造成的影响。
对比不同净化方式、加标量为100 ng/mL时的加标回收率。由图5可知,用QuEChERS法和MCX柱净化时的加标回收率均不到90%,相对标准偏差为0.6%~0.9%。用PEIME HLB柱净化时,平均加标回收率达90%以上,相对标准偏差最高只有0.4%,故选取PEIME HLB柱作为净化方式。
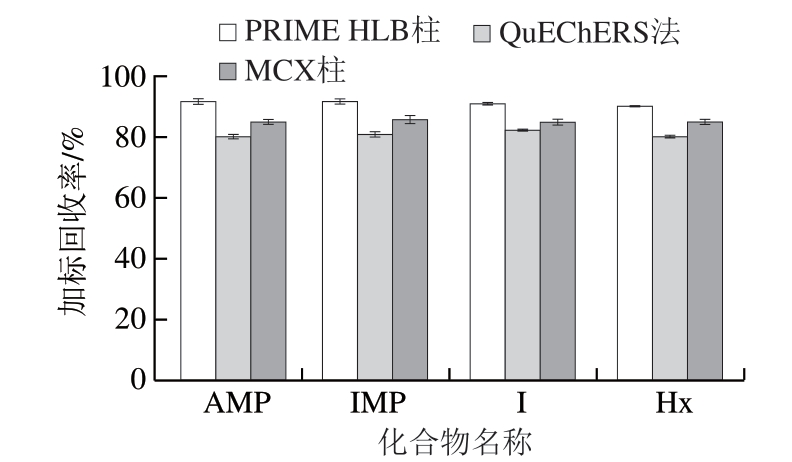
图5 不同净化方式对加标回收率的影响(n=3)
Fig. 5 Effect of purification methods on spiked recoveres (n= 3)
2.5 色谱条件优化
在周俊华等[29]的研究基础上,选择乙腈和甲酸水溶液作为流动相,比较Hilic Plus柱、C18柱和SB-Aq柱3 种色谱柱对4 种化合物的分离效果。由图6可知,由于4 种化合物均为极性化合物,在C18柱上保留较弱,易受到杂质的干扰,目标化合物与杂质不能达到有效分离。Hilic柱可以将4 种化合物分离,但分离度不佳、整体响应不高。SB-Aq柱可将4 种化合物有效分离且峰形对称、尖锐,各物质分离度及响应都较Hilic Plus柱高,因此选用SB-Aq柱作为分析色谱柱。考虑到样品基质的复杂性,在后续研究中,选择梯度洗脱来改善分离效果。
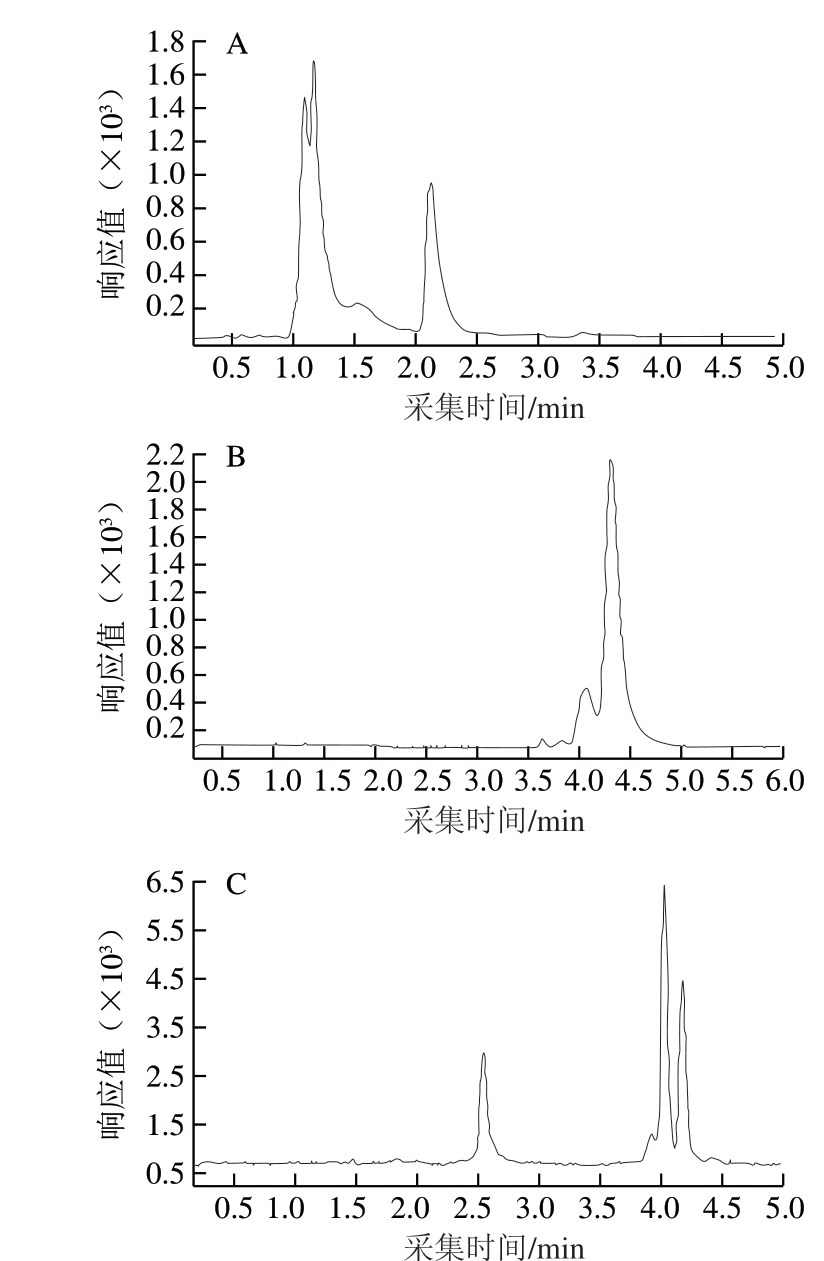
图6 使用3 种色谱柱时4 种目标化合物的分离效果
Fig. 6 Separation efficiencies of four target compounds on three chromatographic columns
A. C18柱(4.6 mm×100 mm,2.7 µm);B. Hilic Plus柱(4.6 mm× 100 mm,3.5 µm);C. SB-Aq柱(3.0 mm×100 mm,1.8 µm)。
2.6 质谱条件优化
AMP、IMP、I中连接碱基与戊糖的糖苷键在酸性条件下不稳定,容易断裂得到带正电荷的基团,在正离子模式下灵敏度较高,因此选取ESI+模式进行检测。 在ESI+模式下,通过直接进样法,优化各化合物的质谱条件,然后通过全扫描模式,得到化合物[M+H]+准分子离子峰,以此作为它们的母离子。在此基础上,通过子离子扫描寻找子离子,选择2 个丰度较高、本底噪音较低的子离子,并优化去簇电压和碰撞能量,最终选定定量分析条件。各化合物的保留时间、母离子、主要碎片离子、最佳碰撞电压和去簇电压详见表2。定性、定量离子流图见图7,检测样品时,通过质谱仪将母离子打碎成相对应的子离子,且相对丰度与图7一致时,则可确定存在此化合物。
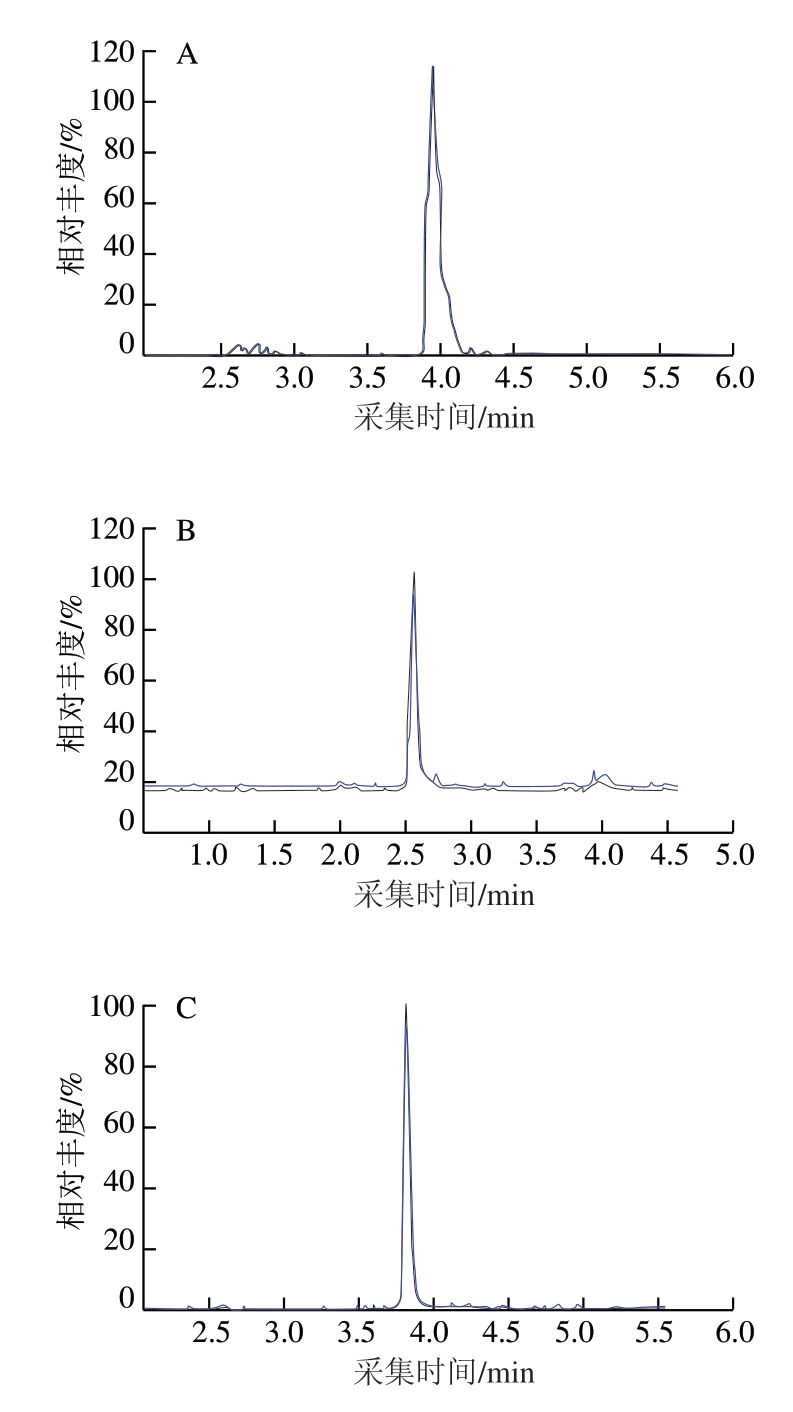
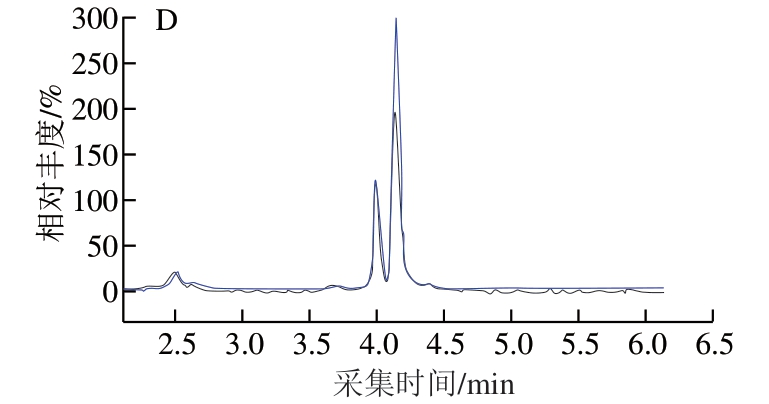
图7 4 种化合物定性、定量离子流图
Fig. 7 Qualitative and quantitative ion current chromatograms for four compounds
A. AMP;B. IMP;C. I;D. Hx。
2.7 方法学考察
2.7.1 线性关系、检出限及定量限
利用逐级稀释法向样品中添加混合标准溶液,配制成AMP、IMP、I、Hx质量浓度梯度均为50、100、200、500、1 000 ng/mL的基质标准溶液,在选定的前处理和仪器条件下进行测定。以3 倍信噪比确定检出限,10 倍信噪比确定定量限。
由表3可知,该方法在50~1 000 ng/mL范围内线性良好,4 种目标化合物相关系数均大于0.996,AMP检出限和定量限分别为0.05、0.20 mg/kg,IMP检出限和定量限分别为0.02、0.10 mg/kg,I和Hx检出限和定量限均分别为0.03、0.15 mg/kg。
表3 4 种目标化合物的回归方程、相关系数、检出限和定量限
Table 3 Calibration curve equations, correlation coefficients, limits of detection and limits of quantification of four target compounds
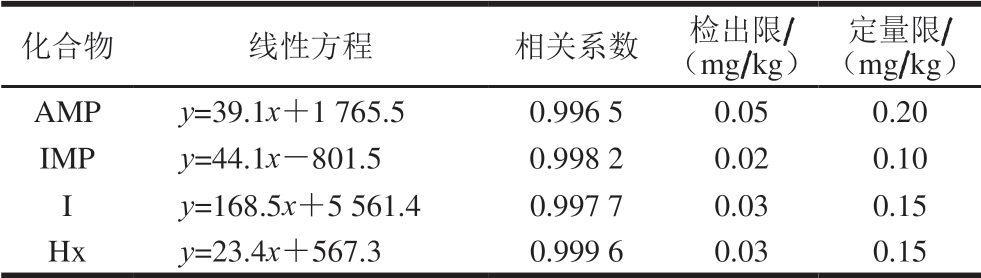
化合物 线性方程 相关系数 检出限/(mg/kg)定量限/(mg/kg)AMP y=39.1x+1 765.5 0.996 5 0.05 0.20 IMP y=44.1x-801.5 0.998 2 0.02 0.10 I y=168.5x+5 561.4 0.997 7 0.03 0.15 Hx y=23.4x+567.3 0.999 6 0.03 0.15
2.7.2 稳定性实验
取2 g鸡肉样品,按照选定的前处理方法进行处理,将所得溶液按照选定的仪器方法于放置0、2、4、6、8、10、12 h进样测定。由表4可知,4 种目标化合物含量测定的相对标准偏差为0.3%~0.8%,表明样品溶液在12 h内稳定。
表4 鸡肉中4 种目标化合物在不同放置时间内的含量变化
Table 4 Changes in contents of four compounds in chicken at different storage times
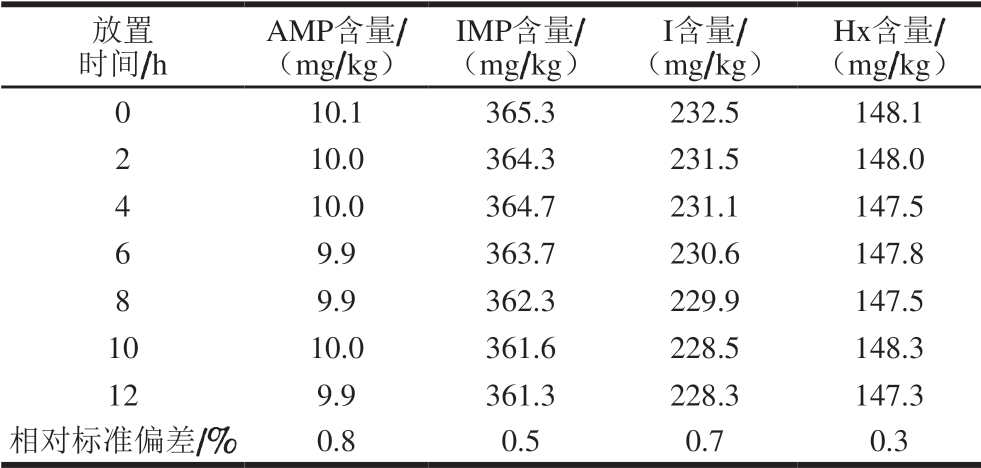
放置时间/h AMP含量/(mg/kg)IMP含量/(mg/kg)I含量/(mg/kg)Hx含量/(mg/kg)0 10.1 365.3 232.5 148.1 2 10.0 364.3 231.5 148.0 4 10.0 364.7 231.1 147.5 6 9.9 363.7 230.6 147.8 8 9.9 362.3 229.9 147.5 10 10.0 361.6 228.5 148.3 12 9.9 361.3 228.3 147.3相对标准偏差/% 0.8 0.5 0.7 0.3
2.7.3 加标回收率和精密度实验
称取鸡肉样品6 份,每份2.0 g,向样品中分别添加不同质量浓度的混合标准溶液,使加标量分别为0.25、1.00、5.00 mg/kg,按照选定的前处理方法和仪器方法进行加标回收率和精密度实验。
由表5可知,在3 个加标水平下,4 种目标化合物的加标回收率为79.63%~91.08%,相对标准偏差均小于5.0%,表明所建立的方法准确度较好,能满足鸡肉中4 种目标化合物含量测定要求。
表5 鸡肉基质加标回收率及精密度测定结果(n=6)
Table 5 Spiked recoveries and precision (RSDs) in chicken matrix (n= 6)
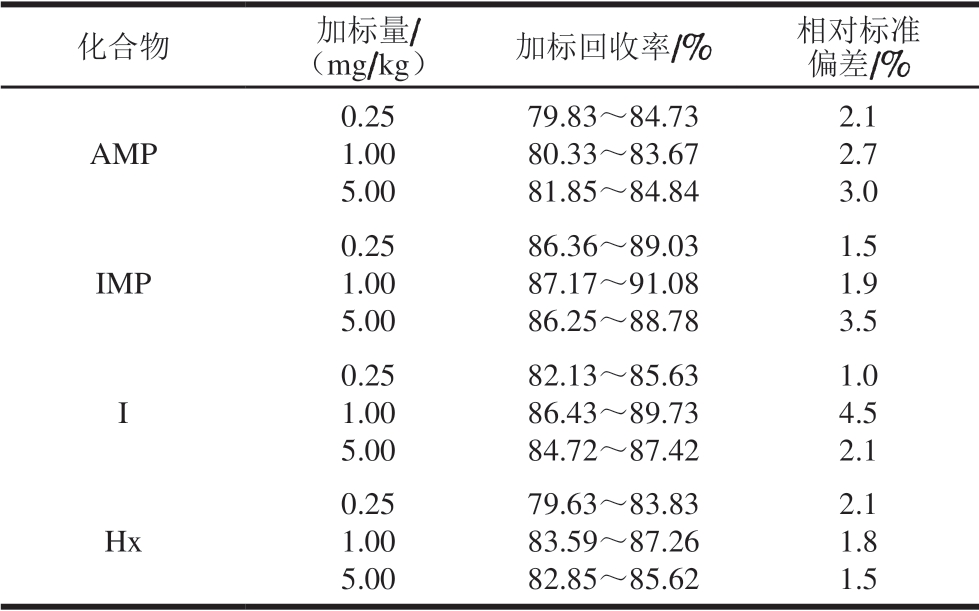
化合物 加标量/(mg/kg) 加标回收率/% 相对标准偏差/%AMP 0.25 1.00 5.00 79.83~84.73 80.33~83.67 81.85~84.84 2.1 2.7 3.0 IMP 0.25 1.00 5.00 86.36~89.03 87.17~91.08 86.25~88.78 1.5 1.9 3.5 I 0.25 1.00 5.00 82.13~85.63 86.43~89.73 84.72~87.42 1.0 4.5 2.1 Hx 0.25 1.00 5.00 79.63~83.83 83.59~87.26 82.85~85.62 2.1 1.8 1.5
3 结 论
建立鸡肉中AMP、IMP、I、Hx 4 种化合物的超高效液相色谱-串联质谱检测方法。在优化条件下,4 种化合物得到有效分离,基线平稳,稳定性好;对样品进行不同水平加标实验,结果表明,回收率较高,精密度较好。该方法简便、可靠、实用性强,适合于鸡肉中AMP、IMP、I、Hx含量的测定。
[1] 张盼盼, 李慧素, 董晓盈, 等. 冰鲜储存对固始鸡肉品质变化的影响[J]. 中国家禽, 2020, 42(1): 71-76. DOI:10.16372/j.issn.1004-6364.2020.01.015.
[2] 王金玲. 畜禽肉及制品的保鲜技术[J]. 现代畜牧科技, 2020(12): 56; 58. DOI:10.19369/j.cnki.2095-9737.2020.12.029.
[3] 王天泽, 谭佳, 杜文斌, 等. 北京油鸡鸡汤滋味物质分析[J]. 食品科学, 2020, 41(8): 159-164. DOI:10.7506/spkx1002-6630-20190505-022.
[4] YU Jun, QI Huhu, WANG Guanghong, et al. Evaluation of the tasteactive and volatile compounds in stewed meat from the Chinese yellowfeather chicken breed[J]. International Journal of Food Properties, 2017, 20(3): 2579-2595. DOI:10.1080/10942912.2017.1375514.
[5] RI Ming, HUANG Yinning, CHEN Ziyu, et al. Marine nucleosides: structure, bioactivity, synthesis and biosynthesis[J]. Marine Drugs, 2014, 12(12): 5817-5838. DOI:10.3390/md12125817.
[6] 王述柏. 鸡肉肌苷酸沉积规律及营养调控研究[D]. 北京: 中国农业科学院, 2004: 16-20.
[7] 唐修君, 杨星星, 樊艳凤, 等. 不同贮藏条件下鸡肉肌苷酸含量的变化规律[J]. 食品工业科技, 2019, 40(2): 266-270. DOI:10.13386/j.issn1002-0306.2019.02.046.
[8] MONTITA M, SIRIWAN T. A simple and cost-effective microfluidic paper-based biosensor analytical device and its application for hypoxanthine detection in meat samples[J]. Food Analytical Methods, 2019, 12(12): 2690-2698. DOI:10.1007/s12161-019-01626-0.
[9] JAVIER D A, MARIA M V, ENCARNACION R G, et al. Determination of nucleosides and nucleotides in food samples by using liquid chromatography and capillary electrophoresis[J]. TrAC Trends in Analytical Chemistry, 2017, 92: 12-31. DOI:10.1016/j.trac.2017.04.005.
[10] SHUN M, TOSHIHIKO K. Simultaneous and absolute quantification of nucleoside triphosphates using liquid chromatographytriple quadrupole tandem mass spectrometry[J]. Genes and Environment, 2018, 40(1): 13. DOI:10.1186/s41021-018-0101-8.
[11] DENG Pan, JI Cheng, DAI Xiaojian, et al. Simultaneous determination of capecitabine and its three nucleoside metabolites in human plasma by high performance liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography B, 2015, 989: 71-79. DOI:10.1016/j.jchromb.2015.03.002.
[12] LIU Wei, ZHANG Lin, TONG Ping, et al. Simultaneous determination of nucleoside and purine compounds in human urine based on a hydrophobic monolithic column using capillary electrochromatography[J]. Electrophoresis, 2015, 12: 2727-2735. DOI:10.1002/elps.201500194.
[13] MOOLTONGCHUN M, TEEPOO S. A simple and cost-effective microfluidic paper-based biosensor analytical device and its application for hypoxanthine detection in meat samples[J]. Food Analytical Methods, 2019, 12(12): 2690-2698. DOI:10.1007/s12161-019-01626-0.
[14] DAISUKE J, YOSHITOMI K, KAZUKI S, et al. Rapid and selective simultaneous quantitative analysis of modified nucleosides using multicolumn liquid chromatography-tandem mass spectrometry[J]. Journal of Analytical Science and Technology, 2017, 8(1): 1-9. DOI:10.1186/s40543-017-0110-4.
[15] 张波泳, 江振作, 王跃飞, 等. UPLC/ESI-Q-TOF MS法分析鲜地黄、生地黄、熟地黄的化学成分[J]. 中成药, 2016(5): 1104-1108. DOI:10.3969/j.issn.1001-1528.2016.05.029.
[16] HUANG Yang, ZHANG Tingting, ZHAO Yumei, et al. Simultaneous analysis of nucleobases, nucleosides and ginsenosides in ginseng extracts using supercritical fluid chromatography coupled with single quadrupole mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2017, 144(10): 213-219. DOI:10.1016/j.jpba.2017.03.059.
[17] ZHANG Ping, GUO Zhenghong, ZHAO Yuqing, et al. Investigation of anti-fatigue effect and simultaneous determination of eight nucleosides in different parts of velvet antler in red deer and sika deer[J]. Chemistry and Biodiversity, 2020, 17(2): 688-693. DOI:10.1002/cbdv.201900512.
[18] 靳羽慧, 邓楚君, 赵慧, 等. 3 种常见食用菌营养成分和嘌呤物质含量分析[J]. 中国食用菌, 2018, 37(4): 62-65; 81. DOI:10.16372/j.issn.1004-6364.2020.01.015.
[19] 李雪, 冯涛, 宋诗清, 等. 不同处理方法对蟹味菇呈味物质释放的影响[J]. 食品科学, 2020, 41(10): 198-205. DOI:10.7506/spkx1002-6630-20190611-121.
[20] 柴洋洋, 王雨萱, 艾凯, 等. 茶树菇呈味物质的提取及鲜味剂的研究[J]. 中国调味品, 2020, 45(3): 5-10; 14. DOI:10.3969/j.issn.1000-9973.2020.03.002.
[21] 谢丽源, 兰秀华, 彭卫红, 等. 不同生态环境对羊肚菌非挥发性呈味物质的影响[J]. 食品工业科技, 2020, 41(17): 237-242. DOI:10.13386/j.issn1002-0306.2020.17.039.
[22] 马晓颖, 吕立涛, 曹君, 等. 高效毛细管电泳法测定羊肚菌(Morchella sextelata)菌丝中单核苷类化合物含量的研究[J]. 食品工业科技, 2020, 41(15): 237-243. DOI:10.13386/J.Issn10020306.202-0.15.037.
[23] 邵洋, 余达威, 杨方, 等. 不同等级中华绒螯蟹滋味物质的比较分析[J]. 渔业科学进展, 2020, 42(4): 192-198. DOI:10.19663/j.issn2095-9869.20191224001.
[24] 方林, 施文正, 刁玉段, 等. 冻结方式对不同部位草鱼呈味物质的影响[J]. 食品科学, 2018, 39(12): 199-204. DOI:10.7506/spkx1002-6630-201812031.
[25] QIU Weiqiang, CHEN Shunsheng, XIE Jing, et al. Analysis of 10 nucleotides and related compounds in Litopenaeus vannamei during chilled storage by HPLC-DAD[J]. LWT-Food Science and Technology, 2016, 67(4): 187-193. DOI:10.1016/j.lwt.2015.11.047.
[26] 伍彬, 章超桦, 吉宏武, 等. 南美白对虾虾头自溶产物主要呈味成分分析[J]. 食品科学, 2010, 31(10): 184-187. DOI:10.7506/spkx1002-6630-201010037.
[27] 汤水粉, 钱卓真, 罗方方, 等. 高效液相色谱法测定水产品中ATP关联化合物[J]. 渔业科学进展, 2014, 35(2): 110-116. DOI:10.3969/j.issn.1000-7075.2014.02.016.
[28] ZHAO Hengqiang, WANG Xiao, LI Hongmei, et al. Characterization of nucleosides and nucleobases in natural cordyceps by HILIC-ESI/TOF/MS and HILIC-ESI/MS[J]. Molecules, 2013, 18: 9795-9769. DOI:10.3390/molecules18089755.
[29] 周俊华, 梁琪妹, 梁方方, 等. 高效液相色谱法测定畜禽肉中肌苷酸研究[J]. 现代农业科技, 2014(19): 294-295. DOI:10.3969/j.issn.1007-5739.2014.19.186.
[30] HE Liqing, WEI Xiaoli, MA Xipeng, et al. Simultaneous quantification of nucleosides and nucleotides from biological samples[J]. Journal of the American Society for Mass Spectrometry, 2019, 30(6): 987-1000. DOI:10.1007/s13361-019-02140-7.