在全球化背景下,鸡肉消费近几十年来日益受到关注。鸡肉脂肪含量低、价格相对较低、无宗教文化约束,具有较强的竞争力[1]。然而,类PSE(pale, soft, exudative)鸡肉的出现严重影响了鲜鸡肉的感官质量,降低了消费者的购买欲望[2-5]。大多数研究认为宰前热应激或宰后环境高温容易导致肌肉糖酵解速率加快(pH值下降速率加快),从而引起肌浆蛋白或肌原纤维蛋白发生过度变性,而蛋白质功能受损会导致家禽产品的功能缺陷[6],给禽肉深加工业造成巨大经济损失。类PSE鸡肉是一类颜色苍白、质地柔软、汁液渗出的异质肉,加工过程中盐溶性蛋白难以提取[3],导致产品产量降低和质构劣变。鸡肉中含20%~23%的蛋白质,鸡胸肉也被认为是烟酸和VB6的极好来源[7]。因此,如何快速、有效从类PSE鸡肉中分离回收并利用蛋白质值得研究。
碱溶酸沉法是酸碱溶解-等电点沉淀的一种,作为很好的蛋白回收方法常用来提取植物蛋白[8]。目前,Zhao Xue等[9-10]已将碱溶酸沉法应用于回收类PSE鸡肉蛋白,并改善其功能特性,但是利用碱溶酸沉法在pH 5.5条件下回收得到的类PSE鸡肉蛋白,提取率仍需进一步提高,且凝胶乳化功能特性弱于其他pH组。因此,需要新的处理方法改进提取效率并改善pH 5.5条件下回收时类PSE鸡肉蛋白功能特性。
超声波作为一种新型绿色食品加工技术,具有缩短加工时间、降低生产成本和改善肉及肉制品品质等优势,在肉及肉制品行业中的应用受到广泛关注[11]。超声波辅助提取是利用超声波作为预处理方法,提取蛋白质的有效方法,通过促进溶剂渗透来提高提取率,具有提取产量高、快速、溶剂消耗率低和环境污染低等优点[12-13]。 此外,很多学者报道超声辅助提取能够增加蛋白提取率并改善其功能特性(溶解性、乳化性、起泡性等),如鸭肝蛋白[14]、扁豆蛋白[15]、米糠蛋白[16]、南极磷虾蛋白[17] 等,将超声辅助提取应用于类PSE鸡肉蛋白的报道很少。前期研究表明,超声波直接作用于类PSE鸡肉蛋白进行改性,对其溶解度和乳化特性的改善有积极影响[6]。本研究采用不同超声时间(0、5、10、15 min)辅助碱提取类PSE鸡肉蛋白,研究其对提取率和功能特性的影响,为充分利用类PSE鸡肉蛋白在食品等领域的潜在价值提供一定科学依据。
1 材料与方法
1.1 材料与试剂
鸡胸肉从河南郑州某加工厂的去骨生产线中挑选。白羽肉鸡平均日龄为44 d,平均活体质量为2.55 kg。样品的选取参照Li Ke等[3]的方法。宰后24 h,测定所有样品的亮度值(L*)和pH值,选取符合类PSE的鸡胸肉(L*24 h>53,pH24 h<5.7);然后去除所有肉眼可见的结缔组织、脂肪和皮肤,将L*不同的肉均切成小块(约1 cm×1 cm×1 cm)并混合,贴标签并包装在聚乙烯袋中,每袋约100 g,冷冻(-20 ℃),并在2 周内使用。
金龙鱼大豆油 益海嘉里金龙鱼粮油食品有限公司; 氯化钠、氯化镁、磷酸二氢钠、磷酸氢二钠等 天津市科密欧化学试剂有限公司;所有试剂均为分析纯。
1.2 仪器与设备
PH-STAR CPU胴体肌肉pH值测定仪 北京布拉德科技发展有限公司;CiX62便携式色度仪 美国爱色丽公司;SZ-22A绞肉机 广州旭众食品机械有限公司; T25高速均浆机 德国IKA公司;VC750超声波破碎仪 美国Sonic公司;PHS-3C pH计 上海雷磁仪器厂; AvantiJ-26S XPI大容量高速冷冻离心机 美国Beckman Coulter公司;TU-1810紫外分光光度计 北京通用仪器有限公司;Nano-ZS90纳米激光粒度仪 英国马尔文仪器公司;Discovery HR-1流变仪 美国TA仪器公司;HH-42水浴锅 常州国华电器有限公司;TA-XT Plus质构分析仪 英国Stable Micro System公司;Regulus 8100冷场发射扫描电子显微镜 日本日立有限公司; Lab-1-50冷冻干燥机 北京博医康实验仪器有限公司。
1.3 方法
1.3.1 类PSE鸡肉蛋白的提取
参考Zhao Xue等[18]的方法,取100 g样品于4 ℃解冻12 h,肉块在预冷的绞肉机中以2 000 r/min绞碎20 s(2 次),然后将糊状物与4 ℃去离子水以1∶6(m/V)混合,10 000 r/min均质1 min;使用2 mol/L NaOH调节均质液pH值至11,在4 ℃冷却10 min,以稳定系统;然后于4 ℃、10 000×g离心15 min,取上清液(含可溶蛋白)使用2 mol/L HCl调节pH值至5.5(等电点附近),在4 ℃条件下过夜沉淀蛋白质后,10 000×g离心15 min,收集沉淀(即类PSE鸡肉蛋白),并重新溶解在去离子水中,用1 mol/L NaOH调整溶液最终pH值至中性。
1.3.2 超声辅助碱法提取类PSE鸡肉蛋白
参考Li Ke等[19]的方法,取150 mL 1.3.1节pH值为11的混合溶液于250 mL烧杯中,将超声波探头(直径13 mm)插入混合溶液1.5 cm深处,整个超声过程中,烧杯置于冰水浴,以避免样品过热。超声参数为:频率20 kHz,功率450 W,工作模式:超声2 s,休息4 s,超声处理时间分别为0、5、10、15 min;温度控制在12 ℃以下。超声辅助碱提取后上清液按照1.3.1节方法处理。最后冷冻干燥获得超声辅助提取的类PSE鸡肉蛋白,将干燥样品贮存在自封袋中,-20 ℃贮藏,待进一步分析[20]。
1.3.3 蛋白提取率测定
参照Wang Feng等[21]的方法,按式(1)计算蛋白质提取率。
式中:m1、C1分别为干燥蛋白质质量/g、蛋白质含量/(g/100 g);m2和C2分别为原料肉质量/g、原料肉蛋白质含量/(g/100 g)。其中,蛋白质含量采用GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》凯氏定氮法测定。
1.3.4 浊度和溶解度测定
浊度测定参考赵颖颖等[22]方法,测定1 mg/mL类PSE鸡肉蛋白溶液在660 nm波长处的吸光度,以磷酸盐缓冲液(10 mmol/L Na2HPO4/NaH2PO4,pH 7.0)为空白。
溶解度测定参考Zhang Ziye等[23]的方法,稍加修改。用磷酸盐缓冲液(10 mmol/L Na2HPO4/NaH2PO4,pH 7.0)将处理后的样品质量浓度调至10 mg/mL,10 000×g、4 ℃离心20 min,用双缩脲法测定上清液中蛋白质质量浓度(mg/mL)。溶解度按式(2)计算。
1.3.5 黏度测定
采用流变仪,选择直径40 mm,不锈钢平板测量系统,平板间距1 mm,温度25 ℃,测量之前将约2 g样品平衡30 s达到室温,记录剪切速率1~1 000 s-1的黏度。
1.3.6 粒径测定
用磷酸盐缓冲液(10 mmol/L Na2HPO4/NaH2PO4,pH 7.0)溶解类PSE鸡肉蛋白,使质量浓度为1 mg/mL。使用激光粒度仪测定样品粒径,每个样品重复3 次。
1.3.7 微观结构观察
将冷冻干燥后的类PSE鸡肉蛋白样品喷金处理,采用扫描电子显微镜观察蛋白表面微观结构。扫描电子显微镜条件:加速电压3 kV,放大倍数×500、×50。
1.3.8 凝胶制备
参照Zhao Xue等[9]的方法,略加修改。用2 g/100 mL氯化钠溶液将类PSE鸡肉蛋白质量浓度调至100 mg/mL,4 ℃搅拌1 h,后转移到50 mL离心管中,螺帽密封;加热前,在4 ℃条件下以500×g离心5 min去除气泡,然后在水浴锅中80 ℃加热20 min。在进一步分析之前,将样品在4 ℃下贮存过夜。
1.3.9 凝胶强度测定
参考Li Ke等[19]的方法。使用质构仪测定,探头型号为P/0.5。参数设置为:测前速率1 mm/s,测试速率1 mm/s, 测后速率2 mm/s,下压距离10 mm,触发力5 g。样品破裂点位第1个峰顶点定义为蛋白质的凝胶强度(g)[24]。
1.3.10 蒸煮损失率测定
通过蒸煮损失率来评价超声辅助碱法提取的类PSE鸡肉蛋白凝胶保水性。蒸煮方法参考1.3.8节。蒸煮前质量记为m3(g),蒸煮后,去除凝胶表面水分,再次称质量,记为m4(g)。蒸煮损失率按式(3)计算。
1.3.11 乳化特性测定
乳液制备参考Zhao Xue等[25]的方法,稍加修改。用2 g/100 mL NaCl溶液将类PSE鸡肉蛋白溶解至质量浓度为2 g/100 mL,然后与200 g/L大豆油混合;使用均质机以10 000 r/min均质2 min(2 次,每次1 min),在均质过程中,为防止热变性,将乳液放置在冰水中;均质后,迅速在底部吸取0.05 mL乳液,加入5 mL 1 mg/mL十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液充分混合。以SDS溶液为空白,在500 nm波长处测定吸光度,记为A0,10 min后再次从底部吸取乳液,在500 nm波长处测定吸光度,记为A10。乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)分别按式(4)~(5)计算[26]。
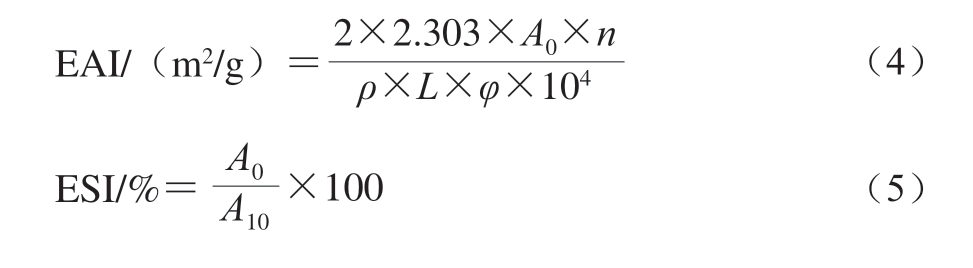
式中:n为稀释倍数(100);L为比色皿的光程长度/cm; φ为油相体积(0.2 mL);ρ为蛋白质量浓度/(g/mL)。
1.4 数据处理
采用Origin 8.5软件(美国Origin Lab公司)作图,使用SPSS v.21.0软件(美国IBM公司)对数据进行单因素方差分析,采用Duncan’s方法作多重比较,P<0.05时认为不同处理组间存在显著差异。
2 结果与分析
2.1 超声时间对类PSE鸡肉蛋白提取率和蛋白含量的影响
由表1可知,与未超声样品(对照组)相比,超声辅助提取增加了蛋白提取率和蛋白含量。对照组提取率为45.55%,当超声处理时间为10 min时,蛋白提取率达到最大,为68.58%。与对照组相比,超声处理10 min蛋白提取率提高50.56%,蛋白含量提高25.32%。这可能是因为超声波引起的机械振动增加了样品和碱性溶液之间的接触面积。此外,超声波产生的空化作用破坏分子键,增加传质,导致较大的蛋白质聚集体解离成可溶的较小聚集体,蛋白质溶解度增加,从而提高蛋白质的提取效率[27]。Zou Ye等[14]研究表明,采用超声辅助碱提取鸭肝蛋白,与对照组相比(42.6%),蛋白质提取率增加67.72%。Zou Ye等[28]也研究了超声辅助碱提取鸡肝蛋白,与对照组相比,蛋白质提取率从43.5%增加至67.6%,提高55.40%。随着超声时间进一步延长,蛋白提取率没有显著变化,可能延长提取时间会阻碍空化驱动力。因此,进一步延长超声时间对提取效率的贡献不大。先前的研究也报道了较长的处理时间对蛋白质的提取率没有贡献[29]。蛋白含量降低可能是因为超声处理时间过长,造成蛋白链的重新聚集[30]。因此,合适的超声辅助提取时间能够提高类PSE蛋白的提取率和蛋白含量。
表1 超声时间对类PSE鸡肉蛋白提取率和蛋白含量的影响
Table 1 Effect of ultrasound treatment time on the yield and purity of protein isolated from PSE-like chicken meat

注:同列小写字母不同,表示差异显著(P<0.05)。表2同。
超声时间/min 蛋白提取率/% 蛋白含量/(g/100 g)0 45.55±3.12c 69.01±0.20d 5 58.43±1.12b 81.37±0.35c 10 68.58±2.30a 86.51±0.20a 15 63.92±2.71a 84.47±0.44b
2.2 超声时间对类PSE鸡肉蛋白浊度和溶解度的影响
浊度能用于反映蛋白的聚集水平,浊度越高,说明蛋白质聚集程度越高[31]。由表2可知,在不同时间的超声处理后,类PSE鸡肉蛋白的浊度发生显著变化 (P<0.05),从0.410(0 min)降低到0.353(10 min)。 这可能是因为超声波的机械效应破坏了蛋白质结构,导致颗粒破碎,蛋白质颗粒的直径减小,从而增加了光散射的比表面积,降低了样品浊度[23]。随着超声时间延长,样品浊度增大,表明蛋白质进一步聚集。随着超声时间延长,类PSE鸡肉蛋白的溶解度呈现先增加后减小的趋势。随着超声时间从0 min延长到10 min,类PSE鸡肉蛋白溶解度从14.55%增加到20.16%。这可能是由于在自然状态下,蛋白质以聚集体形式存在,空化作用产生的机械力可能破坏氢键和疏水相互作用,导致较大的蛋白质聚集体解离成可溶的较小聚集体,从而浊度下降,蛋白质溶解度增加[17]。超声波处理促进了可溶性蛋白质聚集体或不溶性蛋白质聚集体单体的形成[32],导致溶解度增加。此外,更小的颗粒尺寸、更大的比表面积有助于蛋白质-水相互作用,增强蛋白质的溶解度。当超声处理时间为15 min时,类PSE鸡肉蛋白溶解度减小,可能是由于超声时间过长,引起蛋白质的再聚集[30]。
表2 超声时间对类PSE鸡肉蛋白浊度和溶解度的影响
Table 2 Effect of ultrasound treatment time on the turbidity and solubility of protein isolated from PSE-like chicken meat

超声时间/min 浊度(A660 nm) 溶解度/%0 0.410±0.002a 14.55±0.62c 5 0.362±0.003b 18.05±0.43b 10 0.353±0.003c 20.16±0.99a 15 0.406±0.003a 17.97±0.61b
2.3 超声时间对类PSE鸡肉蛋白黏度的影响
由图1可知,类PSE鸡肉蛋白黏度随着超声时间的延长而降低,不同超声时间处理的样品均为剪切变稀流体,其剪切变稀行为表现为表观黏度随剪切速率增加而降低。超声波处理后黏度的降低主要与空化过程中产生的物理力有关。在空化期间,液体介质暴露于剧烈的力,这种力会破坏蛋白链之间的相互作用,导致粒径减小,流动性增强,表现为黏度降低[33]。在同样的剪切速率下,超声15 min样品的黏度略高于超声10 min,可能是因为蛋白质过度变性,这与粒径和溶解度的变化一致。
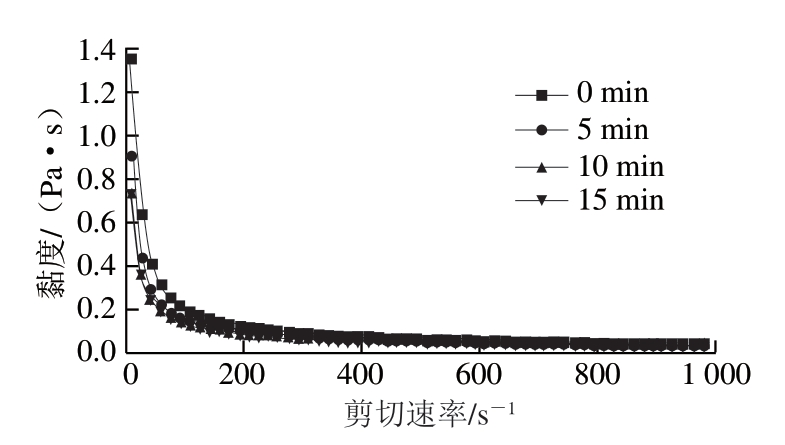
图1 超声时间对类PSE鸡肉蛋白黏度的影响
Fig. 1 Effect of ultrasound treatment time on the viscosity of protein isolated from PSE-like chicken meat
2.4 超声时间对类PSE鸡肉蛋白粒径的影响
由图2可知,随着超声时间延长,类PSE鸡肉蛋白平均粒径的变化趋势为先减小后增加。对照组平均粒径为4 992 nm,超声处理10 min后,平均粒径显著降低至3 184 nm(P<0.05)。Zou Ye等[14]研究表明,与传统的碱法提取相比,超声辅助提取得到的鸭肝分离蛋白粒径较小。这可能是由于超声空化现象产生的微射流和湍流使得蛋白质聚集体解离,产生更小的颗粒。随着超声时间进一步延长,蛋白质的颗粒尺寸增大,可能是因为蛋白过度变性,形成了小的聚集体[30]。
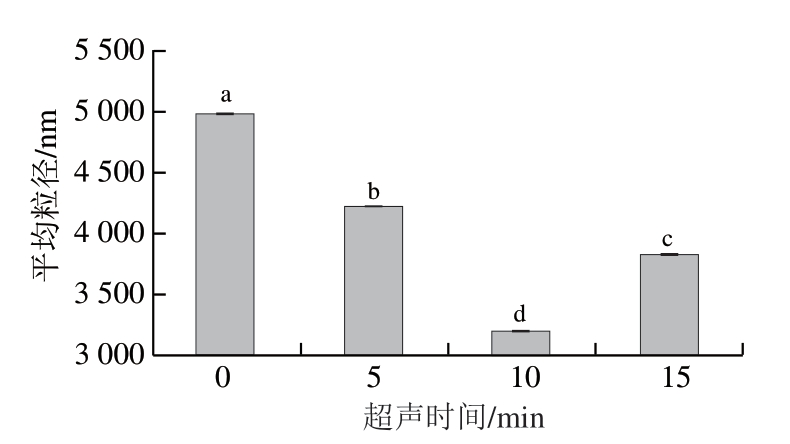
图2 超声时间对类PSE鸡肉蛋白平均粒径的影响
Fig. 2 Effect of ultrasound treatment time on the average particle size of protein isolated from PSE-like chicken meat
小写字母不同,表示差异显著(P<0.05)。图4~6同。
2.5 超声时间对类PSE鸡肉蛋白微观结构的影响
由图3可知,对照组类PSE鸡肉蛋白存在大而形状不规则的微结构,与对照组相比(图3A1、3A2),经超声处理的样品显示出更疏松的结构和不规则的片段,这些微观结构的变化可能是由于超声处理过程中产生的空化效应。当超声处理时间为10 min时,样品具有更小和更疏松的结构,而超声时间进一步延长,样品的碎片尺寸比超声10 min大。这些结果与粒径测定结果相一致。 王怡婷等[34]研究也表明,超声辅助提取得到的鹅肝分离蛋白微观结构较为疏松,这可能是因为超声空化效应产生的强烈物理力破坏了蛋白质之间的非共价键,使粒径减小,导致蛋白质结构更加疏松多孔。

图3 超声时间对类PSE鸡肉蛋白微观结构的影响
Fig. 3 Effect of ultrasound treatment time on the microstructure of protein isolated from PSE-like chicken meat
A~D. 超声处理时间0、5、10、15 min;下标1~2. 放大倍数50、500 倍。
2.6 超声时间对类PSE鸡肉蛋白凝胶蒸煮损失率的影响
蛋白质持水性代表蛋白质产品对水的吸附能力,是蛋白质凝胶最重要的一个功能特性[35]。由图4可知,随着超声时间从0 min延长到10 min,类PSE鸡肉蛋白凝胶的蒸煮损失率从29.87%降低到11.42%,降低61.77%,表明类PSE鸡肉蛋白凝胶保水性增加。这可能是因为适当的超声处理可以改变蛋白质结构,使粒径减小,增加了蛋白质和水之间的相互作用[36],从而使蒸煮损失率降低。随着超声时间进一步延长到15 min,类PSE鸡肉蛋白凝胶的蒸煮损失率无显著变化。Zhang Ziye等[23]研究也表明,适当的超声处理可以增加肌原纤维蛋白凝胶的保水性。
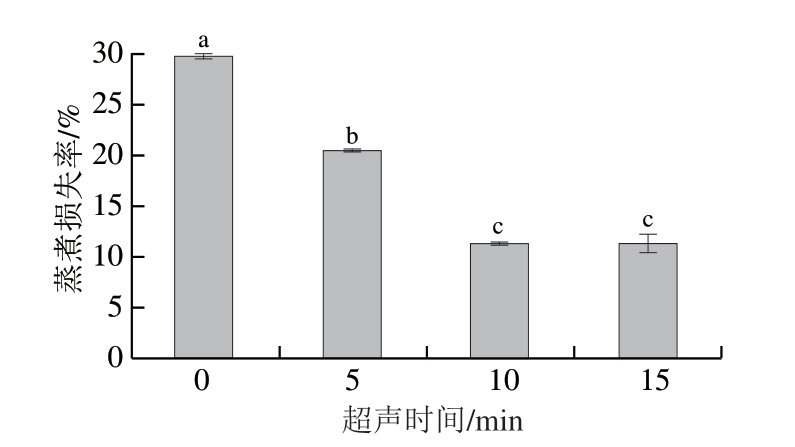
图4 超声时间对类PSE鸡肉蛋白凝胶蒸煮损失率的影响
Fig. 4 Effect of ultrasound treatment time on the cooking loss of heatinduced gels from protein isolated from PSE-like chicken meat
2.7 超声时间对类PSE鸡肉蛋白凝胶强度的影响
由图5可知,与对照组相比,超声辅助提取得到的类PSE鸡肉蛋白凝胶强度显著降低(P<0.05)。超声10 min时,凝胶强度降低至175.89 g,随着超声时间进一步延长,凝胶强度未发生明显变化。超声波处理促使蛋白质分子进一步展开,提高了蛋白质的溶解度,增加了蛋白质与水之间的吸引力,阻碍了蛋白质之间的纵向交联,因而导致形成凝胶的能力减弱[36]。此外,蒸煮损失率降低(体系水分含量增加)也会导致凝胶强度减弱,更多的水被截留在凝胶网络中,导致凝胶结构不太 致密[36-37]。而Li Ke等[19]发现,超声处理能改善类PSE鸡肉糜的凝胶强度,Zhang Chao等[38]研究发现,适当的超声辅助冷冻功率可以提高鸡胸肉的凝胶强度,减少凝胶弱化。这可能是因为样品类型和成分、超声条件、处理方式等不同。
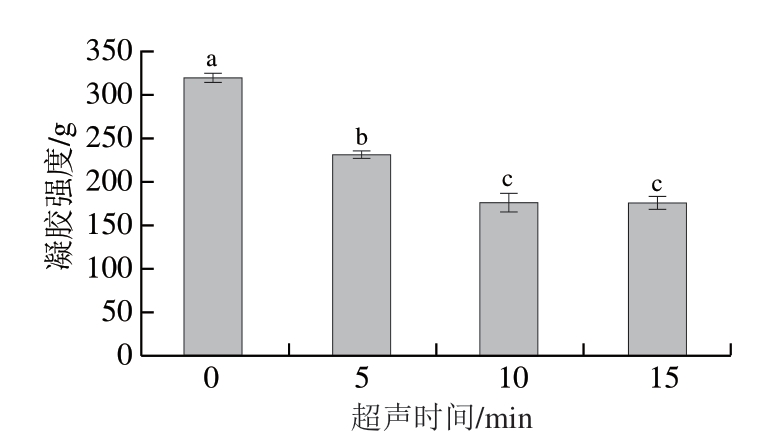
图5 超声时间对类PSE鸡肉蛋白凝胶强度的影响
Fig. 5 Effect of ultrasound treatment time on the gel strength of protein isolated from PSE-like chicken meat
2.8 超声时间对类PSE鸡肉蛋白乳化特性的影响
乳化特性是重要的功能特性,在新产品开发中起着重要作用。EAI和ESI用来描述蛋白质的乳化特性,EAI表示蛋白质形成乳状液的能力,而ESI用来表示蛋白质在一段时间内形成稳定乳状液的能力。
由图6可知,随着超声时间的延长,类PSE鸡肉蛋白EAI显著高于对照组(P<0.05),这可能与超声处理后蛋白质结构的展开有关。与超声10 min相比,超声处理15 min时,EAI显著下降(P<0.05),这可能是因为形成了更大的聚集体,降低了蛋白质的溶解度,与前面结果相一致。Zou Ye等[30]研究表明,超声波处理导致蛋白质粒径减小,从而使蛋白质更快地吸附到油-水界面,并增强乳化性能。与对照组(87.36%)相比,类PSE鸡肉蛋白ESI显著增加(P<0.05),当超声处理时间为10 min时达到最大,为98.67%,超声处理15 min与10 min没有显著差异。结果表明,超声辅助提取可以提高类PSE蛋白的EAI和ESI。Li Wanying等[26]研究表明,与传统的提取方法相比,超声辅助提取得到的啤酒糟蛋白EAI和ESI显著增加。Zou Ye等[28]利用超声辅助碱法提取鸡肝分离蛋白也得到了同样的结果。
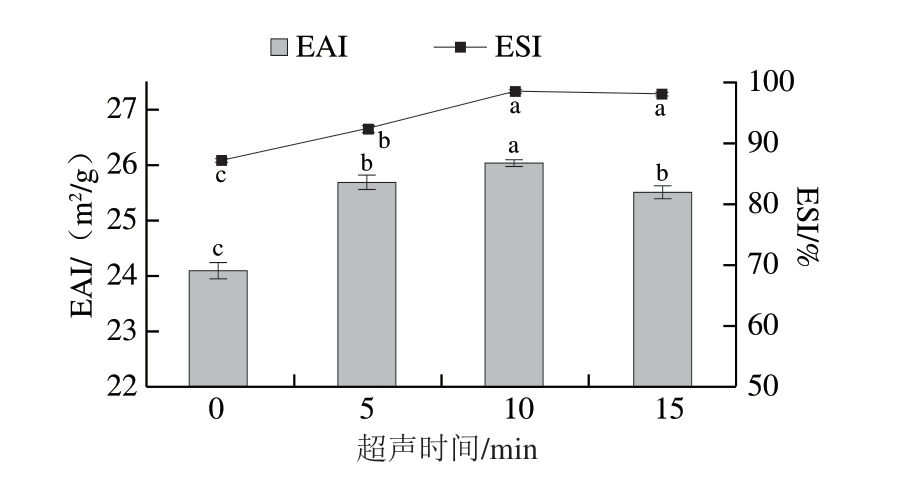
图6 超声时间对类PSE鸡肉蛋白EAI和ESI的影响
Fig. 6 Effect of ultrasound treatment time on the EAI and ESI of
protein isolated from PSE-like chicken meat
3 结 论
超声辅助提取显著提高了类PSE鸡肉蛋白提取率和蛋白含量,降低了蛋白的粒径、浊度、蒸煮损失率。超声处理改变了类PSE鸡肉蛋白的微观结构,使蛋白的粒径降低。粒径降低增大了蛋白质的比表面积,促进了蛋白质与水之间的相互作用,使溶解度增加、蒸煮损失率降低,蒸煮损失率的降低表明凝胶保水性增加,但是凝胶强度降低。此外,超声辅助提取改善了类PSE鸡肉蛋白的乳化特性。因此,超声辅助碱法提取类PSE鸡肉蛋白可以提高类PSE鸡肉的利用价值,增加其加工利用率。下一步针对改善其凝胶强度,可采用协同谷氨酰胺转氨酶、氨基酸等方法。
[1] JIN H M, HER J Y, KANG T, et al. Effects of pulsed electric field (PEF) and oscillating magnetic field (OMF) combination technology on the extension of supercooling for chicken breasts[J]. Journal of Food Engineering, 2017, 196: 27-35. DOI:10.1016/j.jfoodeng.2016.10.002.
[2] DONG Ming, CHEN Hongqiang, ZHANG Yumei, et al. Processing properties and improvement of pale, soft, and exudative-like chicken meat: a review[J]. Food and Bioprocess Technology, 2020, 13(1): 1280-1291. DOI:10.1007/s11947-020-02464-3.
[3] LI Ke, CHEN Lin, ZHAO Yingying, et al. A comparative study of chemical composition, color, and thermal gelling properties of normal and PSE-like chicken breast meat[J]. CyTA-Journal of Food, 2015, 13(2): 213-219. DOI:10.1080/19476337.2014.941411.
[4] LI Ke, ZHAO Yingying, KANG Zhuangli, et al. Reduced functionality of PSE-like chicken breast meat batter resulting from alterations in protein conformation[J]. Poultry Science, 2015, 94(1): 111-122. DOI:10.3382/ps/peu040.
[5] 康壮丽, 赵颖颖, 李可, 等. 类PSE禽肉的品质特征探讨及研究 进展[J]. 食品科学, 2017, 38(7): 284-289. DOI:10.7506/spkx1002-6630-201707045.
[6] LESIOW T, RENTFROW G K, XIONG Y L. Polyphosphate and myofibrillar protein extract promote transglutaminase-mediated enhancements of rheological and textural properties of PSE pork meat batters[J]. Meat Science, 2017, 128: 40-46. DOI:10.1016/j.meatsci.2017.02.002.
[7] DONG Ming, TIAN Huixin, XU Yujuan, et al. Effects of pulsed electric fields on the conformation and gelation properties of myofibrillar proteins isolated from pale, soft, exudative (PSE)-like chicken breast meat: a molecular dynamics study[J]. Food Chemistry, 2021, 342: 128306. DOI:10.1016/J.foodchem.2020.128306.
[8] 柳芬芳, 李迎秋. 绿豆蛋白提取工艺的响应面法优化[J]. 轻工学报, 2020, 35(2): 7-16. DOI:10.12187/2020.02.002.
[9] ZHAO Xue, XING Tong, CHEN Xing, et al. Yield, thermal denaturation, and microstructure of proteins isolated from pale, soft, exudative chicken breast meat by using isoelectric solubilization/precipitation[J]. Process Biochemistry, 2017, 58: 167-173. DOI:10.1016/j.procbio.2017.04.035.
[10] ZHAO Xue, BAI Yun, XING Tong, et al. Use of an isoelectric solubilization/precipitation process to modify the functional properties of PSE (pale, soft, exudative)-like chicken meat protein: a mechanistic approach[J]. Food Chemistry, 2018, 248: 201-209. DOI:10.1016/j.foodchem.2017.12.048.
[11] 黄亚军, 周存六. 超声波技术在肉及肉制品中的应用研究进展[J]. 肉类研究, 2020, 34(5): 91-97. DOI:10.7506/rlyj1001-8123-20200319-079.
[12] BERNARDI S, LUPATINI-MENEGOTTO A L, KALSCHNE D L, et al. Ultrasound: a suitable technology to improve the extraction and techno-functional properties of vegetable food proteins[J]. Plant Foods for Human Nutrition, 2021, 76: 1-11. DOI:10.1007/s11130-021-00884-w.
[13] FU Xizhe, BELWAL T, CRAVOTTO G, et al. Sono-physical and sono-chemical effects of ultrasound: primary applications in extraction and freezing operations and influence on food components[J]. Ultrasonics Sonochemistry, 2019, 60: 104726. DOI:10.1016/j.ultsonch.2019.104726.
[14] ZOU Ye, WANG Li, LI Pengpeng, et al. Effects of ultrasound assisted extraction on the physiochemical, structural and functional characteristics of duck liver protein isolate[J]. Process Biochemistry, 2017, 52: 174-182. DOI:10.1016/j.procbio.2016.09.027.
[15] ZHAO Yajing, WEN Chaoting, FENG Yuqin, et al. Effects of ultrasound-assisted extraction on the structural, functional and antioxidant properties of Dolichos lablab L. protein[J]. Process Biochemistry, 2021, 101: 274-284. DOI:10.1016/J.procbio.2020.11.027.
[16] SUN Lihui, YU Feng, WANG Yuying, et al. Effects of ultrasound extraction on the physicochemical and emulsifying properties of rice bran protein[J]. International Journal of Food Engineering, 2021, 17(5): 327-335. DOI:10.1515/ijfe-2019-0115.
[17] LI Yufeng, ZENG Qiaohui, LIU Guang, et al. Effects of ultrasoundassisted basic electrolyzed water (BEW) extraction on structural and functional properties of Antarctic krill (Euphausia superba) proteins[J]. Ultrasonics Sonochemistry, 2021, 71: 105364. DOI:10.1016/j.ultsonch.2020.105364.
[18] ZHAO Xue, CHEN Xing, HAN Minyi, et al. Application of isoelectric solubilization/precipitation processing to improve gelation properties of protein isolated from pale, soft, exudative (PSE)-like chicken breast meat[J]. LWT-Food Science and Technology, 2016, 72: 141-148. DOI:10.1016/j.lwt.2016.04.045.
[19] LI Ke, KANG Zhuangli, ZHAO Yingying, et al. Use of high-intensity ultrasound to improve functional properties of batter suspensions prepared from PSE-like chicken breast meat[J]. Food and Bioprocess Technology, 2014, 7(12): 3466-3477. DOI:10.1007/s11947-014-1358-y.
[20] ZOU Ye, BIAN Huan, LI Pengpeng, et al. Optimization and physicochemical properties of nutritional protein isolate from pork liver with ultrasound-assisted alkaline extraction[J]. Animal Science Journal, 2018, 89(2): 456-466. DOI:10.1111/asj.12930.
[21] WANG Feng, ZHANG Yizhong, XU Ling, et al. An efficient ultrasound-assisted extraction method of pea protein and its effect on protein functional properties and biological activities[J]. LWTFood Science and Technology, 2020, 127: 109348. DOI:10.1016/j.lwt.2020.109348.
[22] 赵颖颖, 李三影, 田金凤, 等. 超声波对不同盐浓度下肌原纤维蛋白溶解性的影响[J]. 食品与发酵工业, 2021, 47(7): 197-202. DOI:10.13995/j.cnki.11-1802/ts.024905.
[23] ZHANG Ziye, REGENSTEIN J M, ZHOU Peng, et al. Effects of high intensity ultrasound modification on physicochemical property and water in myofibrillar protein gel[J]. Ultrasonics Sonochemistry, 2016, 34: 960-967. DOI:10.1016/j.ultsonch.2016.08.008.
[24] FENG Meiqin, PAN Lihua, YANG Xue, et al. Thermal gelling properties and mechanism of porcine myofibrillar protein containing flaxseed gum at different NaCl concentrations[J]. LWT-Food Science and Technology, 2018, 87: 361-367. DOI:10.1016/j.lwt.2017.09.009.
[25] ZHAO Xue, WU Tao, XING Tong, et al. Rheological and physical properties of O/W protein emulsions stabilized by isoelectric solubilization/precipitation isolated protein: the underlying effects of varying protein concentrations[J]. Food Hydrocolloids, 2019, 95: 580-589. DOI:10.1016/j.foodhyd.2018.03.040.
[26] LI Wanying, YANG Huirong, COLDEA T E, et al. Modification of structural and functional characteristics of brewer’s spent grain protein by ultrasound assisted extraction[J]. LWT-Food Science and Technology, 2021, 139: 110582. DOI:10.1016/j.lwt.2020.110582.
[27] MAITY I, RASALE D B, DAS A K. Sonication induced peptideappended bolaamphiphile hydrogels for in situ generation and catalytic activity of Pt nanoparticles[J]. Soft Matter, 2012, 8(19): 5301-5308. DOI:10.1039/c2sm25126d.
[28] ZOU Ye, LI Pengpeng, ZHANG Kun, et al. Effects of ultrasoundassisted alkaline extraction on the physiochemical and functional characteristics of chicken liver protein isolate[J]. Poultry Science, 2017, 96(8): 2975-2985. DOI:10.3382/ps/pex049.
[29] YU Xiaoxi, GOUYO T, GRIMI N, et al. Ultrasound enhanced aqueous extraction from rapeseed green biomass for polyphenol and protein valorization[J]. Comptes Rendus Chimie, 2016, 19(6): 766-777. DOI:10.1016/j.crci.2016.03.007.
[30] ZOU Ye, XU Pingping, WU Haifeng, et al. Effects of different ultrasound power on physicochemical property and functional performance of chicken actomyosin[J]. International Journal of Biological Macromolecules, 2018, 113: 640-647. DOI:10.1016/j.ijbiomac.2018.02.039.
[31] 李可, 李三影, 扶磊, 等. 低频高强度超声波对鸡胸肉肌原纤维蛋白性质的影响[J]. 食品科学, 2020, 41(23): 122-129. DOI:10.7506/spkx1002-6630-20191205-067.
[32] TANG Chuanhe, WANG Xiaoyan, YANG Xiaoquan, et al. Formation of soluble aggregates from insoluble commercial soy protein isolate by means of ultrasonic treatment and their gelling properties[J]. Journal of Food Engineering, 2009, 92(4): 432-437. DOI:10.1016/j.jfoodeng.2008.12.017.
[33] AMIRI A, SHARIFIAN P, SOLTANIZADEH N. Application of ultrasound treatment for improving the physicochemical, functional and rheological properties of myofibrillar proteins[J]. International Journal of Biological Macromolecules, 2018, 111: 139-147. DOI:10.1016/j.ijbiomac.2017.12.167.
[34] 王怡婷, 杨恒, 张新笑, 等. 超声波辅助提取鹅肝蛋白质及其物化性质和结构[J]. 江苏农业科学, 2019, 47(18): 240-246. DOI:10.15889/j.issn.1002-1302.2019.18.053.
[35] 尹艺霖, 刘学军. 不同超声功率处理对鲢鱼肌原纤维蛋白理化特性及凝胶品质的影响[J]. 肉类研究, 2019, 33(3): 14-19. DOI:10.7506/rlyj1001-8123-20190121-017.
[36] 李长乐, 武雅琴, 王莉莎, 等. 超声波及超声波结合酸处理优化鲣鱼肌原纤维蛋白功能特性[J]. 食品与发酵工业, 2019, 45(3): 123-127. DOI:10.13995/j.cnki.11-1802/ts.017678.
[37] XUE Siwen, XU Xinglian, SHAN Huimin, et al. Effects of highintensity ultrasound, high-pressure processing, and high-pressure homogenization on the physicochemical and functional properties of myofibrillar proteins[J]. Innovative Food science and Emerging Technologies, 2017, 45: 354-360. DOI:10.1016/j.ifset.2017.12.007.
[38] ZHANG Chao, LI Xiangao, WANG Hao, et al. Ultrasoundassisted immersion freezing reduces the structure and gel property deterioration of myofibrillar protein from chicken breast[J]. Ultrasonics Sonochemistry, 2020, 67: 105137. DOI:10.1016/j.ultsonch.2020.105137.