克氏原螯虾(Procambarus clarkii),俗称小龙虾,其风味独特、肉质鲜美,因其高蛋白、低脂肪、低热量的特性,被称为优质水产品,备受广大消费者青睐。虾肉蛋白中含有多种人体所需的必需氨基酸,如色氨酸、苯丙氨酸、赖氨酸、异亮氨酸、缬氨酸、苏氨酸及少量精氨酸[1]。此外,虾黄具有蟹黄味,尤其富含人体所需的钙、磷、铁3 种微量矿物元素,是一种营养较高的动物性食品[2]。
目前生产克氏原螯虾的贮藏方式主要是低温冷藏和低温冷冻保存,这些加工产品的贮藏及运输过程需要长期保持低温冷链,成本相对较高,限制了其加工市场的进一步健康发展[3]。而真空冷冻干燥工艺是采用低温冷冻脱水的食品加工新技术,能够尽可能保留食品的色、香、味,也可以最大程度保持产品质量,延长产品保质期[4]。林丰等[5]研究发现,经真空冷冻干燥的南极磷虾制品的鲜味氨基酸含量最高且风味独特;真空冷冻干燥制品及热风干燥制品风味接近,蛋白质变性及脂肪氧化所产生的挥发性物质相类似。陈学玲等[6]对新鲜武昌鱼进行真空冷冻干燥处理,能够使其保持风味的同时又保持了营养价值。
虾中还包含丰富的氨基酸、肽和蛋白质,风味独特。与熟虾香味有关的挥发性化学成分主要包括烷基、吡嗪和其他含硫化合物。Vejaphan等[7]使用动态顶空-气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)-香气嗅闻评价技术鉴别煮熟的红尾沼泽克氏原螯虾肉中具有挥发性嗅感风味的主要成分,鉴定出70 种化合物,分别呈现出青草味、木头味、黄油味和金属味等;王芝妍等[8]通过顶空固相微萃取(solid phase microextraction,SPME)-GC-MS结合相对气味活度值对虾肉嗅感气味成分进行分析,结果表明,虾肉气味的主体贡献者为醇类和酮类。虾内脏和头部能产生大量挥发性风味化合物。Tanchotikul等[9]用动态顶空和GC-MS方法鉴别分析克氏原螯虾肝胰脏中挥发性风味成分,共鉴定出117 种挥发性风味成分,呈坚果香、青草香、甜的水果香;解万翠等[10]认为,新鲜虾头中含氮化合物含量较高(19.58%),造成新鲜虾头明显的腥味和天然特征风味,此外,虾头中还可能含有醛类化合物、呋喃化合物、含硫化合物及其他未知化合物,构成鲜虾头复杂的天然特色风味。近年来,对虾肝胰腺的研究应用逐渐增多。朱志伟等[11]用内源蛋白酶、调味酶和碱性蛋白酶酶解虾头,不同程度提高了酶解产物中各种游离氨基酸的含量。汤丹剑等[12]用虾头作为原料,采用AS1.398中性蛋白酶生产虾味调味品;刘树青等[13]选用小型毛虾经蛋白酶消化水解,制备低盐度虾酱。孙俊华等[14]选用克氏原螯虾头,采用复合酶法加工制备小龙虾味酱油。
目前,我国针对冻干克氏原螯虾风味变化的深入研究还很少。基于此,本研究以克氏原螯虾为研究对象,通过电子鼻、GC-MS、GC-离子迁移谱(ion mobility spectrometry,IMS)及游离氨基酸测定,为克氏原螯虾的风味研究及其风味产品的开发提供实验依据。
1 材料与方法
1.1 材料与试剂
鲜活克氏原螯虾,购于湖北省武汉市武商量贩农科院店。
氯化钠、三氯乙酸、氢氧化钠(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
7890A-5975C GC-MS仪 美国Agilent Techologies公司;PEN3电子鼻 德国Airsense公司;FiveEosy pH计瑞士Mettler Toledo公司;KQ5200DE超声波清洗器昆山市超声仪器有限公司;TGL-24MC台式高速冷冻离心机 长沙平凡仪器仪表有限公司;GD系列冷冻干燥机(15 m) 江阴市新申宝科技有限公司;L-8900氨基酸自动分析仪 日本日立公司;FlavourSpec®食品风味分析与质量控制系统(配Laboratory Analytical Viewer(LAV)分析软件及3 款插件以及GC×IMS Library Search) 山东海能科学仪器有限公司。
1.3 方法
1.3.1 克氏原螯虾预处理
挑选质量20~25 g/只、鲜活的克氏原螯虾放置于碎冰中,1 h内运回实验室;清水清洗,抽取虾线、用刷子将克氏原螯虾刷洗干净,最后用蒸馏水清洗。
生虾:将预处理后的克氏原螯虾脱壳,虾肉与虾黄分别置于已预冷的盘中保存,于冷冻干燥机中干燥48 h,取出放置于干燥器中待用。
熟制虾:将预处理后的克氏原螯虾放置于蒸笼中,大火蒸制10 min(蒸汽上升时开始计时),冷却至室温,脱壳,虾肉与虾黄分别置于已预冷的盘中保存,于冷冻干燥机中干燥48 h,取出放置于干燥器中待用。
生物学指数及尾肉基本营养成分测定使用鲜虾,电子鼻、SPME-GC-MS、GC-IMS分析及游离氨基酸含量测定使用冻干粉。
1.3.2 生物学指数测定
尾肉指数、钳肉指数、肝胰腺指数及可食部位得率分别按式(1)~(4)计算。

1.3.3 尾肉基本营养成分测定
水分含量测定:参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》;脂肪含量测定:参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》;蛋白质含量测定:参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》;灰分含量测定:参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》。
1.3.4 电子鼻测定
准确称取虾肉和虾肝胰腺各0.2 g,加入2 mL 0.18 g/mL NaCl,置于50 mL进样瓶中。为保证结果可靠性,每个样品分别制备3 个平行样。
顶空平衡温度35 ℃,顶空平衡时间30 min。采用PEN3型便携式电子鼻对样品进行检测。电子鼻测定条件:清洗时间100 s,测定时间120 s,特征值提取时间设定为116~120 s,对特征时间段内的信息进行主成分分析(principal component analysis,PCA)。
1.3.5 SPME-GC-MS测定挥发性物质
参考林丰[5]的方法并加以修改。准确称取虾肉和虾肝胰腺各0.2 g,加入2 mL 0.18 g/mL NaCl,置于20 mL顶空瓶中,于45 ℃磁力搅拌水浴锅中平衡10 min,用已活化好的50/30 μm DVB/CAR/PDMS萃取头顶空吸附40 min。待吸附完毕后,取出插入GC-MS进样口解吸5 min。为保证结果可靠性,每个样品分别制备3 个平行样。
GC条件:DB-1 ms弹性石英毛细管柱(30 m×0.25 mm,0.25 μm),He流量1.0 mL/min,不分流模式进样,进样口温度250 ℃。起始柱温45 ℃,保持2 min,10 ℃/min升温至100 ℃,5 ℃/min升温至200 ℃,8 ℃/min升温至250 ℃,保持5 min。
MS条件:接口温度280 ℃,离子源温度230 ℃,四极杆温度150 ℃;离子化方式:电子轰击电离;电子能量70 eV,质量范围35~350 u。
定性分析:经GC分离后,不同组分形成各自的色谱峰,用GC-MS仪进行分析鉴定。分析结果运用计算机谱库(NIST08)进行初步检索,再结合文献确认挥发性物质的化学组成。
1.3.6 GC-IMS测定
参考王辉等[15]的方法并加以修改。准确称取虾肉和虾肝胰腺各1.0 g,加入5 mL 0.2 g/mL NaCl,置于20 mL顶空瓶中。为保证结果可靠性,每个样品分别制备3 个平行样。
自动顶空进样条件:进样体积200 μL,孵育时间15 min,孵育温度35 ℃,进样针温度85 ℃,孵化转速500 r/min。
GC-IMS条件:FS-SE-54-CB-1色谱柱(15 m×0.53 mm);色谱柱温度60 ℃,载气/漂移气为N2,IMS温度45 ℃,分析时间20 min。
仪器配套的分析软件包括LAV和3 款插件(Reporter插件、Gallery Plot插件、Dynamic PCA插件)以及GC×IMS Library Search(应用软件内置的NIST数据库和IMS数据库可对物质进行定性分析)。LAV:用于查看分析谱图,图中每一个点代表一种挥发性有机物,对其建立标准曲线后可进行定量分析;Reporter插件:直接对比样品间的谱图差异(二维俯视图和三维谱图);Gallery Plot插件:进行指纹图谱对比,直观且定量比较不同样品间挥发性有机物差异;Dynamic PCA插件:动态主成分分析,用于样品聚类分析及快速确定未知样品种类。利用上述软件和插件可以分别从不同角度进行样品分析。
1.3.7 游离氨基酸含量测定
准确称取虾肉和虾肝胰腺各0.2 g,参考付娜等[16]的方法并稍作修改测定游离氨基酸含量。
1.4 数据处理
实验数据使用Excel软件进行处理,采用DPS进行差异显著性分析和相关性分析,用Origin 2017软件作图。
2 结果与分析
2.1 克氏原螯虾生物学指数与尾肉基本营养成分
虾肉(尾肉、钳肉)和肝胰腺是克氏原螯虾中最重要的可食部位。由图1可知,生、熟克氏原螯虾总可食部位得率分别达18.71%和23.57%,熟虾的总可食部位得率显著高于生虾(P<0.05),主要差别在于钳肉指数,而生、熟克氏原螯虾尾肉指数和肝胰腺指数均无显著差异。若不考虑生熟因素,克氏原螯虾的尾肉和肝胰腺质量占总可食组织质量70%以上,其饱满程度直接影响克氏原螯虾的食用价值和经济价值。因此,尾肉和肝胰腺2 个可食组织将作为重点研究对象。由表1可知,克氏原螯虾尾肉的水分与蛋白质含量分别达81.01、16.07 g/100 g,由此可见,克氏原螯虾属于高蛋白、低脂肪的高营养特色水产品[17]。脂肪和蛋白质是动物源食品中重要的风味前体物质,其在加热过程中容易形成醛酮类香气物质[18];因此尾肉、肝胰腺可能是克氏原螯虾香气物质的主要来源。

图1 生、熟克氏原螯虾生物学指数
Fig. 1 Biological index of raw and cooked crayfish
表1 克氏原螯虾尾肉基本营养成分
Table 1 Basic nutrients of crayfish tail meat
营养成分 水分 脂肪 蛋白质 灰分含量/(g/100 g) 81.01±0.15 0.51±0.06 16.07±0.74 1.01±0.03
2.2 电子鼻测定结果
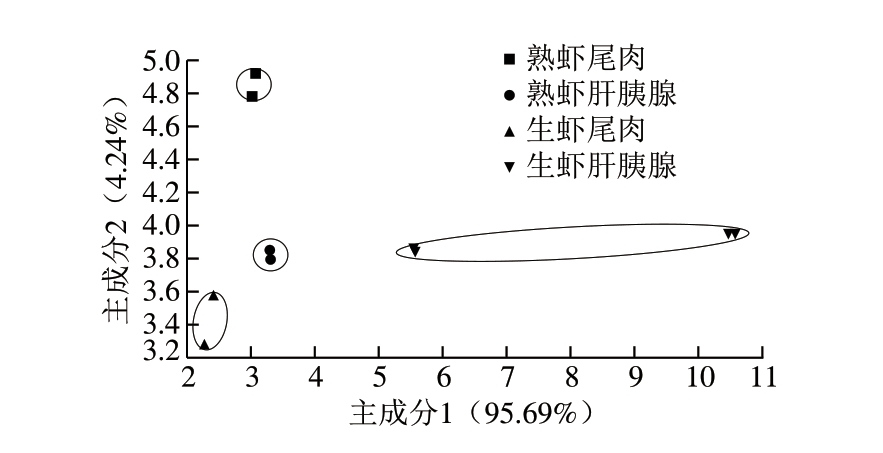
图2 不同部位克氏原螯虾蒸制前后PCA结果
Fig. 2 PCA analysis of tail meat and hepatopancreas before and after steaming
PCA是将电子鼻10 个传感器提取的样品信息进行数据转换和降维处理,并对处理结果进行线性分类后在坐标上形成一个二维散点图[19]。由图2可知,第1主成分(PC1)的贡献率为95.69%,第2主成分(PC2)的贡献率为4.24%,2 种主成分累计贡献率达到99.93%,说明样品整体差异性信息在该主成分平面上展示较为充分。冻干后的生、熟克氏原螯虾尾肉和肝胰腺共4 个样品,平行样形成的区域无重叠,说明4 个样品均有各自的气味特征,其中冻干生虾尾肉和肝胰腺所形成的区域较为分散,说明生虾尾肉和肝胰腺气味差异较大,这可能是组成成分差异导致气味不同;而肝胰腺生熟样品间的差异远大于尾肉生熟样品间的差异,这可能是由于肝胰腺经过热氧化降解生成了新的风味物质[20]。
2.3 克氏原螯虾蒸制前后挥发性物质测定结果
表2 不同部位克氏原螯虾蒸制前后挥发性物质的变化
Table 2 Changes in volatile substances of tail meat and hepatopancreas before and after steaming

挥发性物质 峰面积(×10)生虾肝胰腺 生虾尾肉 熟虾肝胰腺 熟虾尾肉苯甲醛 - - 58.28 14.87 3-甲基-2-丁烯醛 - - 9.13 -异戊醛 - - 2.44 -异戊烯醛 83.01 - - -反-2-戊烯醛 - - 19.81 -己醛 2 848.20 5.23 1 542.90 209.83庚醛 424.65 6.66 70.04 86.00(Z)-4-庚烯醛 34.45 - - -醛类 (E)-2-庚烯醛 123.22 - - -(E,E)-2,4-庚二烯醛 514.24 - 74.08 -反-2-辛烯醛 351.32 - 46.58 -壬醛 161.30 37.70 45.59 219.32反,顺-2,6-壬二烯醛 26.05 - - -癸醛 - - - 19.16反-2-癸烯醛 21.37 - - -反-2,4-癸二烯醛 40.63 - 1.12 -(E,E)-2,4-十一烷二烯醛 2.85 - - -2,6,6-三甲基-1-环己烯-1-羧醛 45.48 - 3.45 -小计 4 676.77 49.59 1 873.42 549.18醇类1-戊醇 213.14 2.58 - -正己醇 100.54 8.88 - -2-乙基己醇 - - 45.97 45.48 1-辛醇 - 5.09 - -异辛醇 - 59.35 - -1-辛烯-3-醇 1 547.10 - - -小计 1 860.78 75.90 45.97 45.48甲基壬基甲酮 8.22 - - -苯乙酮 - - - 9.63 6-甲基-2-庚酮 358.97 - - -3-辛酮 - 335.55 - 2 652.80 2,3-辛二酮 2.87 - 89.50 -2-壬酮 67.67 - - 13.70 α-紫罗酮 5.55 - - -β-紫罗兰酮 29.39 - 0.60 -小计 472.67 335.55 90.10 2 676.13正辛烷 255.78 0.52 - -4-甲基辛烷 - - - 8.08壬烷 102.05 - 2.80 -2-甲基壬烷 - - - 12.82癸烷 69.95 3.85 - -2-甲基癸烷 - - 10.31 2.55十一烷 89.58 2.93 - -3-甲基十一烷 36.96 2.69 13.83 11.96十二烷 22.91 1.70 7.16 6.91正十三烷 3.24 - - -十四烷 2.46 - 1.60 1.50十五烷 5.13 2.34 1.52 2.60烃类 环辛四烯 - - - 30.09 1-十二烯 14.60 - 3.95 -右旋萜二烯 - 47.43 13.95 27.66酮类6
续表1
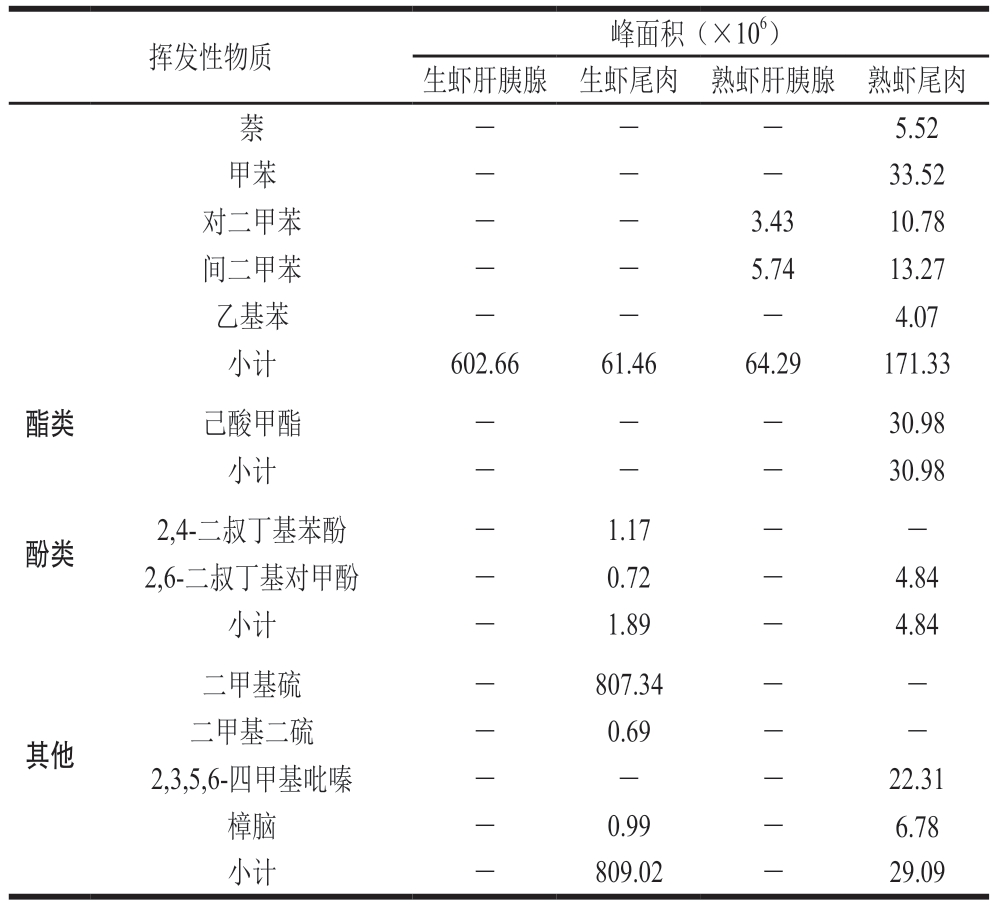
注:-. 未检出。
挥发性物质 峰面积(×106)生虾肝胰腺 生虾尾肉 熟虾肝胰腺 熟虾尾肉萘--- 5.52甲苯 - - - 33.52对二甲苯 - - 3.43 10.78间二甲苯 - - 5.74 13.27乙基苯 - - - 4.07小计 602.66 61.46 64.29 171.33酯类 己酸甲酯 - - - 30.98小计 - - - 30.98酚类 2,4-二叔丁基苯酚 - 1.17 - -2,6-二叔丁基对甲酚 - 0.72 - 4.84小计 - 1.89 - 4.84其他二甲基硫 - 807.34 - -二甲基二硫 - 0.69 - -2,3,5,6-四甲基吡嗪 - - - 22.31樟脑 - 0.99 - 6.78小计 - 809.02 - 29.09
由表2可知,经冷冻干燥后熟制前后克氏原螯虾尾肉和肝胰腺共检出59 种挥发性物质,其中醛类18 种、醇类6 种、酮类8 种、烃类20 种、酯类1 种、酚类2 种、其他化合物4 种。克氏原螯虾肝胰腺和尾肉中含有少量共同风味物质,且生虾肝胰腺中挥发性物质种类和含量远高于生虾尾肉。克氏原螯虾尾肉中共检出20 种挥发性物质,熟制后共检出27 种,说明尾肉熟制可以使克氏原螯虾风味物质更加丰富;己醛、庚醛、壬醛、3-辛酮、少量烷烃等原有挥发性物质含量升高,而这些醛、酮和烷烃是脂类热降解的产物,这些产物赋予食品不同的风味[21]。此外,癸醛、苯乙酮、己酸甲酯、2,3,5,6-四甲基吡嗪等化合物仅在熟制克氏原螯虾尾肉中检出,酯类的种类及含量较少,但它们大多能使食品带有清甜的果香味[22]。吡嗪类是加热过程中容易产生的一类物质,香味特征是坚果香和烘烤香。在热加工食品中吡嗪类通过氨基酸Strecker反应生成[23]。
生虾肝胰腺中共检出32 种挥发性物质,熟制后共检出24 种,熟制后挥发性物质种类减少,含量大部分降低,主要有己醛、庚醛、壬醛、烷烃等,这可能是因为原有的一些挥发性物质熟制后降解成为小分子物质,也有可能是与其他物质发生了进一步反应[24]。醛类物质阈值一般较低,但对总体气味特征有较重要的作用[25-28]。苯甲醛、芳香烃类化合物仅存在于熟制克氏原螯虾中,苯甲醛的气味特征是具有苦杏仁和坚果香气[29],而苯甲醛也是克氏原螯虾熟制后具有特殊香气的重要来源之一,克氏原螯虾熟制后的风味是尾肉和肝胰腺加和作用产生的贡献。
2.4 克氏原螯虾蒸制前后GC-IMS测定结果
由图3可知:冻干生虾尾肉中挥发性有机物较少,熟制后挥发性有机物种类变多、部分含量升高;冻干生虾肝胰腺中挥发性有机物相对较多,熟制后挥发性有机物种类减少、部分含量降低;虾肝胰腺中挥发性有机物种类远大于虾肉,与GC-MS的结论一致。
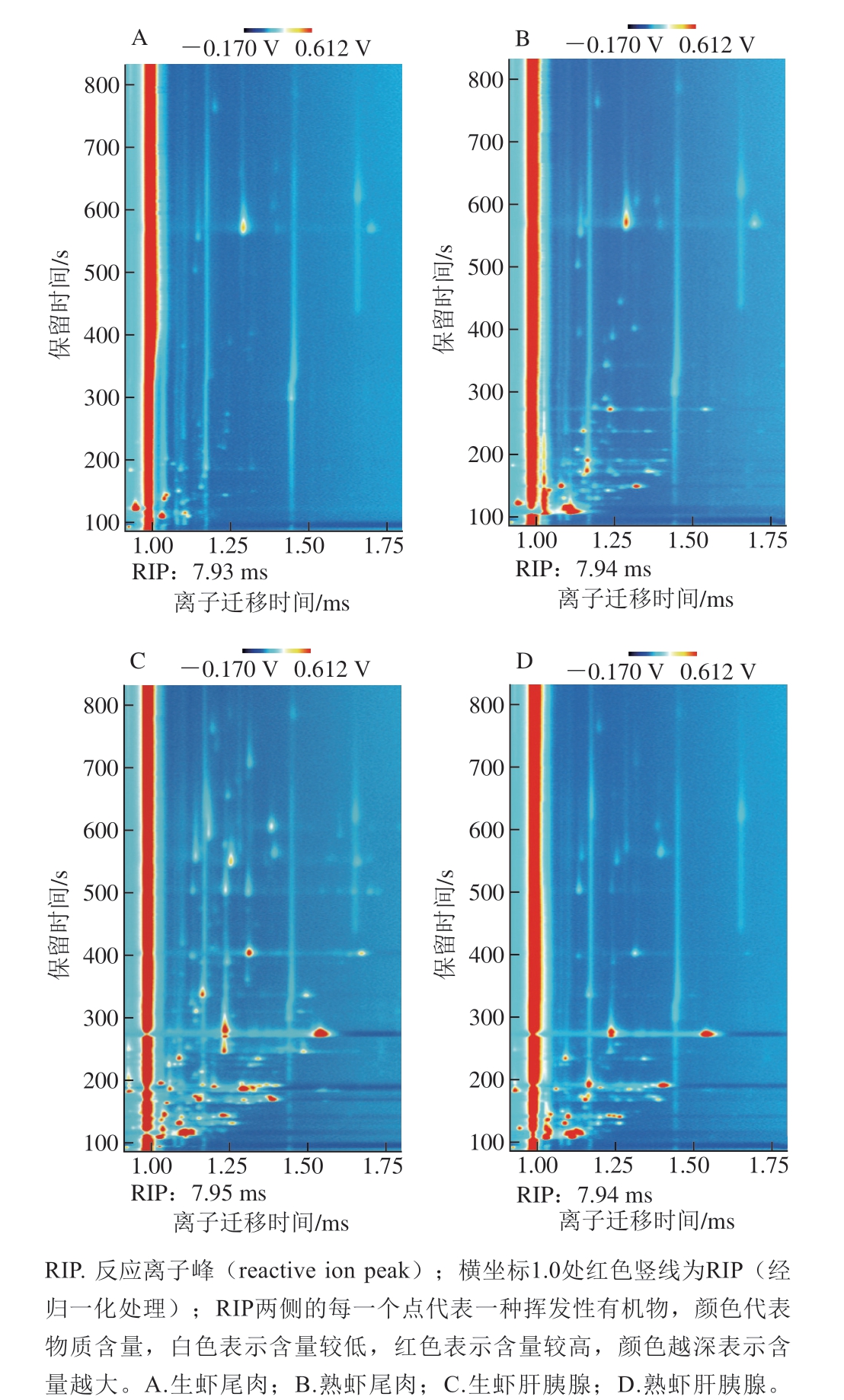
图3 克氏原螯虾不同部位蒸制前后GC-IMS谱图
Fig. 3 GC-IMS spectra of tail meat and hepatopancreas before and after steaming
图4 为FlavourSpec®系统自带LAV软件内置的Gallery Plot插件筛选出的具有明显变化规律的81 种挥发性有机物的离子峰图库[15],每行代表1 个样品中选取的全部信号峰,每列代表同一挥发性有机物在不同样品中的信号峰。由图4可知,每种样品的完整挥发性有机物信息及样品之间挥发性有机物存在差异。冻干生虾尾肉中挥发性有机物种类及含量较少,熟制后出现新的风味物质,并且一些原有物质含量升高,如图中1号区域,这些物质主要包括乙酸乙酯、丁酸甲酯和3-辛酮等,说明虾肉加热变熟后可以使克氏原螯虾的风味物质更加丰富;冻干生虾肝胰腺和生虾尾肉含有少量共同的风味成分,生虾肝胰腺中挥发性有机物的种类和含量远高于尾肉;观察2号区域发现,肝胰腺熟制后挥发性有机物种类和含量大部分降低,这些物质主要包括己醛、3-甲基丁醛、2-丁酮、甲基丙醛、2-己酮、庚醛、反-2-己醛、戊醇、2,3-丁二酮、1-辛烯-3-酮和2-乙基呋喃等醛类、酮类以及少量醇类和呋喃等风味物质;观察3号区域可看出,肝胰腺制熟后使得少量物质含量升高,主要包括乙醇、丙醛、丁醛和戊醛等。

图4 GC-IMS谱图中选取的挥发性有机物Gallery Plot图
Fig. 4 Gallery plot of selected volatile organic compounds in GC-IMS spectra
2.5 克氏原螯虾蒸制前后游离氨基酸组成测定结果
表3 克氏原螯虾蒸制前后游离氨基酸含量变化
Table 3 Changes in free amino acid content tail meat and hepatopancreas before and after steaming mg/g

注:*. 呈味氨基酸;#. 必需氨基酸;+. 呈味强度,+越多呈味强度越大;-. 无味;ND. 未检出。
游离氨基酸 味道特征[30] 生虾肝胰腺 生虾尾肉 熟虾肝胰腺 熟虾尾肉天冬氨酸(Asp)* 鲜(+++)/甜(+++) 1.02±0.10 0.20±0.01 1.81±0.23 1.48±0.20苏氨酸(Thr)# 甜(+++)/苦(+) 8.67±0.02 46.02±5.18 9.27±1.44 5.32±0.69丝氨酸(Ser) 甜(+++)/鲜(+) 3.35±0.12 5.40±0.37 2.76±0.11 2.73±0.21谷氨酸(Glu)* 酸(+++)/鲜(+++) 5.51±0.32 2.60±0.16 8.51±0.80 3.89±0.39丙氨酸(Ala)* 甜(+++) 6.74±0.54 9.34±0.73 9.53±1.12 5.46±0.41甘氨酸(Gly)* 甜(+++) 5.45±0.20 15.39±1.23 11.01±0.78 8.88±0.93半胱氨酸(Cys) - 0.35±0.02 0.13±0.03 ND ND缬氨酸(Val)# 甜(+)/苦(+++) 3.06±0.22 3.92±0.28 2.65±0.41 1.79±0.19甲硫氨酸(Met) 苦(+)/甜(+) 1.65±0.22 4.60±0.39 0.86±0.31 3.39±0.34异亮氨酸(Ile)# 苦(+++) 2.26±0.10 3.43±0.29 0.80±0.19 1.04±0.11亮氨酸(Leu)# 苦(+++) 4.56±0.20 6.04±0.56 1.67±0.33 1.75±0.13酪氨酸(Tyr)* 苦(+) 5.66±1.44 1.78±0.23 7.03±0.83 3.64±0.41苯丙氨酸(Phe)*# 苦(+++) 4.20±0.55 1.39±0.13 3.55±0.48 1.80±0.16赖氨酸(Lys)# 甜(++)/苦(++) 5.97±0.46 10.00±0.82 2.53±0.65 2.20±0.10组氨酸(His)# 苦(++) 1.69±0.10 5.90±0.45 2.28±0.19 2.60±0.30精氨酸(Arg) 苦(+++)/甜(+++) 16.57±1.20139.55±10.7252.45±3.71190.39±20.54脯氨酸(Pro) 甜(+++)/苦(+++) 2.23±0.18 3.21±0.20 2.92±0.57 1.15±0.16游离氨基酸总量 78.94 258.90 119.63 237.51
克氏原螯虾口感鲜美,与游离氨基酸存在很大关系,游离氨基酸是重要的呈味和香味前体物质。游离氨基酸分为鲜、甜、苦3 类,鲜味氨基酸包括天冬氨酸和谷氨酸,甜味氨基酸包括苏氨酸、丝氨酸、丙氨酸、甘氨酸和脯氨酸,苦味氨基酸包括半胱氨酸、缬氨酸、甲硫氨酸、异亮氨酸、亮氨酸、苯丙氨酸、酪氨酸、组氨酸和精氨酸。
甘氨酸、丙氨酸、精氨酸和脯氨酸都是呈味氨基酸,甘氨酸和丙氨酸具有舒适的甜味。由表3可知,苏氨酸、精氨酸、甘氨酸是克氏原螯虾体内含量最高的氨基酸,总体呈甜味。克氏原螯虾肝胰腺熟制后苏氨酸、精氨酸、甘氨酸含量均上升,甜味增强,而尾肉熟制后苏氨酸、甘氨酸含量下降,精氨酸含量上升,总体使得甜味变淡。克氏原螯虾尾肉和肝胰腺中精氨酸含量最高,与Okuma等[31]的研究较吻合。但克氏原螯虾尾肉熟制后苏氨酸含量下降至5.32 mg/g,精氨酸含量上升至190.39 mg/g,这可能是由于加热处理会导致含氮物质变化[30]。克氏原螯虾肝胰腺熟制后游离氨基酸总量明显升高,达119.63 mg/g,而尾肉熟制前后游离氨基酸总量相比肝胰腺熟制前后变化较小,但含量很高,达237.51 mg/g,这与基本营养成分中蛋白质的测定结果吻合,也说明克氏原螯虾经过熟制后,肝胰腺与尾肉共同作用产生良好口味。
3 结 论
生、熟克氏原螯虾均有其各自的气味特征,其中生虾尾肉中共检出20 种挥发性物质,制熟后共检出27 种挥发性物质;生虾尾肉所含挥发性有机物较少,熟制后挥发性有机物种类变多、含量升高。生虾肝胰腺中共检出32 种挥发性物质,熟制后共检出24 种;生虾肝胰腺所含挥发性有机物相对较多,熟制后挥发性有机物种类减少、含量降低;且肝胰腺所含挥发性有机物种类远大于尾肉。可能是由于多不饱和脂肪酸受热氧化和降解,产生不同的风味特征,且在熟制过程中发生美拉德反应和热解反应,产生独特风味。而肝胰腺熟制后使得游离氨基酸总量明显升高,说明熟制后虾的风味增强。
[1] 于晓慧. 即食小龙虾保鲜剂的复配及其抑菌机理的初步研究[D].合肥: 合肥工业大学, 2017: 1-2.
[2] 江杨阳. 小龙虾低温贮藏品质变化规律及其腐败菌鉴定[D]. 杭州:浙江大学, 2019: 8-9.
[3] 董志俭, 孙丽平, 唐劲松, 等. 不同干燥方法对小龙虾品质的影响[J]. 食品研究与开发, 2017, 38(24): 84-87. DOI:10.3969/j.issn.1005-6521.2017.24.017.
[4] 段振华. 水产品干燥技术研究[J]. 食品研究与开发, 2012, 33(5):213-216. DOI:10.3969/j.issn.1005-6521.2012.05.061.
[5] 林丰, 汪之和, 施文正, 等. 干燥方式对南极磷虾干制品风味成分的影响[J]. 上海农业学报, 2016, 32(5): 133-138. DOI:10.15955/j.issn1000-3924.2016.05.27.
[6] 陈学玲, 何建军, 程薇, 等. 武昌鱼真空冷冻升华干燥工艺的研究[J]. 湖北农业科学, 2006, 45(3): 367-369. DOI:10.3969/j.issn.0439-8114.2006.03.040.
[7] VEJAPHAN W, HSIEH C Y, WILLIAMS S S. Volatile flavor components from boiled crayfish (Procambarus clarkii) tail meat[J].Journal of Food Science, 1988, 53(6): 1666-1670. DOI:10.1111/j.1365-2621.1988.tb07811.x.
[8] 王芝妍, 官爱艳, 吕梁玉, 等. 超高压处理对中华管鞭虾虾肉风味的影响[J]. 食品科学, 2017, 38(18): 156-162. DOI:10.7506/spkx1002-6630-201718025.
[9] TANCHOTIKUL U, HSIEH C Y T. Volatile flavor components in crayfish waste[J]. Journal of Food Science, 2006, 54(6): 1515-1520.DOI:10.1111/j.1365-2621.1989.tb05149.x.
[10] 解万翠, 杨锡洪, 章超桦, 等. 顶空固相微萃取-气相色谱-质谱法测定北极虾虾头的挥发性成分[J]. 分析化学, 2011, 39(12): 1852-1857.DOI:10.3724/SP.J.1096.2011.01852.
[11] 朱志伟, 曾庆孝, 林奕封, 等. 虾头的内蛋白酶酶解及复合酶解研究[J].武汉工业学院学报, 2003, 22(2): 4-8.
[12] 汤丹剑, 吴汉民, 娄永江. 酶法制备虾头调味品的研究[J]. 浙江水产学院学报, 1998, 17(1): 19-25.
[13] 刘树青, 林洪. 酶法制备低盐虾酱的研究[J]. 海洋科学, 2003, 27(3):57-61. DOI:10.3969/j.issn.1000-3096.2003.03.013.
[14] 孙俊华, 郑婵卿, 黄志良. 酶法制造虾味酱油[J]. 中国调味品,1999(6): 14-16.
[15] 王辉, 田寒友, 李文采, 等. 基于顶空气相色谱-离子迁移谱技术的冷冻猪肉贮藏时间快速判别方法[J]. 食品科学, 2019, 40(2): 269-274.DOI:10.7506/spkx1002-6630-20180531-443.
[16] 付娜, 王锡昌. 电子舌分析和感官评价在游离氨基酸对中华绒螯蟹整体滋味贡献评价中的研究[J]. 食品工业科技, 2014, 35(20): 91-96.DOI:10.13386/j.issn1002-0306.2014.20.011.
[17] 贺江, 易梦媛, 郝涛, 等. 小龙虾产品品质影响因素研究进展[J]. 食品与机械, 2019, 35(6): 232-236.
[18] 吴娜. 基于脂质热氧化降解解析中华绒螯蟹关键香气物质的形成机制[D]. 上海: 上海海洋大学, 2017: 17-18.
[19] 刘寿春, 钟赛意, 李平兰, 等. 基于电子鼻技术判定冷鲜罗非鱼片品质劣变进程[J]. 食品科学, 2012, 33(20): 189-195.
[20] 倪逸群, 吴娜, 王锡昌. 雌性中华绒螯蟹蒸制过程中肝胰腺脂质与挥发性风味物质形成的关联性分析[J]. 食品科学, 2017, 38(2):127-132. DOI:10.7506/spkx1002-6630-201702021.
[21] MOTTRAM D S. Flavour formation in meat and meat products: a review[J]. Food Chemistry, 1998, 62(4): 415-424. DOI:10.1016/S0308-8146(98)00076-4.
[22] 张娜, 袁信华, 过世东, 等. 中华绒螯蟹挥发性物质的研究[J]. 食品与发酵工业, 2008, 34(3): 141-144; 148.
[23] 金燕. 蟹肉风味的研究[D]. 杭州: 浙江工商大学, 2011. DOI:10.7666/d.Y1862381.
[24] FRANKEL E N. Volatile lipid oxidation products[J]. Progress in Lipid Research, 1983, 22(1): 1-33. DOI:10.1016/0163-7827(83)90002-4.
[25] XIE Jianchun, SUN Baoguo, ZHENG Fuping, et al. Volatile flavor constituents in roasted pork of Mini-pig[J]. Food Chemistry, 2008,109(3): 506-514. DOI:10.1016/j.foodchem.2007.12.074.
[26] SHAHIDI F, BOTTA J R. Seafoods: chemistry, processing technology and quality[M]. Boston: Springer, 1994: 320-334. DOI:10.1007/978-1-4615-2181-5.
[27] KIM H J, MIN D B. Chemistry of lipid oxidation[M]. Boston:Springer, 1999: 175-189. DOI:10.1007/978-1-4615-4693-1_16.
[28] FARMER L J, MCCONNELL J M, GRAHAM W D. Flavor characteristics and lipid composition of Atlantic salmon[M]//SHAHIDI F,CADWALLADER K R. Flavor and lipid chemistry of seafoods. 1997:95-109. DOI:10.1021/bk-1997-0674.ch010.
[29] BAUER K, GARBE D, SURBURG H. Front matter and index[M]//SURBURG H, PANTEN J. Common fragrance and flavor materials:preparation, properties and uses. 4th Edition. Weinheim: Wiley-VCH Verlag GmbH & Co. KGaA, 2001. DOI:10.1002/3527600205.fmatter_indsub.
[30] 姜慧娴, 张瑞娟, 焦阳, 等. 加热方式对南美白对虾和南极磷虾虾肉糜中的游离氨基酸含量的影响[J]. 食品工业科技, 2019, 40(11):241-248.
[31] OKUMA E, FUJITA E, AMANO H, et al. Distribution of free D-amino acids in tissues of crustaceans[J]. Fisheries Science, 1995, 61(1): 157-160.