酱卤肉制品是一类以畜禽肉及其副产品为原料,经煮制调味等工艺加工而成的中式传统肉制品[1],其加工的关键在于卤煮和调味。酱卤肉制品在加工过程中常产生一类致癌、致突变性的多环芳香族化合物——杂环胺(heterocyclic aromatic amines,HAAs),HAAs普遍产生于蛋白质含量丰富的食品经高温油炸、煎烤或长时间烹调等加工过程[2]。酱卤肉制品是在温度相对较低(<100 ℃)的条件下进行加工,卤煮虽是较温和的加热过程,但研究发现酱卤肉制品在经过反复长时间的卤煮后,其总HAAs含量会提高1~3 个数量级[3],且形成的HAAs种类及数量区别于煎炸、烘烤等高温处理肉制品。
20世纪70年代末,人们在烤鱼和烤牛肉炭化表层中发现了HAAs。至今在各类烹调食品中发现并分离鉴定出的HAAs己超过30 种[4]。国际癌症研究机构基于长期的动物实验分析将HAAs分为人类可能致癌物(2A级)及人类潜在致癌物(2B级)两大类。流行病学研究发现,长期摄入HAAs会造成人体多种组织和器官的损坏,甚至诱发结肠[5]、胰腺[6]、前列腺[7]、乳腺[8]、输尿管[9]等靶器官的癌变,增加阿尔兹海默症[10]的患病风险。同时研究发现,HAAs的致突变能力极强,是亚硝酸盐、黄曲霉毒素B1和苯并芘的数十倍甚至数百倍以上[7]。但烹调肉制品中HAAs结构复杂,且仅以痕量水平存在,因此高效、准确地分离、检测HAAs,对HAAs的研究分析至关重要。
本文系统综述酱卤肉制品中HAAs的形成机理、影响因素及分离检测肉制品中HAAs的技术手段,为抑制酱卤肉制品实际生产加工中HAAs的形成以及快速、准确检测HAAs提供一定的参考。
1 酱卤肉制品中HAAs的形成机理
HAAs可分为热反应型HAAs(氨基咪唑氮杂芳烃类)和热解型HAAs(氨基咔啉类)2 种,热反应型HAAs通常形成于典型烹饪/油炸温度下(200 ℃),而热解型HAAs通常在高于250 ℃的温度下通过分解氨基酸和蛋白质形成[11-12]。
1.1 氨基咪唑氮杂芳烃类HAAs形成机理
不同的氨基咪唑氮杂芳烃化学结构相似,都存在咪唑环、吡啶或吡嗪环。氨基咪唑氮杂芳烃类HAAs包括咪唑喹啉类、咪唑喹喔类及咪唑吡啶类化合物。咪唑吡啶类化合物中的2-氨基-1-甲基-6-苯基-咪唑并[4,5-b]吡啶(2-amino-1-methyl-6-phenyl-imidazo[4,5-b]pyridine,PhIP)的形成途径早已明确(图1),而喹啉和喹喔啉类HAAs形成机制尚未完全明确,可能存在2 种途径:一种是羰基途径[13](图2),食品中含有的碳水化合物、脂质、氨基酸等可作为反应型羰基的主要来源,反应型羰基化合物趋向于进行环化和低聚,从而产生HAAs。反应型羰基的形成也有利于其他羰基的生成,为形成香味前体物质提供物质基础[14]。同时适当醛在含氨以及产生氨的化合物中会产生大量的吡啶、吡嗪类物质,肌酸酐的存在一定程度上能够提供生成吡啶、吡嗪类物质所需的氨[15]。吡啶环、吡嗪环的形成是咪唑喹啉类(imidazoquinoline,IQ)和咪唑喹喔啉类(imidazoquinoxaline,IQx)HAAs的重要区别,美拉德反应过程中α-二羰基化合物经Strecker降解产生吡嗪环[16],吡啶除在美拉德反应中被检测产生之外,脂质衍生的羰基胺反应中存在大量的活性羰基,此途径也能够形成吡啶,从而通过脂质的环化和低聚产生HAAs[17]。目前,具体的羰基种类对应形成的HAAs种类仍有待确定,但是充分了解食品中羰基的变化途径也将为进一步认识及抑制HAAs形成提供参考。喹啉和喹喔啉类HAAs形成的另一途径是自由基途径,因其完整的形成过程缺少步骤而存在一定的争议性,尚未得到证实,大致形成途径为美拉德反应生成吡啶和吡嗪自由基,它们与肌酐、相应醛可形成具有喹啉(IQ衍生物)或喹喔啉(IQx衍生物)结构的HAAs[18]。

图1 PhIP形成途径[11]
Fig. 1 Formation pathways of PhIP[11]
1.2 氨基咔啉类HAAs形成机理
肉制品中的热解型HAAs可由游离氨基酸、蛋白质等发生热解作用形成。大部分的热解型HAAs在温度高于250 ℃条件下产生,β-咔啉类HAAs产生条件对于温度的要求低于其他咔啉类HAAs(热降解HAAs),常出现在温度相对较低的肉类或肉制品加工过程中[7],可以通过低温长时间加工而大量产生。研究表明,酱卤肉制品中含量最多的HAAs为β-咔啉类HAAs,高出其余HAAs数倍到数十倍,由于β-咔啉类HAAs在Ames实验中没有表现出突出的致变性,虽然目前在食品行业未得到重视,但是仍具有间接致癌性[3],被世界卫生组织国际癌症研究机构列入2B类致癌物,β-咔啉类HAAs自身毒性不强,但是会作为辅助致突物,诱变增强其他有害物质的毒性,还会对神经组织造成一定毒性。
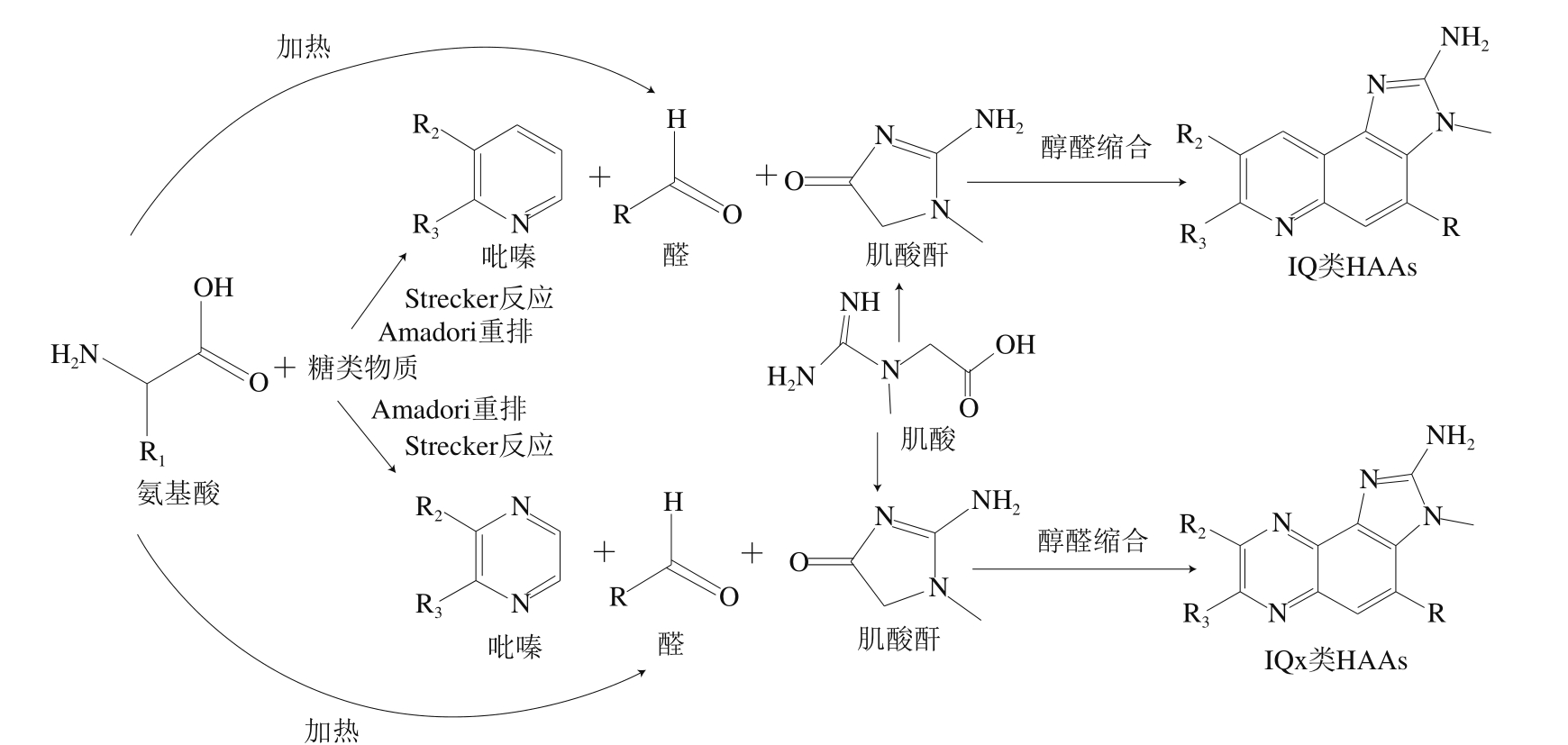
图2 IQ和IQx类HAAs形成途径[6]
Fig. 2 Formation pathways of IQ and IQx type HAAs[6]
β-咔啉类H A A s包括9 H-吡啶并[2,3-b]吲哚(9H-pyrido[4,3-b]indole,Norharman)、1-甲基-9H-吡啶并[2,3-b]吲哚(1-methyl-9H-pyrido[4,3-b]indole,Harman)2 种,其形成机制类似,目前Norharman的形成途径较为明确(图3),存在2 个主要形成途径:1)色氨酸先经过Amadori重排后脱水,其产物在环氧孤对电子存在的条件下发生β-消去反应,进而形成共轭的氧鎓离子,此反应中间体可通过进一步脱水和形成拓展的共轭体系稳定自身或C-C键断开后进行分子取代反应,最终形成β-咔啉类HAAs[6];2)β-咔啉可由色氨酸与乙醛或α-酮酸通过Pictet-Spengler反应形成四氢化-β-咔啉(tetrahydro-β-carbolines,THβC),再经进一步的氧化/脱羧或其他加工过程形成[3]。
2 酱卤肉制品中HAAs形成的影响因素
2.1 原料肉的脂肪与水分含量
目前研究发现,脂肪含量对HAAs的作用机制存在以下3 种观点:一是化学作用,脂肪氧化产生自由基参与美拉德反应,产生吡嗪、吡啶类物质,促进极性HAAs的形成[19];二是用物理因素来解释,脂肪为热传递介质,会影响传热效率,从而导致HAAs的含量变化[20];三是脂肪可以稀释前体物质,减少其互相接触的机会及面积,也可以影响HAAs的形成[21]。而水分的存在也能够一定程度上稀释前体物质,减少其相互接触机会,从而抑制HAAs形成[22]。
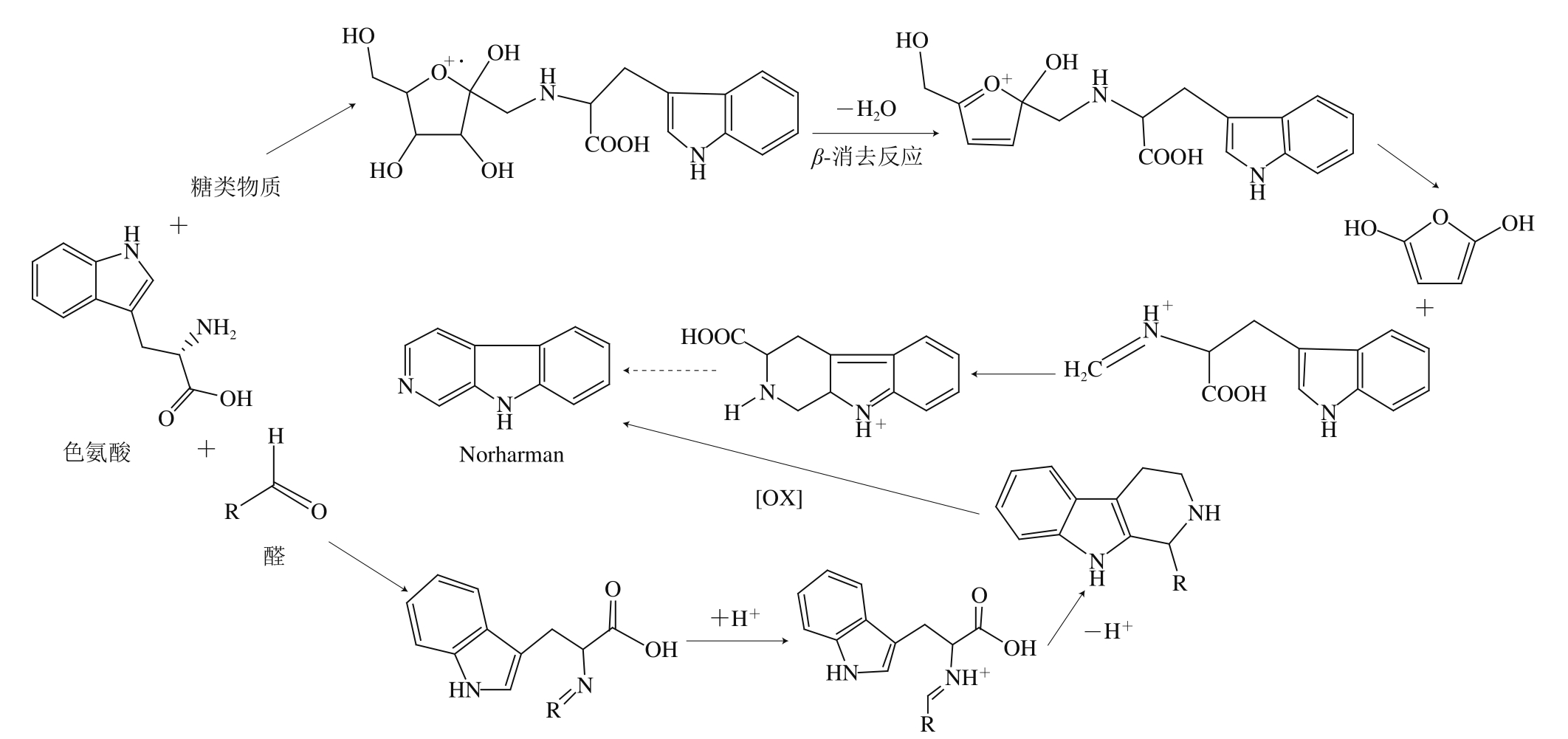
图3 Norharman形成途径[6]
Fig. 3 Formation pathways of Norharman[6]
不同原料肉品种或同一原料肉品种不同部位的脂肪含量有所差别,郭海涛[19]通过对9 种HAAs含量进行检测得出结论:随着脂肪含量在较小幅度内增加(0%~15%),极性HAAs含量显著提高,但当脂肪含量增加到20%,除了PhIP外,其余极性HAAs含量的增加趋势不显著,但仍呈现增长趋势,而非极性HAAs主要来自于氨基酸的热降解作用,与脂肪含量不存在显著相关性。原料肉的不同品种[23]、部位[24]、表面积和形状[19]也对HAAs的产生有显著影响。研究人员发现,对于不同烹饪加工手段制得的肉制品,水分含量越多,HAAs形成种类及含量越少,经卤汁熬制的酱卤肉制品中存在的部分HAAs含量相比于直接暴露在高温油炸条件下的肉制品有所减少[22]。
2.2 卤煮时间及次数
卤水煮制是加工酱卤肉制品的关键步骤之一,是滋味来源的主要途径,传统的酱卤肉制品要在卤水中经过长时间的煮制加工。卤水又有新卤、老卤之分,新卤经过反复卤煮就会变成老卤,卤水经过反复的煮制加工会出现更多的滋味物质,使得酱卤肉制品味道更佳,但同时也导致有害致癌物质的不断产生和积累。卤水的反复加工对肉品色泽、pH值、灰分、风味物质、游离氨基酸及核苷酸含量等均产生不同程度的影响,同时也对亚硝酸盐蓄积及致癌致突变物质产生具有一定促进作用[25]。邵斌[26]发现,随着卤煮时间的延长,卤煮烧鸡的鸡肉及鸡皮中Horman、Norharman、3-氨基-1,4-二甲基-5H-吡啶并[4,3-b]吲哚(3-amino-1,4-dimethyl-5H-pyrido[4,3-b]indole,Trp-P-1)、3-氨基-1-甲基-5H-吡啶并[4,3-b]吲哚(3-amino-1-methyl-5H-pyrido[4,3-b]indole,Trp-P-2)4 种HAAs含量均呈明显的上升趋势,且当卤煮次数达到20 次以上时,IQ和2-胺基-3,4,8-三甲基-3H-咪唑并[4,5-f]喹喔啉(2-amino-3,4,8-trimethyl-3H-imidazo[4,5-f]quinoxaline,4,8-DiMeIQx)2 种HAAs也被检出。郭海涛[19]研究表明,当卤煮时间由1 h延长为6 h,酱卤羊肉中的HAAs含量由51.07 ng/g升高至120.32 ng/g,且在酱卤羊肉中共检出5 种HAAs,其中包括IQ、4,8-DiMeIQx和2-氨基-3,8-二甲基-咪唑[4,5-f]喹恶啉(2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline,MeIQx)3 种极性HAAs和Harman、Norharman 2 种非极性HAAs,且卤煮时间的延长会导致大量Harman和Norharman的生成。杨潇[27]针对不同卤煮时间条件下HAAs的产生进一步研究发现,卤煮2 h为加工关键点,卤煮时间小于2 h时,HAAs含量的上升趋势不显著,而当卤煮时间大于2 h后,HAAs含量将呈现倍数增长趋势。目前研究认为,卤煮次数和时间的增加导致HAAs种类及含量上升的原因可能是酱油等调味料在高温下与肉的反复作用、氨基酸的热降解作用、反复卤煮使得卤汁中出现了更多有利于HAAs形成的前体物质等[26]。
2.3 前体物质
HAAs的形成往往需要一定浓度的前体物质及合适的物质的量比,前体物质含量在不同原料肉品种及同一原料肉品种不同部位间都存在巨大差异性。肌酸、肌酸酐、糖类和氨基酸等都可作为HAAs形成的前体物质,目前主要通过构建模拟体系来研究不同前体物质对HAAs形成的影响。
肌酸、肌酸酐的存在对HAAs的产生有一定促进作用[28]。而糖类在低含量时会促进HAAs产生,高含量则会抑制HAAs产生,这一现象可能是美拉德反应作用的结果,糖在低含量条件下会加速非酶褐变反应,而在高含量条件下则会加快美拉德焦糖化反应[29]。同时,氨基酸的存在种类及含量也会影响不同种类HAAs的形成。潘晗[3]将羊肉作为酱卤加工原料,添加不同含量的肌酸、葡萄糖、苯丙氨酸及色氨酸等前体物质,探究其对酱卤羊肉中β-咔啉类HAAs产生的影响,得出结论:随着色氨酸含量增加,β-咔啉类HAAs含量出现同步增加;而随着葡萄糖含量的不断升高,酱卤羊肉及肉汤中β-咔啉类HAAs含量则呈现先升高后下降的趋势;肌酸在低含量条件下会促进酱卤羊肉及肉汤中2 种HAAs的形成;苯丙氨酸添加量1.2 mmol/L时能显著增加Norharman、Harman含量,其余添加量条件下对Norharman、Harman的形成无显著影响。
2.4 外源添加物
2.4.1 调味料
目前研究发现,通过添加各种调味料可以影响酱卤肉制品中HAAs的产生。红酒能够抑制MeIQx和PhIP生成,但是会导致Harman形成增多[30],而盐、白砂糖、酱油[3]、料酒[26]等在不同添加量条件下会不同程度影响HAAs的产生种类及含量。潘晗[3]通过分析酱卤羊肉中HAAs含量得出结论,酱油及酱肉中都存在大量非极性HAAs,其中Norharman和Harman 2 种HAAs含量最多,它们中约有50%来源于酱油,15%~23%来自于羊肉加工过程中自身发生的热降解反应,剩余27%~31%来自于酱油与羊肉之间发生的反应。糖作为一种重要的调味料会对HAAs的形成产生影响,不同种类及添加量的糖会产生不同的作用效果,研究表明,添加低聚糖和菊粉可能是减少熟牛肉饼中杂环芳香烃形成的有效方法[31-32]。研究人员在针对烤肉中添加糖分影响HAAs生成的研究中发现,蔗糖、葡萄糖、果糖、蜂蜜均可以达到降低HAAs生成量的效果,其中蔗糖的抑制作用较其他3 种糖表现不够理想;同时提出还原糖α-二羰基化合物的降解产物通过与PhIP及其主要前体反应,在抑制PhIP的形成中起重要作用[33]。
2.4.2 香辛料
在酱卤过程中加入一些天然香辛料不仅可以赋予肉制品特殊风味,还能延长保质期,抑制腐败菌的生长。香辛料中化学成分复杂,含有多种活性成分及抗氧化剂,同种香辛料对于不同种类HAAs的作用效果不同,且同种香辛料在不同添加量时可能对HAAs的作用效果也不同。
香辛料中不同成分对HAAs的作用机理也有所区别。洋葱、大蒜中含有丰富的含硫化合物,其含有的大蒜素、二烯丙基硫化物、二烯丙基二硫化物、二丙基二硫化物等物质能参与到美拉德反应中,抑制HAAs产生[34]。香辛料中含有的部分酚类物质通常能够捕获反应性HAAs形成所需的羰基、清除自由基,从而抑制HAAs形成[35],也存在一部分酚类物质能够转化为充当反应性羰基的醌[36],促进HAAs形成[37]。酚类物质中的姜黄素、槲皮素和芦丁主要通过抑制羰基化合物、3S-1,2,3,4-四氢-β-咔啉-3-羧酸形成以及清除β-咔啉类HAAs来抑制HAAs形成,而绿原酸主要通过清除β-咔啉类HAAs和氧气来抑制HAAs形成[38]。一些辣椒、花椒、黑胡椒中存在的酰胺类物质可以通过清除中间体抑制HAAs的形成[39]。部分香辛料对酱卤肉制品中HAAs的作用效果如表1所示。
2.4.3 其他添加物
除上述添加物之外,天然抗氧化剂(如胡萝卜素、维生素等[40])、合成抗氧化剂(如丁基羟基茴香醚、2,6-二叔丁基-4-甲基苯酚、没食子酸丙酯等[41])、天然果蔬提取物、中草药提取物等植物类提取物(如洋葱水提物[42]、葡萄籽提取物[43]、苹果皮提取物[44]、石榴籽提取物[45]、菊花提取物[46]、绿茶提取物等)以及橄榄油、葵花籽油及葡萄籽油等[47]富含多不饱和脂肪酸的食用油,均能够有效抑制食品中发生的致突变作用,含有多种活性物质,可在一定程度上清除自由基,从而减少HAAs的产生。除此之外,保水性物质,如微晶纤维素、羧甲基纤维素[48]、壳聚糖等[49],通过减少食品中水分的损失减少前体物质随水分迁移现象的发生,也能够有效抑制HAAs的产生。
3 肉制品中HAAs的分离检测技术
肉制品基质复杂、存在大量干扰物质以及HAAs自身的低检出限等都给HAAs的分离检测造成了困难,为了方便检测,需要对HAAs进行提取、纯化和浓缩等前处理,从而保证检测准确性,目前HAAs的前处理和检测方法较为复杂,一些具有针对性、高效率、高灵敏性的技术也在不断出现。下面对现有的肉制品中HAAs分离及检测方法进行介绍。
3.1 肉制品中HAAs分离提取技术
3.1.1 液-液萃取(liquid-liquid extraction,LLE)和固相萃取(solid-phase extraction,SPE)
LLE和SPE是比较经典和传统的前处理方法,LLE主要根据溶剂之间的溶解度或分配系数不同,采用无机、有机溶剂或2 类溶剂共同作用使得绝大部分HAAs从一种溶液中转移到另外一种溶液中进行萃取。SPE通常被认为比LLE更具有优势,此方法分析的灵敏度和选择性可以通过使用不同的吸附剂和洗脱剂来进行优化[2]。除一些常见的吸附剂,如硅藻土、人造丝、蓝棉、丙基磺酸柱、强阳离子交换(strong cation exchange,SCX)柱、C18反相柱、Lichrolut EN(树脂型吸附剂)等之外,目前磁性碳纳米管[50]、石墨烯复合材料[51]等作为新型吸附剂,可进一步优化HAAs的提取效果。
3.1.2 固相微萃取(solid-phase microextraction,SPME)
为解决传统LLE、SPE技术存在的局限性,近年来也出现了微萃取技术。SPME技术与SPE的区别在于没有将待测物全部萃取,其原理是使样品基质在覆盖熔融石英纤维的有机聚合物相与水相之间建立起吸附/溶解-解吸的平衡分配。因此,纤维涂层对于目标分析物的提取非常重要。SPME是一种可忽略萃取溶剂的微萃取新技术,因其具备高度兼容性及可行性等特点越来越受到关注。Martín-Calero等[52]采用1-丁基-3-甲基咪唑四氟硼酸盐离子液体作为解吸溶剂,使用CW-TPR商品涂层对试样进行富集,同时能够降低有机溶剂的消耗量,进而实现猪肉中Trp-p-1、Trp-p-2、AαC、2-氨基-3-甲基-9H-吡啶并[2,3-b]吲哚(2-amino-3-methyl-9H-pyrido[2,3-b]indol,MeAαC)、Harman和Norharman的分离和富集。但SPME技术目前商品化纤维涂层选择性不高,因此,此技术还有待进一步研究。Zhang Qianchun等[53]开发了一种在线SPME-高效液相色谱(high performance liquid chromatography,HPLC)技术,用于食品中HAAs的痕量分析,该方法制备了乙烯基苯基硼酸-共聚乙二醇二甲基丙烯酸乙二醇酯聚合物整体填料,可进行在线高效萃取,并采用大体积进样来提高检测灵敏度,显示出良好的渗透性、提取能力和选择性,色谱柱的重现效果令人满意,该方法作为新型SPME技术已成功应用于烤牛肉和烤羊肉中HAAs的分析。
表1 不同香辛料对酱卤肉制品中HAAs的作用效果
Table 1 Effects of different spices on HAAs in soy sauce and pot-roast meat products

注:变化率与香辛料添加种类分别对应。
原料肉种类 香辛料种类 化学成分 作用效果 变化率/% 参考文献酱鸡肉 质量分数5%八角、香叶 萜类及其衍生物、酚类化合物 促进β-咔啉类HAAs形成 72.8、36.4~45.3 [35]酱鸡肉 质量分数5%干姜、青花椒、桂皮 黄酮类、萜类化合物 抑制β-咔啉类HAAs形成 >40 [35]酱鸡肉 质量分数5%陈皮、黑胡椒 黄酮类物质、生物碱等 抑制β-咔啉类HAAs形成 32.40、30.96 [35]酱鸡肉 质量分数3%红花椒 酰胺类物质等 抑制β-咔啉类HAAs形成 27.71 [35]酱鸡肉 桂皮、红花椒精油 萜类及其衍生物等 抑制β-咔啉类HAAs形成 1.5~17.0 [35]卤煮烧鸡 质量分数4%良姜 黄酮类物质 抑制Norharman形成 45.2 [26]卤煮烧鸡 质量分数4%丁香 酚类物质 抑制PhIP形成 46.7 [26]卤煮烧鸡 质量分数4%花椒 酰胺类物质等 抑制Harman形成 35.9 [26]酱猪肉 质量分数0.05%甘草、红花椒、大料、草果 黄酮类、萜类及其衍生物 促进非极性HAAs形成 86.89、538.4、178.7、256.9 [36]酱猪肉 质量分数0.1%红花椒和0.05%甘草、草果 萜类及其衍生物、黄酮类物质 促进8-MeIQx、4,8-DiMeIQx、PhIP形成 4~7 倍 [36]卤煮牛肉 质量分数0.15%香兰素 醛类物质等 抑制Trp-P-1、Trp-P-2、2-氨基-9H-吡啶[2,3-b]吲哚(2-amino-9H-pyrido[2,3-b]indole,AaC)、Norharman、Harman形成 >90 [36]卤煮牛肉 质量分数0.05%山核桃烟熏香味料 酚类物质等 抑制MeIQx、Harman、PhIP形成 96.4~100.0 [19]
3.1.3 微波辅助萃取(microwave-assisted extraction,MAE)
MAE是将样品在微波场中进行加热,通过加热进一步实现对物质的分化提取,将样品中存在的微波能转化为热能,实现对HAAs的分离萃取。目前MAE技术常与分散液-液微萃取(dispersive liquid-liquid microextraction,DLLME)技术联用,Aeenehvand等[54]在微波辅助条件下,用NaOH溶液、乙醇和丙酮混合溶液提取HAAs,去除蛋白质并调节pH值后,立即将样品溶液用于DLLME工艺,甲醇和1-辛醇分别用作分散溶剂和萃取溶剂。研究人员提出了一种MAE低密度溶剂微萃取法,与HPLC联用,并采用中心复合设计[2]、响应面设计[55]等手段对每个参数值进行优化,目前已经成功应用于烧烤及炸鸡制品中HAAs的测定。
3.1.4 DLLME
DLLME是将包含分散性(水-有机混溶溶剂)和萃取性(有机溶剂)溶剂的混合物快速添加到含有目标分析物的水溶液中,会促进混浊溶液的形成。由于两相之间形成的表面积非常大,因此被分析物可以快速、有效地富集在萃取溶剂中[11]。Vichapong等[56]采用表面活性剂辅助DLLME与HPLC技术,对肉制品中的2-氨基-3,4-二甲基咪唑并[4,5-f]喹啉(2-amino-3,4-dimethylimidazo[4,5-f]quinoline,MeIQ)、4,8-DiMeIQx、PhIP、Harman 4 种HAAs进行分析检测,将十二烷基硫酸钠用作离子选择及分散剂,以1-辛醇为萃取溶剂,发现该方法对所有化合物的检出限均为0.01 μg/kg。研究人员开发了离子液体辅助DLLME技术,可用于测定8-MeIQx,此方法将银纳米颗粒(AgNP)修饰的丝网印刷碳纳米纤维作为电极,利用电化学方法进行检测,检出限为5 μg/L[57]。
3.1.5 其他分离提取方法
除上述几种较为常见的分离方法外,在线串联LLESPE、超临界流体萃取(supercritical fluid extraction,SFE)、加压液体萃取[58]、加速溶剂萃取[59]、微固相萃取(micro-SPE)[60-61]及QuEChERS[62]、电膜萃取[63]也被用来提取HAAs。Vichapong等[64]使用新一代浊点萃取程序——空气搅拌浊点萃取(air-agitated cloud-point extraction,AACPE),用于萃取和预浓缩4 种HAAs(MeIQ、4,8-DiMeIQx、PhIP、Harman),此方法已成功应用于高预浓缩因子分析物的分析。微波辅助盐酸法从乳糖中合成了短碳点的荧光水溶性碳纳米颗粒,是新出现的一种纳米技术,其可替代色谱分析前的优化萃取过程,合成纳米颗粒成本廉价、具有荧光特性,通过对碳点荧光的猝灭作用以及存在HAAs时碳点的寿命进行进一步测定,此方法同样也是目前研究HAAs定量的先进手段[65]。部分可用于分离提取肉制品中HAAs的技术条件及其优缺点如表2所示。
表2 肉制品中HAAs的分离提取技术
Table 2 Separation and extraction technologies for HAAs from meat products
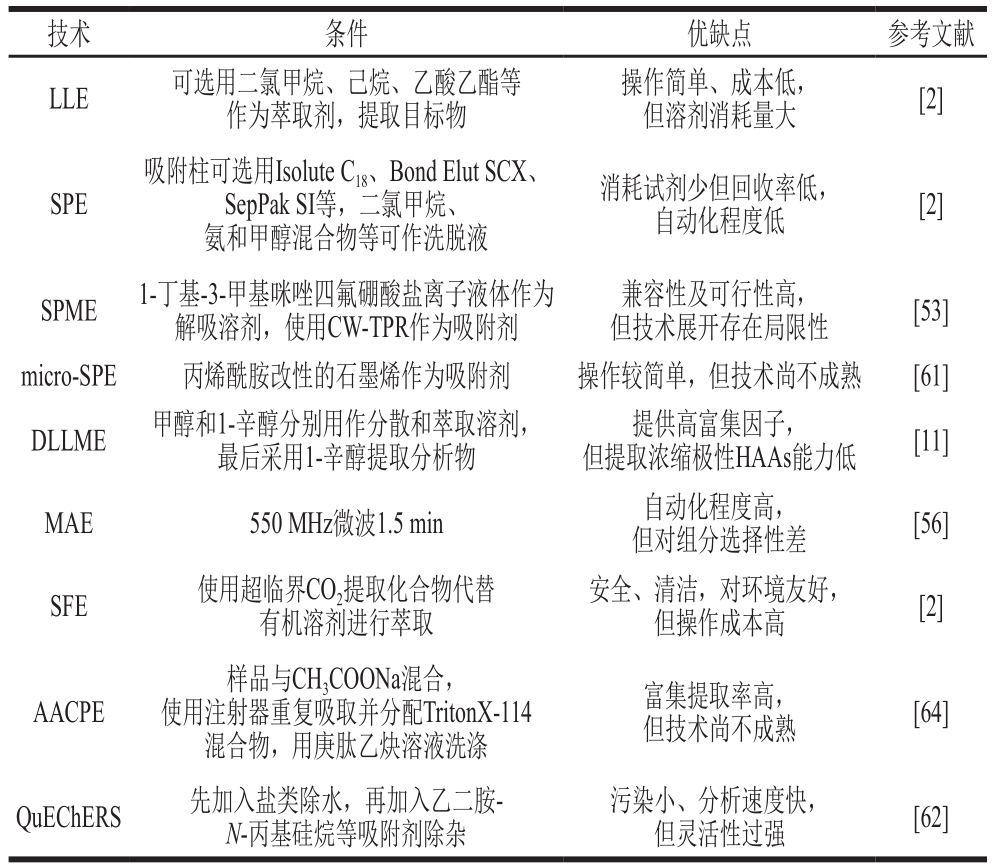
技术 条件 优缺点 参考文献LLE 可选用二氯甲烷、己烷、乙酸乙酯等作为萃取剂,提取目标物操作简单、成本低,但溶剂消耗量大 [2]SPE吸附柱可选用Isolute C18、Bond Elut SCX、SepPak SI等,二氯甲烷、氨和甲醇混合物等可作洗脱液消耗试剂少但回收率低,自动化程度低 [2]SPME 1-丁基-3-甲基咪唑四氟硼酸盐离子液体作为解吸溶剂,使用CW-TPR作为吸附剂兼容性及可行性高,但技术展开存在局限性 [53]micro-SPE 丙烯酰胺改性的石墨烯作为吸附剂 操作较简单,但技术尚不成熟 [61]DLLME 甲醇和1-辛醇分别用作分散和萃取溶剂,最后采用1-辛醇提取分析物提供高富集因子,但提取浓缩极性HAAs能力低 [11]MAE 550 MHz微波1.5 min 自动化程度高,但对组分选择性差 [56]SFE 使用超临界CO2提取化合物代替有机溶剂进行萃取安全、清洁,对环境友好,但操作成本高 [2]AACPE样品与CH3COONa混合,使用注射器重复吸取并分配TritonX-114混合物,用庚肽乙炔溶液洗涤富集提取率高,但技术尚不成熟 [64]QuEChERS 先加入盐类除水,再加入乙二胺-N-丙基硅烷等吸附剂除杂污染小、分析速度快,但灵活性过强 [62]
3.2 肉制品中HAAs检测技术
3.2.1 LC及LC-质谱(mass spectrometry,MS)联用法
HPLC是一种较为理想的HAAs测定方法,但是其灵敏度主要取决于组合的检测设备,HPLC是将不同比例的混合溶剂或极性不同的单一溶剂、缓冲液等流动相装入固定相色谱柱,同时采用高压输液系统,采用一定检验标准进行定量及定性分析。
HPLC-MS是目前检验手段中发展较为迅速的一种,其结合了LC技术对热不稳定性、高沸点物质的高效分离能力以及MS技术对复杂组分的分析能力,是一种分析复杂有机混合物的有效手段,同时MS的应用也能够进一步避免假阳性、假阴性结果的出现。Lee等[66]采用HPLC-MS/MS法对7 种不同食品基质中HAAs进行分析检测,用6 种同位素标记的内标进行定量,使用Chem Elut和Oasis亲水亲脂平衡盒进行样品制备,以消除干扰。Kwak[67]将同位素稀释液LC-MS/MS法用于分析及定量检测鱼基质中存在的HAAs。Toribio等[68]采用低耗时的固相萃取程序纯化样品,并使用LC-MS/MS和离子阱质量分析仪作为测定技术,分析测定烤牛排中的15 种HAAs含量。Linghu等[69]使用EMR-脂质吸附剂和盐析分配进行快速分散固相萃取,体积分数分别为1%和2%的乙腈-甲酸可从不同肉类基质中有效提取HAAs,并且结合HPLC-MS技术定量及定性分析HAAs。
超高效液相色谱-串联质谱(ultra-performance liquid chromatography-tandem mass spectrometry,UPLC-MS)是在传统HPLC的基础上进一步改进,采用1~2 μm的细粒径填料和细内径色谱柱,可以获得很高的柱效。目前MS[70]、电喷雾电离(electrospray ionization,ESI)[71]、大气压化学电离(atmospheric-pressure chemical ionization,APCI)[72]等技术可以辅助UPLC进行HAAs检验分析,提高其灵敏性和准确度。Manful等[73]使用甲醇作为溶剂的加压加速溶剂萃取剂萃取HAAs,然后添加内标并通过UPLC-高分辨率质谱定量检测HAAs,该方法与传统检测技术相比更加快速、准确、可重现,且不需要复杂的预处理步骤。Yan Yan等[74]提出采用乙腈法提取肉制品中的HAAs,并通过一步式Oasis MCX Cartridge固相萃取柱对样品进行纯化,结合UPLC-MS法可实现17 种HAAs的同步提取,乙腈法的回收率可由传统法的32.7%~78.5%提高到42.5%~99.0%,且相对标准偏差低于传统法,由此得出乙腈法具备更高的回收率和更好的重复性。
3.2.2 气相色谱(gas chromatography-based methods,GC)及GC-MS法
GC法多用于分析低极性或非极性HAAs,由于HAAs多属极性、难挥发类物质,通常需要经过衍生处理增加HAAs的挥发性,才能达到较易吸收的效果,由此提出了酰基纯、烷基化、硅烷化等衍生化技术手段,应用于HAAs检测的前处理优化。由于GC仪无法有效检测到低含量HAAs,衍生化过程耗时且只有少部分HAAs经过衍生处理后能采用GC方法检测,所以使用范围较小,不是一种常用的HAAs分析方法。
GC-MS法充分结合了GC技术对复杂物质的高效分离能力以及MS技术的定性、定量、高效分析鉴定能力。研究发现,耐压多样品微量衍生反应装置可用于GC-MS中,分析极性HAAs[75],采用N-(叔丁基二甲基硅烷基)-N-甲基三氟乙酰胺(含1%叔丁基二甲基氯硅烷)硅烷化试剂,在高温条件下衍生极性HAAs,此方法既能够实现多个样品同时衍生的需求,又能够在高于试剂沸点温度下实现衍生反应。GC-MS相比于LC-MS还需衍生步骤,较为繁琐,操作难度较大,近些年不太用于HAAs的检测。
3.2.3 毛细管区带电泳(capillary zone electrophoresis,CZE)法
CZE法是以毛细管为通道、高压电场为主要动力的一种液相分离分析技术,其发展使得分析仪器更加便携化、集成化与微型化。Fei Xiaoqing等[76]使用CZE方法分析肉基质中的8 种HAAs,得到HAAs的最佳分离条件:以pH值为2.20的5 mmol/L甲酸-甲酸铵溶液作为运行电解质,施加18 kV电压,采用固体萃取操作进行净化处理,紫外(ultraviolet,UV)-二极管阵列检测器(diode array detector,DAD)检测,检测波长214 nm。CZE-MS技术将MS技术的高选择性和高灵敏度优势与CZE的高效检测分离优势相结合[77],针对食品中存在的微量复杂HAAs进行分离检测,具备独特优势,十分具有发展前景。此外研究人员将毛细管高效液相色谱(CHPLC)与DAD[78]、MS[79]联用,分析食品中的Harman、Norharman和MeIQx等HAAs。
3.2.4 酶联免疫吸附(enzyme-linked immunosorbent assay,ELISA)法
ELISA是一种基于免疫学反应、可通过抗原抗体结合进行检测的高灵敏性技术,目前可应用于分析检验加工肉制品中的HAAs,可分为间接竞争ELISA法和直接竞争ELISA法。Sheng Wei等[80]采用直接竞争ELISA法对HAAs进行检测,将牛特异性多克隆抗体血清白蛋白作为免疫原,测定半数最大抑制浓度(IC50)和检出限,发现对IQ类HAAs具有很强的特异性。王静等[81]通过ELISA法实现了对目标物4,8-DiMeIQx的高效检测,未来仍可进一步开发此方法在检测HAAs中的应用,为加工肉制品中的HAAs测定提供一种简便、快速的方法。
3.2.5 高效薄层色谱(high-performance thin-layer chromatography,HPTLC)法
表3 肉制品中HAAs的检测技术
Table 3 Detection technologies for HAAs in meat products
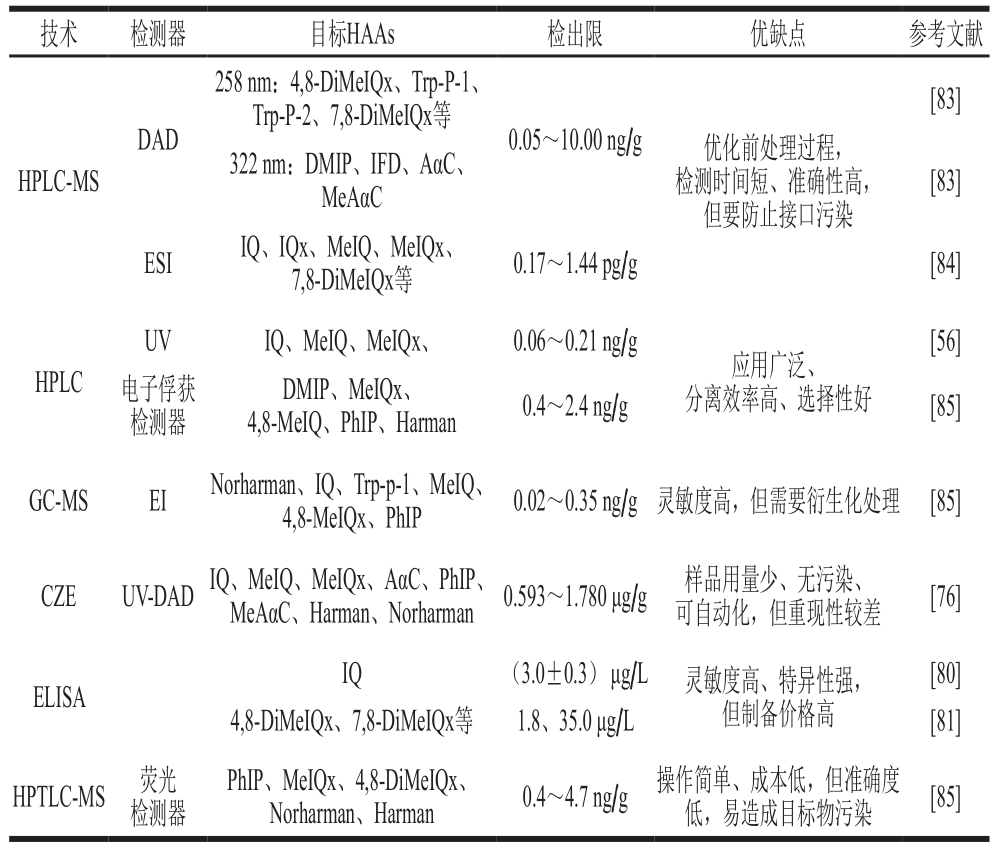
注:DMIP. 2-氨基-1,6-二甲基咪唑[4,5-b]吡啶(2-amino-1,6-dimethyl imidazo[4,5-b]pyridine)。
技术 检测器 目标HAAs 检出限 优缺点 参考文献DAD 258 nm:4,8-DiMeIQx、Trp-P-1、Trp-P-2、7,8-DiMeIQx等 0.05~10.00 ng/g 优化前处理过程,HPLC-MS[83]322 nm:DMIP、IFD、AαC、MeAαC 检测时间短、准确性高,但要防止接口污染[83]ESI IQ、IQx、MeIQ、MeIQx、7,8-DiMeIQx等 0.17~1.44 pg/g [84][56]电子俘获检测器UV IQ、MeIQ、MeIQx、 0.06~0.21 ng/g HPLC DMIP、MeIQx、4,8-MeIQ、PhIP、Harman 0.4~2.4 ng/g [85]应用广泛、分离效率高、选择性好GC-MS EI Norharman、IQ、Trp-p-1、MeIQ、4,8-MeIQx、PhIP 0.02~0.35 ng/g 灵敏度高,但需要衍生化处理 [85]CZE UV-DADIQ、MeIQ、MeIQx、AαC、PhIP、MeAαC、Harman、Norharman 0.593~1.780 μg/g 样品用量少、无污染、可自动化,但重现性较差 [76][80]4,8-DiMeIQx、7,8-DiMeIQx等 1.8、35.0 μg/L [81]HPTLC-MS 荧光检测器ELISA IQ (3.0±0.3) μg/L 灵敏度高、特异性强,但制备价格高PhIP、MeIQx、4,8-DiMeIQx、Norharman、Harman 0.4~4.7 ng/g 操作简单、成本低,但准确度低,易造成目标物污染 [85]
除了上面几种常用的检验HAAs的方法,HPTLC法也可用于检验HAAs,其采用粒度分布很窄的微粒硅剂(5~10 μm)制备高效薄层板,用程序多级展开或圆形展开技术使薄层色谱的灵敏度和分辨率大大提高,分析成本低、干扰小、操作简单,但是准确度较HPLC低,且存在费时、对目标物造成污染等风险,所以现阶段测定肉制品中的HAAs较少使用此方法[82]。表3总结了一些可用于检测肉制品中HAAs的技术手段及其优缺点。
综上所述,每种分离提取和检验方法都存在其相应优势、局限性及适用对象,应根据具体的实验对象、实验条件及在检出限要求下选择合适的方法,才能准确、高效得到实验结果,为今后的实验提供科学的理论支撑。
4 结 语
基于酱卤肉制品中存在的痕量HAAs物质对人体造成的远期危害性,本文对其形成机理、影响因素进行总结。但目前国内外缺乏酱卤肉制品中HAAs的相关研究,酱卤肉制品中许多HAAs形成机制尚未完全明确,其安全问题并未得到重视,且我国对于HAAs在各类食品中的含量标准未作明确限制要求。同时本文针对目前用于分离检测肉制品中HAAs的技术进行分析及评估,但HAAs的痕量水平及食品基质的高度复杂性仍给HAAs研究带来了巨大困难,且我国的分离检验技术发展相对缓慢和固定化。今后,应在进一步探究HAAs形成机理的同时开发适宜的分离检验技术,从而采取合适的抑制手段,提高食品的安全性。
[1] 申霄婵, 李晓, 张羽灵, 等. 常见香辛料对酱猪肉中杂环胺生成的影响[J]. 食品工业科技, 2018, 39(13): 243-247. DOI:10.13386/j.issn1002-0306.2018.13.044.
[2] BARZEGAR F, OMIDI N, KAMANKESH M, et al. An advanced microwave assisted extraction-low density solvent based on sensitive microextraction method coupled with reverse phase high-performance liquid chromatography for the simultaneous determination of heterocyclic aromatic amines in fried chicken nuggets[J]. Analytical Methods, 2019, 17(7): 942-949. DOI:10.1039/c8ay02834f.
[3] 潘晗. 酱肉中norharman和harman形成机理的研究[D]. 北京: 中国农业科学院, 2014: 20-32.
[4] ALAEJOS M S, AFONSO A M. Factors that affect the content of heterocyclic aromatic amines in foods[J]. Comprehensive Reviews in Food Science and Food Safety, 2011, 10(2): 52-108. DOI:10.1111/j.1541-4337.2010.00141.x.
[5] OBA S, SHIMIZU N, NAGATA C, et al. The relationship between the consumption of meat, fat, and coffee and the risk of colon cancer: a prospective study in Japan[J]. Cancer Letters, 2006, 244(2): 260-267.DOI:10.1016/J.CANLET.2005.12.037.
[6] PALUSZKIEWICZ P, SMOLIŃSKA K, DĘBIŃSKA I, et al. Main dietary compounds and pancreatic cancer risk. The quantitative analysis of case-control and cohort studies[J]. Cancer Epidemiology,2012, 36(1): 60-67. DOI:10.1016/j.canep.2011.05.004.
[7] GIBIS M. Heterocyclic aromatic amines in cooked meat products:causes, formation, occurrence, and risk assessment[J]. Comprehensive Reviews in Food Science and Food Safety, 2016, 15(2): 269-302.DOI:10.1111/1541-4337.12186.
[8] NAMIRANIAN N, MORADI-LAKEH M, RAZAVI-RATKI S K, et al.Risk factors of breast cancer in the eastern mediterranean region:a systematic review and meta-analysis[J]. Asian Pacific Journal of Cancer Prevention, 2014, 15(21): 9535-9541. DOI:10.7314/APJCP.2014.15.21.9535.
[9] OZ F, YUZER M O. The effects of different cooking methods on the formation of heterocyclic aromatic amines in turkey meat[J]. Journal of Food Processing and Preservation, 2017, 41(5): e13196. DOI:10.1111/jfpp.13196.
[10] TAUQEERUNNISA S, RACHEL M F, EMILY L, et al. PhIP exposure in rodents produces neuropathology potentially relevant to Alzheimer’s disease[J]. Toxicology, 2020, 437: 152436. DOI:10.1016/j.tox.2020.152436.
[11] ZAMORA R, HIDALGO F J. 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine (PhIP) formation and fate: an example of the coordinate contribution of lipid oxidation and Maillard reaction to the production and elimination of processing related food toxicants[J]. RSC Advances, 2015, 5(13): 9709-9721. DOI:10.1039/c4ra15371e.
[12] DONG Hao, XIAN Yanping, LI Haixia, et al. Potential carcinogenic heterocyclic aromatic amines (HAAs) in foodstuffs: formation,extraction, analytical methods, and mitigation strategies[J].Comprehensive Reviews in Food Science and Food Safety, 2020,19(2): 365-404. DOI:10.1111/1541-4337.12527.
[13] ZAMORA R, HIDALGO F J. Formation of heterocyclic aromatic amines with the structure of aminoimidazoazarenes in food products[J]. Food Chemistry, 2020, 313: 126-128. DOI:10.1016/j.foodchem.2019.126128.
[14] CHIGWEDERE C M, TADELE W W, YI J J, et al. Insight into the evolution of flavor compounds during cooking of common beans utilizing a headspace untargeted fingerprinting approach[J]. Food Chemistry, 2019, 275: 224-238. DOI:10.1016/j.foodchem.2018.09.080.
[15] ZAMORA R, LAVADO-TENA C M, HIDALGO F J. Oligomerization of reactive carbonyls in the presence of ammonia-producing compounds: a route for the production of pyridines in foods[J]. Food Chemistry, 2020, 304: 125284. DOI:10.1016/j.foodchem.2019.125284.
[16] SCALONE G L L, LAMICHHANE P, CUCU T, et al. Impact of different enzymatic hydrolysates of whey protein on the formation of pyrazines in Maillard model systems[J]. Food Chemistry, 2019, 278:533-544. DOI:10.1016/j.foodchem.2018.11.088.
[17] MARTINEZ Y A, GOICOECHEA E, GUILLEN M D. A review of thermo oxidative degradation of food lipids studied by 1H NMR spectroscopy: influence of degradative conditions and food lipid nature[J]. Comprehensive Reviews in Food Science and Food Safety,2014, 13(5): 838-859. DOI:10.1111/1541-4337.12090.
[18] PEARSON A M, CHEN C, GRAY J I, et al. Mechanism(s)involved in meat mutagen formation and inhibition[J]. Free Radical Biology and Medicine, 1992, 13(2): 161-167. DOI:10.1016/0891-5849(92)90078-U.
[19] 郭海涛. 加工条件对羊肉制品中杂环胺含量的影响[D]. 北京: 中国农业科学院, 2013: 21-37.
[20] QUELHAS I, PETISCA C, VIEGAS O, et al. Effect of green tea marinades on the formation of heterocyclic aromatic amines and sensory quality of pan-fried beef[J]. Food Chemistry, 2010, 122(1):98-104. DOI:10.1016/j.foodchem.2010.02.022.
[21] GIBIS M, WEISS J. Inhibitory effect of marinades with hibiscus extract on formation of heterocyclic aromatic amines and sensory quality of fried beef patties[J]. Meat Science, 2010, 85(4): 735-742.DOI:10.1016/j.meatsci.2010.03.034.
[22] KIKUGAVA K. Prevention of mutagen formation in heated meats and model systems[J]. Mutagenesis, 2004, 19(6): 431-439. DOI:10.1093/mutage/geh053.
[23] LIAO G Z, XU X L, ZHOU G H, et al. Effects of cooking methods on the formation of heterocyclic aromatic amines in chicken and duck breast[J]. Meat Science, 2010, 85(1): 149-154. DOI:10.1016/j.meatsci.2009.12.018.
[24] SZTERK A. Heterocyclic aromatic amines in grilled beef: the in fluence of free amino acids, nitrogenous bases, nucleosides, protein and glucose on HAAs content[J]. Journal of Food Composition and Analysis, 2015, 40: 39-46. DOI:10.1016/j.jfca.2014.12.011.
[25] 李波. 卤水及加工工艺对盐水鹅基本品质及风味的影响[D]. 扬州:扬州大学, 2019: 24-39. DOI:10.27441/d.cnki.gyzdu.2019.000585.
[26] 邵斌. 传统烧鸡中9 种杂环胺类化合物形成规律研究[D]. 南京: 南京农业大学, 2012: 41-64.
[27] 杨潇. 烟熏液对卤煮牛肉中杂环胺和多环芳烃含量的影响研究[D].合肥: 合肥工业大学, 2016: 30-32.
[28] 鄢嫣. 烤肉中杂环胺的形成规律的研究[D]. 无锡: 江南大学, 2015:71-73.
[29] TAI C Y, LEE K H, CHEN B H. Effects of various additives on the formation of heterocyclic amines in fried fish fibre[J]. Food Chemistry,2001, 75(3): 309-316. DOI:10.1016/S0308-8146(01)00200-X.
[30] JAVIER G L, OLGA V, MARIA L, et al. In fluence of red wine pomace seasoning and high-oxygen atmosphere storage on carcinogens formation in barbecued beef patties[J]. Meat Science, 2017, 125:10-15. DOI:10.1016/j.meatsci.2016.11.009.
[31] HASNOL N D, JINAP S, SANNY M. Effect of different types of sugars in a marinating formulation on the formation of heterocyclic amines in grilled chicken[J]. Food Chemistry, 2014, 145(2): 514-521.DOI:10.1016/j.foodchem.2013.08.086.
[32] SHIN H S, STRASBURG G M, USTUNOL Z. In fluence of different uni floral honeys on heterocyclic aromatic amine formation and overall mutagenicity in fried ground-beef patties[J]. Journal of Food Science,2003, 68(3): 810-815. DOI:10.1111/j.1365-2621.2003.tb08247.x.
[33] HAN Zhonghui, LIU Bing, NIU Zhiyan, et al. Role of α-dicarbonyl compounds in the inhibition effect of reducing sugars on the formation of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine[J]. Journal of Agricultural and Food Chemistry, 2017, 65(46): 10084-10092.DOI:10.1021/acs.jafc.7b03287.
[34] JANOSZKA B. Heterocyclic amines and azaarenes in pan-fried meat and its gravy fried without additives and in the presence of onion and garlic[J]. Food Chemistry, 2010, 120(2): 463-473. DOI:10.1016/j.foodchem.2009.10.039.
[35] HIDALGO F J, ZAMORA R. 2,4-Alkadienal trapping by phenolics[J]. Food Chemistry, 2018, 263: 89-95. DOI:10.1016/j.foodchem.2018.04.121.
[36] DAMASIUS J, VENSKUTONIS P R, FERRACANE R, et al.Assessment of the in fluence of some spice extracts on the formation of heterocyclic amines in meat[J]. Food Chemistry, 2011, 126: 149-156.DOI:10.1016/j.foodchem.2010.10.091.
[37] JINAP S, SHAHZAD Z L, NUR H T, et al. Heterocyclic aromatic amines in deep fried lamb meat: the in fluence of spices marination and sensory quality[J]. Journal of Food Science and Technology, 2016,53(3): 1411-1417. DOI:10.1007/s13197-015-2137-0.
[38] 李进. 香辛料抑制卤肉中β-咔啉类杂环胺形成的物质基础及机理初步研究[D]. 武汉: 华中农业大学, 2019: 66-71. DOI:10.27158/d.cnki.ghznu.2019.000454.
[39] 张梦茹. 辛辣味香辛料及其特征成分对烤牛肉饼中杂环胺生成规律的影响研究[D]. 无锡: 江南大学, 2017: 17-38.
[40] 聂文, 屠泽慧, 张静, 等. 香兰素和维生素C对卤煮牛肉中杂环胺含量的影响[J]. 食品安全质量检测学报, 2017, 8(6): 1987-1992.
[41] CHEN C H, PEARSON A M, GRAY J I. Effects of synthetic antioxidants (BHA, BHT and PG) on the mutagenicity of IQ-like compounds[J]. Food Chemistry, 1992, 43(3): 177-183.DOI:10.1016/0308-8146(92)90170-7.
[42] NURAY M, OZ F. The effect of using different types and rates of onion-water extract in meatball production on the formation of heterocyclic aromatic amines[J]. Journal of the Science of Food and Agriculture, 2019, 99(7): 3538-3547. DOI:10.1002/jsfa.9574.
[43] KESKEKOGLU H, UREN A. Inhibitory effects of grape seed extract on the formation of heterocyclic aromatic amines in beef and chicken meatballs cooked by different techniques[J]. International Journal of Food Properties, 2017, 20(Suppl 1): S722-S734. DOI:10.1080/109429 12.2017.1308956.
[44] SABALLY K, SLENO L, JAUFFRIT J A, et al. Inhibitory effects of apple peel polyphenol extract on the formation of heterocyclic amines in pan fried beef patties[J]. Meat Science, 2016, 117: 57-62.DOI:10.1016/j.meatsci.2016.02.040.
[45] 陈炎, 蔡克周, 杨潇, 等. 外源成分对肉制品中杂环胺抑制效果的研究进展[J]. 食品科学, 2015, 36(23): 329-333. DOI:10.7506/spkx1002-6630-201523059.
[46] KHAN I A, LIU D, YAO M, et al. Inhibitory effect of Chrysanthemum morifolium flower extract on the formation of heterocyclic amines in goat meat patties cooked by various cooking methods and temperatures[J]. Meat Science, 2019, 147: 70-81. DOI:10.1016/j.meatsci.2018.08.028.
[47] LU F, KUHNLE G K, CHENG Q F. Vegetable oil as fat replacer inhibits formation of heterocyclic amines and polycyclic aromatic hyrdocarbons in reduced fat pork patties[J]. Food Control, 2017, 81:113-125. DOI:10.1016/j.foodcont.2017.05.043.
[48] GIBIS M, WEISS J. Inhibitory effect of cellulose fibers on the formation of heterocyclic aromatic amines in grilled beef patties[J]. Food Chemistry, 2017, 229(15): 828-836. DOI:10.1016/j.foodchem.2017.02.130.
[49] OZ F, KIZIZ M, ZAMAN A, et al. The effects of direct addition of low and medium molecular weight chitosan on the formation of heterocyclic aromatic amines in beef chop[J]. LWT-Food Science and Technology, 2016, 65: 861-867. DOI:10.1016/j.lwt.2015.09.023.
[50] LIANG Ruiyu, HU Yuling, LI Gongke. Photochemical synthesis of magnetic covalent organic framework/carbon nanotube composite and its enrichment of heterocyclic aromatic amines in food samples[J].Journal of Chromatography A, 2020, 1618: 460867. DOI:10.1016/j.chroma.2020.460867.
[51] CAI Lemei, XU Na, XIA Shujun, et al. Preparation of argininemodi fied reduced graphene oxide composite filled in an on-line solidphase extraction disk and its application in the analysis of heterocyclic aromatic amines[J]. Journal of Separation Science, 2017, 40(14):2925-2932. DOI:10.1002/jssc.201700073.
[52] MARTÍN-CALERO A, AYALA J H, GONZÁLEZ V, et al. Ionic liquids as desorption solvents and memory effect suppressors in heterocyclic aromatic amines determination by SPME-HPLC fluorescence[J]. Analytical and Bioanalytical Chemistry, 2008, 394(4):937-946. DOI:10.1007/s00216-008-2568-9.
[53] ZHANG Qianchun, CHENG Yingyi, LI Gongke, et al. Porous boronate affinity monolith for on-line extraction coupled to high-performance liquid chromatography for sensitive analysis of heterocyclic aromatic amines in food samples[J]. Chinese Chemical Letters, 2015, 26(12):1470-1477. DOI:10.1016/j.cclet.2015.10.023.
[54] AEENEHVAND S, TOUDEHROUSTA Z, KAMANKESH M, et al.Evaluation and application of microwave-assisted extraction and dispersive liquid-liquid microextraction followed by high-performance liquid chromatography for the determination of polar heterocyclic aromatic amines in hamburger patties[J]. Food Chemistry, 2016, 190:429-435. DOI:10.1016/j.foodchem.2015.05.103.
[55] BARZEGAR F, KAMANKESH M, MOHAMMADI A. Development and application of microwave-assisted extraction and advanced low density microextraction technique coupled with high-performance liquid chromatography for the successful determination of heterocyclic aromatic amines in barbecued meat sample and method optimization using response surface methodology[J]. Journal of Food Measurement and Characterization, 2019, 13(3): 1755-1764. DOI:10.1007/s11694-019-00093-9.
[56] VICHAPONG J, SRIJARANAI S, SANTALADCHAIYAKIT Y,et al. Preconcentration and simultaneous determination of heterocyclicaromatic aminesin grilled pork samples by ion-pair-based surfactant-assisted dispersive liquid-liquid microextraction and highperformance liquid chromatography[J]. Food Analytical Methods,2016, 9(5): 1120-1127. DOI:10.1007/s12161-015-0291-7.
[57] MONTES C, CONTENTO A M, VILLASEÑOR M J, et al. A screenprinted electrode modified with silver nanoparticles and carbon nano fibers in a na fion matrix for ionic liquid-based dispersive liquidliquid microextraction and voltammetric assay of heterocyclic amine 8-MeIQx in food[J]. Mikrochimica Acta, 2020, 187(3): 190.DOI:10.1007/s00604-020-4138-6.
[58] KHAN M R, BUSQUETS R, SANTOS F J. New method for the analysis of heterocyclic amines in meat extracts using pressurised liquid extraction and liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A, 2008, 1194(2): 155-160.DOI:10.1016/j.chroma.2008.04.058.
[59] OUYANG Y F, LI H B, TANG H B, et al. A reliable and sensitive LCMS-IT-TOF method coupled with accelerated solvent extraction for the identi fication and quantitation of six typical heterocyclic aromatic amines in cooked meat products[J]. Analytical Methods, 2015, 7(21):9274-9280. DOI:10.1039/c5ay01236h.
[60] BASHEER C. Application of micro-solid-phase extraction for the on-site extraction of heterocyclic aromatic amines in seawater[J].Journal of Separation Science, 2018, 41(7): 1610-1617. DOI:10.1002/jssc.201701137.
[61] ZHANG Qianchun, LI Gongke, XIAO Xiaohua. Acrylamidemodified graphene for online micro-solid-phase extraction coupled to high-performance liquid chromatography for sensitive analysis of heterocyclic amines in food samples[J]. Talanta, 2015, 131: 127-135.DOI:10.1016/j.talanta.2014.07.080.
[62] HSIAO H Y, CHEN B H, KAO T H. Correction to analysis of heterocyclic amines in meat by the quick, easy, cheap, effective,rugged, and safe method coupled with LC-DAD-MS-MS[J]. Journal of Agricultural and Food Chemistry, 2017, 65(51): 11329-11329.DOI:10.1021/acs.jafc.7b05430.
[63] KAMANKESH M, MOLLAHOSSEINI A, MOHAMMADI A, et al.HAAs in grilled meat: determination using an advanced lab-on-a-chip flat electromembrane extraction coupled with on-line HPLC[J]. Food Chemistry, 2019, 311: 125876. DOI:10.1016/j.foodchem.2019.125876.
[64] VICHAPONG J, BURAKHAM R, SRIJARANAI S. Air-agitated cloud-point extraction coupled with high-performance liquid chromatography for determination of heterocyclic aromatic amines in smoked sausages[J]. Food Analytical Methods, 2017, 10(6): 1645-1652. DOI:10.1007/s12161-016-0733-x.
[65] LÓPEZ C, ZOUGAGH M, ALGARRA M, et al. Microwaveassisted synthesis of carbon dots and its potential as analysis of four heterocyclic aromatic amines[J]. Talanta, 2015, 132: 845-850.DOI:10.1016/j.talanta.2014.10.008.
[66] LEE Y, HWANG I, KIM H, et al. Validation of analytical methods for heterocyclic amines in seven food matrices using high-performance liquid chromatography-tandem mass spectrometry[J]. Food Additives and Contaminants Part A: Chemistry Analysis Control Exposure and Risk Assessment, 2019, 37(3): 408-420. DOI:10.1080/19440049.2019.1697829.
[67] KWAK E Y. Method validation of heterocyclic amines in fish with LC-MS/MS[J]. Drug Metabolism and Pharmacokinetics, 2017, 32(1):S29-S29. DOI:10.1016/j.dmpk.2016.10.134.
[68] TORIBIO F, BUSQUETS R, PUIGNOU L, et al. Heterocyclic amines in griddled beef steak analysed using a single extract clean-up procedure[J]. Food and Chemical Toxicology, 2006, 45(4): 667-675.DOI:10.1016/j.fct.2006.10.016.
[69] LINGHU Z, KARIM F, TAGHVAEI M, et al. Determination of heterocyclic amines in meat matrices using enhanced matrix removal-lipid extraction and liquid chromatography-tandem mass spectrometry[J]. Journal of Food Science, 2019, 84(7): 1992-2002.DOI:10.1111/1750-3841.14674.
[70] KHAN M R, NAUSHAD M, ALOTHMAN Z A, et al. Solid phase extraction and ultra performance liquid chromatography-tandem mass spectrometric identification of carcinogenic/mutagenic heterocyclic amines in cooked camel meat[J]. RSC Advances, 2015, 5(4): 2479-2485. DOI:10.1039/c4ra13967d.
[71] BARCELÓ-BARRACHINA E, MOYANO E, GALCERAN M T,et al. Ultra-performance liquid chromatography-tandem mass spectrometry for the analysis of heterocyclic amines in food[J].Journal of Chromatography A, 2006, 1125(2): 195-203. DOI:10.1016/j.chroma.2006.05.060.
[72] CHEVOLLEAU S, BOUVILLE A, DEBRAUWER L. Development and validation of a modified QuEChERS protocol coupled to UHPLC-APCI-MS/MS for the simple and rapid quanti fication of 16 heterocyclic aromatic amines in cooked beef[J]. Food Chemistry,2020, 316: 126327. DOI:10.1016/j.foodchem.2020.126327.
[73] MANFUL C F, VIDAL N P, PHAM T H, et al. Rapid determination of heterocyclic amines in ruminant meats using accelerated solvent extraction and ultra-high performance liquid chromatograph-mass spectrometry[J]. MethodsX, 2019, 6: 2686-2697. DOI:10.1016/j.mex.2019.11.014.
[74] YAN Yan, ZHANG Shuang, TAO Guanjun, et al. Acetonitrile extraction coupled with UHPLC-MS/MS for the accurate quanti fication of 17 heterocyclic aromatic amines in meat products[J].Journal of Chromatography B, 2017, 1068: 173-179. DOI:10.1016/j.jchromb.2017.10.015.
[75] 王翊如, 陈方翔, 施雅梅, 等. 耐压多样品微量衍生反应装置在气相色谱-质谱联用法分析极性杂环胺中的应用[J]. 色谱, 2013, 31(1):4-9. DOI:1000-8713(2013)01-0004-06.
[76] FEI Xiaoqing, LI Chen, YU Xiaodong, et al. Determination of heterocyclic amines by capillary electrophoresis with UV-DAD detection using on-line preconcentration[J]. Journal of Chromatography B,2007, 854(1): 224-229. DOI:10.1016/j.jchromb.2007.04.031.
[77] SENTELLAS S, MOYANO E, PUIGNOU L, et al. Determination of heterocyclic aromatic amines by capillary electrophoresis coupled to mass spectrometry using in-line preconcentration[J]. Electrophoresis,2003, 24(17): 3075-3082. DOI:10.1002/elps.200305523.
[78] ROSALES-CONRADO N, LEÓN-GONZÁLES M E, PÉREZARRIBAS L V, et al. Determination of heterocyclic aromatic amines by capillary high-performance liquid chromatography with diode array detection in ready-to-eat cooked ham treated with electron-beam irradiation[J]. Analytical and Bioanalytical Chemistry, 2008, 391(4):1433-1442. DOI:10.1007/s00216-007-1826-6.
[79] GONZALO-LUMBRERAS R, ROSALES-CONRADO N, LEÓNGONZÁLEZ M E, et al. Capillary liquid chromatography with diode array and mass spectrometry detection for heterocyclic aromatic amine determination in ready-to-eat food treated with electron-beam irradiation[J]. Journal of Chromatography A, 2010, 1217(43): 6778-6784. DOI:10.1016/j.chroma.2010.06.073.
[80] SHENG Wei, RAN Xuqin, HU Gaoshuang, et al. Development of an enzyme-linked immunosorbent assay for the detection of 2-amino-3-methylimidazo[4,5-f]quinoline (IQ) in processed foods[J]. Food Analytical Methods, 2015, 9(4): 1036-1045. DOI:10.1007/s12161-015-0282-8.
[81] 王静, 马宁宁, 宋洋. 杂环胺人工抗原的合成以及多克隆抗体的制备[J]. 食品科学, 2017, 38(4): 45-50. DOI:10.7506/spkx1002-6630-201704008.
[82] JAUTZ U, GIBIS M, MORLOCK G E. Quanti fication of heterocyclic aromatic amines in fried meat by HPTLC/UV-FLD and HPLC/UVFLD: a comparison of two methods[J]. Journal of Agricultural and Food Chemistry, 2008, 56(12): 4311-4319. DOI:10.1021/jf800689h.
[83] CHANG C C, KAO T H, ZHANG D, et al. Application of QuEChERS coupled with HPLC-DAD-ESI-MS/MS for determination of heterocyclic amines in commercial meat products[J]. Food Analytical Methods, 2018, 11(11): 3243-3256. DOI:10.1007/s12161-018-1302-2.
[84] JINAP S, JAAFAR S N, HASNOL N D S, et al. Effect of a different mobile phase on LC-ESI-MS/MS performance for the identi fication and quantitation of polar and nonpolar heterocyclic amines in cooked chicken[J]. Journal of Food Measurement and Characterization, 2019,14(1): 262-271. DOI:10.1007/s11694-019-00288-0.
[85] BARZEGAR F, KAMANKESH M, MOHAMMADI A. Heterocyclic aromatic amines in cooked food: a review on formation, health risktoxicology and their analytical techniques[J]. Food Chemistry, 2019,280: 240-254. DOI:10.1016/j.foodchem.2018.12.058.