低温鸡肉制品是指在温度较低的条件下处理鸡肉,使其中心温度达到75~85 ℃,并在0~4 ℃条件下进行贮藏、销售的鸡肉制品[1-2]。低温加工过程不仅能提高鸡肉制品的安全性,保持其原有感官形态,而且能减少营养成分损失,保证其食用价值。因此,低温杀菌技术是一种比较科学且具有较好发展前景的加工技术。但是低温鸡肉制品水分含量和pH值较高,且处理温度较低,极易造成腐败微生物的繁殖,导致食品变质[3],带来一些食品安全问题。传统热杀菌技术会严重影响低温鸡肉制品品质,非热杀菌技术能实现低温鸡肉制品的灭菌,且能较好保持产品品质。目前,低温鸡肉制品比较常用的非热杀菌技术主要有超高压、辐照、超声、等离子体、脉冲紫外线、脉冲电场和脉冲微波等,这些技术不仅能有效控制低温鸡肉制品中微生物的生长,而且能较好保留产品的营养物质和风味,具有良好的应用前景。
本文主要探讨超高压、超声波、低温等离子体、辐照、高压脉冲电场、脉冲微波及脉冲紫外线等非热杀菌技术在低温鸡肉制品致病菌控制中的应用进展,为上述技术在低温鸡肉制品中的应用提供参考。
1 肉制品中常见的食源性致病菌
食源性致病菌污染不仅降低了鸡肉的营养质量和感官品质,而且极易引发食品安全事件,造成重大的经济损失。国家卫生和计划生育委员会关于2015年全国食物中毒事件情况的通报显示,2015年我国发生食物中毒事件169 起,中毒总人数5 926 人,其中由细菌引起的食物中毒占全年食物中毒总数的53.7%[4],可见食源性细菌污染已经不容忽视。
肉制品中常见的食源性细菌主要有沙门氏菌、致病性大肠杆菌、耶尔森菌、单核细胞增生李斯特菌、空肠弯曲杆菌、志贺氏菌、副溶血性弧菌、葡萄球菌、产气荚膜梭状杆菌、蜡状芽孢杆菌和肉毒梭菌等[5]。Ahmed等[6]从肉制品中分离出大肠杆菌、志贺氏菌、沙门氏菌等多个菌种,并且发现食源性细菌导致的疾病在乳制品中的发病率明显高于肉制品。Pernu等[7]从香肠中分离出肉毒梭菌,发现肉毒梭菌能在低温条件下产生毒素。Maung等[8]从福冈地区鸡肉中分离出李斯特菌,并对2012—2017年间菌株的抗药性及污染率进行研究,发现近几年来菌株的耐药性逐渐增强。Würfel等[9]发现,空肠弯曲杆菌主要存在于家禽来源的肉制品中,经空肠弯曲杆菌污染的鸡肉会引发严重的食品安全事故,极大缩短产品货架期。Wang Huhu等[10]对肉制品中的大肠杆菌进行研究,发现大肠杆菌会在肉制品表面形成一种生物膜,这种生物膜会污染肉制品,缩短货架期。Peng Zixin等[11]从猪粪和新鲜鸡肉中分离出致病性小肠结肠炎杆菌,该菌的多重耐药性和毒力基因分布频率较高,对人类健康存在潜在威胁。因此,要控制养殖场对动物使用抗菌药物,减少相关食品的污染。Momtaz等[12]研究发现,小肠结肠炎杆菌主要来自于鸡肉。Lee等[13]开发了一种改良的选择培养基,用于食品中志贺氏菌的检测和分离。鉴于食源性致病菌的危害,采用合理的杀菌技术控制低温肉制品中致病菌的污染和繁殖,成为目前肉制品行业的重要问题。
2 非热杀菌技术的杀菌机制及其在低温鸡肉制品中的应用
低温鸡肉的保鲜处理有2 种方法:1)传统的热杀菌技术,如巴氏杀菌、高温杀菌,这种杀菌方式主要通过高温加热过程使微生物的代谢紊乱,从而导致微生物失活,但是,高温加热过程不但影响鸡肉的感官形态,而且破坏了鸡肉原有的营养成分;2)非热杀菌技术,如超高压、超声波、低温等离子体、辐照、高压脉冲电场、脉冲微波及脉冲紫外线等。与热杀菌技术相比,非热杀菌技术由于处理条件相对温和,具有保护鸡肉营养和感官品质的优势[14]。上述非热杀菌技术的杀菌机制如图1所示。本文综述超高压、超声波、低温等离子体、辐照、高压脉冲电场、脉冲微波及脉冲紫外线几种非热杀菌技术对低温鸡肉的杀菌效果及其杀菌机理。
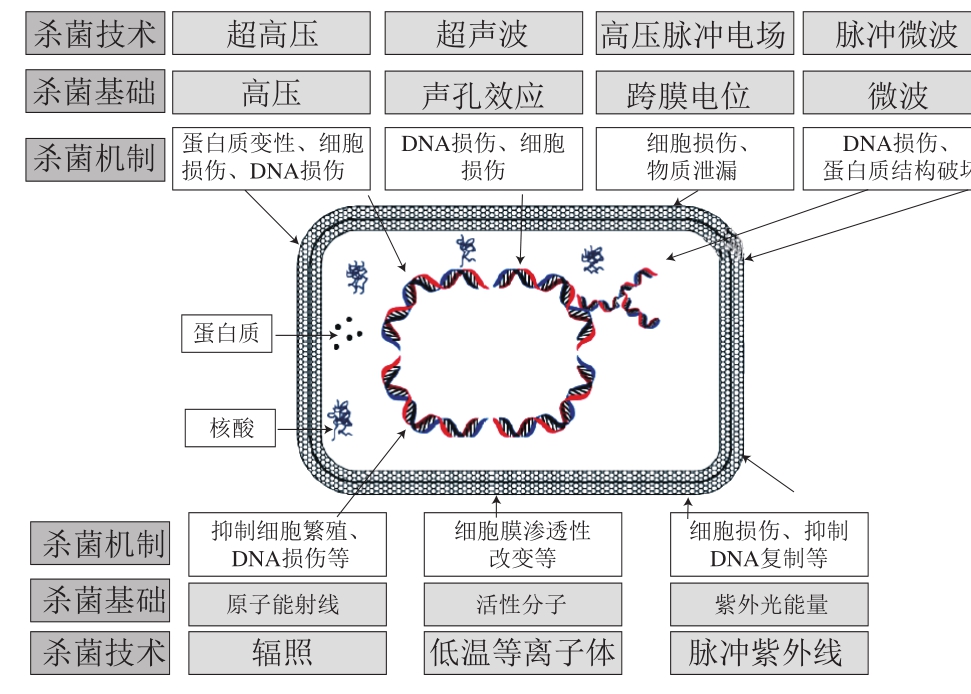
图1 常见非热杀菌技术的杀菌机制[15]
Fig. 1 Inactivation mechanism of microorganisms in non-conventional processing technologies[15]
2.1 超高压
超高压杀菌技术是指将食品物料经软包装后放入液体介质(如水等)中,使用100~1 000 MPa压力在常温或低温条件下作用一段时间,从而达到杀菌的目的。大量研究表明,超高压技术具有灭菌效果好、对食品营养破坏小、安全性高等优点[16]。超高压杀菌作为一种低温杀菌技术具有良好的应用前景。
超高压杀菌技术主要通过控制微生物的生理机能来保鲜食品。在超高压条件下,微生物的细胞膜会被损伤,蛋白质变性,细胞内pH值降低,这些是导致微生物失活的重要原因[17]。赵永强等[18]研究表明,超高压杀菌可以灭活几乎所有的细菌和酵母菌。Reineke等[19]研究高压热灭菌过程中细胞内孢子灭活后的最小菌数,结果表明,孢子对压力和温度联合处理的抗性与其保留吡啶二羧酸的能力有关。
商业中关于超高压的使用,最常见的压力水平为100~600 MPa,延长肉类保质期的最佳压力水平为600 MPa[20]。Ahmed等[21]研究高压灭菌处理在鸡肉冷藏过程中对单核细胞增生李斯特菌及鼠伤寒沙门氏菌的灭活和抑制作用发现,使用300 MPa压力处理鸡肉,包装后冷藏21 d会将病原微生物的数量降至安全水平。Sheen等[22]研究鸡肉灭菌的最佳压力参数,结果表明,应采用单循环模式运行10 min,压力450 MPa,如果循环次数太多,则会导致鸡肉内部结构损伤严重。
2.2 超声波
超声波是指频率20 kHz及以上的声波,因其超出人所能听到的声波范围,故称为超声波。食品工业中常使用的超声灭菌技术是指频率20~100 kHz的超声波。超声波具有的杀菌效力主要归因于空化作用。与传统杀菌方式相比,超声杀菌具有灭菌速率快、营养成分损失少、加工时间短等优点。但是,单独使用超声杀菌时对微生物的灭活效果并不理想。因此,常将超声波和一些灭菌剂联合使用进行杀菌。
超声灭菌使微生物失活的原理主要有2 种:低频率超声波基于超声造成的空化作用使微生物失活;高频率超声波通过破坏细胞结构使微生物失活[23]。空化作用是指当超声传播通过介质时,液体介质分子的周期性交替拉伸和压缩,这种交替的压力变化导致在液体介质中形成气泡,在超声作用下,空化气泡振荡、生长和破裂,短时间内产生高达5 000 K的温度和50 MPa的压力[24]。Guo Liping等[25]研究超声波对微生物的具体破坏作用发现,超声灭菌会改变细胞内的组织结构及蛋白质构象,最终导致微生物细胞的紊乱、裂解和死亡。
许多研究表明,超声常与其他灭菌方式结合用于肉制品工业,抑制细菌生长。靳慧杰[26]研究超声杀菌对冷却肉保质期的影响,结果表明,使用40 kHz超声波加工20 min可以显著增强保鲜剂对冷却肉的保鲜效果,与对照组相比保质期延长9 d,与单独使用保鲜剂处理组相比保质期延长3 d。Lee等[27]研究乙醇和超声波共同处理对鸡肉表皮中大肠菌群及鼠伤寒沙门氏菌的影响,发现在不破坏鸡肉表皮完整的情况下,使用体积分数30%乙醇和超声联合处理对鸡肉表皮的灭菌效果最好。Lin Lin等[28]研究超声对大肠杆菌悬液的灭活效果,得出灭活大肠杆菌的最佳工艺参数为处理时间7 min、超声功率100 W、超声强度50 W/cm2。Alexandre等[29]研究发现,使用25 kHz频率超声波与酸性电解水协同杀菌时,鸡胸肉上细菌的初始菌落数量显著减少。
2.3 低温等离子体
等离子体是指带有电粒子和中性粒子的电离气体,包含多种物理和化学效应,如紫外辐射、电磁场、热效应、带电粒子和活性粒子等。等离子体是一种宇宙中常见的物质,是在电场和磁场作用下形成的离子化气体状物质,被称为是除固体、气体、液体外的第4种物质。低温等离子体灭菌作为一种新型灭菌技术具有环保性强、作用时间短、安全性高等优点,因此主要应用于食品工业与生物医药行业的消毒灭菌。但因其对技术的要求较高,且对食品内部结构的破坏作用还不甚明确,因此低温等离子体的推广应用还需进一步研究。
低温等离子体之所以能够灭菌,主要是由于超氧化物、羟自由基、过氧化氢、一氧化氮和臭氧等活性物质和带电粒子作用于细胞膜及胞内遗传物质,扰乱细胞正常生理功能,从而导致细胞的裂解和死亡[30]。等离子体灭菌可有效作用于细菌、酵母菌及其他有害微生物,甚至较难灭活的孢子[31]。
目前,低温等离子体灭菌主要应用于食品、医学、包装材料等领域。Yeong等[32]研究低温等离子体处理对加工鸡胸肉中大肠杆菌、沙门氏菌、单核细胞增生李斯特菌的影响,发现低温等离子体在39 kV和3.5 min条件下可以使沙门氏菌、大肠杆菌、单核细胞增生李斯特菌数量分别降低3.7、3.9、3.5 (lg(CFU/g))。Rkia等[33]研究表明,100 kV的低温等离子体处理条件下,可以在不改变鸡胸肉质量的情况下,显著抑制鸡胸肉表面腐败微生物的生长,并且贮藏24 d后,经低温等离子体处理的鸡胸肉微生物含量低于未处理的鸡胸肉。Kuwahara等[34]研发一种等离子体射流杀菌装置,经多次实验研究表明,等离子体射流1 s可杀灭88%的细菌和酵母菌,等离子体射流5 s,细菌完全被杀灭。
2.4 辐照
食品辐射(或辐照)杀菌是利用一定剂量波长极短的电离射线对食品(包括原材料)进行杀菌,如利用放射线同位素60Co、157Cs产生的γ射线或低能加速器放射出的β射线对包装食品进行辐照处理。辐照杀菌安全性高、价格便宜、应用范围广,能够保证食品中的营养成分和风味物质不受破坏。由于辐照穿透力强,对食品表面和内部的微生物均有明显的杀菌效果[35]。
辐照灭菌技术主要通过利用原子能射线的能量破坏微生物细胞核内DNA,从而引起微生物死亡,且该射线所产生的活性粒子对细菌也有强烈的杀伤作用。辐照灭菌可有效作用于芽孢菌和酵母菌。许佳[36]研究发现,将空肠弯曲菌以1010 CFU/mL接种于鸡胸肉表面,当电子束剂量为0.15、0.20、0.30、0.40、0.50 kGy时,电子束辐照可以有效灭活鸡胸肉表面的空肠弯曲菌。Song等[37]研究发现,当γ射线辐照剂量为10 kGy时,所有微生物均被灭活,当γ射线辐照剂量大于10 kGy时,食品的所有感官特性偏好得分会下降。
目前,辐照灭菌在延长禽肉制品、卤制品、即食菜肴等多种食品的货架期方面有显著效果[38]。Hassanzadeh等[39]研究表明,低剂量(约2.5 kGy)γ射线辐照鸡肉可以使鸡肉的保质期延长2 周以上。Fallah等[40]研究表明,当使用4.5 kGy射线辐照烤鸡肉时,没有检测到任何食源性病原体,且辐照对烤鸡肉的感官质量没有任何不良影响,贮藏期结束时,辐照样品比未辐照样品更容易接受。彭玲等[41]探讨利用60Co γ射线辐照酱卤鸡爪延长其货架期的效果,结果表明,60Co γ射线辐照对酱卤鸡爪杀菌效果明显,样品初始菌落总数为4.3×102 CFU/g,经4.09 kGy剂量辐照后可降至10 CFU/g。
2.5 高压脉冲电场
高压脉冲电场杀菌又称为高强度脉冲电场杀菌,是将高电压的脉冲反复作用于物料,用于杀灭食品中微生物的一种方式。与热杀菌相比,高压脉冲电场杀菌具有杀菌时间短、对营养物质破坏小、对感官品质影响小等优点。但是目前关于高压脉冲电场杀菌技术的杀菌效果还有待进一步研究。
高压脉冲电场杀菌的机理主要是通过瞬时高压脉冲发生器产生的脉冲电场作用于食品,当食品物料通过处理室时,微生物的细胞结构受到电场强度的破坏,菌体死亡,从而达到灭菌目的。常见的关于高压脉冲电场杀菌理论的假说主要有细胞膜穿孔效应、电磁机制模型、电解产物效应、臭氧效应、黏弹极性形成模型和空穴理论等。Zhu Ning等[42]研究设计脉冲电场处理室,结果表明,所设计的电场处理室能有效灭活大肠杆菌和金黄色葡萄球菌等致病菌。曾新安等[43]研究脉冲电场作用对沙门氏菌的杀菌机理,发现脉冲电场主要通过增大细胞膜的通透性和降低细胞膜流动性最终导致细胞损伤或死亡。
谢媚等[44]研究高压脉冲电场杀菌在鸡肉制品中的应用,结果表明,当使用1.36 kV·cm电场强度、40 次脉冲结合200 MPa高压处理后,鸡肉的微观结构发生变化但不明显,然而对微生物的影响显著。Haughton等[45]研究发现,高压脉冲电场虽然不适合用于生鸡肉的灭菌,但是对于控制鸡肉加工过程中冷水中微生物的数量有重要作用,可以减少水的污染。Clemente等[46]研究高压脉冲电场与多种有机酸结合对鸡腿肉中空肠弯曲杆菌的杀菌效果,结果表明,高压脉冲电场与有机酸协同杀菌效果明显优于单独使用高压脉冲电场杀菌,这种协同杀菌方式可使空肠弯曲杆菌的最大减少量接近1.5 CFU/g。
2.6 脉冲微波
微波是由磁控管的微波产生器产生出的高频波段电磁波,具有电磁波所有的波动特性(如反射、透射、干涉和衍射),微波频率为300 MHz~300 GHz。微波杀菌具有作用时间短、温度上升速率快、消耗能量少、对物料营养成分破坏小等优点[47]。但是如果电磁场分布不均匀,容易导致杀菌不均匀,无法对杀菌的物料进行精确预测。
微波杀菌的主要机理是微波具有热效应和非热效应2 种作用,微生物在2 种效应共同作用下,其内部的蛋白质结构及营养物质结构受到破坏,从而导致微生物死亡。
王婧宇等[48]研究发现,经微波杀菌处理后的鸡肉样品贮藏期变长,且胀袋情况明显减少,保质期内的评分在可接受范围内。Portela等[49]研究微波杀菌对沙门氏菌的灭活作用发现,当微波功率为20 W,处理时间大于750 s时,沙门氏菌数量减少9.26 (lg(CFU/mL)),其他功率(40、60、80 W)、处理时间90~120 s条件下,微生物存活率很低。Benlloch-Tinoco等[50]研究微波功率对单核细胞增生李斯特菌灭活的影响,结果表明,微波功率越大,失活速率越快,在900、1 000 W微波功率加热下,单核细胞增生李斯特菌失活速率比传统热处理快。因此,微波加热是一种有效的杀菌方式,可以灭活食品中的单核细胞增生李斯特菌。Medina-Meza等[51]对微波灭菌过程中肉类营养成分损失进行研究,随着灭菌时间延长,肉制品特性会发生显著变化,这是由于肉中的蛋白变性导致终点核心温度升高,从而导致肌纤维收缩。
2.7 脉冲紫外线
脉冲紫外线是将瞬间放电的脉冲工程技术和特殊的惰性气体灯管相结合,以脉冲形式激发出的紫外线,它利用瞬时、高强度的脉冲光能量杀灭各类微生物,从而弥补传统热杀菌和化学杀菌的缺陷。脉冲紫外线杀菌具有杀菌时间短、污染小、不与物料直接接触、对物料营养成分破坏小等优点,但其在杀菌过程中容易产生一些有毒有害物质,且杀菌效果不容易被监测,有杀菌不彻底的风险。
波长200~300 nm的紫外线都具有杀菌能力。紫外线照射使微生物致死的主要原因是胸腺嘧啶的光化学转变,使得细胞DNA链上相邻的胸腺嘧啶共价结合形成二聚体,这种二聚体的存在阻碍了DNA链的复制,致使细胞死亡。贺莹[52]对紫外线杀菌对大肠杆菌、沙门氏菌等菌体的杀菌效果进行研究,发现波长为253.7 nm的深紫外线容易破坏细菌的DNA结构,使之失去繁殖和自我复制功能,从而达到杀菌目的。Artíguez等[53]研究脉冲紫外线对芽孢杆菌的灭活作用,结果表明,经1.7、4.5 J/cm2脉冲紫外光处理后,芽孢杆菌数量降低6.8 (lg(CFU/cm2)),且随着细胞密度的增加,灭活效果逐渐减弱。Xu Limei等[54]研究发现,在高剂量的紫外线处理下,可以检测到DNA的轻微损伤,并且mRNA的衰减比DNA的衰减更快。
Chun等[55]研究发现,使用5 kJ/m2的紫外线辐射鸡胸肉,可使得鸡胸肉中空肠弯曲杆菌、单核细胞增生李斯特菌和鼠伤寒沙门氏菌初始菌数分别降低1.26、1.29、1.19 CFU/g。Sommers等[56]进行相似研究发现,当使用紫外线杀菌时,无骨去皮鸡胸肉上的无毒鼠疫杆菌数量约减少1 (lg(CFU/g))。沙门氏菌、大肠杆菌、单核细胞增生李斯特菌及金黄色葡萄球菌在紫外线照射下均会表现出失活行为[57]。
3 结 语
随着食品工业的迅速发展,低温鸡肉制品将是我国肉制品发展的一大趋势。但是,低温鸡肉对于运输、贮藏条件要求较高,因此其发展还面临许多挑战。杀菌是解决低温鸡肉保鲜问题的关键技术之一。与传统热杀菌技术相比,非热杀菌技术不用经过强烈的热处理,非常适用于低温鸡肉的保鲜。因此,非热杀菌技术必将成为未来肉制品保鲜研究的热点。但是,目前非热杀菌技术依然存在灭菌参数不佳及灭菌效果达不到理想状态等问题。不同非热杀菌技术既有其优点,也有其自身的局限性。因此,在今后的研究工作中,协同杀菌技术将是另一研究热点。协同杀菌技术是指将2 种或2 种以上非热杀菌方式组合用于物料的杀菌,这种杀菌方式可以弥补各杀菌方式的缺陷,使得灭菌效果达到最佳状态。协同杀菌技术可以有效控制低温肉制品中微生物的繁殖,提高产品质量。俞建峰等[58]研究微波与巴氏杀菌组合在鸡爪灭菌中的应用,发现这种组合杀菌方式可以使鸡爪达到商业无菌的状态,灭菌效果比单一非热灭菌技术好。因此,今后应加强协同杀菌技术的研究,以推动非热杀菌技术在低温肉制品中的应用。
[1] 贺羽, 王帅, 金益, 等. 天然保鲜剂对低温肉制品的保鲜作用[J].江苏农业科学, 2019, 47(1): 177-182. DOI:10.15889/j.issn.1002-1302.2019.01.043.
[2] 郭向莹, 李伟群, 孙仪, 等. 超高压处理对低温鸡肉早餐肠在冷藏期间脂肪氧化的影响[J]. 食品科学, 2013, 34(16): 323-327.DOI:10.7506/spkx1002-6630-201316065.
[3] 王文静, 韩月杰, 王立钊. 低温肉制品微生物污染风险及防控关键技术[J]. 当代畜禽养殖业, 2018(11): 40. DOI:10.14070/j.cnki.15-1150.2018.11.037.
[4] 蒋灵, 温贵兰, 张升波. 超市肉制品细菌污染情况调查[J]. 当代畜禽养殖业, 2019(11): 17-18. DOI:10.14070/j.cnki.15-1150.2019.11.006.
[5] 郑婷. 冷却牛肉中沙门氏菌的生长动力学模型和热失活模型的建立[D]. 泰安: 山东农业大学, 2015: 1-5.
[6] AHMED A M, SHIMAMOTO T. Isolation and molecular characterization of Salmonella enterica, Escherichia coli O157:H7 and Shigella spp. from meat and dairy products in Egypt[J]. International Journal of Food Microbiology, 2014, 168/169(1): 57-62. DOI:10.1016/j.ijfoodmicro. 2013.10.014.
[7] PERNU N, KETO-TIMONEN R, LINDSTRONMET M, et al. High prevalence of Clostridium botulinum in vegetarian sausages[J]. Food Microbiology, 2020, 91: 103512. DOI:10.1016/j.fm.2020.103512.
[8] MAUNG A T, MOHAMMAD T N, NAKASHIMA S, et al.Antimicrobial resistance profiles of Listeria monocytogenes isolated from chicken meat in Fukuoka, Japan[J]. International Journal of Food Microbiology, 2019, 304: 49-57. DOI:10.1016/j.ijfoodmicro.2019.05.016.
[9] WÜRFEL S F R, DA SILVA W P, DE OLIVEIRA M G, et al. Genetic diversity of Campylobacter jejuni and Campylobacter coli isolated from poultry meat products sold on the retail market in Southern Brazil[J]. Poultry Science, 2018, 98(2): 932-939. DOI:10.3382/ps/pey365.
[10] WANG Huhu, WANG XianJing, YU Lanlin, et al. Resistance of biofilm formation and formed-biofilm of Escherichia coli O157:H7 exposed to acid stress[J]. LWT-Food Science and Technology, 2020,118: 1-6. DOI:10.1016/j.lwt.2019.108787.
[11] PENG Zixin, ZOU Mingyuan, LI Menghan, et al. Prevalence,antimicrobial resistance and phylogenetic characterization of Yersinia enterocolitica in retail poultry meat and swine feces in parts of China[J]. Food Control, 2018, 93: 121-128. DOI:10.1016/j.foodcont.2018.05.048.
[12] MOMTHAZ H, DAVOOD R M, SAFARPOOR D F. Identi fication and characterization of Yersinia enterocolitica isolated from raw chicken meat based on molecular and biological techniques[J]. The Journal of Applied Poultry Research, 2013, 22(1): 137-145. DOI:10.3382/japr.2012-00549.
[13] LEE J Y, KANG D H. Development of an improved selective medium for the detection of Shigella spp.[J]. LWT-Food Science and Technology, 2016, 65: 311-317. DOI:10.1016/j.lwt.2015. 08.028.
[14] 刘玲, 郭全友, 李保国, 等. 非热杀菌技术在虾类保鲜与加工中的应用[J]. 食品与发酵科技, 2018, 54(2): 87-91; 112. DOI:10.3969/j.issn.1674-506X.2018.02-019.
[15] BARBA F J. Mild processing applied to the inactivation of the main food-borne bacterial pathogens: a review[J]. Trends in Food Science and Technology, 2017, 66: 20-35. DOI:10.1016/j. tifs.2017.05.011.
[16] LI X, FARID M. A review on recent development in non-conventional food sterilization technologies[J]. Journal of Food Engineering, 2016,182: 33-45. DOI:10.1016/j.jfoodeng.2016.02.026.
[17] HUANG M, ZHANG M, BHANDARI B. Recent development in the application of alternative sterilization technologies to prepared dishes:a review[J]. Critical Reviews in Food Science and Nutrition, 2018,59(7): 1188-1196. DOI:10.1080/10408398.2017.1421140.
[18] 赵永强, 张红杰, 李来好, 等. 水产品非热杀菌技术研究进展[J].食品工业科技, 2015, 36(11): 394-399. DOI:10.13386/j.issn1002-0306.2015.11.071.
[19] REINEKE K, SCHLUMBACH K, BAIER D, et al. The release of dipicolinic acid: the rate-limiting step of Bacillus endospore inactivation during the high pressure thermal sterilization process[J].International Journal of Food Microbiology, 2013, 162(1): 55-63.DOI:10.1016/j.ijfoodmicro.2012.12.010.
[20] WANG C Y, HUANG H W, HSU C P, et al. Recent advances in food processing using high hydrostatic pressure technology[J]. Food Science Nutrition, 2018, 56(4): 527-540. DOI:10.1080/10408398.2012.745479.
[21] AHMED J, HIREMATH N, JACOB H. Efficacy of antimicrobial properties of polylactide/cinnamon oil film with and without highpressure treatment against Listeria monocytogenes and Salmonella typhimurium inoculated in chicken sample[J]. Food Packaging and Shelf Life, 2016, 10: 72-78. DOI:10.1016/j.fpsl.2016.10.003.
[22] SHEEN S, CASSIDY J, SCULLEN B, et al. Inactivation of Salmonella spp. in ground chicken using high pressure processing[J].Food Control, 2015, 57: 41-47. DOI:10.1016 /j.foodcont.2015.04.005.
[23] 雷辰, 夏延斌, 车再全, 等. 超声处理技术在肉类工业中的应用研究进展[J]. 食品与机械, 2016, 32(5): 232-236. DOI:10.13652/j.issn.1003-5788.2016.05.053.
[24] CHEN Fengying, ZHANG Min, Yang Chaohui. Application of ultrasound technology in processing of ready-to-eat fresh food: a review[J]. Ultrasonics Sonochemistry, 2019, 63: 104953. DOI:10.1016/j.ultsonch.2019.104953.
[25] GUO Liping, SUN Yongcai, ZHU Yinglian, et al. The antibacterial mechanism of ultrasound in combination with sodium hypochlorite in the control of Escherichia coli[J]. Food Research International, 2020,129: 108887. DOI:10.1016/j.foodres.2019.108887.
[26] 靳慧杰. 超声波对冷却肉杀菌保鲜作用的研究[D]. 保定: 河北农业大学, 2008: 21-26.
[27] LEE N Y, PARK S Y, KANGI S, et al. The evaluation of combined chemical and physical treatments on the reduction of resident microorganisms and Salmonella typhimurium attached to chicken skin[J]. Poultry Science, 2014, 93(1): 208-215. DOI:10.3382/ps.2013-03536.
[28] LIN Lin, WANG Xinlei, LI Changzhu, et al. Inactivation mechanism of E. coli O157:H7 under ultrasonic sterilization[J].Ultrasonics Sonochemistry, 2019, 59: 104751. DOI:10.1016/j.ultsonch.2019.104751.
[29] ALEXANDRE J C, FLORES D R M, MENEZES C R D, et al.Ultrasound and slightly acid electrolyzed water application: an efficient combination to reduce the bacterial counts of chicken breast during pre-chilling[J]. International Journal of Food Microbiology, 2019, 301:27-33. DOI:10.1016/j.ijfoodmicro.2019.05.004.
[30] 马佩沛. 国外冷等离子体技术在果蔬杀菌保鲜中的应用[J]. 甘肃农业科技, 2017(4): 65-68. DOI:10.3969/j.issn.1001-1463.2017.04.019.
[31] RONIT M, ANIKA S, PRATAP S A. Recent developments in cold plasma decontamination technology in the food industry[J]. Trends in Food Science and Technology, 2018, 80: 93-103. DOI:10.1016/j.tifs.2018.07.014.
[32] YEONG J O, SI H R, LEE S Y, et al. Inactivation of Escherichia coli O157:H7, Salmonella, Listeria monocytogenes, and Tulane virus in processed chicken breast via atmospheric in-package cold plasma treatment[J]. LWT-Food Science and Technology, 2020, 127: 109429.DOI:10.1016/j.lwt.2020.109429.
[33] RKIA M, MISRA N N, AUBREY M, et al. In-package decontamination of chicken breast using cold plasma technology:microbial, quality and storage studies[J]. Meat Science, 2020, 159:107942. DOI:10.1016/j.meatsci.2019.107942.
[34] KUWAHARA T, KUROKI T, YOSHIDA K, et al. Development of sterilization device using air non-thermal plasma jet induced by atmospheric pressure corona discharge[J]. Thin Solid Films, 2012,523: 2-5. DOI:10.1016/j.tsf.2012.05.064.
[35] 王文洁, 赵电波, 李可, 等. 非热杀菌技术在即食肉制品中的应用研究进展[J]. 肉类研究, 2019, 33(10): 69-75. DOI:10.7506/rlyj1001-8123-20190821-192.
[36] 许佳. 电子束辐照对鸡肉表面空肠弯曲菌作用机制及其灭菌工艺的初步研究[D]. 扬州: 扬州大学, 2019: 32-42.
[37] SONG B S, PARK J G, KIM J H, et al. Development of freezedried miyeokguk, Korean seaweed soup, as space food sterilized by irradiation[J]. Radiation Physics and Chemistry, 2012, 81(8): 1111-1114. DOI:10.1016/j.radphyschem.2011.10.025.
[38] 李澧, 朱佳廷, 冯敏, 等. 辐照灭菌对干制鸭肉品质的影响[J].江苏农业科学, 2012, 40(12): 278-280. DOI:10.15889/j.issn.1002-1302.2012.12.026.
[39] HASSANZADEH P, TAJIK H, ROHANI S M R, et al. Effect of functional chitosan coating and gamma irradiation on the shelflife of chicken meat during refrigerated storage[J]. Radiation Physics and Chemistry, 2017, 141: 103-109. DOI:10.1016/j.radphyschem.2017.06.014.
[40] FALLAH A A, SAEI-DEHKORDI S S, RAHNAMA M. Enhancement of microbial quality and inactivation of pathogenic bacteria by gamma irradiation of ready-to-cook Iranian barbecued chicken[J]. Radiation Physics and Chemistry, 2010, 79(10): 1073-1078. DOI:10.1016/j.radphyschem.2010.04.015.
[41] 彭玲, 徐远方, 李文革, 等. 60Co γ射线辐照对酱卤鸡爪杀菌效果及品质的影响[J]. 食品与机械, 2017, 33(12): 110-114; 34. DOI:10.13652/j.issn.1003-5788.2017.12.022.
[42] ZHU Ning, YANG Lan, YU Ning, et al. Design of a treatment chamber for low-voltage pulsed electric field sterilization[J]. Innovative Food Science and Emerging Technologies, 2017, 42: 180-189. DOI:10.1016/j.ifset.2017.07.016.
[43] 曾新安, 欧贇, 王满生. 脉冲电场对沙门氏菌细胞膜流动性的影响及其机理[J]. 华南理工大学学报(自然科学版), 2016, 44(10): 132-136.DOI:103969 /j.issn1000-565X.2016.10.019.
[44] 谢媚, 曹锦轩, 张玉林, 等. 高压脉冲电场杀菌技术在肉品加工中的应用进展[J]. 核农学报, 2014, 28(1): 97-100. DOI:10.11869/jissn.100-8551.2014.01.0097.
[45] HAUGHTON P N, LYNG J G, CRONIN D A, et al. Efficacy of pulsed electric fields for the inactivation of indicator microorganisms and foodborne pathogens in liquids and raw chicken[J]. Food Control,2012, 25(1): 131-135. DOI:10.1016/j.foodcont.2011.10.030.
[46] CLEMENTE I, CONDON-ABANTO S, PEDROS-GARRIDO S,et al. Efficacy of pulsed electric fields and antimicrobial compounds used alone and in combination for the inactivation of Campylobacter jejuni in liquids and raw chicken[J]. Food Control, 2020, 107: 1-8.DOI:10.1016/j. foodcont.2019.01.017.
[47] EKEZIE F G C, SUN D W, HAN Z, et al. Microwave-assisted food processing technologies for enhancing product quality and process efficiency: a review of recent developments[J]. Trends in Food Science and Technology, 2017, 67: 58-69. DOI:10.1016/j.tifs.2017.05.014.
[48] 王婧宇, 张慜, 杨朝晖. 纳米氧化锌结合低频微波杀菌对红酥鸡菜肴品质及货架期的影响[J]. 食品与生物技术学报, 2020, 39(1):76-83. DOI:10.3969/j.issn.1673-1689.2020.01.011.
[49] PORTELA J B, COIMBRA P T, CAPPATO L P, et al. Predictive model for inactivation of Salmonella in infant formula during microwave heating processing[J]. Food Control, 2019, 104: 308-312.DOI:10.1016/j.foodcont.2019.05.006.
[50] BENLLOCH-TINOCO M, CONSUELO P P M, MARTINEZNAVARRETE N, et al. Listeria monocytogenes inactivation kinetics under microwave and conventional thermal processing in a kiwifruit puree[J]. Innovative Food Science and Emerging Technologies, 2014,22: 131-136. DOI:10.1016/j.ifset.2014.01.005.
[51] MEDINA-MEZA I G, BARNABA C, BARBOSA-CANOVAS G V, et al.Effects of high pressure processing on lipid oxidation: a review[J].Innovative Food Science and Emerging Technologies, 2014, 22: 1-10.DOI:10.1016/j.ifset.2013.10.012.
[52] 贺莹. 紫外线杀菌结合气调包装技术对带鱼品质的影响[J]. 肉类研究, 2019, 33(1): 37-41. DOI:10.7506/rlyj1001-8123-20181026-204.
[53] ARTÍGUEZ M L, MARANON I M D. Inactivation of spores and vegetative cells of Bacillus subtilis and Geobacillus stearothermophilus by pulsed light[J]. Innovative Food Science and Emerging Technologies, 2015, 28: 52-58. DOI:10.1016/j.ifset.2015.01.001.
[54] XU Limei, ZHANG Chongmiao, XU Pengcheng, et al. Mechanisms of ultraviolet disinfection and chlorination of Escherichia coli:cultivability, membrane permeability, metabolism, and genetic damage[J]. Journal of Environmental Sciences, 2018, 65: 356-366.DOI:10.1016/j.jes.2017.07.006.
[55] CHUN H H, KIM J Y, LEEB D, et al. Effect of UV-C irradiation on the inactivation of inoculated pathogens and quality of chicken breasts during storage[J]. Food Control, 2010, 21(3): 276-280. DOI:10.1016/j.foodcont.2009.06.006.
[56] SOMMERS C, SHEEN S, SCULLEN O J, et al. Inactivation of Staphylococcus saprophyticus in chicken meat and purge using thermal processing, high pressure processing, gamma radiation, and ultraviolet light[J]. Food Control, 2017, 75: 78-82. DOI:10.1016/j.foodcont.2016.12.020.
[57] GABRIEL A A, MARQUEZ G F. Inactivation behaviors of selected bacteria in ultraviolet-C treated human breast milk[J]. Innovative Food Science and Emerging Technologies, 2017, 41: 216-223. DOI:10.1016/j.ifset.2017.03.010.
[58] 俞建峰, 倪蕾, 崔政伟, 等. 凤爪的微波与巴氏组合杀菌工艺研究[J]. 食品与生物技术学报, 2017, 36(7): 41-47. DOI:10.3969/j.issn.1673-1689.2017.07.007.