阿维菌素是由链霉菌产生的十六元大环内酯类化合物,对线虫和节肢动物均具有很强的驱杀作用,是目前兽医临床使用广泛的抗寄生虫药[1-3]。虽然阿维菌素类药物作用剂量较小(ng/kg级),但其脂溶性较高,且具有神经和发育毒性,在动物体内的残留时间较长。因此,按照世界卫生组织的5 级分类标准,将其列为高毒化合物[4]。美国、欧盟、联合国食品法典委员会(Codex Alimentarius Commission,CAC)和中国都制定了动物组织中阿维菌素类药物的最高残留限量。CAC及许多国家将该类化合物的残留限量设为10 μg/kg。我国农业农村部和国家市场监督管理总局2019年发布的GB 31650—2019《食品安全国家标准 食品中兽药最大残留限量》规定,阿维菌素在牛泌乳期禁用,牛脂肪、肝中的残留限量为100 μg/kg,肾脏中的残留限量为50 μg/kg。
目前,阿维菌素的主要检测方法包括高效液相色谱(high performance liquid chromatography,HPLC)[5-7]、HPLC-串联质谱(HPLC-tandem mass spectrometry,HPLC-MS/MS)[8-9]、免疫亲和色谱(immune affinity chromatography,IAC)[10-11]和酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)[12-13]等。仪器方法的灵敏度高、稳定性和重复性好,但也存在仪器设备昂贵、操作难度大、前处理较为复杂、检测时间长、检测成本较高等缺陷,因此不利于基层实验室的推广使用[14-16]。ELISA方法的灵敏度和检测通量等能够满足实际检测需求,但需要繁琐的洗板操作,检测时间也相对较长。时间分辨荧光免疫分析(timeresolved fluoroimmunoassay,TRFIA)技术是以镧系元素(包括铕、铽、钐、镝等)作为标记物,综合免疫反应的高特异性和镧系元素标记的高灵敏性建立的一种新型非放射性免疫检测技术。镧系元素具有Stokes位移大(>200 nm)和荧光寿命长(1~2 ms)等优点,可以在较大程度上避免激发光和背景荧光信号的干扰,极大提高检测灵敏度。鉴于此,TRFIA已广泛应用于人体和其他动物的临床诊断,以及食品安全检测等多个领域[17-19],但目前应用TRFIA检测牦牛肉中阿维菌素药物残留的报道还很少。为了提供一种成本低、操作简便、灵敏度高,且适用于基层实验室的牦牛肉中阿维菌素的定量检测方法,本研究基于TRFIA原理,建立一种定量测定牦牛肉中阿维菌素残留的快速检测方法,并对其灵敏度、准确度、精密度和稳定性等进行评价,为牦牛肉的检测方法开发提供科学依据。
1 材料与方法
1.1 材料与试剂
60 份牦牛肉样品均从青海省同仁县朝阳牛羊定点屠宰场购买。阿维菌素单克隆抗体G10703、羊抗鼠免疫球蛋白G(immunoglobulin,IgG)均由北京维德维康生物技术有限公司制备。
甲醇、乙腈、正己烷 国药集团化学试剂有限公司;牛血清蛋白(bovine serum albumin,BSA)美国Amresco公司;100、200、300 nm羧基化铕微球(激发光波长365 nm,发射光波长610 nm) 美国Creative Diagnostics公司;硝酸纤维素(cellulose nitrate,NC)膜美国Millipore公司;样品垫、吸收垫、聚氯乙烯(polyvinyl chloride,PVC)底板 上海良信科技有限公司;阿维菌素标准品(纯度≥95%) 美国Sigma公司。
1.2 仪器与设备
KQ-100E超声波清洗仪 昆山市超声仪器有限公司;TSQ Quantum Ultra液相色谱-串联质谱仪 美国Thermo Fisher Scientific公司;JYL-C090样品粉碎机 九阳股份有限公司;WH-400检测卡恒温孵育器、FQ-S2时间分辨荧光定量免疫分析仪(365 nm/610 nm) 北京维德维康生物技术有限公司。
1.3 方法
1.3.1 试剂的配制
储备液配制:准确称取1.0 mg阿维菌素标准品,用甲醇溶解并定容至10 mL,配制成100 mg/L标准储备液,于-20 ℃保存,备用。
复溶液配制:称取3.01 g磷酸氢二钠、0.25 g磷酸二氢钠、20 g BSA、5 g吐温-20、10 g蔗糖,加水溶解并定容至1 L,备用。
1.3.2 羧基化铕微球的标记
将50 μL羧基化铕微球加入450 μL活化缓冲液(0.05 mol/L 2-(N-吗啉代)乙磺酸,pH 5.0),超声5 min;向羧基化铕微球溶液中依次加入1 mmol/L 1-(3-二甲氨基丙基)-3-乙基碳二亚胺和1 mmol/L N-羟基丁二酰亚胺溶液,使其终浓度均为1 mmol/L,室温振荡反应30 min,15 000×g离心10 min,弃去上清液;将沉淀用500 μL偶联缓冲液(0.04 mol/L磷酸盐缓冲液,pH 8.0)复溶,超声5 min,加入20 μL 2 mg/mL阿维菌素单克隆抗体,室温水平摇床反应2 h,15 000×g离心5 min;向沉淀中加入500 μL封闭缓冲液(含0.01 mol/L磷酸盐缓冲液、2 g/100 mL BSA,pH 8.0),4 ℃振荡反应过夜;将反应液15 000×g离心5 min,弃上清,再次使用50 μL复溶液复溶微球,超声3 min,4 ℃避光保存备用[20]。
按照上述步骤,分别采用100、200、300 nm羧基化铕微球标记阿维菌素单克隆抗体,并依据试纸条的荧光强度和层析速率选择适用的羧基化铕微球。
1.3.3 试纸条的制备
用滑膜仪将阿维菌素抗原(0.25 μg/mL)和羊抗鼠IgG(11.65 μg/mL)分别包被在NC膜上,即为检测线(T线,0.9 μL/cm)和质控线(C线,0.9 μL/cm),37 ℃干燥2 h。将羧基化铕微球标记的阿维菌素单克隆抗体以不同喷量(2、3、4 μL/cm)喷涂在玻璃纤维材质的释放垫上,37 ℃干燥2 h[21]。依据试纸条微球释放情况、抑制率和重复性等结果,确定最佳的微球用量。参照图1分别将样品垫、释放垫、NC膜和吸水垫粘贴在PVC底板上,并将其斩切成3.95 mm宽度的试纸条,4 ℃条件下避光、干燥环境中保存。

图1 TRFIA检测试纸条结构示意图
Fig. 1 Schematic diagram of the time-resolved fluorescence immunochromatographic test strip
1.3.4 样品前处理
取适量(50~100 g)新鲜或解冻的牦牛肉样品,经样品粉碎机充分绞碎,均质,取(3.00±0.05) g均质后的样品,置于50 mL离心管中,依次加入50 μL甲酸、1.0 g氯化钠和6.0 mL乙腈,涡旋5 min,4 000 r/min离心5 min;取3 mL上清液置于5 mL离心管中,50~60 ℃水浴条件下氮气吹干,加入2 mL正己烷,充分涡旋20 s,再加入1 mL 10 mmol/L缓冲液(含1 g/100 mL BSA、0.5 g/100 mL吐温-20、1 g/100 mL蔗糖),低速涡旋1 min后,4 000 r/min离心5 min,完全弃去上层正己烷及中间层杂质,取100 μL下层溶液进行检测[22]。
1.3.5 检测步骤
将1.3.3节制备的阿维菌素试纸条从4 ℃取出,恢复至室温。取100 μL待测溶液滴加至试纸条的样本垫上,40 ℃恒温反应8 min后,使用TRFIA仪读取T线和C线处的相对荧光强度,并计算二者相对荧光强度比值(T/C)。
1.3.6 标准曲线的绘制
取经LC-MS/MS法[23]确证为阿维菌素阴性的牦牛肉样品,向其中添加阿维菌素药物标准溶液,使其添加量分别为0.0、0.5、1.0、2.0、4.0、8.0、16.0 μg/kg,充分混匀后,分别按照1.3.4、1.3.5节进行样本处理和检测。每个添加量分别重复检测5 次,取其平均值,以样本中阿维菌素标准品添加量为X轴,T/C比值为Y轴,用Origin 8.0(OriginLabCorp,Northampton,MA,USA)软件进行四参数曲线拟合。
1.3.7 定量限的测定
选取阿维菌素阴性牦牛肉样品20 份,按照1.3.4、1.3.5节进行样本处理和检测,依据1.3.6节建立的标准曲线计算结果的平均值和标准差。20 份样本测定结果的平均值加10 倍标准偏差即为本方法的定量限。
1.3.8 特异性实验
参照1.3.6节所述的方法,通过空白样本梯度加标实验,分别建立牦牛肉中伊维菌素、多拉菌素和依普菌素的竞争抑制曲线,分别计算结合率,求出各阿维菌素结构类似物的50%抑制浓度(half inhibitory concentration,IC50)(空白样本对应的T/C值)时的添加量,然后根据式(1)计算交叉反应率。
式中:B为IC50时阿维菌素添加量/(μg/kg);B0为IC50时阿维菌素结构类似物添加量/(μg/kg)。
1.3.9 准确度和精密度测定
取均质后的牦牛肉空白样本,分别依次添加不同质量浓度的阿维菌素溶液,使阿维菌素最终添加量分别为1、2、4 μg/kg,每个梯度3 个平行,分别按照1.3.4、1.3.5节方法进行样本提取和检测,利用平均值,按式(2)计算加标回收率。
上述实验在不同工作日内重复3 次,分别统计批内变异系数和批间变异系数。
1.3.10 稳定性实验
将制备好的时间分辨荧光试纸条放入45 ℃烘箱内加速老化,分别在老化第0、1、3、7、15天测定阿维菌素添加量为2.0 μg/kg的牦牛肉样品,每个样品3 次平行,考察试纸条T线和C线荧光强度、T/C比值及加标回收率的变化。
1.3.11 与国标方法的比较
取50 份市售牦牛肉样品,采用本研究所建立的TRFIA方法与GB/T 21320—2007《动物源食品中阿维菌素类药物残留量的测定 液相色谱-串联质谱法》[23]中的LC-MS/MS法同时进行检测,并对2 种方法的检测结果进行一致性分析。
1.4 数据处理
使用Excel软件进行相关数据的计算及分析。
2 结果与分析
2.1 荧光试纸条的优化
2.1.1 荧光微球粒径的确定
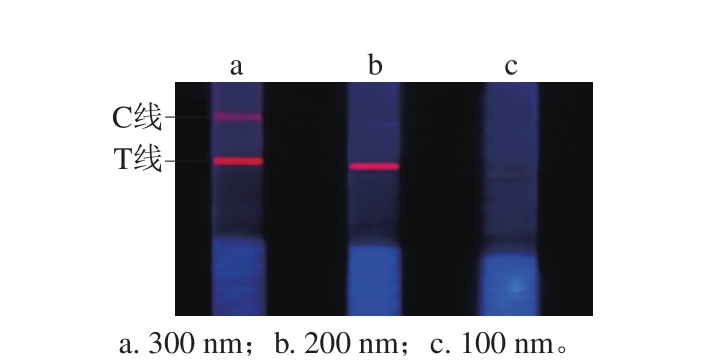
图2 不同粒径荧光微球对试纸条荧光强度和释放效果的影响
Fig. 2 Effect of fluorescent microspheres of various size on fluorescence intensity and release efficiency of test strip
由图2可知:使用300 nm微球,T线和C线的荧光强度较高,但微球的层析速率较慢,需要30 min以上才能完成层析,且300 nm微球的粒径相对较大,致使其在释放垫和NC膜上滞留较为严重,造成检测结果的不准确;使用100 nm荧光微球,层析速率较快,可在5 min左右完成整个层析过程,但是其荧光信号较弱,也不适用;使用200 nm荧光微球能够兼顾层析速率和荧光强度。因此本研究选择200 nm荧光微球作为阿维菌素抗体的标记物。
2.1.2 荧光微球喷量的确定

图3 不同微球喷量的测试结果
Fig. 3 Effect of microsphere amount on fluorescence intensity of test strip
由图3可知:荧光微球喷量为2 μL/cm时,试纸条荧光强度稍弱,且重复性不理想;荧光微球喷量为4 μL/cm时,试纸条荧光强度较强,但是存在释放不充分的问题;荧光微球喷量为3 μL/cm时,释放垫上荧光微球的释放较为干净,且试纸条的荧光强度均能满足检测需求。因此,本研究选择荧光微球喷量为3 μL/cm。
2.2 标准曲线的建立
拟合得到的四参数曲线如图4所示,其方程为y=6.658/(1.000+(x/1.859)1.364),标准曲线的线性相关系数为R2=0.988 7。依据曲线计算得到方法的IC50为1.732 μg/kg。
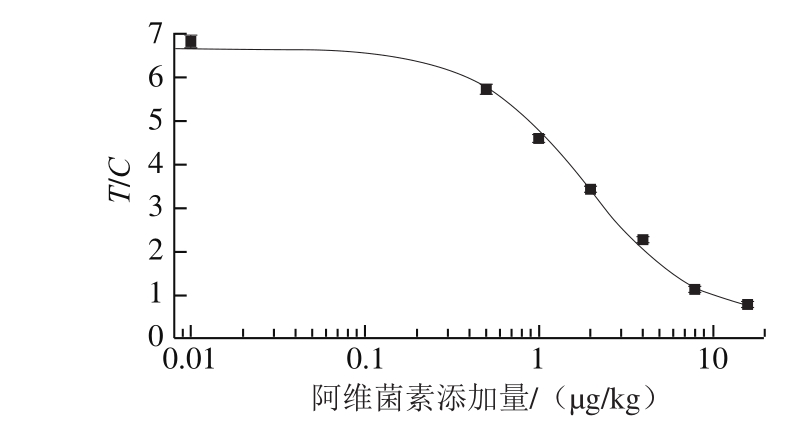
图4 TRFIA检测阿维菌素的标准曲线图
Fig. 4 Standard curve for avermectin detection by TRFIA
2.3 定量限测定结果
利用所建立的TRFIA方法检测20 份经国标方法[23]确证为阴性的牦牛肉样本,20 个样本的检测结果平均值为0.325 μg/kg,标准差为0.066 μg/kg,计算得到该方法对牦牛肉样本中阿维菌素药物的定量限为0.985 μg/kg,为了避免假阳性的发生,将牦牛肉的定量限定为1.0 μg/kg。
2.4 特异性实验结果
表1 TRFIA法测定牦牛肉中阿维菌素的特异性
Table 1 Specificity of TRFIA for the determination of avermectin in yak meat

药物名称 IC50/(μg/kg) 交叉反应率/%阿维菌素 1.732 100.0依维菌素 2.373 73.1多拉菌素 4.124 42.6依普菌素 1.776 97.5
用建立的TRFIA方法对牦牛肉中阿维菌素及其他临床常用阿维菌素结构类似物药物进行检测。由表1可知,阿维菌素、依维菌素、多拉菌素和依普菌素的IC50依次为1.732、2.373、4.124、1.776 μg/kg,交叉反应率分别为100.0%、73.1%、42.6%和97.5%。依普菌素又称为乙酰氨基阿维菌素,与阿维菌素的结构较为相似,故而具有较高的交叉反应率。上述结果表明,本方法可作为牦牛肉中阿维菌素类药物残留的广谱性快速检测方法,提高了检测效率。
2.5 准确度和精密度测定结果
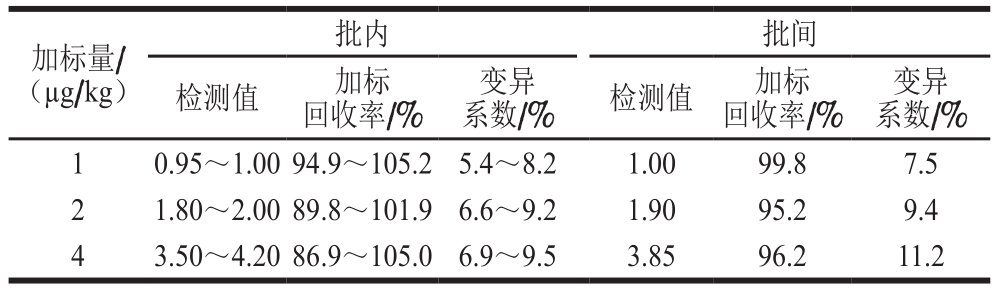
表2 TRFIA法准确度和精密度测定结果
Table 2 Accuracy and precision of TRFIA
加标量/(μg/kg)变异系数/%1 0.95~1.00 94.9~105.2 5.4~8.2 1.00 99.8 7.5 2 1.80~2.00 89.8~101.9 6.6~9.2 1.90 95.2 9.4 4 3.50~4.20 86.9~105.0 6.9~9.5 3.85 96.2 11.2批内 批间检测值 加标回收率/%系数/%检测值加标回收率/%变异
在牦牛肉样本中添加阿维菌素标准物质,使其添加量分别为1、2、4 倍定量限,使用本研究建立的TRFIA方法进行检测。由表2可知,牦牛肉中阿维菌素加标回收率为86.9%~105.2%,批内变异系数为5.4%~9.5%,批间变异系数为7.5%~11.2%,说明该方法具有较好的准确度和精密度。
2.6 稳定性测定结果
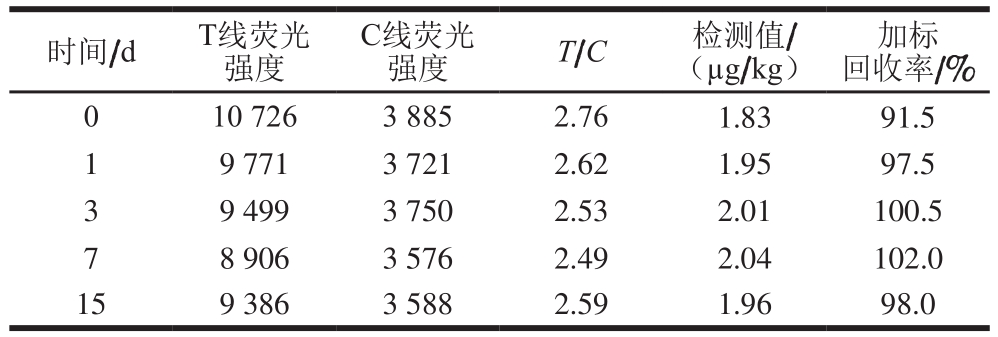
表3 试纸条45 ℃加速稳定性测定结果
Table 3 Stability of test strip under accelerated storage at 45 ℃
时间/d T线荧光强度加标回收率/%0 10 726 3 885 2.76 1.83 91.5 1 9 771 3 721 2.62 1.95 97.5 3 9 499 3 750 2.53 2.01 100.5 7 8 906 3 576 2.49 2.04 102.0 15 9 386 3 588 2.59 1.96 98.0 C线荧光强度T/C检测值/(μg/kg)
由表3可知,本研究制备的阿维菌素时间分辨荧光试纸条在45 ℃环境中老化,第1天内T线和C线的荧光强度有轻微下降的趋势,同时T/C比值也变小,第3~15天试纸条的荧光强度、T/C值及加标回收率基本稳定。由此可以推测,检测卡经过45 ℃老化3 d后可以常温条件下长期保存。
2.7 仪器方法对比结果
牦牛肉样品中阿维菌素添加量分别为1、2、4 μg/kg,同时使用本研究建立的TRFIA方法和国标LC-MS/MS方法进行检测,对2 种检测结果的相关性进行分析。结果表明,TRFIA方法与LC-MS/MS检测结果的线性方程为:y=0.938x+0.110(R2=0.961 5)。说明TRFIA方法的检测结果与LC-MS/MS检测结果呈良好的线性关系,可以应用于牦牛肉中阿维菌素的残留检测。
3 讨 论
阿维菌素类药物是现在兽医临床应用最广泛的广谱抗寄生虫药物,但此类药物对动物危害较大,因此我国制定了阿维菌素类药物的最高残留限量,以保障我国食品安全。动物性食品中阿维菌素类药物残留检测方法的研究也受到关注,并获得了一些研究成果。
Shi Weimin等[24]对牛肝组织中阿维菌素、伊维菌素和埃普利诺菌素等多种药物残留采用ELISA方法进行检测,5~10 μg/kg添加量范围内回收率为53.8%~108.6%,变异系数为3.4%~17.9%。赵卫东等[25]采用ELISA法检测猪肉、牛肉、羊肉中的阿维菌素,测得该方法的最低检测限为1.0 μg/kg,回收率为62.3%~85.6%。刘萤[26]、Wang Chunmei[27]等测定牛乳中的阿维菌素,平均回收率为95.90%,变异系数均在15.42%以内。杨君宏等[28]应用HPLC荧光检测方法同时检测牛肌肉组织中阿维菌素、伊维菌素、多拉菌素和埃普里诺菌素残留量,方法的检测限为0.8 μg/kg,加标回收率为77.3%~119.5%。张伟[29]、高明远[30]、程林丽[31]等采用配备冷却器的LC方法检测牛肉、牛乳及其他牛组织中的阿维菌素、伊维菌素、多拉菌素和埃普利诺菌素,2~100 μg/kg添加量下的平均回收率为70.2%~119.5%,变异系数为1.5%~18.9%。周鑫等[32]采用UPLC-MS/MS测定牛乳中阿维菌素和伊维菌素药物残留,测得回收率为70.8%~93.1%,检测限为1.0 μg/kg。与上述报道相比,本研究所建立的TRFIA方法灵敏度(1.0 μg/kg)、准确度(86.9%~105.2%)和精密度(7.5%~11.2%)基本相当。
4 结 论
本研究建立了牦牛肉中阿维菌素残留的TRFIA方法,其灵敏度、精密度、稳定性均较高,与国标LC-MS/MS方法的符合度高,且具有操作简便、检测时间短和成本低的优点。由此说明,本研究建立的TRFIA检测方法可应用于牦牛肉中阿维菌素类药物残留的实际检测,具有较高应用推广价值。
[1] 于童. 乙酰氨基阿维菌素在牦牛体内的药物动力学、残留消除规律及药效学研究[D]. 北京: 中国农业大学, 2015: 3-7.
[2] 朱娟娟. 阿维链霉菌孢子色素生物合成及PhoR-PhoP双组分信号系统对阿维菌素产量的影响[D]. 武汉: 华中农业大学, 2008: 7.
[3] CAO Xiaomei, LUO Zhengshan, ZENG Weizhu, et al. Enhanced avermectin production by Streptomyces avermitilis ATCC 31267 using high-throughput screening aided by fluorescence-activated cell sorting[J]. Applied Microbiology and Biotechnology, 2018, 102(2):703-712. DOI:10.1007/s00253-017-8658-x.
[4] 陈静, 罗永煌. 阿维菌素类药物在动物性食品中的残留检测研究概况[J]. 贵州畜牧兽医, 2007, 31(4): 9-11. DOI:10.3969/j.issn.1007-1474.2007.04.007.
[5] 孙世伟, 李修炼, 李科明, 等. 黄精中阿维菌素残留量检测方法研究[J]. 西北植物学报, 2007, 27(6): 1151-1155. DOI:10.3321/j.issn:1000-4025.2007.06.014.
[6] 胡晓楠, 郭文丽, 王云, 等. 高效液相色谱-荧光法同时检测水产中阿维菌素和伊维菌素[J]. 现代食品, 2019(20): 164-166. DOI:10.16736/j.cnki.cn41-1434/ts.
[7] 迂君, 赵飞, 贾宏新. 高效液相色谱-荧光法同时检测水产品中阿维菌素和伊维菌素[J]. 中国卫生检验杂志, 2019, 29(7): 792-794.
[8] 高玉玲, 孙鹏, 梁婷, 等. 分散固相萃取-UHPLC-APCI-MS/MS测定猪肉中阿维菌素药物残留量[J]. 高师理科学刊, 2019, 39(7): 64-68.
[9] 宫小明, 董静, 孙军, 等. 动物源性食品中阿维菌素类药物残留的QuEChERS-液质联用法测定[J]. 分析测试学报, 2010, 29(9):933-937. DOI:10.3969/j.issn.1004-4957.2010.09.012.
[10] 谢显传, 张少华, 王冬生, 等. 柱前衍生高效液相色谱法测定果蔬产品阿维菌素及其有毒代谢物的残留量[J]. 中国农业科学, 2005,38(11): 2254-2260. DOI:10.3321/j.issn:0578-1752.2005.11.014.
[11] 杨君宏, 何继红, 侯晓林, 等. 牛肌肉中阿维菌素类药物残留的免疫亲和色谱-高效液相色谱荧光检测方法的研究[J]. 中国畜牧兽医,2014, 41(1): 243-245.
[12] 程茹, 吴紫洁, 张凯, 等. 阿维菌素ELISA试剂盒在鸡肉、鸡肝中的检测效果研究[J]. 食品安全导刊, 2018(10): 68-71. DOI:10.16043/j.cnki.cfs.2018.10.027.
[13] 文豪, 周绪正, 李冰, 等. 阿维菌素类药物残留检测的研究进展[J].黑龙江畜牧兽医, 2015(11): 55-57.
[14] 侯晓林, 何继红, 杜向党, 等. 牛肝中阿维菌素类药物残留的高效液相色谱荧光检测方法的研究[J]. 畜牧兽医学报, 2006, 37(5):500-503. DOI:10.3321/j.issn:0366-6964.2006.05.016.
[15] PAYNE L D, HICKS M B, WEHNER T A. Determination of abamectin and/or ivermectin in cattle feces at low parts per billion levels using HPLC with fluorescence detection[J]. Journal of Agricultural and Food Chemistry, 1995, 43(5): 1233-1237. DOI:10.1021/jf00053a021.
[16] SCHENCK F J, LAGMAN L H. Multiresidue determination of abamectin, doramectin, ivermectin, and moxidectin in milk using liquid chromatography and fluorescence detection[J]. Journal of AOAC International, 1999, 82(6): 1340. DOI:10.1093/jaoac/82.6.1340.
[17] 赖玉玲, 黄丽芳, 雷兴. 时间分辨荧光免疫法检测梅毒螺旋体抗体的临床应用研究[J]. 中国医药科学, 2019, 9(7): 111-115.DOI:10.3969/j.issn.2095-0616.2019.07.032.
[18] BACIGALUPO M A, MERONI G, SECUNDO F, et al. Time-resolved fluoroimmunoassay for quantitative determination of ampicillin in cow milk samples with different fat contents[J]. Talanta, 2008, 77(1):126-130. DOI:10.1016/j.talanta.2008.05.057.
[19] 王泽洲, 吴俊清, 张永宁, 等. 时间分辨荧光免疫分析技术的研究进展[J]. 四川畜牧兽医, 2015(7): 34-37. DOI:10.3969/j.issn.1001-8964.2015.07.015.
[20] 赵义良, 李云, 桑丽雅, 等. 呋喃唑酮代谢物时间分辨荧光免疫快速检测试剂卡的研制及应用[J]. 食品安全质量检测学报, 2018, 9(19):5187-5194. DOI:10.3969/j.issn.2095-0381.2018.19.030.
[21] 崔乃元, 赵义良, 马立才, 等. 水产品中氯霉素时间分辨荧光免疫层析定量检测方法的研究[J]. 食品与发酵工业, 2019, 45(24): 241-245.DOI:10.13995/j.cnki.11-1802/ts.022043.
[22] RODIONOVA N S, ROTA E, TSARKOVA A S, et al. Progress in the study of bioluminescent earthworms[J]. Photochemistry and Photobiology, 2017, 93(2): 416-428. DOI:10.1111/php.12709.
[23] 中华人民共和国质量监督检验检疫总局, 中国国家标准化管理委员会. 动物源食品中阿维菌素类药物残留量的测定 液相色谱-串联质谱法: GB/T 21320—2007[S]. 北京: 中国标准出版社, 2007.
[24] SHI Weimin, HE Jihong, JIANG Haiyang, et al. Determination of multiresidue of avermectins in bovine liver by an indirect competitive ELISA[J]. Journal of Agricultural and Food Chemistry, 2006, 54(17):6143-6146. DOI:10.1021/jf060878v.
[25] 赵卫东, 郑文杰, 贺艳, 等. 酶联免疫法检测动物源性产品中阿维菌素残留[J]. 食品研究与开发, 2009, 30(4): 127-130. DOI:10.3969/j.issn.1005-6521.2009.04.038.
[26] 刘萤, 吴小平, 苏丽芳, 等. ELISA快速测定牛奶中阿维菌素前处理方法的建立[J]. 检验检疫学刊, 2015, 25(4): 58-60. DOI:10.3969/j.issn.1674-5354.2015.04.016.
[27] WANG Chunmei, WANG Zhanhui, JIANG Wenxiao, et al.A monoclonal antibody-based ELISA for multiresidue determination of avermectins in milk[J]. Molecules, 2012, 17(6): 7401-7414.DOI:10.3390/molecules17067401.
[28] 杨君宏, 何继红, 侯晓林, 等. 牛肌肉中阿维菌素类药物残留的免疫亲和色谱-高效液相色谱荧光检测方法的研究[J]. 中国畜牧兽医,2014, 41(1): 243-245.
[29] 张伟, 舒均喜, 郑妍, 等. QuEChERS-高效液相色谱法检测牛肉中的阿维菌素类药物残留[J]. 动物医学进展, 2017, 38(11): 56-60.DOI:10.3969/j.issn.1007-5038.2017.11.012.
[30] 高明远, 高悦. HPLC方法检测牛奶中多拉菌素等3 种药物残留[J].黑龙江畜牧兽医, 2017(3): 282-285.
[31] 程林丽, 安洪泽, 沈建忠, 等. 牛奶中4 种阿维菌素类药物的高效液相色谱快速测定[J]. 中国农业大学学报, 2010, 15(4): 95-98.
[32] 周鑫, 李爱军, 董李学, 等. 液质联用法测定牛奶中的阿维菌素和伊维菌素[J]. 食品工业, 2018, 39(1): 325-327.