鸡肉作为营养价值丰富的白肉,在餐桌上扮演着极其重要的角色。随着食品保鲜技术的日益发展、生活品质的改善及生活节奏的加快,消费者更加在乎食物是否新鲜以及如何保留其原有营养价值。其中,调理鸡肉制品因购买便捷、烹饪方便,得到年轻人的青睐。由于鸡肉中含有大量蛋白质,调理鸡肉在加工与贮藏过程中发生蛋白质氧化,产生结构较复杂且种类繁多的产物,对肉品的质构、风味及营养等品质特性有重要影响[1]。一定程度的蛋白质氧化对于肉制品质构特性及肌原纤维蛋白的功能特性均有有利影响,但过度的蛋白质氧化则会产生负面作用[2]。为更好保证肉品品质,延长货架期,有必要深入研究肉中蛋白质氧化的影响因素。
氯化钠作为食盐的主要成分,是调理鸡肉的基础调味用料。氯化钠除了可以赋予产品咸味特征以及一定添加量下可以抑制微生物引起的肉品腐败外[3],其添加量的高低在加工过程中能显著影响肉制品的脂肪氧化及蛋白质氧化。氯化钠对蛋白质的表面疏水性、羰基含量、巯基含量、稳定性等理化性质有一定影响[4-5],同时肌原纤维蛋白氧化所造成蛋白质结构及功能性的改变会影响肉品的食用品质,甚至降低肉制品的营养价值[6-7]。虽然关于氯化钠对肉品食用品质及脂肪氧化方面的研究较多,但目前国内外鲜有不同添加量氯化钠对冰鲜鸡肉贮藏过程中肌原纤维蛋白氧化的影响等相关方面的研究。
为进一步探究氯化钠在鸡肉腌制冷藏过程中对蛋白质氧化的影响,本研究以鸡胸肉为原料,通过不同添加量的氯化钠处理,提取不同冷藏期鸡肉中的肌原纤维蛋白,对其进行羰基含量、巯基含量、表面疏水性、粒径、二级结构等指标的测定,分析其变化规律,以期为控制鸡肉及相关肉制品肌肉蛋白氧化程度提供理论参考。
1 材料与方法
1.1 材料与试剂
选择日龄相同、大小相近的三黄鸡10 只,购自江苏利华食品有限公司,将活鸡宰杀后,取鸡胸肉。
氯化钠、磷酸氢二钠、磷酸二氢钠、氢氧化钠、氯化钾、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、磷酸氢二钾、盐酸、无水乙醇、磷酸二氢钾、溴汾蓝钠、乙二醇双(2-氨基乙基醚)四乙酸(ethylene glycol bis(2-aminoethyl ether) tetraacetic acid,EGTA)、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、氯化镁(均为分析纯) 南京圣比奥生物公司;总巯基检测试剂盒(A063-1-1分光光度法) 南京建成科技有限公司。
1.2 仪器与设备
T-25数显匀浆机 德国IKA公司;UniCenMR台式冷冻离心机 德国Herolab公司;Centrifuge 5424R小型冷冻离心机 德国Eppendorf公司;Cytation 5多功能酶标仪 美国Biotek公司;Nicomp Z3000纳米粒度电位仪美国PSS公司;J-1500圆二色谱仪 日本Jasco公司;LS-55荧光光谱仪 美国Perkin Elmer公司;漩涡振荡仪奥然科技有限公司;Scientz-IID超声波细胞破碎仪宁波新芝生物科技股份有限公司;HH-4数显恒温水浴锅常州国华电器有限公司。
1.3 方法
1.3.1 样品的制备
将鸡胸肉清洗、冷却至室温,修整去除结缔组织后,切成约8 mm见方的肉丁,均分为6 组,每组150 g。按照质量分数0.0%、1.5%、3.0%、4.5%、6.0%、7.5%分别称取氯化钠,与鸡胸肉丁充分混合,置于4 ℃条件下进行腌制贮藏,分别于冷藏0、2、4 d称取50 g鸡肉,封口包装,于-80 ℃冰箱冻存。每次实验前将所需用量的鸡肉置于4 ℃冰箱中先行解冻后再取用。
1.3.2 水分含量测定
采用直接干燥法,取肉样约2 g于玻璃皿中,于105 ℃热风干燥箱中干燥至恒质量。记录干燥前后的质量。水分含量按式(1)计算。
式中:m1为干燥前样品质量/g;m2为干燥后样品质量/g。
1.3.3 肌原纤维蛋白提取
参考Park等[8]的方法,略作修改。鸡肉于4 ℃解冻后,切碎成肉糜,称取5 g加入4 倍体积缓冲液A(含0.1 mol/L KCl、1 mmol/L MgCl2、7 mmol/L KH2PO4、18 mmol/L K2HPO4、1 mmol/L EGTA,pH 7.0),冰浴均质2 次(12 000 r/min、30 s),冷冻离心(2 000×g、15 min、4 ℃),弃上清取沉淀,重复上述操作2 次。收集沉淀物得到粗蛋白,与4 倍体积缓冲液B(含0.1 mol/L NaCl、1 mol/L HCl,pH 6.0)混匀,匀浆、离心操作同上,重复2 次后,第3次匀浆后液体用4 层纱布过滤,再离心,所得沉淀即为纯肌原纤维蛋白。使用时用磷酸缓冲液(含0.6 mol/L KCl、10 mmol/L K2HPO4,pH 6.0)溶解肌原纤维蛋白,得肌原纤维蛋白溶液。用双缩脲法测定蛋白质量浓度,并将样品放置于4 ℃冰箱保存,48 h内用完。
1.3.4 羰基含量测定
采用D N P H法测定蛋白质羰基含量[9]。取0.1 mL 5 mg/mL肌原纤维蛋白溶液于离心管中,加入0.4 mL 10 mmol/L DNPH(溶于2 mol/L盐酸),漩涡混匀1 min,37 ℃避光反应30 min;加入0.5 mL 20 g/100 mL三氯乙酸,离心(12 000 r/min、10 min、4 ℃),取沉淀;将所得沉淀用1 mL无水乙醇-乙酸乙酯(体积比1∶1混匀)充分洗涤4 次后加入1.25 mL 6 mol/L盐酸胍溶液(溶于20 mmol/L磷酸盐溶液,pH 6.5),37 ℃水浴15 min,混匀充分溶解沉淀后,12 000 r/min离心15 min,取上清液在370 nm波长处(紫外)比色,测定吸光度。空白对照组加入0.4 mL 2 mol/L盐酸(无DNPH),余下步骤如上所述。羰基含量按式(2)计算。
式中:A0为空白对照组溶液体系的吸光度;A1为样品溶液体系的吸光度;ρ为肌原纤维蛋白溶液质量浓度/(mg/L)。
1.3.5 总巯基含量测定
采用分光光度法,制备5 mg/mL肌原纤维蛋白溶液,依照巯基检测试剂盒说明书步骤进行测定及巯基含量计算。
1.3.6 表面疏水性测定
参考Chelh等[10]的方法。向1 mL 5 mg/mL肌原纤维蛋白溶液中加入200 μL 1 mg/mL溴酚蓝(bromophenol blue,BPB)溶液。另取1 mL 20 mmol/L磷酸盐缓冲液(pH 6.0),加入200 μL 1 mg/mL BPB溶液。室温下振荡10 min后5 000 r/min离心15 min。取上清液稀释10 倍后于595 nm波长测定吸光度。蛋白表面疏水性以BPB结合量表示。表面疏水性按式(3)计算。
式中:A0为磷酸盐缓冲液吸光度;A1为样品溶液吸光度。
1.3.7 蛋白粒径测定
取2 mL 1 mg/mL肌原纤维蛋白溶液于测量杯中,通过纳米电位仪测定蛋白溶液中的粒子直径。
1.3.8 蛋白二级结构相对含量的测定
制备2 mL 0.1 mg/mL肌原纤维蛋白溶液及磷酸缓冲液(除去EDTA的影响),通过圆二色谱仪测定蛋白二级结构的变化,主要检测α-螺旋相对含量的改变。
1.3.9 内源性色氨酸荧光光谱分析
用0.5 mol/L氯化钠溶液将肌原纤维蛋白溶液稀释为质量浓度0.04 mg/mL,取约700 μL稀释后肌原纤维蛋白溶液于微量比色皿中,通过荧光分光光度仪测定色氨酸荧光强度的变化。在室温条件下,设置激发波长为280 nm,扫描速率200 nm/min,记录300~400 nm的发射光谱图[11]。
1.4 数据处理
使用Microsoft Excel 2016和IBM SPSS Statistics 22.0软件进行数据分析和处理,计算平均值并采用方差分析法进行显著性分析(P<0.05)。
2 结果与分析
2.1 氯化钠添加量对鸡肉水分含量的影响
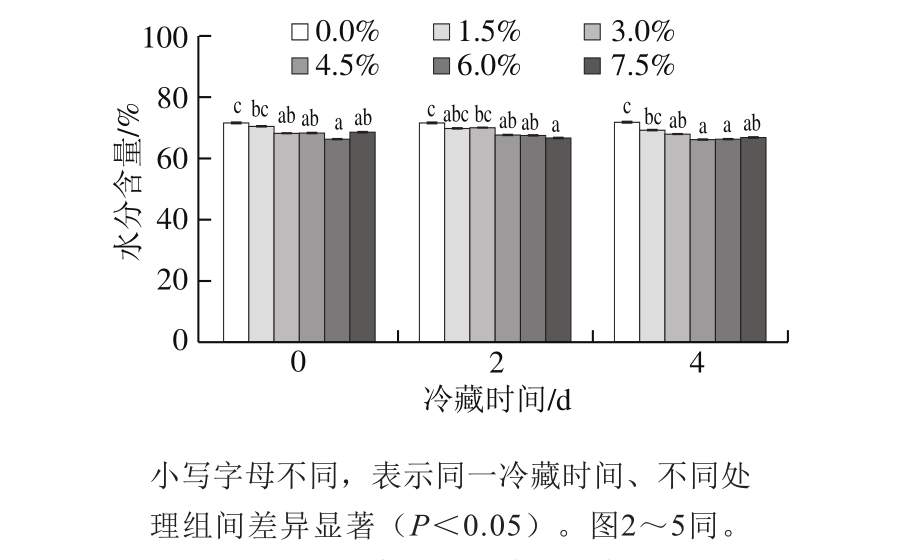
图1 氯化钠添加量对鸡肉水分含量的影响
Fig. 1 Effect of sodium chloride addition on water content of chicken meat
肉中有相当一部分水通过物理作用被截留在肌原纤维蛋白结构中[12],因此水分含量也会影响肉的品质。通过测定不同氯化钠添加量鸡肉随冷藏时间延长水分含量的变化,判断是否产生盐析效应,进而影响蛋白氧化。由图1可知,氯化钠添加量0.0%时,鸡肉冷藏过程中水分含量维持在71.73%左右,随着氯化钠添加量的增大、冷藏时间的延长,水分含量呈下降趋势。其中氯化钠添加量7.5%时,鸡肉水分含量由冷藏0 d的68.63%减少至冷藏4 d的66.83%,肉样保水性相对较好,水分含量变化不明显,这可能与冷藏期间的温湿度有关。在较高的水分含量下,肉样的盐环境相对稳定,因此水分含量对鸡肉中蛋白的影响较小。
2.2 氯化钠添加量对肌原纤维蛋白羰基含量的影响
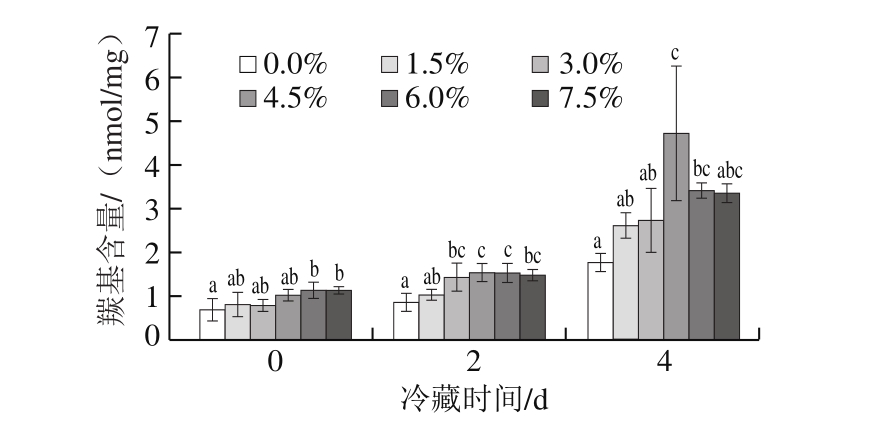
图2 氯化钠添加量对肌原纤维蛋白羰基含量的影响
Fig. 2 Effect of sodium chloride addition on carbonyl group content of myofibrillar protein
蛋白质羰基的形成是由赖氨酸、脯氨酸、精氨酸等直接氧化导致,是蛋白氧化的标志生成物,也是评定肉类蛋白氧化程度的重要指标。由图2可知,肌原纤维蛋白羰基含量随鸡肉冷藏时间延长呈逐渐增大的趋势,在冷藏4 d后达到最大值。空白对照组(氯化钠添加量0.0%)肌原纤维蛋白羰基含量冷藏0 d为0.681 nmol/mg,冷藏4 d后达到1.761 nmol/mg,经过氯化钠处理的肉样,肌原纤维蛋白羰基含量均有显著增加(P<0.05),且明显高于空白对照组。其中,氯化钠添加量4.5%时,肌原纤维蛋白羰基含量在冷藏0 d为1.022 nmol/mg,贮藏4 d后增加至4.715 nmol/mg,约为前者的4.7 倍,其他氯化钠添加量下的肉样肌原纤维蛋白羰基含量也均在冷藏4 d达到初始含量的近3 倍。氯化钠添加量0.0%~4.5%时,羰基含量随氯化钠添加量增加显著增加(P<0.05),氯化钠添加量6.0%~7.5%时,相较于4.5%添加量,羰基含量略微下降,但仍高于其他氯化钠处理组。由于羰基的产生代表着蛋白的氧化,所以氯化钠的存在对鸡肉中肌原纤维蛋白的氧化有显著促进作用,尤其在是氯化钠添加量达到4.5%时,蛋白氧化更加剧烈。Sun Weizheng等[13]研究广式香肠加工过程中不同蛋白的羰基化反应变化过程,结果表明,在加工过程中,肌浆蛋白和肌原纤维蛋白的羰基含量持续明显增加,与图2所示结果一致,说明氯化钠促进了鸡肉中肌原纤维蛋白的氧化。这可能是由于将外源氯化钠添加到鸡肉中会增强肉中Fe3+的活性及溶解性,肉中Fe3+含量会直接影响脂肪氧化和蛋白氧化。但过高的氯化钠添加量是否可能对蛋白氧化产生抑制作用还需要进一步探究。
2.3 氯化钠添加量对肌原纤维蛋白巯基含量的影响
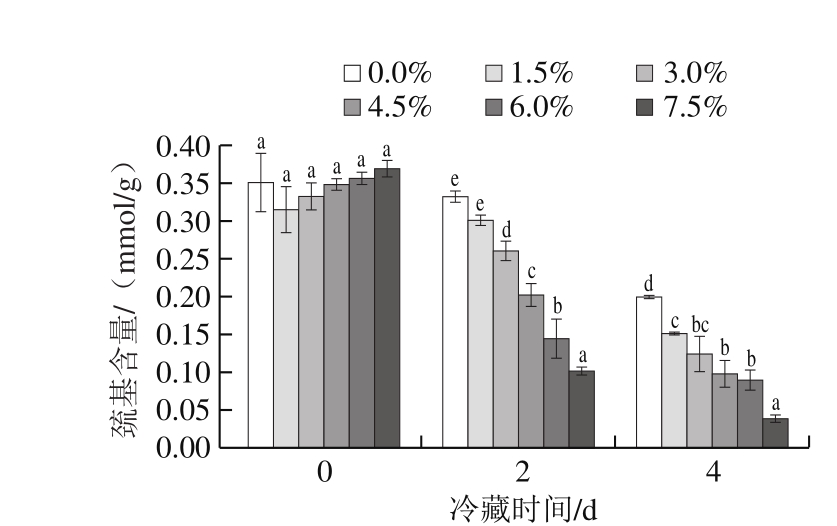
图3 氯化钠添加量对肌原纤维蛋白巯基含量的影响
Fig. 3 Effect of sodium chloride addition on sulfhydryl group content of myofibrillar protein
肉中肌原纤维蛋白的氧化极易导致巯基(蛋白质中具有最高反应活性的基团)的损失,巯基含量越低则说明蛋白氧化程度越高[14-16]。由图3可知,与肌原纤维蛋白羰基含量随冷藏时间延长逐渐增大的趋势相反,肌原纤维蛋白巯基含量随着冷藏时间延长逐渐降低,且随氯化钠添加量的增加而显著下降(P<0.05),说明鸡肉中肌原纤维蛋白氧化加剧。氯化钠添加量0%时,肌原纤维蛋白巯基含量由初始的0.351 mmol/g下降至冷藏4 d的0.198 mmol/g,降低约43%;氯化钠添加量7.5%时,肌原纤维蛋白巯基含量则从初始的0.369 mmol/g下降至冷藏4 d的0.038 mmol/g,降低约90%。随着冷藏时间的延长和氯化钠添加量的增加,鸡肉中肌原纤维蛋白表面的总巯基含量显著降低(P<0.05),这与李学鹏等[17]研究发现六线鱼的肌原纤维蛋白在氧化时间不断延长的条件下,巯基含量呈下降趋势的结论一致。汪媛等[18]也发现,在相同水分含量条件下,猪肉中肌原纤维蛋白的巯基含量随氯化钠添加量的增大而显著下降。这可能是由于在蛋白氧化过程中,空间结构的改变导致巯基暴露,被氧化后以多肽分子之间或内部的二硫键形式存在,或者受其他因素影响,进一步氧化生成磺酸类产物,导致巯基含量下降。
2.4 氯化钠添加量对肌原纤维蛋白表面疏水性的影响

图4 氯化钠添加量对肌原纤维蛋白表面疏水性的影响
Fig. 4 Effect of sodium chloride addition on surface hydrophobicity of myofibrillar protein
表面疏水性是维持蛋白质三级结构的主要作用力,可以在一定程度上反映蛋白质结构的改变[19],是蛋白质常用评价指标之一。表面疏水性的增大通常代表着肌原纤维蛋白氧化加剧,蛋白发生变性、折叠部分解开,导致内部的疏水性氨基酸残基暴露[20]。由图4可知,鸡肉腌制冷藏2 d内肌原纤维蛋白表面疏水性呈上升趋势,在第2天达到最大,其中氯化钠添加量0.0%~4.5%组均为150 μg左右,这可能是由于蛋白氧化使得肌原纤维蛋白发生降解[21],导致疏水基团暴露。但冷藏4 d后各肉样的肌原纤维蛋白表面疏水性显著减小,且随着氯化钠添加量的增加而减小。吴雪燕[22]研究中式香肠加工前期肌原纤维蛋白疏水性变化得出相同结论,该研究同时指出,随着贮藏时间的延长,促氧化处理的样品肌原纤维蛋白表面疏水性处于最低水平,低于对照组与抗氧化组。本研究中添加氯化钠处理的肉样在冷藏4 d后肌原纤维蛋白表面疏水性均低于空白对照组,其中氯化钠添加量为7.5%时,仅为43.80 μg。前期表面疏水性的增大可能是由于氯化钠的存在破坏了蛋白分子外部亲水作用与内部疏水作用间的平衡[23],而后期可能是过高添加量的氯化钠抑制了蛋白质内部的疏水和共价(二硫键)作用,或者因蛋白氧化加深导致内部分子产生交联,形成聚合物,导致其对蛋白酶敏感性降低,使得蛋白酶降解蛋白的效率降低[24]。低氯化钠添加量下表面疏水性的降低可能是由于随冷藏时间的延长,肉中水分含量发生变化,疏水基团随氧化而被包埋,其表面疏水性降低效果弱于高氯化钠添加量肉样。总体来说,氯化钠添加量对鸡肉冷藏过程中肌原纤维蛋白表面疏水性的影响无明显的规律性。
2.5 氯化钠添加量对肌原纤维蛋白平均粒径的影响
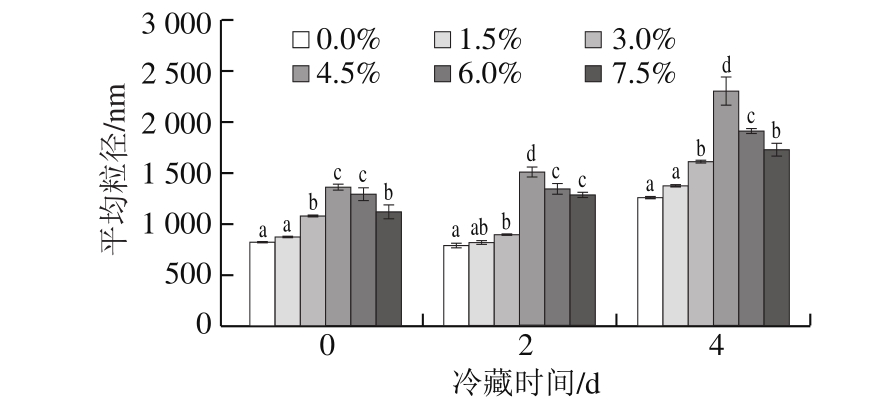
图5 氯化钠添加量对肌原纤维蛋白平均粒径的影响
Fig. 5 Effect of sodium chloride addition on average particle size of myofibrillar protein
粒径可以反映肌原纤维蛋白溶液的聚集情况和聚集体的大小[25]。粒径增大说明蛋白发生变性聚集,溶液中聚集体的大小和数量增加。由图5可知,随着冷藏时间延长,肌原纤维蛋白平均粒径呈增大趋势,不同氯化钠添加量下,鸡肉肌原纤维蛋白溶液的平均粒径均大于冷藏0 d时的初始值,说明蛋白聚集程度增加。肌原纤维蛋白平均粒径随着氯化钠添加量的增加呈先增大后减小趋势。当氯化钠添加量0.0%~4.5%时,肌原纤维蛋白的平均粒径随着添加量的增加显著增大(P<0.05),当氯化钠添加量4.5%~7.5%时则随着氯化钠添加量的增加显著减小(P<0.05),其中氯化钠添加量为4.5%、冷藏4 d的鸡肉肌原纤维蛋白溶液平均粒径达到2 303.6 nm。这可能是由于4.5%氯化钠添加量下,肉样中的蛋白羰基化水平较高,进一步的氧化修饰使蛋白分子内部的交互作用和蛋白-水交互作用的平衡发生变化,引起肌原纤维蛋白肽链发生断裂、蛋白产生一定的交联聚合,从而形成较大粒径的颗粒,导致该添加量下蛋白的平均粒径明显高于其他各组[26-27]。
2.6 氯化钠添加量对肌原纤维蛋白二级结构的影响
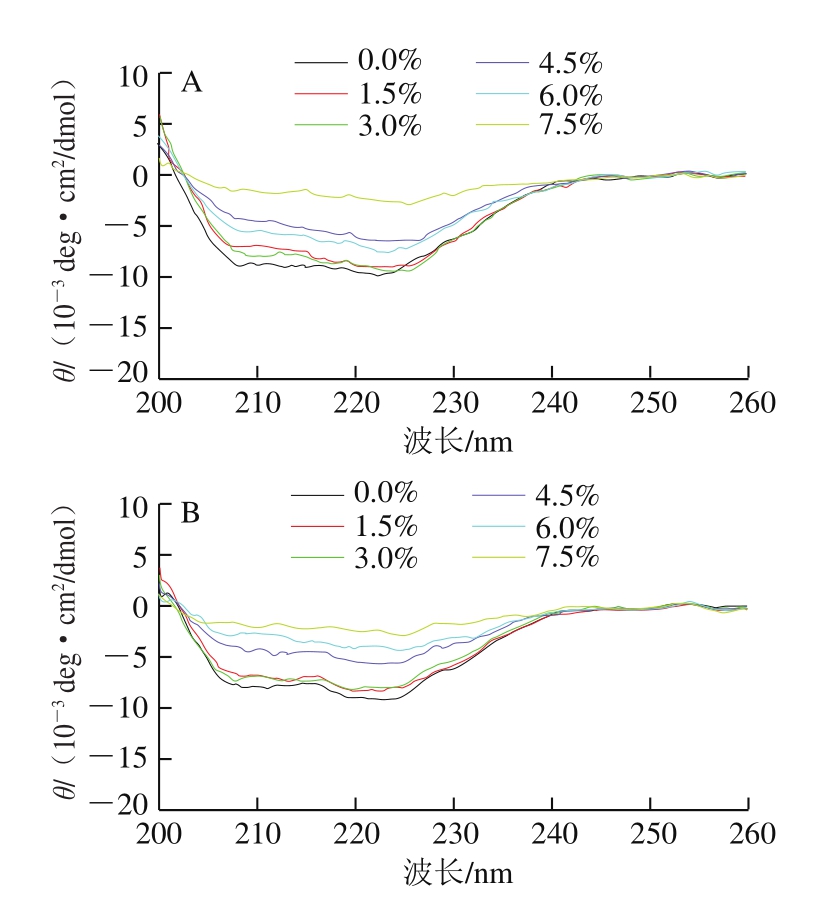
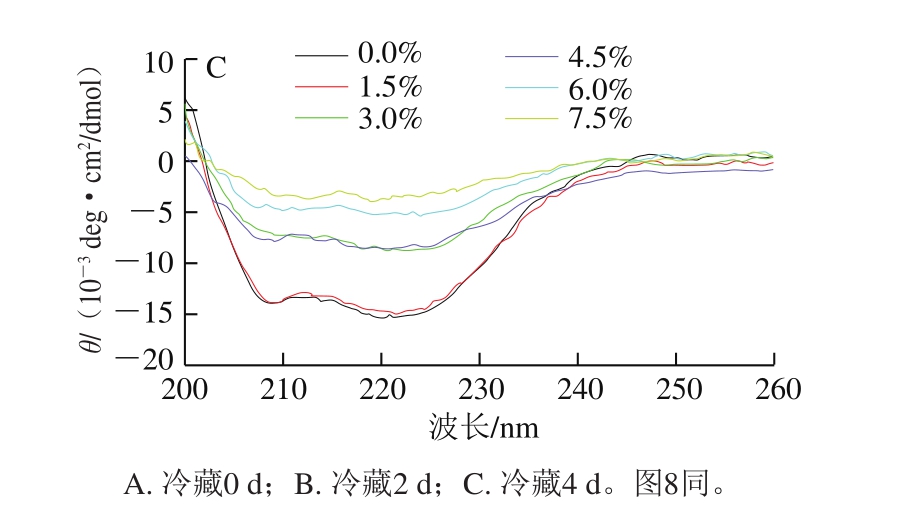
图6 肌原纤维蛋白二级结构圆二色谱图
Fig. 6 Circular dichroism analysis of secondary structure of myofibrillar protein
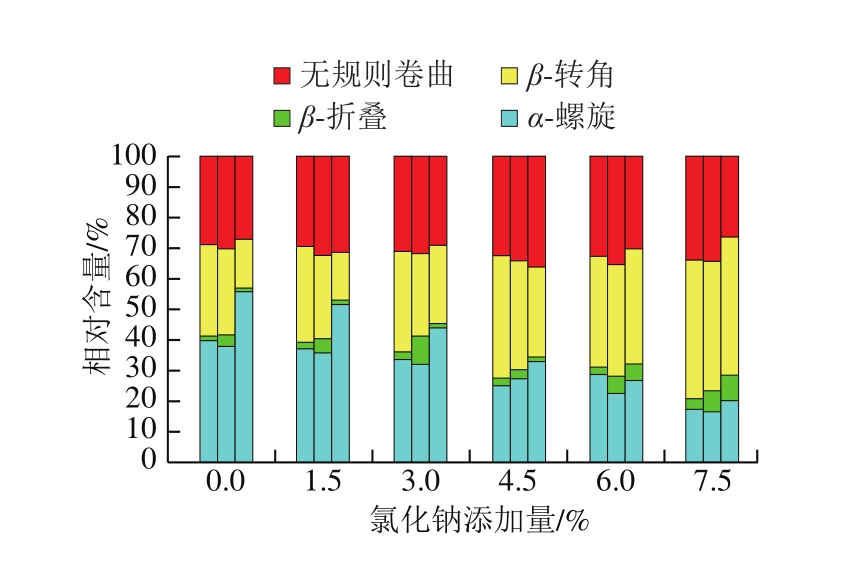
图7 氯化钠添加量对肌原纤维蛋白二级结构的影响
Fig. 7 Effect of sodium chloride addition on secondary structure of myofibrillar protein
蛋白质的二级结构通常采用圆二色光谱法分析。由图6~7可知,随着冷藏时间的延长,不同氯化钠添加量下肌原纤维蛋白的二级结构表面α-螺旋相对含量均在冷藏4 d时明显增加,这与张洪超等[28]发现乌贼肌原纤维蛋白中α-螺旋含量随着氧化进行而逐渐降低的实验结果并不一致,但Sun Weizheng等[13]研究表明,蛋白的羰基化会影响蛋白的结构特性,随着羰基含量的增加,α-螺旋的含量呈上升趋势。因此本研究中,随冷藏时间延长,肌原纤维蛋白氧化不断产生羰基可能促进了α-螺旋相对含量的增加。也有研究结果显示,采用圆二色谱法测定蛋白二级结构时,若存在色氨酸(Trp)、酪氨酸(Tyr)、苯丙氨酸(Phe)及二硫键处于不对称微环境的情况[29-30],α-螺旋含量可能会增加,因此鸡肉中α-螺旋含量在冷藏4 d时明显增加的原因需要进一步探究。肌原纤维蛋白二级结构中,β-折叠相对含量较低,而β-转角相对含量随着氯化钠添加量的增加而呈上升趋势,这与楼宵玮等[31]研究发现的氯化钠浓度在0~0.4 mol/L增加时,肌原纤维蛋白中α-螺旋和β-折叠转化为β-转角的结果一致。无规则卷曲相对含量则无明显变化。低(0.0%、1.5%)、中(3.0%、4.5%)、高(6.0%、7.5%)添加量3 组间的α-螺旋相对含量变化明显,但组内差异却并不明显,较为接近,且α-螺旋相对含量随着氯化钠添加量的增加而逐渐减小,因此氯化钠的存在可能使得肌原纤维蛋白分子断裂,多肽链进行重排,对肌原纤维蛋白的二级结构有一定破坏作用,而高盐含量对肌原纤维蛋白结构的影响更为显著。研究表明,过高的氯化钠和氯化钾浓度会严重干扰圆二光谱的吸收峰[32]。
2.7 氯化钠添加量对肌原纤维蛋白内源色氨酸荧光强度的影响
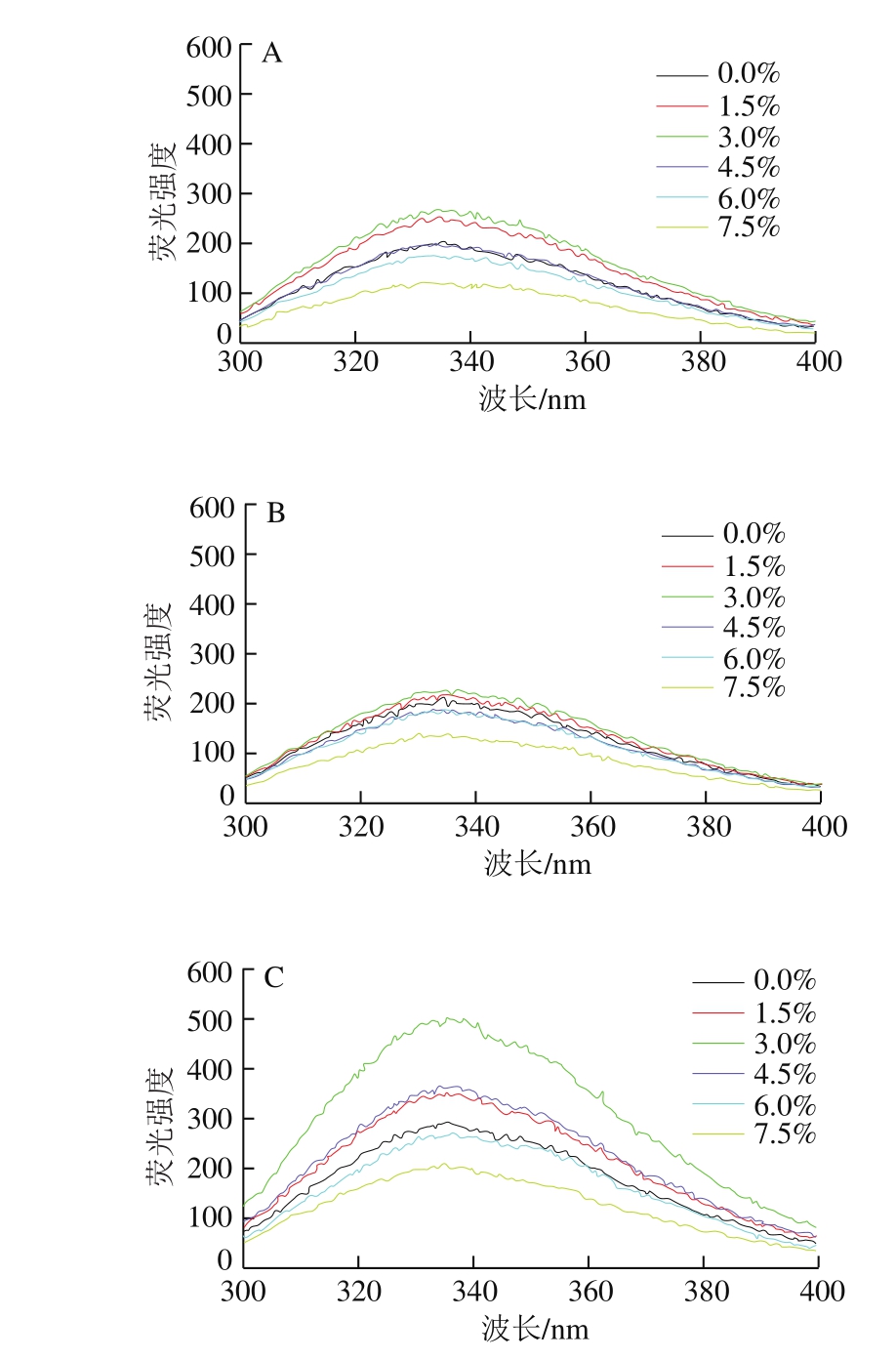
图8 氯化钠添加量对肌原纤维蛋白中色氨酸荧光强度的影响
Fig. 8 Effect of sodium chloride addition on tryptophan fluorescence intensity of myofibrillar protein
由于蛋白质中的某些芳香族氨基酸对氧化敏感,所以内源性色氨酸的荧光强度常被用来表征蛋白结构和构象的变化[33],其荧光强度的大小取决于色氨酸是随蛋白质折叠处于其内核疏水环境还是随蛋白质的展开暴露于表面。由图8可知,随着氯化钠添加量的增大,肌原纤维蛋白中色氨酸的荧光强度先减小后增大,氯化钠添加量为3.0%时达到峰值,而后开始呈下降趋势。在鸡肉冷藏过程中,当氯化钠添加量高于6.0%时,其肌原纤维蛋白色氨酸荧光强度始终低于未添加氯化钠的肉样,氯化钠添加量为7.5%时色氨酸荧光强度均处于最低水平。贾娜等[11]测定氯化钠浓度对猪背最长肌肌原纤维蛋白内源色氨酸荧光强度的影响,结果并未发现有规律性变化。而本实验中,色氨酸荧光强度随着氯化钠添加量的增加呈先上升后下降的趋势,这可能是由于氯化钠高添加量导致蛋白质内核的疏水环境改变,色氨酸发生氧化或包埋,使得其荧光强度减弱。同时实验结果表明,随着冷藏时间的延长,色氨酸内源荧光强度的变化趋势为先减小而后明显增大,这可能与肌原纤维蛋白氧化进程加深、其他氨基酸产生荧光干扰有关。
2.8 肌原纤维蛋白氧化指标相关性分析
表1 肌原纤维蛋白部分氧化指标的相关性分析
Table 1 Correlation coefficients between oxidation indexes of chicken myofibrillar protein
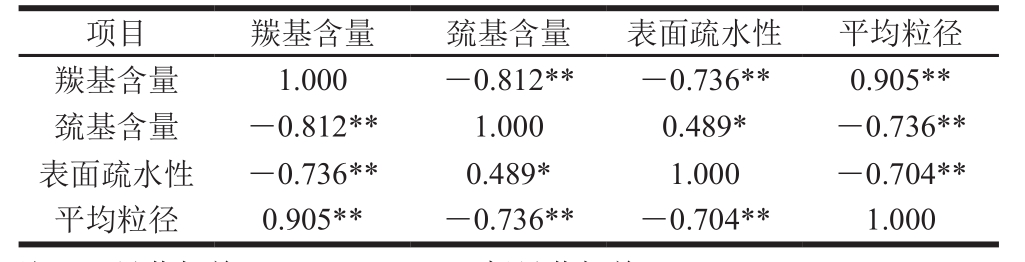
注:*. 显著相关(P<0.05);**. 极显著相关(P<0.01)。
项目 羰基含量 巯基含量 表面疏水性 平均粒径羰基含量 1.000 -0.812** -0.736** 0.905**巯基含量 -0.812** 1.000 0.489* -0.736**表面疏水性 -0.736** 0.489* 1.000 -0.704**平均粒径 0.905** -0.736** -0.704** 1.000
由表1可知,肌原纤维蛋白不同氧化指标之间存在一定的相关性。其中羰基含量与巯基含量呈极显著负相关(P<0.01),说明随着氧化程度的增加,羰基生成积累,巯基则被氧化,使二硫键含量下降。羰基含量与平均粒径则呈极显著正相关(P<0.01),这与图5中蛋白羰基的生成可以破坏蛋白内部的交互作用,引起粒径增大的分析一致。有研究认为,蛋白羰基和相邻氨基酸可能因缩合反应而交联[34],但具体的作用机制还有待研究。肌原纤维蛋白表面疏水性与羰基含量及平均粒径均呈极显著负相关(P<0.01),表面疏水性在冷藏4 d后急剧下降是否与肉样水分含量的降低、羰基含量不断上升、粒径增大有关仍需进一步探究。总而言之,肉内体系环境复杂,不同蛋白氧化指标之间相互影响,相互作用。
3 结 论
通过对鸡肉中肌原纤维蛋白各项指标的测定,发现不同添加量氯化钠对鸡肉冷藏过程中肌原纤维蛋白的氧化具有促进作用。氯化钠的存在促进了羰基的生成,而巯基含量则显著降低。同时在氯化钠促进肌原纤维蛋白氧化的过程中,肌原纤维蛋白会产生一定的聚集交联现象,肌原纤维蛋白溶液的平均粒径有增大趋势,但羰基的生成对粒径的影响以及肌原纤维蛋白的聚集交联是否会导致表面疏水性显著降低仍需进一步探究。通过圆二色光谱法测定肌原纤维蛋白二级结构,发现α-螺旋相对含量随着氯化钠添加量的增加而降低;通过色氨酸荧光强度的测定发现,氯化钠添加量高于3.0%时,其荧光强度随着氯化钠添加量的增大而明显降低,说明过高添加量的氯化钠可以破坏肌原纤维蛋白的二级结构及三级结构,使得肌原纤维蛋白构象发生变化。
[1] 邓凯波, 黄雅萍, 许正金, 等. 白羽肉鸡胸腿肉的氧化对食用品质和钙蛋白酶活性的影响[J]. 食品科学, 2018, 39(23): 87-92.DOI:10.7506/spkx1002-6630-201823014.
[2] ESTEVEZ M, CAVA R. Lipid and protein oxidation, release of iron from heme molecule and colour deterioration during refrigerated storage of liver pate[J]. Meat Science, 2004, 68(4): 551-558.DOI:10.1016/j.meatsci.2004.05.007.
[3] WEN Rongxin, HU Yingying, ZHANG Lang, et al. Effect of NaCl substitutes on lipid and protein oxidation and flavor development of Harbin dry sausage[J]. Meat Science, 2019, 156: 33-43. DOI:10.1016/j.meatsci.2019.05.011.
[4] SUN Weizheng, ZHAO Qiangzhong, ZHAO Mouming, et al.Structural evaluation of myofibrillar proteins during processing of Cantonese sausage by Raman spectroscopy[J]. Journal of Agricultural and Food Chemistry, 2011, 59(20): 11070-11077. DOI:10.1021/jf202560s.
[5] FU Xiangjin, LIN Qinglu, XU Shiying, et al. Effect of drying methods and antioxidants on the flavor and lipid oxidation of silver carp slices[J]. LWT-Food Science and Technology, 2015, 61(1): 251-257.DOI:10.1016/j.lwt.2014.10.035.
[6] 陈洪生, 孔保华, 刁静静, 等. 氧化引起的肌肉蛋白质功能性变化及其控制技术的研究进展[J]. 食品科学, 2015, 36(11): 239-244.DOI:10.7506/spkx1002-6630-201511041.
[7] 李想. 肌原纤维蛋白聚集和构象变化对凝胶特性的影响研究[D]. 新乡: 河南科技学院, 2018: 12-13.
[8] PARK D, XIONG Y L, ALDERTON A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myo fibrillar protein[J]. Food Chemistry, 2007, 101(3):1239-1246. DOI:10.1016/j.foodchem.2006.03.028.
[9] 段丽菊, 刘英帅, 朱燕, 等. DNPH比色法: 一种简单的蛋白质羰基含量测定方法[J]. 毒理学杂志, 2005(4): 320-322. DOI:10.3969/j.issn.1002-3127.2005.04.027.
[10] CHELH I, GATELLIER P, VERONIQUE S L. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683. DOI:10.1016/j.meatsci.2006.05.019.
[11] 贾娜, 谢振峰, 李儒仁, 等. 迷迭香提取物与NaCl协同改善肌原纤维蛋白凝胶特性[J]. 食品科学, 2018, 39(3): 28-33. DOI:10.7506/spkx1002-6630-201803005.
[12] PUOLANNE E, HALONEN M. Theoretical aspects of water-holding in meat[J]. Meat Science, 2010, 86(1): 151-165. DOI:10.1016/j.meatsci.2010.04.038.
[13] SUN Weizheng, CUI Chun, ZHAO Mouming, et al. Effects of composition and oxidation of proteins on their solubility, aggregation and proteolytic susceptibility during processing of Cantonese sausage[J]. Food Chemistry, 2011, 124(1): 336-341. DOI:10.1016/j.foodchem.2010.06.042.
[14] HA A, GENNADIOS A, HANNA M A, et al. Physical and molecular properties of egg-white lipid films[J]. Journal of Food Science, 2010,64(5): 860-864. DOI:10.1111/j.1365-2621.1999.tb15928.x.
[15] 李晨伊. 亚硝酸钠对西式火腿中肌原纤维蛋白氧化影响的研究[D].杨凌: 西北农林科技大学, 2016: 14-15.
[16] 郭丽萍. 超高压结合热处理对猪肉蛋白质氧化、结构及特性的影响[D]. 绵阳: 西南科技大学, 2016: 58-59.
[17] 李学鹏, 周凯, 王金厢, 等. 羟自由基对六线鱼肌原纤维蛋白的氧化规律[J]. 中国食品学报, 2014, 14(6): 19-27. DOI:10.16429/j.1009-7848.2014.06.017.
[18] 汪媛, 张立彦, 齐宏超. NaCl及温度对猪肉脱水过程中蛋白质性质的影响[J]. 肉类研究, 2018, 32(7): 1-6. DOI:10.7506/rlyj1001-8123-201807001.
[19] 张培培. 不同氧化油脂对中式香肠中蛋白质氧化的影响[D]. 扬州:扬州大学, 2014: 25-31.
[20] 魏秀丽, 谢小雷, 张春晖, 等. 猪宰后肌肉体系中μ-Calpain及肌原纤维蛋白理化特性的变化规律[J]. 中国农业科学, 2015(12): 2428-2438. DOI:10.3864/j.issn.0578-1752.2015.12.016.
[21] VISSCHERS R W, DE JONGH H H. Disulphide bond formation in food protein aggregation and gelation[J]. Biotechnology Advances,2005, 23(1): 75-80. DOI:10.1016/j.biotechadv.2004.09.005.
[22] 吴雪燕. 中式香肠中蛋白氧化对蛋白功能性质和香肠品质的影响[D].扬州: 扬州大学, 2014: 46-49.
[23] 薛思雯, 邹玉峰, 杨慧娟, 等. 氯化钠浓度对僵直前高压处理兔肉中肌球蛋白凝胶保水性及其胶凝过程中分子特性和结构变化的影响[J]. 食品工业科技, 2017, 38(3): 97-101; 107. DOI:10.13386/j.issn1002-0306.2017.03.010.
[24] TILMAN G, TOBIAS J, KARTIN M, et al. Decreased proteolysis caused by protein aggregates, inclusion bodies, plaques, lipofuscin,ceroid, and ‘aggresomes’ during oxidative stress, aging, and disease[J].International Journal of Biochemistry and Cell Biology, 2004, 36(12):2519-2530. DOI:10.1016/j.biocel.2004.04.020.
[25] CAO Minjie, CAO Ailing, WANG Jing, et al. Effect of magnetic nanoparticles plus microwave or far-infrared thawing on protein conformation changes and moisture migration of red seabream (Pagrus major) fillets[J]. Food Chemistry, 2018, 266: 498-507. DOI:10.1016/j.foodchem.2018.06.057.
[26] SRINVIASAN S, HULTIN H O. Chemical, physical, and functional properties of cod proteins modified by a nonenzymic free-radicalgenerating system[J]. Journal of Agricultural and Food Chemistry,1997, 45(2): 310-320.
[27] 张丽, 余群力, 孙宝忠. 肌肉蛋白氧化对肉类品质的影响[J]. 食品与发酵工业, 2017, 43(5): 268-276. DOI:10.13995/j.cnki.11-1802/ts.201705043.
[28] 张洪超, 薛张芝, 徐晓蓉, 等. 羟基自由基氧化对乌贼蛋白分子间作用力及结构的影响[J]. 核农学报, 2020, 34(1): 131-138.
[29] PRICE N C. Conformational issues in the characterization of proteins[J].Biotechnology and Applied Biochemistry, 2000, 31(1): 29-40.DOI:10.1042/BA19990102.
[30] DOCKAL M. Conformational transitions of the three recombinant domains of human serum albumin depending on pH[J]. Journal of Biological Chemistry, 2000, 275(5): 3042-3050. DOI:10.1074/jbc.275.5.3042.
[31] 楼宵玮, 蒋娅婷, 潘道东, 等. 氯化钠对肌原纤维蛋白与风味物质相互作用的影响[J]. 食品科学, 2017, 38(5): 74-79. DOI:10.7506/spkx1002-6630-201705012.
[32] 林凯蕾. 圆二色光谱预测蛋白质二级结构组成方法评析[D]. 上海:复旦大学, 2012: 66-68.
[33] STADTMAN E R, LEVINE R L. Free radical-mediated oxidation of free amino acids and amino acid residues in proteins[J]. Amino Acids,2003, 25(3/4): 207-218. DOI:10.1007/s00726-003-0011-2.
[34] XIONG Y, DECKER E A, FAUSTMAN C L, et al. Protein oxidation and implications for muscle food quality[M]//DECKER E A,FAUSTMAN C, LOPEZ-BOTE C J. Antioxiants in muscle foods.New York: John Wiley & Sons, 2000: 85-111.