我国是水产大国,近年来渔业发展取得了长足进步,其中淡水鱼是我国水产的重要组成部分。我国淡水养殖产量占水产养殖产量的3/4,是我国水产的重要组成部分,在我国渔业中占据重要地位[1]。我国2016年、2017年和2018年淡水产品产量分别为3 078.20、3 123.59、3 156.23 万t,其中淡水鱼类产量分别为2 679.14、2 696.69、2 734.09 万t,淡水鱼类在淡水产品中的占比均接近87%[2],是淡水产品的主要来源。市场上的鱼糜制品一般均以经过采肉、漂洗、脱水、精滤、冷冻等工序制得的海水鱼糜或淡水鱼糜为原料制成[3]。本研究的对象是淡水鱼资源革胡子鲶鱼(Clarias gariepinus,CG),其属于优质淡水鱼之一,具有肉多刺少、肉质鲜美、生长速度快、适应性强、经济实惠、易去皮和采肉等特点,是制作鱼糜或鱼糜制品的最佳原料之一[4]。
未漂洗的鱼糜在贮藏中易发生脂肪氧化、蛋白质腐败变质,为解决上述问题,通常会选择在鱼糜和鱼糜制品中添加抗氧化剂,但是不同抗氧化剂对鱼糜及鱼糜制品的抗氧化性有所不同。食品级抗氧化剂是一类以低添加量形式加至食物中可有效防止食物被氧化的物质[5]。常见的食品级抗氧化剂包括合成抗氧化剂和天然抗氧化剂。合成抗氧化剂主要有特丁基对苯二酚、没食子酸丙酯、丁基甲基苯酚和丁基甲氧基苯酚。天然抗氧化剂按活性成分可分为黄酮类、皂苷类、维生素类、多酚类和褪黑素类等[6]。食品行业研究较多的是VE、VC、迷迭香提取物和茶多酚(tea polyphenols,TP)等。蛋白质氧化、脂肪氧化是导致肉制品和鱼糜贮藏过程中品质下降的主要原因。刘焱等[7]发现,在鱼糜中添加TP可显著延缓鱼糜氧化和凝胶品质的降低。付丽等[8]研究3 种天然抗氧化剂复合对冻藏牛肉丸的抗氧化效果发现,TP、葡萄籽提取物和VC复合天然抗氧化剂对牛肉丸冻藏期间的脂肪氧化及品质改善均有理想的效果,具有潜在的应用价值。
在传统鱼糜生产工艺中,漂洗是不可缺少的工序。漂洗可以除去鱼肉中的可溶性蛋白质、色素、气味、脂肪及无机离子(如Ca2+、Mg2+)等成分[9],能够延长鱼糜及鱼糜制品的保藏期。可溶性蛋白质含有大量的蛋白水解酶,在鱼糜的加工和冷藏过程中会造成肌原纤维蛋白降解,影响胶体形成[10]。但是漂洗过程需要投入大量人力和物力,成本较高,同时有大量污水排出,容易造成环境污染,而且漂洗出的可溶性蛋白和脂肪会造成鱼糜的营养成分流失、产率降低。为了解决这一难题和考虑到食品安全问题,本研究选用的抗氧化剂均为天然抗氧化剂。天然抗氧化剂在自然界中分布广泛,并且长期食用不会出现低毒性迹象,具有安全、高效等优点[11]。本研究将添加抗氧化剂的鱼糜进行冻藏后检测脂肪氧化和蛋白质氧化情况,为食品企业保鲜鱼糜提供理论支持。
1 材料与方法
1.1 材料与试剂
革胡子鲶鱼,体质量1.5~1.6 kg,体长40 cm,天津市德仁农业发展有限公司养殖,红旗农贸综合水产批发市场销售。
复合磷酸盐、山梨糖醇 江阴连盛化工有限公司;木薯淀粉 权鑫鸿业(天津)国际贸易有限公司;大豆分离蛋白粉 安阳市得天力食品有限公司;食盐、蔗糖 天津市红旗农贸市场;转谷氨酰胺酶(transglutanminase,TGase,酶活力100 U/g) 江苏一鸣生物股份有限公司;氧化镁、硼酸、盐酸(均为分析纯) 天津市风船化学试剂科技有限公司;牛血清蛋白、双缩脲(均为分析纯) 天津市科密欧化学试剂有限公司;2-硫代巴比妥酸、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、2-硝基苯甲酸 源叶生物有限公司;三氯乙酸(分析纯) 天津市津科精细化工研究所;无水乙醚(分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
CM-14斩拌机 西班牙美卡公司;BJRJ-82绞肉机、BYXX-50烟熏炉、带孔不锈钢模具 浙江嘉兴艾博实业有限公司;CM-5色差仪 日本Konica Minoilta公司;TA-XT plus物性测定仪 英国Stable Micro System公司;3k15离心机 德国Sigma公司;SDX-1全自动风冷速冻箱 天津市特斯达食品机械科技有限公司;DZ-400/2S真空包装机 诸城市美川机械有限公司;ZWY-240摇床 上海智城分析仪器制造有限公司;T6新世纪紫外分光光度计 北京普析通用仪器有限责任公司;ST40R离心机 美国Thermo公司;FA25匀浆机上海鲁克流体机械制造有限公司。
1.3 方法
1.3.1 加工工艺
1.3.1.1 鱼糜加工工艺流程
活鱼(革胡子鲶鱼)→冰浴→敲击头部致晕→清洗→开膛去内脏→去皮→采肉块→清洗→脱水→速冻→绞肉→斩拌→鱼糜→分装→速冻→冷冻贮藏
操作要点:1)前处理方式:将革胡子鲶鱼放入冰水(水中加入碎冰,水温4~5 ℃)中保持10~15 min,立即敲击头部致晕,开膛取出所有内脏,清洗干净鱼体;2)采肉、绞碎:将清洗干净的鱼体手工去皮、采肉,得到大块肉条(块),为便于绞肉,先放入速冻箱中预冻,使中心温度降至-3~-5 ℃,用绞肉机绞碎;3)斩拌:将绞碎的鱼肉粒放入斩拌机中(事先用碎冰降温),先空擂1~2 min,然后加入复合磷酸盐、白糖、山梨糖醇和抗氧化剂(分别为质量分数0.08% TP、0.06% VE、0.08% TP+0.06% VE),斩拌2~3 min,得到3 组鱼糜。
1.3.1.2 鱼糜凝胶加工工艺流程
鱼糜凝胶基本配方:原料鱼糜1 000 g、复合磷酸盐4 g、山梨糖醇0.4 g、蔗糖50 g、食盐22 g、大豆分离蛋白粉50 g、木薯变性淀粉60 g、TGase 4 g,香精香料适量,冰水适量。
鱼糜凝胶加工工艺流程:冷冻贮藏的原料鱼糜→解冻→配料、斩拌制得肉馅→装入带孔不锈钢模具→抽真空→蒸煮→冷却→切块→半成品(放置于4 ℃冰箱,12 h后取样测定)
操作要点:1)斩拌:按照实验设计方案选用不同冷冻时间的CG冷冻鱼糜,缓慢解冻(0~4 ℃)后,放入斩拌机中,先空擂2~3 min,然后加入食盐进行盐擂2~3 min,再依次加入配方中的其他辅料继续斩拌3~4 min,整个斩拌过程控制时间为10 min;2)成型:将斩拌后的肉馅装入带孔不锈钢模具(30 cm×10 cm×5 cm)中,内垫食品级塑料布,将模具的盖固定好;3)抽真空:在压好的模具中用针头从带孔的模具盖和底部、四周扎孔排气,再放入真空滚揉机中抽真空5 min(0.06 MPa),重复2 次,达到抽真空的目的;4)蒸煮:把压好的模具放入烟熏炉,将烟熏炉(蒸煮程序)设置程序单步运行,采用两段式蒸煮方式,先运行程序48 ℃、保持25 min,之后运行程序90 ℃、保持40 min,以防止鱼糜发生凝胶劣化现象。
1.3.2 实验方案设计
按照1.3.1.1节方法得到CG冷冻鱼糜,以其为原料按照1.3.1.2节方法分别添加防冻剂和不同的天然抗氧化剂(0.08% TP、0.06% VE、0.08%TP+0.06% VE)后加工成鱼糜凝胶(鱼豆腐),设计3 组实验,记为TP组、VE组和(TP+VE)组,对照组记为CK组。对3 组鱼糜进行总挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量、硫代巴比妥酸反应物(thiobarbituric acid reactive substance,TBARs)值、羰基含量、巯基含量、肌原纤维蛋白溶解度测定,对3 组鱼糜凝胶进行水分含量、白度、持水力和凝胶强度测定,分析抗氧化剂对鱼糜品质的影响。
1.3.3 指标测定
1.3.3.1 TVB-N含量测定
采用GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》的方法测定。
1.3.3.2 TBARs值测定
参考Chajjan等[12]的方法。
1.3.3.3 肌原纤维蛋白提取及含量测定
参照Fang Yang等[13]的方法提取鱼糜肌原纤维蛋白,放置在4 ℃冰箱保存,72 h内使用。
蛋白质量浓度测定:参考Bradford[14]的方法,采用双缩脲法进行测定,以牛血清蛋白为标准蛋白制作标准曲线。
1.3.3.4 羰基含量测定
参照Oliver等[15]的方法,略作修改。采用DNPH法,羰基含量按式(1)计算,重复测定5 次,结果取平均值。
式中:A370 nm为370 nm波长处的吸光度;2.2×104 L/(mol·cm)为摩尔吸光系数;ρ为以盐酸胍为空白在280 nm波长处测得蛋白质量浓度/(mg/mL)。
1.3.3.5 巯基含量测定
参考Ellman[16]的方法,采用5,5’-二硫代双(2-硝基苯甲酸)法测定。
1.3.3.6 肌原纤维蛋白溶解度测定
参照Benjakul等[17]的方法,并略加修改。配制5 mg/mL肌原纤维蛋白溶液,在2 ℃条件下放置4 h,每隔20 min振摇1 次,在8 500×g条件下离心15 min后取1 mL上清液,分别加入4 mL双缩脲溶液和3 mL乙醚,混合均匀后8 500×g离心10 min,在540 nm波长处测定吸光度。用双缩脲法测定上清液中肌原纤维蛋白质量浓度。肌原纤维蛋白溶解度按式(2)计算,重复测定5 次,结果取平均值。
式中:ρ1为上清液中肌原纤维蛋白质量浓度/(mg/mL);ρ2为配制的肌原纤维蛋白溶液质量浓度/(mg/mL)。
1.3.3.7 水分含量测定
参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》[18]的第一法直接干燥法。
1.3.3.8 白度测定
将鱼糜凝胶搅成肉糜,铺满石英比色皿底部,放置于色差仪上测定样品亮度值(L*)、红度值(a*)和黄度值(b*)。样品白度按式(3)[19]计算。重复测定5 次,结果取平均值。
1.3.3.9 持水力测定
将鱼糜凝胶切成约3 mm厚的薄片,精确称量(2.000 0±0.000 1) g样品(m2,g),用滤纸包裹,在6 000×g、15 ℃条件下离心10 min,离心后立即去掉滤纸,精确称取样品质量(m1,g),每组平行测定5 次。持水力按式(4)[20]计算。
1.3.3.10 凝胶强度测定
将鱼糜凝胶从4 ℃冰箱中取出,切成2.5 cm×2.5 cm×2.5 cm的正方体,在室温中放置25~30 min。利用质构仪测定鱼糜凝胶的凝胶强度。参数设定:选用P/35 S探头,测试模式为压缩力模式,测前速率1.0 mm/s,测中速率1.0 mm/s,测后速率1.0 mm/s,应变50%,触发力5 g。测试结果选择凝胶曲线上第1个峰所在位置的凝胶破断力,对应的距离为凹陷距离,其中凝胶破断力反映鱼糜凝胶的硬度,凹陷距离反映鱼糜凝胶的弹性,二者乘积即为凝胶强度。每个处理组包含5 个平行试样,结果取平均值,凝胶强度按式(5)[21]计算。
1.4 数据处理
用Microsoft Excel 2011软件进行数据处理,结果用平均值±标准差表示。采用Statistix 8.1软件进行显著性分析,显著性水平为0.05。使用Sigma Plot 10.0软件制图。
2 结果与分析
2.1 抗氧化剂对CG鱼糜TVB-N含量的影响
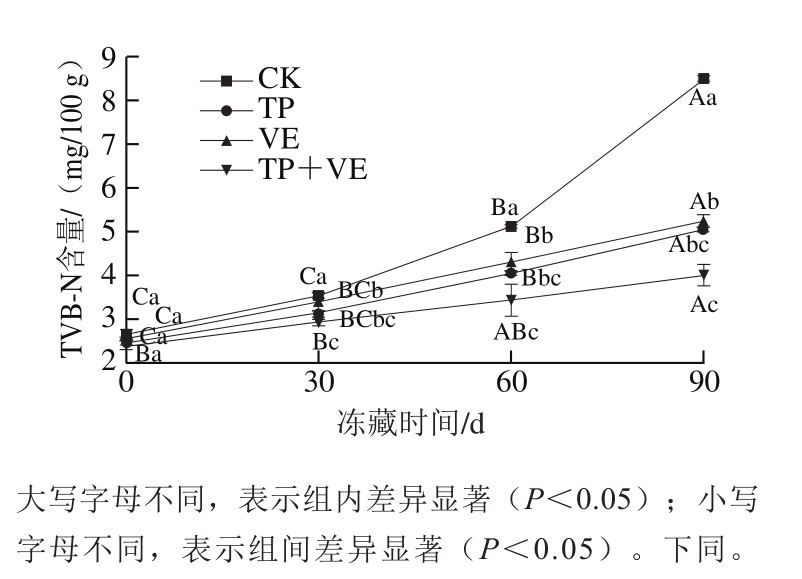
图1 抗氧化剂对CG鱼糜TVB-N含量的影响
Fig.1 Effects of antioxidants on TVB-N content of CG surimi
TVB-N是指水产品在细菌和酶的作用下,分解蛋白质产生的氨及胺类等碱性含氮物质,是评价水产品新鲜度的指标[22]。由图1可知,冻藏0 d时鱼糜TVB-N含量差异不显著,说明冻藏开始时鱼糜还没有开始氧化,处于新鲜状态。随着冻藏时间的延长,TP组和VE组鱼糜TVB-N含量没有显著差异,(TP+VE)组均明显低于TP组和VE组,说明(TP+VE)组鱼糜的抗氧化效果更好,TP+VE应用到鱼糜的冷藏保鲜方面,对延长鱼糜贮藏期效果更佳。CK组鱼糜冻藏0~30 d的TVB-N含量差异不显著,之后随着冻藏时间的延长TVB-N含量显著上升(P<0.05),说明CK组鱼糜冻藏0~30 d内品质良好。TP组和VE组鱼糜冻藏0~30、30~60 d的TVB-N含量差异不显著,冻藏60~90 d期间TVB-N含量显著增加(P<0.05),但仍低于冻藏60~90 d的CK组,说明TP组和CK组鱼糜冻藏0~60 d内的品质良好,冻藏60~90 d内品质在可接受范围内。在冻藏过程中,(TP+VE)组的TVB-N含量变化趋势平缓,说明(TP+VE)组在整个冻藏过程中品质良好,主要是由于TP和VE能够协同作用,从而减弱鱼糜的氧化,在鱼糜贮藏过程中有很广泛的应用价值。
2.2 抗氧化剂对CG鱼糜TBARs值的影响
硫代巴比妥酸法是测定肉类脂肪氧化常用的方法,其原理是脂质发生氧化反应后产生的氧化终产物丙二醛对细胞膜具有一定破坏作用,其在酸性和高温条件下与硫代巴比妥酸反应可以生成红色产物,所以通过对丙二醛含量进行测定可以直接反映出肉类脂肪的氧化情况[23]。
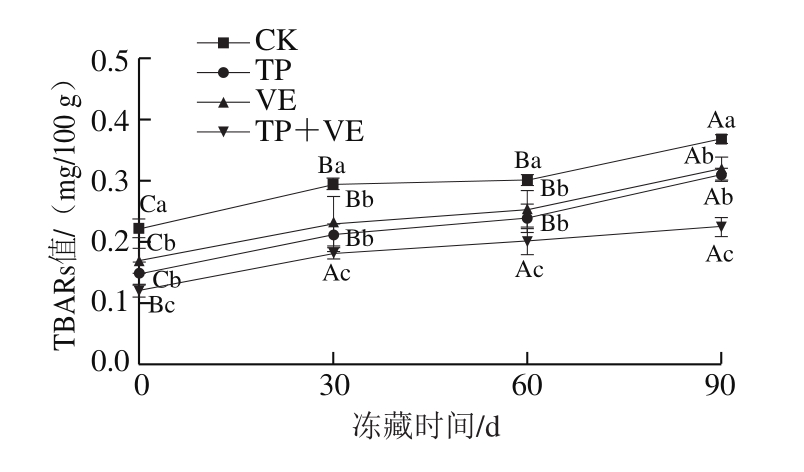
图2 抗氧化剂对CG鱼糜TBARs值的影响
Fig.2 Effects of antioxidants on TBARs value of CG surimi
由图2可知,TP组、VE组和(TP+VE)组鱼糜冻藏0~60 d过程中TBARs值先增加后趋于平缓,和CK组一致,但是TBARs值均显著低于CK组(P<0.05)。TP组和VE组鱼糜冻藏60 d的TBARs值分别为0.24、0.25 mg/100 g,均小于冻藏30 d的CK组(0.29 mg/100 g),说明TP组和VE组鱼糜冻藏0~60 d品质良好。TP组和VE组鱼糜冻藏90 d的TBARs值显著高于冻藏60 d时(P<0.05),数值接近于CK组冻藏60 d的TBARs值(0.30 mg/100 g),说明TP组和VE组鱼糜冻藏0~90 d的品质在可接受范围内。(TP+VE)组鱼糜冻藏前30 d内TBARs值迅速上升,冻藏30~90 d变化趋于平缓,冻藏90 d时的TBARs值为0.19 mg/100 g,低于CK组冻藏初始值(0.22 mg/100 g),说明(TP+VE)组冻藏0~90 d范围内鱼糜品质良好。由此说明添加抗氧化剂TP、VE和TP+VE均能延缓CG鱼糜脂肪氧化,延长保藏期。
2.3 抗氧化剂对CG鱼糜羰基含量的影响
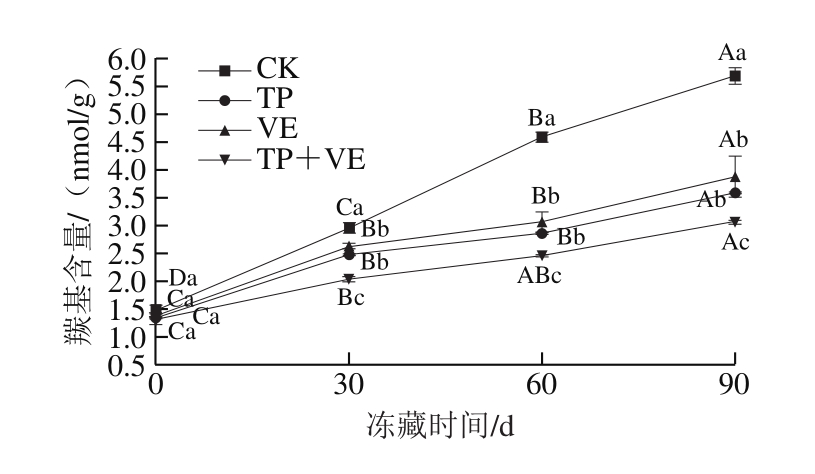
图3 抗氧化剂对CG鱼糜羰基含量的影响
Fig.3 Effects of antioxidants on protein carbonyl content of CG surimi
羰基的产生是蛋白氧化后的一个显著变化,代表蛋白的氧化程度。由图3可知,随着冻藏时间的延长,CK组鱼糜羰基含量显著增加(P<0.05),TP组、VE组和(TP+VE)组呈先增加后趋于平缓的趋势。TP组和VE组鱼糜冻藏0~30 d的羰基含量显著增加(P<0.05),冻藏30~60 d含量差异不显著,冻藏60 d的羰基含量分别为2.83、2.91 nmol/g,低于CK组冻藏30 d的羰基含量(2.96 nmol/g),说明TP组和VE组鱼糜冻藏0~60 d内品质良好。TP组和VE组鱼糜冻藏90 d的羰基含量分别为3.49、3.88 nmol/g,低于CK组冻藏60 d的羰基含量(4.59 nmol/g),说明TP组和VE组冻藏60~90 d的鱼糜品质在可接受范围内。(TP+VE)组冻藏90 d时的羰基含量为2.90 noml/g,低于CK组冻藏30 d的羰基含量(2.96 nmol/g),说明(TP+VE)组冻藏0~90 d内鱼糜品质良好,(TP+VE)组抗氧化剂对鱼糜的抗氧化效果更好。
2.4 抗氧化剂对CG鱼糜巯基含量的影响

图4 抗氧化剂对CG鱼糜巯基含量的影响
Fig.4 Effects of antioxidants on protein sulfhydryl content of CG surimi
巯基是水产品蛋白中最具活性的基团,贮藏期间随蛋白氧化含量下降,是衡量蛋白氧化的指标[24]。由图4可知,TP组、VE组和(TP+VE)组鱼糜冻藏期间巯基含量均呈下降趋势,其下降幅度均小于CK组,3 组鱼糜冻藏期间羰基含量为80.89~98.76 nmol/g,均大于80 nmol/g,说明3 组鱼糜冻藏0~90 d的品质在可接受范围内。TP组和VE组鱼糜冻藏0~30 d的巯基含量为97.90~92.71 nmol/g,均大于90 nmol/g,说明TP组、VE组鱼糜冻藏0~30 d的品质良好,蛋白降解程度不明显。(TP+VE)组鱼糜冻藏60 d的巯基含量仍大于91 nmol/g,说明(TP+VE)组鱼糜冻藏0~60 d内品质良好。在冻藏过程中巯基含量变化程度为(TP+VE)组<TP组<VE组<CK组,说明加入3 组天然抗氧化剂TP、VE、TP+VE在冻藏过程中能延缓鱼糜的氧化,延缓蛋白质降解,对保持鱼糜的良好品质,延长贮藏期有很大的实用价值。
2.5 抗氧化剂对CG鱼糜肌原纤维蛋白溶解度的影响
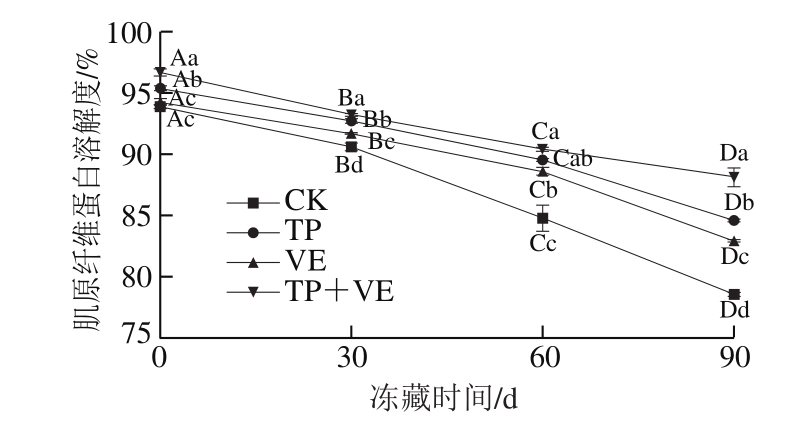
图5 抗氧化剂对CG鱼糜肌原纤维蛋白溶解度的影响
Fig.5 Effects of antioxidants on proteolysis of myofibrillar protein in CG surimi
肌原纤维蛋白代表着鱼糜凝胶网络结构,肌原纤维蛋白溶解度降低的越少,鱼糜的凝胶性能就越好,鱼糜的氧化程度就越低[25-26]。由图5可知,随着冻藏时间的延长,TP组、VE组和(TP+VE)组鱼糜的肌原纤维蛋白溶解度为86%~96%、84%~94%和88%~97%,冻藏60 d时TP组和VE组的肌原纤维蛋白溶解度均超过88%,TP组高于VE组,说明TP组和VE组冻藏0~60 d内品质良好,且TP组鱼糜氧化程度低于VE组,主要是多酚类抗氧化剂含有丰富的活性羟基,能够很好地与鱼糜蛋白紧密结合,从而延缓肌原纤维蛋白的降解。冻藏末期,(TP+VE)组鱼糜的肌原纤维蛋白溶解度为88%左右,说明添加抗氧化剂鱼糜冻藏0~90 d品质良好,抗氧化剂有延缓鱼糜氧化的作用,主要是由于抗氧化剂TP和VE的协同作用延缓了鱼糜的蛋白氧化,这与吴琳琳等[6]研究发现TP和VE协同作用延缓鱼糜的氧化效果更好结果一致。
2.6 抗氧化剂对CG鱼糜凝胶水分含量的影响
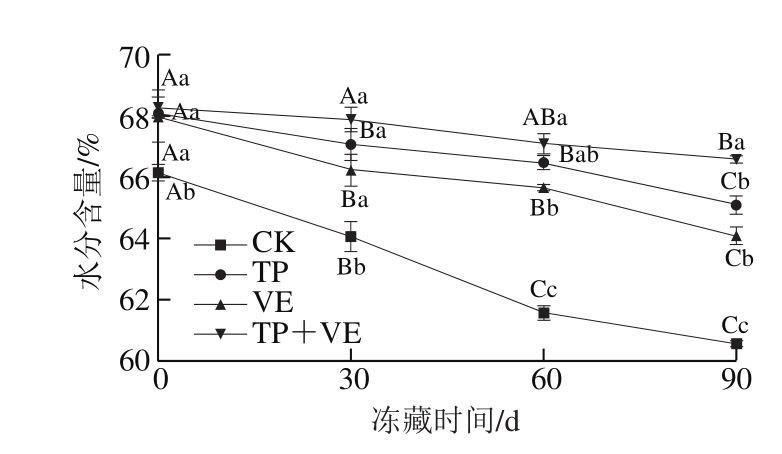
图6 抗氧化剂对CG鱼糜凝胶水分含量的影响
Fig.6 Effects of antioxidant on water content of CG surimi gel
水分含量的高低将会直接影响鱼糜及鱼糜制品的品质。由图6可知:冻藏0~30 d内,TP组、VE组和(TP+VE)组鱼糜凝胶的水分含量显著高于CK组(P<0.05);TP组和VE组鱼糜凝胶冻藏60 d的水分含量分别为66.46%和65.65%,与CK组水分含量的初始值(66.15%)相差不大,说明TP组和VE组鱼糜凝胶冻藏0~60 d品质良好。TP组和VE组鱼糜凝胶冻藏90 d的水分含量均大于冻藏30 d的CK组,说明TP组和VE组在-18 ℃冻藏0~90 d的品质在可接受范围内。(TP+VE)组鱼糜凝胶冻藏90 d的水分含量为66.57%,大于CK组冻藏0 d的水分含量(66.15%),说明(TP+VE)组冻藏0~90 d内品质良好。
2.7 抗氧化剂对CG鱼糜凝胶白度的影响
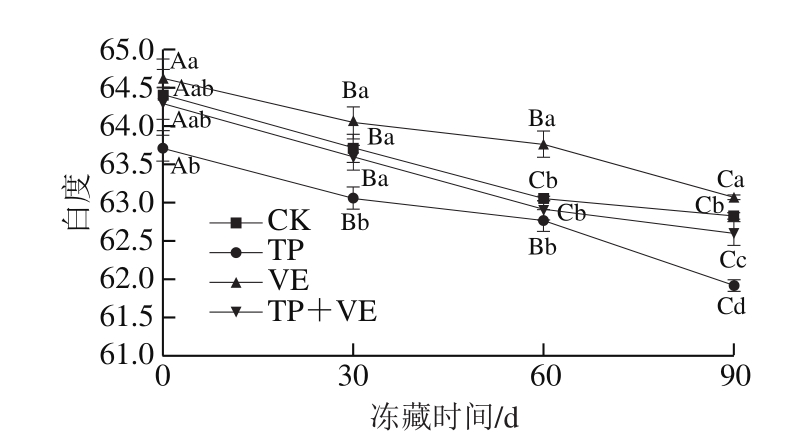
图7 抗氧化剂对CG鱼糜凝胶白度的影响
Fig.7 Effects of antioxidant on whiteness of CG surimi gel
白度是用来判定鱼糜制品色泽的重要指标之一,通常情况下,L*越大,a*越小,白度越大,鱼糜制品就越白,洁白且有一定亮度的鱼糜制品是人们追求的目标[27-29]。由图7可知,随着冻藏时间的延长,鱼糜凝胶的白度呈下降趋势。(TP+VE)组和CK组冻藏0~30 d的白度差异不显著,整个冻藏期间白度为62.59~64.41。冻藏60~90 d内,VE组的白度显著高于(TP+VE)组和CK组(P<0.05),VE组冻藏60 d的白度与30 d时差异不显著,冻藏60 d的白度为63.76,与CK组冻藏30 d的白度(63.71)相近,说明VE组冻藏0~60 d的品质良好,主要是由于在冻藏过程中VE有提高肉制品色泽的功能。TP组的白度低于CK组、(TP+VE)组和VE组,且TP组在冻藏过程中白度降低1.89,与CK组(1.69)相比仅相差0.20,主要原因是TP属于酚类抗氧化剂,本身呈现棕红色,对鱼糜的白度会造成微弱的影响。
2.8 抗氧化剂对CG鱼糜凝胶持水力的影响

图8 抗氧化剂对CG鱼糜凝胶持水力的影响
Fig.8 Effects of antioxidant on water-holding capacity of CG surimi gel
持水力在鱼糜凝胶品质中占据重要地位,它能代表产品的保水性,是影响蛋白交联作用的指标[30]。持水力越好,蛋白结构越完整,凝胶性能就越好。由图8可知,随着冻藏时间的延长,TP组、VE组和(TP+VE)组鱼糜凝胶持水力与CK组相比下降平缓。TP组冻藏90 d的持水力为90.52%,大于冻藏30 d的CK组(90.45%),说明TP组冻藏0~90 d内保水性能良好,主要是由于多酚含有丰富的羟基,能与鱼糜蛋白较好结合,截留更多水分,从而提高鱼糜凝胶的持水力。VE组冻藏0~60 d的持水力大于90%,说明VE组鱼糜凝胶冻藏0~60 d内的保水性能良好,冻藏90 d的持水力(89.78%)与CK组冻藏30 d的持水力(90.45%)仅相差0.67%,因此TP组冻藏0~90 d的保水性能在可接受范围内。(TP+VE)组冻藏90 d的持水力(92.26%)与CK组的初始值(92.34%)相差甚少,可以忽略,因此(TP+VE)组冻藏0~90 d内保水性能良好,主要是由于天然抗氧化剂TP和VE复配后,提高了鱼糜延缓氧化的能力,延长了鱼糜的保藏期,以至于整个冻藏期间(TP+VE)组仍保持良好的品质。
2.9 抗氧化剂对CG鱼糜凝胶强度的影响
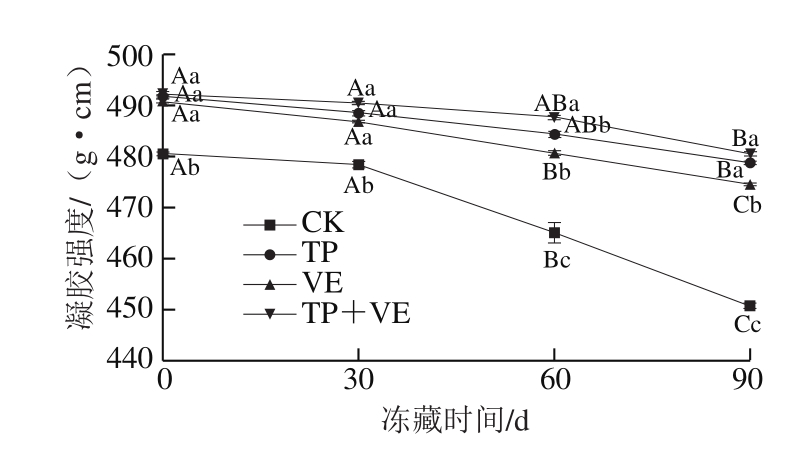
图9 抗氧化剂对CG鱼糜凝胶强度的影响
Fig.9 Effects of antioxidant on gel strength of CG surimi gel
凝胶强度是衡量鱼糜品质的重要指标之一[31]。在一定范围内,凝胶强度越大,说明鱼糜凝胶品质越好。由图9可知,冻藏初期,TP组、VE组和(TP+VE)组的凝胶强度显著高于CK组(P<0.05),凝胶强度分别增加11.2、10.0、12.7 g·cm,说明TP、VE、TP+VE 3 组抗氧化剂均能提高鱼糜凝胶强度。TP组和VE组冻藏60 d的凝胶强度分别为484.34、480.58 g·cm,均大于CK组冻藏的初始值(480.52 g·cm),说明TP组和VE组冻藏0~60 d内凝胶特性良好。TP组冻藏90 d的凝胶强度为484.73 g·cm,大于CK组冻藏30 d的凝胶强度(478.45 g·cm),而VE组冻藏90 d的凝胶强度与CK组冻藏30 d的凝胶强度仅相差0.72 g·cm,说明TP组和VE组冻藏0~90 d的凝胶特性在可接受范围内。(TP+VE)组在整个冻藏过程中凝胶强度为482.49~492.26 g·cm,大于CK组冻藏0 d的凝胶强度(480.52 g·cm),说明(TP+VE)组冻藏0~90 d内凝胶特性良好。
3 结 论
为了延长鱼糜贮藏时间,延缓鱼糜的氧化,以未漂洗的新鲜CG鱼肉为主要原料,添加抗氧化剂和防冻剂后制成鱼糜并进行冻藏。从TVB-N含量、TBARs值、羰基含量、肌原纤维蛋白溶解度、水分含量、持水力和凝胶强度来看,TP组、VE组冻藏0~60 d内品质良好,冻藏60~90 d的品质在可接受范围内,(TP+VE)组在冻藏0~90 d内保持良好的品质;从巯基含量来看,TP组、VE组冻藏0~30 d内品质良好,(TP+VE)组冻藏0~60 d内品质良好;从白度来看,TP组的白度低于CK组、(TP+VE)组和VE组,VE组冻藏0~60 d的品质良好。综合以上结果,TP组、VE组冻藏0~60 d内品质特性良好,冻藏0~90 d内品质在可接受范围内,(TP+VE)组冻藏0~90 d内品质特性良好。
[1]陈诗波, 李崇光.中国淡水鱼农户精养成本收益及生产效率分析[J].价格理论与实践, 2007(11): 44-45.
[2]国家统计局.中国统计年鉴[M].北京: 中国统计出版社, 2019: 8-12.
[3]张婷, 李茜雅, 唐欢, 等.鱼糜及鱼糜制品加工工艺研究进展[J].中国调味品, 2018, 43(3): 185-191.DOI:10.3969/j.issn.1000-9973.2018.03.042.
[4]李鹏, 郭耀华, 马俪珍, 等.加热处理对鲶鱼鱼糜漂洗水中肌浆蛋白性质的影响[J].天津农学院学报, 2015, 22(2): 16-20.DOI:10.3969/j.issn.1008-5394.2015.02.005.
[5]HALLIWELL B, AESECHBACH R, LOLIGER J.The characterization of antioxidants[J].Food and Chemical Toxicology,1995, 33(7): 601-607.
[6]吴琳琳, 常忠义, 高红亮, 等.抗氧化剂TBHQ、VE和TP对罗非鱼非漂洗鱼糜的抗氧化作用[J].农林科技大学学报(自然科学版), 2012,40(4): 185-190.DOI:10.13207/j.cnki.jnwafu.2012.04.008.
[7]刘焱, 娄爱华, 丁玉珍, 等.茶多酚对淡水鱼糜脂类及蛋白质的影响[J].食品工业科技, 2009, 30(7): 291-293.DOI:10.13386/j.issn1002-0306.2009.07.064.
[8]付丽, 吴丽, 胡晓波, 等.三种天然抗氧化剂复合对冻藏牛肉丸抗氧化效果的研究[J].现代食品科技, 2018, 34(3): 159-166.DOI:10.13982/j.mfst.1673-9078.2018.03.023.
[9]孟珺, 郭颖, 高红亮, 等.不漂洗鱼糜的制作工艺研究[J].食品工业科技, 2012, 33(10): 247-249.DOI:10.13386/j.issn1002-0306.2012.10.079.
[10]何阳春, 何咏平.鱼糜制品弹性与鱼肉凝胶特性研究进展[J].水产科学.2004, 23(6): 41-42.DOI:10.16378/j.cnki.1003-1111.2004.06.014.
[11]高静.天然抗氧化剂及其协同作用[J].食品安全质量检测学报, 2020, 11(6): 1859-1864.DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.06.030.
[12]CHAJJAN M, PANPIPAT W, NISOA M.Chemical deterioration and discoloration of semi-dried tilapia processed by sun drying and microwave drying[J].Drying Technology, 2016, 35(5): 642-649.DOI:10.1080/07373937.2016.1199565.
[13]FANG Yang, RUSTAD T, XU Yanshun, et al.Endogenous proteolytic enzymes: a study of their impact on cod (Gadus morhua) muscle proteins and textural properties in a fermented product[J].Food Chemistry, 2015, 172: 551-558.DOI:10.1016/j.foodchem.2014.09.086.
[14]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Analytical Biochemistry, 1976, 72: 248-254.
[15]OLIVER C, AHN B, MOERMAN E, et al.Aged-related changes in oxidized proteins[J].Journal of Biological Chemistry, 1987, 262:5488-5491.
[16]ELLMAN G L.Tissue sulfhydryl groups[J].Archives of Biochemistry and Biophysics, 1959, 82: 70-77.
[17]BENJAKUL S, BAHER F.Physicochmical and enzymatic changes of cod muscle proteins subjected todifferent freezethaw cycles[J].Journal of the Science of Food and Agriculture, 2000, 80(8): 1143-1150.DOI:10.1002/1097-0010(200006).
[18]中华人民共和国国家卫生和计划生育委员会.食品安全国家标准食品中水分的测定: GB 5009.3—2016[S].北京: 中国标准出版社,2016.
[19]熊凤娇, 马俪珍, 王洋.脂肪添加种类和比例对鱼豆腐品质特性的影响[J].肉类研究, 2018, 32(3): 1-6.DOI:10.7506/riyj.1001-8123-201803001.
[20]宁云霞, 杨淇越, 鲍佳彤, 等.原料肉种类和组成对鱼肉肠品质特性的影响[J].食品科技, 2019, 44(12): 117-124.DOI:10.13684/j.cnki.spkj.2019.12.021.
[21]杨铭铎, 张璇.新型肉肠开发的研究进展[J].四川旅游学院学报,2015(3): 14-17.
[22]徐晨, 耿胜荣, 白婵, 等.TVB-N与生鲜草鱼片储藏时间和温度的关系[J].湖北农业科学, 2016, 55(23): 6204-6207.DOI:10.14088/j.cnki.issn0439-8114.2016.23.051.
[23]鞠健, 胡佳慧, 熊光权, 等.基于空气(普通包装)和真空包装条件下鲈鱼片脂肪氧化指标建立鲈鱼货架期预测模型[J].食品工业科技,2018, 39(6): 191-198.DOI:10.13386/j.issn1002-0306.2018.06.035.
[24]鞠健, 汪超, 李冬生, 等.茶多酚和迷迭香结合Nisin对冷藏鲈鱼品质的影响[J].食品科学技术学报, 2017, 35(1): 70-75.DOI:10.3969/j.issn.2095-6002.2017.01.011.
[25]李靖, 马嫄, 岳文婷, 等.猪背最长肌蛋白质在冷冻贮藏过程中的变化[J].食品工业科技, 2018, 39(16): 248-252.DOI:10.13386/j.issn1002-0306.2018.16.044.
[26]刁小琴, 关文婷, 张瑛, 等.冷冻及解冻处理对肌原纤维蛋白理化性质的影响[J].中国酿造, 2019, 38(12): 153-157.DOI:10.11882/j.issn.0254-5071.2019.12.030.
[27]PARK J W.Surimi gel colors as affected by moisture content and physical conditions[J].Journal of Food Science, 1995, 60(1): 15-18.DOI:10.1111/j.1365-2621.1995.tb05596.x.
[28]HSU C K, CHIANG B H.Effects of water, oil, starch, calcium carbonate and titanium dioxide on the color and texture of threadfin and hairtail surimi gels[J].International Journal of Food Science and Technology, 2002, 37(4): 387-393.DOI:10.1046/j.1365-2621.2002.00577.x.
[29]ENDOO N, YONGSAWATDIGUL J.Comparative study on chemical and gel-forming properties of surimi from freshwater and marine fish during frozen storage[J].Food and Applied Bioscience Journal, 2014,2(3): 192-202.
[30]徐祖东, 戴志远, 陈康, 等.3 种即食鱼豆腐营养成分分析及凝胶性能评价[J].食品科学, 2017, 38(18): 93-98.DOI:10.7506/spkx1002-6630-201718015.
[31]刘芳芳, 林婉玲, 李来好, 等.鱼糜凝胶形成方法及凝胶特性影响因素的研究进展[J].食品工业科技, 2019, 40(8): 292-296; 303.DOI:10.13386/j.issn1002-0306.2019.08.049.