随着我国经济的快速发展,羊肉消费量显著提高。羊肉富含水分、蛋白质、脂肪、矿物质以及维生素等营养成分。羊肉中脂肪以及胆固醇含量显著低于猪肉,是不饱和脂肪酸的良好来源[1]。同时羊肉的多汁性以及嫩度已成为现代消费者选择羊肉的主要原因[2]。肉在食用前通常需要煮熟,因此了解煮熟过程中肉质的变化非常重要。烹煮羊肉的过程中,高温促使蛋白质变性,从而影响营养和口感风味。Combes[3]、董晗[4]及王兆明[5]等研究不同蒸煮温度下兔肉嫩度的变化发现,蒸煮温度升高导致兔肉品质下降。吴利芬等[6]在研究加热温度和水分含量对猪肉品质的影响时发现,加热温度越高、水分含量越低,猪肉硬度越大。Roldán等[7]研究温度对低温真空蒸煮羊肉品质的影响,结果表明温度越高羊肉品质越差,在扫描电子显微镜(scanning electron microscope,SEM)图像中观察到60 ℃时结缔组织造粒、70 ℃时出现凝胶化。目前,对羊肉的研究主要集中在风味和贮藏品质等[8-9]方面,而羊肉在加热过程中所发生的一系列变化并未详细阐明。本实验以苏州湖羊为研究对象,分析不同蒸煮温度对羊肉蒸煮损失率、pH值、色泽、质构、蛋白降解状况、脂肪氧化及微观结构的影响,旨在进一步阐明蒸煮温度对羊肉肌原纤维蛋白特性的影响。
1 材料与方法
1.1 材料与试剂
8 月龄湖羊(公羊)后腿肉 苏州太湖东山湖羊产业发展有限公司。
磷酸盐缓冲溶液(pH 7.0) 赛默飞世尔科技公司;10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶超快速配制试剂盒上海碧云天生物技术有限公司;体积分数25%戊二醛、0.02 mol/L硫代巴比妥酸(thiobarbituric acid,TBA)上海源叶生物科技有限公司;考马斯亮蓝染色溶液、0.1%乙二胺四乙酸(ehylene diamine tetraacetic acid,EDTA)、7.5%三氯乙酸(trichloroacetic acid,TCA)生工生物工程(上海)股份有限公司。
1.2 仪器与设备
HH-ZK1单孔数显水浴锅 南京科尔仪器设备有限公司;Ultra TurraxT25 BASIS高速匀浆机 德国IKA公司;Infinite 200 PRO多功能酶标仪 瑞士Tecan公司;Sorvall ST16R高速冷冻离心机 美国赛默飞世尔科技公司;XL-30环境扫描电子显微镜 荷兰皇家飞利浦公司;TMS-PRO食品质构仪 美国FTC公司;SC-80C全自动色差计 北京康光光学仪器有限公司;Gel Doc XR凝胶成像系统 美国Bio-Rad公司。
1.3 方法
1.3.1 样品前处理
使用前将羊后腿肉于4 ℃解冻24 h,去除可见结缔组织、脂肪和筋膜,切成长×宽×高为50 mm×50 mm×20 mm的肉块并装入蒸煮袋中。样品分别浸入温度(T+2) ℃(T为中心温度)的水浴锅中进行加热,使用插入式温度计测定肉样中心温度,当肉样中心温度分别达到50、60、70、80、90 ℃时,立即浸入冰水中降温至中心温度20 ℃。每个处理组3 个平行。
1.3.2 蒸煮损失率测定
将样品修整后使用滤纸擦干表面水分,称质量,然后将样品按1.3.1节方法处理,取出处理后的样品用滤纸擦干表面水分并记录质量。根据式(1)计算蒸煮损失率。
式中:m1为蒸煮前质量/g;m2为蒸煮后质量/g。
1.3.3 pH值测定
称取2.0 g样品切碎后置于装有20 mL 4 ℃蒸馏水的50 mL离心管中,经匀浆机高速(10 000 r/min)匀浆30 s后静置30 min。pH计经过调零后置于样品中,待数值稳定后记录pH值。
1.3.4 质构特性测定
将样品沿肌纤维方向切成10 mm×10 mm×10 mm的小方块,平行测定3 次。参数如下:圆柱形P/50A探头,感应源25 N,压头直径41 mm,测试速率120 mm/min,触发力0.8 N,压缩比50%,停留时间5 s。
1.3.5 色泽测定
肉样切成长×宽×高为5 cm×5 cm×1 cm的肉块,使用色差计进行测定。测定前使用标准白色样品板及黑色样品板调零,然后测定样品红度值(a*)、黄度值(b*)及亮度值(L*),每个样品测定3 次,结果取平均值。
1.3.6 肌原纤维蛋白的提取
参考Wu Mangang等[10]的方法并稍作修改。称取2.0 g肉切碎放入50 mL离心管中,加入10 倍体积的4 ℃磷酸盐缓冲溶液(pH 7.0)匀浆2 次,每次15 s,间歇30 s,2 000×g离心20 min,弃上清液。重复上述步骤,共离心3 次。用0.1 mol/L NaCl溶液洗涤3 次,相同条件下再次离心,沉淀即为肌原纤维蛋白。
1.3.7 肌原纤维蛋白的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析
将6 mg/mL肌原纤维蛋白样品与2×上样缓冲液以体积比1∶1混匀,于100 ℃下水浴10 min。采用4%浓缩胶、15%分离胶,上样量为15 μL。浓缩胶电压90 V、电泳时间30 min,分离胶电压120 V、电泳时间60 min。电泳结束后,取下胶使用考马斯亮蓝染色溶液进行染色、摇床脱色,拍照成像。
1.3.8 硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARs)值测定
参考李梦琪等[11]的方法并稍作修改。取5.0 g肉样切碎后置于蓝帽瓶中并加入30 mL 7.5% TCA溶液(含0.1% EDTA),7 000 r/min高速匀浆2 min,双层滤纸抽滤2 次;取5 mL滤液加入5 mL 0.02 mol/L TBA溶液,90 ℃水浴40 min;冷却后2 000×g离心5 min,取上清液并加入5 mL氯仿摇匀,静置后取上清液分别于532、600 nm波长处测定吸光度。结果以每千克肉样中所含丙二醛质量表示,TBARs值按式(2)计算。
式中:A532 nm为样品在532 nm波长处吸光度;A600 nm为样品在600 nm波长处吸光度;m为样品质量/g。
1.3.9 SEM观察肌原纤维蛋白微观结构
羊肉蒸煮后沿肌纤维方向切成长×宽×高为1 cm×1 cm×3 cm的条状,将切好的样品置于-196 ℃液氮中迅速冷冻。冷冻后垂直于肌纤维方向迅速切成厚5 mm的片状,置于2.5%戊二醛溶液(由0.1 mol/L磷酸盐缓冲液配制)中,4 ℃下固定3 d。固定完成后使用0.1 mol/L磷酸盐缓冲液清洗3 次,每次15 min,用体积分数30%、50%、70%、80%、90%、95%乙醇、无水乙醇、无水乙醇(含无水硫酸钠)逐级脱水,每次15 min,干燥、喷金处理。
1.4 数据分析
采用Excel软件统计数据;采用SPSS 16.0软件进行结果统计分析,采用Duncan’s新复极差法进行多重比较,在0.05水平上进行显著检验(P<0.05);使用Origin 18.5软件进行绘图。
2 结果与分析
2.1 蒸煮温度对羊肉蒸煮损失率的影响
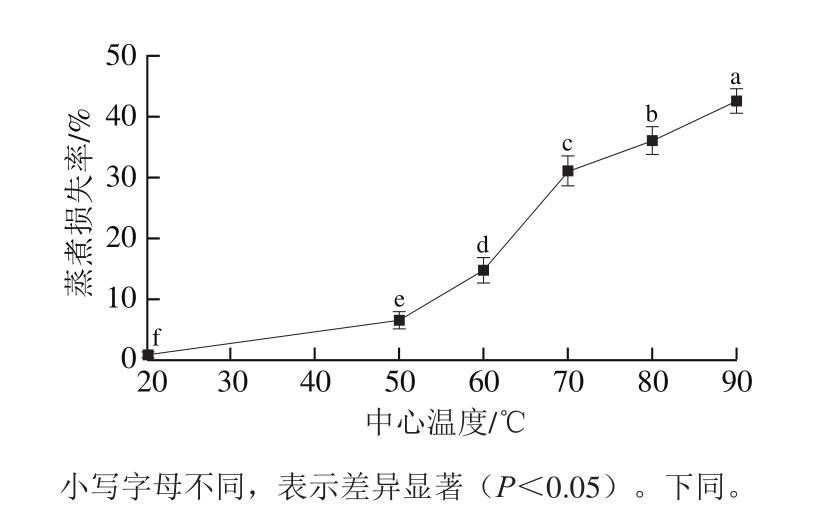
图1 蒸煮温度对羊肉蒸煮损失率的影响
Fig.1 Influence of cooking temperature on cooking loss rate of mutton
加热导致羊肉中水分含量降低汁液流失和体积变小。系水力是影响肉品多汁性以及嫩度的重要因素,主要通过蒸煮损失率来体现。蒸煮过程中羊肉汁液大量损失,并以温度和时间为依赖因素[12]。由图1可知,随着中心温度的升高,羊肉的蒸煮损失率显著增大。中心温度20 ℃时,羊肉的蒸煮损失率最小(0.90%),之后随中心温度的升高不断增大,中心温度90 ℃时达到最大(41.47%)。这与Vaudagna等[13]的研究结果一致,即低温真空蒸煮过程中,牛肉的蒸煮损失率在45~80 ℃范围内随温度的升高而增大,80 ℃后蒸煮损失率逐渐减小。肉品在热处理过程中的汁液流失现象与肌原纤维蛋白变性有关[14]。研究发现,温度低于60 ℃的肉类汁液流失主要与热变性肌浆蛋白等物质随自由水分流出以及胶原蛋白收缩有关[15]。温度高于60 ℃的汁液流失一部分是由于肌动蛋白、肌球蛋白变性,另一部分是由于胶原蛋白交联度降低形成明胶析出所致[16-17]。
2.2 蒸煮温度对羊肉pH值的影响

图2 蒸煮温度对羊肉pH值的影响
Fig.2 Influence of cooking temperature on pH value of mutton
由图2可知,随着中心温度的升高,羊肉pH值整体呈上升趋势。在50~60 ℃期间,pH值呈下降趋势,随后在60~90 ℃呈上升趋势。pH值与肉中水分含量相关,在蒸煮过程中水分流失会带走一部分乳酸,可能会对羊肉pH值造成影响[18]。加热过程中羊肉pH值的增大可能是由于加热导致蛋白变性引起酸性基团减少,也可能是由于肌肉中的水分被蛋白束缚住[19-20]。50~60 ℃期间pH值下降可能与脂肪水解形成脂肪酸有关。
2.3 蒸煮温度对羊肉质构的影响
表1 蒸煮温度对羊肉质构的影响( ±s,n=3)
±s,n=3)
Table 1 Influence of cooking temperature on texture of mutton (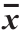 ±s, n= 3)
±s, n= 3)
注:同列小写字母不同,表示差异显著(P<0.05)。
中心温度/℃ 硬度/N 黏附性/mJ 内聚力 弹性/mm 胶黏性/N 咀嚼性/mJ 20 50.63±5.58d 0.74±0.09b 0.17±0.03d 1.69±0.03c 7.10±2.41d 14.26±3.33d 50 63.90±6.23cd 0.75±0.01b 0.30±0.03c 1.73±0.07c 19.37±3.04c 33.92±6.33d 60 82.90±9.72 bc 0.94±0.08a 0.33±0.01bc 2.60±0.33b 30.10±5.09bc71.39±10.10c 70 88.60±4.30 b 0.96±0.11a 0.37±0.02b 2.33±0.19b 31.83±4.05b 76.29±12.25c 80 126.57±19.37 a0.69±0.04bc 0.47±0.01a 3.30±0.37a 59.53±8.92a194.55±17.20a 90 84.07±10.41bc 0.54±0.06c 0.45±0.01a 3.39±0.06a 37.50±4.53b127.17±15.43b
质构特性是评价肉品品质尤其是嫩度的重要指标[21]。硬度是肌肉保持形状的结合力,弹性是肌肉经外力作用后的复原能力,内聚力是肌肉抵抗咀嚼受损保证其完整性的能力,咀嚼性则是上述三者的综合表现[22]。由表1可知,羊肉硬度随中心温度的升高呈现先升高后下降的趋势,在80 ℃时达到最大(P<0.05)。羊肉弹性随着中心温度的升高呈现上升的趋势。黏附性、内聚力、胶黏性和咀嚼性的变化趋势和硬度相似。影响肉品质构特性的因素很多,但主要因素为水分含量、蛋白质组分、肌纤维特性和温度[12]。中心温度低于80 ℃时,咀嚼性增大的原因可能是由于结缔组织和肌原纤维蛋白变性增加了胶原蛋白含量以及缩小了肌纤维空隙[23]。当中心温度超过80 ℃后,结缔组织降解使肌肉组织变得松散,硬度下降[23]。
2.4 蒸煮温度对羊肉脂肪氧化的影响
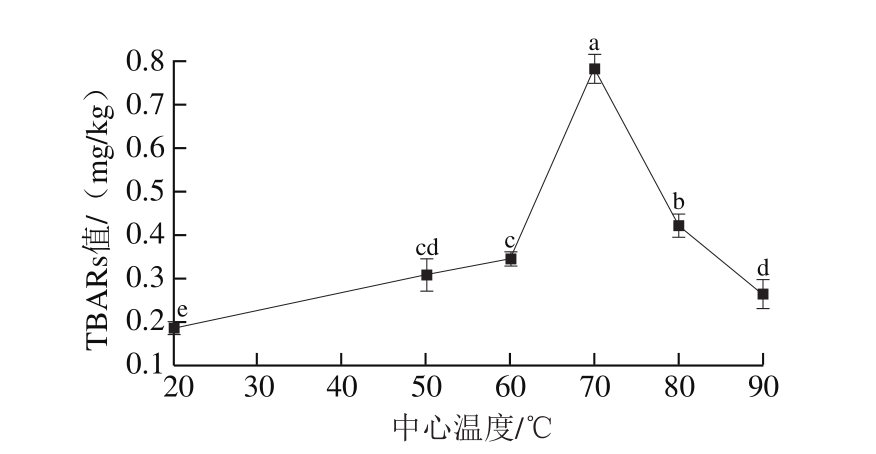
图3 蒸煮温度对羊肉TBARs值的影响
Fig.3 Effect of cooking temperature on TBARs value of mutton
TBARs值作为衡量脂质氧化的标准之一,通过量化脂肪氧化次级产物丙二醛的含量来检测肉类脂质氧化程度[20]。由图3可知,中心温度低于70 ℃时,TBARs值呈上升趋势,当中心温度高于70 ℃时,TBARs值呈下降趋势。李梦琪等[11]研究表明,加热导致真空低温烹饪鸡胸肉TBARs值增加,且在65~85 ℃范围内随加热温度的升高TBARs值呈下降趋势,这可能是由于丙二醛与羊肉中蛋白质、氨基酸等含氨基化合物作用导致丙二醛含量下降。
2.5 蒸煮温度对羊肉色泽的影响

图4 蒸煮温度对羊肉色泽的影响
Fig.4 Influence of cooking temperature on color of mutton
肉色是影响消费者食欲的重要因素,温度会影响肉色的变化。羊肉色泽主要受肌红蛋白的影响。由图4可知,随着中心温度的上升L*整体呈上升趋势,70 ℃时达到最大。a*整体呈下降趋势,b*整体呈上升趋势且在60 ℃最大。这可能是由于随着中心温度的升高,羊肉蛋白变性,蒸煮损失率增大,汁液流失增大,水分聚集在肉样表面,光照反射力增强,L*增大[22]。随着中心温度的升高肌肉中氧合肌红蛋白中Fe2+被氧化成Fe3+,形成使肉色变成褐色的高铁肌红蛋白,使得a*下降、b*整体上升[27]。
2.6 蒸煮温度对肌原纤维蛋白的影响
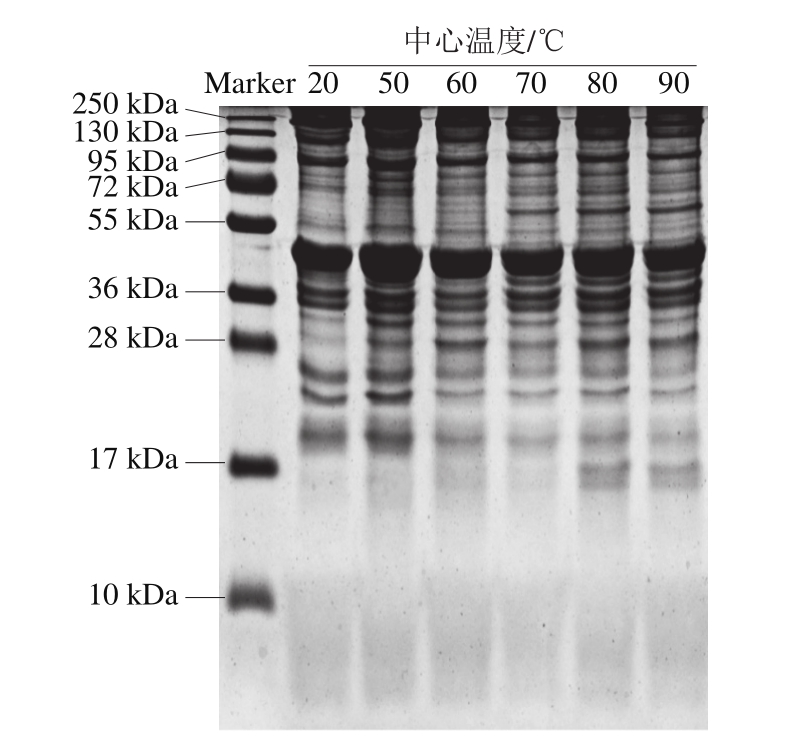
图5 不同蒸煮温度下的羊肉肌原纤维蛋白SDS-PAGE图
Fig.5 SDS-PAGE of mutton myofibrillar proteins at different cooking temperatures
通过SDS-PAGE图可以观察不同蒸煮温度下羊肉肌原纤维蛋白的变化。由图5可知,随着中心温度的升高,分子质量36~130 kDa的部分蛋白发生降解,并产生了新的小分子肽。中心温度70~90 ℃分子质量55~72 kDa、80~90 ℃分子质量10~17 kDa均出现了新的肽片段。同时,在250 kDa处出现蛋白条带聚集的现象,这可能是由蛋白质氧化与脂质氧化和/或肌红蛋白氧化结合所致[24-25]。
2.7 蒸煮温度对羊肉微观结构的影响
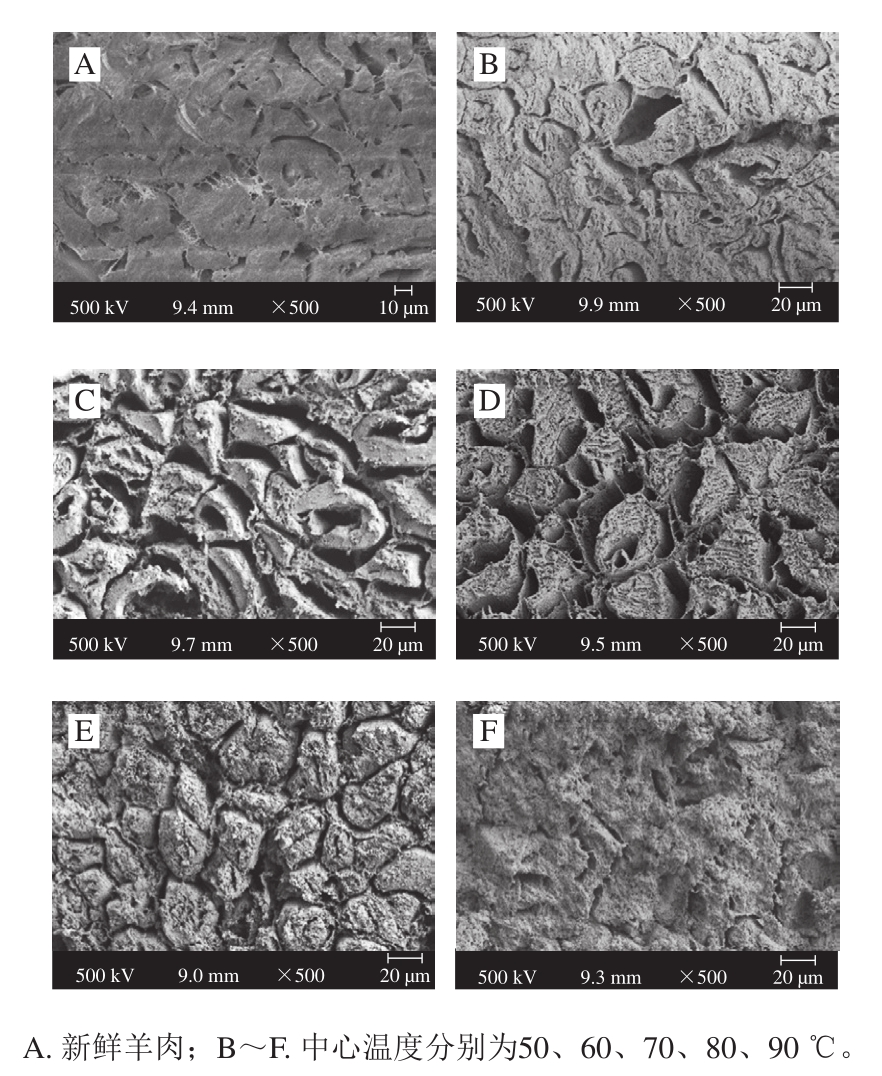
图6 蒸煮温度对羊肉微观结构的影响
Fig.6 Influence of cooking temperature on microstructure of mutton
不同中心温度对羊肉微观结构的影响程度不同。由图6可知,新鲜羊肉肌纤维结构完整,排列整齐。随着中心温度的升高,肌纤维间隙逐渐增大,70 ℃时间隙最大,随后间隙逐渐缩小。随着内部温度升高,纤维排列紧凑主要归因于水分流失、细胞膜破坏、纤维横向收缩、凝胶形成以及结缔组织收缩[26]。除了明显的间隙变化外,结缔组织的变化也尤为明显。中心温度60 ℃后,肌纤维表面出现颗粒物质,可能是由肌内膜和肌膜结构开始破裂引起。随着温度升高,造粒和崩解现象加剧。90 ℃时颗粒填充于肌肉纤维之间和肌肉纤维束之间[28]。Roldán等[7]发现随着烹饪温度的升高和时间的延长,结缔组织会发生严重的变性进而形成凝胶,变性凝胶和其他微粒物质填补了空隙,导致肌肉紧绷。Qi Jun[12]和Benjakul[29]等研究发现,一些残留的不溶性胶原蛋白会挤压热变性肌原纤维,使肌肉纤维间隙减小,光线照射时反射光增加,导致肉色更加明亮,与L*结果基本相似。
3 结 论
不同蒸煮温度下羊肉蛋白的相关特性发生了显著变化:蒸煮损失率随着羊肉中心温度的升高显著增大(P<0.05);TBARs值、pH值、色泽、质构特性以及微观结构均随中心温度的增加而发生变化,造成这些变化最主要的原因可能是肌原纤维蛋白的变化。肌原纤维蛋白作为肌肉中的主要结构蛋白,能够通过毛细作用保持肉中水分。当肌肉被加热时,蛋白变性并释放出被包裹的汁液,影响熟肉的色泽。结缔组织的增溶作用和肌原纤维蛋白的热变性共同改善了肉的嫩度。脂肪氧化产物可以直接或间接与蛋白质发生反应,如脂肪氧化产物氢过氧化物和醛类可以与赖氨酸反应生成吡咯衍生物,脂质氧化产物与氨基酸残基反应所生成的产物会引起蛋白质交联。由于蛋白质的交联与聚集会对随后的蛋白质消化率产生负面影响,因此进一步研究蛋白质的变化将是很有意义的。
[1]OBERT C C, PAYAM V, VOSTER M, et al.Nutritional enhancement of sheep meat fatty acid profile for human health and wellbeing[J].Food Research International, 2018, 104: 25-38.DOI:10.1016/j.foodres.2017.05.005.
[2]ERIN L V B, CHARLES S F, DONNA N, et al.Marine ω-3 polyunsaturated fatty acid and fish intake after colon cancer diagnosis and survival: CALGB 89803 (Alliance)[J].Cancer Epidemiology,Biomarkers and Prevention, 2018, 27(4): 438-445.DOI:10.1158/1055-9965.EPI-17-0689.
[3]COMBES S, LEPETIT J, DARCHE B, et al.Effect of cooking temperature and cooking time on Warner-Bratzler tenderness measurement and collagen content in rabbit meat[J].Meat Science,2004, 66(1): 91-96.DOI:10.1016/S0309-1740(03)00019-6.
[4]董晗, 张牧焓, 诸永志, 等.不同加热温度对兔肉肉质的影响[J].江西农业学报, 2012, 24(5): 167-169.DOI:10.3969/j.issn.1001-8581.2012.05.052.
[5]王兆明, 贺稚非, 余力, 等.加热后兔肉中心温度的变化对其品质特性的影响[J].食品科学, 2015, 36(19): 67-71.DOI:10.7506/spkx1002-6630-201519012.
[6]吴利芬, 张立彦, 汪媛, 等.加热温度和含水量对猪肉及其蛋白质特性的影响[J].肉类研究, 2018, 32(10): 12-18.DOI:10.7506/rlyj1001-8123-201810003.
[7]ROLDÁN M, ANTEQUERA T, MARTÍN A, et al.Effect of different temperature-time combinations on physicochemical, microbiological,textural and structural features of sous-vide cooked lamb loins[J].Meat Science, 2013, 93(3): 572-578.DOI:10.1016/j.meatsci.2012.11.014.
[8]ARSHAD M S, SOHAIB M, AHMAD R S, et al.Ruminant meat flavor influenced by different factors with special reference to fatty acids[J].Lipids in Health and Disease, 2018, 17(1): 1-13.DOI:10.1186/s12944-018-0860-z.
[9]MUELA E, MONGE P, SAÑUDO C, et al.Sensory quality of lamb following long-term frozen storage[J].Meat Science, 2016, 114: 32-37.DOI:10.1016/j.meatsci.2015.12.001.
[10]WU Mangang, XIONG YoulingL., CHEN Jie.Rheology and microstructure of myofibrillar protein-plant lipid composite gels:effect of emulsion droplet size and membrane type[J].Journal of Food Engineering, 2011, 106(4): 318-324.DOI:10.1016/j.jfoodeng.2011.05.022.
[11]李梦琪, 孙思远, 刘敏, 等.加热温度和时间对真空低温烹饪鸡胸肉脂肪与蛋白质氧化的影响[J].肉类研究, 2018, 32(10): 6-11.DOI:10.7506/rlyj1001-8123-201810002.
[12]QI Jun, LI Xiao, ZHANG Wenwen, et al.Influence of stewing time on the texture, ultrastructure and in vitro digestibility of meat from the yellow-feathered chicken breed[J].Animal Science Journal, 2018,89(2): 474-482.DOI:10.1111/asj.12929.
[13]VAUDAGNA S R, SÁNCHEZ G, NEIRA M S, et al.Sous vide cooked beef muscles: effects of low temperature-long time (LT-LT)treatments on their quality characteristics and storage stability[J].International Journal of Food Science and Technology, 2002, 37(4):425-441.DOI:10.1046/j.1365-2621.2002.00581.x.
[14]郑皎皎, 吴琼, 王垚, 等.鲤鱼肌肉蒸制过程中的品质变化[J].食品与发酵工业, 2015, 41(1): 90-95.DOI:10.13995/j.cnki.11-1802/ts.201501018.
[15]田旭, 何航, 揭晓蝶, 等.不同煮制时间对猪肉品质及营养成分的影响[J].肉类工业, 2018(6): 25-29.
[16]KIM K H, KIM Y S, LEE Y K, et al.Postmortem muscle glycolysis and meat quality characteristics of intact male Korean native (Hanwoo)cattle[J].Meat Science, 2000, 55(1): 47-52.DOI:10.1016/S0309-1740(99)00124-2.
[17]KONDJOYAN A, KOHLER A, REALINI C E, et al.Towards models for the prediction of beef meat quality during cooking[J].Meat Science, 2014, 97(3): 323-331.DOI:10.1016/j.meatsci.2013.07.032.
[18]计红芳, 张令文, 王方, 等.加热温度对鹅肉理化性质、质构与微观结构的影响[J].食品与发酵工业, 2017, 43(3): 89-93.DOI:10.13995/j.cnki.11-1802/ts.201703016.
[19]SILVA J A, PATARATA L, MARTINS C.Influence of ultimate pH on bovine meat tenderness during ageing[J].Meat Science, 1999,52(4): 453-459.DOI:10.1016/S0309-1740(99)00029-7.
[20]王海超, 张德权, 曹立创, 等.质量等级对白羽肉鸡肌肉质构特性的影响[J].食品科技, 2018, 43(4): 102-108.
[21]章海风, 周晓燕, 钤莉妍, 等.煮制时间对驴肉不同部位食用品质的影响[J].美食研究, 2018, 35(4): 37-40.DOI:10.3969/j.issn.1009-4717.2018.04.008.
[22]LEWIS G J, PURSLOW P P.The strength and stiffness of perimysial connective tissue isolated from cooked beef muscle[J].Meat Science,1989, 26(4): 255-269.DOI:10.1016/0309-1740(89)90011-9.
[23]TAMILMANI P, PANDEY M C.Thermal analysis of meat and meat products[J].Journal of Thermal Analysis and Calorimetry, 2016,123(3): 1899-1917.DOI:10.1007/s10973-015-4696-8.
[24]PARK D, XIONG YoulingL., ALDERTON A L, et al.Biochemical changes in myofibrillar protein isolates exposed to three oxidizing systems[J].Journal of Agricultural and Food Chemistry, 54(12): 4445-4451.DOI:10.1021/jf0531813.
[25]RIPOLL G, LOBÓN S, JOY M.Use of visible and near infrared reflectance spectra to predict lipid peroxidation of light lamb meat and discriminate dam’s feeding systems[J].Meat Science, 2018, 143: 24-29.DOI:10.1016/j.meatsci.2018.04.006.
[26]CHRISTENSEN L, ERTBJERG P, AASLYNG M D, et al.Effect of prolonged heat treatment from 48 ℃ to 63 ℃ on toughness, cooking loss and color of pork[J].Meat Science, 2011, 88(2): 280-285.DOI:10.1016/j.meatsci.2010.12.035.
[27]GARCÍA-SEGOVIA P, ANDRÉS-BELLO A, MARTÍNEZ-MONZÓ J.Effect of cooking method on mechanical properties, color and structure of beef muscle (M.pectoralis)[J].Journal of Food Engineering, 2007, 80(3):813-821.DOI:10.1016/j.jfoodeng.2006.07.010.
[28]VASANTHI C, VENKATARAMANUJAM V, DUSHYANTHAN K.Effect of cooking temperature and time on the physico-chemical,histological and sensory properties of female carabeef (buffalo)meat[J].Meat Science, 2007, 76(2): 274-280.DOI:10.1016/j.meatsci.2006.11.018.
[29]BENJAKUL S, VISESSANGUAN W, KIJROONGROJANA K,et al.Effect of heating on physical properties and microstructure of black tiger shrimp (Penaeus monodon) and white shrimp(Penaeus vannamei) meats[J].International Journal of Food Science and Technology, 2008, 43(6): 1066-1072.DOI:10.1111/j.1365-2621.2007.01566.x.