卤煮是我国一种历史悠久的传统肉制品加工方法,其是将原料肉经简单腌制后,在添加有香辛料的卤汤中进行长时间煮制。牛肉经卤煮后能形成特有的醇厚口感和风味,但在长时间沸汤(>98 ℃)环境中,牛肉内部易发生以还原糖、氨基酸、肌酐和肌酸为底物的美拉德反应,生成一类可以致畸、致癌、致突变的有机化合物——杂环胺[1-2]。杂环胺是一类多环芳香族化合物,根据其结构特点可以分为氨基咪唑类和氨基咔啉类两大类,最先在煎炸、烘烤等高温加工肉类食品中发现。大量研究表明,通过食品摄入的杂环胺容易引起人体胃肠道疾病和多种肿瘤的发生[3-4]。因此,杂环胺的生成和控制也是肉品科技工作者关注的热点。
对于肉制品加工过程中杂环胺产生的控制,目前添加香辛料是主流手段之一。姚瑶等[5]研究发现,添加香叶等香辛料,卤煮牛肉中β-咔啉、γ-咔啉和2-氨基-3-甲基咪唑[4,5-f]喹啉(2-amino-3-methylimidazo[4,5-f]quinoline,IQ)型杂环胺含量显著降低。申霄婵等[6]在酱猪肉中添加7 种不同香辛料,结果发现,添加0.05%和0.10%的丁香可以显著抑制杂环胺总量。李进等[7]发现,黑胡椒等香辛料对卤鸡肉中β-咔啉类杂环胺形成有抑制作用,且抑制能力与羟自由基清除能力有紧密联系。在肉制品加工过程中,美拉德反应形成的吡啶和吡嗪自由基被认为是杂环胺形成的关键中间产物,添加外源抗氧化剂或含有抗氧化成分的物质可以通过清除自由基反应,减少杂环胺的生成[8-9]。辣椒与生姜作为肉制品加工过程中常见的香辛料,不仅可以调香,还可以抑制脂质氧化[10]、丙烯酰胺生成[11]等多种不利的化学反应,其抑制功能可能与其含有的活性组分有关。
卤煮牛肉中,辣椒和生姜是常用香辛料,而辣椒和生姜及其所含的主要活性成分对杂环胺的影响尚不明确。本实验研究辣椒和生姜对卤煮牛肉杂环胺生成的影响情况,并对辣椒、生姜中的活性组分辣椒素和6-姜酚在其功效发挥中的作用进行探讨,以期为卤煮肉制品安全加工提供科学依据。
1 材料与方法
1.1 材料与试剂
新鲜牛后腿肉、干红辣椒(产地贵州大方)、生姜(产地云南玉溪)、食盐、白砂糖、海鲜酱油 合肥家乐福超市。
三氯乙酸、正己烷、浓硫酸、无水乙醇、盐酸、石油醚、乙酸正己酯、氨水、甲苯、香草醛、苦味酸、盐酸胍、乙酸乙酯、2,2'-联氮-双(3-乙基-苯并噻唑啉-6-磺酸)二铵盐(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)ammonium salt,ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、葡萄糖、肌酐、肌酸(以上试剂均为分析纯)、辣椒素、6-姜酚、碘(纯度均大于99%) 国药集团化学试剂有限公司;硅藻土 阿拉丁试剂(上海)有限公司;杂环胺标品(纯度≥99%):2-氨基-1-甲基-6-苯基咪唑[4,5-b]吡啶(2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine,PhIP)、3-氨基-1-甲基-5H-吡啶并[4,3-b]吲哚(3-amino-1-methyl-5H-pyrido[4,3-b]indole,Trp-P-2)、2-氨基-3,4,8-三甲基咪唑并[4,5-f]喹恶啉(2-amino-3,4,8-trimethylimidazo[4,5-f]quinoxaline,DiMeIQx)、3-氨基-1,4-二甲基-5H-吡啶并[4,3-b]吲哚(3-amino-1,4-dimethyl-5H-pyrido[4,3-b]indole,Trp-P-1)、2-氨基-3,4-二甲基咪唑并[4,5-f]喹啉(2-amino-3,4-dimethylimidazo[4,5-f]quinoline,MeIQ)、2-氨基-3,8-二甲基-咪唑[4,5-f]喹恶啉(2-amino-3,8-dimethylimidazo[4,5-f]quinoxaline,MeIQx)、1-甲基-9H-吡啶[3,4-b]吲哚(1-methyl-9H-pyrido[3,4-b]indole,Harman)、2-氨基-9H-吡啶[2,3-b]吲哚(2-amino-9H-pyrido[2,3-b]indole,AaC)、IQ 加拿大TRC公司。
1.2 仪器与设备
Thermo QE 高分辨质谱仪 赛默飞世尔科技(中国)有限公司;QTrap 6500质谱仪 美国AB Sciex公司;P2紫外-可见分光光度计 上海向帆仪器有限公司;1100高效液相色谱仪 美国Agilent公司;S-1-150S高速冷冻离心机 巩义市宏华仪器设备工贸有限公司;Hei-VAP旋转蒸发仪 德国Heidolph公司;800Y皇代家用小型粉碎机 曲阜顺阳机械有限公司。
1.3 方法
1.3.1 样品制备
将新鲜冷冻牛肉放在冷水中解冻,解冻后将牛肉分割成5 cm×1 cm×5 mm大小的肉条,剔除脂肪组织和筋膜,待用。
添加香辛料组:干红辣椒直接用家用小型粉碎机粉碎后过20 目筛,待用。生姜粉碎后用真空冷冻干燥机真空干燥后待用。每组添加牛肉300 g、食盐6 g、白砂糖6 g、酱油5 mL,分别添加碾碎的辣椒和生姜粉末4.5 g,置于煮锅中,加入1 000 mL蒸馏水,用600 W功率卤煮2 h,每隔0.5 h补充适量蒸馏水,使煮锅内水位始终保持与初始水位相同。卤煮完成后将牛肉捞出,沥干水分后进行各项指标测定。
添加活性组分组:每组添加牛肉300 g、食盐6 g、白砂糖6 g、酱油5 mL,分别添加5 mg 6-姜酚和辣椒素,其余条件与添加香辛料组一致。
对照组:不添加香辛料及活性组分,其余条件均与实验组相同。
1.3.2 指标测定
1.3.2.1 还原糖含量测定
参考陈炎等[12]的方法稍作修改。还原糖提取方法:准确称取2.00 g肉泥,放入50 mL烧杯中,加入20 mL蒸馏水,并用均质机将样品均质,搅匀;静置1 min后置于50 ℃水浴锅中温水浴0.5 h,水浴结束后将悬浊液倒入50 mL圆底离心管中进行高速离心(4 ℃、7 000 r/min、3 min);离心结束后将上清液倒入100 mL容量瓶中,用蒸馏水定容后于540 nm波长处测定吸光度。根据还原糖标准曲线(y=0.950x-0.258)计算含量。
1.3.2.2 肌酐、肌酸含量测定
参考杨潇[13]的方法。取300 mg碎肉于试管中,加入2 mL 0.6 mol/L高氯酸,充分振荡并于冰水中浸提15 min。4 ℃、10 000 r/min高速离心5 min后,取上清液800 μL于离心管中待测。
肌酐含量测定:在8 0 0 μ L上清液中加入40 μL 4 g/100 mL溴百里香酚蓝,混匀后加入一定量的0.8 mol/L KOH溶液,使得溶液pH值保持在6~8。将溶液4 ℃、10 000 r/min高速离心5 min后,取上清液于2.0 mL离心管中,添加0.75 mL碱性苦味酸盐反应液充分振荡混匀,于室温下反应45 min,最后于490 nm波长处测定吸光度。根据肌酐标准曲线(y=0.305x-0.106)计算样品待测液中肌酐质量浓度(mg/100 mL)。
肌酸含量测定:取300 μL上清液加入40 μL碘反应液,使颜色稳定2 min以上。加入0.6 mL氯仿后充分混匀,4 ℃、4 000 r/min高速离心5 min后,取0.1 mL上清液加入0.7 mL超纯水充分振荡混匀。取0.7 mL稀释液,加入0.15 mL饱和苦味酸溶液,沸水孵育1 h。待冷却至室温,加入0.6 mL磷酸盐缓冲液(pH 10.0),于室温下反应45 min,最后于490 nm波长处测定吸光度。根据肌酸标准曲线(y=0.165x-0.025)计算样品待测液中肌酸质量浓度(mg/100 mL)。
样品中肌酐、肌酸含量按式(1)计算。
式中:X为样品中肌酐或肌酸的含量/(mg/100 g);ρ为根据标准曲线计算得到的样品待测液中肌酐或肌酸质量浓度/(mg/100 mL);V为样品待测液最终定容体积/μL;m为样品质量/mg。
1.3.2.3 杂环胺含量测定
参考Gross等[14]的方法。
色谱条件:色谱柱:TSK-Gel ODS-80TM色谱柱(250 mm×4.6 mm,5 μm),进样量20 μL,柱温30 ℃,流动相A:乙腈;流动相B:0.05 mol/L醋酸铵-醋酸缓冲液。洗脱梯度:0 min,10%流动相B;25 min时,50%流动相B;35 min时,10%流动相B。
杂环胺含量按式(2)计算。
式中:X为样品中杂环胺的含量/(ng/g);ρ为依据标准曲线计算得到的样品待测液中杂环胺质量浓度/(μg/L);V为样品待测液最终定容体积/mL;m为样品质量/g。
1.3.2.4 香辛料中活性组分含量测定
取100 mg生姜和辣椒分别置于2 mL离心管,加入1 500 μL超纯水;涡旋30 s后冰水浴超声15 min并在12 000 r/min下离心15 min,取上清液500 μL,氮气吹干;加入250 μL提取液(体积分数50%甲醇)复溶,冰水浴超声15 min后12 000 r/min离心15 min,取上清液置于2 mL进样瓶待测。
色谱条件与质谱条件参考缪萍等[1 5]的方法稍作改动。色谱柱为Waters UPLC HSS T3色谱柱(2.1 mm×100.0 mm,1.8 μm),柱温箱温度设为40 ℃,自动进样器温度设为4 ℃,进样体积2 μL,流速0.3 mL/min。流动相A:0.1%甲酸水溶液;流动相B:乙腈。洗脱梯度:0~2 min,2%流动相B;2~11 min,2%~98%流动相B;11~13 min,98%流动相B;13~15 min,98%~2%流动相B。
高分辨质谱仪参数设置:通过信息依赖性获取(information-dependent acquisition,IDA)模式进行高分辨质谱数据采集。在IDA模式下,数据采集软件(Xcalibur 4.1,Thermo)依据一级质谱数据和预先设定的标准,自动选择离子并采集其二级质谱数据。每个循环选取3 个强度大于5 000的离子,离子源参数如下:喷雾电压:+3 500/-3 500 V,毛细管温度350 ℃,鞘气压力206.85 kPa,辅助气压力68.95 kPa,碰撞能量:10、30、50 eV。数据采集时按Mass Range进行分段,70~300、290~600、590~1 100,从而扩大二级谱图的采集率。采集获得的数据分别使用本实验室自建的BiotreeDB数据库及MAPS软件进行数据分析。将母离子与二级谱中的子离子组合成离子对,建立多反应监测(multiple reaction monitoring,MRM)数据库,然后再在三重四极杆质谱仪上对所有样品进行MRM数据采集。
AB Sciex QTrap 6500质谱仪参数设置:离子源参数:离子喷雾电压:+5 000/-4 500 V,气帘气压力241.325 kPa,温度500 ℃,离子源气体1压力413.7 kPa,离子源气体2压力413.7 kPa,去簇电压±100 V。
1.3.2.5 DPPH自由基、ABTS阳离子自由基清除率测定
生姜/辣椒水提物的制备:取0.5 g生姜/辣椒粉末于25 mL试管中,加入蒸馏水定容并在沸水浴中提取0.5 h,最后将提取液高速离心(8 000 r/min、5 min、4 ℃),取上清液备用,将上清液稀释至质量浓度0.1、0.2、0.3、0.4、0.5 mg/mL。
6-姜酚/辣椒素水溶液的制备:将6-姜酚与辣椒素分别用蒸馏水配制成质量浓度0.1、0.2、0.3、0.4、0.5 mg/mL的溶液。
DPPH自由基、ABTS阳离子自由基清除率的测定参考屠泽慧[16]、姚瑶[5]等的方法。
DPPH自由基清除率测定:将4 mL不同质量浓度的生姜/辣椒水提物以及6-姜酚/辣椒素水溶液与4 mL 0.1 mmol/L DPPH溶液混合均匀,在暗处静置1 h后,515 nm波长处测定吸光度,记为A样品;将4 mL蒸馏水与4 mL 0.1 mmol/L DPPH溶液混合均匀,相同条件下测定吸光度,记为A对照。DPPH自由基清除率按式(3)计算。
ABTS阳离子自由基清除率测定:将40 μL不同质量浓度的生姜/辣椒水提物以及6-姜酚/辣椒素水溶液与4 mL ABTS溶液混合均匀,暗处反应6 min后在734 nm波长处测定吸光度,记为A样品;将40 μL无水乙醇与4 mL ABTS溶液混合均匀,相同条件下测得吸光度,记为A对照。ABTS阳离子自由基清除率按式(4)计算。
1.4 数据处理
采用Origin 9.0软件进行绘图及统计分析,所有实验均重复3 次,结果以平均值±标准差表示;采用SPSS 19.0软件进行数据显著性分析和相关性分析,P<0.05为有显著性差异或显著相关。
2 结果与分析
2.1 生姜及辣椒对卤煮牛肉中杂环胺生成的影响
表1 添加生姜/辣椒后卤煮牛肉中杂环胺含量(n= 3)
Table 1 Contents of heterocyclic amines in stewed beef with added ginger or chili pepper (n= 3)ng/g

注:同列小写字母不同,表示差异显著(P<0.05);ND. 未检测到。表2同。
组别 PhIP含量MeIQx含量 MeIQ含量 IQ含量 DiMeIQx含量极性杂环胺总量对照组 5.34±0.16a 4.68±0.20a 7.23±0.14a6.27±0.20a 5.52±0.10a29.04±0.64a生姜组 3.24±0.28b 1.05±0.20c 5.19±0.20b 4.59±0.14b 5.01±0.20b19.08±0.03c辣椒组 4.11±0.18b 2.79±0.28b6.54±0.32ab6.48±0.16a 4.29±0.26b24.21±0.27b组别 Trp-p-1含量Trp-p-2含量Harman含量 Aac含量 非极性杂环胺总量 杂环胺总量对照组 4.80±0.16a 0.33±0.04a 1.50±0.02a3.54±0.30a10.17±1.06a39.21±2.01a生姜组 4.65±0.18a ND ND 2.52±0.14b7.17±0.28c26.25±1.02c辣椒组 4.50±0.12a 0.39±0.02a 1.11±0.04b2.97±0.42ab8.97±0.96b33.18±1.33b
由表1可知,与对照组相比,生姜组的极性杂环胺与非极性杂环胺总量显著降低(P<0.05),其中,每种杂环胺含量分别下降39.33%(PhIP)、77.56%(MeIQx)、28.22%(MeIQ)、26.79%(IQ)、9.24%(DiMeIQx)、3.13%(Trp-p-1)、100.00%(Trp-p-2、Harman)、28.81%(Aac)。吕美[17]研究煎烤牛肉饼中的杂环胺含量时发现,添加3%生姜对PHIP的抑制率达到100%,对Aac及Harman的抑制率也分别达到77.27%和77.08%,抑制率的不同可能与生姜的添加量、品种及干基含量有关。与对照组相比,辣椒组的极性杂环胺与非极性杂环胺总量也均显著降低(P<0.05),每种杂环胺含量分别降低23.03%(PhIP)、40.38%(MeIQx)、9.54%(MeIQ)、22.28%(DiMeIQx)、6.25%(Trp-p-1)、26.00%(Harman)、16.10%(Aac),其中IQ、Trp-p-2的含量比对照组稍高,但没有显著变化。杨调调[18]发现在西式熏煮香肠中添加辣椒可以显著抑制Aac的产生,推测是由于辣椒中富含的黄酮类、酰胺类化合物对杂环胺起到了抑制作用。在卤煮牛肉中,目前关于生姜和辣椒中具有抑制杂环胺作用的具体成分尚不明确。
2.2 生姜和辣椒中的天然活性物质
将植物广泛靶标代谢组技术应用于生姜和辣椒成分的检测。首先用高分辨质谱获取样品各组分质谱图,再结合Biotree DB高分辨二级谱库进行精准物质鉴定,最后从质谱图中提取MRM离子对信息,对样本进行特异性建库,再利用三重四极杆质谱MRM技术进行精确定量。
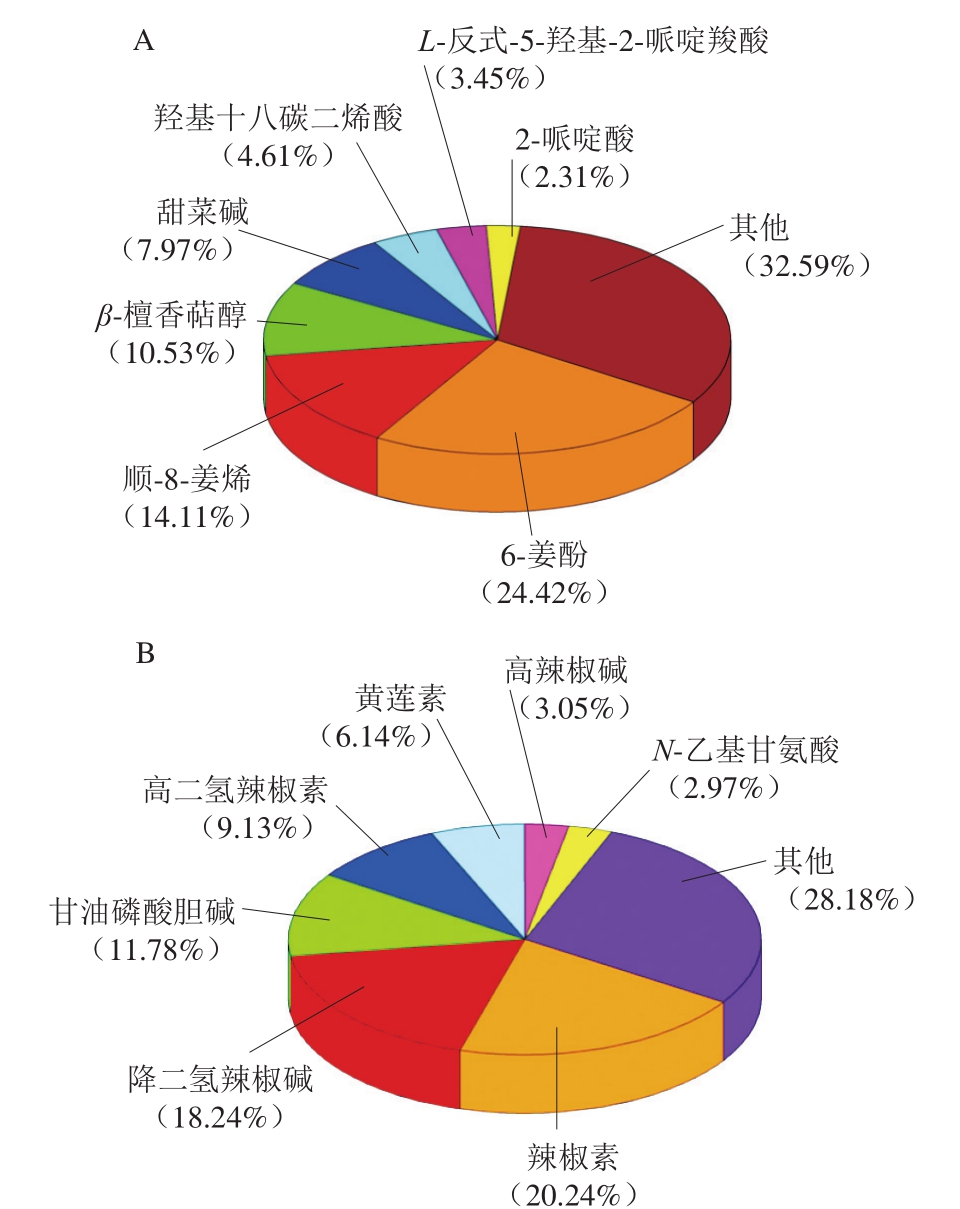
图1 生姜(A)和辣椒(B)中的天然活性物质组成
Fig. 1 Composition of natural bioactive substances in ginger (A) and chili pepper (B)
由图1A可知,在生姜的天然组分当中,含量最多的6-姜酚占比达24.42%,其次为顺-8-姜烯(14.11%)、β-檀香萜醇(10.53%)、甜菜碱(7.97%)等。其中,6-姜酚具有较强的抗氧化作用,其抗氧化能力低于二丁基羟基甲苯,但高于VE[19],这可能与其酚羟基及β-羟基酮的结构有关,6-姜酚的酚羟基可以通过脱氢反应生成半醌自由基,进一步生成联苯酚,由于联苯酚的稳定性较强,可以终断氧化的链式反应,起到抗氧化的目的[20]。由图1B可知,在辣椒的天然组分当中,辣椒素的占比最高(20.24%),其次为降二氢辣椒碱(18.24%)、甘油磷酸胆碱(11.78%)、高二氢辣椒素(9.13%)等。辣椒素是一种黄酮物质,同样具有一定的抗氧化活性。抗氧化性的强弱对杂环胺的抑制有重要作用[21],生姜与辣椒中含量最高的2 种活性物质可能对抑制杂环胺有积极影响。
2.3 添加6-姜酚与辣椒素对卤煮牛肉中杂环胺生成的影响
表2 添加6-姜酚、辣椒素后卤煮牛肉中杂环胺的含量(n= 3)
Table 2 Contents of heterocyclic amines in stewed beef with added 6-gingerol or capsaicin (n= 3)
ng/g
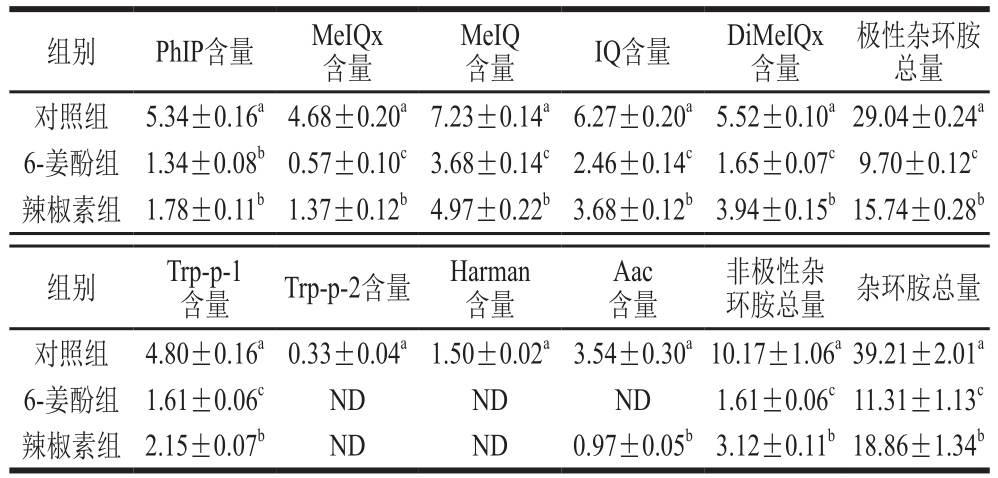
组别 PhIP含量 MeIQx含量MeIQ含量 IQ含量 DiMeIQx含量极性杂环胺总量对照组 5.34±0.16a4.68±0.20a7.23±0.14a6.27±0.20a5.52±0.10a29.04±0.24a 6-姜酚组 1.34±0.08b0.57±0.10c3.68±0.14c2.46±0.14c1.65±0.07c9.70±0.12c辣椒素组 1.78±0.11b1.37±0.12b4.97±0.22b3.68±0.12b3.94±0.15b15.74±0.28b组别 Trp-p-1含量 Trp-p-2含量 Harman含量Aac含量非极性杂环胺总量 杂环胺总量对照组 4.80±0.16a0.33±0.04a1.50±0.02a3.54±0.30a10.17±1.06a39.21±2.01a 6-姜酚组 1.61±0.06c ND ND ND 1.61±0.06c11.31±1.13c辣椒素组 2.15±0.07b ND ND 0.97±0.05b3.12±0.11b18.86±1.34b
由表2可知,分别添加6-姜酚与辣椒素后,卤煮牛肉中的极性杂环胺与非极性杂环胺含量显著降低(P<0.05)。其中,添加6-姜酚后各杂环胺含量分别较对照组下降74.91%(PhIP)、87.82%(MeIQx)、49.10%(MeIQ)、41.31%(IQ)、70.11%(DiMeIQx)、66.46%(Trp-p-1)、100.00%(Trp-p-2、Harman、Aac),添加辣椒素后各杂环胺含量分别较对照组下降66.67%(PhIP)、70.73%(MeIQx)、31.26%(MeIQ)、41.31%(IQ)、28.62%(DiMeIQx)、55.21%(Trp-p-1)、100.00%(Trp-p-2、Harman)、72.60%(Aac)。从抑制效果可以看出,6-姜酚抑制杂环胺的效果更好。
加入6-姜酚后卤煮牛肉中杂环胺含量显著降低,这可能是由于6-姜酚是一种酚类物质,而酚类物质对杂环胺有一定的抑制效果。Sabally等[22]在牛肉饼中添加富含多酚的苹果皮提取物,发现其可以显著降低PhIP和MeIQx含量。Jamali等[23]在牛肉馅饼中添加玫瑰花茶提取物,发现在160、220 ℃条件下对PHIP有很强的抑制效果,原因可能是玫瑰花茶提取物中富含儿茶素等酚类物质。相似地,辣椒素作为一种黄酮类物质,对杂环胺也起到了抑制作用。Zeng Maomao等[24]在烤牛肉饼中添加辣椒素后发现杂环胺含量显著降低,且对牛肉饼的质构没有负面影响。Keskekoglu等[25]在牛肉与鸡肉中添加葡萄籽提取物,发现牛肉与鸡肉中的杂环胺含量分别下降65%与37%。
2.4 生姜和辣椒及其活性组分的抗氧化性分析
研究表明,杂环胺的形成过程中自由基反应起到重要作用,而香辛料中的天然抗氧化活性成分对反应过程中的自由基具有一定的清除作用,从而起到抑制杂环胺形成的作用[8-9]。衡量一个物质的抗氧化性强弱一般可以用DPPH、ABTS阳离子自由基清除率高低来表示[26]。
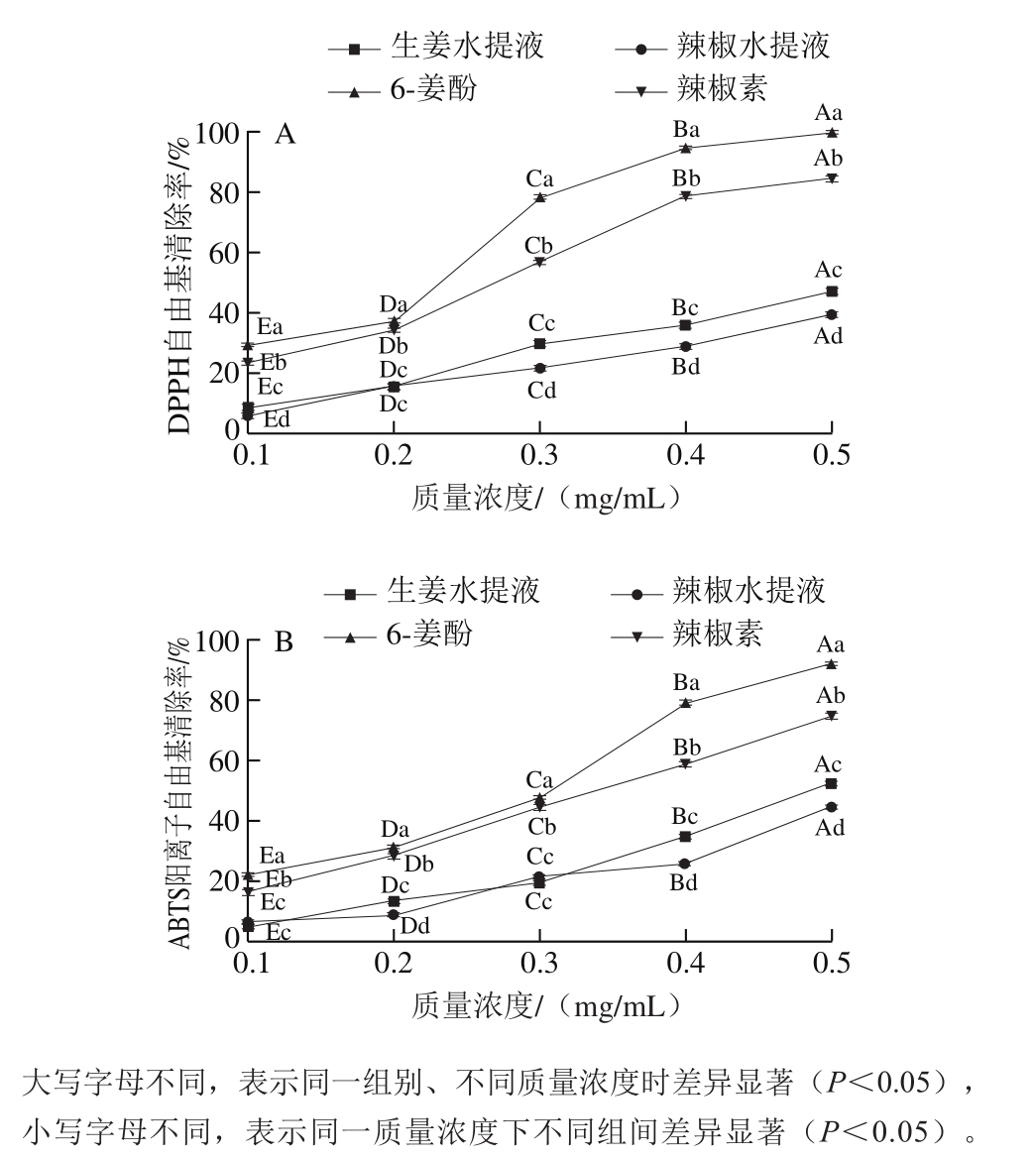
图2 不同香辛料及其活性组分的DPPH(A)、ABTS阳离子自由基清除率(B)
Fig. 2 DPPH (A) and ABTS cation radical scavenging rates (B) of different spices and their bioactive components
由图2可知,随着质量浓度的增加,生姜、辣椒及其天然活性组分6-姜酚和辣椒素的DPPH、ABTS阳离子自由基清除率均呈现上升趋势。其中,6-姜酚组的自由基清除率始终保持最高,0.5 mg/mL时DPPH自由基清除率达99.8%,ABTS阳离子自由基清除率达91.54%。其次为辣椒素组,0.5 mg/mL时,DPPH自由基清除率达84.65%,ABTS阳离子自由基清除率达75.65%。2 种天然活性组分组的自由基清除率均高于生姜组与辣椒组。在0.5 mg/mL时生姜组与辣椒组的DPPH自由基清除率分别为46.79%、39.34%,ABTS阳离子自由基清除率分别为52.24%、44.34%。从自由基清除率的结果可以看出,各组抗氧化性强弱为:6-姜酚组>辣椒素组>生姜组>辣椒组。这一结果与添加香辛料与活性组分后卤煮牛肉杂环胺生成量相符合。
2.5 生姜/辣椒与6-姜酚/辣椒素对杂环胺前体物质含量的影响
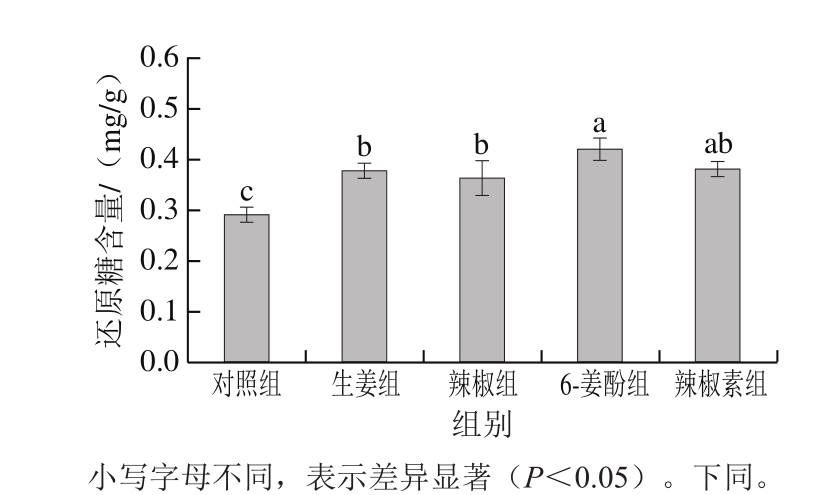
图3 不同香辛料及其活性组分对卤煮牛肉中还原糖含量的影响
Fig. 3 Effects of different spices and their bioactive components on reducing sugar content in stewed beef
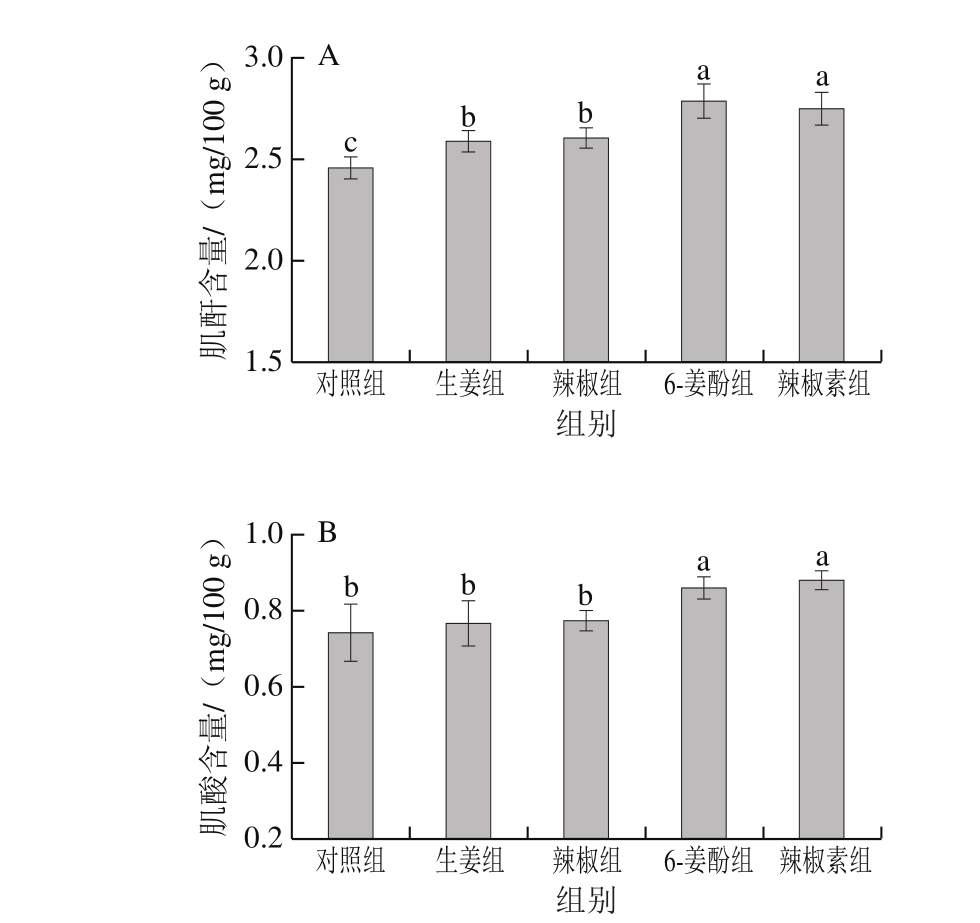
图4 不同香辛料及其活性组分对卤煮牛肉中肌酐(A)和肌酸含量(B)的影响
Fig. 4 Effects of different spices and their bioactive components on creatinine (A) and creatine contents (B) in stewed beef
还原糖、肌酐和肌酸是杂环胺生成的重要前体物质,它们与一些游离氨基酸、二肽在加热过程中通过美拉德反应可以生成IQ等杂环胺[27]。由图3和图4A可知,与对照组相比,实验组的还原糖及肌酐含量显著上升(P<0.05),这可能是由于加入生姜/辣椒和6-姜酚/辣椒素之后,抑制了还原糖及肌酐参与美拉德反应进一步合成杂环胺。由图4B可知,与对照组相比,添加生姜/辣椒组的肌酸含量均无显著变化,而添加6-姜酚/辣椒素组的肌酸含量显著上升(P<0.05),这可能是由于生姜和辣椒的抗氧化活性还不足以影响肌酸含量,而由于6-姜酚/辣椒素具有较强的抗氧化性,清除了肌酸进行次级反应的必要自由基,从而使得肌酸含量相比于对照组显著上升。
2.6 卤煮牛肉中极性/非极性杂环胺与前体物质的相关性分析
为进一步探究添加生姜、辣椒及其活性组分过程中,卤煮牛肉中的杂环胺含量与前体物质之间的关系,对极性杂环胺、非极性杂环胺形成量和还原糖、肌酐、肌酸含量进行相关性分析。
表3 卤煮牛肉中极性/非极性杂环胺与前体物质含量的相关性
Table 3 Correlation between contents of polar/non-polar heterocyclic amines and precursors in stewed beef

注:*. 在0.05水平上(双侧)显著相关。
杂环胺类型 还原糖含量 肌酐含量 肌酸含量极性杂环胺含量 r=-0.933*P=0.021 r=-0.941*P=0.017 r=-0.844 P=0.072非极性杂环胺含量r=-0.838 P=0.076 r=-0.956*P=0.011 r=-0.942*P=0.016
由表3可知,极性杂环胺含量与还原糖、肌酐含量呈显著负相关,非极性杂环胺含量与肌酐、肌酸含量呈显著负相关。根据这一结果,进一步推测加入的香辛料及其活性组分,由于其自由基清除能力,会清除还原糖、肌酐、肌酸等前体物质反应所需的自由基,从而降低了杂环胺含量。
3 讨 论
杂环胺的生成机制一般离不开美拉德反应与自由基反应。美拉德反应中的Strecker降解会产生大量乙烯基-吡啶、乙烯基-吡嗪等物质,这些物质与肌酐、肌酸反应,经过高温热解及环化脱水等步骤会生成杂环胺;美拉德反应的中间产物,如色氨酸-Amadori化合物经过脱水消去等反应容易生成β-咔啉类杂环胺。而一些自由基,如烷基吡啶自由基,容易与肌酐、肌酸反应生成IQ型(喹啉类)杂环胺[28]。目前有研究认为,通过在食品中添加香辛料或其他具有抗氧化作用的物质,如迷迭香提取物、茶叶提取物等,可以清除杂环胺反应所需的自由基或减轻美拉德反应,最终可以起到抑制杂环胺的作用[23,29-30]。在本研究中,6-姜酚与辣椒素2 种多酚化合物不仅具有较强的自由基清除能力,还可以抑制杂环胺的前体物进一步发生反应,如美拉德反应。多酚化合物可以与美拉德反应的中间产物5-羟甲基糠醛和席夫碱上的羰基碳原子进行反应,从而减轻美拉德反应程度[31]。因此,生姜和辣椒对卤煮牛肉的杂环胺生成具有抑制效果可能是由于其含有的酚类化合物具有较强的抗氧化性,既可以清除杂环胺生成所需的自由基,也可以减轻美拉德反应,使得杂环胺的前体物质(还原糖、肌酐、肌酸)难以发生次级反应。
4 结 论
添加生姜和辣椒可以显著降低卤煮牛肉中杂环胺的含量(P<0.05)。生姜和辣椒中含量最高的2 种活性物质6-姜酚与辣椒素均具有较强的抗氧化性,可以清除杂环胺生成过程中所需的自由基,避免杂环胺前体物质(还原糖、肌酐、肌酸)进一步反应,从而对杂环胺的抑制有着积极作用,而抑制效果主要与其抗氧化性强弱有关。本研究为使用这些食材作为烹饪过程中潜在的杂环胺天然抑制剂提供了理论基础。
[1] WARD M H, SINHA R, HEINEMAN E F, et al. Risk of adenocarcinoma of the stomach and esophagus with meat cooking method and doneness preference[J]. International Journal of Cancer, 1997, 71(1): 14-19. DOI:10.1002/(sici)1097-0215(19970328)71:1<14::aid-ijc4>3.0.co;2-6.
[2] HIROSE M, NISHIKAWA A, SHIBUTANI M, et al.Chemoprevention of heterocyclic amine-induced mammary carcinogenesis in rats[J]. Environmental and Molecular Mutagenesis,2002, 39(2/3): 271-278. DOI:10.1002/em.10066.
[3] SAL W. Well-done meat intake, heterocyclic amine exposure,and cancer risk[J]. Nutrition and Cancer, 2009, 61(4): 437-446.DOI:10.1080/01635580802710741.
[4] SUGIMURA T, SATO S. Mutagens-carcinogens in foods[J]. Cancer Research, 1983, 43(Suppl 5): 2415-2421. DOI:10.1146/annurev.nu.06.070186.000435.
[5] 姚瑶, 彭增起, 邵斌, 等. 20 种市售常见香辛料的抗氧化性对酱牛肉中杂环胺含量的影响[J]. 中国农业科学, 2012, 45(20): 4252-4259.DOI:10.3864/j.issn.0578-1752.2012.20.015.
[6] 申霄婵, 李晓, 张羽灵, 等. 常见香辛料对酱猪肉中杂环胺生成的影响[J]. 食品工业科技, 2018(13): 243-247. DOI:10.13386/j.issn1002-0306.2018.13.044.
[7] 李进, 李凯凯, 高悦, 等. 固相萃取-高效液相色谱法分析香辛料对酱卤肉中β-咔啉类杂环胺形成的影响[J]. 现代食品科技, 2019, 35(3):234-240. DOI:10.13982/j.mfst.1673-9078.2019.3.035.
[8] KATO T, HARASHIMA T, MORIYA N, et al. Formation of the mutagenic/carcinogenic imidazoquinoxaline-type heterocyclic amines through the unstable free radical Maillard intermediates and its inhibition by phenolic antioxidants[J]. Carcinogenesis, 1996, 17(11):2469-2476. DOI:10.1093/carcin/17.11.2469.
[9] KIKUGAWA K. Involvement of free radicals in the formation of heterocyclic amines and prevention by antioxidants[J]. Cancer Letters,1999, 143(2): 123-126. DOI:10.1016/S0304-3835(99)00140-8.
[10] 朱新武, 曾晓房, 鲁长海, 等. 天然香辛料及其复配对脂肪氧化的影响[J]. 中国食品添加剂, 2015(2): 146-150. DOI:10.3969/j.issn.1006-2513.2015.02.017.
[11] 刘玲玲. 红烧肉加工过程中营养成分变化及丙烯酰胺抑制研究[D].南昌: 南昌大学, 2016: 45-59.
[12] 陈炎, 杨潇, 屠泽慧, 等. 愈创木酚对卤煮牛肉中多环芳烃含量的影响[J]. 食品科学技术学报, 2017, 35(5): 36-44. DOI:10.3969/j.issn.2095-6002.2017.05.006.
[13] 杨潇. 烟熏液对卤煮牛肉中杂环胺和多环芳烃含量的影响研究[D].合肥: 合肥工业大学, 2016: 44-45.
[14] GROSS G A, GRÜTER A. Quantitation of mutagegnic/carcinogenic heterocyclic aromatic amines in food products[J]. Journal of Chromatography A, 1992, 592(1/2): 271-278. DOI:10.1016/0021-9673(92)85095-B.
[15] 缪萍, 裘福荣, 曾金, 等. LC-MS/MS同时测定四逆汤中11 个有效成分[J]. 中成药, 2014, 36(7): 1430-1434. DOI:10.3969/j.issn.1001-1528.2014.07.019.
[16] 屠泽慧. 香辛料与照射处理对熏肠多环芳烃含量及品质的影响[D].合肥: 合肥工业大学, 2018: 15-17.
[17] 吕美. 香辛料的抗氧化性及其对煎烤牛肉饼中杂环胺形成的影响[D].无锡: 江南大学, 2011: 32-33.
[18] 杨调调. 西式熏煮香肠加工过程中杂环胺的累积规律及抑制研究[D].无锡: 江南大学, 2019: 44-53.
[19] 黄雪松, 宴日安, 吴建中. 姜酚的生物活性述评[J]. 暨南大学学报(自然科学与医学版), 2005, 26(3): 434-439. DOI:10.3969/j.issn.1000-9965.2005.03.030.
[20] 鲁昊浩, 焦睿, 黄雪松. 6-姜酚与6-姜酚肟抗氧化性质的比较研究[J].现代食品科技, 2015, 31(9): 113-118.
[21] 廖国周, 王桂瑛, 徐幸莲, 等. 葡萄籽提取物对烤羊肉中杂环胺形成的影响[J]. 食品与发酵工业, 2011, 37(6): 98-101.
[22] SABALLY K, SLENO L, JAUFFRIT J A, et al. Inhibitory effects of apple peel polyphenol extract on the formation of heterocyclic amines in pan fried beef patties[J]. Meat Science, 2016, 117: 57-62.DOI:10.1016/j.meatsci.2016.02.040.
[23] JAMALI M, ZHANG Y, TENG H, et al. Inhibitory effect of Rosa rugosa tea extract on the formation of heterocyclic amines in meat patties at different temperatures[J]. Molecules, 2016, 21(2): 173.DOI:10.3390/molecules21020173.
[24] ZENG Maomao, ZHANG Mengru, HE Zhiyong, et al. Inhibitory profiles of chilli pepper and capsaicin on heterocyclic amine formation in roast beef patties[J]. Food Chemistry, 2017, 221: 401-411.DOI:10.1016/j.foodchem.2016.10.061.
[25] KESKEKOGLU H, UREN A. Inhibitory effects of grape seed extract on the formation of heterocyclic aromatic amines in beef and chicken meatballs cooked by different techniques[J]. International Journal of Food Properties, 2017, 20(Suppl 1): 722-734. DOI:10.1080/10942912.2017.1308956.
[26] 高红豆, 胡文忠, 姜爱丽, 等. 体外试验法模拟芒果中主要抗氧化物的相互作用关系[J]. 现代食品科技, 2019, 35(3): 107-111; 206.
[27] 曾茂茂, 李洋, 何志勇, 等. 液相色谱-质谱联用法结合主成分分析考察食品中前体物质对杂环胺生成的影响[J]. 分析化学, 2014, 42(1):71-76. DOI:10.3724/SP.J.1096.2014.30628.
[28] 李永, 何志勇, 高大明, 等. 热加工食品中杂环胺形成及抑制机制[J]. 食品安全质量检测学报, 2019, 10(2): 42-49. DOI:10.3969/j.issn.2095-0381.2019.02.006.
[29] PUANGSOMBAT K, SMITH J S. Inhibition of heterocyclic amine formation in beef patties by ethanolic extracts of rosemary[J].Journal of Food Science, 2010, 75(2): 40-47. DOI:10.1111/j.1750-3841.2009.01491.x.
[30] MURKOVIC M, STEINBERGER D, PFANNHAUSER W.Antioxidant spices reduce the formation of heterocyclic amines in fried meat[J]. Zeitschrift fuer Lebensmittel-Untersuchung und -Forschung A,1998, 207(6): 477-480. DOI:10.1007/s002170050364.
[31] OLIVIERO T, CAPUANO E, CÄMMERER B, et al. Influence of roasting on the antioxidant activity and HMF formation of a cocoa bean model systems[J]. Journal of Agricultural and Food Chemistry,2009, 57(1): 147-152. DOI:10.1021/jf802250j.