牦牛被誉为“高原之舟”,传统放牧的牦牛肉是一种营养成分含量高、安全、无污染的肉类,具有高蛋白、低脂肪、维生素含量高的优点[1]。但在传统放牧模式下,牦牛的饲草转化率较低[2],生长周期长,对青藏高原草场生态造成了巨大压力。随着物质生活水平的提高,人们对于牦牛肉的需求日益增长,牦牛舍饲育肥、补饲等技术成为产业发展的必然趋势。养殖方式的改变不仅可以提高牦牛的生长性能和屠宰性能[3-5],还会对牦牛肉品质产生一定影响。王莉[6]、孔祥颖[7]和杨小林[8]等发现,补饲可以显著提高牦牛肉的脂肪含量和嫩度,并显著降低牦牛肉水分含量(P<0.05)。杨昌福等[9]研究发现,育肥牦牛肉有更高的pH值和更低的蒸煮损失(P<0.05)。方雷[10]和郝力壮[11]研究发现,暖季补饲可以显著提高牦牛肉中必需氨基酸含量(P<0.05)。除此之外,挥发性风味物质也是牦牛肉品质的重要衡量标准。舍饲育肥下的羊肉[12-13]和牛肉[14]风味与传统放牧模式相比有很大差异。目前,养殖方式对牦牛肉的挥发性风味物质和脂肪酸组成是否产生影响未见系统报道。为此,本研究以传统放牧和育肥6 个月的牦牛背最长肌为研究对象,比较分析挥发性风味成分和脂肪酸组成差异,以期为牦牛肉生产提供理论基础。
1 材料与方法
1.1 材料与试剂
随机选取青海省海晏县健康的2~3 岁龄放牧和舍饲育肥6 个月公牦牛各6 头。放牧组:天然牧场传统放牧养殖;育肥组:舍饲育肥6 个月,饲料原料包括青贮、酒糟、燕麦、菜粕等;饲喂遵循定时、定量、定人员原则;饲料按配方进行配比,并使用TMR混合日粮搅拌机进行搅拌;每天上午和下午定时饲喂2 次、饮水2 次,并在饲喂过程中定时混匀饲料。根据GB/T 19477—2004《牛屠宰操作规程》进行屠宰,屠宰后胴体需放置在0~4 ℃条件下排酸24 h,分割后取左半侧胴体背最长肌作为实验样品。
甲醇(色谱纯) 河北四友卓越科技有限公司;浓盐酸(优级纯) 重庆川东化工(集团)有限公司;乙醚(分析纯)、石油醚(分析纯)、氢氧化钾(优级纯)、氢氧化钠(优级纯)、氯化钠(分析纯)、正己烷(分析纯) 成都市科龙化工试剂厂;2-甲基-3-庚酮标准溶液 上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
7890A-7000气相色谱-质谱联用仪、6890气相色谱仪美国安捷伦科技有限公司;DB-WAX色谱柱(30 m×250 μm,0.25 μm) 美国J&W公司;固相微萃取装置、50/30 μm二乙基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/polydimethylsiloxane,DVB/CAR/PDMS)萃取头 美国Supelco公司。
1.3 方法
1.3.1 脂肪酸测定
参照GB 5009.168—2016《食品安全国家标准 食品中脂肪酸的测定》中的酸水解法。
1.3.2 风味物质测定
称取6 g肉糜,放入20 mL萃取瓶中密封,50 ℃条件下平衡20 min。将固相萃取进样器插入萃取瓶的顶空部分,萃取40 min。然后将萃取器转移至气相色谱-质谱联用仪,250 ℃解吸7 min,同时启动仪器采集数据。
风味化合物定性:通过保留时间与NIST 2.0质谱数据库比对进行鉴定,另外根据化合物的保留时间计算保留指数(retention indices,RI)[15],并与www.Flavornet.com网站的RI进行比较鉴定化合物。
风味化合物定量:采用内标法,在顶空固相微萃取前向样品中加入1 μL 0.816 mg/mL内标物2-甲基-3-庚酮,结果以样品质量(干基)计,风味化合物含量按下式计算。
式中:S1为化合物色谱峰面积/(μV·s);S2为内标物色谱峰面积/(μV·s);ρ为内标物质量浓度/(mg/mL);V为内标物体积/μL;m为样品质量(干基)/g。
1.4 数据处理
采用Microsoft Office Excel 2003软件进行数据处理,结果用平均值±标准差表示。采用SPSS 20.0软件全因子模型对数据进行统计分析与主成分分析,差异显著水平为0.05。
2 结果与分析
2.1 不同养殖模式下牦牛背最长肌的脂肪酸组成
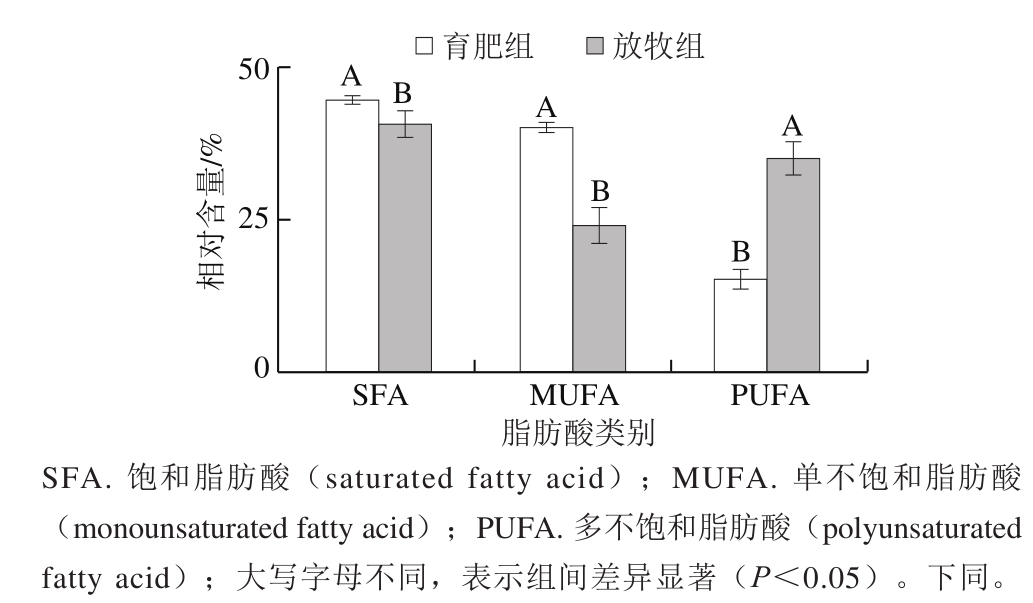
图1 不同养殖模式下牦牛背最长肌的脂肪酸组成及相对含量
Fig. 1 Relative contents of various fatty acid classes in yak Longissimus dorsi under different feeding modes
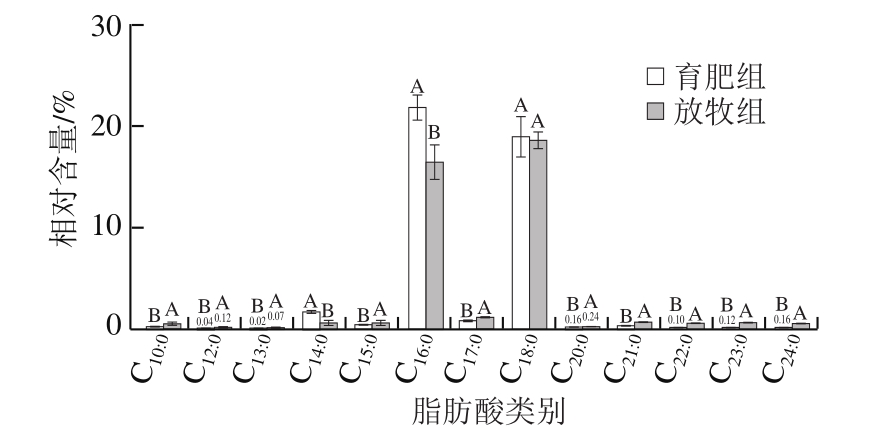
图2 不同养殖模式下牦牛背最长肌SFA相对含量
Fig. 2 Relative contents of individual SFAs in yak Longissimus dorsi under different feeding modes
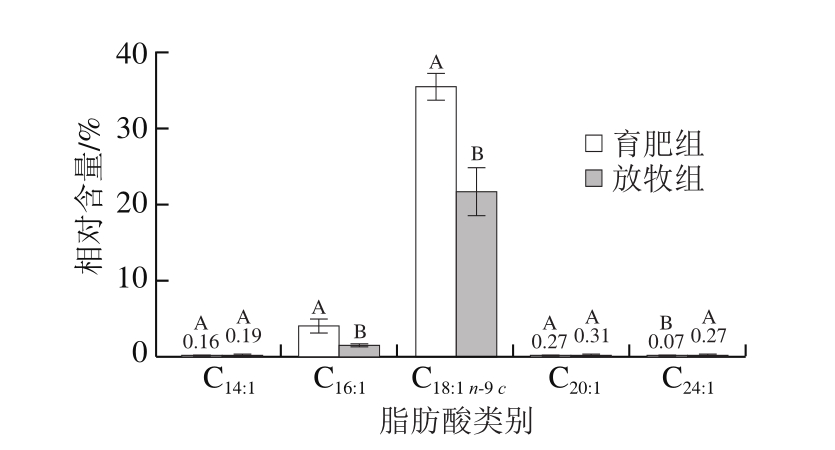
图3 不同养殖模式下牦牛背最长肌MUFA相对含量
Fig. 3 Relative contents of individual MUFAs in yak Longissimus dorsi under different feeding modes
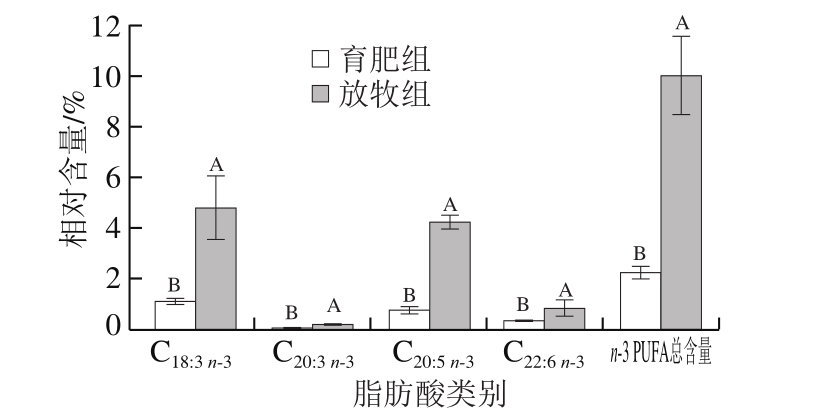
图4 不同养殖模式下牦牛背最长肌n-3 PUFA相对含量
Fig. 4 Relative contents of total and individual n-3 PUFAs in yak Longissimus dorsi under different feeding modes
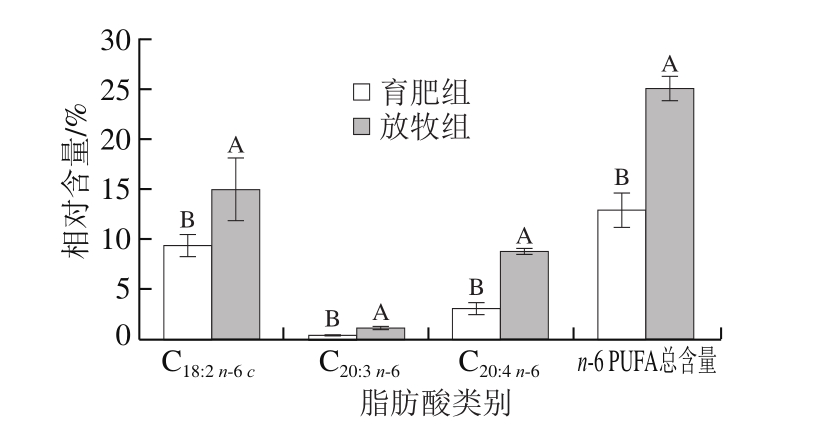
图5 不同养殖模式下牦牛背最长肌n-6 PUFA相对含量
Fig. 5 Relative contents of individual and total n-6 PUFAs in yak
Longissimus dorsi under different feeding modes
由图1~5可知,放牧组和育肥组牦牛背最长肌均检出13 种SFA、5 种MUFA和7 种PUFA,但是2 组样品的脂肪酸组成差异较大。放牧组牦牛背最长肌脂肪酸相对含量依次为SFA(40.77%)>PUFA(35.15%)>MUFA(24.07%),育肥组为SFA(44.72%)>MUFA(40.10%)>PUFA(15.18%)。SFA均为2 组中相对含量最高的脂肪酸,且育肥组SFA相对含量显著升高,育肥组MUFA相对含量显著高于放牧组,而育肥组PUFA相对含量则显著低于放牧组(P<0.05)。
与放牧组相比,育肥组牦牛背最长肌的葵酸(C10:0)、月桂酸(C12:0)、十三烷酸(C13:0)、十五烷酸(C15:0)、珍珠酸(C17:0)、花生酸(C20:0)、二十一烷酸(C21:0)、山嵛酸(C22:0)、二十三烷酸(C23:0)和二十四烷酸(C24:0)相对含量均显著降低(P<0.05),棕榈酸(C16:0)相对含量显著升高(P<0.05),油酸(C18:1 n-9 c)和棕榈油酸(C16:1)相对含量显著升高(P<0.05),n-3 PUFA和n-6 PUFA总含量显著降低(P<0.05),且7 种PUFA相对含量均显著降低(P<0.05)。
2.2 不同养殖模式下牦牛背最长肌的挥发性风味物质组成
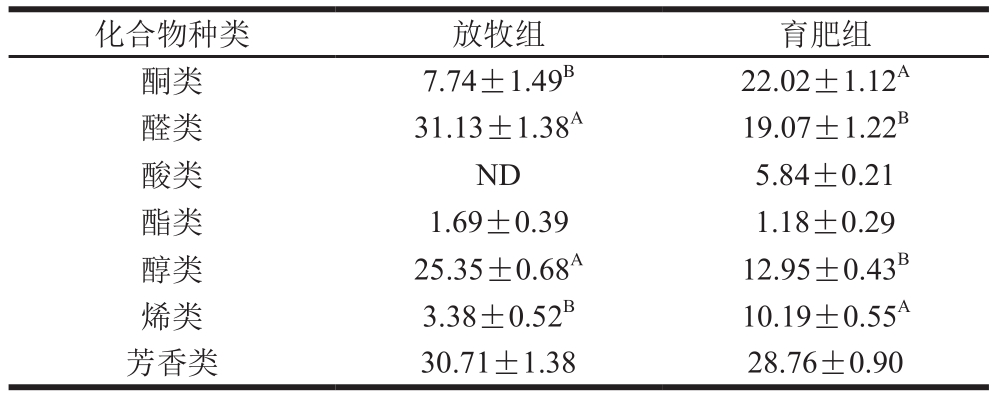
表1 不同养殖模式下牦牛背最长肌各类挥发性风味物质的相对含量
Table 1 Relative contents of various classes of volatile flavor compounds in yak Longissimus dorsi under different feeding modes%
注:ND. 未检出;同行大写字母不同,表示不同饲养方式间差异显著(P<0.05)。表2同。
化合物种类 放牧组 育肥组酮类 7.74±1.49B 22.02±1.12A醛类 31.13±1.38A 19.07±1.22B酸类 ND 5.84±0.21酯类 1.69±0.39 1.18±0.29醇类 25.35±0.68A 12.95±0.43B烯类 3.38±0.52B 10.19±0.55A芳香类 30.71±1.38 28.76±0.90
由表1~2可知,牦牛背最长肌中共检出32 种挥发性风味物质,其中放牧组检出26 种,育肥组检出30 种。检出的挥发性风味物质可以分为7 类,包括酮类4 种、醛类10 种、酸类2 种、酯类1 种、醇类5 种、烯类2 种及芳香类8 种。其中,酸类物质仅在育肥组中检出。2 组样品各类挥发性风味物质组成差异较大,放牧组相对含量最高的为醛类(31.13%),其次为芳香类(30.71%)及醇类(25.35%);而育肥组相对含量最高的为芳香类(28.76%),其次为酮类(22.02%)及醛类(19.07%)。
表2 不同养殖模式下牦牛背最长肌挥发性风味物质鉴定结果
Table 2 Identification of volatile flavors in yak Longissimus dorsi under different feeding patterns
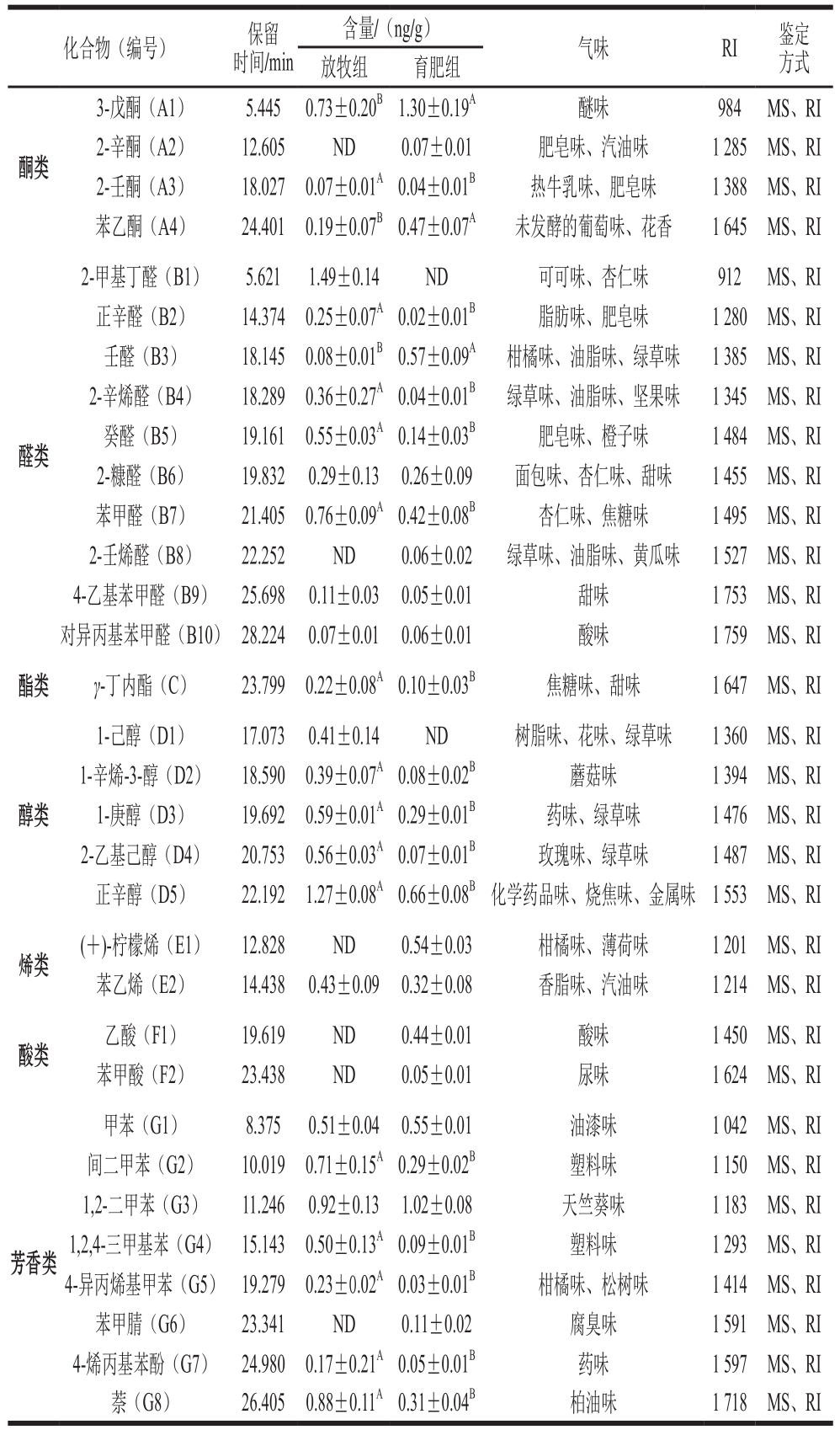
化合物(编号) 保留时间/min含量/(ng/g) 气味 RI 鉴定方式放牧组 育肥组酮类3-戊酮(A1) 5.445 0.73±0.20B1.30±0.19A 醚味 984 MS、RI 2-辛酮(A2) 12.605 ND 0.07±0.01 肥皂味、汽油味 1 285 MS、RI 2-壬酮(A3) 18.027 0.07±0.01A0.04±0.01B 热牛乳味、肥皂味 1 388 MS、RI苯乙酮(A4) 24.401 0.19±0.07B0.47±0.07A 未发酵的葡萄味、花香 1 645 MS、RI 2-甲基丁醛(B1) 5.621 1.49±0.14 ND 可可味、杏仁味 912 MS、RI正辛醛(B2) 14.374 0.25±0.07A0.02±0.01B 脂肪味、肥皂味 1 280 MS、RI壬醛(B3) 18.145 0.08±0.01B0.57±0.09A 柑橘味、油脂味、绿草味 1 385 MS、RI 2-辛烯醛(B4) 18.289 0.36±0.27A0.04±0.01B 绿草味、油脂味、坚果味 1 345 MS、RI癸醛(B5) 19.161 0.55±0.03A0.14±0.03B 肥皂味、橙子味 1 484 MS、RI 2-糠醛(B6) 19.832 0.29±0.13 0.26±0.09 面包味、杏仁味、甜味 1 455 MS、RI苯甲醛(B7) 21.405 0.76±0.09A0.42±0.08B 杏仁味、焦糖味 1 495 MS、RI 2-壬烯醛(B8) 22.252 ND 0.06±0.02 绿草味、油脂味、黄瓜味 1 527 MS、RI 4-乙基苯甲醛(B9) 25.698 0.11±0.03 0.05±0.01 甜味 1 753 MS、RI对异丙基苯甲醛(B10) 28.224 0.07±0.01 0.06±0.01 酸味 1 759 MS、RI酯类 γ-丁内酯(C) 23.799 0.22±0.08A0.10±0.03B 焦糖味、甜味 1 647 MS、RI醛类醇类1-己醇(D1) 17.073 0.41±0.14 ND 树脂味、花味、绿草味 1 360 MS、RI 1-辛烯-3-醇(D2) 18.590 0.39±0.07A0.08±0.02B 蘑菇味 1 394 MS、RI 1-庚醇(D3) 19.692 0.59±0.01A0.29±0.01B 药味、绿草味 1 476 MS、RI 2-乙基己醇(D4) 20.753 0.56±0.03A0.07±0.01B 玫瑰味、绿草味 1 487 MS、RI正辛醇(D5) 22.192 1.27±0.08A0.66±0.08B 化学药品味、烧焦味、金属味 1 553 MS、RI烯类 (+)-柠檬烯(E1) 12.828 ND 0.54±0.03 柑橘味、薄荷味 1 201 MS、RI苯乙烯(E2) 14.438 0.43±0.09 0.32±0.08 香脂味、汽油味 1 214 MS、RI酸类 乙酸(F1) 19.619 ND 0.44±0.01 酸味 1 450 MS、RI苯甲酸(F2) 23.438 ND 0.05±0.01 尿味 1 624 MS、RI芳香类甲苯(G1) 8.375 0.51±0.04 0.55±0.01 油漆味 1 042 MS、RI间二甲苯(G2) 10.019 0.71±0.15A0.29±0.02B 塑料味 1 150 MS、RI 1,2-二甲苯(G3) 11.246 0.92±0.13 1.02±0.08 天竺葵味 1 183 MS、RI 1,2,4-三甲基苯(G4) 15.143 0.50±0.13A0.09±0.01B 塑料味 1 293 MS、RI 4-异丙烯基甲苯(G5) 19.279 0.23±0.02A0.03±0.01B 柑橘味、松树味 1 414 MS、RI苯甲腈(G6) 23.341 ND 0.11±0.02 腐臭味 1 591 MS、RI 4-烯丙基苯酚(G7) 24.980 0.17±0.21A0.05±0.01B 药味 1 597 MS、RI萘(G8) 26.405 0.88±0.11A0.31±0.04B 柏油味 1 718 MS、RI
育肥组酮类物质相对含量(22.02%)显著高于放牧组(7.74%)(P<0.05),其中,育肥组3-戊酮和苯乙酮含量显著高于放牧组(P<0.05),2-壬酮含量显著低于放牧组(P<0.05),2-辛酮仅在育肥组检出。育肥组醛类物质相对含量(19.07%)显著低于放牧组(31.13%)(P<0.05),其中,放牧组含量最高的醛类物质为2-甲基丁醛,而育肥组中未检出该物质,育肥组含量最高的为壬醛,含量显著高于放牧组(P<0.05),而癸醛、正辛醛、2-辛烯醛、苯甲醛含量显著低于放牧组(P<0.05)。育肥组1-庚醇、正辛醇、2-乙基己醇和1-辛烯-3-醇含量显著低于放牧组(P<0.05),且育肥组未检出1-己醇。育肥组烯类物质含量显著高于放牧组(P<0.05),仅在育肥组检出(+)-柠檬烯,2 组均检出苯乙烯,且含量无显著差异。γ-丁内酯是2 组样品中检出的唯一一种酯类物质,其可赋予牛肉甜味,育肥组γ-丁内酯含量显著低于放牧组(P<0.05)。育肥组检出较高含量乙酸,放牧组未检出酸类物质。育肥组芳香类物质间二甲苯、1,2,4-三甲基苯、4-异丙烯基甲苯、萘和4-烯丙基苯酚含量显著低于放牧组(P<0.05),同时,育肥组中检出苯甲腈,但放牧组中未检出。
2.3 不同养殖模式下牦牛背最长肌挥发性风味成分主成分分析
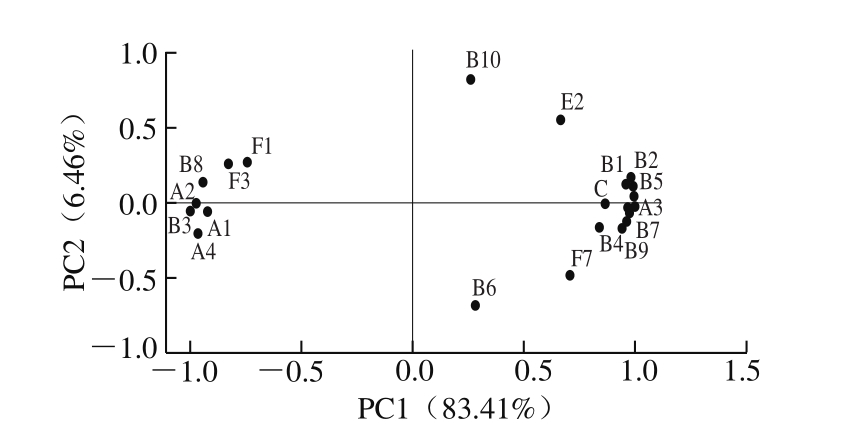
图6 牦牛背最长肌挥发性风味物质主成分分析结果
Fig. 6 Distribution of volatile substances in PC1 versus PC2
由图6可知,主成分1(PC1)和主成分2(PC2)的方差贡献率分别为83.41%和6.46%,累计达到89.87%。与PC1高度相关的变量有1-庚醇、2-乙基己醇、乙酸、柠檬烯、1-己醇、癸醛和2-甲基丁醛等;与PC2高度相关的变量有2-糠醛、对异丙基苯甲醛、苯乙烯、4-烯丙基苯酚、甲苯和1,2-二甲苯(一些物质编号重叠,图中未显示)。
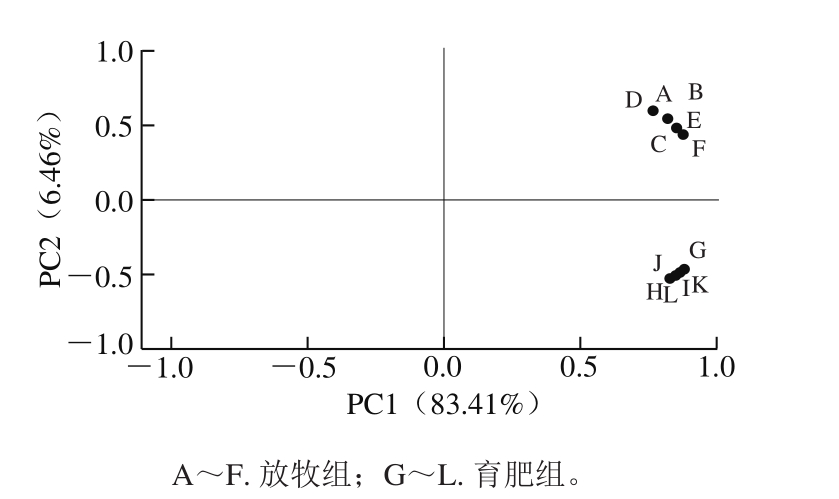
图7 2 组样品主成分分析结果
Fig. 7 Distribution of two groups of samples in PC1 versus PC2
由图7可知,2 组样品分居在X轴两侧,没有重叠,表明不同饲养模式对牦牛背最长肌的风味组成有较大影响。
牦牛背最长肌挥发性风味物质主成分的载荷绝对值越大,对主成分的贡献越大。由表3可知,酮类、醇类、醛类和芳香类化合物是第1主成分的重要风味物质,贡献率大小依次为酮类>醇类>醛类>芳香类。第2主成分的重要风味物质为酯类、烯类和酸类化合物,贡献率依次降低。
表3 挥发性风味物质的主成分载荷矩阵
Table 3 Principal component loading matrix of volatile flavors

风味物质 载荷(α)PC1 PC2酮类 0.910 -0.068醇类 0.870 0.411醛类 -0.839 -0.461芳香类 -0.787 -0.104酯类 0.073 0.892烯类 0.643 0.872酸类 -0.151 -0.853
3 讨 论
3.1 不同养殖模式下牦牛背最长肌脂肪酸组成分析
SFA可以提高人体血液中低密度脂蛋白胆固醇水平,有引起心血管疾病的潜在危险,对人体健康会产生一定影响[16]。本研究结果表明,育肥组和放牧组牦牛背最长肌SFA相对含量最高,主要是硬脂酸(C18:0)和棕榈酸(C16:0)相对含量较高引起的,这与Legako等[17]的研究结果一致。SFA在放牧组和育肥组均占比最大,主要原因可能是反刍动物瘤胃中微生物多样性高,存在较多可以将不饱和脂肪酸转化为SFA的微生物[18]。
MUFA可以降低低密度脂蛋白胆固醇水平,且不会降低对人体有益的高密度脂蛋白胆固醇水平,所以可以预防动脉硬化,同时对于其他脂肪酸的吸收有积极作用[19]。MUFA测定结果表明,育肥组牦牛背最长肌MUFA相对含量显著高于放牧组(P<0.05),主要由较高相对含量的油酸(C18:1 n-9 c)和棕榈油酸(C16:1)引起,油酸亦为2 组样品检出的所有脂肪酸中相对含量最高的脂肪酸,这与谭子璇等[20]的研究结果一致。
育肥组牦牛背最长肌n-3 PUFA和n-6 PUFA总含量显著降低。PUFA是细胞膜的结构成分,同时还可以调节生理功能,在生物系统中有着广泛功能,对于稳定细胞膜功能、调控心血管疾病及促进生长发育等具有重要作用[21]。其中,二十二碳六烯酸(docosahexenoic acid,DHA)、二十碳五烯酸(eicosapentaenoic acid,EPA)都是对人体有益的PUFA,育肥组含量显著低放于牧组(P<0.05)。DHA是影响儿童智力和视敏度的重要物质,EPA合成的二十烷类可以促进血管舒张[22]。牧草中含有更高含量n-3 PUFA,而精饲料中含有更高含量n-6 PUFA[23],育肥组n-3 PUFA含量显著降低可能是由于在牦牛育肥过程中缺乏牧草的摄入引起的。目前,牦牛育肥、补饲等技术缺乏营养需求标准指导,且藏区饲料原料相对匮乏,因而管理普遍粗放,无法根据牦牛不同阶段的实际营养需求对饲料进行科学配比。这可能是造成本研究中饲喂精饲料育肥组牦牛背最长肌n-6 PUFA含量显著降低的原因。
3.2 不同养殖模式下牦牛背最长肌挥发性风味物质组成分析
挥发性风味物质主要由美拉德反应和脂质氧化降解产生。牛肉风味与脂肪酸有直接联系[24]。与SFA相比,风味物质的构成极容易被PUFA的氧化产物所影响,这是由于PUFA与SFA相比含有更多双键,更容易发生自动氧化[25]。
醛类的香气阈值很低,能够赐予牛肉愉快的甜香味和水果味,因此是牛肉非常重要的特征香气组成成分[26]。育肥组牦牛背最长肌的醛类物质相对含量显著低于放牧组(P<0.05)。Greenberg[27]在对家禽副产物的挥发性风味特性研究中发现,醛类物质主要是PUFA氧化形成的产物。因此育肥组醛类物质相对含量显著降低可能与PUFA含量显著降低有关。育肥组牦牛背最长肌壬醛相对含量显著升高,2-辛烯醛和苯甲醛相对含量显著降低(P<0.05),这与李文博等[28]对不同饲养方式下苏尼特羊肉挥发性风味成分的检测结果一致。亚油酸、亚麻酸和油酸分别是2-辛烯醛、苯甲醛和壬醛的主要来源物质[29-30],所以短期育肥使肉中的亚油酸和亚麻酸含量显著降低,油酸含量显著升高(P<0.05)可能是引起壬醛、苯甲醛和2-辛烯醛含量变化的主要原因。壬醛和2-辛烯醛都可以赋予牦牛肉油脂味和绿草味,而苯甲醛能产生令人不愉快的气味,如苦杏仁味和焦糖味,影响牛肉香气。
酮类作为脂质氧化产物,大多具有奶油香或水果香,在主成分分析中,对第1主成分贡献率最大的物质为酮类,其对肉品风味有积极影响。在育肥组检出4 种酮类物质,放牧组检出3 种。仅在育肥组中检出2-辛酮,它是一种具有肥皂味的风味物质,该物质也是牛肉风味的重要来源。
醇类化合物主要由肌肉中的共轭亚油酸被脂肪氧合酶和过氧化酶降解产生[23]。醇类化合物一般具有植物香、酸败味和化学药品味。直链的低级一级醇风味通常会随着碳链的增长而增强,表现出清香、木香、脂肪香的特征[31]。在2 组样品检出的醇类物质中辛醇相对含量均最高,它具有化学药品味、烧焦味和金属味,可能在一定程度上影响牦牛肉风味。2 组样品中均检出的1-辛烯-3-醇是一种重要的醇类风味物质,具有蘑菇香气,由花生四烯酸第12位碳上的氢过氧化物裂解产生的辛烯基团与氧反应生成辛烯基氧自由基再进一步反应生成[32]。在主成分分析中,醇类物质对第1主成分的贡献率仅次于酮类物质。但是多数醇类化合物有较高阈值,较高含量的醇类或非饱和醇才会对牛肉风味产生影响,其他醇类化合物不会对牛肉风味产生很大影响[33]。因此,醇类物质对于牦牛肉风味的贡献并不大。
酸类物质会给牛肉带来不愉快气息,如酸味和尿味。仅在育肥组检出的酸类物质可能会对育肥组的牦牛肉风味产生一定影响。大部分酸类物质由碳水化合物和氨基酸分解产生[34],这可能是仅在饲喂精饲料的育肥组检出酸类物质的原因之一。
烯类物质往往能给牛肉带来成熟的香脂气息。育肥组共检出2 种烯类物质,放牧组仅检出1 种。柠檬烯赋予牛肉类似柠檬和柑橘的香味,苯乙烯能够赋予牛肉脂香味。含苯芳香类化合物在2 组中均占比最高,但主成分分析结果显示,芳香类物质与酸类、烯类类似,对主成分的贡献率不高。其中甲苯、1,2-二甲苯、间二甲苯等芳香烃类化合物可能来自动物饲料,其沉积在动物脂肪中,进而发生氧化反应,影响肉的风味[35]。
4 结 论
随着消费者对牦牛肉消费和均衡供应需求的增长以及政府、社会对保护青藏高原生态环境的日益重视,舍饲育肥将成为牦牛产业发展的必然趋势。本研究发现,与传统放牧牦牛相比,现有育肥模式下的牦牛背最长肌中PUFA相对含量均显著降低,尤其是n-3 PUFA和n-6 PUFA相对含量均显著降低(P<0.05),表明育肥模式下牦牛肉的PUFA组成结构趋向不合理,降低了牦牛肉的固有营养(功能性)品质。尽快明确各阶段牦牛营养需求以及通过营养精准调控技术改善牦牛肉中不饱和脂肪酸,尤其是PUFA组成结构,应是当前牦牛产业的迫切需求和重要的营养学研究方向。风味物质测定结果表明,2 组样品共检出7 大类、32 种挥发性风味物质,其中,放牧组检出26 种,育肥组检出30 种。主成分分析结果表明,传统放牧与育肥模式下牦牛背最长肌的挥发性风味物质组成差异较大。综上所述,现有育肥模式在很大程度上影响了牦牛肉脂肪酸组成,而其作为挥发性风味物质的重要前体物质,进而对牦牛背最长肌的风味产生较大影响,使放牧组和育肥组牦牛背最长肌的风味组成呈现明显差异。
[1] 魏雅萍, 丁凤焕, 徐惊涛, 等. 牦牛、犏牛及黄牛肉脂肪酸和风味物质的分析[J]. 青海畜牧兽医杂志, 2009, 39(5): 1-4. DOI:10.3969/j.issn.1003-7950.2009.05.001.
[2] 肖志清, 钟传友, 朱继发. 牦牛和黑犏牛草原肥育试验[J]. 西南民族学院学报(畜牧兽医版), 1982, 12(1): 21-25.
[3] 牟永娟, 郭淑珍, 包永清, 等. 冷季补饲和犊牛早期断奶对甘南牦牛生长发育和繁殖性能的影响[J]. 畜牧兽医杂志, 2019, 38(6): 11-13.DOI:10.3969/j.issn.1004-6704.2019.06.004.
[4] 周立业. 不同饲养方式对放牧犊牦牛生长发育及肉品品质的影响[D]. 兰州: 甘肃农业大学, 2007: 1-2.
[5] 曾钰, 彭忠利, 陈仕勇, 等. 暖季补饲矿物元素复合舔砖对放牧牦牛生长性能及产奶量的影响[J]. 黑龙江畜牧兽医, 2018, 50(21): 149-153.
[6] 王莉, 孙宝忠, 保善科, 等. 补饲和放养牦牛肉品质及肌肉微观结构差异[J]. 肉类研究, 2015, 29(6): 5-10. DOI:10.7506/rlyj1001-8123-201506002.
[7] 孔祥颖, 张丽, 保善科, 等. 放养过程中补饲对青海高原牦牛产肉能力及肉品质的影响[J]. 中国畜牧兽医, 2015, 42(1): 104-108.DOI:10.16431/j.cnki.1671-7236.2015.01.016.
[8] 杨小林, 陈勇, 朱友军, 等. 舍饲牦牛、犏牛和放牧牦牛屠宰性状、肉质及其营养成分比较[J]. 湖北农业科学, 2019, 58(24): 170-174.DOI:10.14088/j.cnki.issn0439-8114.2019.24.041.
[9] 杨昌福, 柏雪, 高彦华, 等. 全放牧与舍饲育肥对牦牛肉品质及安全性的影响[J]. 畜牧与兽医, 2019, 51(1): 23-28.
[10] 方雷. 饲养方式对夏季牦牛生长性能、屠宰性能、牛肉品质和瘤胃细菌多样性的影响[D]. 北京: 中国农业大学, 2015: 20-34.
[11] 郝力壮. 牦牛暖季补饲对改善肉品质的作用及机理研究[D]. 兰州:兰州大学, 2019: 55-58.
[12] 王朕朕. 限时放牧对羊肉风味物质沉积的影响及其机制初探[D].北京: 中国农业大学, 2015: 28-43.
[13] 钱文熙. 滩羊肉品质研究[D]. 银川: 宁夏大学, 2005: 42-53.
[14] 沙坤, 孙宝忠, 张泽俊, 等. 不同饲养方式的部位肉制作的哈萨克风干牛肉挥发性风味成分差异分析[J]. 食品科学, 2017, 38(18): 48-53.DOI:10.7506/spkx1002-6630-201718008.
[15] YANG R, LUO Liping, ZHANG Haijing, et al. Common aromaactivecomponents of propolis from 23 regions of China[J]. Journal of the Science of Food and Agriculture, 2010, 90(7): 1268-1282.DOI:10.1002/jsfn.3969.
[16] 韩燕, 宋欢, 谢佳乐. 膳食脂肪生理功能及脂肪酸膳食的研究进展[J]. 中国食物与营养, 2007, 12(5): 54-56. DOI:10.3969/j.issn.1006-9577.2007.05.018.
[17] LEGAKO J F, DINH T T N, MILLER M F, et al. Effects of USDA beef quality grade and cooking on fatty acid composition of neutral and polar lipid fractions[J]. Meat Science, 2015, 100: 246-255.DOI:10.1016/j.meatsci.2014.10.013.
[18] FRUET A P B, TROMBETTA F, STEFANELLO F S, et al. Effects of feeding legume-grass pasture and different concentrate levels on fatty acid profile, volatile compounds, and off-flavor of the M. longissimus thoracis[J]. Meat Science, 2018, 140(3): 112-118. DOI:10.1016/j.meatsci.2018.03.008.
[19] SCHMID U, BORNSCHEUER U T, SOUMANOU M M, et al.Optimization of the reaction conditions in the lipase-catalyzed synthesis of structured triglycerides[J]. Journal of the American Oil Chemists’ Society, 1998, 75(11): 1527-1531. DOI:10.1007/s11746-998-0089-5.
[20] 谭子璇, 王琦, 徐旭, 等. 金川牦牛与麦洼牦牛舍饲育肥条件下肉品质的比较研究[J]. 食品工业科技, 2018, 39(17): 46-51.DOI:10.13386/j.issn1002-0306.2018.17.008.
[21] 余文三. 多不饱和脂肪酸的研究概况[J]. 国外医学(卫生学分册),1998, 15(6): 41-44; 49.
[22] RUXTON C H S, REED S C, SIMPSON M J A, et al. The health benefits of omega-3 polyunsaturated fatty acids: a review of the evidence[J]. Journal of Human Nutrition and Dietetics, 2004, 17(5):449-459. DOI:10.1111/j.1365-277X.2004.00552.x.
[23] POPOVA T. Effect of the rearing system on the fatty acid composition and oxidative stability of the M. longissimus lumborum and M. semimembranosus in lambs[J]. Small Ruminant Research, 2007,71(1/3): 150-157. DOI:10.1016/j.smallrumres.2006.06.001.
[24] FORSS D A. Odor and flavor compounds from lipids[J]. Progress in the Chemistry of Fats and Other Lipids, 1973, 13(1): 177-258.DOI:10.1016/0079-6832(73)90007-4.
[25] MORRISSEY P A, KERRY J P, GALVIN K. Lipid oxidation in muscle foods[J]. ACS Symposium, 2002, 836(55): 188-200.DOI:10.1021/bk-2003-0836.ch014.
[26] INSAUSTI K, GONI V, PETRI E, et al. Effect of weight at slaughter on the volatile compounds of cooked beef from Spanish cattle breeds[J]. Meat Science, 2005, 70(1): 83-90. DOI:10.1016/j.meatsci.2004.12.003.
[27] GREENBERG M J. Characterization of poultry by-product meal flavor volatiles[J]. Journal of Agricultural and Food Chemistry, 1981,29(4): 831-834. DOI:10.1021/jf00106a038.
[28] 李文博, 罗玉龙, 刘畅, 等. 饲养方式对苏尼特羊肉挥发性风味成分和脂肪酸组成的影响[J]. 食品科学, 2019, 40(24): 207-213.DOI:10.7506/spkx1002-6630-20190107-095.
[29] HOWE P E, BARBELLA N G. Flavor of meat and meat products[J].Journal of Food Science, 2006, 2(3): 197-202. DOI:10.1111/j.1365-2621.1937.tb16510.x.
[30] BA H V, RYU K S, LAN N T K, et al. Influence of particular breed on meat quality parameters, sensory characteristics, and volatile components[J]. Food Science and Biotechnology, 2013, 22(3): 651-658.DOI:10.1007/s10068-013-0127-4.
[31] MA Q L, HAMID N, BEKHIT A E D, et al. Evaluation of pre-rigor injection of beef with proteases on cooked meat volatile profile after 1 day and 21 days post-mortem storage[J]. Meat Science, 2012, 92(4):430-439. DOI:10.1016/j.meatsci.2012.05.006.
[32] HEAHT H B, REINECCLUS G. Flavor chemistry and technology[M].Connecticut: The AVI Publishing Company, 1986. DOI:10.1007/978-1-349-09350-2.
[33] KEYS A, ANDERSON J T, GRANDE F. Serum cholesterol response to changes in the diet[J]. Metabolism, 1965, 14(7): 776-787.DOI:10.1016/0026-0495(65)90001-6.
[34] HERRANZ B, DE LA HOZ L, HIERRO E, et al. Improvement of the sensory properties of dry-fermented sausages by the addition of free amino acids[J]. Food Chemistry, 2005, 91(4): 673-682. DOI:10.1016/j.foodchem.2004.06.040.
[35] KABAN G. Changes in the composition of volatile compounds and in microbiological and physicochemical parameters during pastırma processing[J]. Meat Science, 2009, 82(1): 17-23. DOI:10.1016/j.meatsci.2008.11.017.