畜禽血液蛋白质含量丰富[1-3],并且含有利于人体吸收的亚铁血红素[4-6]。2018年我国生猪出栏量6.94 亿头,猪肉产量5 404 万t,位居世界第一,具有大量的猪血资源[7]。利用猪血资源制备血红素,可减少大量未降解猪血的排放,降低环境污染,还可以为缺铁性贫血人群的补铁提供有效途径[8-9]。亚铁血红素肽是将畜禽血液中的血红蛋白经物理和化学方法处理,除去其中大部分氨基酸后得到的由长度不等的短肽段与亚铁血红素连接而成的混合物[10]。目前,亚铁血红素肽的提取方法主要有冰醋酸法[11]、酸性丙酮法[12-13]、表面活性剂法[14-16]、羧甲基纤维素钠(carboxy methyl cellulose-Na,CMC-Na)法[17]和酶水解法[18-20]等。其中冰醋酸法、酸性丙酮法和表面活性剂法需使用有毒试剂,不可用于食用;CMC-Na法提取的产物纯度和回收率均较低;而酶水解法可人工控制,副反应相对较少[21-23],且在不使用有毒试剂的情况下使亚铁血红素与一定量的肽段结合,提高人体吸收率[24]。
本研究以猪血为原料,利用碱性蛋白酶和风味蛋白酶两步水解血红蛋白,以制备亚铁血红素肽。在单因素试验基础上采用响应面法确定最佳酶解工艺,为亚铁血红素肽的制备工艺及规模化生产提供依据。
1 材料与方法
1.1 材料与试剂
猪血 江苏雨润肉食品有限公司。
碱性蛋白酶 上海蓝季科技发展有限公司;风味蛋白酶 诺维信(中国)生物技术有限公司;三氯乙酸、福林试剂、干酪素、L-酪氨酸、吡啶、甲醛、硼酸、浓硫酸、盐酸、乙酸钠(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
5427R高速冷冻离心机 德国Eppendorf公司;FA1204B电子分析天平、PHS-3C pH计 上海精密科学仪器有限公司;HH-M6恒温水浴锅 金坛市城西春兰实验仪器厂;JY92-2D超声清洗机 宁波新芝生物科技有限公司;UV-1700紫外-可见分光光度计 日本岛津仪器有限公司。
1.3 方法
1.3.1 血红蛋白溶液的制备
取新鲜猪血,立即加入猪血体积1/10的3.8 g/100 mL柠檬酸三钠抗凝,搅拌均匀后3 500 r/min离心15 min,收集下层红血球,用生理盐水洗涤后得到干净红血球;将红血球与蒸馏水以体积比1∶3混合,使用超声波破碎细胞,超声条件为:温度10 ℃、功率350 W、时间10 min;破碎后的红细胞置于4 ℃冰箱中溶血20 h以上,得到血红蛋白溶液。
1.3.2 高效蛋白酶的筛选
将1.3.1节得到的血红蛋白溶液作为底物,采用两步酶解法,第1步分别采用中性蛋白酶、胰蛋白酶、碱性蛋白酶3 种肽链内切酶酶解,以血红蛋白溶液水解度和亚铁离子得率为指标,选取最适内切酶;第2步分别采用风味蛋白酶和氨肽酶2 种肽链外切酶继续酶解,以血红蛋白溶液水解度和亚铁离子得率为指标,选取最适外切酶。各酶水解条件均为最适条件,如表1所示。
表1 5 种商业酶的最适酶解条件
Table 1 Optimal enzymatic conditions of five commercial enzymes

酶种类 最适温度/℃ 最适pH中性蛋白酶 50~55 6.0~7.0碱性蛋白酶 50~55 7.5~8.5胰蛋白酶 40~50 8.0~9.0风味蛋白酶 45~55 6.0~7.5氨肽酶 40~50 6.0~7.5
1.3.3 血红蛋白溶液水解度测定
血红蛋白溶液中总氮含量的测定采用凯氏定氮法[25],酶解液中氨基态氮含量的测定采用甲醛滴定法[26]。血红蛋白溶液水解度按下式计算。
1.3.4 亚铁离子含量测定
参照HJ/T 345—2007《水质 铁的测定 邻菲啰啉分光光度法》[27]中的邻菲啰啉分光光度法,稍作改进。
1.3.5 亚铁血红素含量测定
亚铁血红素肽的主体部分为亚铁血红素,因此测定亚铁血红素肽含量只需测定亚铁血红素含量即可。参考Guo Shanguang等[28]的分光光度法,并稍作修改。
1.3.6 响应面试验设计
在单因素试验结果基础上,选择酶底比(E/S)、酶解时间和酶解温度为因素,血红蛋白溶液水解度为响应值,采用Design-Expert 8.0.6软件中的Box-Behnken中心组合试验进行3因素3水平试验设计,优化分析得到二次多项式回归方程预测模型,考察其可信程度,研究碱性蛋白酶和风味蛋白酶的最优酶解工艺,2 种酶的酶解工艺响应面试验因素水平如表2所示。
表2 酶解工艺响应面试验因素水平表
Table 2 Coded levels and actual corresponding levels of experimental factors used in Box-Behnken design

酶种类 A E/S/(kU/g) B酶解时间/h C酶解温度/℃碱性蛋白酶-1(8) -1(3) -1(40)0(10) 0(5) 0(50)1(12) 1(7) 1(60)风味蛋白酶-1(8) -1(2) -1(40)0(10) 0(4) 0(50)1(12) 1(6) 1(60)
1.4 数据处理
采用Design-Expert 8.0.6软件进行响应面优化试验设计和响应面三维图和等高线图绘制,采用Origin 8.6软件进行图表绘制。
2 结果与分析
2.1 不同蛋白酶酶解效果分析
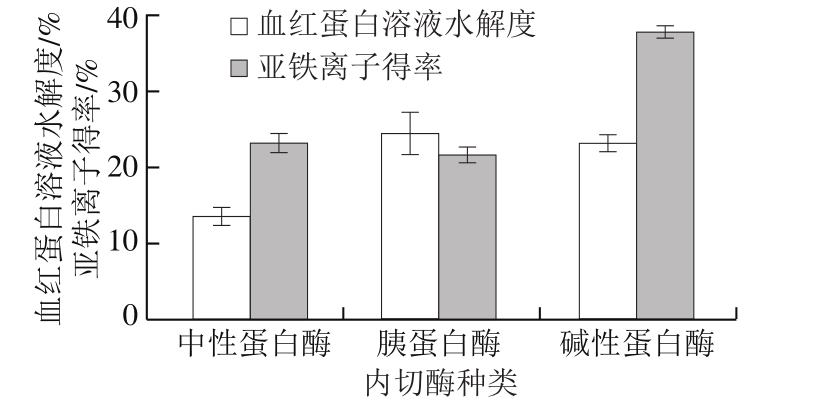
图1 不同内切酶的血红蛋白酶解效果
Fig. 1 Effect of different endoproteases on degree of hydrolysis and yield of hemopeptides
由图1可知,3 种内切酶中,采用胰蛋白酶时的血红蛋白溶液水解度最高,为24.65%,采用碱性蛋白酶时的血红蛋白溶液水解度略低,为23.39%,二者无显著差异,且均高于采用中性蛋白酶时的血红蛋白溶液水解度。碱性蛋白酶酶解液的亚铁离子得率为37.97%,显著高于另外2 种内切酶酶解液(P<0.05)。虽然采用胰蛋白酶时血红蛋白溶液水解度最高,但其酶解液的亚铁离子得率较低,因此选择碱性蛋白酶作为内切酶。
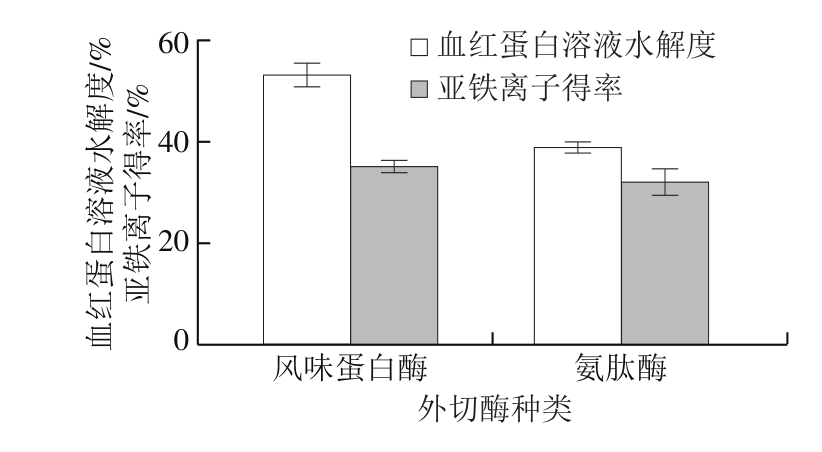
图2 不同外切酶的血红蛋白酶解效果
Fig. 2 Effect of different exoproteases on hemoglobin
由图2可知,无论是血红蛋白溶液水解度还是亚铁离子得率,风味蛋白酶均优于氨肽酶,因此选择风味蛋白酶作为外切酶。
2.2 响应面法优化碱性蛋白酶酶解工艺的试验结果与分析
2.2.1 碱性蛋白酶酶解工艺的响应面分析
碱性蛋白酶酶解工艺的响应面试验设计方案及结果如表3所示。由表4可知,模型极显著(P<0.000 1),说明该模型能够解释大部分实验情况的变化,同时失拟项不显著,进一步说明该模型的合理性,因此,可以用此模型对实验结果进行分析和预测。回归方程模型为:Y=-102.958 69+15.653 13A+1.878 13B+1.622 12C+0.080 63AB-0.015 38AC+0.036 63BC-0.752 94A2-0.420 44B2-0.016 17C2,回归方程中的一次项B、二次项BC达到显著水平(P<0.05),二次项A2、B2、C2均达到极显著水平(P<0.01),表明各因素对血红蛋白溶液水解度的影响不是简单的线性关系。方差分析中因素A、B、C的F值分别为5.82、10.77、3.36,即各因素对血红蛋白溶液水解度的影响程度大小顺序为酶解时间>E/S>酶解温度。模型拟合系数R2=0.974 2,模型校正拟合系数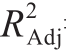 =0.941 1,表明该模型能够解释血红蛋白溶液水解度94.11%的变化来自于所选变量。同时变异系数为2.63%,说明模型置信度高,能够准确预测和分析3 个变量对血红蛋白溶液水解度的影响。
=0.941 1,表明该模型能够解释血红蛋白溶液水解度94.11%的变化来自于所选变量。同时变异系数为2.63%,说明模型置信度高,能够准确预测和分析3 个变量对血红蛋白溶液水解度的影响。
表3 碱性蛋白酶酶解工艺的Box-Behnken设计方案及试验结果
Table 3 Box-Behnken design scheme with experimental values of hydrolysis degree using alkaline protease

试验号 A E/S B酶解时间 C酶解温度 血红蛋白溶液水解度/%1 0-1 1 19.35 2 -1 -1 0 17.86 3 0 0 0 22.61 4-1 -1 19.69 5 1-1 0 18.01 0 6 23.39 7 0 0 0 23.83 0 0 0 8 22.84 9 1 1 0 20.09 0 0 0 10 -1 0 -1 17.76 11 0 0 0 24.06 12 -1 1 0 18.65 13 0 1 1 21.87 14 1 0 1 19.06 15 1 0 -1 19.41 16 0 1 -1 19.28 17 -1 0 1 18.64
表4 碱性蛋白酶酶解工艺模型回归方程系数的显著性检验
Table 4 Analysis of variance of regression model coefficients for alkaline protease hydrolysis and significance test

注:*. 差异显著(P<0.05);**. 差异极显著(P<0.01)。表5同。
方差来源 平方和 自由度 均方 F值 P(Prob>F)模型 76.10 9 8.46 29.38 <0.000 1**A 1.67 1 1.67 5.82 0.466 0 B 3.10 1 3.10 10.77 0.013 4*C 0.97 1 0.97 3.36 0.109 6 AB 0.42 1 0.42 1.45 0.268 3 AC 0.38 1 0.38 1.31 0.289 3 BC 2.15 1 2.15 7.46 0.029 3*A2 38.19 1 38.19 132.71 <0.000 1**B2 11.91 1 11.91 41.38 0.000 4**C2 11.01 1 11.01 38.24 0.000 5**残差 2.01 7 0.29失拟项 0.47 3 0.16 0.41 0.757 2纯误差 1.54 4 0.39总差 78.12 16
2.2.2 碱性蛋白酶水解影响因素的交互作用分析
根据回归方程绘制响应面图,图形形状与三维图倾斜度均能反映因素间的交互作用程度。等高线为圆形表示两因素交互作用不显著,椭圆形表示两因素交互作用显著;三维图倾斜度越大,坡度越陡,说明两因素交互作用越显著。
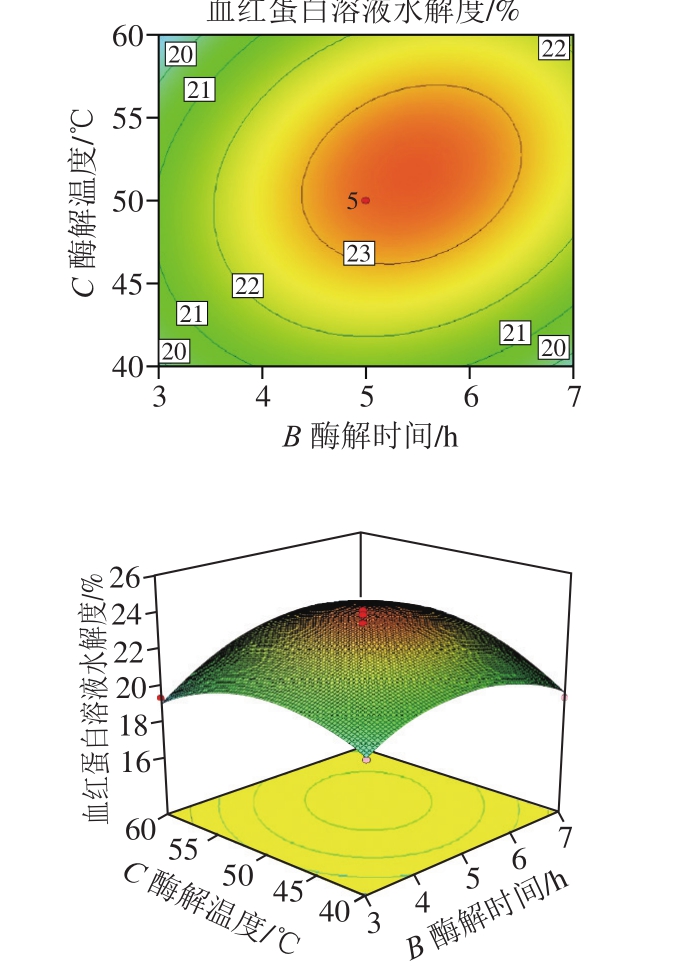
图3 酶解温度和酶解时间对碱性蛋白酶水解所得血红蛋白溶液水解度交互作用的三维图和等高线图
Fig. 3 Three-dimensional response surface and contour maps showing the effect of interaction between hydrolysis temperature and time on the degree of alkaline protease hydrolysis
仅对交互作用显著的2 个因素(酶解温度和酶解时间)进行交互作用分析。由图3可知,当酶解时间为5 h、酶解温度在40~50 ℃内增加时,血红蛋白溶液水解度逐渐上升,酶解温度在50~60 ℃内增加时血红蛋白溶液水解度小幅度下降,主要原因可能是温度50 ℃左右时碱性蛋白酶活性最高,而随着温度继续升高,部分酶分子会因吸收过多热量导致次级键解体,从而导致酶逐渐失活[29];酶解温度为50 ℃、酶解时间在3~5 h内增加时血红蛋白溶液水解度迅速上升,酶解时间在5~7 h内增加时血红蛋白溶液水解度缓慢下降,原因可能是随着反应时间的延长,底物浓度减小的同时伴随产物的积累,部分酶失活,从而导致反应速率下降[30-31]。
2.2.3 碱性蛋白酶的最佳酶解工艺及验证实验
采用Design-Expert 8.0.6软件对碱性蛋白酶酶解工艺条件进行优化,得到最佳水解工艺为E/S 10.16 kU/g、酶解时间5.45 h、酶解温度51.52 ℃,在此工艺条件下,血红蛋白溶液水解度预测值为23.46%。在上述最佳水解工艺条件下进行3 次平行实验后取平均值,得到实际血红蛋白溶液水解度为23.35%,与预测值相差0.11%,误差率为0.47%,证明响应面分析法对于碱性蛋白酶酶解工艺的优化结果可靠。
2.3 响应面法优化风味蛋白酶酶解工艺的试验设计及结果
2.3.1 风味蛋白酶酶解工艺的响应面分析
风味蛋白酶酶解工艺的响应面试验设计方案及结果如表5所示。
表5 风味蛋白酶酶解工艺的Box-Behnken设计方案及试验结果
Table 5 Box-Behnken design scheme with experimental values for hydrolysis degree with flavourzyme
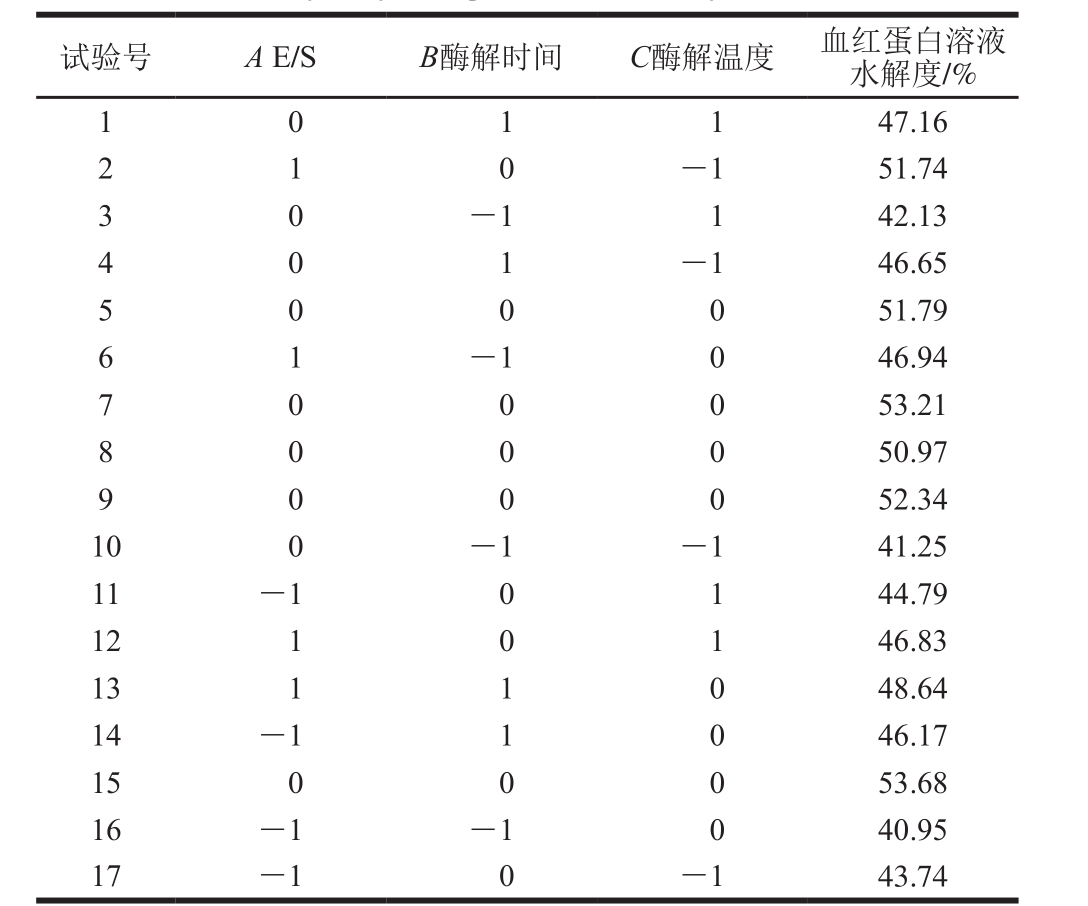
试验号 A E/S B酶解时间 C酶解温度 血红蛋白溶水解度/%1 0 1 1 47.16 2-1 51.74 3 0-1 1 42.13 1 0 4-1 46.65 5 0 0 0 51.79 0 1 6-1 0 46.94 7 0 0 0 53.21 1 8 50.97 9 0 0 0 52.34 0 0 0 10 0 -1 -1 41.25 11 -1 0 1 44.79 12 1 0 1 46.83 13 1 1 0 48.64 14 -1 1 0 46.17液15 0 0 0 53.68 16 -1 -1 0 40.95 17 -1 0 -1 43.74
表6 风味蛋白酶酶解工艺模型回归方程系数的显著性检验
Table 6 Analysis of variance of regression model coefficients for flavourzyme hydrolysis and significance test
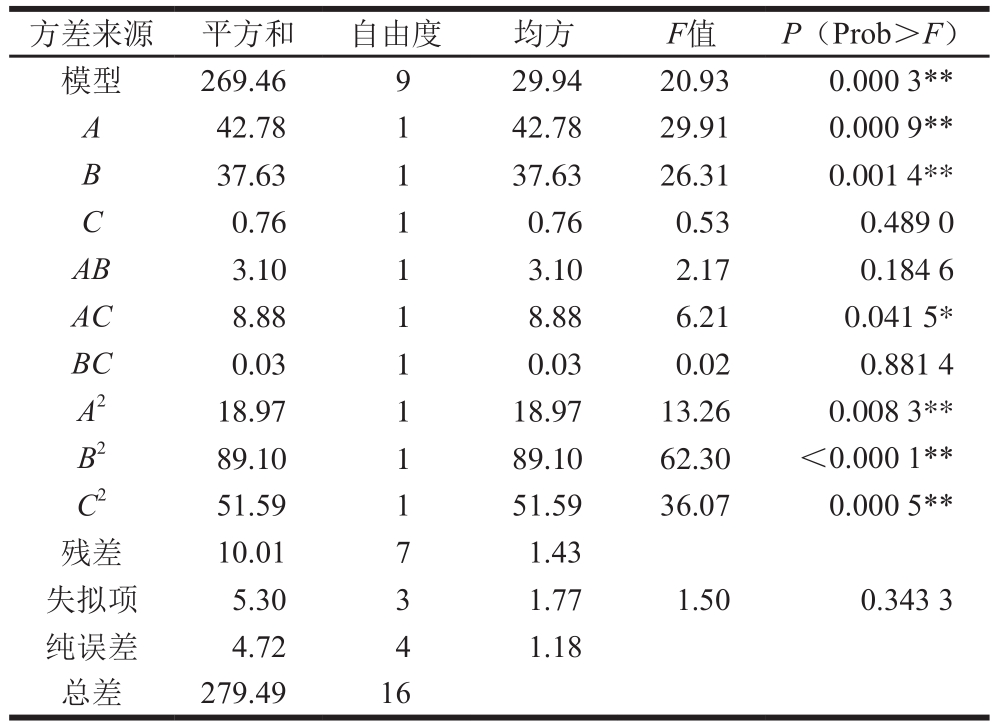
方差来源 平方和 自由度 均方 F值 P(Prob>F)模型 269.46 9 29.94 20.93 0.000 3**A 42.78 1 42.78 29.91 0.000 9**B 37.63 1 37.63 26.31 0.001 4**C 0.76 1 0.76 0.53 0.489 0 AB 3.10 1 3.10 2.17 0.184 6 AC 8.88 1 8.88 6.21 0.041 5*BC 0.03 1 0.03 0.02 0.881 4 A2 18.97 1 18.97 13.26 0.008 3**B2 89.10 1 89.10 62.30 <0.000 1**C2 51.59 1 51.59 36.07 0.000 5**残差 10.01 7 1.43失拟项 5.30 3 1.77 1.50 0.343 3纯误差 4.72 4 1.18总差 279.49 16
由表6可知,模型极显著(P<0.000 1),说明该模型能够解释大部分实验情况的变化,同时失拟项不显著,进一步说明该模型的合理性,因此,可以用此模型对实验结果进行分析和预测。回归方程模型为:Y=52.40+2.31A+2.17B-0.31C-0.88AB-1.49AC-0.10BC-2.12A2-4.60B2-3.50C2,回归方程中的一次项A和B达到极显著水平(P<0.01),交互项AC达到显著水平(P<0.05),二次项A2、B2、C2均达到极显著水平(P<0.01),表明各因素对血红蛋白溶液水解度的影响不是简单的线性关系。方差分析中因素A、B、C的F值分别为29.91、26.31、0.53,即各因素对血红蛋白溶液水解度的影响程度大小顺序为E/S>酶解时间>酶解温度。模型拟合系数R2=0.964 2,模型校正拟合系数R2Adj=0.918 1,表明该模型能够解释血红蛋白溶液水解度91.81%的变化来自于所选变量。同时变异系数为2.51%,说明模型置信度高,能够准确预测和分析3 个变量对血红蛋白溶液水解度的影响。
2.3.2 风味蛋白酶水解影响因素的交互作用分析

图4 E/S和酶解温度对风味蛋白酶水解所得血红蛋白溶液水解度交互作用的三维图和等高线图
Fig. 4 Three-dimensional response surface and contour maps showing the effect of E/S and hydrolysis temperature on flavourzyme hydrolysis degree
仅对交互作用显著的2 个因素(E/S和酶解温度)进行交互作用分析。由图4可知,从三维图中可以直观地看出,E/S和酶解温度的交互作用较显著。当E/S为10 kU/g、酶解温度在40~50 ℃内增加时,血红蛋白溶液水解度迅速上升,酶解温度在50~60 ℃内增加时,血红蛋白溶液水解度缓慢下降;酶解温度为50 ℃、E/S在8~10 kU/g内增加时血红蛋白溶液水解度迅速上升,E/S在10~12 kU/g内增加时,血红蛋白溶液水解度变化不大,分析其原因可能是酶添加量增加会加快反应速率,但酶添加量过多会使底物和酶之间形成一种饱和状态,饱和的酶之间会形成竞争关系,从而抑制其催化作用[32]。
2.3.3 风味蛋白酶的最佳酶解工艺及验证实验
风味蛋白酶最佳水解工艺条件为E/S 11.13 kU/g、酶解时间4.37 h、酶解温度48.34 ℃,在此工艺条件下,血红蛋白溶液水解度预测值为53.28%。在上述最佳水解工艺条件下进行3 次平行实验后取平均值,得到实际血红蛋白溶液水解度为54.31%,与预测值相差1.03%,误差率为1.9%,对比优化前的水解度33.26%有明显提升,且测得两步酶解后酶解液中亚铁血红素含量为1.12 g/100 g,说明响应面分析法对于血红蛋白水解工艺的优化结果可靠,可较好地预测实验结果,应用于实际生产中。
3 结 论
以血红蛋白溶液水解度和亚铁离子得率为指标,筛选得到碱性蛋白酶作为最适内切酶,风味蛋白酶作为最适外切酶,对血红蛋白溶液进行两步酶解。第1步采用碱性蛋白酶酶解血红蛋白,在单因素试验基础上,以血红蛋白溶液水解度为响应值,采用响应面分析法建立E/S、酶解时间、酶解温度3 个因素对血红蛋白溶液水解度的二次回归方程模型,并优化出最优酶解工艺为E/S 10.16 kU/g、酶解时间5.45 h、酶解温度51.52 ℃。为了增加血红蛋白的酶解程度,减少不溶性肽,采用风味蛋白酶继续酶解,以第1步酶解产物作为第2步酶解的底物,根据响应面优化结果确定风味蛋白酶的最优酶解工艺为E/S 11.13 kU/g、酶解时间4.37 h、酶解温度48.34 ℃,此条件下血红蛋白溶液水解度达到54.31%,比传统工艺酶解制备亚铁血红素肽的水解度提升约20%,说明在两步酶解的基础上,通过响应面法能有效优化酶法制备亚铁血红素肽的工艺,为亚铁血红素肽的进一步开发与利用提供了理论依据。
在单因素和响应面法的基础上优化出两步酶解法,制备亚铁血红素肽。第1步酶解最优工艺参数为采用碱性蛋白酶,E/S 10.16 kU/g、酶解时间5.45 h、酶解温度51.52 ℃;第2步酶解最优工艺参数为采用风味蛋白酶,E/S 11.13 kU/g、酶解时间4.37 h、酶解温度48.34 ℃。在两步酶解条件下,血红蛋白水解度可达54.31%,对比优化前水解度(33.26%)有显著提升,结果误差较小,与预测值相近,说明该方法可用于实际生产,同时可为亚铁血红素肽的进一步开发与利用提供理论依据。
[1] 宋璇, 侯成立, 高远, 等. 血红蛋白及其衍生物在食品中的应用[J].中国食品学报, 2018, 18(7): 314-322. DOI:10.16429/j.1009-7848.2018.07.038.
[2] NAGABABU E, RIFKIND J M. Heme degradation by reactive oxygen species[J]. Antioxidants and Redox Signaling, 2004, 6(6): 967-978.DOI:10.1089/ars.2004.6.967.
[3] 闫文杰, 李兴民. 动物血液主要功能成分制备及应用研究进展[J].食品研究与开发, 2018, 39(16): 215-219. DOI:10.3969/j.issn.1005-6521.2018.16.041.
[4] 陈炜林, 胡余明, 李梓民, 等. 血红素铁改善缺铁性贫血效果观察[J].中国食品卫生杂志, 2012, 24(4): 309-311.
[5] AMARELLE V, O’BRIAN M R, FABIANO E. ShmR is essential for utilization of heme as a nutritional iron source in Sinorhizobium meliloti[J]. Applied and Environmental Microbiology, 2008, 74(20):6473-6475. DOI:10.1128/AEM.01590-08.
[6] 李迎楠, 李享, 贾晓云, 等. 酶法制备血红素对湘式腊肠色泽和挥发性风味的影响[J]. 肉类研究, 2017, 31(11): 45-52. DOI:10.7506/rlyj1001-8123-201711008.
[7] 虞华, 赵红兵, 虞丽娜. 2018年我国生猪市场回顾及2019年形势展望[J].肉类工业, 2019(3): 1-6. DOI:10.3969/j.issn.1008-5467.2019.03.001.
[8] SCHONFELDT H C, HALL N G. Determining iron bio-availability with a constant heme iron value[J]. Journal of Food Composition and Analysis, 2011, 24(4/5): 738-740. DOI:10.1016/j.jfca.2011.01.002.
[9] DELOUGHERY T G. Iron deficiency anemia[J]. Medical Clinics of North America, 2016, 101(2): 319-332. DOI:10.1016/j.mcna.2016.09.004.
[10] ERIKSSON C. Heme-iron-enriched amino acid and a process for the preparation of heme-iron-enriched amino acid, US19810255218[P].1983-10-25.
[11] 赵金松. 猪血中血红素提取工艺研究[J]. 肉类研究, 2006, 20(3): 49-51.
[12] 周淡宜, 徐水祥, 江月仙. 血红素纯化技术研究[J]. 药物生物技术,2004, 11(3): 181-183. DOI:10.3969/j.issn.1005-8915.2004.03.011.
[13] 宋照军, 刘玺, 赵良, 等. 血红素提取纯化新技术研究[J]. 现代食品科技, 2004, 20(1): 6-9. DOI:10.13982/j.mfst.1673-9078.2004.01.003.
[14] 吴立芳. 利用猪血制备氯化血红素技术的研究[D]. 长沙: 湖南农业大学, 2006: 12-13.
[15] DUARTE R T, CARVALHO SIMÕES M C, SGARBIERI V C.Bovine blood components: fractionation, composition, and nutritive value[J]. Journal of Agricultural and Food Chemistry, 1999, 47(1):231-236. DOI:10.1021/jf9806255.
[16] 杨天. 细胞色素c自组装纳米胶团结构模拟过氧化物酶研究[D].开封: 河南大学, 2015: 36-39.
[17] 卫乐红, 时亚文, 陈石良, 等. 血红素铁的制备及应用研究进展[J]. 食品与药品, 2013(5): 357-360. DOI:10.3969/j.issn.1672-979X.2013.05.021.
[18] IN M J, CHAE H J, OH N S. Process development for heme-enriched peptide by enzymatic hydrolysis of hemoglobin[J]. Bioresource Technology, 2002, 84(1): 63-68. DOI:10.1016/s0960-8524(02)00009-3.
[19] 武军, 贾冬舒, 秦凤贤, 等. 鹿血亚铁血红素肽的纯化及影响因子分析[J]. 食品安全导刊, 2016(30): 139-141. DOI:10.16043/j.cnki.cfs.2016.30.099.
[20] 张崟, 刘文龙, 熊伟, 等. 响应面法优化酶解猪血制备血红素工艺[J].食品研究与开发, 2016, 37(20): 101-106. DOI:10.3969/j.issn.1005-6521.2016.20.024.
[21] 张凤英. 不同酶水解猪血红蛋白制备抗氧化肽的比较[J]. 科技展望,2015(24): 56. DOI:10.3969/j.issn.1672-8289.2015.24.051.
[22] IN M J, KIM D C, CHAE H J, et al. Effects of degree of hydrolysis and pH on the solubility of heme-iron enriched peptide in hemoglobin hydrolysate[J]. Bioscience, Biotechnology and Biochemistry, 2003,67(2): 365-367. DOI:10.1271/bbb.67.365.
[23] 岑剑伟, 胡庆蓉, 魏涯, 等. 复合酶水解法从罗非鱼血液中提取血红素及其性质研究[J]. 食品工业科技, 2016, 37(19): 58-61.DOI:10.13386/j.issn1002-0306.2016.19.003.
[24] 秦春青, 黄可, 李本姣, 等. 酶解鹅血制备高氨基酸血红素[J]. 食品工业科技, 2016, 37(12): 172-177. DOI:10.13386/j.issn1002-0306.2016.12.025.
[25] 杭州市环境保护监测站. 水质 凯氏氮的测定: GB/T 11891—1989[S].北京: 中国标准出版社, 1989.
[26] 上海市酿造科学研究所. 氨基态氮测定法: ZB X 66038—1987[S].北京: 中国标准出版社, 1987.
[27] 国家环境保护总局. 水质 铁的测定 邻菲啰啉分光光度法:HJ/T 345—2007[S]. 北京: 中国标准出版社, 2007.
[28] GUO Shanguang, ZHAO Mouming, CUI Chun, et al. Preparation and antioxidant properties of decolorized porcine hemoglobin hydrolysates[J]. Chemistry and Bioengineering, 2007(4): 49-53.
[29] 何国庆. 食品酶学[M]. 北京: 化学工业出版社, 2009: 58-60.
[30] 杨锡洪, 夏文水. 酶法水解血红蛋白制备亚铁血红素肽[J]. 食品与机械, 2005, 21(3): 14-16. DOI:10.3969/j.issn.1003-5788.2005.03.004.
[31] 陈清西. 酶学及其研究技术[M]. 厦门: 厦门大学出版社, 2015.
[32] 陈逸文. 产纤维素酶海洋微生物的筛选及其产酶优化与酶学性质初步研究[D]. 杭州: 浙江大学, 2017: 71-72.